修回日期: 2026-01-17
接受日期: 2026-01-26
在线出版日期: 2026-01-28
在代谢相关脂肪性肝病(metabolism-associated fatty liver disease, MAFLD)模型中, 微小核糖核酸(microRNA, miR)-145表达能够延缓疾病进展, miR-126参与血管生成和内皮修复, 这两种病理状态是MAFLD与冠心病共同的发病基础.
探讨冠心病并MAFLD患者血清miR-122、miR-145、miR-126表达及对病情联合评估价值.
选取2024-01/2025-06浦江县人民医院289例冠心病患者, 根据并MAFLD情况分为冠心病并MAFLD组(105例)、单纯冠心病组(184例), 另选同期289例健康体检者作为对照组. 比较各组基线资料、血清miR-122、miR-145、miR-126表达水平, 以Pearson相关性及多元线性回归分析血清miR-122、miR-145、miR-126与冠心病并MAFLD患者冠状动脉病变综合评分(synergy between percutaneous coronary intervention with Taxus and Cardiac Surgery, SYNTAX)关系, 受试者工作特征曲线(receiver operating characteristic, ROC)分析三者及联合对冠心病并MAFLD患者病情的评估价值.
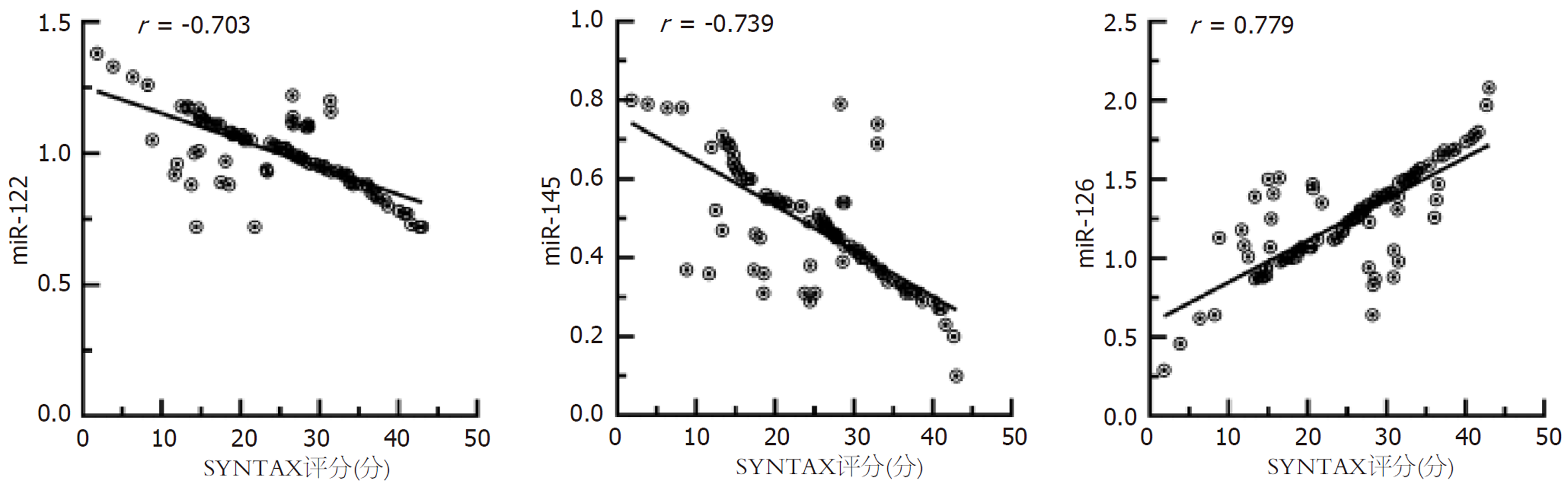
各组甘油三酯(triglyceride, TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)比较差异有统计学意义(P<0.05). 冠心病并MAFLD组血清miR-122、miR-145表达水平低于单纯冠心病组、对照组, miR-126表达水平高于单纯冠心病组、对照组(P<0.05); 单纯冠心病组血清miR-122、miR-145表达水平低于对照组, miR-126表达水平高于对照组(P<0.05). 冠心病并MAFLD组患者SYNTAX评分高于单纯冠心病组(P<0.05). 冠心病并MAFLD组中高风险患者血清miR-122、miR-145低于低风险患者, miR-126高于低风险患者(均P<0.001). Pearson相关性结果示, miR-122、miR-145与SYNTAX评分呈负相关(P<0.001), miR-126与冠心病并MAFLD患者SYNTAX评分呈正相关(P<0.001). 多元线性回归分析显示, 在校正了TG和LDL-C的影响后, 血清miR-122、miR-145、miR-126的表达水平与冠心病并MAFLD患者的SYNTAX评分均呈独立相关性(均P<0.001). ROC分析显示, 联合的曲线下面积(area under the curve, AUC)值显著高于三者单独的AUC值(Z = 3.428、2.905、2.499, P = 0.001、0.004、0.012).
冠心病并MAFLD患者血清miR-122、miR-145表达降低, miR-126表达升高, 并与患者病情严重程度有关, 联合检测时有助于高风险患者的早期识别, 为临床提供决策支持.
核心提要: 本研究旨在系统分析冠心病并代谢相关脂肪性肝病患者血清中微小核糖核酸(microRNA, miR)-122、miR-145和miR-126的表达水平及对病情联合评估价值, 探讨其在该共病状态下的变化, 为深入理解两种疾病的共同病理机制、早期识别高风险患者提供新的理论依据和潜在的干预靶点.
引文著录: 洪娟娟, 张童童, 周楚. 冠心病并代谢相关脂肪性肝病患者血清miR-122、miR-145、miR-126表达及对病情联合评估价值探究. 世界华人消化杂志 2026; 34(1): 62-71
Revised: January 17, 2026
Accepted: January 26, 2026
Published online: January 28, 2026
In metabolism-associated fatty liver disease (MAFLD) models, miR-145 expression is known to delay disease progression, while microRNA (miR)-126 is involved in angiogenesis and endothelial repair. These two pathological states constitute the common pathogenic basis for MAFLD and coronary heart disease (CHD).
To investigate the expression of serum miR-122, miR-145, and miR-126 in patients with CHD complicated by MAFLD and their value in the assessment of disease condition.
A total of 289 patients with CHD in Pujiang County People's Hospital from January 2024 to June 2025 were selected and divided into a CHD and MAFLD group (105 cases) and a simple CHD group (184 cases) according to the presence of MAFLD or not. Another 289 healthy subjects in the same period were selected as a control group. Baseline data and serum miR-122, miR-145, and miR-126 expression levels were compared among the groups. Pearson correlation and multiple linear regression were used to analyze the relationship between serum miR-122, miR-145, and miR-126 and synergy between percutaneous coronary intervention with Taxus and Cardiac Surgery (SYNTAX) scores in patients with CHD and MAFLD. The receiver operating characteristic (ROC) curve was plotted to assess the value of the three molecules and their combination in patients with CHD and MAFLD.
There were significant differences in triglyceride (TG) and low-density lipoprotein cholesterol (LDL-C) between the groups (P < 0.05). The expression levels of serum miR-122 and miR-145 in the CHD and MAFLD group were lower than those of the simple CHD group and the control group, and the expression level of miR-126 was higher than that of the simple CHD group and the control group (P < 0.05). The expression levels of serum miR-122 and miR-145 in the simple CHD group were lower than those of the control group, and the expression level of miR-126 was higher than that of the control group (P < 0.05). The SYNTAX score of patients in the CHD and MAFLD group was higher than that of the simple CHD group (P < 0.05). The levels of serum miR-122 and miR-145 in high-risk patients in the CHD with MAFLD group were lower than those of low-risk patients, and miR-126 was higher than that of low-risk patients (all P < 0.001). Pearson correlation results showed that miR-122 and miR-145 were negatively correlated with SYNTAX score (P < 0.001), and miR-126 was positively correlated with SYNTAX score in patients with CHD and MAFLD (P < 0.001). Multivariate linear regression analysis showed that after adjusting for the effects of TG and LDL-C, the expression levels of serum miR-122, miR-145 and miR-126 were independently correlated with SYNTAX score in patients with CHD and MAFLD (all P < 0.001). ROC analysis showed that the area under the curve (AUC) value of the three molecules was significantly higher than the AUC values of any of them alone (Z = 3.428, 2.905, and 2.499, P = 0.001, 0.004, and 0.012, respectively).
The expression of serum miR-122 and miR-145 in patients with CHD and MAFLD decreases, and the expression of miR-126 increases, which is related to the severity of patient condition. Their combined detection is helpful for the early identification of high-risk patients and provides clinical decision support.
- Citation: Hong JJ, Zhang TT, Zhou C. Association of serum miR-122, miR-145, and miR-126 levels with disease condition in patients with coronary heart disease and MAFLD. Shijie Huaren Xiaohua Zazhi 2026; 34(1): 62-71
- URL: https://www.wjgnet.com/1009-3079/full/v34/i1/62.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v34.i1.62
代谢相关脂肪性肝病(metabolism-associated fatty liver disease, MAFLD)已成为全球最常见的慢性肝病, 其患病率随着肥胖和2型糖尿病的流行而增加[1]. 近年研究表明[2,3], MAFLD并非孤立的肝脏病变, 而是一种可累及全身多系统的代谢性疾病, 其与冠心病的密切联系已成为该领域的研究热点与临床管理的核心问题. 循证医学证据显示, MAFLD是冠心病发生和发展的独立危险因素, 且其严重程度与主要不良心血管事件的风险呈正相关, 然而连接这两种疾病的分子机制尚未完全阐明, 这限制了对高危患者的早期识别和精准干预[4,5]. 传统的肝酶、血脂等生物标志物在评估MAFLD患者心血管风险时, 其敏感性和特异性均显不足, 故探寻新的标志物意义重大. 微小核糖核酸(microRNA, miR)通过调控靶基因的表达, 在MAFLD患者细胞代谢、炎症等核心生物学进程中扮演关键角色, 为这一领域提供了新的研究方向[6]. miR-122是肝脏特异性表达最丰富的miR之一, 能够敏感反映肝细胞脂肪变性、炎症和损伤程度, 其血清水平与MAFLD的严重程度密切相关, 并可能通过系统性炎症和代谢紊乱间接影响冠心病进展[7]. miR-145定位于血管平滑肌细胞等, 是维持血管稳态、防止动脉粥样硬化斑块的产生和恶化的关键调节因子[8]. 研究表明[9], 在高胆固醇饮食诱导的MAFLD模型中, 上调miR-145表达能够延缓疾病进展, 提示其在代谢与血管病变中的潜在作用. miR-126作为内皮细胞功能的主要调控者, 参与血管生成和内皮修复, 其表达异常是内皮功能障碍和胰岛素抵抗的早期标志, 而这两种病理状态是MAFLD与冠心病共同的发病基础[10,11]. 尽管已有研究分别探讨了上述miR在肝脏疾病或心血管疾病中的作用, 但对于其在MAFLD与冠心病共存状态下的表达模式及整体临床意义, 目前认识仍较为有限. 基于此, 本研究旨在系统分析冠心病并MAFLD患者血清中miR-122、miR-145和miR-126的表达水平及对病情联合评估价值, 探讨其在该共病状态下的变化, 为深入理解两种疾病的共同病理机制、早期识别高风险患者提供新的理论依据和潜在的干预靶点.
研究对象: 本研究为单中心前瞻性研究, 根据样本量估算公式: n = (Z1-α/2)2×P(1-P)/d2, Z1-α/2 = 1.96, P根据预实验数据设置为0.80(预期敏感度和特异度), d设置为0.05(允许误差), 最小样本量为246. 选取2024-01/2025-06医院收治的289例冠心病患者, 可满足统计学处理要求. (1)纳入标准: 满足《内科学》[12]中冠心病的诊断标准; >18岁; 生命体征平稳; (2)排除标准: 肝肾功能衰竭; 先天性心脏病; 合并自身免疫性肝病、药物性肝损伤等特定原因导致的肝病; 近期有重大手术、创伤、输血或感染史; 癌症. 根据是否合并MAFLD[13]分为单纯冠心病组(184例)、冠心病并MAFLD组(105例).
另选同期于本院体检中心进行健康体检的289例个体作为对照组, 体检结果显示肝、心、肾等重要脏器功能正常, 无慢性肝病(包括病毒性肝炎、自身免疫性肝病、药物性肝损伤等), 无肝脏脂肪变性相关表现(肝脏超声检查无脂肪肝特征、肝功能指标无明显异常), 无自我报告或病历记载的心脏手术史.
1.2.1 资料收集: 就诊时收集年龄、性别、体质量指数、病史、吸烟、饮酒、冠心病类型、血脂4项、空腹血糖、糖化血红蛋白、谷草转氨酶、谷丙转氨酶、碱性磷酸酶资料.
1.2.2 冠状动脉病变综合评分: 该评分用于量化冠状动脉病变复杂性和严重程度, 从优势血管类型、病变部位和数量等方面进行评估, 所有病变的分数相加之和为总分, 分数越高, 代表患者的冠状动脉病变越复杂、越严重. 根据冠状动脉病变综合评分(synergy between percutaneous coronary intervention with taxus and cardiac surgery, SYNTAX)评分[14]将冠心病并MAFLD患者分为中高风险组(SYNTAX评分≥23分)、低风险组(SYNTAX评分<23分).
1.2.3 血清miR-122、miR-145、miR-126检测: 入院就诊时采集清晨空腹静脉血3 mL, 按照总RNA提取试剂盒(QIAGEN公司miRNeasy Serum)说明书提取血清总RNA, 使用茎环引物进行逆转录, 反应体系(20 μL): 总RNA模板(8 μL)、特异性茎环逆转录引物(10 μM)、5×Reverse Transcription Buffer(4.0 μL)、dNTP Mix(10 mM each, 0.4 μL)、Reverse Transcriptase(200 U/μL, 1.0 μL)、RNase Inhibitor(40 U/μL, 0.5 μL)、无RNA酶水补至20 μL, 逆转录程序: 16 ℃ 30 min(引物退火与延伸), 42 ℃ 30 min(逆转录), 85 ℃ 5 min(酶失活), 4 ℃(保持). 将逆转录得到的cDNA产物进行实时荧光定量聚合酶链反应, 反应体系(20 μL): 2×SYBR Green qPCR Master Mix(10.0 μL)、特异性上游引物(10 μM, 0.8 μL)、通用下游引物(10 μM, 0.8 μL)、cDNA模板(2.0 μL)、无RNA酶水(6.4 μL), 引物序列见表1. 扩增程序: 预变性: 95 ℃ 5 min, 循环反应(40个循环), 95 ℃ 15 s(变性), 60 ℃ 30 s(退火/延伸, 于此阶段采集荧光信号), 行溶解曲线分析, 采用2-ΔΔCt法计算miR-122、miR-145、miR-126的相对表达量.
| 指标 | 茎环逆转录引物 | 上游 | 下游 |
| miR-122 | 5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACAAACACC-3' | 5'-TGGAGTGTGACAATGGTGTTT-3' | 5'-AGTGCAGGGTCCGAGGTATT-3' |
| miR-145 | 5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACAGGGAT-3' | 5'-TGGAGTCCAGTTTTCCCAGGA-3' | 5'-AGTGCAGGGTCCGAGGTATT-3' |
| miR-126 | 5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTCGTACC-3' | 5'-TGGATCGATTATTACTCACGGT-3' | 5'-AGTGCAGGGTCCGAGGTATT-3' |
| 内参基因U6 | 5'-AAAATATGGAACGCTTCACGA-3' | 5'-GCTTCGGCAGCACATATACTAAAAT-3' | 5'-CGCTTCACGAATTTGCGTGTCAT-3' |
统计学处理 采用SPSS 27.0软件, 计数资料用n(%)表示, 以χ2检验; 计量资料以(mean±SD)表示, 3组比较以单因素方差分析, 进一步两两比较行LSD-t检验, 两组之间比较行独立样本t检验; 以Pearson相关性分析血清miR-122、miR-145、miR-126与冠心病并MAFLD患者SYNTAX评分关系, 多元线性回归分析校正了混杂因素后, 三者对冠心病并MAFLD患者SYNTAX评分的影响; 受试者工作特征曲线(receiver operating characteristic, ROC)分析三者及联合对冠心病并MAFLD患者病情的评估价值. P<0.05为差异有统计学意义.
各组甘油三酯(triglyceride, TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)比较差异有统计学意义(P<0.05). 见表2.
| 资料 | 冠心病并MAFLD组(105例) | 单纯冠心病组(184例) | 对照组(289例) | F/t/χ2 | P值 |
| 年龄(岁) | 61.34±8.71 | 61.89±9.25 | 60.75±8.93 | 0.914 | 0.401 |
| 性别 | 0.260 | 0.878 | |||
| 男 | 68(64.76) | 122(66.30) | 185(64.01) | ||
| 女 | 37(35.24) | 62(33.70) | 104(35.99) | ||
| BMI(kg/m2) | 24.32±1.03 | 24.19±0.92 | 24.22±0.85 | 0.712 | 0.491 |
| 糖尿病 | 45(42.86) | 70(38.04) | 101(34.95) | 2.111 | 0.348 |
| 高血压 | 78(74.29) | 130(70.65) | 198(68.51) | 1.250 | 0.535 |
| 高脂血症 | 91(86.67) | 150(81.52) | 225(77.85) | 3.968 | 0.138 |
| 吸烟 | 52(49.52) | 95(51.63) | 140(48.44) | 0.458 | 0.795 |
| 饮酒 | 41(39.05) | 65(35.33) | 115(39.79) | 0.986 | 0.611 |
| 冠心病类型 | 0.127 | 0.722 | |||
| 慢性冠状动脉综合征 | 75(71.43) | 135(73.37) | - | ||
| 不稳定型心绞痛 | 30(28.57) | 49(26.63) | - | ||
| TG(mmol/L) | 2.85±0.91 | 1.89±0.78 | 1.45±0.47 | 166.850 | 0.000 |
| TC(mmol/L) | 4.89±0.95 | 4.76±0.88 | 4.65±0.91 | 2.852 | 0.059 |
| LDL-C(mmol/L) | 3.15±0.72 | 2.82±0.68 | 2.58±0.64 | 29.139 | 0.000 |
| HDL-C(mmol/L) | 1.05±0.23 | 1.07±0.25 | 1.09±0.24 | 1.151 | 0.317 |
| FPG(mmol/L) | 5.45±0.60 | 5.39±0.64 | 5.31±0.72 | 1.910 | 0.149 |
| HbAlc(%) | 5.65±0.84 | 5.58±0.90 | 5.52±0.79 | 0.990 | 0.372 |
| ALT(U/L) | 30.00±6.95 | 30.27±7.58 | 29.14±5.38 | 1.912 | 0.149 |
| AST(U/L) | 30.45±6.77 | 29.12±8.03 | 28.58±6.27 | 2.779 | 0.063 |
| ALP(U/L) | 72.11±9.23 | 70.53±8.67 | 69.95±9.43 | 2.142 | 0.118 |
冠心病并MAFLD组血清miR-122、miR-145表达水平低于单纯冠心病组、对照组, miR-126表达水平高于单纯冠心病组、对照组(P<0.05); 单纯冠心病组血清miR-122、miR-145表达水平低于对照组, miR-126表达水平高于对照组(P<0.05). 冠心病并MAFLD组患者SYNTAX评分高于单纯冠心病组(P<0.05). 见表3.
根据SYNTAX评分将冠心病并MAFLD患者分为中高风险与低风险亚组. 中高风险患者血清miR-122、miR-145低于低风险患者, miR-126高于低风险患者(均P<0.001). 见表4.
| 组别 | 例数 | miR-122 | miR-145 | miR-126 |
| 中高风险 | 67 | 0.82±0.26 | 0.39±0.11 | 1.42±0.49 |
| 低风险 | 38 | 1.32±0.41 | 0.64±0.22 | 0.92±0.30 |
| t | -7.646 | -7.764 | 5.706 | |
| P值 | 0.000 | 0.000 | 0.000 |
miR-122、miR-145与SYNTAX评分呈负相关(P<0.001), miR-126与SYNTAX评分呈正相关(P<0.001), 见图1.
以SYNTAX评分为因变量, 纳入各组比较筛选出的P<0.05的TG、LDL-C、miR-122、miR-145、miR-126作为自变量进行多元线性回归分析, 结果显示, 所构建的回归模型具有统计学意义(F = 18.735, P<0.001), 该模型能解释SYNTAX评分40.60%的变异(调整后R2 = 0.406). 在校正了TG和LDL-C的影响后, 血清miR-122、miR-145、miR-126的表达水平与冠心病并MAFLD患者的SYNTAX评分均呈独立相关性(均P<0.001), 见表5.
| 自变量 | B值 | 标准误差 | 偏回归系数(标准化) | t | P值 |
| 常量 | 35.671 | 2.894 | - | 12.325 | <0.001 |
| miR-122 | -1.927 | 0.385 | -0.289 | -5.005 | <0.001 |
| miR-145 | -2.153 | 0.398 | -0.323 | -5.410 | <0.001 |
| miR-126 | 1.784 | 0.371 | 0.265 | 4.809 | <0.001 |
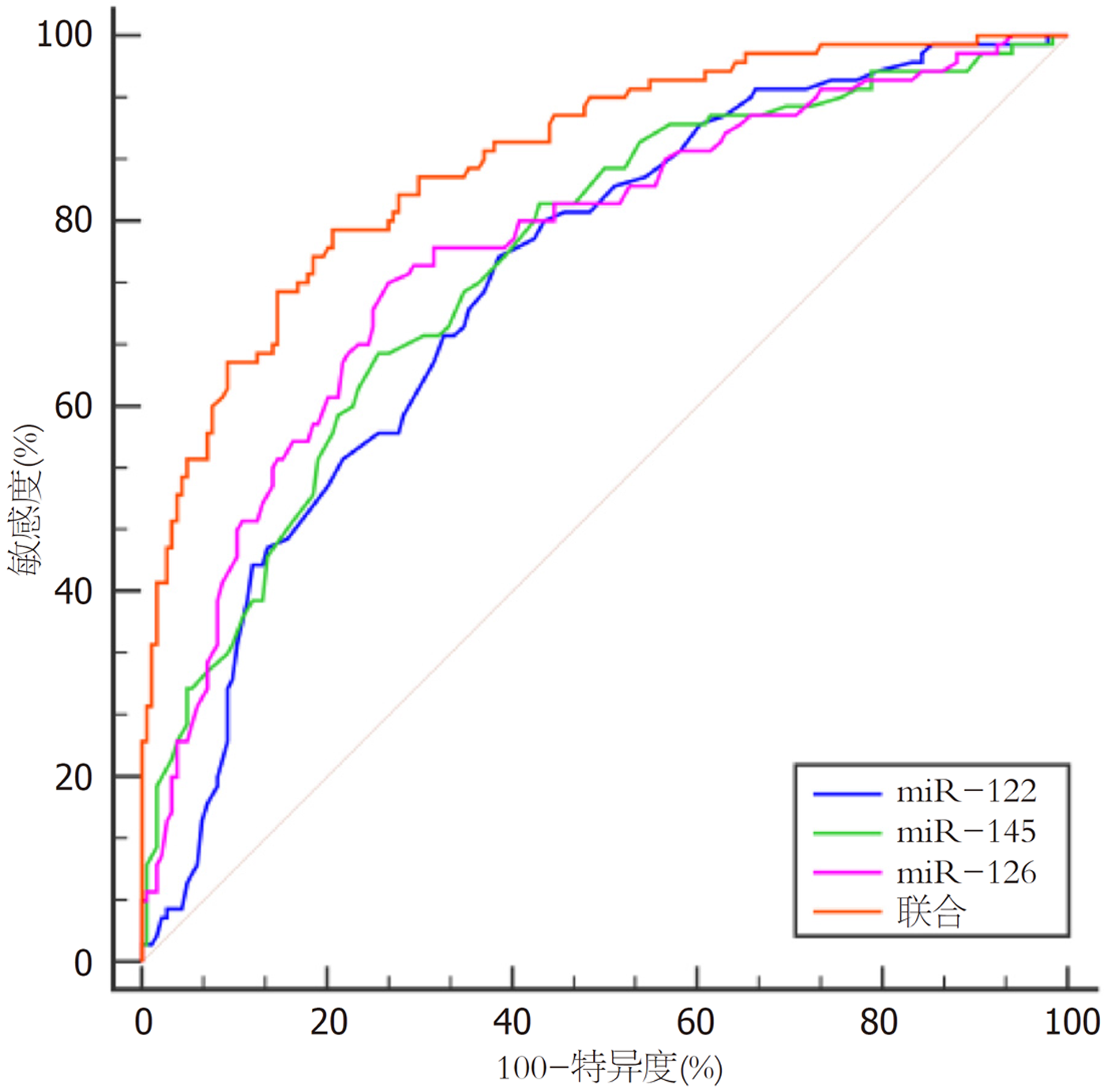
以冠心病并MAFLD患者病情风险为状态变量(低风险 = 0, 中高风险 = 1), 绘制ROC曲线, 运用Logistic回归拟合法得到三者联合的方程: Logit(P) = 0.863-0.715×miR-122-0.566×miR-145+β1×X1+1.024×miR-126, 联合的曲线下面积(area under the curve, AUC)值显著高于三者单独的AUC值(Z = 3.428、2.905、2.499, P = 0.001、0.004、0.012), 见图2和表6.
| 指标 | AUC | 95%CI | Cut-off值 | 敏感度(%) | 特异度(%) | P值 |
| miR-122 | 0.733 | 0.678-0.783 | 1.12 | 76.19 | 61.41 | <0.001 |
| miR-145 | 0.755 | 0.701-0.804 | 0.55 | 65.71 | 74.46 | <0.001 |
| miR-126 | 0.769 | 0.716-0.816 | 1.08 | 73.33 | 73.37 | <0.001 |
| 联合 | 0.865 | 0.821-0.903 | 79.05 | 79.35 | <0.001 |
MAFLD肝脏脂肪代谢失衡, 合成过多的富含甘油三酯的极低密度脂蛋白, 并在胆固醇酯转移蛋白作用下, 产生更多小而密低密度脂蛋白颗粒, 其氧化后易被巨噬细胞吞噬形成泡沫细胞, 导致动脉粥样硬化斑块; 且MAFLD时肝细胞脂肪堆积导致肝脏胰岛素信号通路受损, 发生严重的肝脏胰岛素抵抗, 加剧全身性的胰岛素抵抗和高胰岛素血症, 导致脂肪组织分解增加, 释放大量游离脂肪酸入血, 增加极低密度脂蛋白合成, 形成恶性循环, 同时MAFLD还是炎症刺激源, 可引起炎症介质的释放, 并通过氧化应激与脂质过氧化途径, 使斑块变得不稳定, 易于破裂, 进而导致冠心病发生与进展[15,16]. 本研究结果发现, 冠心病并MAFLD的患者, 其TG、LDL-C水平显著升高, 与既往报道[17]一致, 提示当MAFLD与冠心病共存时, 患者暴露在一个更加显著的致动脉粥样硬化代谢环境中, 这不仅是两种疾病的简单叠加, 更是系统性代谢紊乱的深度整合与恶性循环. 且本研究发现, 冠心病并MAFLD组的SYNTAX评分显著高于单纯冠心病组, 表明MAFLD的存在与更弥漫、更复杂的冠状动脉病变密切相关, 这可能是由于MAFLD驱动的持续性代谢异常, 如胰岛素抵抗、高游离脂肪酸状态以及慢性炎症, 共同加速了动脉粥样硬化斑块的进展.
miR-122主要功能是维持肝细胞的正常分化和肝脏的代谢稳态, 抑制miR-122会导致肝脏脂肪变性改善, 但同时会引起HDL-C合成下降, 这凸显了其调控网络的复杂性[18,19]. MAFLD患者肝组织中miR-122表达较健康人群明显降低, 与肝脏炎症呈负相关, 扮演了保护因子角色[20]. 本研究结果显示, 与健康人群相比, 单纯冠心病患者血清miR-122水平降低, 提示miR-122可能与冠心病发病存在关联; 而在冠心病并MAFLD的患者中, 其表达水平进一步降低, 说明miR-122的表达受冠心病与MAFLD共病状态的叠加影响, 很可能是连接两种疾病的一个重要分子桥梁. 根据既往报道[21,22], miR-122能调控糖脂代谢, miR-122表达的缺失可引起代谢失衡, 加重MAFLD病情, 间接影响冠心病病情. 另一方面, miR-122水平降低可导致炎症浸润细胞产生大量的炎症因子, 加重肝纤维化病变, 并损伤血管内皮细胞、导致动脉粥样硬化斑块不稳定, 直接影响冠心病的进展情况[23].
miR-145来源于血管平滑肌细胞等, 具有维持血管平滑肌细胞收缩表型和血管稳态的作用[24]. 在冠心病和动脉粥样硬化模型中, miR-145的表达下调, 恢复其表达可延缓疾病进展[25]. 本研究也发现单纯冠心病患者miR-145表达水平降低, 同时本研究还发现在冠心病并MAFLD的患者中, 其表达水平进一步降低, 这一递进式的下降趋势提示, MAFLD所特有的代谢紊乱环境, 如系统性胰岛素抵抗、慢性低度炎症及脂毒性应激, 可能对血管壁产生了叠加的负面影响, 进一步抑制了miR-145的表达, 从而加剧血管稳态的失衡. miR-145下调时, 血管平滑肌细胞更易从保护性的收缩型向病理性的合成型转化, 促进其增殖、迁移与分泌过多的细胞外基质, 直接导致动脉粥样硬化斑块的进展与纤维帽稳定性的下降, 增加不良心血管事件风险[26,27].
miR-126来源于内皮细胞等, 是血管生成、内皮细胞存活、迁移和血管完整性的核心调控因子[28-31]. 宋白利等[32]报道, 2型糖尿病患者血清miR-126表达水平与MAFLD有关. 王辉等[33]指出, miR-126与冠状动脉粥样硬化斑块稳定性有关, 可见miR-126是MAFLD与冠心病间的共享机制. 本研究发现, 单纯冠心病组患者血清miR-126水平已显著高于健康对照组, 而在冠心病并MAFLD的患者中, 其表达进一步升高, 提示miR-126可能与冠心病发生有关, 并可能建立了冠心病与MAFLD的分子关联. 在MAFLD与冠心病共存的持续代谢应激环境下, miR-126高表达可能反映内皮细胞处于过度激活甚至功能失调状态, 可通过促进病理性血管生成、加剧血管炎症等机制, 加速动脉粥样硬化进程[34].
在以上研究基础上, 本研究还发现, 冠心病并MAFLD组中高风险患者血清miR-122、miR-145低于低风险患者, miR-126高于低风险患者, 血清miR-122、miR-145表达水平与冠心病并MAFLD患者SYNTAX评分呈负相关, miR-126与冠心病并MAFLD患者SYNTAX评分呈正相关, 可量化冠状动脉病变复杂性和严重程度. 齐贵彬等[35]报道, miR-145与冠心病患者冠状动脉病变严重程度呈负相关, 本研究结论与之一致. 本研究不仅发现miR-122、miR-145和miR-126在冠心病及MAFLD患者中的表达变化情况, 更揭示了其在共病状态下的协同与递进模式: 与单纯冠心病或健康状态相比, 冠心病合并MAFLD患者呈现出miR-122与miR-145的进一步下调, 以及miR-126的进一步上调, 这种表达模式与冠状动脉病变的复杂程度独立相关, 即使在校正了TG和LDL-C等传统致动脉粥样硬化脂质因素后, 关联依然显著, 提示这三种miR构成的分子网络, 可能是连接肝脏代谢紊乱与冠状动脉血管损伤的一个独立于经典血脂通路的核心机制, MAFLD与冠心病共病并非简单的疾病叠加, 而是在持续、强烈的系统性胰岛素抵抗、脂毒性、慢性低度炎症等代谢应激下, 形成了一个独特的病理微环境: (1)MAFLD导致miR-122降低, 引发肝脏胰岛素抵抗与脂代谢紊乱, 升高的游离脂肪酸与炎症因子进入循环, 一方面抑制血管平滑肌细胞中miR-145表达, 促进动脉粥样硬化斑块形成; 另一方面激活内皮细胞miR-126高表达, 加剧内皮功能失调; (2)miR-145降低导致斑块稳定性下降, miR-126高表达引发病理性血管生成, 共同加重冠心病病情; 而冠脉病变引发的心肌缺血会通过神经-体液调节, 进一步加重肝脏淤血与代谢负担, 抑制miR-122表达, 形成肝脏损伤→血管病变→肝脏进一步损伤的恶性循环; (3)三者的协同调控最终导致共病患者不仅面临更严重的代谢紊乱, 更承受代谢损伤+血管结构破坏+炎症持续激活的三重打击, 表现为SYNTAX评分显著高于单纯冠心病患者, 且中高风险患者中三者表达异常更为明显[36]. 因此在MAFLD与冠心病共病的背景下, 血清miR-122、miR-145的严重缺失及miR-126高表达可能解释了该群体为何冠脉病变更为复杂、SYNTAX评分更高, 针对三者进行干预, 或为改善此类患者预后提供了一个新的思路.
本研究ROC分析显示, 联合的AUC值显著高于三者单独的AUC值, 提示三者联合能提高对冠心病并MAFLD病情的评估价值, 有助于早期识别需要介入治疗的高风险患者, 为血运重建提供决策辅助. 目前, 识别冠心病并MAFLD的患者及其病情严重程度的评估, 需要分别进行心脏评估(如冠脉CTA或造影)和肝脏评估(如肝脏超声或FibroScan), 流程复杂且成本较高. 本研究提出的血清miR-122、miR-145、miR-126联合模型, 仅需通过一次抽血, 即可提供关键的信息, 对于已确诊冠心病的患者, 检测三者可以无创地筛查其是否合并了临床上尚未发现的MAFLD, 特别是那些肝功能酶学指标正常但已存在肝脂肪变或炎症的高危人群; 反之, 对于已确诊MAFLD的患者, 检测三者可用于初步评估其冠状动脉受累的风险, 作为决定是否需要进行更深入心脏检查的决策依据; 同时临床上医生可根据检测结果, 对冠心病并MAFLD患者进行危险分级, 对高风险者启动更积极的药物治疗和更密切的随访, 在早期筛查共病、无创风险分层、指导治疗决策等方面均展现出巨大的转化前景, 这不仅有助于实现对冠心病并MAFLD患者的早期、精准干预, 更有助于促进未来心血管代谢疾病管理向精准医学迈进. 既往研究多单独探讨miR-122与MAFLD、miR-145/miR-126与冠心病的关联, 或局限于单一疾病的标志物验证, 未关注MAFLD与冠心病共病这一临床高发且管理复杂的特殊人群. 本研究的创新之处在于, 首次在冠心病并MAFLD的共病群体中, 系统揭示了血清miR-122、miR-145和miR-126构成的特定表达谱, 不仅证实了这种表达谱与更严重的冠状动脉病变独立相关, 还通过多元回归和ROC分析, 成功构建并初步验证了一个多标志物联合评估模. 尽管其确切的临床效用有待前瞻性研究验证, 但本研究已明确指出了从生物标志物发现, 迈向临床决策支持的可行路径. 但本研究仍具有一定局限之处, 如建立了三者表达水平与临床表型的关联, 但未深入探讨其下游具体的分子机制; 尽管通过多元线性回归分析校正混杂因素的影响, 但仍可能存在其他未测量的混杂因素, 如患者的饮食习惯、运动量等, 这些因素都可能对miR的表达谱产生调控作用, 从而对结果造成潜在偏倚, 这也是后续的一个研究方向.
综上所述, 冠心病并MAFLD患者血清miR-122、miR-145表达降低, miR-126表达升高, 并与患者病情严重程度有关, 联合检测时有助于高风险患者的早期识别, 为临床提供决策支持.
在代谢相关脂肪性肝病(metabolism-associated fatty liver disease, MAFLD)模型中,上调微小核糖核酸(microRNA, miR)-145表达能够延缓疾病进展, 提示其在代谢与血管病变中的潜在作用. miR-126参与血管生成和内皮修复, 其表达异常是内皮功能障碍和胰岛素抵抗的早期标志, 而这两种病理状态是MAFLD与冠心病共同的发病基础.
尽管已有研究分别探讨了上述miR在肝脏疾病或心血管疾病中的作用, 但对于其在MAFLD与冠心病共存状态下的表达模式及整体临床意义, 目前认识仍较为有限.
探讨冠心病并MAFLD患者血清miR-122、miR-145、miR-126表达及对病情联合评估价值.
选取289例冠心病患者, 冠心病并MAFLD组、单纯冠心病组, 另选同期289例健康体检者作为对照组. 比较各组基线资料、血清miR-122、miR-145、miR-126表达水平, 分析三者及联合对冠心病并MAFLD患者病情的评估价值.
多元线性回归分析显示, 在校正了甘油三酯和低密度脂蛋白胆固醇的影响后, 血清miR-122、miR-145、miR-126的表达水平与冠心病并MAFLD患者的SYNTAX评分均呈独立相关性(均P<0.001). 受试者工作特征曲线分析显示, 联合的曲线下面积(area under the curve, AUC)值显著高于三者单独的AUC值(Z = 3.428、2.905、2.499, P = 0.001、0.004、0.012).
冠心病并MAFLD患者血清miR-122、miR-145表达降低, miR-126表达升高, 并与患者病情严重程度有关, 联合检测时有助于高风险患者的早期识别, 为临床提供决策支持.
本研究的创新之处在于, 成功构建并初步验证了一个多标志物联合评估模. 但本研究已明确指出了从生物标志物发现, 迈向临床决策支持的可行路径. 但可能对miR的表达谱产生调控作用, 从而对结果造成潜在偏倚, 这也是后续的一个研究方向.
| 1. | Eslam M, Fan JG, Yu ML, Wong VW, Cua IH, Liu CJ, Tanwandee T, Gani R, Seto WK, Alam S, Young DY, Hamid S, Zheng MH, Kawaguchi T, Chan WK, Payawal D, Tan SS, Goh GB, Strasser SI, Viet HD, Kao JH, Kim W, Kim SU, Keating SE, Yilmaz Y, Kamani L, Wang CC, Fouad Y, Abbas Z, Treeprasertsuk S, Thanapirom K, Al Mahtab M, Lkhagvaa U, Baatarkhuu O, Choudhury AK, Stedman CAM, Chowdhury A, Dokmeci AK, Wang FS, Lin HC, Huang JF, Howell J, Jia J, Alboraie M, Roberts SK, Yoneda M, Ghazinian H, Mirijanyan A, Nan Y, Lesmana CRA, Adams LA, Shiha G, Kumar M, Örmeci N, Wei L, Lau G, Omata M, Sarin SK, George J. The Asian Pacific association for the study of the liver clinical practice guidelines for the diagnosis and management of metabolic dysfunction-associated fatty liver disease. Hepatol Int. 2025;19:261-301. [PubMed] [DOI] |
| 2. | Zhou XD, Targher G, Byrne CD, Somers V, Kim SU, Chahal CAA, Wong VW, Cai J, Shapiro MD, Eslam M, Steg PG, Sung KC, Misra A, Li JJ, Brotons C, Huang Y, Papatheodoridis GV, Sun A, Yilmaz Y, Chan WK, Huang H, Méndez-Sánchez N, Alqahtani SA, Cortez-Pinto H, Lip GYH, de Knegt RJ, Ocama P, Romero-Gomez M, Fudim M, Sebastiani G, Son JW, Ryan JD, Ikonomidis I, Treeprasertsuk S, Pastori D, Lupsor-Platon M, Tilg H, Ghazinyan H, Boursier J, Hamaguchi M, Nguyen MH, Fan JG, Goh GB, Al Mahtab M, Hamid S, Perera N, George J, Zheng MH. An international multidisciplinary consensus statement on MAFLD and the risk of CVD. Hepatol Int. 2023;17:773-791. [PubMed] [DOI] |
| 3. | Tsai PS, Cheng YM, Wang CC, Kao JH. The impact of concomitant hepatitis C virus infection on liver and cardiovascular risks in patients with metabolic-associated fatty liver disease. Eur J Gastroenterol Hepatol. 2023;35:1278-1283. [PubMed] [DOI] |
| 4. | Fu T, Ling J, Zhao H, Lin K, Deng Y, Zhang M, Qi X, Yu P, Lin W, Liu X. Comparative association between NAFLD and MAFLD with cardiovascular events and mortality: Evidence from observational studies. PLoS One. 2025;20:e0312650. [PubMed] [DOI] |
| 5. | Younossi ZM, Zelber-Sagi S, Lazarus JV, Wong VW, Yilmaz Y, Duseja A, Eguchi Y, Castera L, Pessoa MG, Oliveira CP, El-Kassas M, Tsochatzis E, Fan JG, Spearman CW, Tacke F, Castellanos Fernandez MI, Alkhouri N, Schattenberg JM, Romero-Gómez M, Noureddin M, Allen AM, Ong JP, Roberts SK, Shubrook JH, Burra P, Kohli R, Kautz A, Holleboom AG, Lam B, Isaacs S, Macedo P, Gastaldelli A, Henry L, Ivancovsky-Wajcman D, Nader F, de Avila L, Price JK, Mark HE, Villota-Rivas M, Barberá A, Kalligeros M, Gerber LH, Alqahtani SA. Global Consensus Recommendations for Metabolic Dysfunction-Associated Steatotic Liver Disease and Steatohepatitis. Gastroenterology. 2025;169:1017-1032.e2. [PubMed] [DOI] |
| 6. | Xu X, Yu C, He H, Pan X, Hou A, Feng J, Tan R, Gong L, Chen J, Ren J. MiR-337-3p improves metabolic-associated fatty liver disease through regulation of glycolipid metabolism. iScience. 2023;26:108352. [PubMed] [DOI] |
| 7. | Zhang Z, Moon R, Thorne JL, Moore JB. NAFLD and vitamin D: Evidence for intersection of microRNA-regulated pathways. Nutr Res Rev. 2023;36:120-139. [PubMed] [DOI] |
| 8. | Li J, Ma J. MiR-145-5p inhibits proliferation of hepatocellular carcinoma, acting through PAI-1. Am J Transl Res. 2025;17:888-896. [PubMed] [DOI] |
| 9. | Demirel-Yalciner T, Cetinkaya B, Arga KY, Sozen E, Ozer NK. Analysis of miRNA Expression Profiles in High Cholesterol Diet-Induced MASH Progression: Potential Effect of α-Tocopherol. IUBMB Life. 2025;77:e70063. [PubMed] [DOI] |
| 10. | Yu H, Davoudi M, Sadegh-Nejadi S, Miao X, Bagherieh M, Afrisham R. Impact of monotherapy and combination therapy with glucagon-like peptide-1 receptor agonists on exosomal and non-exosomal MicroRNA signatures in type 2 diabetes mellitus: a systematic review. J Transl Med. 2025;23:477. [PubMed] [DOI] |
| 11. | Ando Y, Yamazaki M, Yamada H, Munetsuna E, Fujii R, Mizuno G, Ichino N, Osakabe K, Sugimoto K, Ishikawa H, Ohashi K, Teradaira R, Ohta Y, Hamajima N, Hashimoto S, Suzuki K. Association of circulating miR-20a, miR-27a, and miR-126 with non-alcoholic fatty liver disease in general population. Sci Rep. 2019;9:18856. [PubMed] [DOI] |
| 13. | 中国医药生物技术协会慢病管理分会; 中国研究型医院学会肝病(中西医结合)专业委员会; 中华医学会全科医学分会; 代谢相关脂肪性肝病基层诊疗与管理指南制订专家组. 代谢相关脂肪性肝病基层诊疗与管理指南(2025年). 中华肝脏病杂志. 2025;33:422-433. [DOI] |
| 14. | Scala A, Erriquez A, Verardi FM, Marrone A, Scollo E, Trichilo M, Durante A, Tedeschi D, Cortese B, Ielasi A, Valentini G, Tebaldi M, Campo G, Pavasini R, Biscaglia S. Functional (Re)Development of SYNTAX Score II 2020: Predictive Performance and Risk Assessment. J Clin Med. 2023;12:5844. [PubMed] [DOI] |
| 15. | European Association for the Study of the Liver; European Association for the Study of Diabetes; European Association for the Study of Obesity. EASL-EASD-EASO Clinical Practice Guidelines on the management of metabolic dysfunction-associated steatotic liver disease (MASLD): Executive Summary. Diabetologia. 2024;67:2375-2392. [PubMed] [DOI] |
| 16. | Zhang Y, Wang F, Tang J, Shen L, He J, Chen Y. Association of triglyceride glucose-related parameters with all-cause mortality and cardiovascular disease in NAFLD patients: NHANES 1999-2018. Cardiovasc Diabetol. 2024;23:262. [PubMed] [DOI] |
| 17. | Wen W, Fan H, Zhang S, Hu S, Chen C, Tang J, You Y, Wang C, Li J, Luo L, Cheng Y, Zhou M, Zhao X, Tan T, Xu F, Fu X, Chen J, Dong P, Zhang X, Wang M, Feng Y. Associations between metabolic dysfunction-associated fatty liver disease and atherosclerotic cardiovascular disease. Am J Med Sci. 2024;368:557-568. [PubMed] [DOI] |
| 18. | Colaianni F, Zelli V, Compagnoni C, Miscione MS, Rossi M, Vecchiotti D, Di Padova M, Alesse E, Zazzeroni F, Tessitore A. Role of Circulating microRNAs in Liver Disease and HCC: Focus on miR-122. Genes (Basel). 2024;15:1313. [PubMed] [DOI] |
| 19. | Zhang J, Huang H. miR-122-5p/KIF5B/AMPK/AKT regulatory network regulates the progression of NAFLD. Am J Transl Res. 2021;13:696-707. [PubMed] |
| 20. | López-Sánchez GN, Montalvo-Javé E, Domínguez-Perez M, Antuna-Puente B, Beltrán-Anaya FO, Hidalgo-Miranda A, Chávez-Tapia NC, Uribe M, Nuño-Lámbarri N. Hepatic mir-122-3p, mir-140-5p and mir-148b-5p expressions are correlated with cytokeratin-18 serum levels in MAFLD. Ann Hepatol. 2022;27:100756. [PubMed] [DOI] |
| 21. | Huang XY, Chen JX, Ren Y, Fan LC, Xiang W, He XJ. Exosomal miR-122 promotes adipogenesis and aggravates obesity through the VDR/SREBF1 axis. Obesity (Silver Spring). 2022;30:666-679. [PubMed] [DOI] |
| 22. | Mokhtari Ardekani A, Mohammadzadehsaliani S, Behrouj H, Moridi H, Moradi MN, Ghasemi H. miR-122 dysregulation is associated with type 2 diabetes mellitus-induced dyslipidemia and hyperglycemia independently of its rs17669 variant. Mol Biol Rep. 2023;50:4217-4224. [PubMed] [DOI] |
| 23. | Royfman RS, McTague JR, Ranabothu M, Menon B. Extrahepatic and Circulating miR-122: Diagnostic Implications and Future Directions. Microrna. 2025;14:93-100. [PubMed] [DOI] |
| 24. | Fenzl FQ, Lederer EM, Brumma L, Krüger P, Schroll M, Wilming F, Djabali K. Deregulated miR-145 and miR-27b in Hutchinson-Gilford progeria syndrome: implications for adipogenesis. Aging (Albany NY). 2025;17:2278-2311. [PubMed] [DOI] |
| 25. | Ashraf A, Huang Y, Choroomi A, Johnson K, Torres J, Chung EJ. Endothelial-targeting miR-145 micelles restore barrier function and exhibit atheroprotective effects. Nanoscale Horiz. 2025;10:976-986. [PubMed] [DOI] |
| 26. | Qian N, Qiu L. Correlation analysis of serum miR-145 and miR-210 with carotid artery stenosis and their predictive value for cerebral ischemic events. Int J Neurosci. 2025;135:807-814. [PubMed] [DOI] |
| 27. | Chen W, Cui F, Fan J, Liu K, He Y. The Diagnostic and Prognostic Value of Circulating miR-126-3p and miR-145-5p in Coronary Artery Calcification Lesions. Catheter Cardiovasc Interv. 2025;106:780-791. [PubMed] [DOI] |
| 28. | Bassand K, Metzinger L, Naïm M, Mouhoubi N, Haddad O, Assoun V, Zaïdi N, Sainte-Catherine O, Butt A, Guyot E, Oudar O, Laguillier-Morizot C, Sutton A, Charnaux N, Metzinger-Le Meuth V, Hlawaty H. miR-126-3p is essential for CXCL12-induced angiogenesis. J Cell Mol Med. 2021;25:6032-6045. [PubMed] [DOI] |
| 29. | Benko J, Sarlinova M, Mikusova V, Bolek T, Pec MJ, Halasova E, Galajda P, Samos M, Mokan M. MiR-126 and miR-146a as markers of type 2 diabetes mellitus: a pilot study. Bratisl Lek Listy. 2023;124:527-533. [PubMed] [DOI] |
| 30. | Yang QY, Yu Q, Zeng WY, Zeng M, Zhang XL, Zhang YL, Guo L, Jiang XJ, Gan JL. Killing two birds with one stone: miR-126 involvement in both cancer and atherosclerosis. Eur Rev Med Pharmacol Sci. 2022;26:6145-6168. [PubMed] [DOI] |
| 31. | Ye ZQ, Meng XH, Fang X, Liu HY, Mwindadi HH. MiR-126 regulates the effect of mesenchymal stem cell vascular repair on carotid atherosclerosis through MAPK/ERK signaling pathway. World J Stem Cells. 2025;17:106520. [PubMed] [DOI] |
| 32. | 宋 白利, 付 留俊, 刘 婕, 常 毅娜, 张 文博, 袁 圆, 姜 宏卫. 新诊断2型糖尿病患者血清miR-126表达水平与非酒精性脂肪性肝病的 相关性研究. 中国糖尿病杂志. 2018;26:812-816. [DOI] |
| 34. | Lin DC, Lin JB, Chen Z, Chen R, Wan CY, Lin SW, Ruan QS, Li HY, Wu SY. Independent and combined effects of environmental factors and miR-126, miR-143, and miR-145 on the risk of coronary heart disease. J Geriatr Cardiol. 2017;14:688-695. [PubMed] [DOI] |
| 35. | 齐 贵彬, 高 建步, 张 明磊, 张 永杰, 王 星, 彭 小荷, 董 晓双, 李 京倡, 刘 琳. 冠心病病人血清miR-34a、miR-145表达与冠状动脉病变程度的关系及相关机制研究. 中西医结合心脑血管病杂志. 2023;21:1266-1270. [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁