修回日期: 2025-12-10
接受日期: 2025-12-16
在线出版日期: 2026-01-28
目前, 通过核苷(酸)类似物和/或聚乙二醇干扰素治疗的慢性乙型肝炎(chronic hepatitis B, CHB)患者, 即使获得功能性治愈, 其肝细胞核内的共价闭合环状DNA(covalently closed circular deoxyribonucleic acid, cccDNA)仍无法被完全清除, cccDNA是持续乙型肝炎病毒(hepatitis B virus, HBV)感染、药物反应差和停药后复发的重要原因. 而血清中的乙型肝炎病毒核心抗原(hepatitis-B-core-related antigen, HBcrAg)、HBV RNA以及HBV DNA能一定程度反映出肝细胞内cccDNA水平, 本研究比较了血清HBcrAg、HBV RNA、高灵敏HBV DNA预测抗病毒治疗疗效的价值, 旨在为临床提供参考依据.
探讨血清HBcrAg、HBVRNA以及高灵敏HBV DNA水平在CHB抗病毒治疗过程中的预测价值.
观察44例接受恩替卡韦(entecavir, ETV)治疗的乙型肝炎e抗原(hepatitis B e antigen, HBeAg)阳性CHB患者的情况. 在基线、治疗12 wk、96 wk时检测血清HBcrAg、HBV RNA以及高灵敏HBV DNA和其他HBV血清学指标.
治疗96 wk时, 61.4%患者高灵敏HBV DNA低于检测下限(10 IU/mL), 45.4%患者发生血清学应答; 根据治疗96 wk时血清HBeAg状态进行亚组分析, 结果显示, HBeAg(-)组的基线乙型肝炎病毒表面抗原(HBV surface-protein, HBsAg)水平、基线至治疗96W的HBcrAg和HBV RNA水平均显著低于HBeAg(+)组, 96 wk的乙型肝炎核心抗体(hepatitis B core antibody, HBcAb)水平显著高于HBeAg(+)组(P<0.005). 基线的血清HBcrAg和HBV RNA水平可预测治疗96 wk时HBeAg状态, 曲线下面积分别为0.757(95%CI: 0.609-0.906, P = 0.004)、0.687(95%CI: 0.528-0.847, P = 0.034). 从基线到治疗第96 wk总体血清HBcrAg、HBV RNA、高灵敏HBV DNA水平均显著下降(P<0.05), 但在HBeAg(+)组中, 12 wk与96 wk的HBcrAg、HBV RNA、高灵敏HBV DNA水平差异无显著性(P>0.05). 相关性分析显示基线、治疗96 wk的HBcrAg、HBV RNA和高灵敏HBV DNA之间均呈正相关, 以HBcrAg和HBV RNA之间的相关性最强(基线 vs 治疗96 wk: r = 0.598, P<0.001 vs r = 0.773, P<0.001). HBcrAg和HBV RNA在基线时与HBsAg呈正相关, 治疗96 wk时相关性消失; HBcrAg和HBcAb在治疗96 wk时呈弱的负相关(r = -0.302, P = 0.047). 进一步logistic回归分析显示基线HBcrAg水平是影响HBeAg阴转的显著因素(比值比: 0.046, 95%CI: 0.003-0.827, P = 0.037).
基线血清HBcrAg水平可用于预测HBeAg阳性的CHB患者接受ETV抗病毒治疗后HBeAg的消失, 优于HBV RNA和高灵敏HBV DNA.
核心提要: 本研究比较慢性乙型肝炎(chronic hepatitis B, CHB)患者的血清乙型肝炎核心抗原(hepatitis-B-core-related antigen, HBcrAg)、乙型肝炎病毒(hepatitis B virus, HBV) RNA以及高灵敏HBV DNA水平在恩替卡韦(entecavir, ETV)抗病毒治疗过程中疗效上的预测价值. 结果示基线血清HBcrAg水平可用于预测乙型肝炎e抗原(hepatitis B e antigen, HBeAg)阳性的CHB患者接受ETV抗病毒治疗后HBeAg的消失, 优于HBV RNA和高灵敏HBV DNA.
引文著录: 刘斌, 杨柳, 康海燕, 杨莉, 刘云燕, 刘震霞, 党殿杰, 高永革, 李纯平, 李绍臣, 李敏然, 戴二黑. 血清HBcrAg、HBV RNA以及高灵敏HBV DNA预测恩替卡韦治疗慢性乙型肝炎患者疗效价值的比较. 世界华人消化杂志 2026; 34(1): 51-61
Revised: December 10, 2025
Accepted: December 16, 2025
Published online: January 28, 2026
Currently, nucleos(t)ide analogues and/or pegylated interferon cannot completely eradicate the covalently closed circular DNA (cccDNA) within hepatocyte nuclei in chronic hepatitis B (CHB) patients, even after achieving a functional cure. cccDNA is a key factor contributing to persistent hepatitis B virus (HBV) infection, poor drug response, and relapse after treatment discontinuation. Serum markers such as hepatitis B core-related antigen (HBcrAg), HBV RNA, and HBV DNA can, to some extent, reflect the intrahepatic cccDNA level. This study compared the value of serum HBcrAg, HBV RNA, and high-sensitivity HBV DNA in predicting the efficacy of antiviral therapy, aiming to provide a reference for clinical practice.
To investigate the predictive value of serum HBcrAg, HBV RNA, and high-sensitivity HBV DNA levels for efficacy of antiviral therapy for CHB.
A total of 44 hepatitis B e antigen (HBeAg)-positive CHB patients treated with entecavir (ETV) were included. Serum HBcrAg, HBV RNA, high-sensitivity HBV DNA, and other HBV serological markers were detected at baseline and 12 wk and 96 wk of treatment.
At 96 wk of treatment, 61.4% of patients had high-sensitivity HBV DNA below the lower limit of detection (10 IU/mL), and 45.4% developed serological responses; subgroup analysis according to serum HBeAg status at 96 wk of treatment showed that baseline HBV surface-protein (HBsAg) levels, HBcrAg, and HBV RNA levels from baseline to 96 wk of treatment were significantly lower in the HBeAg (−) group than in the HBeAg (+) group, and hepatitis B core antibody (HBcAb) levels at 96 wk were significantly higher than those in the HBeAg (+) group (P < 0.005). Baseline serum HBcrAg and HBV RNA levels predicted HBeAg status at 96 wk of treatment, with area under the curve values of 0.757 (95%CI: 0.609-0.906, P = 0.004) and 0.687 (95%CI: 0.528-0.847, P = 0.034), respectively. The overall serum levels of HBcrAg, HBV RNA, and high-sensitivity HBV DNA decreased significantly from baseline to 96 wk of treatment (P < 0.05), but there was no significant difference in HBcrAg, HBV RNA, and highly sensitive HBV DNA levels between 12 wk and 96 wk in the HBeAg (+) group (P > 0.05). Correlation analysis showed a positive correlation between HBcrAg, HBV RNA, and high-sensitivity HBV DNA at baseline and 96 wk of treatment, with the strongest correlation observed between HBcrAg and HBV RNA (baseline vs 96 wk of treatment: r = 0.598, P < 0.001 vs r = 0.773, P < 0.001). HBcrAg and HBV RNA were positively correlated with HBsAg at baseline, which disappeared after 96 wk of treatment; HBcrAg and HBcAb were weakly negatively correlated at 96 wk of treatment (r = -0.302, P = 0.047). Further logistic regression analysis showed that baseline HBcrAg level was a significant factor affecting HBeAg negative conversion (odds ratio: 0.046, 95%CI: 0.003-0.827, P = 0.037).
Baseline serum HBcrAg levels proves superior to HBV RNA and high-sensitivity HBV DNA in predicting HBeAg loss in HBeAg-positive CHB patients receiving ETV antiviral therapy.
- Citation: Liu B, Yang L, Kang HY, Yang L, Liu YY, Liu ZX, Dang DJ, Gao YG, Li CP, Li SC, Li MR, Dai EH. Comparison of serum HBcrAg, HBV RNA, and high-sensitivity HBV DNA as predictors of efficacy in patients with chronic hepatitis B treated with entecavir. Shijie Huaren Xiaohua Zazhi 2026; 34(1): 51-61
- URL: https://www.wjgnet.com/1009-3079/full/v34/i1/51.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v34.i1.51
慢性乙型病毒性肝炎(chronic hepatitis B, CHB)仍然是全球重大公共卫生威胁之一, 根据最新估计, 影响着全球约2.54亿人, 每年约110万人死于乙型肝炎病毒(hepatitis B virus, HBV)相关性疾病[1]. HBV感染是引起肝功能衰竭、肝硬化和肝细胞癌的主要因素[2], 它属于嗜肝DNA病毒科, 感染肝细胞后, 病毒的松弛环状DNA(relaxed circular deoxyribonucleic acid, rcDNA)侵入细胞核, 在DNA聚合酶等的作用下, 将rcDNA修复转化为共价闭合环状DNA(covalently closed circular deoxyribonucleic acid, cccDNA), 然后以cccDNA为模板, 转录编码不同成分的各种mRNA, 不断产生子代病毒[3]. 核苷(酸)类似物(nucleos(t)ide analogues, NAs)通过阻断前基因组RNA(pregenomic ribonucleic acid, pgRNA)逆转录成DNA来防止新病毒颗粒的形成, 但不会干扰cccDNA转录和病毒蛋白的形成; 而通过聚乙二醇干扰素进行免疫治疗只能使部分CHB患者获得功能性治愈, 肝细胞核内可能仍存在cccDNA. 因此, cccDNA被认为是持续HBV感染、药物反应差和停药后复发的重要原因[4].
定量检测肝组织HBV cccDNA水平及其转录活性是监测治疗结果的理想标志物[5], 但肝组织HBV cccDNA测量需要通过有创的肝穿刺活检获得标本[6]. 因此, 亟需能够反映肝细胞内cccDNA水平的无创替代标志物. 目前, 临床上常使用血清定量HBV DNA来监测CHB患者的病毒活性和治疗反应[7], NAs能有效地阻碍病毒的逆转录过程, 血清HBV DNA水平通常低于检测值下限, 产生病毒学应答后会失去与cccDNA活性的相关性. 乙型肝炎核心抗原(hepatitis-B-core-related antigen, HBcrAg)是一种包含乙型肝炎核心抗原(hepatitis B core antigen, HBcAg)、乙型肝炎e抗原(hepatitis B e antigen, HBeAg)、p22蛋白质的复合标志物. 研究发现, 血清HBcrAg水平与血清HBV DNA、乙型肝炎表面抗原(HBV surface-protein, HBsAg)、HBeAg和cccDNA水平呈正相关, 能反映肝细胞内cccDNA转录活性[8], 具有取代HBV DNA的潜力来预测抗病毒治疗的疗效及停药后的复发风险[9,10]. 血清HBV RNA主要来源于未经逆转录的HBV pgRNA, 存在于有病毒外包膜包裹或裸的核衣壳内, 研究表明[11-14], 它也与肝细胞内cccDNA转录活性有关, 可作为预测HBeAg是否发生血清学转换以及NAs停药后复发风险的指标. 然而, HBcrAg、HBV RNA作为cccDNA替代标记物在CHB治疗前和治疗期间的价值仍不完全明确. 因此, 本文通过观察长期接受恩替卡韦(entecavir, ETV)治疗CHB患者的血清HBcrAg、HBV RNA、高灵敏HBV DNA及其他HBV血清学指标, 分析其动态水平的变化, 比较上述指标作为疗效评价指标的价值.
患者与分组: 选择2017年在石家庄市第五医院、保定市传染病医院、邯郸市传染病医院、张家口市传染病医院、唐山市传染病医院、廊坊市人民医院门诊和住院的HBeAg阳性CHB患者, 均单药口服ETV(苏州东瑞, 口服0.5 mg/d). 本研究为前瞻性研究, 在治疗前和治疗第12 wk、96 wk时收集血清样本, 储存在-8 ℃下. 根据患者经抗病毒治疗96 wk时是否发生血清学应答进行疗效评价, 分为HBeAg(+)组、HBeAg(-)组进行比较.
纳入标准: (1)年龄≥18岁, 不分性别; (2) HBsAg阳性超过6 mo; (3)HBeAg阳性; (4)未接受过核苷(酸)类抗病毒药物治疗.
排除标准: (1)合并甲型肝炎病毒、丙型肝炎病毒、丁型肝炎病毒、戊型肝炎病毒、人类免疫缺陷病毒感染; (2)存在乙型肝炎以外的肝脏疾病, 例如药物性肝炎、自身免疫性肝炎、酒精性肝炎等; (3)目前正在接受免疫抑制剂或激素; (4)妊娠、哺乳期, 有怀孕意向, 并不做避孕措施者; (5)吸毒、酗酒或药物滥用史者.
使用全自动免疫分析仪Lumipulse G1200分析仪, 通过HBcrAg检测试剂盒(化学发光法)测量血清HBcrAg. 检测仪器和试剂均由日本富士瑞必欧株式会社提供, 实验严格按试剂盒说明书进行.
使用全自动核酸提取仪(品牌: 热景, 型号: P48)、全自动医用PCR分析系统(品牌: 天隆, 型号: Gentier 96E), 通过HBV RNA(HBV-RNA)测定试剂盒(PCR-荧光探针法)测量血清HBV RNA, 检测值下限(limit of detection, LoD)为25 copies/mL.
使用全自动荧光PCR分析系统(品牌: Roche, 型号: cobas z480), 通过HBV核酸定量检测试剂盒(PCR-荧光法)(罗氏诊断公司)测量血清HBV DNA, 检测值下限为10 IU/mL.
统计学处理 使用SPSS Statistics 25.0软件进行统计分析. 首先对数据应用Kolmogorov-Smirnov正态性检验. 对于符合正态分布的数据, 描述性统计量表示为平均值±标准差. 不符合正态分布的数据使用中位数(四分位距)进行描述. 计数资料用百分比(%)表示, 组间比较采用卡方检验. 使用Mann-Whitney U检验或卡方比较不同观察组的连续变量和分类变量. 采用Pearson或Spearman相关性分析评估2个变量之间的相关性. 级间比较采用方差分析; 使用二元逻辑回归分析筛选可能影响血清学应答相关因素. P<0.05被认为具有统计学意义.
纳入了2017-01-01/2018-12-31期间在上述医院接受口服ETV抗病毒治疗的44例HBeAg阳性的CHB患者, 基线和ETV治疗后96 wk HBeAg阳性CHB患者的特征总结于表1中. 血清高灵敏HBV DNA的LoD为10 IU/mL, 对于低于下限者以7 IU/mL(LoD/√2)替代进行统计分析. 治疗96 wk后, 27例(61.4%)CHB患者高灵敏HBV DNA<10 IU/mL, 20例(45.4%)患者HBeAg为阴性, 即发生血清学应答. 基于治疗96 wk时患者是否发生血清学应答进行亚组分析, 比较HBeAg(+)组与HBeAg(-)组患者基线、12 wk、96 wk的血清丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)、总胆红素(total bilirubin, TBIL)、HBsAg、HBeAg、乙型肝炎核心抗体(hepatitis B core antibody, HBcAb)、高灵敏HBV DNA、HBcrAg及HBV RNA水平变化的差异. 结果显示, 与HBeAg(+)组相比, HBeAg(-)组的基线HBsAg水平、基线至治疗96 wk的HBcrAg和HBV RNA水平更低, 96 wk的HBcAb水平更高, 差异均具有统计学意义(P<0.005)(表1).
| All patients | HBeAg+ | HBeAg- | P值 | |
| 例数(n) | 44 | 24 | 20 | |
| 性别(男/女) | (27/17) | (15/9) | (12/8) | 0.865 |
| 年龄(year) | 38(31.5, 43) | 36(30.25, 39) | 39(34.5, 43) | 0.127 |
| ALT(U/L) | ||||
| 基线 | 160.65(71.25, 228.75) | 166.15(87.75, 279.7) | 145.5(60.5, 228.75) | 0.795 |
| 12 wk | 37.3(22.73, 54.75) | 35.3(25.92, 78.4) | 37.55(19.85, 48.45) | 0.316 |
| 96 wk | 18.6(12.08, 26.38) | 22.95(16.99, 29.16) | 13.72(11.63, 22.65) | 0.043 |
| AST(U/L) | ||||
| 基线 | 82(45.5, 136.5) | 80.5(48.75, 122.23) | 83.5(44.25, 148.5) | 0.832 |
| 12 wk | 30.5(26.08, 38.8) | 31.35(24.01, 37.9) | 29.35(26.08, 43.1) | 0.724 |
| 96 wk | 21.03(17.79, 24.93) | 21.47(17.79, 24.36) | 20.56(17.25, 25.98) | 0.981 |
| TBIL(umol/L) | ||||
| 基线 | 16.18(12.85, 23.85) | 15.35(11.8, 23.25) | 18.71(14.01, 24.6) | 0.472 |
| 12 wk | 14.4(11.06, 17.36) | 13.1(9.9, 17.38) | 15.47(12.45, 17.87) | 0.229 |
| 96 wk | 14.88(11.28, 20.77) | 12.71((10.25, 16.2) | 19.73(14.24, 29.35) | 0.012 |
| HBsAg1 | ||||
| 基线 | 3.97(3.35, 4.39) | 4.22(3.59, 4.40) | 3.5(3.08, 4.17) | 0.018 |
| 12 wk | 3.92(3.41, 4.15) | 3.99(3.47, 4.27) | 3.70(3.34, 4.12) | 0.289 |
| 96 wk | 3.67(3.25, 3.87) | 3.64(3.26, 3.74) | 3.76(3.08, 3.92) | 0.671 |
| HBeAg1 | ||||
| 基线 | 2.48(1.52, 2.92) | 2.73(2.26, 3.14) | 1.69(0.70, 2.71) | 0.01 |
| 12 wk | 0.36(-0.75, 1.56) | 1.47(0.36, 2.17) | -0.74(-1.94, 0.34) | <0.001 |
| 96 wk | -0.30(-2, 0.81) | 0.59(-0.17, 1.33) | -2(-2, -2) | <0.001 |
| HBcAb1 | ||||
| 基线 | 1.95(0.99, 2.15) | 1.08(0.97, 2.07) | 2.1(1.02, 2.76) | 0.073 |
| 12 wk | 1.99(1.38, 2.07) | 1.96(1.03, 2.06) | 2.01(1.63, 2.10) | 0.239 |
| 96 wk | 1.60(1.01, 2.11) | 1.12(0.97, 1.85) | 1.97(1.50, 2.11) | 0.027 |
| 高灵敏HBV DNA1 | ||||
| 基线 | 7.04(5.78, 7.97) | 7.03(5.92, 8.22) | 7.04(4.68, 7.76) | 0.48 |
| 12 wk | 2.38(1.48, 3.74) | 2.19(1.42, 3.76) | 2.51(1.60, 3.71) | 0.878 |
| 96 wk | 0.70(0.7, 1.45) | 0.91(0.7, 1.81) | 0.7(0.7, 1.03) | 0.192 |
| HBcrAg3 | ||||
| 基线 | 7.00(6.85, 7.00) | 7.00(7.00, 7.00) | 6.9(6.18, 7.00) | 0.001 |
| 12 wk | 6.31(5.62, 7.00) | 6.63(6.14, 7.00) | 5.78(5.39, 6.67) | 0.005 |
| 96 wk | 5.67(4.71, 6.42) | 6.18(5.47, 6.81) | 4.71(4.34, 5.65) | 0.001 |
| HBV RNA2 | ||||
| 基线 | 7.22(6.04, 7.83) | 7.49(6.43, 8.13) | 6.80(4.54, 7.48) | 0.034 |
| 12 wk | 5.58(4.24, 6.79) | 5.81(4.54, 7.01) | 4.71(3.35, 5.76) | 0.04 |
| 96 wk | 3.80(2.81, 5.34) | 4.54(3.36, 6.18) | 3.19(2.16, 4.56) | 0.022 |
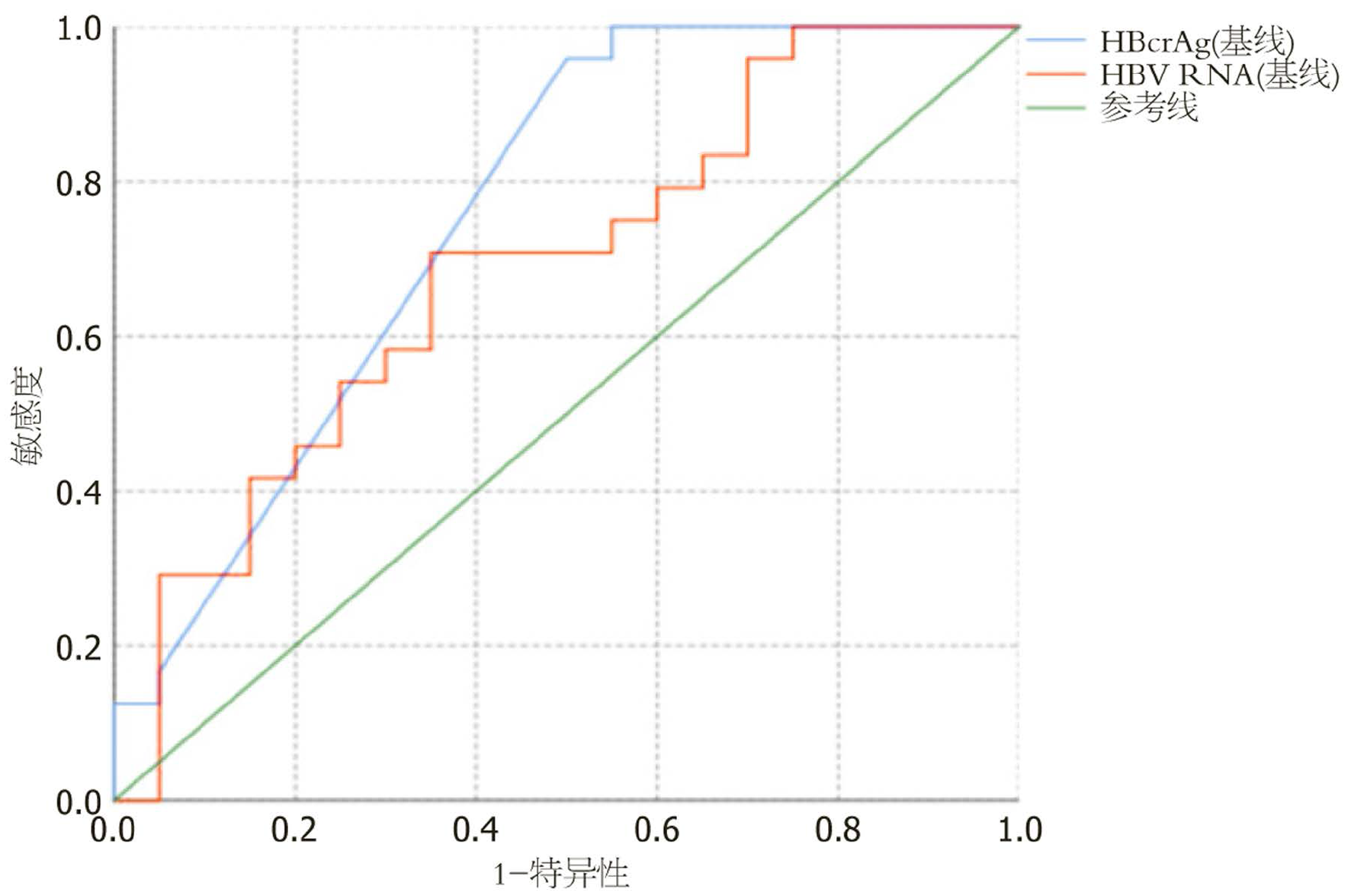
基线的HBcrAg和HBV RNA水平与治疗96W时的HBeAg状态显著相关. 随后的受试者工作特征(receiver operating characteristic, ROC)曲线分析结果显示: HBcrAg预测治疗96 wk时HBeAg阴转的曲线下面积(area under the curve, AUC)值为0.757(95%CI: 0.609-0.906, P = 0.004), 计算的临界值为6.9 log10 U/mL, 灵敏度和特异性分别为95.8%和50%. 相比之下, HBV RNA预测治疗96 wk时HBeAg阴转的AUC值为0.687(95%CI: 0.528-0.847, P = 0.034), 临界值为7.09 log10 copies/mL, 灵敏度和特异性分别为70.8%和65%(见图1).
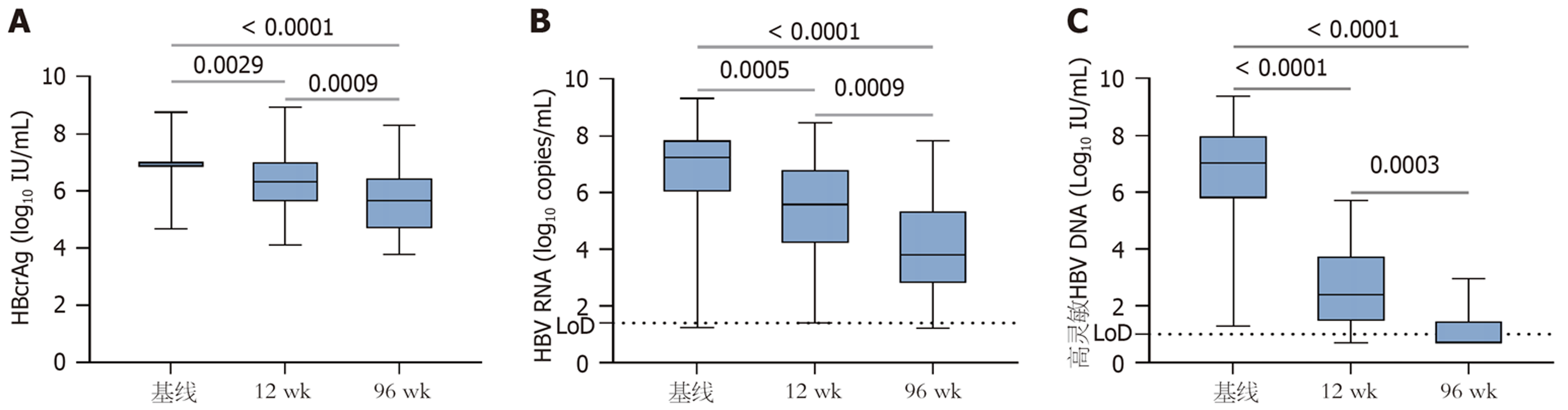
分别检测基线、治疗12 wk、96 wk时间点CHB患者血清HBcrAg、HBV RNA和高灵敏HBV DNA水平, 血清HBcrAg分别水平为: 7.00(6.85, 7.00)log10 U/mL、6.31(5.62, 7.00)log10 U/mL、5.67(4.71, 6.42)log10 U/mL; 血清HBV RNA水平分别为: 7.22(6.04, 7.83)log10 copies/mL、5.58(4.24, 6.79)log10 copies/mL、3.80(2.81, 5.34)log10 copies/mL; 血清HBV DNA水平分别为: 7.04(5.78, 7.97)log10 IU/mL、2.38(1.48, 3.74)log10 IU/mL、0.70(0.7, 1.45)log10 IU/mL. 从基线到治疗第96 wk, 血清HBcrAg、HBV RNA、高灵敏HBV DNA水平均呈现逐渐下降趋势, 各时间点比较差异有统计学意义(P<0.05, 图2).
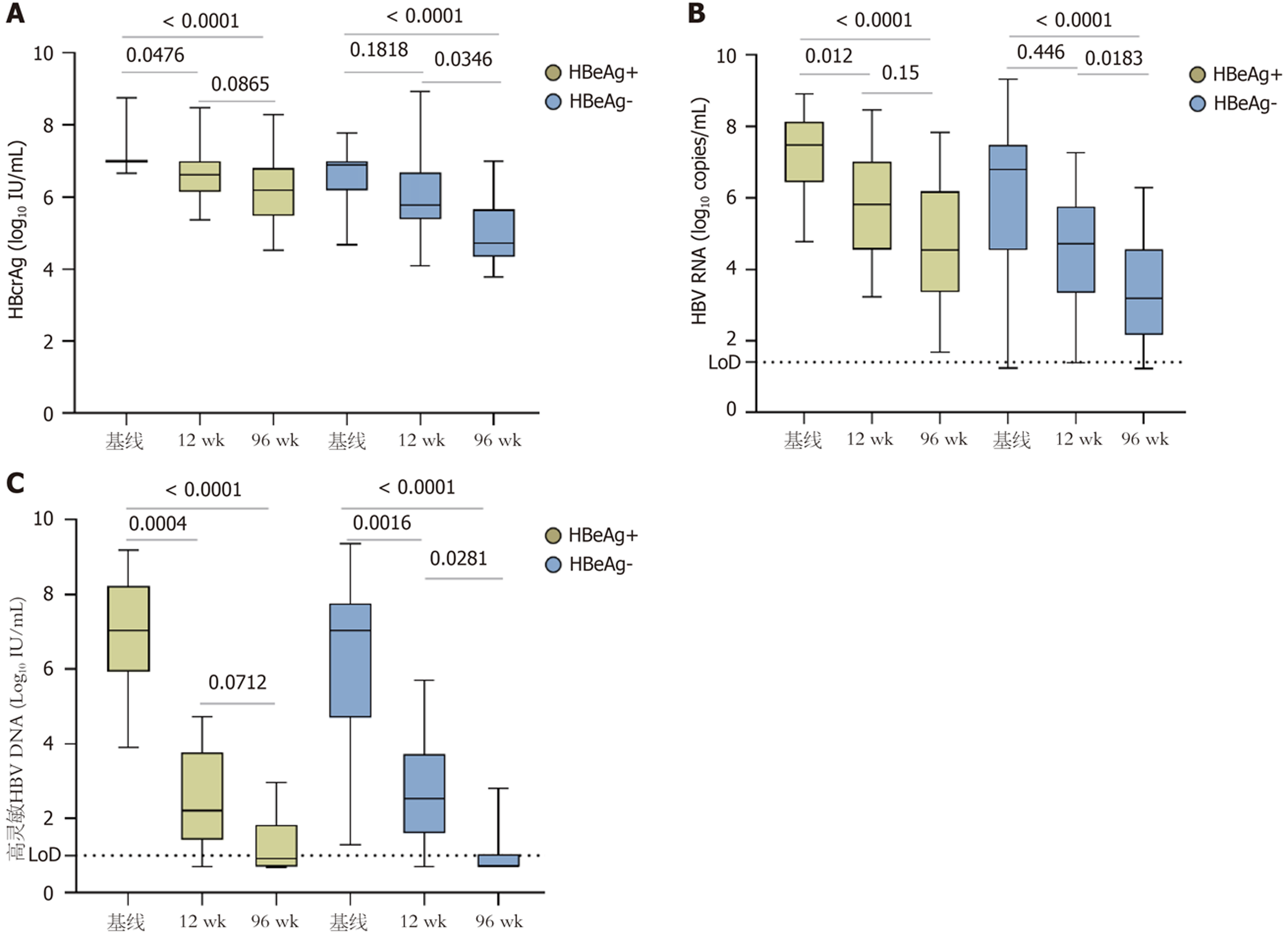
进一步分析不同HBeAg状态下的血清HBcrAg、HBV RNA和高灵敏HBV DNA纵向水平变化, 结果显示: HBeAg(-)组基线、治疗12 wk、96 wk的血清HBcrAg水平分别为6.9(6.18, 7.00)log10 U/mL、5.78(5.39, 6.67)log10 U/mL、4.71(4.34, 5.65)log10 U/mL; HBV RNA的水平为6.80(4.54, 7.48)log10 copies/mL、4.71(3.35, 5.76)log10 copies/mL、3.19(2.16, 4.56)log10 copies/mL. 治疗96 wk的HBcrAg、HBV RNA水平均显著低于基线及12 wk水平(P<0.05), 但12 wk与基线水平之间比较差异无显著性(P>0.05). 高灵敏HBV DNA水平分别为7.04(4.68, 7.76)log10 IU/mL、2.51(1.60, 3.71)log10 IU/mL、0.7(0.7, 1.03)log10 IU/mL, 高灵敏HBV DNA水平呈下降趋势, 三者之间差异有显著性(P<0.05, 图3).
HBeAg(+)组基线、治疗12 wk、96 wk的HBcrAg水平分别为7.00(7.00, 7.00)log10 U/mL、6.63(6.14, 7.00)log10 U/mL、6.18(5.47, 6.81)log10 U/mL; HBV RNA水平分别为7.49(6.43, 8.13)log10 copies/mL、5.81(4.54, 7.01)log10 copies/mL、4.54(3.36, 6.18)log10 copies/mL; 高灵敏HBV DNA水平分别为7.03(5.92, 8.22)log10 IU/mL、2.19(1.42, 3.76)log10 IU/mL、0.91(0.7, 1.81)log10 IU/mL. 治疗96 wk的HBcrAg、HBV RNA、高灵敏HBV DNA水平均显著低于基线水平(P<0.05, 图3), 但与治疗12 wk的水平比较差异无显著性(P>0.05).
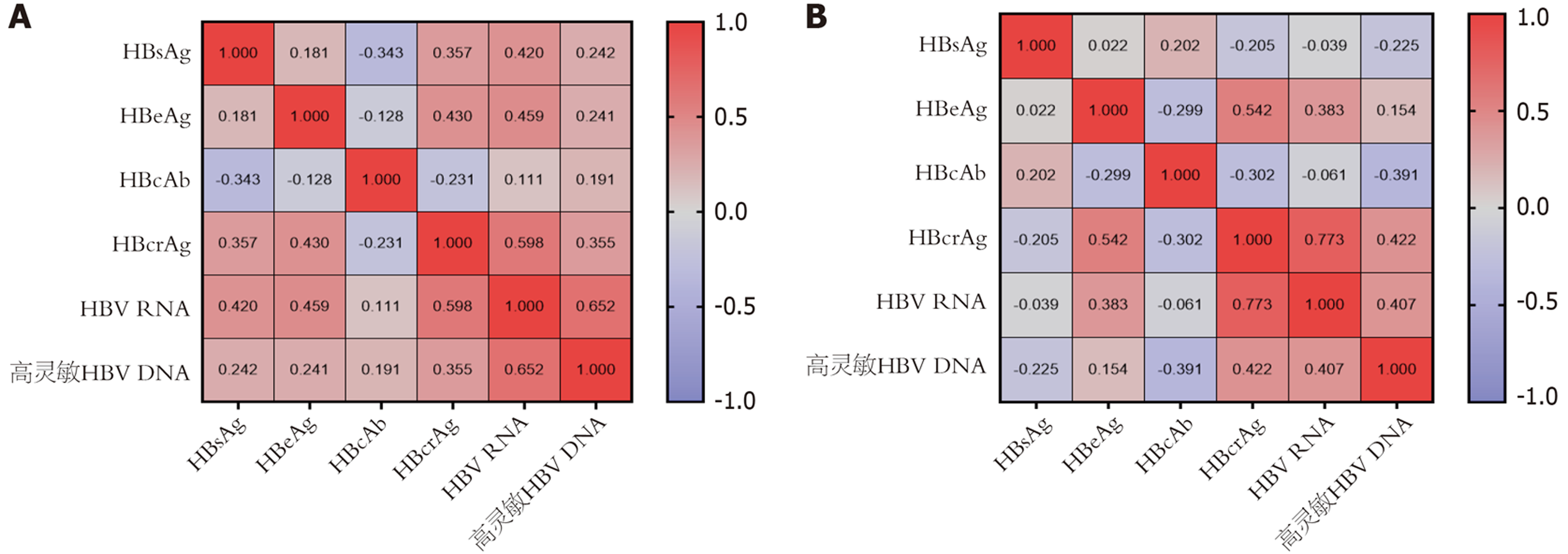
我们分别探讨了基线和治疗96 wk的血清HBsAg、HBeAg、HBcAb、HBcrAg、HBV RNA、高灵敏HBV DNA之间的相关性. 结果显示: 基线时, 血清HBcrAg与HBsAg(r = 0.357, P = 0.017)、HBeAg(r = 0.430, P = 0.004)、HBV RNA(r = 0.598, P<0.001)和高灵敏HBV DNA(r = 0.355, P = 0.018)均呈正相关; HBV RNA与HBsAg(r = 0.420, P = 0.005)、HBeAg(r = 0.459, P = 0.002 )、HBcrAg(r = 0.598, P<0.001)和高灵敏HBV DNA(r = 0.652, P<0.001)也均呈正相关(见图4A).
治疗96 wk后, 血清HBeAg、HBcrAg、HBV RNA和高灵敏HBV DNA之间的正相关仍持续存在(P<0.05), 但HBcrAg与HBsAg、HBV RNA与HBsAg的相关性消失. 而HBcrAg与HBcAb表现出负相关(r = -0.302, P = 0.047)(见图4B).
使用二元logistic回归分析来筛选预测HBeAg阴转的可能因素. 因变量为96 wk时HBeAg状态, 影响因素包括基线性别、年龄、血清ALT水平、血清AST水平、TBIL水平、HBsAg水平、HBcAb水平、高灵敏HBV DNA水平、HBcrAg水平、HBV RNA水平. 单因素分析发现HBsAg、HBcrAg和HBV RNA水平是影响ETV治疗96 wk时CHB患者HBeAg状态的显著因素(P<0.05). 进一步行多因素分析以消除混杂因素, 结果发现仅基线HBcrAg水平是影响HBeAg阴转的预测因子(P<0.05)(表2).
| 变量 | 单变量 | P值 | 多变量 | P值 |
| OR (95%CI) | OR (95%CI) | |||
| 性别 | 0.900(0.266-3.042) | 0.865 | ||
| 年龄 | 1.025(0.971-1.082) | 0.375 | ||
| ALT | 0.999(0.997-1.001) | 0.518 | ||
| AST | 1(0.997-1.002) | 0.749 | ||
| TBIL | 0.984(0.947-1.021) | 0.390 | ||
| HBsAg | 0.294(0.103-0.836) | 0.022 | 0.327(0.090-1.191) | 0.090 |
| HBcAb | 2.095(0.954-4.597) | 0.065 | ||
| HBV DNA | 0.694(0.443,1.087) | 0.110 | ||
| 高灵敏HBV DNA | 0.839(0.592-1.189) | 0.323 | ||
| HBcrAg | 0.059(0.005-0.744) | 0.029 | 0.046(0.003-0.827) | 0.037 |
| HBV RNA | 0.602(0.378-0.959) | 0.032 | 1.349(0.630-2.886) | 0.441 |
本研究重点观察比较了血清HBcrAg、HBV RNA和高灵敏HBV DNA定量水平在接受ETV治疗的HBeAg阳性CHB患者中血清学应答方面的预测价值, 研究发现从基线至治疗96 wk, 血清HBcrAg、HBV RNA、高灵敏HBV DNA水平均呈逐渐下降趋势, 且三者之间均呈正相关, 其中HBcrAg与HBV RNA相关性较大; HBcrAg、HBV RNA在基线时都与HBsAg呈正相关, 但在治疗96 wk时相关性消失. 多因素logistic回归分析显示基线HBcrAg水平是影响ETV治疗96 wk血清HBeAg阴转的独立危险因素.
NAs能有效阻碍HBV的逆转录过程, 通常血清HBV DNA水平会低于检测阈值, 但不会直接影响cccDNA的转录[15]. 最近的研究表明[9,16], 经NAs抗病毒治疗的CHB患者, HBcrAg、HBV RNA的持续存在可能是HBeAg血清转换率低的原因, 是评估cccDNA及其在肝脏中转录活性的优越替代标志物. 在本研究中, 纳入44例HBeAg阳性CHB患者接受单药ETV治疗, 显示血清总体HBcrAg、HBV RNA和高灵敏HBV DNA水平随着治疗时间的延长而逐渐降低, 三者趋势具有一致性; 从基线至治疗96W, HBeAg(-)组的血清HBcrAg和HBV RNA水平均显著低于HBeAg(+)组, Wang等[17]的研究结果与我们一致; 而在61.4%高灵敏HBV DNA低于检测阈值的CHB患者中, 血清HBcrAg、HBV RNA检测仍然呈阳性, 因此, 证明了血清HBcrAg、HBV RNA水平在反映肝内病毒转录活性和NAs治疗效果方面的价值优于高灵敏HBV DNA. 然而, 经ETV治疗96 wk后, HBeAg(-)患者的HBcAb水平高于HBeAg(+)的患者, 与其他病毒学标志物的趋势相反, 这种现象可能与HBV复制被ETV抑制后, 激活了HBV特异性CD8 T细胞免疫反应, 从而清除病毒, 刺激了HBcAb产生[18].
HBeAg消失或血清转换是HBeAg阳性患者在抗病毒治疗过程中的主要终点之一. 有研究表明[19-22]血清HBcrAg和HBV RNA水平具有预测经NAs治疗的HBeAg阳性CHB患者血清学反应的创新标志物的潜力. 本研究观察到与HBeAg(+)组相比, HBeAg(-)组血清HBcrAg和HBV RNA水平均显著降低, ROC曲线分析显示, 在基线临界值为6.9 log10 U/mL的情况下, HBcrAg预测HBeAg阴转的AUC值为0.757, 灵敏度为95.8%, 特异性为50%; 相比之下, HBV RNA的预测能力略低, 临界值为7.09 log10 copies/mL时AUC为0.687, 敏感性为70.8%, 特异性为65%. 在Lin等[9]研究中, 基线纳入了73例HBeAg(+)和76例HBeAg(-)CHB患者, HBcrAg和HBV RNA都具有预测HBeAg血清学转换的潜力, HBV RNA对HBeAg(+)预测的AUC为0.945, 临界值为2.99 log10 copies/mL, 灵敏度为87.7%, 特异性为89.5%, 而HBcrAg的预测能力略低(AUC为0.754, 临界值为3.20 log10 mU/mL, 敏感性为91.8%, 特异性为48.7%). 本研究结果显示基线HBcrAg可作为经ETV治疗96 wk后HBeAg阴转的有效筛选指标, 但特异度不足, 临床实践中需结合基线HBeAg滴度及治疗过程中相关指标的动态变化进行综合评估, 以提升预测的精准性. 此外HBcrAg和HBV RNA的临界值水平相对较高及预测能力的差异, 可能与纳入的基线CHB患者HBeAg均为阳性, 且样本量相对少有关.
在Wang等[17]研究中入组了83例HBeAg(+)患者, 接受NAs长期治疗, 63.86%患者达到HBeAg清除, 他们发现治疗72 wk后, 无论HBeAg清除是否发生, HBcrAg、HBV RNA和HBV DNA水平较基线显著降低(P<0.05). 与我们的观察结果一致, 但与HBeAg(-)组不同的是, 在HBeAg(+)组中, 12 wk与96 wk的HBcrAg、HBV RNA、高灵敏HBV DNA水平无显著差异(P>0.05). 因此, 除了与基线水平比较外, 还需动态监测治疗期间HBcrAg、HBV RNA和HBV DNA水平的变化情况, 有助于判断NAs的治疗效果.
我们还研究了血清HBsAg、HBeAg、HBcAb、HBcrAg、HBV RNA和高灵敏HBV DNA之间的相关性. 值得注意的是, 纳入的44例HBeAg(+)患者, 不论是基线还是治疗96 wk, HBcrAg、HBV RNA和高灵敏HBV DNA之间均表现出相互关联, 呈正相关, 其中以HBcrAg和HBV RNA之间的相关性最强(基线 vs 治疗96 wk: r = 0.598, P<0.001 vs r = 0.773, P<0.001). Liao等[23]研究也表明HBcrAg与HBV RNA之间的相关系数最高(r = 0.629, P<0.001). 在Erken等[10]研究中纳入了44例HBeAg(+)患者及45例HBeAg(-)患者, 使用聚乙二醇干扰素180 μg qw联合阿德福韦酯抗病毒治48 wk, 后进行随访, 发现HBeAg(+)组在基线至第56 wk, HBcrAg水平与血清中的HBsAg、HBV pgRNA和HBV DNA表现出密切正相关. 与我们的结果相似, 因为HBcrAg和HBV RNA都来源于cccDNA, 这种相关性有利于理解血清HBcrAg、HBV RNA和HBV DNA水平之间相对稳定的相关性. 本研究发现HBcrAg与HBsAg在基线时呈正相关, 在治疗96 wk时相关性消失. 既往的研究表明HBeAg(+)患者HBcrAg和HBsAg之间存在中等相关性[24]. Li等[25]研究中纳入了93例接受ETV治疗的HBeAg(+)CHB患者, 患者基线HBcrAg水平与HBsAg正相关(r = 0.495, P<0.001), 但治疗78 wk时两者不存在相关性, 与本研究结果相似. 此外, 本研究也观察到基线HBV RNA水平也与HBsAg正相关, 治疗96 wk时二者不存在相关性, 这种情况解释了血清HBV RNA与HBcrAg水平之间相对较强的关联性, 治疗96 wk时HBcrAg和HBV RNA与HBsAg相关性消失, 可以用在抗病毒治疗后, 血清HBsAg可能主要来源于整合的HBV DNA而不是cccDNA来解释.
此外, 本研究发现基线时HBcrAg和HBcAb之间无相关性, 在治疗96 wk时呈弱的负相关(r = -0.302, P = 0.047). Li等[25]研究中也调查了HBcrAg和HBcAb之间的关系, 结果显示所有患者在基线时均无显著相关性, 但在治疗78 wk时呈弱的负相关(r = -0.263, P = 0.014). HBcAg是HBcrAg的组成部分, 抗原性强, 可刺激机体产生HBcAb, 虽然HBcAg可以作为病毒粒子的组成部分分泌到血液中, 但它通常包含在病毒包膜内, 不易被B细胞捕获, 从而降低了免疫反应, 使体内产生的HBcAb较少, 这可能是HBcrAg与HBcAb产生之间的不平行现象的原因. 此外, HBcrAg、HBV RNA均与HBeAg正相关, 这可能与HBeAg是HBcrAg的一个组成部分有关.
Erken等[10]研究表明血清HBcrAg与cccDNA的相关性优于HBV RNA, HBcrAg作为cccDNA替代标志物的适用性优于HBV RNA. 在本研究中, 基线HBcrAg水平是影响HBeAg阴转的预测因子, 支持这一观点, 可能是因为HBV RNA仅存在于血浆病毒样颗粒中[26], 而病毒样颗粒的释放量远低于病毒蛋白, 且蛋白质在血浆中的稳定性通常高于RNA, 而HBcrAg包含三种蛋白质成分, 检测稳定性强于HBV RNA. 但在Wang等[17]研究中显示HBV RNA对HBeAg清除和血清转化的预测性能优于HBcrAg. 因此需要更大样本量、设计合理的前瞻去队列研究进一步验证.
我们的研究存在一定的不足. 首先, 样本量相对较小, 仅纳入了HBeAg+的CHB患者, 根据治疗96 wk后的HBeAg状态进行分组, 比较两组患者血清标志物水平的差异, 缺乏基线为HBeAg-患者的血清标志物数据; 其次只检测了基线、12 wk、96 wk血清标志物水平, 治疗时间相对较短, 缺乏更长期的数据. 因此, 需要未来具有更大样本量和前瞻性设计的研究来证实我们的结论.
我们得出结论, 血清HBcrAg、HBV RNA和高灵敏HBV DNA在ETV治疗过程中均呈逐渐下降趋势, 三者之间呈显著正相关性. 基线HBcrAg可预测抗病毒治疗后HBeAg的消失, 且优于HBV RNA和高灵敏HBV DNA. HBcrAg由于其广泛而可靠的应用, 可能成为一种实用的临床标志物.
慢性乙型病毒性肝炎(chronic hepatitis B, CHB)患者在核苷(酸)类似物和/或聚乙二醇干扰素治疗期间, 定量检测肝细胞内乙型肝炎病毒(hepatitis B virus, HBV)共价闭合环状DNA(covalently closed circular DNA, cccDNA)水平及其转录活性有利于早期预测疗效, 血清乙型肝炎病毒核心抗原(hepatitis-B-core-related antigen, HBcrAg)、HBV RNA以及HBV DNA可作为cccDNA的无创替代标志物, 一定程度上反映出肝细胞内cccDNA水平.
血清HBcrAg、HBV RNA以及HBV DNA作为HBV cccDNA无创替代标志物预测CHB抗病毒治疗疗效的价值仍不完全明确, 需要进一步研究.
探讨血清HBcrAg、HBV RNA以及高灵敏HBV DNA水平预测CHB抗病毒治疗疗效的价值.
纳入44例接受恩替卡韦(entecavir, ETV)治疗的乙型肝炎e抗原(hepatitis B e antigen, HBeAg)阳性CHB患者, 在基线、治疗12 wk、96 wk时检测血清HBcrAg、HBV RNA以及高灵敏HBV DNA水平;根据治疗96 wk时血清HBeAg状态分为 HBeAg(-)组与HBeAg(+)组, 比较两组患者基线至治疗96 wk时的血清HBcrAg、HBV RNA以及高灵敏HBV DNA水平差异及其之间的相关性; Logistic回归分析影响HBeAg阴转的预测因素; 受试者工作特征曲线分析预测HBeAg阴转的效能.
44例HBeAg阳性的CHB患者经ETV治疗96 wk后, 61.4%患者高灵敏HBV DNA低于检测下限, 20例为HBeAg(-), 24例为HBeAg(+).HBeAg(-)组的基线至治疗96 wk的血清HBcrAg和HBV RNA水平均显著低于HBeAg(+)组(P<0.05), 基线血清HBcrAg和HBV RNA水平预测治疗96 wk时HBeAg状态的曲线下面积分别为0.757、0.687. 相关性分析显示基线、治疗96 wk的HBcrAg、HBV RNA和高灵敏HBV DNA之间均呈正相关, 以HBcrAg和HBV RNA之间的相关性最强. Logistic多因素回归分析显示基线HBcrAg水平是影响HBeAg阴转的显著因素.
基线血清HBcrAg水平可预测HBeAg阳性的CHB患者经ETV治疗后HBeAg的消失, 优于HBV RNA和高灵敏HBV DNA.
本研究尚存局限性: 首先, 样本量相对较小; 其次, 治疗随访的时间相对较短, 缺乏更长期的数据; 未来需要开展大样本量前瞻性研究来验证本研究的结论.
| 1. | Boora S, Sharma V, Kaushik S, Bhupatiraju AV, Singh S, Kaushik S. Hepatitis B virus-induced hepatocellular carcinoma: a persistent global problem. Braz J Microbiol. 2023;54:679-689. [PubMed] [DOI] |
| 2. | Zhang W, Zhang D, Dou X, Xie Q, Jiang J, Chen X, Ren H. Consensus on Pegylated Interferon Alpha in Treatment of Chronic Hepatitis B. J Clin Transl Hepatol. 2018;6:1-10. [PubMed] [DOI] |
| 3. | Li X, Zhao J, Yuan Q, Xia N. Detection of HBV Covalently Closed Circular DNA. Viruses. 2017;9:139. [PubMed] [DOI] |
| 4. | Kumar R, Pérez-Del-Pulgar S, Testoni B, Lebossé F, Zoulim F. Clinical relevance of the study of hepatitis B virus covalently closed circular DNA. Liver Int. 2016;36 Suppl 1:72-77. [PubMed] [DOI] |
| 5. | Gao N, Guan G, Xu G, Wu H, Xie C, Mo Z, Deng H, Xiao S, Deng Z, Peng L, Lu F, Zhao Q, Gao Z. Integrated HBV DNA and cccDNA maintain transcriptional activity in intrahepatic HBsAg-positive patients with functional cure following PEG-IFN-based therapy. Aliment Pharmacol Ther. 2023;58:1086-1098. [PubMed] [DOI] |
| 6. | Höner Zu Siederdissen C, Maasoumy B, Cornberg M. What is new on HBsAg and other diagnostic markers in HBV infection? Best Pract Res Clin Gastroenterol. 2017;31:281-289. [PubMed] [DOI] |
| 7. | European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol. 2017;67:370-398. [PubMed] [DOI] |
| 8. | Testoni B, Lebossé F, Scholtes C, Berby F, Miaglia C, Subic M, Loglio A, Facchetti F, Lampertico P, Levrero M, Zoulim F. Serum hepatitis B core-related antigen (HBcrAg) correlates with covalently closed circular DNA transcriptional activity in chronic hepatitis B patients. J Hepatol. 2019;70:615-625. [PubMed] [DOI] |
| 9. | Lin J, Jiang S, Chen X, Zhu M, Zhang H. The significance of detecting HBV pgRNA and HBcrAg in HBV patients treated with NAs. Medicine (Baltimore). 2024;103:e37752. [PubMed] [DOI] |
| 10. | Erken R, Zaaijer HL, Willemse SB, Bakker E, Takkenberg BB, Reesink HW, Kootstra NA. Hepatitis B core related antigen in relation to intrahepatic and circulating viral markers, before and after combination therapy. Ann Hepatol. 2021;26:100540. [PubMed] [DOI] |
| 12. | Zhu Y, Luo Y, Guo F, Yang K, Fan H, Liu C, Huang B, Tang X, Guan Y. [Predictive value of serum HBV RNA for therapeutic effect of entecavir in patients with chronic hepatitis B]. Nan Fang Yi Ke Da Xue Xue Bao. 2022;42:1250-1255. [PubMed] [DOI] |
| 13. | Mak LY, Cloherty G, Wong DK, Gersch J, Seto WK, Fung J, Yuen MF. HBV RNA Profiles in Patients With Chronic Hepatitis B Under Different Disease Phases and Antiviral Therapy. Hepatology. 2021;73:2167-2179. [PubMed] [DOI] |
| 14. | Seto WK, Liu KS, Mak LY, Cloherty G, Wong DK, Gersch J, Lam YF, Cheung KS, Chow N, Ko KL, To WP, Fung J, Yuen MF. Role of serum HBV RNA and hepatitis B surface antigen levels in identifying Asian patients with chronic hepatitis B suitable for entecavir cessation. Gut. 2021;70:775-783. [PubMed] [DOI] |
| 15. | Levrero M, Testoni B, Zoulim F. HBV cure: why, how, when? Curr Opin Virol. 2016;18:135-143. [PubMed] [DOI] |
| 16. | 饶 希, 施 欢欢, 吴 振平, 李 小鹏, 刘 晓妍, 张 伦理. 长期核苷酸类似物治疗的慢性乙型肝炎患者血清HBV pgRNA与抗原状态变化的相关性研究. 中华肝脏病杂志. 2021;29:766-770. [DOI] |
| 17. | Wang Y, Liao H, Deng Z, Liu Y, Bian D, Ren Y, Yu G, Jiang Y, Bai L, Liu S, Liu M, Zhou L, Chen Y, Duan Z, Lu F, Zheng S. Serum HBV RNA predicts HBeAg clearance and seroconversion in patients with chronic hepatitis B treated with nucleos(t)ide analogues. J Viral Hepat. 2022;29:420-431. [PubMed] [DOI] |
| 18. | Ye G, Chen C, Zhou Y, Tang L, Cai J, Huang Y, Yang J, Feng Y, Chen L, Wang Y, Ma Y, Lin G, Wu Y, Jiang X, Hou J, Li Y. Anti-HBc mirrors the activation of HBV-specific CD8(+) T cell immune response and exhibits a direct effect on HBV control. Antiviral Res. 2024;230:105975. [PubMed] [DOI] |
| 19. | Caviglia GP, Armandi A, Rosso C, Ribaldone DG, Pellicano R, Fagoonee S. Hepatitis B Core-Related Antigen as Surrogate Biomarker of Intrahepatic Hepatitis B Virus Covalently-Closed-Circular DNA in Patients with Chronic Hepatitis B: A Meta-Analysis. Diagnostics (Basel). 2021;11:187. [PubMed] [DOI] |
| 20. | Luo H, Tan N, Kang Q, Pan J, Chen H, Xi H, Yu M, Xu X. Hepatitis B virus pregenomic RNA status can reveal the long-term prognoses of chronic hepatitis B patients treated with nucleos(t)ide analogues. J Viral Hepat. 2020;27:323-328. [PubMed] [DOI] |
| 21. | Wang B, Carey I, Bruce M, Montague S, Dusheiko G, Agarwal K. HBsAg and HBcrAg as predictors of HBeAg seroconversion in HBeAg-positive patients treated with nucleos(t)ide analogues. J Viral Hepat. 2018;25:886-893. [PubMed] [DOI] |
| 22. | Sonneveld MJ, van Oord GW, van Campenhout MJ, De Man RA, Janssen HLA, de Knegt RJ, Boonstra A, van der Eijk AA. Relationship between hepatitis B core-related antigen levels and sustained HBeAg seroconversion in patients treated with nucleo(s)tide analogues. J Viral Hepat. 2019;26:828-834. [PubMed] [DOI] |
| 23. | Liao H, Liu Y, Li X, Wang J, Chen X, Zou J, Li Q, Liu L, Wang J, Huang B, Lu F, Xu D. Monitoring of serum HBV RNA, HBcrAg, HBsAg and anti-HBc levels in patients during long-term nucleoside/nucleotide analogue therapy. Antivir Ther. 2019;24:105-115. [PubMed] [DOI] |
| 24. | Chen EQ, Wang ML, Tao YC, Wu DB, Liao J, He M, Tang H. Serum HBcrAg is better than HBV RNA and HBsAg in reflecting intrahepatic covalently closed circular DNA. J Viral Hepat. 2019;26:586-595. [PubMed] [DOI] |
| 25. | Li J, Wu Z, Wang GQ, Zhao H. Hepatitis B core-related antigen reflects viral replication and protein production in chronic hepatitis B patients. Chin Med J (Engl). 2021;134:1160-1167. [PubMed] [DOI] |
| 26. | Jansen L, Kootstra NA, van Dort KA, Takkenberg RB, Reesink HW, Zaaijer HL. Hepatitis B Virus Pregenomic RNA Is Present in Virions in Plasma and Is Associated With a Response to Pegylated Interferon Alfa-2a and Nucleos(t)ide Analogues. J Infect Dis. 2016;213:224-232. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 河北省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁