修回日期: 2025-08-29
接受日期: 2025-09-12
在线出版日期: 2025-09-28
帽状息肉病是一种罕见疾病, 病因与发病机制尚未明确. 本研究基于文献回顾, 推测其潜在病因, 并通过统计学方法分析其常见临床表现、典型内镜及病理特征, 以期规范并优化治疗策略, 改善患者的临床结局及预后.
分析总结帽状息肉病(cap polyposis, CP)的可能病因、临床表现、结肠镜和病理特征、治疗及转归等, 旨在加强临床医生对该疾病的认识.
报道2例天津市人民医院消化内科收治的CP患者, 详细描述2例患者的诊疗经过及预后. 同时收集截至2025-06国内外报道的CP病例资料及相关文献, 对该疾病的流行病学特征、发病机制、临床表现、诊断、治疗及预后等信息进行总结分析.
联同本文复习2例, 截至2025-06文献报道CP病例共计82例, 男女比例约0.95:1; 中位年龄44岁, 其中≤18岁少年患者13例(15.8%); 常见临床表现包括便血、腹泻、腹痛等, 部分患者可出现不同程度低蛋白血症和贫血; 病变主要累及直肠和乙状结肠, 内镜下表现为大小及数量不等的息肉样病变, 表面充血并伴有黏液和脓性渗出物附着; 本病的特征性病理表现为黏膜组织表面覆盖一层由纤维蛋白炎性渗出物、黏液和肉芽组织形成所构成的"帽"状结构; 治疗上以药物治疗为主, 包括抗炎、抗感染、根除幽门螺杆菌及应用生物制剂治疗; 息肉数量较少且范围相对局限的患者, 可考虑内镜下治疗; 若药物或内镜下治疗效果欠佳, 可以考虑行手术治疗.
CP是一种病因尚未明确的结直肠良性疾病, 缺乏典型的临床表现及实验室检查, 特征性的内镜及病理表现有助于明确诊断.
核心提要: 帽状息肉病(cap polyposis, CP)非常罕见, 目前文献报道不超过100例, 非常容易漏诊和误诊. 本文共收集了82例资料完整的病例, 分析总结CP的可能病因、临床表现、结肠镜和病理特征、治疗及转归等, 以期加强临床医生对该疾病的认识.
引文著录: 赵狄, 刘艳迪, 崔翠翠. 帽状息肉病的临床特征分析. 世界华人消化杂志 2025; 33(9): 749-757
Revised: August 29, 2025
Accepted: September 12, 2025
Published online: September 28, 2025
Cap polyposis (CP) is a rare condition with elusive etiology and pathogenesis. Based on a comprehensive literature review, this study aimed to postulate its underlying causes and statistically analyze its common clinical manifestations and typical endoscopic and pathological features, with the goal of standardizing and optimizing treatment strategies to enhance clinical outcomes and prognosis.
To analyze and summarize the potential etiology, clinical manifestations, colonoscopic and pathological characteristics, treatment, and prognosis of CP, so as to raise clinicians' awareness of this rare disease.
We report two cases of CP admitted to the Department of Gastroenterology, Tianjin Union Medical Center, detailing the diagnostic and therapeutic course as well as prognosis. The literature on CP published before June 2025 was collected and analyzed. And the epidemiological characteristics, pathogenesis, clinical manifestations, diagnosis, treatment, and prognosis of CP were systematically reviewed.
A total of 82 cases of CP had been reported up to June 2025 in the literature, with a male to female ratio of approximately 0.95:1. The median age was 44 years old, and there were 13 patients (15.8%) ≤ 18 years old. Common clinical manifestations included hematochezia, diarrhea, and abdominal pain, as well as varying degrees of hypoalbuminemia and anemia in some patients. The lesions were usually located at the rectum and sigmoid colon, and colonoscopic findings revealed polypoid mucosal lesions of varying sizes and numbers, with mucoid exudate or fibrinopurulent covering the surface of the lesion. The characteristic pathological manifestation of this disease was a "cap-like" structure covering the mucosal surface, composed of fibrin inflammatory exudates, mucus, and granulation tissue. Therapeutic management primarily involved pharmacological treatment, including anti-inflammatory therapy, anti-infection agents, Helicobacter pylori eradication, and biologic agents. For patients with a limited number of polyps and localized involvement, endoscopic therapy may be considered. Surgical intervention could be an option if pharmacological or endoscopic treatments prove ineffective.
CP is a benign colorectal disease of unknown etiology, lacking typical clinical manifestations and laboratory findings. Characteristic endoscopic and pathological features are crucial for definitive diagnosis.
- Citation: Zhao D, Liu YD, Cui CC. Clinical characteristics of cap polyposis. Shijie Huaren Xiaohua Zazhi 2025; 33(9): 749-757
- URL: https://www.wjgnet.com/1009-3079/full/v33/i9/749.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i9.749
帽状息肉病(cap polyposis, CP)是一种罕见的良性肠道疾病, 由William等[1]于1985年首次描述, 因其被脓性渗出液覆盖的肉芽组织的"帽状"特征而得名. 该疾病病例数极为有限, 目前文献报道不超过100例, 非常容易漏诊和误诊. 本文报道2例天津市人民医院消化科收治的CP病例, 并收集近年国内外病例报道资料及相关文献, 旨在加强临床医生对该疾病的认识, 减少误诊及漏诊病例的发生.
共入选病例82例, 其中本文报道病例2例, 其余80例为截至2025-06国内外报道的CP病例, 该部分病例资料通过文献检索获得.
在PubMed数据库、EMBASE数据库、中国知网全文数据库、万方数据库和维普中文期刊数据库中检索截至2025-06报道诊断CP的病例, 排除重复报道病例, 排除诊断未明、病例基本信息及诊疗经过不完善等情况. 检索式及检索结果如下: 在万方数据库、中国知网全文数据库和维普中文期刊数据库中以"帽状息肉病"为检索词, 检索到2021-02/2023-06期间可纳入文献8篇; 在PubMed数据库和EMBASE数据库中以"Cap polyposis"为检索词, 检索到1998-04/2024-05期间可纳入文献67篇. 综上共计检索相关文献75篇, 累计报道病例数80例, 联同本文报道2例共纳入82例病例进行文献复习.
统计学处理 应用SPSS 27.0软件进行数据分析. 非正态分布计量资料以中位数表示; 计数资料应用例数(%)表示. 方差不齐的近似正态分布计量资料, 选用非参数检验方法. 组间比较采用Kruskal-Wallis H检验, 若组间总体比较存在显著差异, 则进一步采用Dunn检验进行事后两两比较.
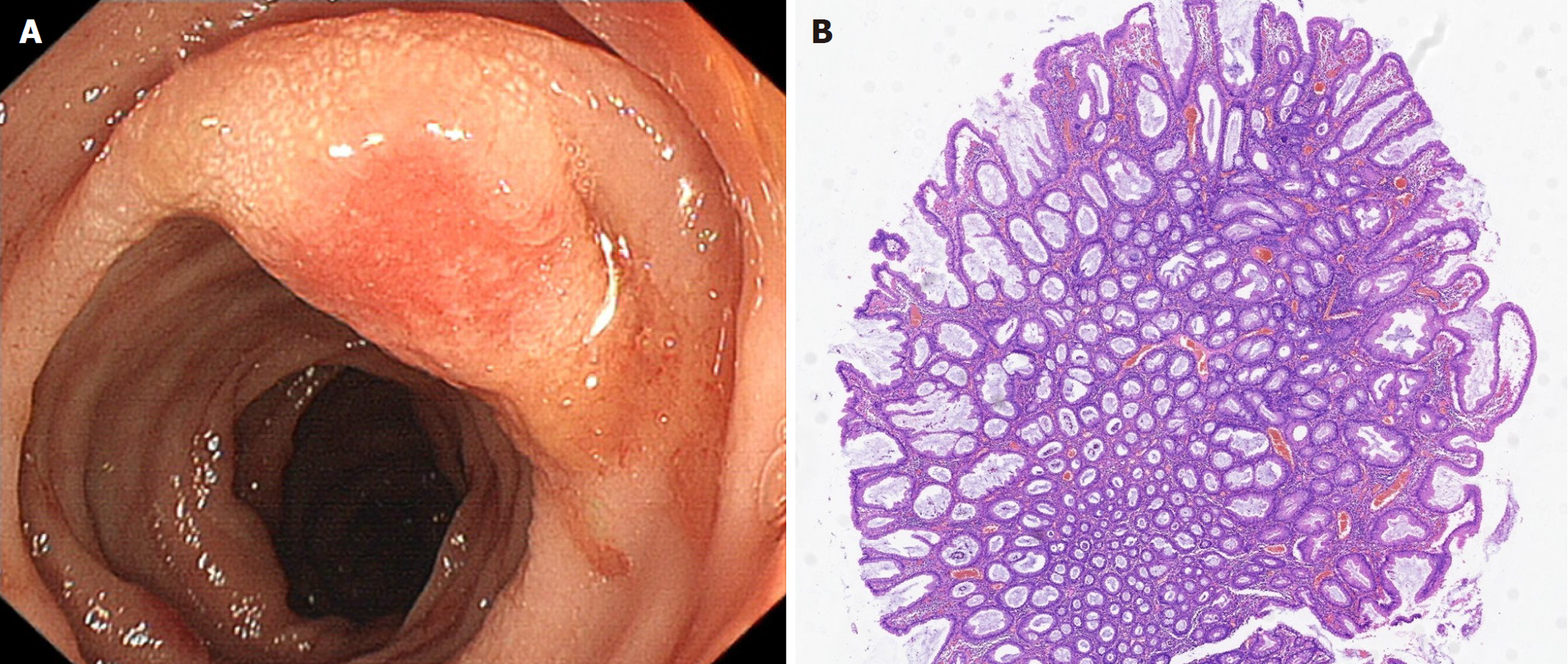
2.1.1 病例1: 患者女性, 71岁, 主述"间断腹泻、粘液血便12年, 加重2月"于2022-02-06收入天津市人民医院消化科. 患者12年前因腹泻、粘液血便于当地医院诊断为"溃疡性结肠炎", 应用美沙拉嗪治疗后症状改善, 后规律服药, 但症状间断反复, 入院前2 mo髋关节置换术后出现腹泻, 每日10余次, 可见少量粘液及血迹, 当地医院完善肠镜考虑溃疡性结肠炎, 结肠多发息肉, 行内镜下息肉电切治疗, 术后便血量增加, 故就诊于天津市人民医院. 患者既往脑垂体瘤微创手术史. 入院查体: 生命体征平稳, 腹平坦, 下腹部轻压痛, 无反跳痛, 肠鸣音亢进, 双下肢轻度凹陷性水肿. 实验室检查: 血常规示血红蛋白96 g/L, 白细胞计数、血小板计数正常. 白蛋白27 g/L. 肿瘤标记物: 糖类抗原125: 57.38 U/mL, 糖类抗原72-4: 24.6 IU/mL. 便常规: 白细胞8-10/HPF, 红细胞8-10/HPF. 余化验检测未见明显异常. 全腹部CT平扫+强化: 横结肠、降结肠、乙状结肠、直肠肠壁弥漫性、环形增厚, 明显强化, 结肠袋大部消失、变平, 系膜直小血管增多、密集, 呈梳状排列, 肠系膜可见多发小淋巴结影, 短径<1.0 cm, 轻-中度均匀强化, 边缘光滑. 结肠镜: 降结肠、乙状结肠及直肠可见多发扁平粘膜隆起, 直径约0.3-1.2 cm, 表面充血, 部分糜烂, 周围呈白色点状改变, 病变间可见相对正常粘膜(图1A). 胃镜: 慢性非萎缩性胃炎. 病理: 粘膜组织息肉样生长伴大量急慢性炎, 表面糜烂, 可见隐窝脓肿, 腺上皮粘液分泌亢进, 考虑炎性息肉. 给予美沙拉嗪4 g/d口服, 氢化可的松+血凝酶灌肠治疗, 症状改善出院. 5 mo后(2022-07-28)因症状加重再次收入我科, 完善肠系膜血管CTA未见明显异常, 复查结肠镜: 横结肠近脾曲、降结肠、乙状结肠、直肠可见多发扁平黏膜隆起、表面糜烂, 覆少量白色分泌物, 周围呈白色点状改变. 病理: 粘膜慢性炎症伴糜烂, 间质纤维组织增生, 局灶腺上皮萎缩, 局灶腺上皮低级别上皮内瘤变. 考虑不除外CP, 完善C14呼气试验阳性, 给予根除(克拉霉素、甲硝唑、雷贝拉唑、胶体果胶铋)治疗, 效果欠佳, 加用甲泼尼龙32 mg口服, 症状改善, 大便不成形, 每日5次左右, 无便血, 出后院激素规范减量, 4 mo后(2022-12-06)症状再次加重于肛肠外科住院治疗, 后经评估行全结肠直肠(包括肛门)切除+腹腔粘连松解+腹腔切开引流+回肠造口术, 术后病理: (全结肠、直肠切除)距回盲瓣15 cm至距回盲瓣70 cm处肠黏膜充血水肿、糜烂伴溃疡形成, 肠黏膜隐窝变性坏死, 肠壁全层广泛血管扩张淤血, 考虑为肠系膜血管病所致的缺血性改变; 后病理送至浙江大学医学院附属邵逸夫医院会诊: (手术切除标本)肠粘膜活动性炎, 部分表面上皮脱落、炎性肉芽组织形成, 隐窝扭曲、萎缩、局部隐窝增生, 黏液分泌亢进, 间质肌纤维稍增生, 毛细血管增生, 血管扩张充血, 考虑符合CP(图1B). 随访患者恢复良好, 血红蛋白、白蛋白恢复正常.
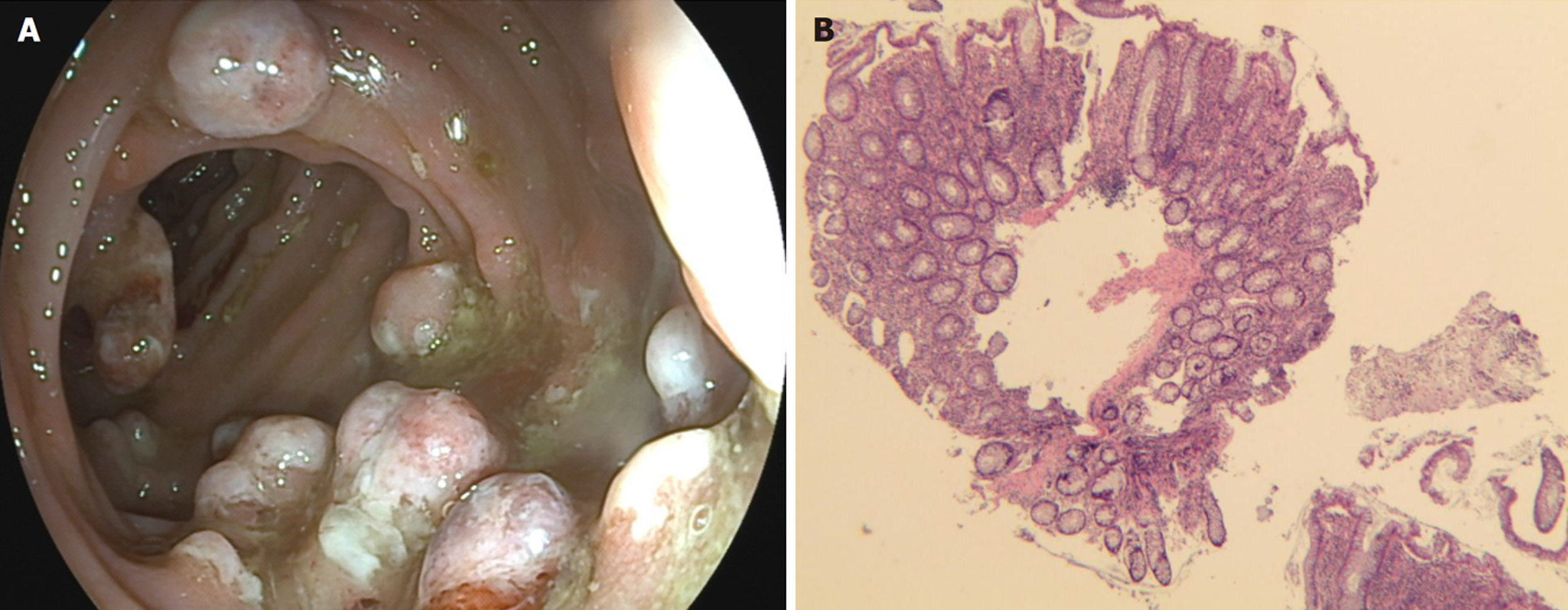
2.1.2 病例2: 患者男性, 36岁, 主述"间断腹泻2年, 加重伴腹痛、便血1 mo"于2023-04-10收入天津市人民医院消化科. 患者2年前无明显诱因间断出现腹泻, 为黄色稀便, 无粘液脓血, 最多每日4-5次, 无其他不适, 自行服用蒙脱石散治疗, 症状反复, 入院前1 mo大便次数增多至每日10余次, 水样便, 可见少量鲜血, 伴下腹坠痛, 无发热, 遂收入天津市人民医院治疗. 患者既往无基础疾病, 入院查体: 生命体征平稳, 腹平坦, 下腹部轻压痛, 无反跳痛, 肠鸣音亢进. 实验室检查: 血常规示血红蛋白110 g/L, 白细胞计数、血小板计数正常. 快速C反应蛋白: 32.69 mg/L. 便常规: 白细胞>40/HPF, 红细胞10-15/HPF. 便培养无致病菌生长. 余化验检测未见明显异常. 全腹部CT平扫+强化: 横结肠至直肠壁弥漫性、环形增厚, 结肠袋存在, 增强检查黏膜面明显强化, 系膜直小血管增多、密集, 呈梳状排列, 肠周可见多发小淋巴结, 短径均小于1.0 cm, 强化均匀, 边缘光滑. 结肠镜: 升结肠粘膜尚光滑, 远段横结肠、降结肠、乙状结肠、直肠可见广泛充血红斑糜烂及多发粘膜隆起, 隆起表面可见粘液及纤维素样渗出(图2A). 胃镜: 慢性非萎缩性胃炎. 病理: 粘膜组织息肉样生长伴大量急慢性炎, 局灶糜烂、溃疡形成, 隐窝分支变形. 给予美沙拉嗪3 g/d口服, 氢化可的松+血凝酶灌肠治疗, 症状改善出院. 4 mo后(2023-08-21)因症状加重再次收入我科, 复查结肠镜: 远段横结肠、降结肠、乙状结肠、直肠可见多发粘膜隆起, 隆起表面可见粘液及纤维素样渗出, 病变间粘膜略粗糙, 局部可见充血糜烂. 病理: 粘膜溃疡伴肉芽组织形成, 黏液分泌亢进, 不除外CP(图2B). 考虑CP, 完善C14呼气试验阳性, 给予根除(克拉霉素、甲硝唑、雷贝拉唑、胶体果胶铋)治疗, 效果欠佳, 加用甲泼尼龙32 mg口服治疗, 症状改善, 大便不成形, 每日2次左右, 无便血, 出院后1 mo复查C14呼气试验阴性, 目前激素已停用, 继续服用美沙拉嗪, 患者病情尚稳定, 定期门诊随访.
2.2.1 一般临床资料: 82例患者中男性40例、女性42例, 中位年龄44岁, 其中≤18岁少年患者13例(15.8%), 年龄最小者11 mo龄.
2.2.2 临床表现及实验室检查: CP患者报道病例中常见症状包括便血、腹泻、腹痛等, 82例患者中63例(76.8%)出现便血或检测便潜血阳性, 46例(56.1%)出现腹泻, 25例(30.5%)出现腹痛, 其他症状还包括体重减轻12例, 下肢水肿7例, 里急后重5例, 直肠粘膜脱垂4例, 肛门下坠2例. 82例患者中6例(7.3%)出现C反应蛋白升高, 23例(28.0%)出现贫血, 27例(32.9%)出现不同程度低蛋白血症. 我们分析了20例具有明确数值的低蛋白血症患者的血清白蛋白水平与其病变范围的相关性, 各组患者的血清白蛋白水平描述性统计结果如表1所示, 左半结肠组和全结肠组的平均白蛋白水平较低(分别为23.0 g/L和24.0 g/L), 由于样本量较小且部分组别例数较少, 我们首先对数据进行正态性检验(Shapiro-Wilk检验)和方差齐性检验(Levene检验). 结果显示, 各组数据近似服从正态分布(P>0.05), 但方差不齐(P<0.05), 因此采用Kruskal-Wallis H检验进行组间比较, 结果显示, 各组间血清白蛋白水平差异具有统计学意义(H = 8.62, P = 0.035). 为进一步明确差异来源, 我们使用Dunn检验进行事后两两比较. 结果显示, 直肠乙状结肠组与左半结肠组之间的差异具有统计学意义(P = 0.021), 而其他组间比较均未达到显著性水平(所有P>0.05), 详见表2.
| 内镜范围 | 例数 | 平均白蛋白(g/L) | 标准差 | 最小值 | 最大值 |
| 直肠 | 2 | 32.5 | 1.5 | 32 | 33 |
| 直肠乙状结肠 | 13 | 30.8 | 5.2 | 21 | 39 |
| 左半结肠 | 4 | 23.0 | 4.5 | 15 | 28 |
| 全结肠 | 1 | 24.0 | - | 24 | 24 |
| 比较组 | P值 |
| 直肠乙状结肠 vs 左半结肠 | 0.021 |
| 直肠 vs 左半结肠 | 0.078 |
| 直肠乙状结肠 vs 全结肠 | 0.312 |
| 左半结肠 vs 全结肠 | 0.654 |
2.2.3 结肠镜下病变范围: 对结肠镜下病变累及范围进行统计, 单纯直肠21例(25.6%), 直肠及乙状结肠33例(40.2%), 左半结肠12例(14.6%), 其中5例直肠豁免, 全结直肠4例, 其中有3例直肠豁免, 其余为各段结肠散发病例, 其中以乙状结肠为主(6例). 此外还有2例为胃部发病病例.
2.2.4 治疗及转归: 82例中保守治疗者54例(65.9%), 其中23例患者单独或联合内镜下治疗, 16例(69.6%)治疗后症状改善. 药物治疗包括各类美沙拉嗪制剂、激素类(包括口服、静脉或灌肠)、抗感染治疗、根除幽门螺杆菌(Helicobacter pylori, H. pylori)治疗以及应用生物制剂治疗. 其中, H. pylori阳性患者共23例, 行根除治疗者19例, 症状改善者15例(有效率78.9%). 此外, 有4例H. pylori阴性者行根除治疗, 治疗有效率为50%. 应用生物制剂治疗5例, 4例应用英夫利西单抗, 2例症状改善, 2例效果欠佳. 另外1例应用阿达木单抗+强的松治疗, 但激素减量时症状复发, 后改用英夫利西单抗联合硫唑嘌呤治疗, 效果欠佳, 行全结肠切除术. 82例中行外科手术治疗28例(34.1%), 症状改善者20例, 另有4例病灶切除后因疗效欠佳或病灶复发, 再次行扩大切除术, 后症状改善. 转归方面, 药物治疗有效率为59.2%(29/49), 低于手术治疗的有效率71.4%(20/28).
CP是一种罕见的良性肠道疾病, 据报道该病可发生于任何年龄, 但以中年人群为主, 女性患者居多[2], 本文统计82例患者的发病年龄为11 mo-76岁, 中位发病年龄44岁, 其中≤18岁少年患者13例, 但性别无显著差异, 考虑与纳入病例时排除部分基本信息不完善的病例所致的选择偏倚有关.
CP的病因目前尚不明确, 相关研究表明或与黏膜脱垂、结肠动力异常、肠道菌群失调、H. pylori感染等因素相关. 研究证实CP与黏膜脱垂综合征具有组织学上的相似性(纤维肌性闭塞和腺体增生)[3]. 此外, 还有研究发现, 在CP病变边缘存在少量的黏膜内弹性蛋白, 而该蛋白是黏膜脱垂综合征的特征之一[4]. 这些表明黏膜脱垂和异常的结直肠运动对黏膜的慢性机械性刺激可能是CP发病的重要机制之一. Okamot等[5]的研究表明CP的发病可能与宿主-菌群共生关系的受损有关. 其报道了1例H. pylori阴性的CP患者, 口服抗生素治疗6 mo后息肉消退, 使用新一代测序技术进行粪便微生物群分析后显示, 服药前后肠道微生物群组成发生了显著变化, Blautia、Dorea和Sutterella的数量明显减少, 而有研究证实, Blautia和Dorea百分比的增加与IBD患者手术后缓解有关[6,7]. 这些表明CP与肠道微生态失调可能存在密切关系. CP可能与H. pylori感染有关, 已有部分病例报道了根除H. pylori治疗对于H. pylori阳性CP患者的疗效. 此外, 2019年的日本H. pylori感染管理指南也将CP列为可能与H. pylori相关的疾病[8]. 但仍有大部分病例H. pylori阴性且在病灶黏膜中未检出H. pylori, 故相关研究推测H. pylori可能通过释放炎症调节剂、分子模拟和全身免疫反应等机制间接导致帽状息肉的发生[9,10].
CP的临床症状可表现为便血、腹泻、腹痛、体重减轻等, 这与本文的统计结果基本一致. 根据既往报道[11], 部分患者可因肠道蛋白渗漏导致低蛋白血症而出现水肿和腹水等表现, 并且认为低蛋白血症反映了疾病活动性. 本文统计结果显示, 32.9%的患者出现不同程度的低蛋白血症. 进一步分析发现, 低蛋白血症的严重程度与内镜下所见病变范围之间存在显著统计学关联(P = 0.035). 其中, 左半结肠病变患者的血清白蛋白水平显著低于直肠乙状结肠病变患者(P = 0.021). CP的实验室检查无明显特异性, C-反应蛋白(C-reactive protein, CRP)及白细胞计数通常在正常范围内[12], 由于大部分患者存在便血表现, 故可出现不同程度贫血. 本研究统计有32.9%的患者存在贫血, 但由于样本量有限, 尤其重度贫血病例数过少(仅1例), 未能发现贫血严重程度与内镜下病变范围之间存在统计学相关性.
CP内镜下表现为大小及数量不等的息肉样粘膜病变, 多数无蒂, 表面充血发红, 伴有黏液和脓性渗出物附着, 部分病例报道息肉周围粘膜可见微小的白色斑点[13], 病灶之间黏膜正常. 内镜窄带成像技术下见病变中心处无结构, 无结构区域内部未见异常的微血管, 周围的微腺管和微血管未见异常[14]. 超声内镜提示第二层明显增厚[15], 而粘膜脱垂综合征则以第三层增厚为主[16], 这也是二者的鉴别要点之一. 据报道病变主要累及直肠和乙状结肠[17], 本文统计病变位于单纯直肠和直肠乙状结肠的病例共54例, 占全部病例的65.9%. 另外, 也有个别胃部发生CP的报道[18,19]. CP的强化CT影像缺乏特异性, 可表现为病变肠管不同程度增厚, 严重者可见管腔变窄, 部分病变可见软组织肿块影并可见区域性淋巴结肿大, 易误诊为肿瘤[20].
CP的特征性病理表现为黏膜组织表面覆盖一层由渗出的纤维蛋白伴急慢性炎细胞浸润、黏液分泌和肉芽组织形成所构成的"帽"状结构[21]. 上皮层可以见到隐窝细长、分支、扭曲、扩张; 隐窝上皮排列规整, 无异型性; 少量隐窝呈锯齿状改变. 大多数可见隐窝内黏液过度分泌, 相关研究表明与正常细胞分泌的黏液不同, 该黏液以非硫酸粘蛋白为主, 硫酸粘蛋白比例较少. 其作用目前尚不清楚, 推测其对粘膜可能有保护作用[22]. 粘膜固有层内平滑肌和纤维垂直于黏膜肌在隐窝间穿插增生, 病变后期出现纤维肌性闭塞[23].
针对该病目前尚无系统规范用以指导治疗, 综合既往文献报告可归纳为药物治疗、内镜下治疗及手术治疗. 此外, 有报道指出, 通过避免排便时过度用力[24]以及实施全胃肠外营养以减少粪便对肠道的机械性刺激[9], 可能对改善病情具有一定作用. 药物治疗包括5-氨基水杨酸制剂、糖皮质激素、甲硝唑、根除H. pylori药物及生物制剂. 根据既往报道, 5-氨基水杨酸制剂及糖皮质激素对于CP疗效欠佳且多有复发[25], 目前尚无研究明确阐述上述药物在CP治疗中的具体作用机制. 鉴于CP的息肉"帽"本质上是由大量中性粒细胞、淋巴细胞和浆细胞浸润的炎性肉芽组织, 我们推测5-氨基水杨酸及糖皮质激素可能通过抑制促炎因子的产生、调节炎症信号通路, 从而减轻局部炎症反应, 促进息肉缩小及炎症消退. 应用甲硝唑治疗CP是基于该病可能与肠道感染有关, 然而, 现有研究提示甲硝唑对CP的有益作用可能并非主要依赖其抗菌机制[15]. 一方面, 其他广谱抗生素(如左氧氟沙星和环丙沙星)并未显示出明确的临床改善作用[10]; 另一方面, 研究表明甲硝唑还可能通过充当自由基清除剂、调节淋巴细胞的功能、抑制白细胞与内皮细胞的粘附和白细胞的迁移等多种途径发挥其抗炎作用[15]. 本研究统计发现2例H. pylori阴性患者在接受含甲硝唑的方案根除治疗后出现症状缓解, 推测该疗效可能与甲硝唑的免疫调节及抗炎作用相关. 目前已有诸多学者报道了根除H. pylori治疗对H. pylori阳性CP患者的疗效[9,10], 本研究统计显示, 根除H. pylori治疗组的有效率为73.9%(17/23), 显著高于非根除药物治疗组的31.1%(14/45). 生物制剂治疗CP的报告较少, 疗效亦存在差异, 现有报道以英夫利西单抗为主. 结合病例分析发现, 症状获得改善的2例患者其CRP水平基本处于正常范围,而其中1例疗效欠佳者的CRP高达83 mg/L, 同时伴有低白蛋白血症(血清白蛋白为24 g/L)[26,27], 推测治疗失败可能与高炎症负荷及低蛋白状态导致药物浓度不足有关. 此外, 另有1例治疗无效患者在英夫利西单抗治疗前后结肠黏膜组织中TNF-α水平未见显著变化, 提示该类患者炎症反应可能并非主要由肿瘤坏死因子(tumor necrosis factor alpha, TNF-α)通路驱动, 其发病机制存在异质性[28]. 内镜下治疗以内镜下黏膜切除术(endoscopic mucosal resection, EMR)及内镜下黏膜剥离术(endoscopic submucosal dissection, ESD)为主, 但术后易复发, 本研究统计内镜下治疗复发率约为40%(10/25). 对于单发或息肉个数较少、散在分布的病例可以行EMR治疗. 而息肉多发、密集分布、病变范围较广的病例则更适合行ESD治疗, 并且ESD能进行完整的病理评估, 在防止复发方面更具优势[29]. 关于CP手术的最佳时机尚未确定, 但Tokunaga等[30]报道, 手术的有效率只有55%左右, 低于本文统计的有效率71.4%, 考虑与纳入样本量有关. 如果CP的息肉数量多, 范围广, 内镜下无法完全切除, 或药物治疗无效且患者有低蛋白血症等全身症状, 可以考虑手术切除病变肠道.
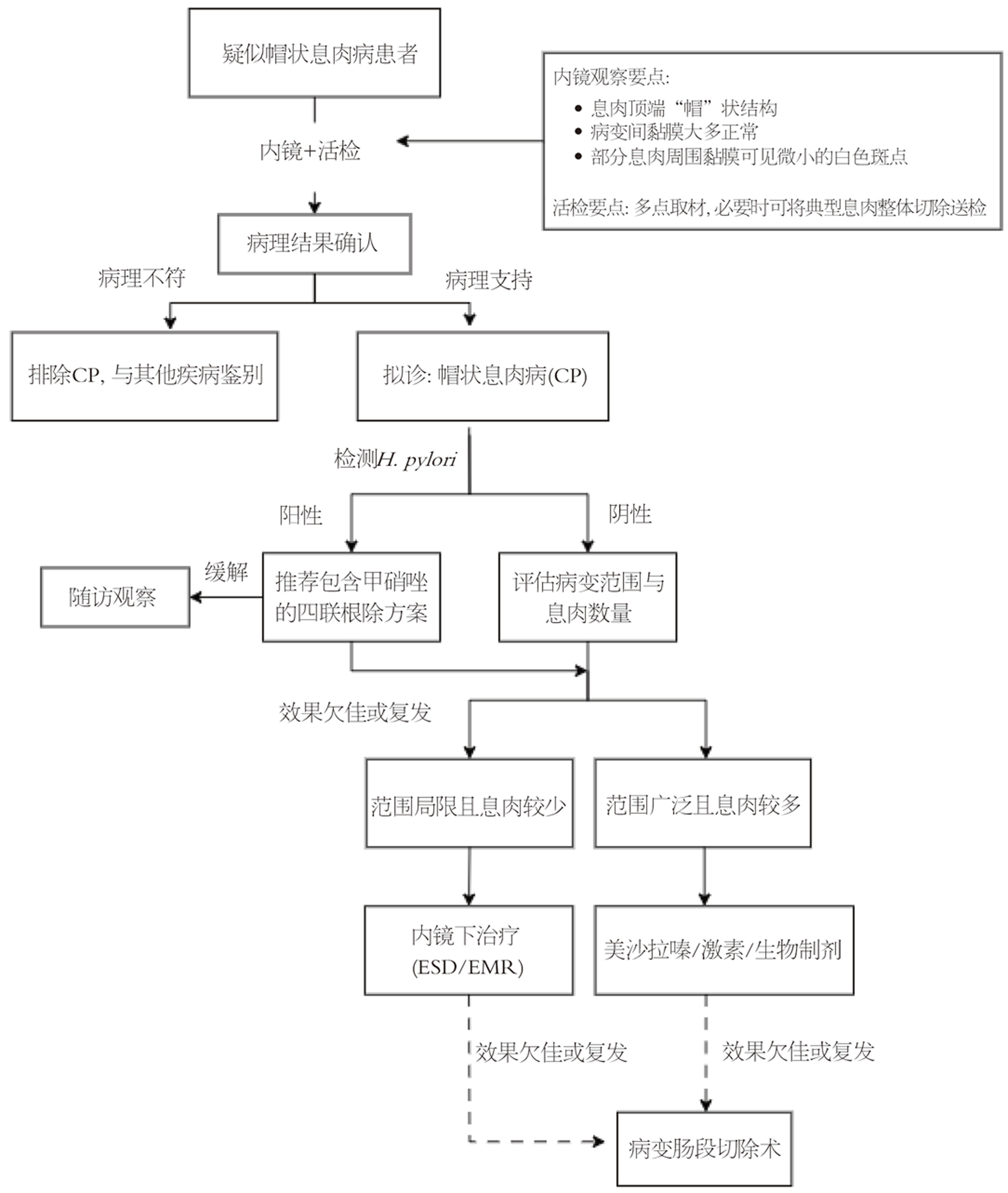
综上, CP是一种病因尚未明确的结直肠良性疾病, 缺乏典型的临床表现及实验室检查, 虽然特征性的内镜及病理表现有助于诊断, 但仍然极易被误诊, 本文统计的82例患者中就有1/3以上(26/82)的患者被误诊为炎症性肠病或黏膜脱垂综合征等, 故总结鉴别要点如下: (1)溃疡性结肠炎也可出现炎性假性息肉, 但息肉之间难以看到正常黏膜. 组织学溃疡性结肠炎腺体缺乏CP的过度分泌表现, 往往在隐窝结构改变基础上伴随慢性炎性细胞浸润; (2)CP和黏膜脱垂综合征组织学表现非常相似, 都有纤维肌性闭塞和腺体增生, 不同点是CP有帽状结构, 而黏膜脱垂综合征会有腺体异位至黏膜下层, 黏膜下层有纤维肌性闭塞、腺体增生和黏液囊肿形成[31]. 该病目前尚无公认的诊断标准,基于文献分析结果, 本研究初步构建了诊疗建议流程图(图3), 以辅助临床医生深化对该病的认识、提升诊断效率, 并为改善患者临床结局及预后提供参考.
帽状息肉病(cap polyposis, CP)是一种罕见的结直肠疾病, 截至目前, 全球确诊病例仅百余例, 属于消化领域的疑难杂症. 纵观国内外研究现状, 目前对CP的认知仍主要基于病例报告和小样本病例系列分析, 其病因及发病机制尚不明确, 临床表现多样, 由于缺乏对典型内镜及病理特征的认识, 极易出现误诊和漏诊. 治疗策略存在显著争议, 从药物治疗到内镜下切除, 乃至手术治疗均有尝试, 但缺乏标准化方案. 本研究的意义在于通过对现有报道病例的系统梳理和分析, 填补这一知识鸿沟, 加强临床医生对该疾病的认识.
本研究旨在系统分析CP的临床特征、内镜与病理表现、治疗反应及预后, 拟解决以下关键问题: 一是明确CP的流行病学特征和临床表现规律, 尤其是在低蛋白血症、贫血等全身表现与病变范围之间的关联; 二是总结其特征性的内镜与病理诊断要点, 降低误诊率; 三是评估不同治疗策略(包括药物、内镜及手术)的有效性及复发情况. 本研究通过系统性分析, 更深入地阐明CP的临床、内镜及病理学特征谱, 并评估了不同治疗方案的远期疗效, 初步建立了诊疗流程图, 为建立基于证据的CP标准化诊疗路径提供关键依据.
本研究的主要目标包括: 第一, 总结CP的流行病学特点、临床表现和内镜病理特征, 提高诊断准确性, 减少误诊; 第二, 探索低蛋白血症、病变范围等指标与疾病严重程度的相关性, 为病情评估提供依据; 第三, 分析不同治疗方案(包括药物、内镜及手术干预)的疗效与复发情况. 本研究实现了对CP人口学特征、临床特点、内镜与病理标志的全面总结, 明确了左半结肠受累与低蛋白血症的显著关联, 并初步构建了CP的诊疗流程图. 这些成果不仅为临床提供了清晰的诊断参考和治疗路径, 也为未来开展更大样本前瞻性研究和机制探索奠定了理论基础, 对提升CP的规范诊疗水平具有重要意义.
本研究采用回顾性病例分析与系统性文献综述相结合的方法, 对CP的临床特征、治疗反应及预后进行深入探讨. 运用统计方法对低蛋白血症严重程度与病变范围之间的相关性进行了验证. 本研究首次对中、英文文献进行大规模系统性病例整合, 形成迄今样本量最大的CP临床特征分析; 首次运用统计方法验证了低蛋白血症严重程度与病变范围之间的相关性, 为判断病情严重程度提供了客观依据; 并基于证据初步构建了CP临床诊疗流程图, 具有较强的临床指导价值.
本研究成功实现了既定目标, 系统揭示了CP的临床特征、治疗反应及预后相关因素, 并为该病的诊断与治疗提供了重要依据. 研究统计了常见症状的占比, 便血(76.8%)、腹泻(56.1%)及腹痛(30.5%), 部分患者伴有低蛋白血症(32.9%)和贫血(28.0%). 分析了各种治疗手段的有效率, 药物治疗总有效率为59.2%, 其中根除幽门螺杆菌(Helicobacter pylori, H. pylori)治疗后有效率高达78.9%, 而手术治疗的有效率为71.4%, 且术后仍存在复发可能. 本研究首次基于大样本数据系统地总结了CP患者的临床特点, 所初步构建的诊疗流程图整合了内镜、病理与治疗策略, 有助于临床减少误诊并实施个体化治疗, 对提升CP的诊疗规范性与患者预后具有重要推动作用.
本研究首次通过统计学方法证实左半结肠CP病变与低蛋白血症严重程度显著相关, 提示病变范围可作为评估蛋白质丢失和疾病严重程度的重要指标. 本研究提出CP可能是一种与黏膜机械性损伤、菌群失调及H. pylori感染等多种因素相关的异质性疾病, 其发病并非单一机制驱动. 同时认为甲硝唑对部分H. pylori阴性患者的疗效可能源于其抗炎及免疫调节作用, 而非单纯抗菌效果. 本研究首次整合中外文献病例进行大样本量系统分析, 并构建了基于循证医学的CP临床诊疗流程图. 研究发现根除治疗在H. pylori阳性患者中的疗效显著, 建议作为一线治疗方案. 同时发现生物制剂的疗效差异较大, 通过总结相关报道猜测其疗效可能与机体炎症负荷及蛋白营养状态相关. 本研究为CP的早期诊断、严重度评估及个体化治疗提供了清晰参考, 所提出的诊疗流程图有助于降低误诊率, 优化治疗策略, 改善患者预后.
本研究为回顾性分析, 病例来源于多家中心且时间跨度较大, 存在诊疗标准不统一、部分数据缺失等局限性. 此外, CP发病率低, 样本量仍相对有限, 尤其针对治疗策略的比较(如生物制剂、手术方式选择)未能进行多因素分析, 一定程度上影响结论的普适性. 如果可能, 未来建议各中心长期随访报道的患者, 追踪其远期预后, 同时深入探索CP的发病机制, 包括黏膜屏障功能、肠道菌群构成、免疫微环境改变及遗传易感性之间的相互作用. 本研究未来研究的最佳方法应结合前瞻性登记研究体系, 标准化临床数据、内镜图像及生物样本(组织、血液、粪便)的采集流程. 可运用分子生物学技术(如宏基因组、转录组及单细胞测序)深入解析疾病机制, 通过同质化的数据比较不同治疗方案的有效性与安全性, 为CP的个体化精准治疗提供高级别证据支持.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B, B
C级 (良好): C, C
D级 (一般): 0
E级 (差): E
科学编辑: 刘继红 制作编辑:张砚梁
| 2. | Papaconstantinou I, Karakatsanis A, Benia X, Polymeneas G, Kostopoulou E. Solitary rectal cap polyp: Case report and review of the literature. World J Gastrointest Surg. 2012;4:157-162. [PubMed] [DOI] |
| 3. | Tomar S, Maksimak M, Diehl DL. Cap Polyposis: An Elusive Diagnosis in a Pediatric Patient Successfully Managed With Endoscopic Treatment. ACG Case Rep J. 2022;9:e00918. [PubMed] [DOI] |
| 4. | Campbell AP, Cobb CA, Chapman RW, Kettlewell M, Hoang P, Haot BJ, Jewell DP. Cap polyposis--an unusual cause of diarrhoea. Gut. 1993;34:562-564. [PubMed] [DOI] |
| 5. | Okamoto K, Watanabe T, Komeda Y, Okamoto A, Minaga K, Kamata K, Yamao K, Takenaka M, Hagiwara S, Sakurai T, Tanaka T, Sakamoto H, Fujimoto K, Nishida N, Kudo M. Dysbiosis-Associated Polyposis of the Colon-Cap Polyposis. Front Immunol. 2018;9:918. [PubMed] [DOI] |
| 6. | Mondot S, Lepage P, Seksik P, Allez M, Tréton X, Bouhnik Y, Colombel JF, Leclerc M, Pochart P, Doré J, Marteau P; GETAID. Structural robustness of the gut mucosal microbiota is associated with Crohn's disease remission after surgery. Gut. 2016;65:954-962. [PubMed] [DOI] |
| 7. | Tyler AD, Knox N, Kabakchiev B, Milgrom R, Kirsch R, Cohen Z, McLeod RS, Guttman DS, Krause DO, Silverberg MS. Characterization of the gut-associated microbiome in inflammatory pouch complications following ileal pouch-anal anastomosis. PLoS One. 2013;8:e66934. [PubMed] [DOI] |
| 8. | Kato M, Ota H, Okuda M, Kikuchi S, Satoh K, Shimoyama T, Suzuki H, Handa O, Furuta T, Mabe K, Murakami K, Sugiyama T, Uemura N, Takahashi S. Guidelines for the management of Helicobacter pylori infection in Japan: 2016 Revised Edition. Helicobacter. 2019;24:e12597. [PubMed] [DOI] |
| 9. | Akamatsu T, Nakamura N, Kawamura Y, Shinji A, Tateiwa N, Ochi Y, Katsuyama T, Kiyosawa K. Possible relationship between Helicobacter pylori infection and cap polyposis of the colon. Helicobacter. 2004;9:651-656. [PubMed] [DOI] |
| 10. | Nakagawa Y, Nagai T, Okawara H, Nakashima H, Tasaki T, Soma W, Hisamatsu A, Watada M, Murakami K, Fujioka T. Cap polyposis (CP) which relapsed after remission by avoiding straining at defecation, and was cured by Helicobacter pylori eradication therapy. Intern Med. 2009;48:2009-2013. [PubMed] [DOI] |
| 11. | Shimura H, Yoshida S, Murakoshi N, Nakamura A, Itobayashi E, Shimura K. A case of cap polyposis successfully treated by steroid enema therapy. Gastroenterol Endosc. 2008;50:1311-1318. [DOI] |
| 12. | Akamatsu T. Clinical Features of Cap Polyposis. Nippon Daicho Komonbyo Gakkai Zasshi. 2001;54:950-954. [DOI] |
| 13. | Chang HS, Yang SK, Kim MJ, Ye BD, Byeon JS, Myung SJ, Kim JH. Long-term outcome of cap polyposis, with special reference to the effects of steroid therapy. Gastrointest Endosc. 2012;75:211-216. [PubMed] [DOI] |
| 15. | Shimizu K, Koga H, Iida M, Yao T, Hirakawa K, Hoshika K, Mikami Y, Haruma K. Does metronidazole cure cap polyposis by its antiinflammatory actions instead of by its antibiotic action? A case study. Dig Dis Sci. 2002;47:1465-1468. [PubMed] [DOI] |
| 16. | Hizawa K, Iida M, Suekane H, Mibu R, Mochizuki Y, Yao T, Fujishima M. Mucosal prolapse syndrome: diagnosis with endoscopic US. Radiology. 1994;191:527-530. [PubMed] [DOI] |
| 17. | Tamura K, Matsuda K, Yokoyama S, Iwamoto H, Mizumoto Y, Nakamura Y, Murakami D, Yamaue H. Successful laparoscopic resection for cap polyposis: case report, literature review. Surg Case Rep. 2018;4:69. [PubMed] [DOI] |
| 18. | Yang SY, Choi SI. Can the stomach be a target of cap polyposis? Endoscopy. 2010;42 Suppl 2:E124-E125. [PubMed] [DOI] |
| 19. | Iguchi E, Tsumura T, Sekikawa A, Wakasa T, Maruo T, Okabe Y, Kimura T, Osaki Y. Cap-polyposis-like gastropathy with hypoproteinemia treated with H. pylori eradication. Intern Med. 2013;52:2215-2218. [PubMed] [DOI] |
| 20. | Khadka T, Giri GK, Sherpa P, Shrestha N, Poudyal S. Cap Polyposis: A Case Report. JNMA J Nepal Med Assoc. 2023;61:555-558. [PubMed] [DOI] |
| 22. | Buisine MP, Colombel JF, Lecomte-Houcke M, Gower P, Aubert JP, Porchet N, Janin A. Abnormal mucus in cap polyposis. Gut. 1998;42:135-138. [PubMed] [DOI] |
| 23. | Brunner M, Agaimy A, Atreya R, Grützmann R, Matzel KE. Cap polyposis in children: case report and literature review. Int J Colorectal Dis. 2019;34:363-368. [PubMed] [DOI] |
| 24. | Oriuchi T, Kinouchi Y, Kimura M, Hiwatashi N, Hayakawa T, Watanabe H, Yamada S, Nishihira T, Ohtsuki S, Toyota T. Successful treatment of cap polyposis by avoidance of intraluminal trauma: clues to pathogenesis. Am J Gastroenterol. 2000;95:2095-2098. [PubMed] [DOI] |
| 25. | Minagawa T, Ikeuchi H, Kusunoki K, Kuwahara R, Horio Y, Kihara T, Hirota S, Uchino M. Cap polyposis treated with laparoscopic-assisted total proctocolectomy and ileal J-pouch anal anastomosis: a case report. Surg Case Rep. 2021;7:153. [PubMed] [DOI] |
| 26. | Kim ES, Jeen YT, Keum B, Seo YS, Chun HJ, Um SH, Kim CD, Ryu HS. Remission of cap polyposis maintained for more than three years after infliximab treatment. Gut Liver. 2009;3:325-328. [PubMed] [DOI] |
| 27. | Bookman ID, Redston MS, Greenberg GR. Successful treatment of cap polyposis with infliximab. Gastroenterology. 2004;126:1868-1871. [PubMed] [DOI] |
| 28. | Maunoury V, Breisse M, Desreumaux P, Gambiez L, Colombel JF. Infliximab failure in cap polyposis. Gut. 2005;54:313-314. [PubMed] [DOI] |
| 29. | 周 影, 姜 秋利, 陈 百胜, 吴 瑕, 吴 杏榆, 李 娜珊, 李 平, 陈 巍峰. 环周直肠黏膜剥离术治疗直肠帽状息肉所致的贫血患者1例. 中国临床案例成果数据库. 2024;E1556-E1556. |
| 30. | Tokunaga M, Ikeda S, Okiyama J, Hinoi T, Ohdan H. A Cap Polyposis Operated by Laparoscopy Assisted Low Anterior Resection: A Case Report. Nippon Shokaki Geka Gakkai Zasshi. 2009;42:685-690. [DOI] |