修回日期: 2025-09-04
接受日期: 2025-09-17
在线出版日期: 2025-09-28
无法手术的中晚期结肠癌(colorectal cancer, CRC)患者, 化疗综合治疗可延长生存期. 尽管近年来治疗手段的进步改善了CRC患者预后, 但是患者2年复发率在60%左右, 且早期诊断尚待突破, 因此探索新型靶向治疗机制具有重要意义.
分析阿帕替尼通过下调VEGFR2-PLC-ERK1/2通路抑制结肠癌细胞增殖影响.
培养结肠癌LS174T细胞, 选取对数生长期细胞, 分别加入0、25、50及100 mmol/L的阿帕替尼对细胞处理24、48、72 h, 检测阿帕替尼对细胞增殖影响. 在采用100 mmol/L的阿帕替尼对细胞处理24、48、72 h, 检测对细胞凋亡率、细胞周期影响, Western-blot检测相关凋亡蛋白和VEGFR2-PLC-ERK1/2通路相关蛋白表达情况.
24、48及72 h 25、50及100 mmol/L阿帕替尼组细胞吸光度均低于0 mmol/L组, 差异有统计学意义(P<0.05), 伴随阿帕替尼浓度增大、时间延长, LS174T细胞受到的抑制作用逐步变强, 阿帕替尼对于LS174T细胞增殖抑制呈现为时间浓度依赖性. 24、48及72h时阿帕替尼组细胞凋亡率分别为12.59%±1.18%、18.79%±1.40%、25.80%±1.51%, 高于对照组细胞凋亡率6.56%±1.10%, 差异有统计学意义(P<0.05); 和对照组相比, 阿帕替尼组24、48及72 h时G2/M、S期细胞数降低, G0/G1细胞数增加, 差异有统计学意义(P<0.05); 和对照组相比, 24、48及72 h时阿帕替尼组细胞内Bax、Cleaved caspase-3蛋白表达升高, Bcl-2蛋白表达降低, 差异有统计学意义(P<0.05); 和对照组相比, 24、48及72 h时阿帕替尼组细胞pERK1/2、pPLC蛋白表达降低, 差异有统计学意义(P<0.05), tERK1/2、tPLC蛋白表达无显著差异(P>0.05).
阿帕替尼对结肠癌LS174T细胞增殖有抑制作用, 并诱导细胞凋亡, 其作用机制可能和下调VEGFR2-PLC-ERK1/2通路内关键蛋白磷酸化有联系.
核心提要: 结肠癌(colorectal cancer, CRC)治疗中, 血管内皮生长因子/血管内皮生长因子受体[(vascular endothelial growth factor, VEGF)/(vascular endothelial growth factor receptor, VEGFR)]靶向药物是研究重点. 阿帕替尼作为小分子酪氨酸激酶抑制剂, 通过特异性结合VEGFR-2, 抑制VEGF诱导的内皮细胞增殖及微血管生成. 其机制涉及阻断VEGFR2-PLC-ERK1/2信号通路, 进而抑制肿瘤血管形成和CRC细胞增殖. 体外及裸鼠移植实验证实, 阿帕替尼对胃癌、CRC等实体瘤具有显著抗肿瘤活性, 为晚期CRC治疗提供了新策略.
引文著录: 崔亦筱, 余德顺, 张诗琪. 阿帕替尼通过VEGFR2-PLC-ERK1/2通路抑制结肠癌LS174T细胞增殖的机制研究. 世界华人消化杂志 2025; 33(9): 741-748
Revised: September 4, 2025
Accepted: September 17, 2025
Published online: September 28, 2025
For patients with colorectal cancer (CRC) who cannot be operated on, chemotherapy-based combined treatment can prolong their survival. Although the evolution of treatment methods in recent years has improved the prognosis of CRC patients, the 2-year recurrence rate of patients is about 60%, and early diagnosis has yet to be broken through. Therefore, it is of great significance to explore a new targeted treatment mechanism.
To analyze the effect of apatinib on the proliferation of colon cancer cells and explore the underlying mechanism.
Colorectal cancer LS174T cells were cultured. The cells in logarithmic growth phase were treated with 0, 25, 50 and 100 mmol/L apatinib for 24, 48 and 72 h to detect the effect of apatinib on cell proliferation. The cells were also treated with 100 mmol/L apatinib for 24, 48, and 72 h, and the apoptosis rate and cell cycle were detected. The expression of apoptosis proteins and VEGFR2-PLC-ERK1/2 pathway proteins was detected by Western blot.
Apatinib significantly inhibited the proliferation of colon cancer LS174T cells in a time- and dose-dependent manner (P < 0.05). The apoptosis rates of the apatinib group at 24, 48, and 72 h were 12.59% ± 1.18%, 18.79% ± 1.40%, and 25.80% ± 1.51%, respectively, all of which were signfiicantly higher than that of the control group 6.56% ± 1.10% (P < 0.05). Compared with the control group, the number of cells at G2/M and S phases significantly decreased in the apatinib group at 24, 48, and 72 hours and the number of G0/G1 cells significantly increased (P < 0.05). Compared with the control group, the expression of Bax and Cleaved caspase-3 proteins was increased and the expression of Bcl-2 protein was decreased in the apatinib group at 24, 48, and 72 hours (P < 0.05); the expression of pERK1/2 and pPLC proteins in the apatinib group decreased significantly at 24, 48, and 72 hours (P < 0.05), and there was no significant difference in tERK1/2 and tPLC protein expression (P > 0.05).
Apatinib can inhibit the proliferation of colorectal cancer LS174T cells and induce apoptosis, which may be related to the down-regulation of phosphorylation of key VEGFR2-PLC-ERK1/2 pathway proteins.
- Citation: Cui YX, Yu DS, Zhang SQ. Mechanism underlying inhibitory effect of apatinib on proliferation of colorectal cancer LS174T cells. Shijie Huaren Xiaohua Zazhi 2025; 33(9): 741-748
- URL: https://www.wjgnet.com/1009-3079/full/v33/i9/741.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i9.741
结肠癌(colorectal cancer, CRC)为临床多见恶性肿瘤之一, 患者发病率和治疗复杂性较高, 早期患者可通过肠镜下治疗或手术实现根治; 中晚期患者以手术为核心, 结合放化疗、靶向治疗及免疫治疗等综合手段, 部分患者仍有望获得根治[1]. 对于无法手术的中晚期患者, 以化疗为基础的综合治疗可显著延长生存期. 尽管近年来手术及辅助治疗手段的进步改善了CRC患者预后, 但是手术切除后患者2年复发率在60%左右[2], 且早期诊断生物标志物尚待突破, 因此探索新型靶向治疗机制具有重要意义. 积极探寻靶向治疗CRC药物的重点之一为血管内皮生长因子/血管内皮生长因子受体[(vascular endothelial growth factor, VEGF)/(vascular endothelial growth factor receptor, VEGFR)]抗血管生长类药品. 阿帕替尼为新型小分子酪氨酸激酶抑制剂, 可用于靶向治疗临床很多实体肿瘤患者[3]. 阿帕替尼能够和VEGFR-2特异性结合, 对VEGF刺激内皮细胞的增殖与迁移起到抑制作用, 进而抑制微血管的密度[4]. 相关研究显示[5], 阿帕替尼为VEGFR-2抑制剂, 经过对VEGFR-2靶向抑制对新生肿瘤血管产生抑制作用. 阿帕替尼经高度选择性地强效抑制VEGFR-2磷酸化和下游的PI3K-AKT-mTOR、ERK1/2-MAPK路径活化, 使信号传导抑制, 通过对生成的新生血管抑制来阻止患者体内肿瘤生长. 多项体外、体内实验显示, 阿帕替尼对胃癌、CRC、肺癌等裸小鼠移植瘤有明显抗肿瘤活性. 因此, 本研究经过分析阿帕替尼通过下调VEGFR2-PLC-ERK1/2通路抑制CRC细胞增殖影响, 为临床患者诊疗提供一些借鉴.
细胞株: 人CRC细胞株LS174T(中国科学院生物研究所). 药品材料: 细胞周期检测试剂盒、CCK-8检测试剂盒、膜联蛋白-Ⅴ-硫氰酸荧光素(Annexin-Ⅴ-FITC)/碘化丙啶(PI)凋亡检测试剂盒(碧云天生物研究所), 阿帕替尼片(江苏恒瑞医药公司), 0.25%胰蛋白酶消化液、100×青霉素/链霉素混合液、胎牛血清(以色列Biological Industries公司), RPMI 1640培养基(美国Hyclone公司), Bax抗体(CST #5023, 1:1000)、pERK1/2抗体(Abcam #ab214362, 1:2000). 仪器: 凝胶成像系统(美国Bio-Rad公司), 不同规格移液器(德国Eppendorf公司), 细胞培养板、细胞培养瓶(美国Corning公司), CyFolw space分选型流式细胞仪(德国PARTEC公司).
1.2.1 培养细胞: PRMI 1640完全培养基(含1%链霉素/青霉素混合液, 10%胎牛血清)于37 ℃, 含5%CO2培养箱内培养LS174T细胞, 细胞生长到培养瓶底面积90%进行传代. PBS冲洗2次, 采用0.25%胰蛋白酶消化2 min, 胰酶去掉, 在置入培养基(含胎牛血清)对细胞吹打, 细胞悬液传到新培养瓶内, 在置入新鲜PRMI 1640完全培养基培养.
1.2.2 CCK-8法检测细胞增殖: 选取对数生长期细胞放置在96孔细胞培养板内, 细胞浓度调整为1×105/mL, 细胞贴壁以后, 置入最终浓度分别是0、1、5、10、25、50及100 mmol/L阿帕替尼溶液, 每个浓度下在设立5个平行复孔, 在培养至24、48及72 h分别置入CCK8试剂10 mL, 孵育2 h置入二甲基亚砜溶液, 检测570 nm处吸光值(A)情况, 重复检测三次取平均值.
1.2.3 细胞周期与细胞凋亡: LS174T细胞选取对数生长期经0.25%胰蛋白酶消化以后制备为单细胞悬液, 6孔细胞培养板内种植, 浓度为1×105/mL, 细胞贴壁后置入0及100 mmol/L的阿帕替尼溶液, 培养24、48及72 h时采用Annexin Ⅴ-PTIC/PI试剂盒与细胞周期检测试剂盒检测细胞凋亡率与细胞周期情况, 其中0 mmol/L的阿帕替尼溶液作为对照组. 凋亡检测步骤: 细胞收集后, 按说明书加入Annexin V-FITC和PI, 避光孵育15 min; 细胞周期检测: 70%乙醇固定后, PBS洗涤, 加入PI染液(含50 μg/mL PI和100 μg/mL RNase A), 37 ℃避光孵育30 min, 流式细胞仪分析.
1.2.4 细胞相关凋亡蛋白和VEGFR2-PLC-ERK1/2通路相关蛋白表达: Western-blot检测相关凋亡蛋白和VEGFR2-PLC-ERK1/2通路相关蛋白表达, 采集经0 mmol/L的阿帕替尼溶液处理LS174T细胞、经100 mmol/L的阿帕替尼溶液处理24、48及72 h的LS174T细胞, 磷酸缓冲盐溶液洗涤, 置入细胞裂解液对细胞蛋白提取, 起始电压80 V, 溴酚蓝染料前缘进入分离胶上缘后电压提升至100 V, 溴酚蓝泳出分离胶下缘后电泳结束. 半干电转移仪于PVDF膜内行蛋白质电转移, 恒流30 mA, 连续90 min. PVDF膜取采用5% TBST脱脂奶粉封闭, 震荡60 min. 结束封闭TNS-T漂洗液洗膜10 min, 3次, 膜转移至杂交袋内, 加入适量漂洗液稀释抗体, 封口后于4 ℃下孵育过夜; TBST漂洗液洗膜10 min, 3次, 加入漂洗液稀释辣根过氧化物酶标记二抗, 震荡60 min. PVDF膜放置于ECL显色液内震荡温育5 min, 暗室下曝光、显影及定影. 清水冲洗以后, 晾干扫描, IPP软件对扫描图像目的条带行灰度分析.
统计学处理 采用SPSS 19.0统计软件进行数据分析, 计量资料(mean±SD)表示, 多组比较采用单因素方差分析, 组间两两比较用t检验, P<0.05差异有统计学意义.
24、48及72 h时5、10、25、50及100 mmol/L阿帕替尼组细胞吸光度均低于0 mmol/L组, 差异有统计学意义(P<0.05), 伴随阿帕替尼浓度增大, LS174T细胞受到的抑制作用逐步变强, 进一步统计分析显示, 同一浓度下不同时间点之间的吸光度差异具有统计学意义(P<0.05), 提示阿帕替尼对LS174T细胞的增殖抑制具有时间依赖性. 在5 μmol/L和10 μmol/L的临床相关浓度下, 处理72 h后细胞活性已显著降低至对照组的76.5%±6.5%和63.5%±5.9%(均P<0.05), 表明阿帕替尼在生理可达浓度下仍能有效抑制CRC细胞增殖. 详见表1.
| 不同含量组 | A值 | ||
| 24 h | 48 h | 72 h | |
| 0 mmol/L | 1.32±0.12 | 1.55±0.14f | 1.70±0.13fg |
| 1 mmol/L | 1.25±0.11 | 1.48±0.13f | 1.62 ± 0.12fg |
| 5 mmol/L | 1.01±0.10a | 1.15±0.12af | 1.30 ± 0.11afg |
| 10 mmol/L | 0.85±0.09ab | 0.95±0.11abf | 1.08 ± 0.10abfg |
| 25 mmol/L | 0.69±0.13abc | 0.84±0.16abcf | 0.95±0.10abcfg |
| 50 mmol/L | 0.56±0.10abcd | 0.70±0.15abcdf | 0.82±0.13abcdfg |
| 100 mmol/L | 0.42±0.11abcde | 0.52±0.12abcdef | 0.64±0.09abcdefg |
| F | 16.834 | 19.073 | 15.861 |
| P值 | <0.05 | <0.05 | <0.05 |
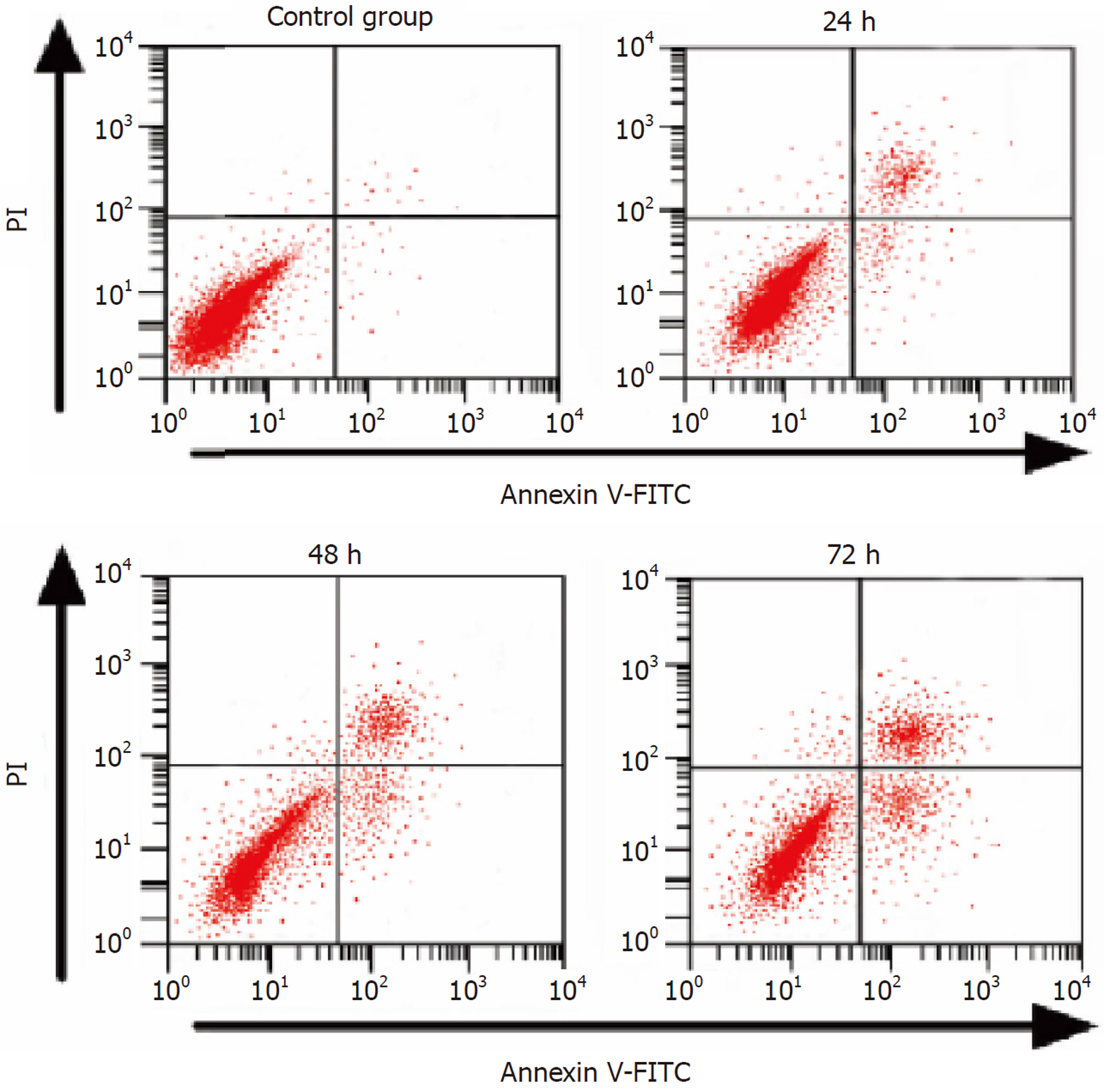
在各时间点, 所有给药组的细胞凋亡率均显著高于同期对照组(P<0.05). 在24 h, 凋亡效应随浓度增加而增强; 在48和72 h, 5-100 μmol/L各浓度组之间凋亡率无显著差异(P>0.05), 10 μmol/L阿帕替尼处理72 h诱导的凋亡率25.16%±1.58%与100 μmol/L组25.80%±1.51%无显著差异(P>0.05), 详见表2. 24、48及72 h时10 μmol/L阿帕替尼组细胞凋亡率流式细胞分析, 详见图1.
| 不同含量组 | 凋亡率(%) | ||
| 24 h | 48 h | 72 h | |
| 0 mmol/L | 6.56±1.10 | 7.25±1.15 | 7.83±1.21 |
| 1 mmol/L | 8.12±0.95a | 10.35±1.08a | 12.47±1.15a |
| 5 mmol/L | 10.28±1.12a | 14.61±1.24a | 19.83±1.43a |
| 10 mmol/L | 13.75±1.20a | 18.94±1.35a | 25.16±1.58a |
| 25 mmol/L | 11.92±1.18a | 17.85±1.32a | 24.90±1.55a |
| 50 mmol/L | 12.35±1.16a | 18.52±1.38a | 25.40±1.60a |
| 100 mmol/L | 12.59±1.18a | 18.79±1.40a | 25.80±1.51a |
和对照组相比, 10 μmol/L阿帕替尼组24、48及72 h时G2/M、S期细胞数降低, G0/G1细胞数增加, 差异有统计学意义(P<0.05), 详见表3.
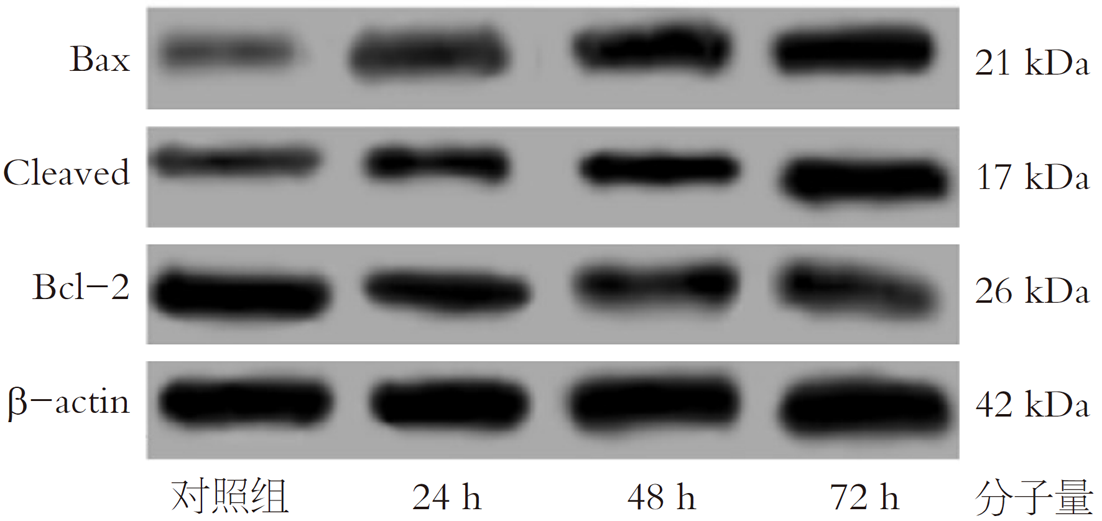
和对照组相比, 24、48及72 h时10 μmol/L阿帕替尼组细胞内Bax、Cleaved caspase-3蛋白表达升高, Bcl-2蛋白表达降低, 差异有统计学意义(P<0.05), 详见表4和图2.
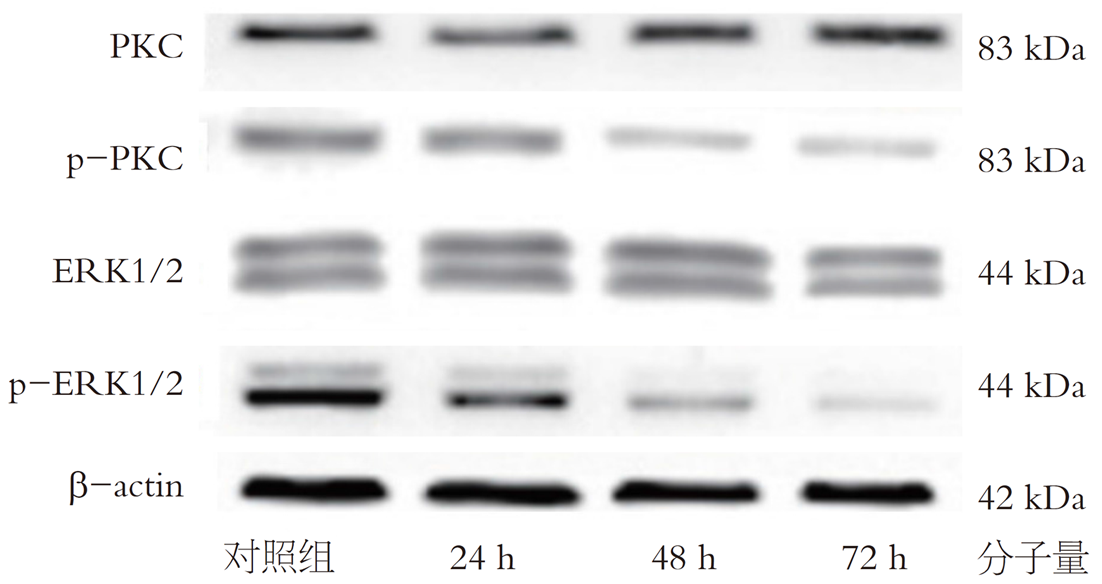
和对照组相比, 24、48及72 h时10 μmol/L阿帕替尼组细胞pERK1/2、pPLC蛋白表达降低, 差异有统计学意义(P<0.05), tERK1/2、tPLC蛋白表达无显著差异(P>0.05), 详见表5和图3.
CRC是临床常见的消化道恶性肿瘤之一, 但早期诊断仍缺乏高敏感性和特异性的生物标志物. 目前, 中晚期患者需结合手术、化疗、靶向治疗及免疫治疗等综合手段, 部分患者仍可达到长期生存[6,7]. 但传统化疗药物缺少靶向性, 在治疗过程中还会损伤到正常组织细胞, 使患者出现严重毒副影响, 同时普遍存在的耐药性也对化疗药物疗效产生了严重制约. 所以, 从分子水平上探究CRC成因和相关发展原理, 基于信号通路和肿瘤特异性靶蛋白研制靶向药物成了对研究CRC药物治疗的重点. 阿帕替尼对于CRC、白血病HL-60细胞株和胃癌有显著抑制影响[8], 同时结合化疗药物对癌细胞的抑制作用显著, 但关于其具体作用机制的研究仍相对不足. 特别是阿帕替尼通过VEGFR2下游信号通路(如PLC-ERK1/2)直接调控CRC细胞增殖与凋亡的分子机制尚未完全阐明.
细胞内关于阿帕替尼作用机制尚未完全明确, 其辅助作用靶点或者联合作用靶点也不是很明确. 阿帕替尼是新型酪氨酸激酶抑制剂, 临床Ⅰ/Ⅱ试验已经显示它对于结直肠癌有治疗效果[9], 本文研究显示, 24、48及72 h时25、50及100 mmol/L阿帕替尼组细胞吸光度均低于0 mmol/L组, 差异有统计学意义, 伴随阿帕替尼浓度增大、时间延长, LS174T细胞受到的抑制作用逐步变强, 阿帕替尼对于LS174T细胞增殖抑制呈现为时间浓度依赖性, 这和临床试验相符.
本研究采用流式细胞仪和CCK-8实验检测在体外阿帕替尼可诱导CRCLS174T细胞凋亡, 对其生长抑制影响显著, 且呈现良好的时效性. 当前对于阿帕替尼药效相关研究较多, 临床Ⅰ/Ⅱ试验显示阿帕替尼对于CRC有一定治疗效果, 临床Ⅱ/Ⅲ期试验显示它对于非小细胞肺癌、肝癌和胃肠等疗效都比较理想[10], 同时单药肿瘤移植模型显示阿帕替尼抗肿瘤活性作用比较强[11], 由此看来阿帕替尼是一种非常有潜力靶向药物. 细胞周期紊乱与细胞凋亡为发生肿瘤主要因素, 本研究经过检测细胞周期与细胞凋亡显示, 24、48及72 h时阿帕替尼组细胞凋亡率分别为12.59%±1.18%、18.79%±1.40%、25.80%±1.51%, 高于对照组细胞凋亡率6.56%±1.10%; 和对照组相比, 阿帕替尼组24、48及72 h时G2/M、S期细胞数降低, G0/G1细胞数增加, 差异有统计学意义. 肿瘤细胞细胞周期发生紊乱, 机体内细胞生长失控, 造成细胞的无限增长. 化疗药物能够把肿瘤细胞周期G0/G1阻滞, 抑制DNA合成与分裂相关蛋白质, 对肿瘤细胞的分裂抑制, 从而起到抗肿瘤影响[12,13]. 本研究发现阿帕替尼同样具有显著的抗肿瘤作用, 其机制可能是通过诱导细胞周期阻滞来实现的. VEGFR2-PLC-ERK1/2路径已经证实和细胞增殖、细胞周期调控联系紧密, ERK1/2活化后可经磷酸化将Jun癌基因(c-Jun)激活, 导致细胞增殖与DNA合成[14]. 为进一步验证, 本研究采用蛋白免疫印迹检测VEGFR2-PLC-ERK1/2通路内相关蛋白表达, 结果显示, 和对照组相比, 24、48及72 h时阿帕替尼组细胞pERK1/2、pPLC蛋白表达降低, 差异有统计学意义, 这和细胞周期受阻与细胞增殖抑制结果相符.
细胞凋亡为正常生物学现象, 在细胞内环境稳定的维持方面有重要影响, 为多种基因严格控制. 机体内和细胞凋亡相关蛋白非常多, 其中研究较多的为胱天蛋白酶(Caspase)家族与Bcl-2蛋白家族. Caspase-3为细胞凋亡中主要凋亡执行蛋白酶, Bax基因与Bcl-2基因为主要凋亡调控基因, 它们三者分别是凋亡中主要的凋亡效应因子、凋亡抑制因子与凋亡促进因子, 对于肿瘤细胞的凋亡有重要影响[15-17]. 本文研究显示, 和对照组相比, 24、48及72 h时阿帕替尼组细胞内Bax、Cleaved caspase-3蛋白表达升高, Bcl-2蛋白表达降低, 差异有统计学意义, 说明阿帕替尼可能经过下调Bcl-2蛋白表达, 上调Cleaved Caspase-3、Bax蛋白表达来加速CRC细胞的凋亡. 这一结果与胃癌中阿帕替尼诱导凋亡的报道一致[18], 提示其可能通过线粒体途径激活Caspase级联反应. 此外, 阿帕替尼选择性抑制pERK1/2而非总ERK1/2, 表明其靶向通路磷酸化而非蛋白表达. ERK1/2作为MAPK家族成员, 其磷酸化被抑制可阻断c-Jun等转录因子活化, 最终导致细胞周期停滞于G0/G1期[19]. 这一机制与本研究观察到的S期细胞减少结果相符.
既往研究多聚焦阿帕替尼在胃癌和肝癌中的抗血管生成作用[20,21], 而本研究首次在CRC中揭示其通过VEGFR2-PLC-ERK1/2通路调控凋亡的机制. Sajjan等[22]曾报道阿帕替尼抑制HT29细胞增殖, 但未涉及ERK1/2通路; 本实验进一步证实pERK1/2磷酸化下调是阿帕替尼作用的关键环节, 为其靶向治疗提供了新靶点. 本研究结果表明, 阿帕替尼能通过抑制VEGFR2-PLC-ERK1/2信号通路, 直接诱导CRC LS174T细胞发生G0/G1期阻滞与凋亡. 尽管阿帕替尼的促凋亡效应在其它肿瘤类型中已有报道[8,18], 但本研究首次在CRC模型中系统揭示了其上游信号机制源于对VEGFR2-PLC-ERK1/2通路的特异性抑制, 并明确了PLCγ在此过程中的关键介导作用. 相较于既往主要关注增殖抑制效应的研究[22], 本研究通过多时间点分析, 进一步将通路抑制与细胞周期动态变化相关联, 为理解阿帕替尼的直接抗肿瘤作用提供了新的机制深度和实验依据.
本研究的局限性在于仅使用LS174T细胞系, 未来需通过异种移植模型验证阿帕替尼的体内效果. 此外, VEGFR2下游通路复杂(如PI3K-AKT、JAK-STAT), 阿帕替尼是否协同调控其他通路仍需探索. 结合PD-1抑制剂等免疫疗法, 可能是增强疗效的新策略. 尽管本研究中高浓度阿帕替尼(25-100 μmol/L)的应用是体外研究的一种局限, 但我们在临床相关浓度(1-10 μmol/L)下同样观察到了显著的抗肿瘤效应. 这提示阿帕替尼在体内的卓越疗效可能源于其"双重打击"机制-即本研究揭示的对肿瘤细胞的直接抑制作用与其经典的抗血管生成作用的协同. 因此, 我们的发现不仅为其直接抗肿瘤效应提供了机制证据, 更深化了对临床疗效的理解, 为优化靶向治疗策略提供了新视角. 同时, 本研究为阿帕替尼通过VEGFR2-PLC-ERK1/2通路发挥作用提供了重要证据, 但直接验证pVEGFR2抑制及通路必要性的实验将是未来研究的重点, 以最终确立该因果机制.
综上所述, 阿帕替尼对LS174T细胞的增殖抑制和凋亡诱导呈时间-浓度依赖性, 这一效应与其下调VEGFR2-PLC-ERK1/2通路活性、调控凋亡相关蛋白(Bax/Bcl-2/Caspase-3)密切相关.
无法手术的中晚期结肠癌患者, 化疗综合治疗可延长生存期. 尽管近年来治疗手段的进步改善了结肠癌(colorectal cancer, CRC)患者预后, 但是患者2年复发率在60%左右, 且早期诊断尚待突破, 因此探索新型靶向治疗机制具有重要意义.
阿帕替尼经高度选择性地强效抑制VEGFR-2磷酸化和下游的PI3K-AKT-mTOR、ERK1/2-MAPK路径活化, 使信号传导抑制, 通过对生成的新生血管抑制来阻止患者体内肿瘤生长. 多项体外、体内实验显示, 阿帕替尼对胃癌、CRC、肺癌等裸小鼠移植瘤有明显抗肿瘤活性.
分析阿帕替尼通过下调VEGFR2-PLC-ERK1/2通路抑制结肠癌细胞增殖影响.
培养结肠癌LS174T细胞, 选取对数生长期细胞, 分别加入0、25、50及100 mol/L的阿帕替尼对细胞处理24、48、72 h, 检测阿帕替尼对细胞增殖影响. 在采用100 mol/L的阿帕替尼对细胞处理24、48、72 h, 检测对细胞凋亡率、细胞周期影响, Western-blot检测相关凋亡蛋白和VEGFR2-PLC-ERK1/2通路相关蛋白表达情况.
阿帕替尼浓度依赖性地抑制LS174T细胞增殖(P<0.05), 显著提升凋亡率(12.59%-25.80% vs 6.56%), 阻滞G2/M和S期并增加G0/G1期细胞. 机制上, 通过上调Bax/Cleaved caspase-3、下调Bcl-2激活凋亡通路, 同时抑制pERK1/2和pPLC表达(P<0.05), 而总蛋白水平不变.
阿帕替尼对结肠癌LS174T细胞增殖有抑制作用, 并诱导细胞凋亡, 其作用机制可能和下调VEGFR2-PLC-ERK1/2通路内关键蛋白磷酸化有联系.
本研究为阿帕替尼通过VEGFR2-PLC-ERK1/2通路发挥作用提供了重要证据, 但直接验证pVEGFR2抑制及通路必要性的实验将是未来研究的重点, 以最终确立该因果机制.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): D
E级 (差): E
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Emiloju OE, Sinicrope FA. Neoadjuvant Immune Checkpoint Inhibitor Therapy for Localized Deficient Mismatch Repair Colorectal Cancer: A Review. JAMA Oncol. 2023;9:1708-1715. [PubMed] [DOI] |
| 2. | Wang Y, Zhang L, Liu W, Yang JP, Peng HJ, Zhang JW. Apatinib enhances the antitumor effects of radiation in HeLa cell line mouse model of invasive cervical cancer. Ann Transl Med. 2022;10:459. [PubMed] [DOI] |
| 4. | Xie C, Zhou X, Liang C, Li X, Ge M, Chen Y, Yin J, Zhu J, Zhong C. Apatinib triggers autophagic and apoptotic cell death via VEGFR2/STAT3/PD-L1 and ROS/Nrf2/p62 signaling in lung cancer. J Exp Clin Cancer Res. 2021;40:266. [PubMed] [DOI] |
| 5. | Gao S, Li X, Shi W, Huo L, Liu H. Efficacy of the Low Dose Apatinib plus Chemotherapy on Advanced Gastric Carcinoma. J Oncol. 2022;2022:3009494. [PubMed] [DOI] |
| 6. | Direito R, Barbalho SM, Figueira ME, Minniti G, de Carvalho GM, de Oliveira Zanuso B, de Oliveira Dos Santos AR, de Góes Corrêa N, Rodrigues VD, de Alvares Goulart R, Guiguer EL, Araújo AC, Bosso H, Fornari Laurindo L. Medicinal Plants, Phytochemicals and Regulation of the NLRP3 Inflammasome in Inflammatory Bowel Diseases: A Comprehensive Review. Metabolites. 2023;13:728. [PubMed] [DOI] |
| 7. | Morton D, Seymour M, Magill L, Handley K, Glasbey J, Glimelius B, Palmer A, Seligmann J, Laurberg S, Murakami K, West N, Quirke P, Gray R; FOxTROT Collaborative Group. Preoperative Chemotherapy for Operable Colon Cancer: Mature Results of an International Randomized Controlled Trial. J Clin Oncol. 2023;41:1541-1552. [PubMed] [DOI] |
| 8. | Pan Q, Wang J, Jiang X, Yang E, Dong L, Gu K. Apatinib enhances chemosensitivity of acute myeloid leukemia hl60 cells to cytarabine by inducing apoptosis. J BUON. 2019;24:374-381. [PubMed] |
| 9. | Li F, Wu ST, Qu MH, Wang YX, Ma CL, Yu BH, Wang GS. Studies on isolation and structural identification of saponins from the herb Hylomecon japonica and their bioactivities. Carbohydr Res. 2021;507:108391. [PubMed] [DOI] |
| 10. | Li J, Qin S, Wen L, Wang J, Deng W, Guo W, Jia T, Jiang D, Zhang G, He Y, Ba Y, Zhong H, Wang L, Lin X, Yang J, Zhao J, Bai Y, Wu X, Gao F, Sun G, Wu Y, Ye F, Wang Q, Xie Z, Yi T, Huang Y, Yu G, Lu L, Yuan Y, Li W, Liu L, Sun Y, Sun Y, Yin L, Hou Z. Safety and efficacy of apatinib in patients with advanced gastric or gastroesophageal junction adenocarcinoma after the failure of two or more lines of chemotherapy (AHEAD): a prospective, single-arm, multicenter, phase IV study. BMC Med. 2023;21:173. [PubMed] [DOI] |
| 11. | Chen X, Xu H, Chen X, Xu T, Tian Y, Wang D, Guo F, Wang K, Jin G, Li X, Wang R, Li F, Ding Y, Tang J, Fang Y, Zhao J, Liu L, Ma L, Meng L, Hou Z, Zheng R, Liu Y, Guan N, Zhang B, Tong S, Chen S, Li X, Shu Y. First-line camrelizumab (a PD-1 inhibitor) plus apatinib (an VEGFR-2 inhibitor) and chemotherapy for advanced gastric cancer (SPACE): a phase 1 study. Signal Transduct Target Ther. 2024;9:73. [PubMed] [DOI] |
| 12. | Arcella A, Sanchez M. Natural substances to potentiate canonical glioblastoma chemotherapy. J Chemother. 2021;33:276-287. [PubMed] [DOI] |
| 13. | Lv S, Wu Z, Luo M, Zhang Y, Zhang J, Pascal LE, Wang Z, Wei Q. Integrated analysis reveals FOXA1 and Ku70/Ku80 as targets of ivermectin in prostate cancer. Cell Death Dis. 2022;13:754. [PubMed] [DOI] |
| 14. | Dai X, Lin A, Mi X, Ke Y, Zhang J, Chen X. p38 and ERK1/2-Dependent Activation of c-Jun Is Required for the Downregulation of Oxidative Stress-Induced ERα in Hypothalamic Astrocytes. Neuroendocrinology. 2023;113:756-769. [PubMed] [DOI] |
| 16. | Karthikeyan C, Amawi H, Viana AG, Sanglard L, Hussein N, Saddler M, Ashby CR, Moorthy NSHN, Trivedi P, Tiwari AK. lH-Pyrazolo[3,4-b]quinolin-3-amine derivatives inhibit growth of colon cancer cells via apoptosis and sub G1 cell cycle arrest. Bioorg Med Chem Lett. 2018;28:2244-2249. [PubMed] [DOI] |
| 17. | Chen Z, Zhang B, Gao F, Shi R. Modulation of G(2)/M cell cycle arrest and apoptosis by luteolin in human colon cancer cells and xenografts. Oncol Lett. 2018;15:1559-1565. [PubMed] [DOI] |
| 18. | Wang T, Zhang J, Cui L. Apatinib inhibits gastric carcinoma development by regulating the expression levels of IL-17 via the Bax/Bcl-2 signaling pathway. Exp Ther Med. 2021;21:654. [PubMed] [DOI] |
| 19. | Hu Y, Jing J, Shi Y, Zhang P, Dong D, Wu Y, Dong X, Li E, Fan Y. Apatinib inhibits pancreatic cancer growth, migration and invasion through the PI3K/AKT and ERK1/2/MAPK pathways. Transl Cancer Res. 2021;10:3306-3316. [PubMed] [DOI] |
| 20. | Luo Q, Dong Z, Xie W, Fu X, Lin L, Zeng Q, Chen Y, Ye G, Chen M, Hu H, Wang L, Xie Y, Cai W. Apatinib remodels the immunosuppressive tumor ecosystem of gastric cancer enhancing anti-PD-1 immunotherapy. Cell Rep. 2023;42:112437. [PubMed] [DOI] |
| 21. | Zhang TQ, Geng ZJ, Zuo MX, Li JB, Huang JH, Huang ZL, Wu PH, Gu YK. Camrelizumab (a PD-1 inhibitor) plus apatinib (an VEGFR-2 inhibitor) and hepatic artery infusion chemotherapy for hepatocellular carcinoma in Barcelona Clinic Liver Cancer stage C (TRIPLET): a phase II study. Signal Transduct Target Ther. 2023;8:413. [PubMed] [DOI] |
| 22. | Sajjan VP, Anigol LB, Gurubasavaraj PM, Patil D, Patil PS, Gummagol NB, Quah CK, Wong QA, Celik I. New2-((2-(2,4-dinitrophenyl)hydrazineeylidene) derivatives: design, synthesis, in silico, and in vitro anticancer studies. J Biomol Struct Dyn. 2023;41:11681-11699. [PubMed] [DOI] |