修回日期: 2025-08-25
接受日期: 2025-09-17
在线出版日期: 2025-09-28
慢性乙型肝炎(chronic hepatitis B, CHB)肝硬化常合并心脏电生理异常及全身炎症反应. 本研究假设患者心电图改变与血清白介素-33(interleukin-33, IL-33)水平相关, 且二者联合对肝硬化心肌病具有预测价值.
探讨CHB肝硬化患者12导联心电图变化与血清IL-33的相关性, 并分析二者对患者预后的预测价值.
选取2022-04/2024-03金华市人民医院医院收治的CHB患者、CHB肝硬化患者各110例, 分别纳入CHB组、肝硬化组, 均进行12导联心电图及血清IL-33检测, 比较两组12导联心电图特征及血清IL-33, 比较肝硬化组不同Child-Pugh分级左心室肥大、Q-Tc间期及血清IL-33, 比较肝硬化组左心室肥大、Q-Tc间期延长不同状态血清IL-33并进行相关性分析; 随访12个月根据是否并发肝硬化心肌病分为预后不良组、预后良好组, 比较不同预后肝硬化患者左心室肥大、Q-Tc间期及血清IL-33, 分析左心室肥大、Q-Tc间期延长及血清IL-33对预后的预测价值.
肝硬化组左心室肥大发生率、Q-Tc间期、血清IL-33水平高于CHB组(P<0.05); 不同Child-Pugh分级左心室肥大、Q-Tc间期及血清IL-33比较差异均有统计学意义(P<0.05); 肝硬化组中左心室肥大患者血清IL-33水平高于非左心室肥大患者, Q-Tc间期延长患者血清IL-33水平高于非Q-Tc间期延长患者(P<0.05); 左心室肥大、Q-Tc间期延长与血清IL-33均呈正相关(P<0.05); 随访12 mo, 失访7例, 其余患者中28例发生肝硬化心肌病者纳入预后不良组, 75例未发生肝硬化心肌病者纳入预后良好组, 预后不良组左心室肥大、Q-Tc间期延长发生率高于预后良好组, 血清IL-33水平高于预后良好组(P<0.05); 左心室肥大、Q-Tc间期及血清IL-33联合预测患者预后不良的受试者工作特征曲线及曲线下面积(area under the curve, AUC)为0.924(95%CI: 0.855-0.967), 高于三者单独预测的AUC(Z = 4.370、0.021、0.023, P<0.05).
CHB肝硬化患者存在左心室肥大、Q-Tc间期延长等心电改变, 且血清IL-33明显升高, 左心室肥大、Q-Tc间期延长与血清IL-33联合检测对患者预后有较高预测效能.
核心提要: 本研究发现慢性乙型肝炎肝硬化患者存在左心室肥大及Q-Tc间期延长等心电异常, 且与血清白介素-33水平呈正相关. 三者联合对肝硬化心肌病的发生具有较高的预测价值, 为早期预警提供了新思路.
引文著录: 龚城妙, 施晓英, 滕瑾, 薛芳. 慢性乙型肝炎肝硬化患者12导联心电图变化与血清IL-33的相关性及预后预测价值. 世界华人消化杂志 2025; 33(9): 725-733
Revised: August 25, 2025
Accepted: September 17, 2025
Published online: September 28, 2025
Chronic hepatitis B (CHB) cirrhosis is often associated with cardiac electrophysiological abnormalities and systemic inflammatory response. We hypothesized that electrocardiogram changes are related to serum interleukin-33 (IL-33) levels, and the combination of the two has predictive value for cirrhotic cardiomyopathy.
To investigate the correlation between changes in 12-lead electrocardiogram and serum IL-33 in patients with CHB cirrhosis, and to analyze the predictive value of both for patient prognosis.
A total of 110 patients with CHB and 110 patients with CHB-related cirrhosis admitted to Jinhua People's Hospital from April 2022 to March 2024 were selected and included in the CHB group and cirrhosis group, respectively. Both groups underwent 12-lead electrocardiogram and serum IL-33 testing. The characteristics of 12-lead electrocardiograms and serum IL-33 levels were compared between the two groups. Left ventricular hypertrophy, Q-Tc interval, and serum IL-33 levels were compared among different Child-Pugh classifications in the cirrhosis group. Serum IL-33 levels were also compared in different states of left ventricular hypertrophy and prolonged Q-Tc interval in the cirrhosis group, and correlation analysis was conducted. After a 12-month follow-up, patients were divided into a poor prognosis group and a good prognosis group based on whether they developed cirrhotic cardiomyopathy. Left ventricular hypertrophy, Q-Tc interval, and serum IL-33 levels were compared between patients with different prognoses. The predictive value of left ventricular hypertro-phy, prolonged Q-Tc interval, and serum IL-33 for prognosis was analyzed.
The incidences of left ventricular hypertrophy, Q-Tc interval, and serum IL-33 levels were higher in the cirrhosis group than in the CHB group (P < 0.05). There were statistically significant differences in left ventricular hypertrophy, Q-Tc interval, and serum IL-33 levels among different Child-Pugh classifications (P < 0.05). In the cirrhosis group, patients with left ventricular hypertrophy had higher serum IL-33 levels than those without, and patients with prolonged Q-Tc interval had higher serum IL-33 levels than those without (P < 0.05). Left ventricular hypertrophy and prolonged Q-Tc interval were positively correlated with serum IL-33 levels (P < 0.05). After a 12-month follow-up, 7 patients were lost to follow-up. Among the remaining patients, 28 with cirrhotic cardiomyopathy were included in the poor prognosis group, and 75 without cirrhotic cardiomyopathy were included in the good prognosis group. The incidence of left ventricular hypertrophy and prolonged Q-Tc interval was higher in the poor prognosis group than in the good prognosis group, and serum IL-33 level was higher in the poor prognosis group than in the good prognosis group (P < 0.05). The area under the curve (AUC) of the combination of left ventricular hypertrophy, Q-Tc interval, and serum IL-33 for predicting poor patient prognosis was 0.924 (95% confidence interval: 0.855-0.967), which was higher than the AUCs for each individual predictor (Z = 4.370, 0.021, and 0.023, respectively, P < 0.05).
Patients with CHB-related cirrhosis exhibit electrocardiographic changes such as left ventricular hypertrophy and prolonged Q-Tc interval, accompanied by significantly elevated serum levels of IL-33. The combined detection of left ventricular hypertrophy, prolonged Q-Tc interval, and serum IL-33 levels has high predictive efficacy for patient prognosis.
- Citation: Gong CM, Shi XY, Teng J, Xue F. Correlation between changes in 12-lead electrocardiogram and serum IL-33 in patients with chronic hepatitis B-related cirrhosis and their predictive value for prognosis. Shijie Huaren Xiaohua Zazhi 2025; 33(9): 725-733
- URL: https://www.wjgnet.com/1009-3079/full/v33/i9/725.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i9.725
慢性乙型肝炎(chronic hepatitis B, CHB)肝硬化是一种进行性、弥漫性肝损害, 最终可导致肝功能失代偿及多系统并发症[1]. CHB肝硬化患者除典型的腹水、门脉高压外, 还常合并心血管系统损害, 已有研究表明[2-4], 肝硬化因代谢紊乱、门脉高压及全身炎症状态等, 易发生变时性功能不全、QT间期延长等心脏电生理异常, 严重者可导致肝硬化心肌病且心脏电生理也易发生异常改变. 肝硬化心肌病发生较隐匿, 可引发心脏收缩/舒张功能障碍、心脏电生理异常等[5]. 12导联心电图是非入侵性评估心脏电活动、心脏功能的常用检查方法, CHB肝硬化患者心脏血流动力学、心脏电生理异常在心电图上可有相应表现[6]. CHB肝硬化的发生发展涉及多种细胞因子、趋化因子等分子调控. 白介素-33(interleukin-33, IL-33)属促炎性细胞因子, 在过敏、免疫性疾病等病理改变中异常表达[7,8]. IL-33在炎症时期可激活、驱动机体免疫反应, 可能参与CHB肝硬化患者肝纤维化及心脏损害的病理过程. 目前临床尚缺少关于CHB肝硬化患者心电异常变化与血清学促炎因子的相关性. 本研究旨在探讨CHB肝硬化患者12导联心电图特征与血清IL-33的关联性, 并评估二者在肝硬化心肌病预测中的临床作用, 为CHB肝硬化患者心血管并发症早期预警和干预提供理论依据. 现报道如下.
选取2022-04/2024-03金华市人民医院收治的CHB患者、CHB肝硬化患者各110例, 分别纳入CHB组、肝硬化组. 其中CHB组男69例, 女41例; 年龄(47-67)岁, 平均(56.82±4.75)岁; 血钾浓度平均(3.97±0.42) mmol/L; 血钙浓度平均(2.02±0.24) mmol/L. 肝硬化组男72例, 女38例; 年龄(48-66)岁, 平均(57.13±4.32)岁; 血钾浓度平均(3.91±0.46) mmol/L; 血钙浓度平均(1.96±0.23) mmol/L. 两组基线资料均衡可比(P>0.05).
(1)纳入标准: CHB符合《慢性乙型肝炎防治指南(2019年版)》[9]诊断标准; 肝硬化符合《肝硬化诊治指南》[10]诊断; 接受12导联心电图检查; 近3个月未服用可引起心电改变的药物(钙通道阻滞剂、β-受体阻滞剂等); (2)排除标准: 存在除CHB外其他肝炎病毒感染; 伴有冠状动脉粥样硬化性心脏病、严重心律失常及其他类型心肌病(扩张性心肌病、肥厚性心肌病、高血压性心肌病等); 伴有肝胆系统恶性肿瘤; 存在脂肪肝、自身免疫性肝病等; 有肝移植手术史; 精神异常. 本研究经医院伦理委员会审批通过, 患者及其家属知情并同意.
1.2.1 12导联心电图检测: 由两名高年资(工作经验10年以上)心电诊科医生使用12导联心电图机(日本光电公司, 型号: 1550P和1350P)测量和记录, 取平卧位, 全身放松, 暴露手腕、脚踝及胸部, 75%酒精棉球擦拭电极接触部位, 同步12导联记录, 采样频率≥500 Hz, 至少记录10 s稳定波形. 心电图检测结果由两名医生进行单独阅片分析, 讨论得出统一结果. 记录心率、QRS波群、舒张压、收缩压、左心室肥大、左心房肥大、Q-T间期、Q-Tc间期、P-R间期、V1导联S波深度、S波加R波振幅、V5导联R波振幅等特征参数.
1.2.2 血清IL-33检测: 采集受试者5 mL清晨外周静脉血, 加入抗凝剂的试管内静置0.5 h, 离心(3000 r/min, 15 min)分离血清, 采用全自动酶标仪(美国BIO-RAD伯乐-550型), 以酶联免疫吸附法检测血清IL-33.
1.2.3 预后评估: 随访12 mo, 根据是否发生肝硬化心肌病进行预后评估, 诊断标准: 排除其他原因的心脏疾病(缺血性心脏病、原发性心肌病、心脏瓣膜病、原发性高血压性心脏病、先天性心脏病等), 存在心脏收缩/舒张功能障碍, 收缩功能障碍(至少符合以下任1项): (1)左室射血分数降低(≤50%); (2)整体纵向应变绝对值下降<18%. 舒张功能障碍(至少符合以下任3项): (1)间隔e'<7 cm/s; (2)E/e'比值>15; (3)三尖瓣反流最大流速>2.8 m/s; (4)左心房容积指数>34 mL/m2, 将发生肝硬化心肌病者纳入预后不良组, 未发生肝硬化心肌病者纳入预后良好组.
(1)比较两组12导联心电图特征及血清IL-33; (2)比较肝硬化组不同Child-Pugh分级左心室肥大、Q-Tc间期及血清IL-33; 肝功能Child-Pugh分级标准: 评估一般状况、血清白蛋白、凝血酶时间、血清胆红素、腹水5个指标, 均计分1-3分, 总分5-15分, "评分5-6分、7-9分、10-15分"分别对应"A级、B级、C级", 分级越高说明肝储备功能越差; (3)比较肝硬化组左心室肥大、Q-Tc间期延长不同状态血清IL-33; Q-Tc间期延长判定: 心率校正后的QT间期超过正常范围, 男性>450 ms, 女性>460 ms即可判定. 左心室肥大判定: 采用Romhilt-Estes评分系统综合评估, Romhilt-Estes评分≥5分诊断为左心室肥大; (4)分析左心室肥大、Q-Tc间期延长与血清IL-33的相关性; (5)比较不同预后肝硬化患者左心室肥大、Q-Tc间期及血清IL-33; (6)分析左心室肥大、Q-Tc间期及血清IL-33对预后的预测价值.
统计学处理 采用SPSS 27.0对数据进行分析, 计量资料以(mean±SD)表示, 多组间比较以单因素方差进行分析, 组间两两对比采用LSD-t检验, 两组间比较采用独立样本t检验, 计数资料以n(%)表示, 差异行χ2检验, 以Spearman相关系数法进行相关性分析, 采用受试者工作特征(receiver operating characteristic, ROC)曲线进行预后预测分析, 曲线下面积(area under the curve, AUC)对比应用DeLong检验, 均采用双侧检验, 检验水准α = 0.05.
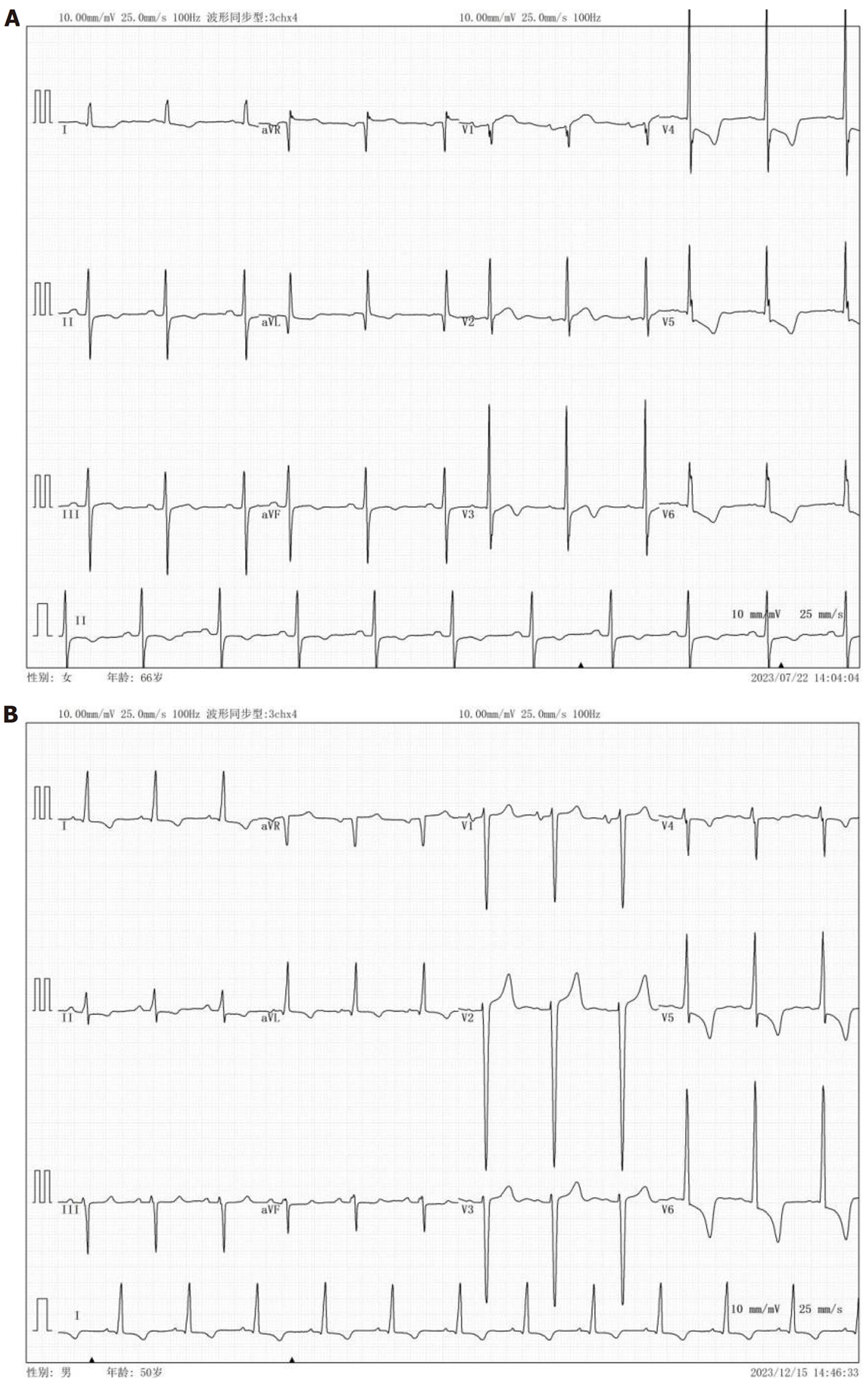
肝硬化组左心室肥大发生率、Q-Tc间期、血清IL-33水平高于CHB组(P<0.05), 见表1. 肝硬化患者左心室肥大、Q-Tc间期延长典型心电图见图1.
| 指标 | 肝硬化组(110例) | CHB组(110例) | χ2/t | P值 |
| 心率(次/min) | 74.52±11.28 | 72.43±9.91 | 1.460 | 0.146 |
| QRS(ms) | 95.48±13.34 | 96.04±8.12 | 0.376 | 0.707 |
| 舒张压(mmHg) | 76.85±11.05 | 79.26±8.77 | 1.792 | 0.075 |
| 收缩压(mmHg) | 125.79±16.38 | 128.95±10.76 | 1.691 | 0.092 |
| 左心室肥大 | 23(20.91) | 6(5.45) | 11.479 | 0.001 |
| 左心房肥大 | 6(5.45) | 3(2.73) | 0.463 | 0.496 |
| Q-T间期(ms) | 402.47±46.13 | 393.96±43.84 | 1.402 | 0.162 |
| Q-Tc间期(ms) | 463.68±42.07 | 416.79±22.38 | 10.320 | 0.000 |
| P-R间期(ms) | 162.32±27.22 | 158.46±24.34 | 1.109 | 0.269 |
| SV1(mV) | 0.77±0.15 | 0.80±0.19 | 1.300 | 0.195 |
| R+S(mV) | 2.09±0.62 | 2.23±0.64 | 1.648 | 0.101 |
| RV5(mV) | 1.42±0.39 | 1.50±0.44 | 1.427 | 0.155 |
| 血清IL-33(pg/mL) | 97.88±18.57 | 32.76±6.63 | 34.638 | <0.001 |
不同Child-Pugh分级左心室肥大、Q-Tc间期及血清IL-33比较差异均有统计学意义(P<0.05), 见表2.
肝硬化组中左心室肥大患者血清IL-33水平高于非左心室肥大患者, Q-Tc间期延长患者血清IL-33水平高于非Q-Tc间期延长患者(P<0.05), 见表3.
| 项目 | 血清IL-33(pg/mL) | t | P值 | |
| 左心室肥大 | 是(23例) | 149.36±33.94 | 13.039 | <0.001 |
| 否(87例) | 84.27±16.57 | |||
| Q-Tc间期延长 | 是(47例) | 136.82±25.03 | 19.421 | <0.001 |
| 否(63例) | 68.83±10.48 |
以Spearman相关系数法分析, 左心室肥大(是 = 1, 否 = 0)、Q-Tc间期延长(是 = 1, 否 = 0)与血清IL-33均呈正相关(rs = 0.685、0.703, P<0.05).
随访12 mo, 因联系方式或住址变更等原因失访7例, 其余患者中28例发生肝硬化心肌病者纳入预后不良组, 75例未发生肝硬化心肌病者纳入预后良好组. 预后不良组左心室肥大、Q-Tc间期延长发生率高于预后良好组, 血清IL-33水平高于预后良好组(P<0.05), 见表4.
| 组别 | 例数 | 左心室肥大[n(%)] | Q-Tc间期(ms) | 血清IL-33(pg/mL) |
| 预后不良组 | 28 | 13(46.43) | 492.88±77.62 | 161.37±27.04 |
| 预后良好组 | 75 | 8(10.67) | 452.78±72.29 | 76.20±15.41 |
| χ2/t | 16.064 | 2.455 | 20.008 | |
| P值 | <0.001 | 0.016 | <0.001 |
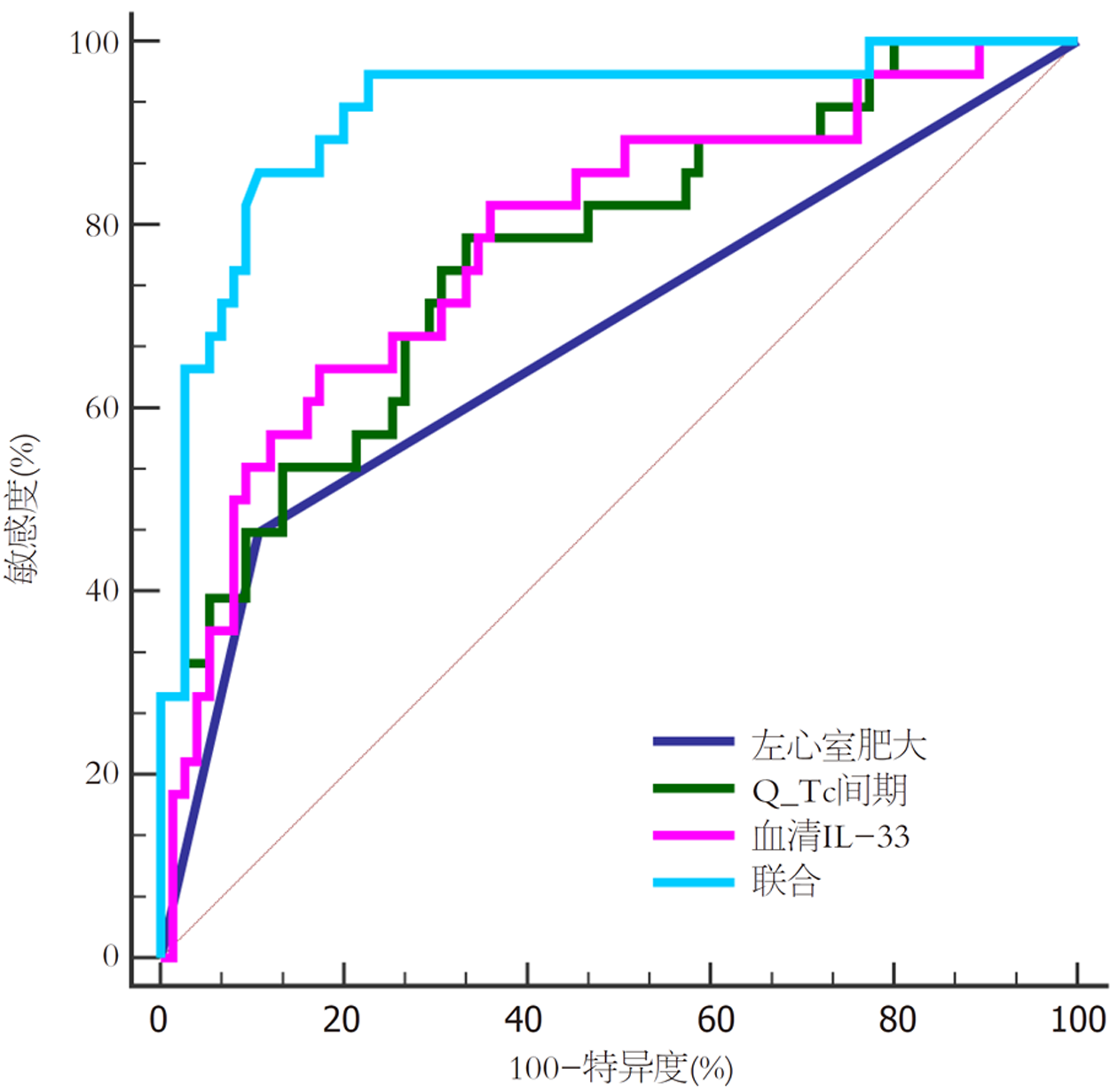
以预后不良组为阳性样本, 预后良好组为阴性样本, 以左心室肥大、Q-Tc间期及血清IL-33为检验变量绘制ROC曲线, 结果显示, 左心室肥大、Q-Tc间期及血清IL-33联合预测患者预后不良的AUC为0.924(95%CI: 0.855-0.967), 高于三者单独预测的AUC(Z = 4.370、0.021、0.023, P<0.05). 见表5和图2.
| 指标 | AUC | 95%CI | Z统计 | 截断值 | 敏感度(%) | 特异度(%) | P值 |
| 左心室肥大 | 0.679 | 0.580-0.767 | 3.490 | 是 | 46.43 | 89.33 | <0.001 |
| Q-Tc间期 | 0.770 | 0.677-0.847 | 4.996 | 396.11 ms | 78.57 | 66.67 | <0.001 |
| 血清IL-33 | 0.781 | 0.689-0.857 | 5.244 | 154.92 pg/mL | 64.29 | 82.67 | <0.001 |
| 联合 | 0.924 | 0.855-0.967 | 13.170 | - | 85.71 | 89.33 | <0.001 |
CHB肝硬化是消化内科常见的慢性肝病. CHB发生后存在进行性肝细胞坏死、肝星状细胞生成, 可引发肝内结缔组织增生, 细胞外基质"合成-降解"失衡, 从而引发肝脏纤维化、再生结节形成, 导致肝硬化及肝功能失代偿[11,12]. 临床研究表示[13], 肝硬化患者存在弥漫性肝损伤, 且常伴有血流动力学、心肌电生理异常改变, 导致心肌损害, 可存在多种心电图检测异常现象. 肝硬化心肌病是肝硬化严重并发症之一, 是肝硬化引起的慢性心功能障碍性疾病, 由于该病的潜在性, 在无应激因素作用时临床表现较为隐匿性, 无明显心功能不全症状, 常常不为临床重视, 但其可在无其他已知心脏病的情况下出现心肌的收缩/舒张功能障碍及电生理功能异常, 从而影响患者预后.
尽管肝硬化引起的心肌病变在心电图上的表现存在非特异性, 但12导联心电图仍可对病情进行快速评估, 同时结合其他辅助检查可提高对CHB肝硬化心肌病的诊断效能[14]. 有文献证实[15,16], 肝硬化患者中存在心功能的损伤. 本研究显示, 肝硬化组左心室肥大发生率、Q-Tc间期高于CHB组, 提示CHB肝硬化患者心血管系统受累. 原因可能在于: CHB肝硬化患者内脏血管扩张、门脉高压可降低血管阻力, 心输出量代偿性增加, 长时间高动力循环导致心脏负荷增加, 促进心肌肥厚; 另外腹水、水钠潴留等症状可导致左心室血容量增加, 表现为左心室肥大[17,18]. Q-Tc间期是反映心脏去极化和复极作用的重要参数, Q-Tc间期延长表示心脏复极延迟, 其发生机理可能为肝硬化伴发低钾血症、低镁血症导致电解质异常, 延迟心肌复极; 肝硬化腹水引起膈肌抬高, 心外膜受到一定程度的压迫而影响到心肌细胞除极、复极, 加之利尿剂、抗生素等药物因素, 心电图表现为肢体导联低电压、Q-Tc间期延长等[19-21]. 本研究显示, 预后不良组左心室肥大、Q-Tc间期延长发生率高于预后良好组. 预后不良的CHB肝硬化患者存在代偿、高动力循环等生理病理改变, 易造成心脏损害、心肌病, 导致心电图异常. Child-Pugh分级是综合评价肝功能的公认指标, 本研究显示, Child-Pugh分级越高, 左心室肥大、Q-Tc间期延长发生率越高, 提示CHB肝硬化患者心电图异常与肝功能受损程度有一定联系. 但本研究Child-Pugh B、C级样本量较少, 小样本亚组可能影响统计学效力. 廖廷姝等[22]研究显示, 心电图异常率与肝功能Child-Pugh分级呈正相关, 鲁慧先等[23]研究表明, 不同Child-Pugh分级CHB肝硬化患者Q-Tc间期水平比较差异明显, 与本研究相似.
肝脏炎症及其所致的肝纤维化是CHB肝硬化发生、进展的主要病理学基础[24]. IL-33是IL-1超家族成员, 可与生长刺激表达基因2结合激活下游信号通路, 调节炎症反应, 在传染性疾病、自身免疫性疾病等中扮演重要角色[25,26]. 本研究结果显示, 肝硬化组血清IL-33水平高于CHB组, 不同Child-Pugh分级血清IL-33比较差异显著. 分析其机制可能为: CHB发生后IL-33被激活释放到细胞外, 与肝细胞表面受体结合, 通过激活肝内免疫细胞、肝星状细胞等, 诱导肝脏中其他细胞产生IL-6、IL-8等多种炎症介质[27]. 肝细胞炎症引起Th1/Th2失衡, 促进炎症反应与肝纤维化, 进一步加重CHB肝硬化的病理改变. 此外, IL-33可介导M0巨噬细胞转化为M2巨噬细胞, 而M2巨噬细胞的大量生成可促进成纤维细胞分化, 促使胶原细胞外基质生成并沉积于肝内, 导致肝硬化发生与进展[28]. 此外, 本研究显示预后不良组血清IL-33水平高于预后良好组, 其在肝硬化心肌病的发生中可能存在潜在的心脏作用机制, 经分析, 一方面外周循环中IL-33升高可能激活IL-33/ST2信号通路, 刺激心脏成纤维细胞增殖, 促心脏纤维化, 另一方面IL-33可放大全身炎症状态, 间接造成心肌细胞氧化应激损伤, 心肌细胞收缩功能障碍, 削弱心脏应激代偿能力, 促进肝硬化心肌病变[29].
本研究ROC曲线显示, 左心室肥大、Q-Tc间期及血清IL-33联合预测患者预后不良的AUC为0.924(95%CI: 0.855-0.967), 高于三者单独预测的AUC. CHB肝硬化患者的左心室肥大、Q-Tc间期延长可反映高动力循环与潜在心肌病变, 血清IL-33可反映炎症反应与肝纤维化, 联合检测对预测患者肝硬化心肌病具有重要作用. 临床应重视CHB肝硬化患者的心功能改变, 对肝硬化患者定期进行心电图检查, 监测血清IL-33表达水平, 有利于临床对肝硬化心肌病高风险患者进行早期干预治疗、改善患者预后. 尽管本研究揭示了心电图异常表现与血清IL-33在CHB肝硬化中的联合预测价值, 但所聚焦的心电图指标相对局限, 未能全面覆盖肝硬化心肌病的所有电生理表现. 肝硬化及高动力循环状态对心脏的影响是多方面的, 除左心室肥大、Q-Tc间期延长外, 还可伴有ST-T段改变、心率变异性、异常心搏等其他心电图异常; 未来还需系统性纳入更为综合的指标, 以期更全面地构建肝硬化心肌病的风险预测模型.
综上所述, CHB肝硬化患者存在心电图异常表现, 血清IL-33异常升高, 联合左心室肥大、Q-Tc间期延长与血清IL-33预测肝硬化心肌病的效能较高, 对CHB肝硬化患者预后有较高预测价值. 但本研究为单中心研究, 样本量较少、病例可能存在选择偏倚, 且预后随访时间有限, 随访12 mo可能不足以全面评估患者长期预后, 未来有待临床多中心扩大样本来源、长随访时间, 进一步研究证实.
慢性乙型肝炎(chronic hepatitis B, CHB)肝硬化常合并心脏电生理异常及全身炎症反应. 本研究假设患者心电图改变与血清白介素-33(interleukin-33, IL-33)水平相关, 且二者联合对肝硬化心肌病具有预测价值.
CHB肝硬化的发生发展涉及多种细胞因子、趋化因子等分子调控. IL-33属促炎性细胞因子, 在过敏、免疫性疾病等病理改变中异常表达. IL-33在炎症时期可激活、驱动机体免疫反应, 可能参与CHB肝硬化患者肝纤维化及心脏损害的病理过程. 目前临床尚缺少关于CHB肝硬化患者心电异常变化与血清学促炎因子的相关性.
探讨CHB肝硬化患者12导联心电图变化与血清IL-33的相关性, 并分析二者对患者预后的预测价值.
选取CHB患者、CHB肝硬化患者各110例, 分别纳入CHB组、肝硬化组, 均进行12导联心电图及血清IL-33检测, 比较两组12导联心电图特征及血清IL-33, 比较肝硬化组不同Child-Pugh分级左心室肥大、Q-Tc间期及血清IL-33, 比较肝硬化组左心室肥大、Q-Tc间期延长不同状态血清IL-33并进行相关性分析; 随访12个月根据是否并发肝硬化心肌病分为预后不良组、预后良好组, 比较不同预后肝硬化患者左心室肥大、Q-Tc间期及血清IL-33, 分析左心室肥大、Q-Tc间期延长及血清IL-33对预后的预测价值.
肝硬化组左心室肥大发生率、Q-Tc间期、血清IL-33水平高于CHB组(P<0.05); 不同Child-Pugh分级左心室肥大、Q-Tc间期及血清IL-33比较差异均有统计学意义(P<0.05); 肝硬化组中左心室肥大患者血清IL-33水平高于非左心室肥大患者, Q-Tc间期延长患者血清IL-33水平高于非Q-Tc间期延长患者(P<0.05); 左心室肥大、Q-Tc间期延长与血清IL-33均呈正相关(P<0.05); 随访12 mo, 失访7例, 其余患者中28例发生肝硬化心肌病者纳入预后不良组, 75例未发生肝硬化心肌病者纳入预后良好组, 预后不良组左心室肥大、Q-Tc间期延长发生率高于预后良好组, 血清IL-33水平高于预后良好组(P<0.05); 左心室肥大、Q-Tc间期及血清IL-33联合预测患者预后不良的受试者工作特征曲线及曲线下面积(area under the curve, AUC)为0.924(95%CI: 0.855-0.967), 高于三者单独预测的AUC(Z = 4.370、0.021、0.023, P<0.05).
CHB肝硬化患者存在左心室肥大、Q-Tc间期延长等心电改变, 且血清IL-33明显升高, 左心室肥大、Q-Tc间期延长与血清IL-33联合检测对患者预后有较高预测效能.
研究为单中心研究, 样本量较少、病例可能存在选择偏倚, 且预后随访时间有限, 随访12 mo可能不足以全面评估患者长期预后, 未来有待临床多中心扩大样本来源、长随访时间, 进一步研究证实.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B, B
C级 (良好): C, C, C
D级 (一般): D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Liao MJ, Li J, Dang W, Chen DB, Qin WY, Chen P, Zhao BG, Ren LY, Xu TF, Chen HS, Liao WJ. Novel index for the prediction of significant liver fibrosis and cirrhosis in chronic hepatitis B patients in China. World J Gastroenterol. 2022;28:3503-3513. [PubMed] [DOI] |
| 2. | Ahn JC, Attia ZI, Rattan P, Mullan AF, Buryska S, Allen AM, Kamath PS, Friedman PA, Shah VH, Noseworthy PA, Simonetto DA. Development of the AI-Cirrhosis-ECG Score: An Electrocardiogram-Based Deep Learning Model in Cirrhosis. Am J Gastroenterol. 2022;117:424-432. [PubMed] [DOI] |
| 4. | Lee W, Vandenberk B, Raj SR, Lee SS. Prolonged QT Interval in Cirrhosis: Twisting Time? Gut Liver. 2022;16:849-860. [PubMed] [DOI] |
| 6. | 王 风雷, 雷 飞飞, 杜 卫星, 李 刚, 李 儒贵, 李 芳, 李 金科, 谭 华炳. 肝炎后肝硬化患者心电图改变与Child-Pugh分级及预后的相关性. 中国药物与临床. 2013;13:196-197. |
| 7. | Borgia F, Custurone P, Li Pomi F, Vaccaro M, Alessandrello C, Gangemi S. IL-33 and IL-37: A Possible Axis in Skin and Allergic Diseases. Int J Mol Sci. 2022;24:372. [PubMed] [DOI] |
| 11. | Ou M, Tian Y, Zhuang G, Peng Y. QTc interval prolongation in liver cirrhosis with upper gastrointestinal bleeding. Med Clin (Barc). 2021;156:68-75. [PubMed] [DOI] |
| 12. | Rui F, Xu L, Yeo YH, Xu Y, Ni W, Tan Y, Zheng Q, Tian X, Zeng QL, He Z, Qiu Y, Zhu C, Ding W, Wang J, Huang R, Xue Q, Wang X, Chen Y, Fan J, Fan Z, Ogawa E, Kwak MS, Qi X, Shi J, Wong VW, Wu C, Li J. Machine Learning-Based Models for Advanced Fibrosis and Cirrhosis Diagnosis in Chronic Hepatitis B Patients With Hepatic Steatosis. Clin Gastroenterol Hepatol. 2024;22:2250-2260.e12. [PubMed] [DOI] |
| 13. | Lupu D, Stănescu C, Nedelcu DL, Stoica GA, Botezat MM, Lupu AŞ. Electrophysiological parameters in patients with hepatic cirrhosis. Rom J Morphol Embryol. 2024;65:687-692. [PubMed] [DOI] |
| 14. | Ndakotsu A, Nduka TC, Agrawal S, Asuka E. Cirrhotic cardiomyopathy: comprehensive insights into pathophysiology, diagnosis, and management. Heart Fail Rev. 2025;30:739-748. [PubMed] [DOI] |
| 15. | Kaur H, Premkumar M. Diagnosis and Management of Cirrhotic Cardiomyopathy. J Clin Exp Hepatol. 2022;12:186-199. [PubMed] [DOI] |
| 17. | Gossios T, Savvatis K, Zegkos T, Ntelios D, Rouskas P, Parcharidou D, Karvounis H, Efthimiadis GK. Deciphering hypertrophic cardiomyopathy with electrocardiography. Heart Fail Rev. 2022;27:1313-1323. [PubMed] [DOI] |
| 18. | Gregolin CS, do Nascimento M, Borges de Souza SL, Ferreira Mota GA, Bomfim GF, de Azevedo Melo Luvizotto R, Sugizaki MM, Zanati Bazan SG, Salomé de Campos DH, Dias MC, Correa CR, Cicogna AC, Ferreira do Nascimento A. Myocardial Dysfunction in Cirrhotic Cardiomyopathy is Associated with Alterations of Phospholamban Phosphorylation and IL-6 Levels. Arch Med Res. 2021;52:284-293. [PubMed] [DOI] |
| 19. | Barutcu S, Inanc I, Sabanoglu C, Polat E. Predictive value of Tp-e interval, Tp-e/QT, and Tp-e/QTc for disease severity in patients with liver cirrhosis. Eur Rev Med Pharmacol Sci. 2023;27:1110-1120. [PubMed] [DOI] |
| 20. | Koshy AN, Gow PJ, Testro A, Teh AW, Ko J, Lim HS, Han HC, Weinberg L, VanWagner LB, Farouque O. Relationship between QT interval prolongation and structural abnormalities in cirrhotic cardiomyopathy: A change in the current paradigm. Am J Transplant. 2021;21:2240-2245. [PubMed] [DOI] |
| 21. | Bhardwaj A, Joshi S, Sharma R, Bhardwaj S, Agrawal R, Gupta N. QTc prolongation in patients of cirrhosis and its relation with disease severity: An observational study from a rural teaching hospital. J Family Med Prim Care. 2020;9:3020-3024. [PubMed] [DOI] |
| 24. | 梁 甜, 周 琳, 周 晓玲. NLRP3炎症小体介导的肝纤维化炎症反应及激活机制研究进展. 临床与实验病理学杂志. 2024;40:636-639. [DOI] |
| 25. | Song J, Dai J, Chen X, Ding F, Ding Y, Ma L, Zhang L. Bifidobacterium mitigates autoimmune hepatitis by regulating IL-33-induced Treg/Th17 imbalance via the TLR2/4 signaling pathway. Histol Histopathol. 2024;39:623-632. [PubMed] [DOI] |
| 26. | Askoura M, Abbas HA, Al Sadoun H, Abdulaal WH, Abu Lila AS, Almansour K, Alshammari F, Khafagy ES, Ibrahim TS, Hegazy WAH. Elevated Levels of IL-33, IL-17 and IL-25 Indicate the Progression from Chronicity to Hepatocellular Carcinoma in Hepatitis C Virus Patients. Pathogens. 2022;11:57. [PubMed] [DOI] |
| 27. | 强 锐, 徐 俊驰, 朱 莉, 朱 传武, 陈 洁, 刘 轩妙, 胥 萍. 血清sST2和IL-33在乙肝相关慢加急性肝衰竭患者中的测定及其临床价值的探讨. 标记免疫分析与临床. 2022;29:2000-2005. |
| 29. | 张 文婧, 郭 文玲. IL-33/ST2通路在心血管疾病中作用及机制的研究进展. 中西医结合心脑血管病杂志. 2022;20:3724-3726. |