修回日期: 2025-06-04
接受日期: 2025-07-17
在线出版日期: 2025-07-28
高脂血症已成为急性胰腺炎(acute pancreatitis, AP)的第三大病因, 且发病率逐年上升, 高脂血症型胰腺炎(hyperlipidemic pancreatitis, HLAP)常表现为更严重的炎症反应, 易进展为重症AP, 传统治疗对部分患者效果有限, 需早期识别高危患者以优化干预策略. 目前HLAP严重度评估主要依赖临床评分、影像学, 但存在滞后性或侵入性, 淀粉酶、脂肪酶等常规指标与病情严重度相关性差, 急需寻找更敏感的早期预测指标.
探讨HLAP患者外周血肝素结合蛋白(heparin-binding protein, HBP)、醛固酮(aldosterone, ALD)、C反应蛋白/白蛋白(C-reactive protein/albumin ratio, CAR)水平与病情程度、预后相关性, 并分析其对预后的预测价值.
选取2021-01/2024-12绍兴市上虞人民医院200例HLAP患者为研究对象, 依据入院28 d内预后情况将HLAP患者分为预后不良亚组、预后良好亚组. 比较各组外周血HBP、ALD、CAR水平, 并分析其与病情程度[急性生理与慢性健康状况Ⅱ(acute physiology and chronic health status Ⅱ, APACHE Ⅱ)评分、AP严重程度床旁指标评分(acute pancreatitis severity bedside index score, BISAP)]相关性. 多因素Logistic回归分析预后的影响因素. 分析外周血HBP、ALD、CAR间交互作用. 分析外周血HBP、ALD、CAR对预后的预测价值, 并对比分析HBP、ALD、CAR联合预测效能与传统指标(APACHE Ⅱ评分、BISAP评分)的预测效能.
预后不良亚组年龄、发病至入院时间、APACHE Ⅱ评分、BISAP评分及外周血TG、HBP、ALD、CAR水平均高于预后良好亚组(P<0.05); 预后不良亚组、预后良好亚组HLAP患者外周血HBP、ALD、CAR水平与APACHE Ⅱ评分、BISAP评分呈正相关(P<0.05), 且预后不良患者相关性更高; 外周血HBP、ALD、CAR水平为预后的独立危险因素(P<0.05); 以外周血HBP、ALD、CAR均值为界, 分为高水平(+)与低水平(-), 交互作用显示, 外周血HBP、ALD、CAR交互作用对HLAP患者预后不良风险存在协同作用, 三者均高水平时, 其协同效用为三者单独存在产生效应之和的1.242倍; 外周血HBP、ALD、CAR单项及联合预测预后的曲线下面积(area under the curve, AUC)值分别为0.734、0.758、0.768、0.926, 且联合预测的AUC值明显大于各指标单独预测(P<0.05); 传统指标APACHE Ⅱ评分、BISAP评分预测预后的AUC值分别为0.737、0.749, 均低于HBP、ALD、CAR联合预测的AUC值(P<0.05).
HLAP预后不良患者外周血TG、HBP、ALD、CAR水平升高, 其与病情程度、预后密切相关, 且外周血HBP、ALD、CAR交互作用对HLAP患者预后不良风险存在协同作用, 联合检测其水平对预后的预测价值优于单项指标及APACHE Ⅱ评分、BISAP评分的预测价值.
核心提要: 血肝素结合蛋白(heparin-binding protein, HBP)由中性粒细胞释放, 可参与血管通透性调节和炎症反应, 在脓毒症和多器官功能障碍中已显示预测价值, 但在高脂血症型胰腺炎(hyperlipidemic pancreatitis, HLAP)中的研究较少;醛固酮(aldosterone, ALD)升高与肾素-血管紧张素-醛固酮系统过度激活有关, 可加剧胰腺微循环障碍和全身炎症, 可能与HLAP的液体复苏需求和预后相关; C反应蛋白/白蛋白(C-reactive protein/albumin ratio, CAR)可综合反映炎症、营养/免疫状态, 在多种炎症性疾病(如脓毒症、癌症)中预测预后, 但HLAP中的应用尚未明确. 本研究主要探讨HBP、ALD、CAR交互作用对HLAP患者预后不良风险的交互作用及其对预后不良的预测价值.
引文著录: 于芳芳, 吴世民, 秦利花, 孟兰兰, 蒋柯炜, 项利娟. 外周血HBP、ALD及CAR水平对高脂血症型胰腺炎患者预后的预测价值. 世界华人消化杂志 2025; 33(7): 553-561
Revised: June 4, 2025
Accepted: July 17, 2025
Published online: July 28, 2025
Hyperlipidemia has become the third leading cause of acute pancreatitis (AP), and its incidence rate is increasing year by year. Hyperlipidemic pancreatitis (HLAP) often presents with more severe inflammatory reactions, prone to progress to severe acute pancreatitis. Traditional treatments have limited effectiveness for some patients, necessitating early identification of high-risk patients to optimize intervention strategies. Currently, the severity assessment of HLAP mainly relies on clinical scores and imaging, but there are delays or invasiveness. Routine indicators such as amylase and lipase have poor correlation with disease severity, urgently requiring the search for more sensitive early predictive indicators.
To investigate the correlation between the levels of peripheral blood heparin-binding protein (HBP), aldosterone (ALD), and C-reactive protein/albumin ratio (CAR) and the severity and prognosis of HLAP in patients, as well as to analyze their predictive value for prognosis.
Two hundred patients with HLAP admitted to our hospital from January 2021 to December 2024 were selected as the study subjects. These HLAP patients were categorized into a poor prognosis subgroup and a good prognosis subgroup based on their prognosis within 28 days of admission. Peripheral blood levels of HBP, ALD, and CAR in each group were compared, and their correlation with the severity of the condition [acute physiology and chronic health status Ⅱ (APACHE Ⅱ) score and acute pancreatitis severity bedside index score (BISAP)] was analyzed. Multivariate logistic regression analysis was conducted to identify factors influencing prognosis. The interaction between peripheral blood HBP, ALD, and CAR was analyzed. The predictive value of peripheral blood HBP, ALD, and CAR for prognosis was analyzed, and the predictive efficacy of HBP, ALD, and CAR in combination with traditional indicators (APACHE Ⅱ score and BISAP score) was also compared and analyzed.
Age, time from onset to admission, APACHE Ⅱ score, BISAP score, and peripheral blood TG, HBP, ALD, and CAR levels in the poor prognosis subgroup were all higher than those of the good prognosis subgroup (P < 0.05). In both the poor and good prognosis subgroups, the levels of HBP, ALD, and CAR in peripheral blood of HLAP patients were positively correlated with the APACHE Ⅱ score and BISAP score (P < 0.05), with a stronger correlation observed in patients with poor prognosis, and the levels of HBP, ALD, and CAR in peripheral blood were independent risk factors for prognosis (P < 0.05). Using the mean values of HBP, ALD, and CAR in peripheral blood as the cutoff, the patients were categorized into groups with high levels (+) and low levels (-). Interaction analysis showed that the interaction of HBP, ALD, and CAR in peripheral blood had a synergistic effect on the poor prognosis risk in HLAP patients. When all three were at high levels, their synergistic effect was 1.242 times greater than the sum of their individual effects. The area under the curve (AUC) values for predicting prognosis using HBP, ALD, and CAR alone and in combination were 0.734, 0.758, 0.768, and 0.926, respectively. The AUC value of combined prediction was significantly higher than that of each individual indicator alone (P < 0.05). The AUC values for predicting prognosis using the traditional indicators APACHE Ⅱ score and BISAP score were 0.737 and 0.749, respectively, both of which were lower than the AUC value of combined prediction using HBP, ALD, and CAR (P < 0.05).
HLAP patients with poor prognosis exhibit elevated levels of TG, HBP, ALD, and CAR in their peripheral blood, which are closely related to the severity of the disease and prognosis. Furthermore, the interaction among peripheral blood HBP, ALD, and CAR has a synergistic effect on the risk of poor prognosis in HLAP patients. The predictive value of jointly detecting their levels for prognosis is superior to that of individual indicators, as well as the APACHE Ⅱ score and BISAP score.
- Citation: Yu FF, Wu SM, Qin LH, Meng LL, Jiang KW, Xiang LJ. Predictive value of peripheral blood HBP, ALD, and CAR levels for prognosis of patients with hyperlipidemic pancreatitis. Shijie Huaren Xiaohua Zazhi 2025; 33(7): 553-561
- URL: https://www.wjgnet.com/1009-3079/full/v33/i7/553.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i7.553
急性胰腺炎(acute pancreatitis, AP)是一种由多因素诱发胰酶异常而造成胰腺组织自我消化、水肿的炎症性疾病, 其中高脂血症型胰腺炎(hyperlipidemic pancreatitis, HLAP)发病率约占所有AP患者的12%-38%, HLAP是指因血脂升高所致胰腺血供障碍继而造成胰腺出血、坏死的AP, 具有年轻化、重症化、易复发等特点, 且病情进展迅速, 可引起全身多器官功能障碍, 导致预后较差[1,2]. 临床常采用炎症指标、影像学检查、病情程度相关评分等评估AP患者预后及病情程度, 但存在设计指标多、检查项目较多等局限性, 限制其临床应用[3]. 因而需寻找快速有效的指标评估HLAP病情严重程度及预测患者预后, 这对HLAP患者治疗及改善预后有重要价值. 肝素结合蛋白(heparin-binding protein, HBP)是由中性粒细胞分泌, 可介导腺泡细胞炎症反应, 加快组织炎症浸润, 增加器官损伤风险, 且与AP病情进展密切相关[4]. 醛固酮(aldosterone, ALD)存在心脏、肾脏等多种组织中, 可调节机体水盐代谢、激素, 引起血管内皮细胞损伤, 加剧血管平滑肌细胞痉挛, 且与AP病情发展有关[5]. C反应蛋白/白蛋白(C-reactive protein/albumin ratio, CAR)可评估机体炎症状态, 且与炎症反应严重程度有关, 随着AP病情程度加重, C型反应性蛋白(C-reactive protein, CRP)水平随之升高, 研究表明AP患者应激状态下, 可增强蛋白质分解代谢, 减少蛋白质摄入, 导致ALB合成减少, 而CAR升高预示AP患者预后较差[6]. 目前外周血HBP、ALD、CAR在HLAP中的临床价值尚缺乏相关报道, 本研究尝试性分析HLAP患者外周血HBP、ALD、CAR水平, 探讨其与HLAP病情严重程度、预后相关性, 并分析其对预后的预测价值, 旨在早期识别预后不良风险, 为早期个体化干预提供依据.
一般资料: 选取2021-01/2024-12绍兴市上虞人民医院200例HLAP患者为研究对象. 本研究经本院伦理委员会审核批准. 纳入标准: (1)符合HLAP诊断标准[7]: ①出现典型上腹痛症状, 且血清淀粉酶或脂肪酶水平>正常值上限的3倍. ②腹部影像学检查证实为胰腺炎. ③入院时甘油三酯(triglyceride, TG)≥11.3 mmol/L或5.65 mmol/L≤TG<11.3 mmol/L, 且血清呈乳糜状、重度脂浊, 排除其他可能导致胰腺炎的原因, 符合≥2项即可确诊; (2)年龄>18岁; (3)首次发病; (4)发病时间明确; (5)发病至入院前未经相关治疗; (6)患者及家属知情同意, 且签署知情同意书. 排除标准: (1)病因不明; (2)既往有肝肾疾病病史; (3)合并消化道肿瘤等恶性肿瘤患者; (4)长期使用激素、免疫抑制剂; (5)合并胆囊炎、其他感染性疾病; (6)酒精等病因所致AP; (7)合并急性肠梗阻等其他消化系统疾病; (8)精神疾病; (9)伴有明显出血倾向或凝血功能障碍; (10)胆源性胰腺炎、自身免疫性胰腺炎等. 对照组无胰腺炎病史, 经体检显示无心血管疾病、慢性肝肾疾病、恶性肿瘤、自身免疫病等, 无精神疾病或认知障碍, 且体检前3个月内无感染、创伤、手术或住院史.
1.2.1 治疗方法与预后判定: HLAP患者予以规范治疗[8]: 包括禁食、补液、吸氧、抗感染、抑制胰酶活性、持续胃肠减压、纠正酸碱失衡、胃肠外营养支持治疗等综合治疗. 依据入院28 d内预后情况将HLAP患者分为预后不良亚组、预后良好亚组(采用盲法评估预后), 预后不良判定标准[9]: 进展为急性重症, 出现并发症(感染性坏死、急性肾损伤、脓毒症/感染休克等)、死亡等, 符合任意一项即为预后不良, 否则定义为预后良好.
1.2.2 检测外周血HBP、ALD及CAR水平: 对照组体检当日、观察组入院时分别采集外周静脉血10 mL, 其中5 mL血液样本置于含抗凝剂枸橼酸钠的采血管内, 以3000 r/min速率离心10 min(离心半径10 cm)分离血浆; 另外5 mL血液样本置于不含抗凝剂的采血管内, 以3000 r/min速率离心10 min(离心半径10 cm)分离血清. 采用免疫比浊法检测血清HBP水平(购自山西康健恩生物), 采用化学发光法检测血浆ALD水平(购自深圳市科润达生物), 采用免疫比浊法检测血清CRP水平(购自上海一研生物). 采用AU5800自动化生化分析仪(美国贝克曼公司)检测血浆ALB水平, 并计算CAR.
1.2.3 收集临床资料: 通过医院信息系统, 实时录入患者诊疗数据, 并建立专用研究数据库, 以此收集HLAP患者临床资料, 包括性别、年龄、身体质量指数、发病至入院时间、吸烟史、饮酒史、基础疾病、急性生理与慢性健康状况Ⅱ(acute physiology and chronic health status Ⅱ, APACHE Ⅱ)评分、AP严重程度床旁指标评分(bedside index for severity in acute pancreatitis, BISAP)及实验室指标[总胆固醇、TG、碱性磷酸酶、天门冬氨酸氨基转移酶、血尿素氮、血肌酐, 采用URIT-8401全自动生化分析仪(上海聚慕医疗器械有限公司)检测患者入院时上述实验室指标. APACHE Ⅱ评估病情严重程度[10]: 包括急性生理学、年龄、慢性健康状况, 总分为71分, 得分越高则病情越重. BISAP评估病情严重程度[11]: 包括年龄(≥60岁或<60岁)、胸腔积液(有或无)、精神状态(格拉斯哥昏迷量表评分<15分或≥15分)、尿素氮(>25 mg/dL或≤25 mg/dL)、全身炎症反应综合征(有或无), 每项计1分, 总分为5分, 得分越高则病情越严重.
(1)调查不同预后患者临床资料, 并对比分析不同预后患者外周血HBP、ALD、CAR水平; (2)分析不同预后患者入院时外周血HBP、ALD、CAR水平与APACHE Ⅱ、BISAP评分相关性; (3)分析入院时外周血HBP、ALD、CAR水平与传统指标(APACHE Ⅱ、BISAP评分)对预后的预测价值, 并对比其预测效能.
统计学处理 采用SPSS 25.0软件分析本研究数据, 计量资料采用均数±标准差(mean±SD)表示, 两组间比较采用独立样本t检验; 计数资料采用n(%)表示, 两组间比较采用χ2检验; Pearson分析HBP、ALD、CAR水平与APACHE Ⅱ、BISAP评分相关性; 多因素Logistic回归分析HBP、ALD、CAR与预后的关系; 受试者工作特征曲线(receiver operating characteristic, ROC)分析各指标单项及联合检测对预后的预测价值, 不同方案间曲线下面积(area under the curve, AUC)比较采用DeLong检验, 以P<0.05为差异有统计学意义.
200例HLAP患者入院28 d内进展为重症AP32例, 出现感染性坏死24例, 脓毒症或感染性休克12例, 并发急性肾损伤需进行透析治疗3例, 持续性急性呼吸窘迫综合征5例, 死亡2例, 占39.00%(78/200), 纳入预后不良亚组, 其余122例纳入预后良好亚组. 预后不良患者年龄、发病至入院时间、APACHE Ⅱ评分、BISAP评分及外周血TG、HBP、ALD、CAR水平均高于预后良好患者(P<0.05). 见表1.
| 资料 | 预后不良(n = 78) | 预后良好(n = 122) | t/χ2 | P值 |
| 性别 | 0.486 | 0.486 | ||
| 男 | 48(61.54) | 69(56.56) | ||
| 女 | 30(38.46) | 53(43.44) | ||
| 年龄(岁) | 44.17±4.22 | 39.25±4.06 | 8.231 | <0.001 |
| BMI(kg/m2) | 23.34±1.79 | 22.87±2.02 | 1.676 | 0.095 |
| 发病至入院时间(h) | 24.19±5.14 | 21.57±3.07 | 4.513 | 0.000 |
| 吸烟史 | 23(29.49) | 32(26.23) | 0.253 | 0.615 |
| 饮酒史 | 27(34.62) | 39(31.97) | 0.151 | 0.698 |
| 基础疾病 | ||||
| 糖尿病 | 48(61.54) | 71(58.20) | 0.220 | 0.639 |
| 高血压 | 16(20.51) | 22(18.03) | 0.190 | 0.663 |
| 脂肪肝 | 36(46.15) | 42(34.43) | 2.751 | 0.097 |
| 病情程度评分 | ||||
| APACHE Ⅱ评分 | 7.25±1.12 | 6.74±0.92 | 3.509 | 0.001 |
| BISAP评分 | 1.97±0.41 | 1.25±0.32 | 13.884 | <0.001 |
| 实验室指标 | ||||
| TC(mmol/L) | 8.74±1.02 | 8.94±1.25 | 1.183 | 0.238 |
| TG(mmol/L) | 19.22±3.14 | 12.05±2.41 | 18.201 | <0.001 |
| ALP(U/L) | 190.41±20.41 | 188.37±17.69 | 0.749 | 0.455 |
| AST(U/L) | 83.37±12.49 | 80.22±10.78 | 1.893 | 0.060 |
| BUN(mmol/L) | 5.72±1.34 | 5.41±1.03 | 1.843 | 0.067 |
| Scr(μmol/L) | 75.94±9.22 | 74.39±7.14 | 1.334 | 0.184 |
| HBP(μg/L) | 32.47±6.33 | 21.84±4.92 | 13.304 | <0.001 |
| ALD(pg/L) | 174.36±15.22 | 142.33±12.94 | 15.928 | <0.001 |
| CAR | 2.78±0.62 | 1.92±0.47 | 11.122 | <0.001 |
两亚组HLAP患者外周血HBP、ALD、CAR水平与APACHE Ⅱ评分、BISAP评分均呈正相关(P<0.05), 且预后不良患者相关性更高. 见表2.
| 组别 | HBP | ALD | CAR | |||
| r | P值 | r | P值 | r | P值 | |
| 预后不良 | ||||||
| APACHE Ⅱ评分 | 0.578 | <0.001 | 0.537 | <0.001 | 0.604 | <0.001 |
| BISAP评分 | 0.561 | <0.001 | 0.531 | <0.001 | 0.598 | <0.001 |
| 预后良好 | ||||||
| APACHE Ⅱ评分 | 0.559 | <0.001 | 0.528 | <0.001 | 0.572 | <0.001 |
| BISAP评分 | 0.547 | <0.001 | 0.519 | <0.001 | 0.565 | <0.001 |
以HLAP患者预后为因变量(赋值: 预后良好 = 0, 预后不良 = 1), 采用倾向性评分匹配法调整年龄、发病至入院时间、TG等其他混杂变量后, 其余变量进行Logistic回归分析, 结果显示, 外周血HBP、ALD、CAR水平为HLAP患者预后的独立危险因素(P<0.05). 见表3.
| 自变量 | β | SE | Wald χ2 | OR | 95%CI | P值 |
| HBP | 0.380 | 0.112 | 11.528 | 1.463 | 1.074-1.992 | <0.001 |
| ALD | 0.301 | 0.092 | 10.680 | 1.351 | 1.025-1.780 | <0.001 |
| CAR | 0.412 | 0.117 | 12.397 | 1.510 | 1.119-2.037 | <0.001 |
| 常数项 | -0.337 | 0.209 | 25.691 | - | - | <0.001 |
以外周血HBP、ALD、CAR均值为界, 分为高水平(+)与低水平(-). 交互作用显示, 外周血HBP、ALD、CAR交互作用对HLAP患者预后不良风险存在协同作用, 三者均高水平时, 其协同效用为三者单独存在产生效应之和的1.242倍. 见表4.
| HBP/ALD/CAR | 预后 | OR | 95%CI | RERI | AP | SI | |
| 不良 | 良好 | ||||||
| -/-/- | 2 | 39 | 1 | 7.750 | 0.127 | 1.242 | |
| -/-/+ | 7 | 19 | 1.616 | 1.074-2.433 | |||
| -/+/- | 6 | 23 | 1.593 | 1.105-2.296 | |||
| +/-/- | 6 | 23 | 1.628 | 1.098-2.413 | |||
| -/+/+ | 11 | 5 | 17.380 | 9.842-30.693 | |||
| +/-/+ | 12 | 6 | 15.971 | 8.977-28.415 | |||
| +/+/- | 12 | 5 | 17.547 | 9.024-34.119 | |||
| +/+/+ | 20 | 2 | 61.229 | 27.603-138.406 | |||
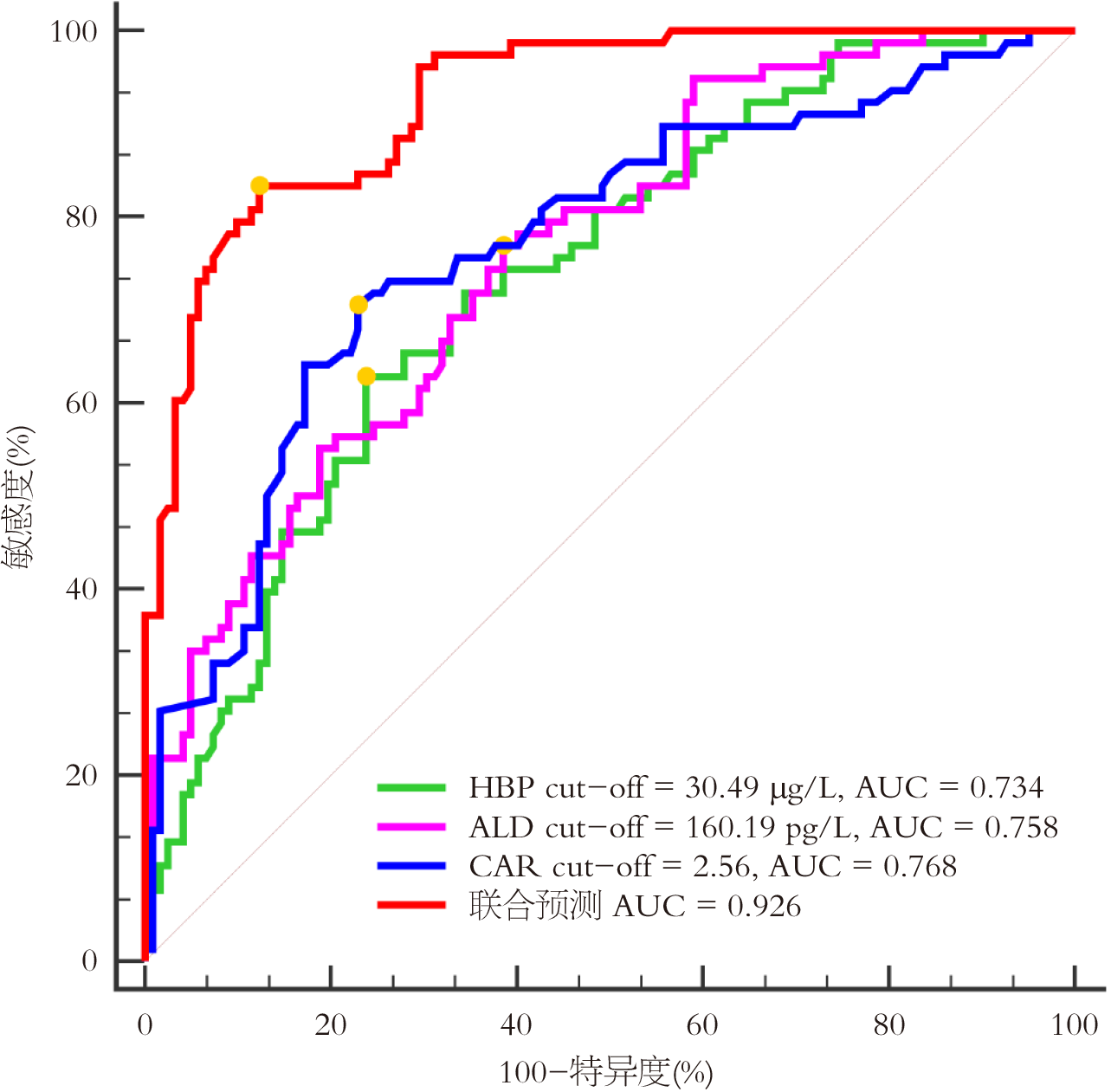
以预后不良亚组患者为阳性样本, 预后良好亚组患者为阴性样本, 外周血HBP、ALD、CAR水平为源数据, 绘制ROC曲线, 结果显示外周血HBP、ALD、CAR水平预测HLAP患者预后的AUC值均>0.7, 具有一定预测效能; 将外周血HBP、ALD、CAR水平进行Logistic回归拟合, 返回预测概率Log(p), 即Log(P) = -0.337+0.380×HBP+0.301×ALD+0.412×CAR, 将其作为独立检验变量, 获得联合预测AUC值, 明显大于各指标单独预测AUC值(Z = 4.960、4.206、4.086, P<0.05), 此时敏感度及特异度分别为83.30%、87.70%. 见图1, 表5.
| 指标 | 截断值 | AUC | 95%CI | 约登指数 | 敏感度(%) | 特异度(%) | P值 |
| HBP | 30.49 μg/L | 0.734 | 0.667-0.794 | 0.391 | 62.82 | 76.23 | <0.001 |
| ALD | 160.19 pg/L | 0.758 | 0.693-0.816 | 0.3.84 | 76.92 | 61.48 | <0.001 |
| CAR | 2.56 | 0.768 | 0.703-0.825 | 0.476 | 70.51 | 77.05 | <0.001 |
| 联合预测 | - | 0.926 | 0.880-0.958 | 0.710 | 83.30 | 87.70 | <0.001 |
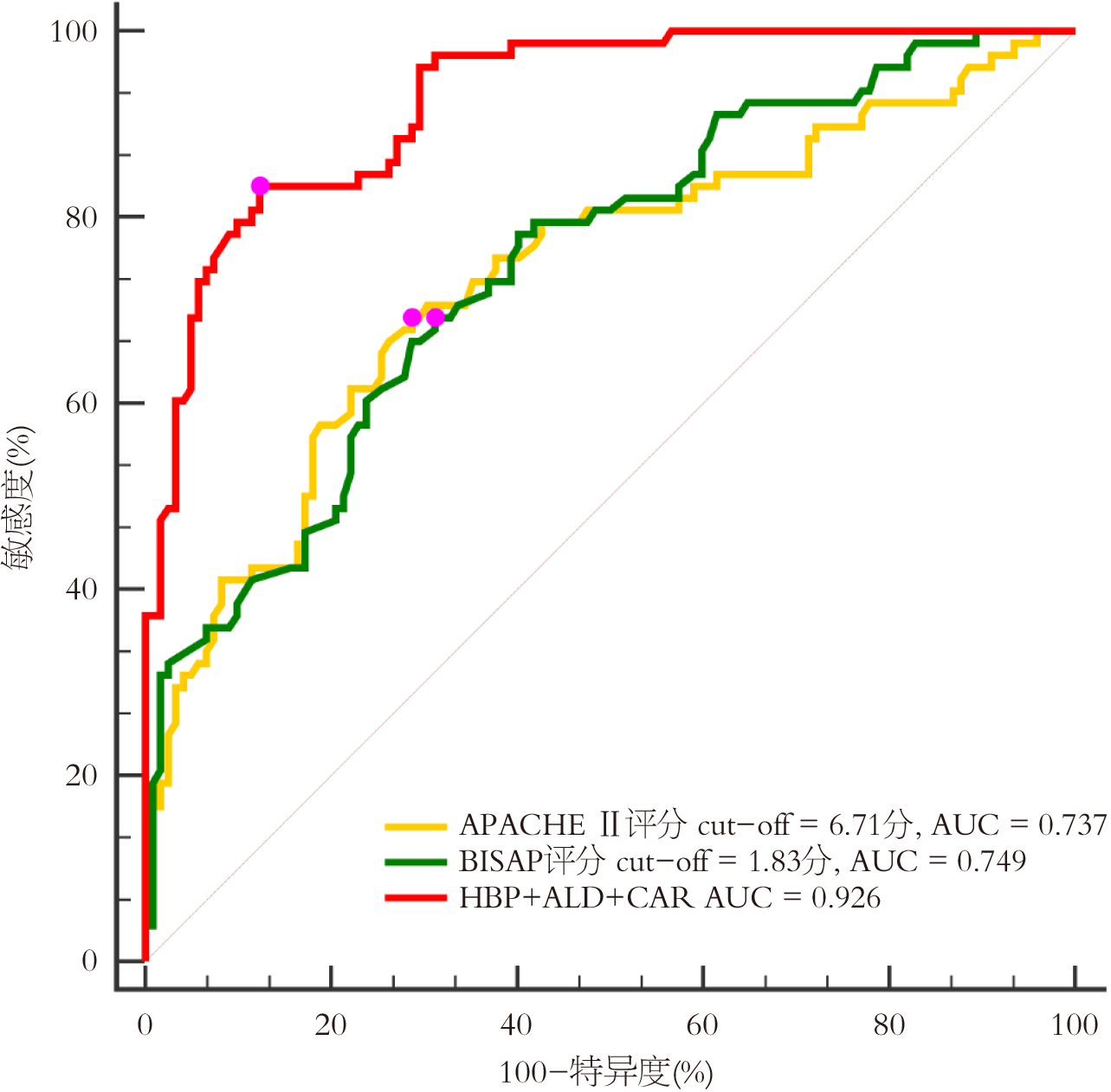
ROC曲线显示, 传统指标APACHE Ⅱ评分、BISAP评分预测HLAP患者预后的AUC值分别为0.737、0.749, 均低于外周血HBP、ALD、CAR联合预测AUC值(Z = 4.677、4.760, P<0.05). 见图2, 表6.
| 指标 | AUC | 95%CI | 约登指数 | 敏感度(%) | 特异度(%) | P值 |
| APACHE Ⅱ评分 | 0.737 | 0.671-0.797 | 0.405 | 69.23 | 71.31 | <0.001 |
| BISAP评分 | 0.749 | 0.683-0.807 | 0.381 | 69.23 | 68.85 | <0.001 |
| HBP+ALD+CAR | 0.926 | 0.880-0.958 | 0.710 | 83.30 | 87.70 | <0.001 |
AP发病机制可能为胰腺组织自我破坏, 可促使炎症细胞释放大量炎症因子, 加重胰腺损伤, 引发全身系统炎症反应, 导致胰蛋白酶原过度激活、胰腺自身消化; 脂蛋白代谢异常可增加血液黏稠度、血管通透性, 促进血栓形成, 促使脂肪微粒栓塞胰腺毛细血管, 诱导乳糜颗粒、游离脂肪酸聚集于胰腺, 这可促使胰腺血液循环受阻, 引起胰腺血供障碍, 破坏胰腺细胞结构、功能, 导致HLAP发生[12-14].
HBP具有趋化特性, 可激活单核细胞、巨噬细胞, 增加血管通透性, 增强机体炎症反应, 参与脓毒症、AP等发生发展过程[15,16]. HBP可激活磷脂酰肌醇-3-激酶/蛋白激酶B、Wnt/β-连环蛋白信号通路, 刺激炎症因子释放, 并可结合糖胺聚糖, 引起血管内皮损伤, 诱导钙进入细胞, 激活钙依赖性细胞骨架重排, 促使细胞间隙形成, 导致血管渗漏, 还可激活氧化应激反应, 破坏腺泡细胞结构, 诱导腺泡细胞凋亡, 加快胰腺炎病情进展[17-19]. 苏岚等[20]研究表明重症AP预后不良患者血清HBP水平升高. 本研究发现外周血HBP水平与APACHE Ⅱ评分、BISAP评分呈正相关, 且为预后的独立危险因素. 分析其原因可能为激活内皮细胞、单核细胞, 促进炎症因子释放, 招募更多中性粒细胞至炎症部位, 放大炎症反应, 破坏内皮细胞连接, 导致微循环渗漏、组织水肿, 并可增加血管内皮通透性, 引起胰腺微循环障碍, 加重缺血和坏死, 从而参与HLAP发生过程; HBP水平升高可增加血管通透性, 刺激中性粒细胞释放炎症介质, 引发全身炎症反应, 破坏血管内皮屏障, 加剧氧化应激反应, 并可诱发重要器官的灌注不足, 加重胰腺组织损伤程度, 还可引起胰腺微循环障碍, 促使腺泡细胞坏死, 导致预后不良风险增加. 肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system, RAAS)过度激活可促使肾素活性(plasma renin activity, PRA)释放量增加, PRA又可促进ALD分泌, 而ALD可结合盐皮质激素受体, 激活细胞核因子κB信号通路, 促进炎症因子释放, 引起胰腺组织炎症损伤, 并可激活胰腺星状细胞, 促使细胞外基质沉积、胰腺纤维化, 破坏腺泡细胞线粒体功能, 诱发细胞凋亡或坏死, 增加活性氧生成量, 诱导胰腺腺泡细胞氧化损伤[21-23]. 汤伟胜等[24]研究表明重症AP患者血浆ALD水平升高. 本研究发现预后不良患者外周血ALD水平升高, 其与APACHE Ⅱ评分、BISAP评分呈正相关, 且为预后不良的独立危险因素. 原因可能为ALD水平升高可引起胰腺微循环障碍, 激活胰腺局部RAAS, 促进炎症因子释放, 增加活性氧生成, 加重胰腺损伤, 并可收缩胰腺微血管, 减少血流灌注, 引起缺血-再灌注损伤, 加重胰腺组织氧化损伤, 从而参与HLAP发生过程; ALD可介导炎症、氧化应激反应, 引起微血管内皮功能障碍, 诱发线粒体功能障碍, 加重胰腺缺血程度, 破坏胰腺功能, 从而促进预后不良发生.
CRP水平升高时伴随ALB水平降低, CAR可反映机体炎症状态, 评估AP病情严重程度, 其中CRP可募集中性粒细胞浸润胰腺组织, 增强白细胞-内皮黏附, 抑制内皮细胞一氧化氮合成, 促进血管收缩、血栓形成, 导致微循环阻塞; ALB具有抗凝血、抗炎、抗凋亡等作用, 可反映机体营养状态, 保护微循环系统, 减轻血管通透性[25,26]. 本研究显示预后不良患者外周血CAR水平升高. 马那琦等[27]研究表明重症AP预后不良患者CAR升高. 同时本研究发现CAR与APACHE Ⅱ评分、BISAP评分呈正相关. 究其原因可能为CAR升高表明机体内炎症反应加剧, 而随着CRP水平升高导致ALB水平降低, 其中CRP可诱导单核巨噬细胞聚集于胰腺组织受损部位, 加重胰腺组织水肿程度, 影响胰腺组织血液灌注, 从而加重HLAP病情严重程度. 本研究进一步分析显示外周血CAR水平为预后的独立危险因素, 推测其原因可能为CRP水平升高、ALB水平降低可增加血管通透性, 促进血栓形成, 引起微循环阻塞, 加重腺泡细胞损伤程度, 诱导胰腺及其他组织器官损伤, 从而增加预后不良发生风险. 同时本研究以外周血HBP、ALD、CAR均值为界, 分为高水平(+)与低水平(-). 交互作用显示, 外周血HBP、ALD、CAR交互作用对HLAP患者预后不良风险存在协同作用, 三者均高水平时, 其协同效用为三者单独存在产生效应之和的1.242倍, 提示外周血HBP、ALD、CAR交互作用可共同促进预后不良发生. 既往研究表明APACHE Ⅱ评分、BISAP评分在评估HLAP患者病情及预后中具有一定应用价值, 但涉及内容过多、操作较为复杂, 且缺少时限性, 不利于早期快速评估病情及预后; 影像学检查难以量化评估病情; 血清学指标具有快速、经济等优点, 可通过动态监测血清指标实时评估病情发展及预测预后[28-30]. 李宇等[31]研究表明HBP预测AP合并感染的AUC值为0.835. 王巧芳等[32]研究表明CAR预测HLAP患者预后的AUC为0.781. 本研究发现外周血HBP、ALD、CAR预测预后的AUC值分别为0.734、0.758、0.768, 且联合预测的AUC值明显大于各指标单独预测, 表明HBP、ALD、CAR对预后具有一定预测效能. 同时本研究对比分析HBP、ALD、CAR联合预测效能与传统指标APACHE Ⅱ评分、BISAP评分的预测效能, 这也是本研究创新之处, 结果发现APACHE Ⅱ评分、BISAP评分预测预后的AUC值分别为0.737、0.749, 均低于HBP、ALD、CAR联合预测的AUC值, 提示HBP、ALD、CAR可能作为临床早期预测HLAP患者预后的潜在指标. 这可能是因为HBP、ALD、CAR在临床中更易获得, 且操作简单、预测价值较高, 这对临床具有一定指导意义.
综上所述, HLAP预后不良患者外周血TG、HBP、ALD、CAR水平明显升高, 其与APACHE Ⅱ评分、BISAP评分呈正相关, 其为HLAP患者预后的独立危险因素, 且外周血HBP、ALD、CAR交互作用对HLAP患者预后不良风险存在协同作用, 联合检测其水平预测预后具有临床应用价值. 但外周血指标检测时间点较为单一, 未动态追踪治疗过程中的关键指标变化, 在一定程度上限制研究结果的泛化, 有待日后临床基于本研究结果开展前瞻性研究纳入外周血指标的动态监测数据, 同时关于HBP、ALD、CAR在HLAP中的价值仍需进一步研究.
急性胰腺炎(acute pancreatitis, AP)是一种由多因素诱发胰酶异常而造成胰腺组织自我消化、水肿的炎症性疾病, 其中高脂血症型胰腺炎(hyperlipidemic pancreatitis, HLAP)发病率约占所有AP患者的12%-38%, HLAP是指因血脂升高所致胰腺血供障碍继而造成胰腺出血、坏死的AP, 具有年轻化、重症化、易复发等特点, 且病情进展迅速, 可引起全身多器官功能障碍, 导致预后较差.
目前外周血血肝素结合蛋白(heparin-binding protein, HBP)、醛固酮(aldosterone, ALD)、C反应蛋白/白蛋白(C-reactive protein/albumin ratio, CAR)在HLAP中的临床价值尚缺乏相关报道, 本研究尝试性分析HLAP患者外周血HBP、ALD、CAR水平, 探讨其与HLAP病情严重程度、预后相关性, 并分析其对预后的预测价值, 旨在早期识别预后不良风险, 为早期个体化干预提供依据.
探讨高脂血症型胰腺炎患者外周血肝素结合蛋白、醛固酮、C反应蛋白/白蛋白水平与病情程度、预后相关性, 并分析其对预后的预测价值.
选取2021-01/2024-12绍兴市上虞人民医院200例HLAP患者为研究对象, 依据入院28 d内预后情况将HLAP患者分为预后不良亚组、预后良好亚组. 比较各组外周血HBP、ALD、CAR水平, 并分析其与病情程度急性生理与慢性健康状况Ⅱ评分、AP严重程度床旁指标评分相关性. 多因素Logistic回归分析预后的影响因素. 分析外周血HBP、ALD、CAR间交互作用. 分析外周血HBP、ALD、CAR对预后的预测价值, 并对比分析HBP、ALD、CAR联合预测效能与传统指标[急性生理与慢性健康状况Ⅱ(acute physiology and chronic health status Ⅱ, APACHE Ⅱ)评分、急性胰腺炎严重程度床旁指标评分(acute pancreatitis severity bedside index score, BISAP)评分]的预测效能.
HBP由中性粒细胞释放, 可参与血管通透性调节和炎症反应, 在脓毒症和多器官功能障碍中已显示预测价值, 但在HLAP中的研究较少; ALD升高与肾素-血管紧张素-醛固酮系统(Renin-Angiotensin-Aldosterone System, RAAS)过度激活有关, 可加剧胰腺微循环障碍和全身炎症, 可能与HLAP的液体复苏需求和预后相关; CAR可综合反映炎症、营养/免疫状态, 在多种炎症性疾病(如脓毒症、癌症)中预测预后, 但HLAP中的应用尚未明确.
HLAP预后不良患者外周血TG、HBP、ALD、CAR水平升高, 其与病情程度、预后密切相关, 且外周血HBP、ALD、CAR交互作用对HLAP患者预后不良风险存在协同作用, 联合检测其水平对预后的预测价值优于单项指标及APACHE Ⅱ评分、BISAP评分的预测价值.
联合检测其水平预测预后具有临床应用价值. 但外周血指标检测时间点较为单一, 未动态追踪治疗过程中的关键指标变化, 在一定程度上限制研究结果的泛化, 有待日后临床基于本研究结果开展前瞻性研究纳入外周血指标的动态监测数据, 同时关于HBP、ALD、CAR在HLAP中的价值仍需进一步研究.
| 1. | Wang J, Xia Y, Cao Y, Cai X, Jiang S, Liao Y, Shi M, Luo H, Wang D. Evaluating the efficacy and timing of blood purification modalities in early-stage hyperlipidemic acute pancreatitis treatment. Lipids Health Dis. 2023;22:208. [PubMed] [DOI] |
| 2. | Zhou W, Liu Q, Wang Z, Yao L, Chen J, Yang X. Analysis of the clinical profile and treatment efficiency of hyperlipidemic acute pancreatitis. Lipids Health Dis. 2024;23:70. [PubMed] [DOI] |
| 3. | Jiang D, Wang J, Guo S. Correlations of Triglyceride with Type, Severity and Clinical Prognosis of Acute Pancreatitis. Clin Lab. 2022;68. [PubMed] [DOI] |
| 4. | Sjöbeck M, Sternby H, Herwald H, Thorlacius H, Regnér S. Heparin-binding protein is significantly increased in acute pancreatitis. BMC Gastroenterol. 2021;21:337. [PubMed] [DOI] |
| 5. | Rouette J, Yin H, McDonald EG, Barkun A, Azoulay L. Renin-Angiotensin-Aldosterone System Inhibitors and Risk of Acute Pancreatitis: A Population-Based Cohort Study. Drug Saf. 2022;45:65-74. [PubMed] [DOI] |
| 6. | Tarar MY, Khalid A, Choo XY, Khurshid S, Tumeh H, Muhammad K. Use of the C-Reactive Protein (CRP)/Albumin Ratio as a Severity Tool in Acute Pancreatitis: Systematic Review. Cureus. 2022;14:e29243-e29253. [DOI] |
| 10. | Mihailo B, Zoran K, Miodrag J, Saša M, Darko M, Ivan S, Bratislav T, Janko P, Svetlana V. Procalcitonin and BISAP score versus C-reactive protein and APACHE II score in early assessment of severity and outcome of acute pancreatitis. Vojnosanit Pregl. 2012;69:425-431. [DOI] |
| 11. | Londoño-Ruiz G, Ramírez-Giraldo C, Vesga-Rosas A, Vargas-Barato F. Prediction of severe pancreatitis in a population with low atmospheric oxygen pressure. Sci Rep. 2022;12:19518. [PubMed] [DOI] |
| 12. | Zhai C, Li X, Xiao D, Chen L, Wang C, Zheng M. Severe hyperlipidemia pancreatitis induced by taking tamoxifen after breast cancer surgery-Case report. Front Oncol. 2023;13:1103637. [PubMed] [DOI] |
| 14. | Jiang DL, Tang MY, Liu TT, Zhang XY, Luo J, Ji YF, Li XH, Zhang XM. Magnetic resonance imaging (MRI) and clinical features of different parts of the pancreas involved in acute pancreatitis: a cross-sectional study. Quant Imaging Med Surg. 2024;14:8361-8373. [PubMed] [DOI] |
| 15. | Shu W, Wan J, Yang X, Chen J, Yang Q, Liu F, Xia L. Heparin-Binding Protein Levels at Admission and Within 24 h Are Associated with Persistent Organ Failure in Acute Pancreatitis. Dig Dis Sci. 2021;66:3597-3603. [PubMed] [DOI] |
| 16. | Zhong Y, Yu Z, Wang L, Yang X. Combined detection of procalcitonin, heparin-binding protein, and interleukin-6 is a promising assay to diagnose and predict acute pancreatitis. J Clin Lab Anal. 2021;35:e23869. [PubMed] [DOI] |
| 17. | Kong D, Lei Z, Wang Z, Yu M, Li J, Chai W, Zhao X. A novel HCP (heparin-binding protein-C reactive protein-procalcitonin) inflammatory composite model can predict severe acute pancreatitis. Sci Rep. 2023;13:9440. [PubMed] [DOI] |
| 18. | 李 磊, 郑 传明, 夏 群, 程 峰, 陈 硬, 宋 琦, 徐 术根, 王 振杰. 肝素结合蛋白联合降钙素原在评估急性胰腺炎合并感染中的预测价值. 中华全科医学. 2020;18:927-929, 1068. |
| 21. | Rahimi R, Hashemi Rafsanjani SMR, Heidari-Soureshjani S, Sherwin CMT, Kasiri K. The Association between use of Renin-Angiotensin-Aldosterone System Inhibitors and the Risk and Mortality of Pancreatic Cancer: A Systematic Review and Meta-Analysis. Curr Rev Clin Exp Pharmacol. 2025;20:60-71. [PubMed] [DOI] |
| 22. | Grewal S, Fosam A, Chalk L, Deven A, Suzuki M, Correa RR, Blau JE, Demidowich AP, Stratakis CA, Muniyappa R. Insulin sensitivity and pancreatic β-cell function in patients with primary aldosteronism. Endocrine. 2021;72:96-103. [PubMed] [DOI] |
| 25. | Funamizu N, Utsunomiya T, Honjo M, Ito C, Shine M, Uraoka M, Nagaoka T, Tamura K, Sakamoto K, Ogawa K, Takada Y. Preoperative C-Reactive Protein-to-Albumin Ratio Predicts Postoperative Pancreatic Fistula following Pancreatoduodenectomy: A Single-Center, Retrospective Study. Curr Oncol. 2022;29:9867-9874. [PubMed] [DOI] |
| 26. | Serafini S, Friziero A, Sperti C, Vallese L, Grego A, Piangerelli A, Belluzzi A, Moletta L. The Ratio of C-Reactive Protein to Albumin Is an Independent Predictor of Malignant Intraductal Papillary Mucinous Neoplasms of the Pancreas. J Clin Med. 2021;10:2058. [PubMed] [DOI] |
| 28. | 陈 辉, 兰 涛, 张 培君, 孟 繁斌, 姚 长存, 孙 思. BISAP、Ranson和APACHE Ⅱ评分系统对高脂血症性急性胰腺炎患者病情和预后的评估价值. 现代生物医学进展. 2020;20:361-365. |
| 31. | 李 宇, 杨 春, 张 效良. 血清学指标肝素结合蛋白、红细胞分布宽度联合急性生理与慢性健康评分量表评分在评估急性胰腺炎合并感染中的预测价值. 中华生物医学工程杂志. 2021;27:549-552. |
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C, C, C
D级 (一般): D
E级 (差): E, E
科学编辑: 刘继红 制作编辑:郑晓梅