修回日期: 2025-06-11
接受日期: 2025-07-17
在线出版日期: 2025-07-28
肝脏缺血再灌注损伤机制涉及免疫功能等多方面. 右美托咪定(dexmedetomidine, Dex)具有抗炎、抗氧化及免疫调节作用. 本研究假设加速康复外科(enhanced recovery after surgery, ERAS)理念下Dex不同应用时机对老年肝脏手术患者肝脏缺血再灌注损伤及免疫功能的影响不同.
探究ERAS理念下Dex应用时机对老年肝脏手术患者肝脏缺血再灌注损伤及免疫功能的影响.
选取2021-01/2023-01武义县第一人民医院90例行肝脏切除手术的老年肝脏肿瘤患者, 随机分为A组(n = 45)、B组(n = 45), A组于麻醉诱导前应用Dex, B组于麻醉诱导后应用Dex. 比较两组入室时(T0)、切皮时(T1)、切肝时(T2)、术毕即刻(T3)血流动力学指标[心率(heart rate, HR)、平均动脉压(mean arterial pressure, MAP)]、氧化应激指标[乳酸(lactate, LA)、皮质醇(cortisol, Cor)、血糖(blood sugar, Glu)]、炎性因子[肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-6(interleukin-6, IL-6)、C反应蛋白(C-reactive protein, CRP)]及T0、T3、术后1 h(T4)肝功能指标[谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)]、免疫功能指标[免疫球蛋白A(immunoglobulin A, IgA)、免疫球蛋白M(immunoglobulin M, IgM)、免疫球蛋白G(immunoglobulin G, IgG)], 并比较两组术后恢复情况、不良反应发生情况.
A组T1、T2、T3时HR、MAP均低于B组(P<0.05); A组T1、T2、T3时LA、Cor、Glu水平均低于B组(P<0.05); A组T1、T2、T3时血清TNF-α、IL-6、CRP水平均低于B组(P<0.05); A组T3、T4时血清ALT、AST水平均低于B组(P<0.05); A组T3、T4时血清IgA、IgM水平均高于B组(P<0.05); A组苏醒时间、恢复意识时间、气管导管拔除时间、术后排气时间与B组比较, 差异无统计学意义(P>0.05); A组不良反应发生率(11.11%)与B组(17.78%)比较, 差异无统计学意义(P>0.05).
与麻醉诱导后应用Dex比较, 麻醉诱导前应用Dex能更有效维持老年肝脏肿瘤患者肝脏切除手术中血流动力学稳定, 减轻氧化应激和炎性损伤, 从而减轻肝脏缺血再灌注损伤引起的肝功能降低和免疫功能下降.
核心提要: 本文是假设快速康复外科理念下右美托咪定应用时机对老年肝脏手术患者肝脏缺血再灌注损伤及免疫功能影响的研究, 纳入90例行肝脏切除手术的老年肝脏肿瘤患者, 对其影响对其影响因素进行研究.
引文著录: 饶湘, 陈舍黄, 周信阳, 钟学武, 李玲, 黄高石. ERAS理念下Dex应用时机对老年肝脏手术患者肝脏缺血再灌注损伤及免疫功能影响的研究. 世界华人消化杂志 2025; 33(7): 543-552
Revised: June 11, 2025
Accepted: July 17, 2025
Published online: July 28, 2025
The mechanism of liver ischemia-reperfusion injury involves multiple aspects such as immune function. Dexmedetomidine (Dex) has anti-inflammatory, antioxidant, and immunomodulatory effects. This study hypothesized that Dex adminstration timing has varying effects on liver ischemia-reperfusion injury and immune function in elderly patients undergoing liver surgery within the framework of enhanced recovery after surgery (ERAS).
To investigate the impact of Dex administration timing on hepatic ischemia-reperfusion injury and immune function in elderly patients undergoing liver surgery within the framework of ERAS.
Ninety elderly patients with liver tumors who underwent liver resection in our hospital from January 2021 to January 2023 were selected and randomly divided into group A (n = 45) and group B (n = 45). Group A received Dex before anesthesia induction, while group B was given Dex after induction of anesthesia. The two groups were compared for hemodynamic indexes [heart rate (HR) and mean arterial pressure (MAP)], oxidative stress indicators [lactate (LA), cortisol (Cor), and blood sugar (Glu)], and inflammatory factors [tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6), and C-reactive protein (CRP)] at entry (T0), skin incision (T1), liver incision (T2), and immediately after surgery (T3), as well as liver function indexes [alanine aminotransferase (ALT) and aspartate aminotransferase (AST)] and immune function indexes [immunoglobulin (Ig)A, IgM, and IgG] at T0, T3, and T4 (1 h after surgery). The postoperative recovery and adverse reactions were also compared between the two groups.
HR and MAP in group A were lower than those of group B at T1, T2, and T3 (P < 0.05). LA, Cor, and Glu levels at T1, T2, and T3 in group A were lower than those of group B (P < 0.05). Serum levels of TNF-α, IL-6, and CRP at T1, T2, and T3 were lower than those of group B (P < 0.05). Serum ALT and AST levels at T3 and T4 in group A were lower than those of group B (P < 0.05). Serum IgA and IgM levels at T3 and T4 in group A were higher than those of group B (P < 0.05). There were no significant differences in time to wake-up, time to recovery, time to tracheal extubation, or time to first postoperative exhaust between the two groups (P > 0.05). The incidence of adverse reactions in group A (11.11%) was comparable to that of group B (17.78%) (P > 0.05).
Compared with the application of Dex after induction of anesthesia, the application of Dex before anesthesia induction can more effectively maintain hemodynamic stability during liver resection in elderly patients with liver tumors, reduce oxidative stress and inflammatory damage, and thereby reduce liver ischemia-reperfusion injury caused by decreased liver function and decreased immune function.
- Citation: Rao X, Chen SH, Zhou XY, Zhong XW, Li L, Huang GS. Effect of dexmedetomidine administration timing on hepatic ischemia-reperfusion injury and immune function in elderly patients undergoing liver surgery within ERAS framework. Shijie Huaren Xiaohua Zazhi 2025; 33(7): 543-552
- URL: https://www.wjgnet.com/1009-3079/full/v33/i7/543.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i7.543
原发性肝细胞癌是全世界常见的恶性肿瘤之一, 其恶性程度高, 近年来其发病率及死亡率仍有升高趋势, 每年约50%的新发肝癌发生在中国[1]. 目前, 肝切除术是肝癌最主要的根治性治疗手段, 但肝脏解剖结构复杂、血供丰富, 手术难度高、创伤性大, 而老年患者机体各脏器功能衰弱, 手术耐受性差、风险高, 在遵循加速康复外科(enhanced recovery after surgery, ERAS)理念的前提下, 加强围术期管理对改善患者预后至关重要[2]. 气管插管全麻是保障肝脏切除手术顺利进行的重要措施, 可抑制中枢神经, 发挥反射抑制、松弛骨骼肌、降低疼痛程度等作用[3]. 右美托咪定(dexmedetomidine, Dex)是重要辅助麻醉药, 具有良好镇痛、镇静作用, 且能抑制交感神经活性, 减少麻醉药物剂量, 有助于稳定术中血流动力学[4,5]. 既往有研究指出, Dex不同应用时机的麻醉效果不同, 应用于老年麻醉诱导前能更有效稳定诱导期血流动力学[6]. 且已有部分研究探讨了Dex在肝脏手术或ERAS中的应用, 但针对Dex不同应用时机对老年肝脏切除患者缺血再灌注氧化应激和炎性损伤、肝功能恢复及免疫功能的影响尚无研究报道. 基于此, 本研究尝试探究ERAS理念下Dex不同应用时机对老年肝脏切除手术患者肝脏缺血再灌注氧化应激和炎性损伤、肝功能恢复及免疫功能影响. 报告如下.
1.1.1 一般资料: 基于同类研究数据, 以氧化应激指标[如乳酸(lactic acid, LA)]为主要效应量, 预期组间差异均值为1.2 mmol/L(SD = 1.0), 设定α = 0.05(双侧检验)、β = 0.2(功效80%). 通过G*Power 3.1计算, 每组需42例, 总样本量84例(当前90例满足要求). 经武义县第一人民医院伦理委员会审批通过, 选取2021-01/2023-01武义县第一人民医院90例行肝脏切除手术的老年肝脏肿瘤患者, 满足最小样本量要求. 依据1:1配对原则, 根据患者就诊序号采用电脑随机数字表法随机分为A组(n = 45)、B组(n = 45), 采用计算机生成1-90随机数字表, 规定1-45数字对应患者纳入A组, 于麻醉诱导前应用Dex, 46-90数字对应患者纳入B组, 于麻醉诱导后应用Dex. 将制定好的麻醉方法使用连续编号的不透明信封保存, 当所有患者符合选例标准时拆开信封并执行信封里对应的麻醉方法. 本研究采用单盲设计, 麻醉医师知晓分组, 受试者与结局评估者设盲. 对比两组性别、年龄、体质量指数、肿瘤分期[7]、肝功能Child-Pugh分级[8]、美国麻醉师协会(American Society of Anesthesiologists, ASA)[9]分级、手术方式, 均无显著差异(P>0.05). 见表1.
| 组别 | 例数 | 性别(男/女) | 年龄(岁) | 体质量指数 | 肿瘤分期 | 肝功能Child-Pugh分级 | ASA分级 | 手术方式 | ||||
| Ⅰ-Ⅱ期 | Ⅲa期 | A级 | B级 | Ⅱ级 | Ⅲ级 | 区段切除 | 半肝切除 | |||||
| A组 | 45 | 28/17 | 60-78(69.12±4.43) | 19.5-28.3(25.13±1.58) | 26(57.78) | 19(42.22) | 18(40.00) | 27(60.00) | 24(53.33) | 21(46.67) | 30(66.67) | 15(33.33) |
| B组 | 45 | 25/20 | 60-77(68.59±4.20) | 19.1-27.9(24.86±1.51) | 29(64.44) | 16(35.56) | 20(44.44) | 25(55.55) | 27(60.00) | 18(40.00) | 33(73.33) | 12(26.67) |
| χ2/t | 0.413 | 0.582 | 0.829 | 0.421 | 0.182 | 0.407 | 0.476 | |||||
| P值 | 0.520 | 0.562 | 0.410 | 0.517 | 0.670 | 0.523 | 0.490 | |||||
1.1.2 选例标准: 纳入标准: (1)参照《原发性肝癌诊疗规范(2017年版)》[10]诊断为原发性肝癌; (2)年龄≥60岁; (3)肿瘤分期Ⅰ-Ⅲa期; (4)肝功能Child-Pugh分级A-B级; (5)ASA分级Ⅱ-Ⅲ级; (6)能耐受手术; (7)术前未接受放化疗等治疗; (8)患者及家属知晓本研究, 已签署同意书.
排除标准: (1)肺部感染、泌尿系感染等感染性疾病患者; (2)合并其他原发恶性肿瘤者; (3)肿瘤发生远处转移者; (4)神经系统疾病患者; (5)严重心脑血管疾病、肾功能不全者; (6)近期有严重创伤史或手术史者; (7)血液系统疾病患者; (8)自身免疫性疾病患者; (9)糖尿病、高血压等疾病患者.
所有患者均择期行腹腔镜下肝脏切除手术治疗, 术前1 d开展ERAS理念的健康宣教, 指导患者适量进行体育锻炼, 给予肠外高营养, 术前12 h禁食, 术前8 h禁饮, 手术及麻醉操作均由同一组手术医生、麻醉医生完成, 患者入室后常规开放外周静脉通路, 连接HX-EC00智能动态心电监护仪(购自上海聚慕医疗器械有限公司)监测血压、体温、呼吸等生命体征, 给予5 min面罩去氮给氧(氧流量6 L/min), 随后实施全身麻醉诱导: 静脉注射2 mg咪达唑仑(江苏九旭药业有限公司, 国药准字22241104)、0.5 μg/kg舒芬太尼(宜昌人福药业有限责任公司, 国药准字AB40901121)、0.3 mg/kg依托咪酯(江苏恩华医药股份有限公司, 国药准字T YT25B04)、0.15 mg/kg顺苯磺酸阿曲库铵(杭州澳亚生物技术股份有限公司, 国药准字25022511); 麻醉维持: 气管插管行机械通气, 吸入1.5%七氟烷(江苏恒瑞医药有限公司 国药准字24122431), 同时泵注瑞芬太尼(江苏恩华药业股份有限公司, 国药准字H20143314)0.1 μg/(kg•min), 麻醉维持中七氟烷和瑞芬太尼的剂量标准化, 间断静推顺苯磺酸阿曲库铵5 mg/次, 维持术中脑电双频指数值在40-60之间. A组于麻醉诱导前15 min应用Dex(宜昌人福药业股份有限公司, 国药准字AD4110171), 静脉注射0.8 μg/kg Dex[11], 于10 min内完毕. B组于麻醉诱导后(气管插管前)应用Dex, 用法用量同A组. 两组手术开始后均以0.5 μg/(kg•h)持续输注Dex, 直至腹腔镜退出, 术中监测膀胱温度, 给予加热毯、输注液体加温、冲洗液加温, 手术室温度维持在22-24 ℃.
(1)两组入室时(T0)、切皮时(T1)、切肝时(T2)、术毕即刻(T3)血流动力学指标[心率(heart rate, HR)、平均动脉压(mean arterial pressure, MAP)]、氧化应激指标[LA、皮质醇(cortisol, Cor)、血糖(blood glucose, Glu)]、炎性因子[肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-6(interleukin-6, IL-6)、C反应蛋白(C-reactive protein, CRP)]水平. HR、MAP从心电监护仪上读取. 采集患者各时间段外周静脉血5 mL, 取其中2 mL血液标本采用贝克曼Coulter LH750型全血分析仪测定全血中LA、Glu水平, 取3 mL血液标本离心处理(转速3500 r/min, 时间5 min)取血清, 采用化学发光法测定血清Cor水平, 试剂盒购自郑州安图生物工程股份有限公司; 采用酶联免疫吸附法测定血清TNF-α、IL-6、CRP水平, 试剂盒购自深圳迈瑞生物医疗电子股份有限公司; (2)两组T0、T3、术后1 h(T4)肝功能指标[谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)]、免疫功能指标[免疫球蛋白A(immunoglobulin A, IgA)、免疫球蛋白M(immunoglobulin M, IgM)]水平. 采集患者各时间段外周静脉血3 mL, 离心处理(转速3500 r/min, 时间5 min)取血清, 采用全自动干式生化分析仪(南京大树生物医疗技术股份有限公司)检测血清IgA、IgM水平. 采用免疫透射比浊法检测血清IgA、IgM水平, 试剂盒购自天津博奥赛斯生物科技有限公司; (3)两组手术情况(肝门阻断时间、手术时间、出血量、术中输血、应用血管活性物质)及术后恢复情况(苏醒时间、恢复意识时间、气管导管拔除时间、术后排气时间、住院时间); (4)两组不良反应(寒战、低氧血症、躁动、恶心/呕吐)及术后并发症(切口感染、肠梗阻、肺部感染)发生情况.
统计学处理 数据处理采用SPSS 22.0软件, 计数资料以例数描述, 采用χ2检验; 计量资料采取Bartlett方差齐性检验与Kolmogorov-Smirnov正态性检验, 均确认具备方差齐性且服从正态分布, 以平均数±标准差描述, 两组间比较采用独立样本t检验, 不同时间、组间交互作用下指标采用重复测量方差分析; P<0.05为差异有统计学意义.
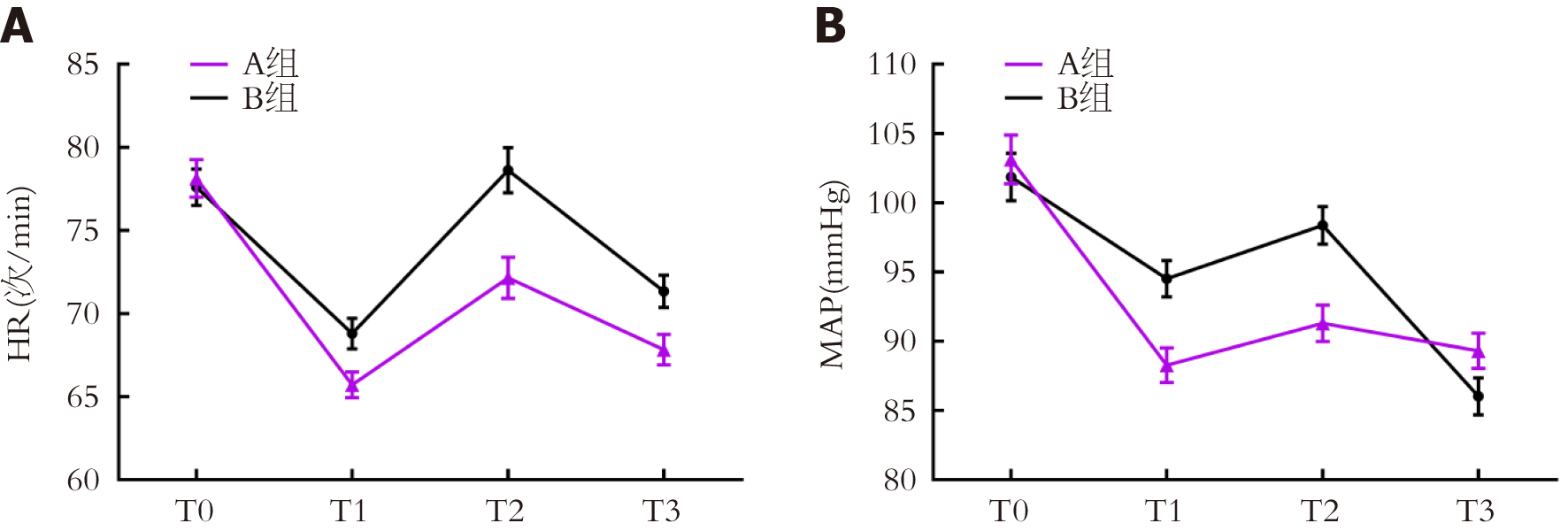
两组T0时HR、MAP比较, 差异无统计学意义(P>0.05); A组T1、T2、T3时HR、MAP均较B组低(P<0.05); 组间-时间交互作用比较, 差异有统计学意义(P<0.05). 见表2. 两组血流动力学指标动态变化折线图见图1.
| 指标 | 组别 | n | T0 | T1 | T2 | T3 |
| HR(次/min) | A组 | 45 | 78.12±7.65 | 65.71±5.26 | 72.15±8.29 | 67.82±6.14 |
| B组 | 45 | 77.59±7.38 | 68.79±6.13 | 78.62±9.17 | 71.33±6.51 | |
| 组间 | F = 9.337, P<0.001 | |||||
| 时间 | F = 8.106, P<0.001 | |||||
| 组间-时间交互 | F = 6.241, P<0.001 | |||||
| MAP(mmHg) | A组 | 45 | 103.12±11.84 | 88.27±8.36 | 91.30±8.82 | 89.31±8.52 |
| B组 | 45 | 101.85±11.50 | 94.52±8.79 | 98.36±9.10 | 86.03±9.04 | |
| 组间 | F = 11.035, P<0.001 | |||||
| 时间 | F = 9.127, P<0.001 | |||||
| 组间-时间交互 | F = 7.368, P<0.001 | |||||
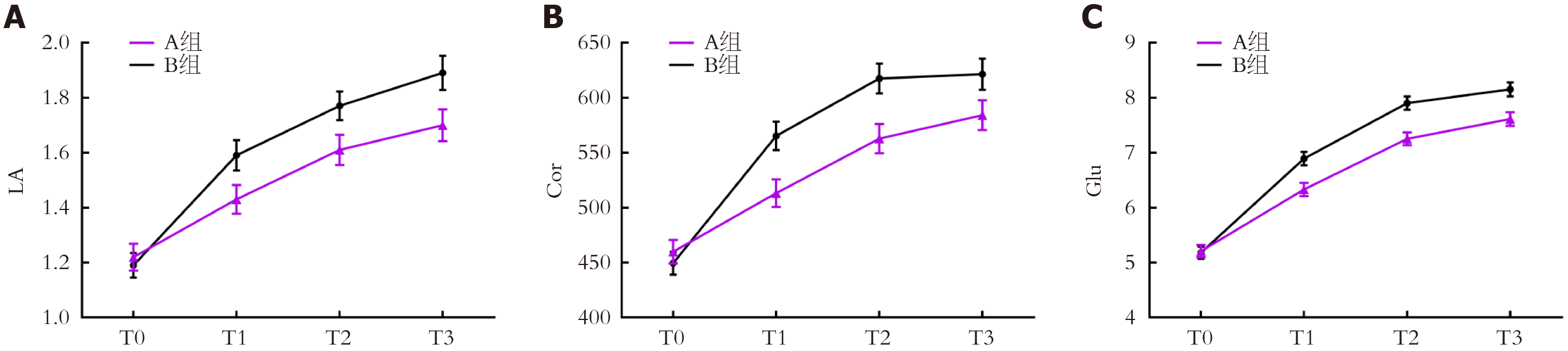
两组T0时LA、Cor、Glu水平比较, 差异无统计学意义(P>0.05); A组T1、T2、T3时LA、Cor、Glu水平均较B组低(P<0.05); 组间-时间交互作用比较, 差异有统计学意义(P<0.05). 见表3. 两组氧化应激指标动态变化折线图见图2.
| 指标 | 组别 | n | T0 | T1 | T2 | T3 |
| LA | A组 | 45 | 1.22±0.33 | 1.43±0.35 | 1.61±0.37 | 1.70±0.39 |
| B组 | 45 | 1.19±0.30 | 1.59±0.37 | 1.77±0.35 | 1.89±0.42 | |
| 组间 | F = 8.357, P<0.001 | |||||
| 时间 | F = 7.209, P<0.001 | |||||
| 组间-时间交互 | F = 5.916, P<0.001 | |||||
| Cor | A组 | 45 | 459.83±72.64 | 513.12±84.65 | 562.67±89.38 | 584.17±91.23 |
| B组 | 45 | 449.47±70.38 | 565.27±86.71 | 617.39±91.60 | 621.38±95.49 | |
| 组间 | F = 10.334, P<0.001 | |||||
| 时间 | F = 8.526, P<0.001 | |||||
| 组间-时间交互 | F = 6.718, P<0.001 | |||||
| Glu | A组 | 45 | 5.21±0.76 | 6.33±0.81 | 7.25±0.79 | 7.61±0.83 |
| B组 | 45 | 5.18±0.74 | 6.89±0.85 | 7.90±0.82 | 8.15±0.86 | |
| 组间 | F = 9.264, P<0.001 | |||||
| 时间 | F = 7.615, P<0.001 | |||||
| 组间-时间交互 | F = 6.102, P<0.001 | |||||
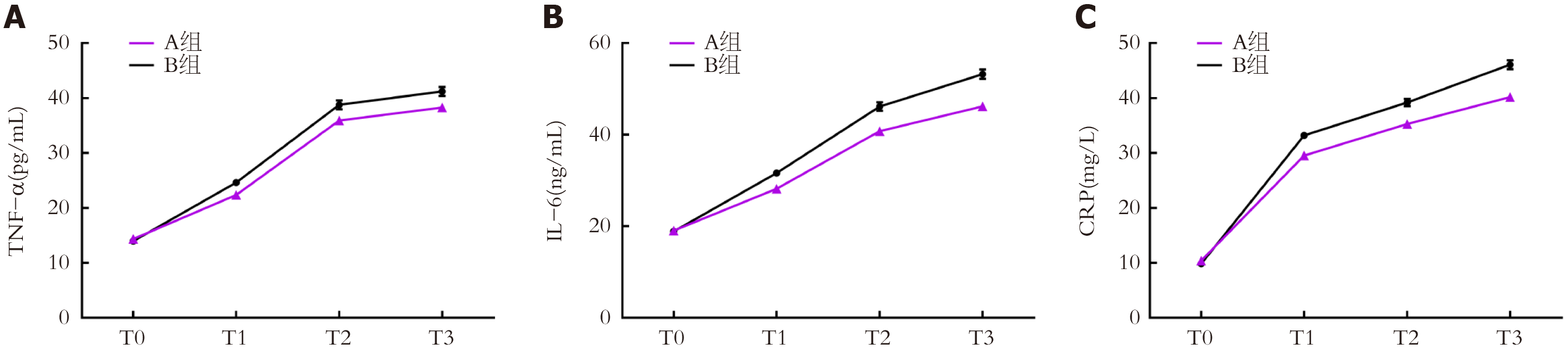
两组T0时血清TNF-α、IL-6、CRP水平比较, 差异无统计学意义(P>0.05); A组T1、T2、T3时血清TNF-α、IL-6、CRP水平均较B组低(P<0.05); 组间-时间交互作用比较, 差异有统计学意义(P<0.05). 见表4. 两组炎性因子动态变化折线图见图3.
| 指标 | 组别 | n | T0 | T1 | T2 | T3 |
| TNF-α(pg/mL) | A组 | 45 | 14.35±1.62 | 22.37±3.15 | 35.89±5.28 | 38.27±5.46 |
| B组 | 45 | 13.96±1.57 | 24.61±3.46 | 38.76±5.51 | 41.19±5.60 | |
| 组间 | F = 9.165, P<0.001 | |||||
| 时间 | F = 7.583, P<0.001 | |||||
| 组间-时间交互 | F = 6.217, P<0.001 | |||||
| IL-6(ng/mL) | A组 | 45 | 19.05±2.49 | 28.18±4.16 | 40.75±5.90 | 46.17±6.38 |
| B组 | 45 | 18.86±2.38 | 31.59±4.72 | 46.15±6.43 | 53.22±7.02 | |
| 组间 | F = 15.339, P<0.001 | |||||
| 时间 | F = 13.726, P<0.001 | |||||
| 组间-时间交互 | F = 11.840, P<0.001 | |||||
| CRP(mg/L) | A组 | 45 | 10.38±1.75 | 29.53±3.78 | 35.27±4.26 | 40.19±5.20 |
| B组 | 45 | 9.84±1.69 | 33.18±4.02 | 39.19±4.58 | 46.05±5.46 | |
| 组间 | F = 19.316, P<0.001 | |||||
| 时间 | F = 17.287, P<0.001 | |||||
| 组间-时间交互 | F = 15.129, P<0.001 | |||||
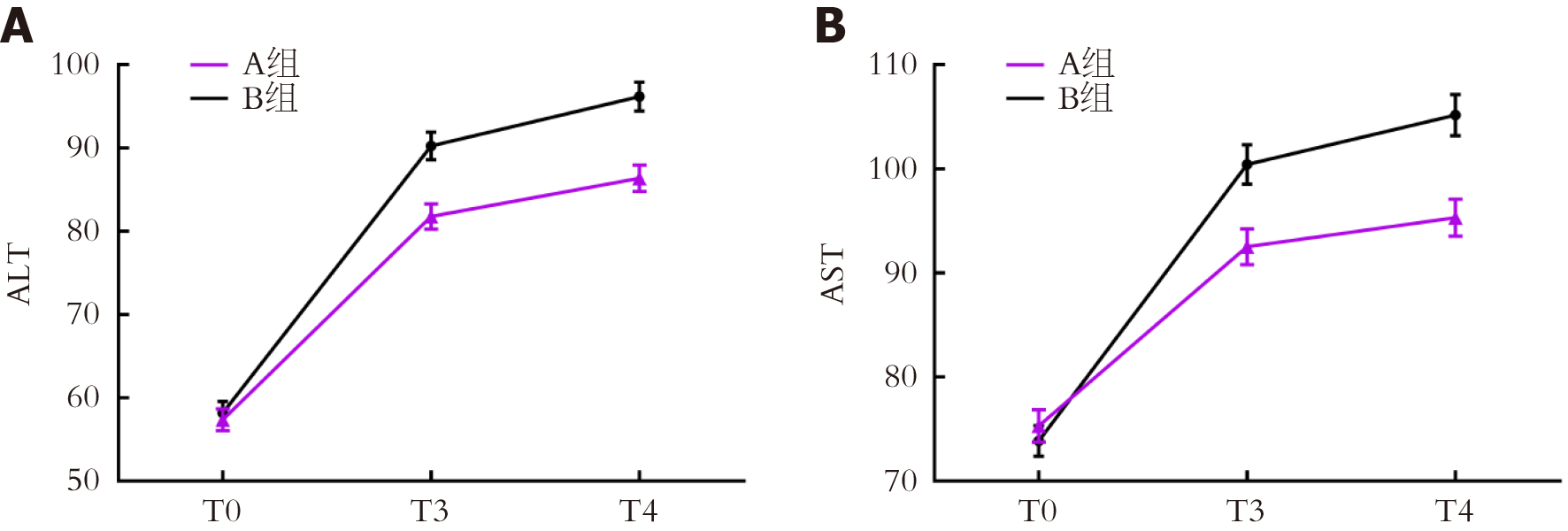
两组T0时血清ALT、AST水平比较, 差异无统计学意义(P>0.05); A组T3、T4时血清ALT、AST水平均较B组低(P<0.05); 组间-时间交互作用比较, 差异有统计学意义(P<0.05). 见表5. 两组肝功能指标动态变化折线图见图4.
| 指标 | 组别 | n | T0 | T3 | T4 |
| ALT | A组 | 45 | 57.36±8.89 | 81.79±10.35 | 86.37±10.71 |
| B组 | 45 | 58.17±9.20 | 90.24±11.20 | 96.18±11.55 | |
| 组间 | F = 14.026, P<0.001 | ||||
| 时间 | F = 12.175, P<0.001 | ||||
| 组间-时间交互 | F = 10.340, P<0.001 | ||||
| AST | A组 | 45 | 75.29±10.41 | 92.50±11.64 | 95.32±12.08 |
| B组 | 45 | 73.85±9.96 | 100.43±12.75 | 105.17±13.34 | |
| 组间 | F = 9.026, P<0.001 | ||||
| 时间 | F = 7.659, P<0.001 | ||||
| 组间-时间交互 | F = 5.827, P<0.001 | ||||
两组T0时血清IgA、IgM水平比较, 差异无统计学意义(P>0.05); A组T3、T4时血清IgA、IgM水平均较B组高(P<0.05); 组间-时间交互作用比较, 差异有统计学意义(P<0.05). 见表6.
| 指标 | 组别 | n | T0 | T3 | T4 |
| IgA | A组 | 45 | 2.95±0.28 | 2.48±0.25 | 2.29±0.23 |
| B组 | 45 | 3.03±0.31 | 2.23±0.24 | 2.04±0.20 | |
| 组间 | F = 20.157, P<0.001 | ||||
| 时间 | F = 18.664, P<0.001 | ||||
| 组间-时间交互 | F = 16.825, P<0.001 | ||||
| IgM | A组 | 45 | 1.67±0.38 | 1.26±0.29 | 1.09±0.21 |
| B组 | 45 | 1.70±0.42 | 1.10±0.25 | 0.95±0.19 | |
| 组间 | F = 14.371, P<0.001 | ||||
| 时间 | F = 12.056, P<0.001 | ||||
| 组间-时间交互 | F = 9.887, P<0.001 | ||||
两组肝门阻断时间、手术时间、出血量、术中输血、应用血管活性物质、苏醒时间、恢复意识时间、气管导管拔除时间、术后排气时间、住院时间比较, 差异无统计学意义(P>0.05). 见表7和表8.
| 组别 | n | 肝门阻断时间(min) | 手术时间(min) | 出血量(mL) | 术中输血 | 应用血管活性物质 |
| A组 | 45 | 57.29±12.43 | 197.82±26.75 | 212.35±24.18 | 8(17.78) | 33(73.33) |
| B组 | 45 | 61.84±15.07 | 207.13±30.46 | 220.96±29.07 | 10(22.22) | 36(80.00) |
| t | 1.563 | 1.541 | 1.528 | 0.278 | 0.559 | |
| P值 | 0.122 | 0.127 | 0.130 | 0.598 | 0.455 |
| 组别 | n | 苏醒时间(min) | 恢复意识时间(min) | 气管导管拔除时间(min) | 术后排气时间(h) | 住院时间(d) |
| A组 | 45 | 12.53±2.15 | 13.74±2.21 | 14.12±2.19 | 46.52±5.71 | 9.67±2.15 |
| B组 | 45 | 12.96±2.27 | 14.05±2.32 | 14.76±2.28 | 47.13±6.15 | 10.32±2.47 |
| t | 0.923 | 0.649 | 1.358 | 0.488 | 1.332 | |
| P值 | 0.359 | 0.518 | 0.178 | 0.627 | 0.187 |
ERAS是一种新型外科理念, 目的在于降低手术应激反应及并发症发生, 进而促进患者快速恢复健康, 随着ERAS的推广应用, 多模式麻醉镇痛越来越受临床重视, 即采用多种有效的麻醉方式来减少单一麻醉的不良反应, 完善麻醉和镇痛, 加快术后康复[12].
Dex是一种高度选择α2受体激动剂, 可减轻应激反应, 保持术中血流动力学平稳, 减轻脏器功能损伤, 且不存在呼吸抑制副作用, 与全麻联合应用有助于改善麻醉效果[13]. 但Dex对血流动力学的影响受剂量、给药速度和给药时机的影响, 临床上Dex的应用时机尚无统一标准. 目前, Dex在肝脏切除手术中也得到广泛应用, 临床多项研究证实Dex能减轻肝脏手术患者的肝功能损伤, 并抑制多种细胞因子的释放, 有利于降低缺血再灌注损伤[14,15]. 但何时应用Dex能获得更佳效果, 目前尚无研究报道. 本研究以Dex不同应用时机为切入点, 通过对比分析发现, 与麻醉诱导后应用Dex比较, 麻醉诱导前应用Dex能更有效抑制术中HR、MAP升高, 由此可见于老年肝脏切除手术患者麻醉诱导前应用Dex能更有效稳定术中血流动力学波动, 有助于降低手术风险, 促进手术顺利进行. 分析其原因可能在于患者麻醉诱导前对手术存在一定恐惧和焦虑情绪, Dex可作用于脑和脊髓的α2受体, 抑制神经元放电, 发挥镇痛镇静作用, 且能引发及维持自然非动眼睡眠[16], 于麻醉诱导前应用Dex能早期激活α2受体, 有效发挥镇静、催眠效果, 从而减轻患者恐惧和焦虑情绪引起的HR、MAP波动, 有助于稳定术中HR、MAP, 更有利于减少应激反应的不利影响. 一项动物学研究显示, Dex预处理、联合处理、后处理均能在不同程度上产生肺保护作用, 且Dex联合处理比右美托咪定预处理及后处理的肺保护效果更明显[17]. 在剖宫产术行腰硬联合麻醉中, 麻醉开始前15 min给予Dex的镇静效果高于麻醉后给药[18]. 而在小儿电子耳蜗植入术中, 麻醉诱导插管后则是Dex较为合理的临床用药时机, 可进一步稳定术中血流动力学, 减少麻醉苏醒躁动[19].
此外, 本研究发现麻醉诱导前应用Dex能进一步下调老年肝脏肿瘤患者肝脏切除手术中LA、Cor、Glu水平, 同时能降低术中血清TNF-α、IL-6、CRP水平. 由此可见麻醉诱导前应用Dex在减轻术中应激反应及炎症反应方面的作用更明显. 这是因为肝脏外科手术可引起缺血再灌注损伤, 虽然目前肝脏外科技术及手术设备的改善提高了肝脏手术安全性, 但肝脏缺血再灌注损伤依然是一个影响肝脏围手术期效果及预后的主要因素[20]. 肝脏缺血再灌注损伤的机制较复杂, 涉及氧化应激、炎性损伤、微循环障碍、细胞凋亡等多方面. 于麻醉诱导前应用Dex能提前发挥显著的镇痛、镇静作用, 且Dex具有抗交感、抗应激作用, 从而达到降低患者应激反应以及炎性反应的目的. 相关研究指出, 术中应用Dex是降低高龄肝脏手术患者术中免疫应激指标以及炎性细胞因子水平的有效措施[21]. 本研究还发现, 麻醉诱导前应用Dex能下调术后血清ALT、AST水平及IgA、IgM水平. 表明麻醉诱导前应用Dex能更有效降低患者肝功能及免疫功能损伤, 这与其能减轻术中应激反应、炎症反应引起的损伤有关. 研究显示[22], Dex可通过上调超氧化物歧化酶和核因子2相关因子2表达、减轻氧化应激反应和炎症反应. Dex还能通过下调miR-34a表达促进SIRT1蛋白表达, 从而降低脂多糖诱导的Kupffer细胞氧化应激反应[23]. 且本研究发现Dex不同应用时机对患者术后恢复情况无明显影响, 均具有一定安全性, 麻醉诱导前应用Dex的不良反应发生率低于麻醉诱导后应用Dex, 但组间比较差异无统计学意义, 这可能与本研究样本量较少有关, 仍需通过多中心、大样本研究进一步探讨.
综上可知, 老年肝脏切除手术麻醉诱导前应用Dex, 能获得较麻醉诱导后应用Dex更稳定的术中血流动力学, 且能减轻氧化应激和炎性损伤, 发挥保护肝功能和免疫功能的作用. 本研究临床意义在于指导临床优化老年肝脏手术麻醉方案, 选择合适Dex应用时机. 但本研究存在样本量较少的不足, 研究结果可能存在一定误差, 且未探究成本效益, 未来仍需通过多中心的大样本研究进一步验证.
目前, 肝切除术是肝癌最主要的根治性治疗手段, 但肝脏解剖结构复杂、血供丰富, 手术难度高、创伤性大, 而老年患者机体各脏器功能衰弱, 手术耐受性差、风险高, 在遵循加速康复外科(enhanced recovery after surgery, ERAS)理念的前提下, 加强围术期管理对改善患者预后至关重要.
本研究尝试探究ERAS理念下右美托咪定(dexmedetomidine, Dex)不同应用时机对老年肝脏切除手术患者肝脏缺血再灌注氧化应激和炎性损伤、肝功能恢复及免疫功能影响.
探究ERAS理念下Dex应用时机对老年肝脏手术患者肝脏缺血再灌注损伤及免疫功能的影响.
选取2021-01/2023-01武义县第一人民医院90例行肝脏切除手术的老年肝脏肿瘤患者, 随机分为A组(n = 45)、B组(n = 45), A组于麻醉诱导前应用Dex, B组于麻醉诱导后应用Dex. 比较两组入室时(T0)、切皮时(T1)、切肝时(T2)、术毕即刻(T3)血流动力学指标[心率(heart rate, HR)、平均动脉压(mean arterial pressure, MAP)]、氧化应激指标[乳酸(lactate, LA)、皮质醇(cortisol, Cor)、血糖(blood sugar, Glu)]、炎性因子[肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-6(interleukin-6, IL-6)、C反应蛋白(C-reactive protein, CRP)]及T0、T3、术后1 h(T4)肝功能指标[谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)]、免疫功能指标[免疫球蛋白A[(immunoglobulin A, IgA)、免疫球蛋白M(immunoglobulin M, IgM)、免疫球蛋白G(immunoglobulin G, IgG)], 并比较两组术后恢复情况、不良反应发生情况.
A组T1、T2、T3时HR、MAP均低于B组(P<0.05); A组T1、T2、T3时LA、Cor、Glu水平均低于B组(P<0.05); A组T1、T2、T3时血清TNF-α、IL-6、CRP水平均低于B组(P<0.05); A组T3、T4时血清ALT、AST水平均低于B组(P<0.05); A组T3、T4时血清IgA、IgM水平均高于B组(P<0.05); A组苏醒时间、恢复意识时间、气管导管拔除时间、术后排气时间与B组比较, 差异无统计学意义(P>0.05); A组不良反应发生率(11.11%)与B组(17.78%)比较, 差异无统计学意义(P>0.05).
与麻醉诱导后应用Dex比较, 麻醉诱导前应用Dex能更有效维持老年肝脏肿瘤患者肝脏切除手术中血流动力学稳定, 减轻氧化应激和炎性损伤, 从而减轻肝脏缺血再灌注损伤引起的肝功能降低和免疫功能下降.
本研究临床意义在于指导临床优化老年肝脏手术麻醉方案, 选择合适Dex应用时机. 但本研究存在样本量较少的不足, 研究结果可能存在一定误差, 且未探究成本效益, 未来仍需通过多中心的大样本研究进一步验证.
| 1. | 全国多中心前瞻性肝癌极早期预警筛查项目(PreCar)专家组, 王 红阳, 侯 金林, 王 传新, 樊 蓉, 陈 磊, 杜 鲁涛, 钱 云松, 汪 慧. 中国肝癌早筛策略专家共识. 中华肝脏病杂志. 2021;29:515-522. |
| 2. | 海峡两岸医药卫生交流协会肿瘤防治专家委员会, 吴 健雄, 许 建萍, 荣 维淇, 王 黎明. 肝癌肝切除围手术期管理中国专家共识(2021年版). 中华肿瘤杂志. 2021;43:414-430. |
| 3. | Liu Y, Su M, Li W, Yuan H, Yang C. Comparison of general anesthesia with endotracheal intubation, combined spinal-epidural anesthesia, and general anesthesia with laryngeal mask airway and nerve block for intertrochanteric fracture surgeries in elderly patients: a retrospective cohort study. BMC Anesthesiol. 2019;19:230. |
| 5. | Lee S. Dexmedetomidine: present and future directions. Korean J Anesthesiol. 2019;72:323-330. |
| 7. | 贾 宁阳, 霍 雷, 张 娟. 十大恶性肿瘤影像分级检查推荐方案(1.0版)之肝癌. 中国医学计算机成像杂志. 2019;25:446-450. |
| 8. | de Guevara LL, Dagher L, Arruda VM, Nakajima K, Kudo M. Sorafenib treatment by Child-Pugh score in Latin American patients with hepatocellular carcinoma. Future Oncol. 2020;16:2511-2520. |
| 13. | Grape S, Kirkham KR, Frauenknecht J, Albrecht E. Intra-operative analgesia with remifentanil vs. dexmedetomidine: a systematic review and meta-analysis with trial sequential analysis. Anaesthesia. 2019;74:793-800. |
| 14. | Pan JR, Li XL, He Y, Jian CJ, Chen HX, Hei ZQ, Zhou SL. Comparison of dexmedetomidine vs. remifentanil combined with sevoflurane during radiofrequency ablation of hepatocellular carcinoma: a randomized controlled trial. Trials. 2019;20:28. |
| 16. | Erickson SJ, Millar J, Anderson BJ, Festa MS, Straney L, Shehabi Y, Long DA; Baby SPICE Investigators and the Australian and New Zealand Intensive Care Society Paediatric Study Group (ANZICS-PSG). Dexmedetomidine Sedation in Mechanically Ventilated Critically Ill Children: A Pilot Randomized Controlled Trial. Pediatr Crit Care Med. 2020;21:e731-e739. |
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D, D
E级 (差): E
科学编辑: 刘继红 制作编辑:郑晓梅