修回日期: 2025-05-09
接受日期: 2025-05-16
在线出版日期: 2025-05-28
结直肠癌具有较高的发病率和死亡率. 根治性手术是目前临床主要治疗手段, 而化疗是不符合手术适应症的患者主要治疗手段之一, 但部分患者化疗后可能由于病情较重等原因, 仍存在一定的复发转移率.
探讨泛免疫炎症值(pan-immune inflammation value, PIV)、纤维蛋白原与白蛋白比值(fibrinogen to albumin ratio, FAR)、控制营养状态(controlled nutritional status, CONUT)评分单独及联合检测对结直肠癌患者化疗预后的预测价值.
选取2021-01/2024-01于杭州市临平区第一人民医院行化疗治疗的结直肠癌患者98例进行前瞻性研究, 依据化疗后随访情况, 将患者分为预后良好组、预后不良组. 比较两组临床资料及PIV、FAR、CONUT评分, 分析各指标与患者预后的相关性, 分析患者化疗预后的影响因素, 分析PIV、FAR、CONUT评分单独及联合对化疗预后的预测价值, 采用卡普兰-迈耶曲线分析不同PIV、FAR、CONUT评分患者的生存情况.
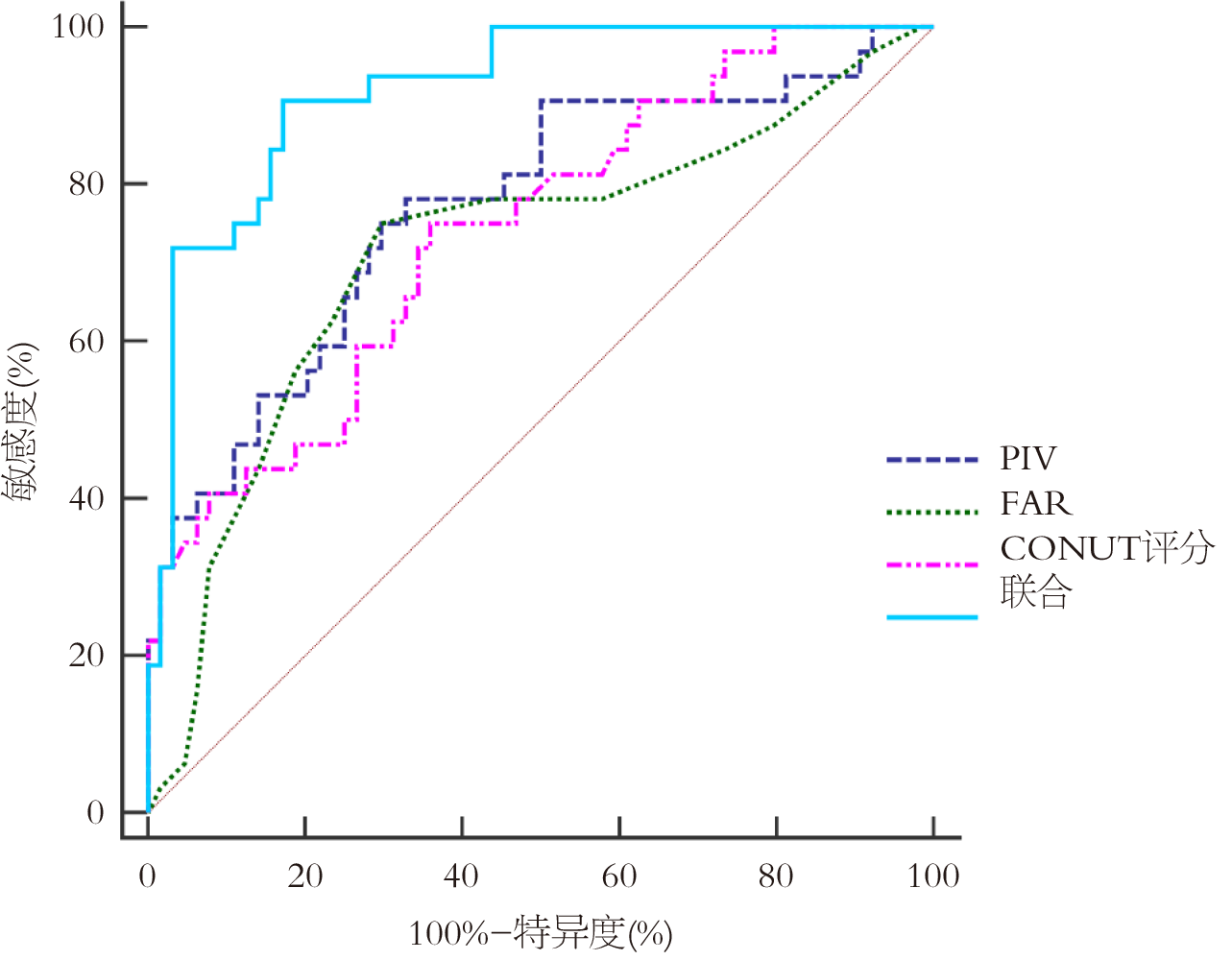
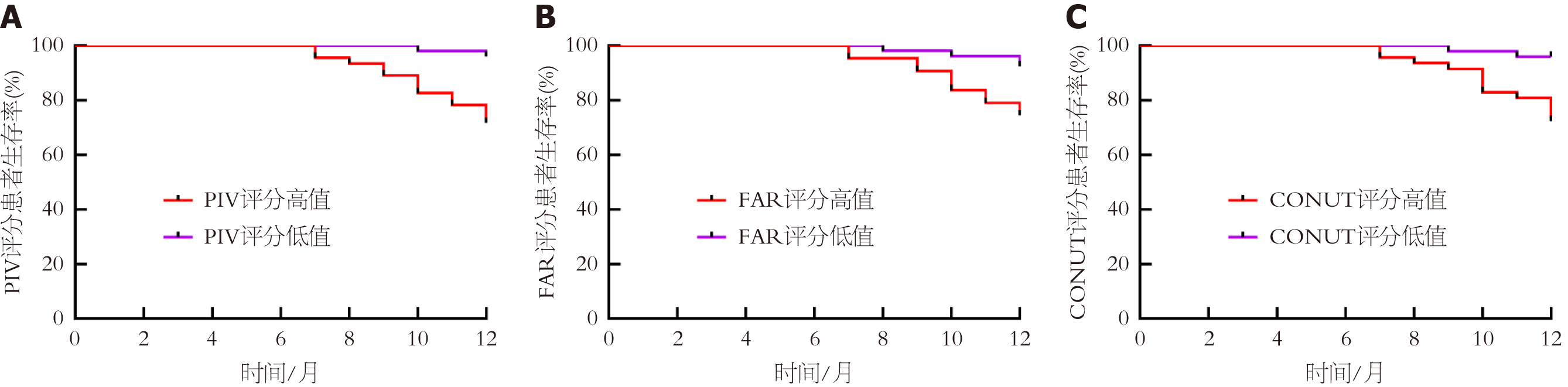
预后不良组肿瘤直径、临床分期Ⅳ期、有淋巴结转移占比、PIV、FAR、CONUT评分高于预后良好组(P<0.05); PIV、FAR、CONUT评分与化疗预后呈正相关(P<0.05); PIV、FAR、CONUT评分是结直肠癌患者化疗预后的独立影响因素(P<0.05); PIV、FAR、CONUT评分联合预测结直肠癌患者化疗预后的受试者工作特征曲线及曲线下面积为0.921, 约登指数为0.734, 敏感度为90.62%, 特异度为82.81%, 预测价值高于各指标单独检测(P<0.05); PIV、FAR、CONUT评分高值患者1年生存率低于低值患者(P<0.05).
PIV、FAR、CONUT评分与结直肠癌患者化疗预后有关, 各指标联合可为临床预测患者化疗预后提供一定参考价值.
核心提要: 本研究通过检测化疗患者泛免疫炎症值、纤维蛋白原与白蛋白比值、控制营养状态评分, 并分析各指标与患者化疗预后的相关性, 旨在为临床预测患者化疗预后提供参考.
引文著录: 钟彩琼, 张宁波, 朱剑. PIV、FAR联合CONUT评分预测结直肠癌患者化疗预后的研究. 世界华人消化杂志 2025; 33(5): 373-380
Revised: May 9, 2025
Accepted: May 16, 2025
Published online: May 28, 2025
Colorectal cancer has a high incidence and mortality rate. Radical surgery is currently the main clinical treatment method, while chemotherapy is one of the main treatment methods for patients who do not meet the surgical indications. However, some patients may still have recurrence and metastasis after chemotherapy due to serious conditions and other reasons.
To evaluate the predictive value of pan-immune inflammation value (PIV), fibrinogen to albumin ratio (FAR), and controlled nutritional status (CONUT) score, individually and in combination, for the prognosis of patients with colorectal cancer undergoing chemotherapy.
A prospective study was conducted on 98 colorectal cancer patients who underwent chemotherapy treatment at The First People's Hospital of Linping District from January 2021 to January 2024. Based on the prognosis after chemotherapy, the patients were categorized into two groups: Good prognosis and poor prognosis. The clinical data, as well as PIV, FAR, and CONUT score, were compared between the two groups. The correlation between each indicator and patient prognosis was analyzed, and the factors influencing the prognosis of patients undergoing chemotherapy were investigated. The predictive value of PIV, FAR, and CONUT score, individually and jointly, for prognosis was also analyzed. Kaplan-Meier curves were used to analyze the survival of patients with different PIV, FAR, and CONUT scores.
The poor prognosis group had a high proportion of patients with greater tumor diameter, clinical stage IV, lymph node metastasis, and high PIV, FAR, and CONUT score than the good prognosis group (P < 0.05). PIV, FAR, and CONUT score were positively correlated with prognosis of patients undergoing chemotherapy (P < 0.05). PIV, FAR, and CONUT score were independent factors affecting the prognosis of colorectal cancer patients undergoing chemotherapy (P < 0.05). The area under the curve, Youden's index, sensitivity, and specificity of the combined prediction of PIV, FAR, and CONUT score for the prognosis of colorectal cancer patients undergoing chemotherapy were 0.921%, 0.734%, 90.62%, and 82.81%, respectively, indicating higher predictive value than individual indicators (P < 0.05). Patients with high PIV, FAR, and CONUT score had a lower 1-year survival rate than those with low values (P < 0.05).
PIV, FAR, and CONUT score are associated with the prognosis of patients with colorectal cancer undergoing chemotherapy, and the combination of these indicators can provide appreciated reference value for clinicians in predicting the prognosis of these patients.
- Citation: Zhong CQ, Zhang NB, Zhu J. Prognostic prediction for colorectal cancer patients undergoing chemotherapy using PIV, FAR, and CONUT score. Shijie Huaren Xiaohua Zazhi 2025; 33(5): 373-380
- URL: https://www.wjgnet.com/1009-3079/full/v33/i5/373.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i5.373
结直肠癌是临床常见的消化系统恶性肿瘤, 具有较高的发病率和死亡率[1]. 根治性手术是目前临床主要治疗手段, 而化疗是不符合手术适应症的患者主要治疗手段之一, 但部分患者化疗后可能由于病情较重等原因, 仍存在一定的复发转移率[2,3]. 目前临床研究多倾向于采用血清肿瘤标志物对结直肠癌患者化疗预后进行预测, 但预测结果特异性较低, 寻找可有效预测结直肠癌患者化疗预后的相关指标, 对后续治疗方案的制定有重要临床意义[4,5]. 泛免疫炎症值(pan-immune inflammation value, PIV)属于新型免疫炎症标志物, 通过综合多种血常规指标, 有效反映机体炎症水平、免疫状态. 研究显示, PIV与多种实体肿瘤患者的预后关系密切[6,7]. 纤维蛋白原与白蛋白比值(fibrinogen to albumin ratio, FAR)是以患者营养状况和凝血功能为基础的指标, 与肿瘤发生发展有关[8]. 控制营养状态(controlled nutritional status, CONUT)评分是用于评估患者免疫情况和营养状态的指标, 常用于预测结直肠癌患者术后并发症的发生风险[9]. 目前国内研究中, 上述各指标多用于结直肠癌的诊断或术后预后的预测中, 较少涉及化疗患者预后预测, 基于此, 本研究通过检测化疗患者PIV、FAR、CONUT评分, 并分析各指标与患者化疗预后的相关性, 旨在为临床预测患者化疗预后提供参考.
一般资料: 前瞻性选取2021-01/2024-01于杭州市临平区第一人民医院行化疗治疗的结直肠癌患者98例进行研究. 纳入标准: (1)经临床病理检查确诊为结直肠癌, 且符合《中国结直肠癌诊疗规范(2017年版)》[10]相关诊断标准; (2)化疗前无其他放化疗、免疫治疗、靶向治疗史; (3)肿瘤下缘距肛缘>5 cm; (4)预期生存时间≥6 mo; (5)临床分期Ⅲ-Ⅳ期; (6)签署知情同意书. 排除标准: (1)合并其他种类恶性肿瘤; (2)近期有输血、大量失血史; (3)存在严重心脑血管疾病、肝肾功能障碍, 或其他可能影响本研究指标的疾病; (4)近期有免疫抑制剂、抗凝药物使用史; (5)存在精神类疾病.
1.2.1 资料收集: 由两位经统一培训后的医护人员对患者资料进行收集, 包括性别、年龄、体质量指数(body mass index, BMI)、既往史(饮酒史、糖尿病、高血压、高脂血症)、肿瘤类型(结肠癌、直肠癌)、组织学类型(腺癌、粘液腺癌)、肿瘤直径、临床分期、淋巴结转移、分化程度及化疗方案(FOLFOX、FOLFIRI)情况. 其中, BMI = 体重(kg)/身高2(m2); 饮酒史为每周饮酒>1次且每次饮酒量≥50 mL; 糖尿病定义为存在既往糖尿病史并使用降糖药, 或本次入院时快速血糖检测结果>7.0 mol/L, 或随机血糖>11.1.0 mol/L; 高血压定义为存在既往高血压史且服用降压药, 收缩压≥140 mmHg, 或舒张压≥90 mmHg; 高脂血症定义为既往高脂血症史并使用降脂药物, 或本次入院胆固醇>5.2 mmol/L或三酰甘油>1.7 mmol/L; 临床分期采用结直肠癌TNM分期[11]进行评估. 收集统计患者PIV、FAR值及CONUT评分情况, 采集患者入院时外周静脉血3 mL于抗凝管中, 采用全自动血细胞分析仪(济南希森美康医用电子有限公司, 鲁械注准20182220002, 型号XS-500ix)检测中性粒细胞计数、单核细胞计数、血小板计数、淋巴细胞计数, 计算PIV = 中性粒细胞计数×单核细胞计数×血小板计数/淋巴细胞计数; 采用全自动凝血分析仪(北京倍肯恒业科技发展股份有限公司, 京械注准20182220238, 型号MRX-auto400)检测血浆纤维蛋白原, 采用全自动生化分析仪(武汉尚宜康健科技有限公司, 鄂械注准20182222359, 型号KEA-TR100)检测血浆白蛋白及总胆固醇, FAR = 血浆纤维蛋白原/血浆白蛋白, 并依据相关标准[12], 以血浆白蛋白、淋巴细胞计数、总胆固醇评分总和计算CONUT评分.
1.2.2 化疗预后评估: 依据患者实际情况及《中国结直肠癌诊疗规范(2017年版)》[10]相关标准对患者进行治疗, 化疗方案包括FOLFOX和FOLFIRI. 化疗后随访12 mo, 随访期间发生复发、转移或死亡的患者纳入预后不良组, 否则纳入预后良好组.
(1)比较两组临床资料, 包括性别、年龄、BMI、既往史(饮酒史、糖尿病、高血压、高脂血症)、肿瘤类型(结肠癌、直肠癌)、组织学类型(腺癌、粘液腺癌)、肿瘤直径、临床分期、淋巴结转移、分化程度及化疗方案(FOLFOX、FOLFIRI)情况; (2)比较两组PIV、FAR、CONUT评分; (3)分析PIV、FAR、CONUT评分与患者化疗预后的相关性; (4)分析患者化疗预后的影响因素; (5)分析PIV、FAR、CONUT评分单独及联合评估对患者化疗预后的预测价值; (6)分析PIV、FAR、CONUT评分高值与低值患者的1年生存情况.
统计学处理 采用SPSS 22.0统计学软件进行分析, 计数资料以n(%)表示, 行χ2检验, 计量资料以(mean±SD)表示, 行t检验; 采用点二列相关性分析指标与患者化疗预后的相关性; 采用Logistic回归分析患者化疗预后的影响因素, 并采用方差膨胀因子(variance inflation factor, VIF)进行多重共线性的诊断, 当VIF>10, 则认为自变量间存在共线性; 采用受试者工作特征曲线分析各指标单独及联合的预测价值; 采用卡普兰-迈耶曲线(Kaplan-Meier, KM)分析各指标高值、低值患者1年生存率情况; P<0.05为差异有统计学意义.
化疗后随访12 mo, 失访2例, 预后良好64例, 预后不良32例, 其中复发转移22例, 死亡10例. 预后不良组与预后良好组性别、年龄、BMI、既往史、肿瘤类型、组织学类型、分化程度、化疗方案比较, 差异无统计学意义(P>0.05); 预后不良组肿瘤直径、临床分期、淋巴结转移与预后良好组比较, 差异有统计学意义(P<0.05), 见表1.
| 资料 | 预后不良组(n = 32) | 预后良好组(n = 64) | t/χ2 | P值 |
| 性别 | 0.086 | 0.770 | ||
| 男 | 18(56.25) | 38(59.38) | ||
| 女 | 14(43.75) | 26(40.63) | ||
| 年龄(岁) | 51.13±3.76 | 50.59±4.02 | 0.634 | 0.528 |
| BMI(kg/m2) | 21.08±1.44 | 20.87±1.51 | 0.652 | 0.516 |
| 既往史 | ||||
| 饮酒史 | 13(40.63) | 24(37.50) | 0.088 | 0.767 |
| 糖尿病 | 4(12.50) | 7(10.94) | 0.013 | 0.910 |
| 高血压 | 8(25.00) | 18(28.13) | 0.105 | 0.745 |
| 高脂血症 | 8(25.00) | 15(23.44) | 0.029 | 0.866 |
| 肿瘤类型 | 0.190 | 0.663 | ||
| 结肠癌 | 19(59.38) | 35(54.69) | ||
| 直肠癌 | 13(40.63) | 29(45.31) | ||
| 组织学类型 | 0.107 | 0.743 | ||
| 腺癌 | 27(84.38) | 57(89.06) | ||
| 黏液腺癌 | 5(15.63) | 7(10.94) | ||
| 肿瘤直径(cm) | 4.38±0.61 | 3.72±0.48 | 5.791 | <0.001 |
| 临床分期 | 6.776 | 0.009 | ||
| Ⅲ期 | 11(34.38) | 40(62.50) | ||
| Ⅳ期 | 21(65.63) | 24(37.50) | ||
| 淋巴结转移 | 6.023 | 0.014 | ||
| 无 | 10(31.25) | 37(57.81) | ||
| 有 | 22(68.75) | 27(42.19) | ||
| 分化程度 | 0.091 | 0.763 | ||
| 中高分化 | 20(62.50) | 42(65.63) | ||
| 低分化 | 12(37.50) | 22(34.38) | ||
| 化疗方案 | 0.118 | 0.731 | ||
| FOLFOX | 24(75.00) | 50(78.13) | ||
| FOLFIRI | 8(25.00) | 14(21.88) |
预后不良组PIV、FAR、CONUT评分高于预后良好组(P<0.05), 见表2.
| 组别 | 例数 | PIV | FAR | CONUT评分(分) |
| 预后不良组 | 32 | 618.27±164.78 | 0.14±0.04 | 5.38±1.37 |
| 预后良好组 | 64 | 475.93±121.30 | 0.10±0.03 | 4.21±1.05 |
| t | 4.793 | 5.494 | 4.637 | |
| P值 | <0.001 | <0.001 | <0.001 |
点二列相关性分析, PIV、FAR、CONUT评分与化疗预后(预后良好 = 0, 预后不良 = 1)呈正相关(P<0.05), 见表3.
| 指标 | 化疗预后 | |
| rpb | P值 | |
| PIV | 0.735 | <0.001 |
| FAR | 0.718 | <0.001 |
| CONUT评分 | 0.707 | <0.001 |
以结直肠癌患者化疗预后作为因变量(预后良好 = 0, 预后不良 = 1), 肿瘤直径(以原值录入)、临床分期(Ⅲ期 = 1, Ⅳ期 = 2)、淋巴结转移(无 = 0, 有 = 1)、PIV(以原值录入)、FAR(以原值录入)、CONUT评分(以原值录入)作为自变量, Logistic回归分析, 肿瘤直径(以原值)、临床分期、淋巴结转移、PIV、FAR、CONUT评分是结直肠癌患者化疗预后的独立影响因素(P<0.05), 经多重共线性诊断, VIF>10, 提示存在多重共线性. 将肿瘤直径、临床分期、淋巴结转移剔除, 结果显示, PIV、FAR、CONUT评分是结直肠癌患者化疗预后的独立影响因素(P<0.05), 且VIF<10, 不存在多重共线性, 见表4.
| 变量 | β | S.E. | Wald χ2 | OR | 95%CI | P值 |
| 模型1 | ||||||
| 肿瘤直径 | 0.783 | 0.223 | 12.332 | 2.188 | 1.593-3.006 | <0.001 |
| 临床分期 | ||||||
| Ⅲ期 | 1.000 | |||||
| Ⅳ期 | 1.719 | 0.410 | 17.577 | 5.579 | 2.045-15.218 | <0.001 |
| 淋巴结转移 | ||||||
| 无 | 1.000 | |||||
| 有 | 1.819 | 0.424 | 18.412 | 6.168 | 2.186-17.402 | <0.001 |
| PIV | 0.754 | 0.205 | 13.517 | 2.125 | 1.627-2.775 | <0.001 |
| FAR | 0.664 | 0.185 | 12.885 | 1.943 | 1.503-2.511 | <0.001 |
| CONUT评分 | 0.585 | 0.172 | 11.562 | 1.795 | 1.383-2.329 | <0.001 |
| 常数项 | - | - | <0.001 | |||
| 模型2 | ||||||
| PIV | 0.687 | 0.190 | 13.067 | 1.987 | 1.511-2.614 | <0.001 |
| FAR | 0.609 | 0.192 | 10.073 | 1.839 | 1.428-2.369 | <0.001 |
| CONUT评分 | 0.507 | 0.158 | 10.295 | 1.660 | 1.302-2.117 | <0.001 |
| 常数项 | - | - | <0.001 |
以预后良好组作为阴性组, 预后不良组作为阳性组, PIV、FAR、CONUT评分作为源数据, 绘制受试者工作特征曲线(receiver operating characteristic, ROC)曲线, 结果显示, PIV、FAR、CONUT评分预测结直肠癌患者化疗预后的受试者工作特征曲线及曲线下面积(area under the curve, AUC)为0.770、0.715、0.740, 约登指数为0.453、0.453、0.391, 最佳截断值为529.66、0.12、4.68分, 敏感度为78.12%、75.00、75.00%, 特异度为67.19%、70.31%、64.06%; 根据Logistic回归分析模型2构建PIV、FAR、CONUT评分联合预测模型, 绘制ROC曲线, 结果显示, PIV、FAR、CONUT评分联合预测结直肠癌患者化疗预后的AUC为0.921, 约登指数为0.734, 敏感度为90.62%, 特异度为82.81%, 预测价值显著提升(Z = 3.081、3.869、3.341, P<0.05), 见图1.
根据ROC曲线获取PIV、FAR、CONUT评分最佳截断值为界分为低值与高值. KM曲线分析, PIV、FAR、CONUT评分高值患者1年生存率71.74%(33/46)、74.42%(32/43)、72.34%(34/47)低于低值患者96.00%(48/50)、92.45%(49/53)、95.92%(47/49)(Log-rank = 3.114、2.867、3.023, P<0.05), 见图2.
随着经济社会的快速发展, 人们生活习惯、饮食习惯发生改变, 导致结直肠癌的发病率和死亡率呈现一定上升趋势[13]. 有学者指出, 结直肠癌的发生发展与机体免疫炎症反应和营养状态关系密切, 而炎症反应可促进机体释放促肿瘤因子, 并诱导免疫抑制影响肿瘤微环境, 导致患者病情加剧[14,15]. 目前临床多针对结直肠癌患者术后并发症进行评估, 而本研究则侧重于患者化疗预后进行分析, 旨在为结直肠癌化疗患者的后续治疗提供一定参考.
免疫炎症生物标志物是反映机体炎症和免疫状态平衡情况的指标, 而PIV是学者通过整合中性粒细胞计数、单核细胞计数、血小板计数、淋巴细胞计数开发出的新型免疫炎症生物标志物, 临床研究认为, PIV与多种恶性肿瘤的临床病理特征及预后关系密切[16,17]. 本研究结果显示, 预后不良组PIV值显著高于预后良好组, 通过采用点二列相关性分析显示, PIV与患者化疗预后呈正相关, 提示PIV与患者化疗预后有关, 与Efil等[18]研究结果类似. 原因在于, 肿瘤可通过分泌炎症介质促进自身进展, 同时, 炎症因子的大量产生可激活全身炎症反应, 影响机体免疫平衡状态和组织修复能力, 而失衡的免疫环境可显著升高PIV值[19,20]. PIV是衡量全身炎症状态的综合指标, 化疗前异常升高的PIV可能提示机体免疫状态异常, 甚至损害血管内皮功能, 影响组织供氧和修复功能, 提高患者化疗预后不良风险[21]. 通过结果分析, 本研究发现, PIV是结直肠癌化疗预后的影响因素, 进一步表明PIV值与患者化疗预后有关. 临床可通过在化疗前检测患者PIV值以评估机体免疫炎症水平, 并对PIV值异常升高患者进行进一步检查并制定针对性治疗方案, 尽可能改善患者预后.
FAR是纤维蛋白原与白蛋白的比值, 有学者指出, 纤维蛋白原可参与肿瘤细胞增殖、凋亡、血管生成等重要病理生理学过程, 而白蛋白对维持细胞稳定增殖有一定影响, 同时, 白蛋白异常降低是肿瘤相关疾病患者预后不良的危险因素[22,23]. 本研究结果显示, 预后不良组FAR值显著高于预后良好组, 提示FAR与结直肠癌患者化疗预后有关, 与Li等[24]研究结果基本一致. 原因在于, 纤维蛋白原是凝血系统相关指标之一, 可作为癌细胞外基质框架, 诱导生长因子进入癌细胞以加速癌细胞增殖和侵袭[25]. 白蛋白也可用于反映患者营养状态, 而肿瘤患者多存在营养不良情况, 极低的白蛋白水平与患者免疫功能异常有关[26]. 故化疗前FAR值异常提升, 提示癌细胞进展风险较高, 患者免疫功能下降, 可能提高患者化疗预后不良风险. 本研究结果显示, FAR与结直肠癌患者化疗预后存在正相关关系, 且为患者化疗预后的影响因素, 进一步表明FAR与结直肠癌患者化疗预后有关. 临床工作中, 对于化疗前FAR值较高的患者应进行重点关注, 因为相关患者化疗后复发转移风险较高, 临床需进行进一步辅助治疗以改善患者预后.
CONUT评分是临床常用快速、客观的营养筛查工具, 通过检测白蛋白、淋巴细胞计数和总胆固醇指标水平对患者营养状态进行评估, 对临床患者身体状况的评估有一定应用价值[27,28]. 本研究结果显示, 随着预后转好, CONUT评分逐渐升高, 且CONUT评分与患者化疗预后呈正相关, 为患者化疗预后的影响因素, 提示CONUT评分与结直肠癌患者化疗预后有关. Wang等[29]研究结果指出, 高CONUT评分患者住院时间有明显延长, 是因为高CONUT评分患者营养不良情况更严重, 该情况可能导致患者化疗后死亡率显著升高. 目前临床对CONUT评分的研究侧重于对患者生存期的分析, 但仅针对生存期评估患者预后可能导致结果较片面, 本研究中预后不良组纳入了复发转移患者, 结果仍显示CONUT评分与患者化疗预后有关, 提示临床可扩大对CONUT评分的应用范围.
由于各指标侧重点不同, 临床上单独应用可能存在一定局限性, 基于上述结果, 本研究创新性的以Logistic回归分析模型为基础, 将PIV、FAR、CONUT评分进行联合以预测患者化疗预后, 结果显示, 三者联合预测的AUC值显著高于各指标单独预测, 提示各指标联合可为临床预测患者化疗预后提供一定参考价值. 虽然本研究采用前瞻性研究方法, 可在一定程度上提高研究的准确性与科学性, 但纳入病例数较少, 可能导致结果存在一定偏差, 未来需要进一步开展大样本、多中心研究, 以进一步明确PIV、FAR、CONUT评分联合对结直肠癌化疗预后的预测价值.
综上所述, PIV、FAR、CONUT评分与结直肠癌患者化疗预后有关, 临床可通过联合各指标检测为患者化疗预后预测提供参考.
结直肠癌具有较高的发病率和死亡率. 根治性手术是目前临床主要治疗手段, 而化疗是不符合手术适应症的患者主要治疗手段之一, 但部分患者化疗后可能由于病情较重等原因, 仍存在一定的复发转移率.
目前国内研究中, 上述各指标多用于结直肠癌的诊断或术后预后的预测中, 较少涉及化疗患者预后预测.
探讨泛免疫炎症值、纤维蛋白原与白蛋白比值、控制营养状态评分单独及联合检测对结直肠癌患者化疗预后的预测价值.
选取2021-01/2024-01于杭州市临平区第一人民医院行化疗治疗的结直肠癌患者98例进行前瞻性研究, 依据化疗后随访情况, 将患者分为预后良好组、预后不良组. 分析泛免疫炎症值(pan-immune inflammation value, PIV)、纤维蛋白原与白蛋白比值(fibrinogen to albumin ratio, FAR)、控制营养状态(controlled nutritional status, CONUT)评分单独及联合对化疗预后的预测价值, 采用卡普兰-迈耶曲线分析不同PIV、FAR、CONUT评分患者的生存情况.
三者联合预测的受试者工作特征曲线及曲线下面积值显著高于各指标单独预测, 提示各指标联合可为临床预测患者化疗预后提供一定参考价值. 虽然本研究采用前瞻性研究方法, 可在一定程度上提高研究的准确性与科学性, 但纳入病例数较少, 可能导致结果存在一定偏差, 未来需要进一步开展大样本、多中心研究, 以进一步明确PIV、FAR、CONUT评分联合对结直肠癌化疗预后的预测价值.
PIV、FAR、CONUT评分与结直肠癌患者化疗预后有关, 临床可通过联合各指标检测为患者化疗预后预测提供参考.
本研究则侧重于患者化疗预后进行分析, 旨在为结直肠癌化疗患者的后续治疗提供一定参考.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C, C
D级 (一般): D, D
E级 (差): 0
科学编辑: 刘继红 制作编辑:郑晓梅
| 1. | Huang A, Sun Z, Hong H, Yang Y, Chen J, Gao Z, Gu J. Novel hypoxia- and lactate metabolism-related molecular subtyping and prognostic signature for colorectal cancer. J Transl Med. 2024;22:587. [PubMed] [DOI] |
| 2. | Riesco-Martinez MC, Modrego A, Espinosa-Olarte P, La Salvia A, Garcia-Carbonero R. Perioperative Chemotherapy for Liver Metastasis of Colorectal Cancer: Lessons Learned and Future Perspectives. Curr Treat Options Oncol. 2022;23:1320-1337. [PubMed] [DOI] |
| 3. | Wang H, Yang W, Qin Q, Yang X, Yang Y, Liu H, Lu W, Gu S, Cao X, Feng D, Zhang Z, He J. E3 ubiquitin ligase MAGI3 degrades c-Myc and acts as a predictor for chemotherapy response in colorectal cancer. Mol Cancer. 2022;21:151. [PubMed] [DOI] |
| 4. | Manojlovic N, Savic G, Nikolic B, Rancic N. Dynamic monitoring of carcinoembryonic antigen, CA19-9 and inflammation-based indices in patients with advanced colorectal cancer undergoing chemotherapy. World J Clin Cases. 2022;10:899-918. [PubMed] [DOI] |
| 5. | Lehtomäki K, Heervä E, Kellokumpu-Lehtinen PL, Mustonen H, Salminen T, Joensuu H, Hermunen K, Boisen MK, Johansen JS, Haglund C, Osterlund P. Transient Changes in Serum CEA, CA19-9, CRP, YKL-40, and IL-6 during Adjuvant Chemotherapy and Survival of Patients with Colorectal Cancer. Int J Mol Sci. 2023;24. [PubMed] [DOI] |
| 6. | 刘 贤明, 彭 丽丽, 任 燕燕, 王 发艳, 张 洪珍. HER2阴性晚期胃癌患者外周血LMR、SII与PIV对生存结局的预测价值及预后影响因素研究. 临床误诊误治. 2022;35:47-53. [DOI] |
| 7. | Liao W, Li J, Feng W, Kong W, Shen Y, Chen Z, Yang H. Pan-immune-inflammation value: a new prognostic index in epithelial ovarian cancer. BMC Cancer. 2024;24:1052. [PubMed] [DOI] |
| 8. | Sun H, Ma J, Lu J, Yao ZH, Ran HL, Zhou H, Yuan ZQ, Huang YC, Xiao YY. Fibrinogen-to-albumin ratio predicts overall survival of hepatocellular carcinoma. World J Gastrointest Oncol. 2023;15:1662-1672. [PubMed] [DOI] |
| 9. | Martínez-Escribano C, Arteaga Moreno F, Pérez-López M, Cunha-Pérez C, Belenguer-Varea Á, Cuesta Peredo D, Blanco González FJ, Tarazona-Santabalbina FJ. Malnutrition and Increased Risk of Adverse Outcomes in Elderly Patients Undergoing Elective Colorectal Cancer Surgery: A Case-Control Study Nested in a Cohort. Nutrients. 2022;14. [PubMed] [DOI] |
| 10. | 国家卫生和计划生育委员会《中国结直肠癌诊疗规范(年版)》专家组. 中国结直肠癌诊疗规范(2017年版). 中华临床医师杂志(电子版). 2018;12:3-23. [DOI] |
| 11. | Mahmoud NN. Colorectal Cancer: Preoperative Evaluation and Staging. Surg Oncol Clin N Am. 2022;31:127-141. [PubMed] [DOI] |
| 12. | Cao LY, Cheng S, Lin L, Chen MX. Effect of Controlling Nutritional Status Score (CONUT) and Prognostic Nutritional Index (PNI) on patients after spinal tuberculosis surgery. Sci Rep. 2022;12:16056. [PubMed] [DOI] |
| 13. | GBD 2019 Colorectal Cancer Collaborators. Global, regional, and national burden of colorectal cancer and its risk factors, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet Gastroenterol Hepatol. 2022;7:627-647. [PubMed] [DOI] |
| 14. | Li H, Wang K, Hao M, Liu Y, Liang X, Yuan D, Ding L. The role of intestinal microecology in inflammatory bowel disease and colorectal cancer: A review. Medicine (Baltimore). 2023;102:e36590. [PubMed] [DOI] |
| 15. | Ye J, Hu Y, Chen X, Chang C, Li K. Comparative Effects of Different Nutritional Supplements on Inflammation, Nutritional Status, and Clinical Outcomes in Colorectal Cancer Patients: A Systematic Review and Network Meta-Analysis. Nutrients. 2023;15. [PubMed] [DOI] |
| 16. | Arici MO, Kivrak Salim D, Kocer M, Alparslan AS, Karakas BR, Ozturk B. Predictive and Prognostic Value of Inflammatory and Nutritional Indexes in Patients with Breast Cancer Receiving Neoadjuvant Chemotherapy. Medicina (Kaunas). 2024;60. [PubMed] [DOI] |
| 17. | Wang QY, Zhong WT, Xiao Y, Lin GL, Lu JY, Xu L, Zhang GN, Du JF, Wu B. Pan-immune-inflammation value as a prognostic biomarker for colon cancer and its variation by primary tumor location. World J Gastroenterol. 2024;30:3823-3836. [PubMed] [DOI] |
| 18. | Efil SC, Guner G, Guven DC, Celikten B, Celebiyev E, Taban H, Akyol A, Isik A, Kilickap S, Yalcin S, Dizdar O. Prognostic and predictive value of tumor infiltrating lymphocytes in combination with systemic inflammatory markers in colon cancer. Clin Res Hepatol Gastroenterol. 2023;47:102171. [PubMed] [DOI] |
| 19. | Bhat AA, Nisar S, Singh M, Ashraf B, Masoodi T, Prasad CP, Sharma A, Maacha S, Karedath T, Hashem S, Yasin SB, Bagga P, Reddy R, Frennaux MP, Uddin S, Dhawan P, Haris M, Macha MA. Cytokine- and chemokine-induced inflammatory colorectal tumor microenvironment: Emerging avenue for targeted therapy. Cancer Commun (Lond). 2022;42:689-715. [PubMed] [DOI] |
| 20. | Long L, Xiong B, Luo Z, Yang H, She Q. Association between Pan-Immune Inflammation Value and Sarcopenia in Hypertensive Patients, NHANES 1999-2018. J Clin Hypertens (Greenwich). 2025;27:e14944. [PubMed] [DOI] |
| 21. | Ning X, Wu C, Song B, Wang HM, Jin HZ. Evaluation of hematological inflammatory parameters in patients with palmoplantar pustulosis. Int J Dermatol. 2024;63:1713-1719. [PubMed] [DOI] |
| 22. | Mai RY, Bai T, Luo XL, Wu GB. Preoperative fibrinogen-to-albumin ratio predicts the prognosis of patients with hepatocellular carcinoma subjected to hepatectomy. BMC Gastroenterol. 2022;22:261. [PubMed] [DOI] |
| 23. | Chen W, Shan B, Zhou S, Yang H, Ye S. Fibrinogen/albumin ratio as a promising predictor of platinum response and survival in ovarian clear cell carcinoma. BMC Cancer. 2022;22:92. [PubMed] [DOI] |
| 24. | Li K, Yan J, Zhang H, Lu C, Wang W, Guo M, Zhang X, Zhang Z. Prognostic value of preoperative white blood cell to hemoglobin ratio and fibrinogen to albumin ratio in patients with colorectal cancer. Medicine (Baltimore). 2024;103:e37031. [PubMed] [DOI] |
| 25. | Shen Y, Li Y, Wang Z, Xu W, Wang W, Chen X. The prognostic value of FAR and a novel FAR-CA125 score in resectable gastric signet ring cell carcinoma patients. J Cancer Res Clin Oncol. 2023;149:9597-9608. [PubMed] [DOI] |
| 26. | Han R, Tian Z, Jiang Y, Guan G, Sun X, Yu Y, Zhang L, Zhou J, Jing X. Prognostic significance of systemic immune-inflammation index and platelet-albumin-bilirubin grade in patients with pancreatic cancer undergoing radical surgery. Gland Surg. 2022;11:576-587. [PubMed] [DOI] |
| 27. | Di Vincenzo O, D'Elia L, Ballarin G, Pasanisi F, Scalfi L. Controlling Nutritional Status (CONUT) score and the risk of mortality or impaired physical function in stroke patients: A systematic review and meta-analysis. Nutr Metab Cardiovasc Dis. 2023;33:1501-1510. [PubMed] [DOI] |
| 28. | Xue W, Hu X, Zhang Y. The Association of Controlling Nutritional Status (CONUT) Score with Survival in Patients with Surgically Treated Renal Cell Carcinoma and Upper Tract Urothelial Carcinoma: A Systematic Review and Meta-Analysis. Nutr Cancer. 2022;74:1907-1916. [PubMed] [DOI] |