修回日期: 2025-11-13
接受日期: 2025-12-12
在线出版日期: 2025-12-28
约30%-50%结直肠癌患者在术后可能会出现局部复发或远处转移. 可见了解结直肠癌患者复发转移的相关因素, 对改善患者预后具有积极意义.
基于增强计算机断层扫描(computed tomography, CT)、临床资料构建结直肠癌预后结局的Lasso-Logistic模型, 旨在为评估患者预后提供参考.
选取舟山妇女儿童医院、舟山医院2021-01/2024-11收治的260例结直肠癌患者作为研究对象, 根据患者预后情况分为预后良好组(208例)、预后不良组(52例). 比较两组临床资料和增强CT特征, Lasso-Logistic筛选结直肠癌患者预后的影响因素, 构建结直肠癌患者预后的列线图, 并对其进行验证.
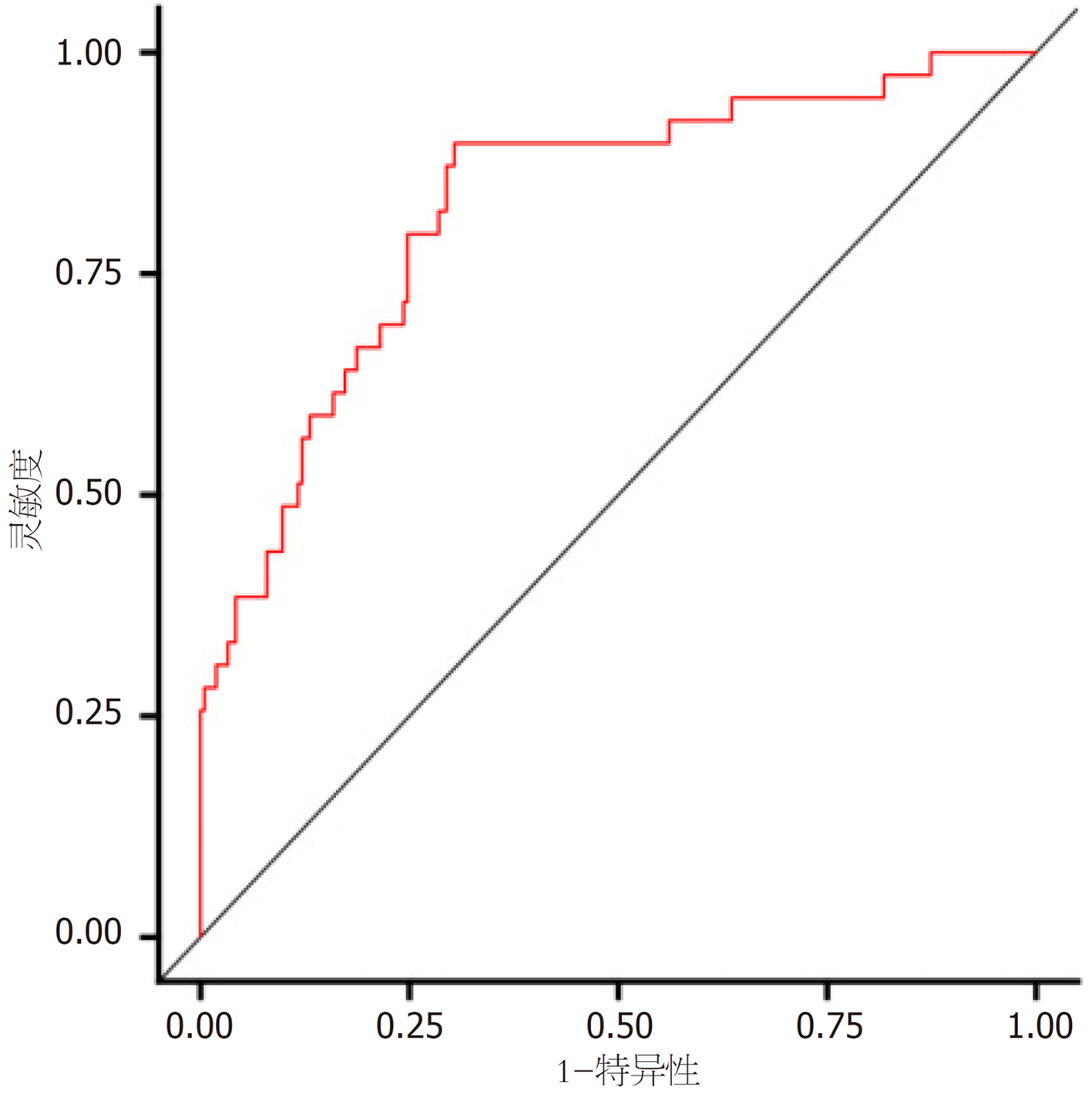
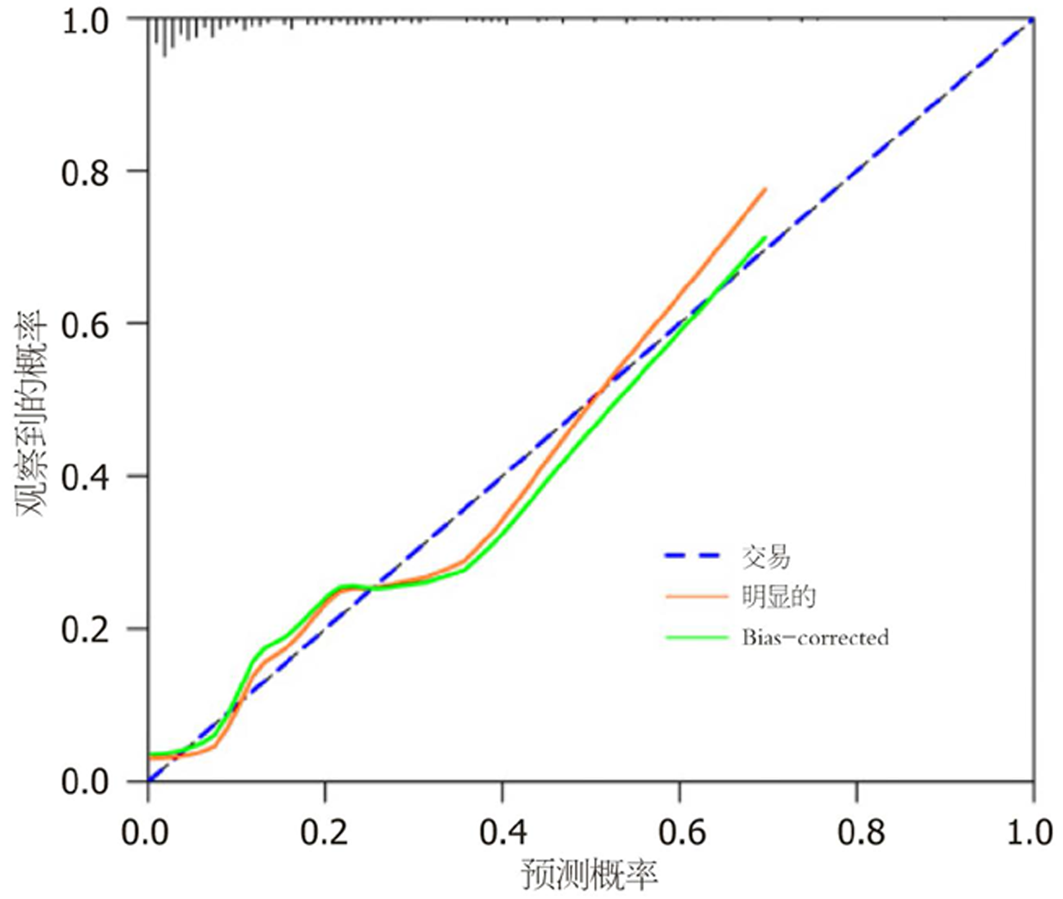
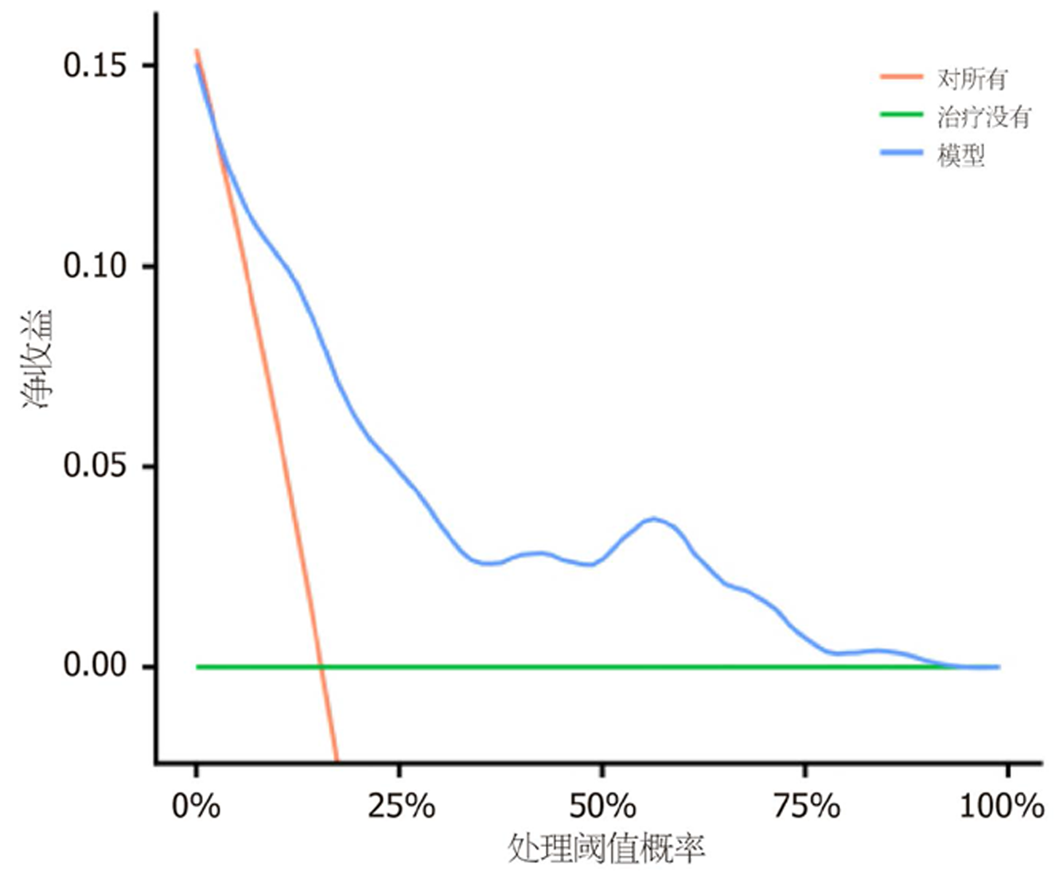
两组癌胚抗原(carcinoembryonic antigen, CEA)、糖抗原(carbohydrate antigen, CA)19-9、平扫CT值、动脉期CT值、静脉期CT值、动脉期CT强化值、静脉期CT强化值、强化CT值比较, 差异具有统计学意义, 差异具有统计学意义(P<0.05); Lasso回归筛选的变量分别为CEA、CA19-9、动脉期CT强化值、静脉期CT强化值、强化CT值; Logistic回归结果显示, CEA、CA19-9、动脉期CT强化值、静脉期CT强化值、强化CT值是影响结直肠癌患者预后不良的影响因素(P<0.05); 根据Lasso-Logistic回归获得变量绘制患者预后的列线图, 校准曲线、受试者工作特征曲线及决策曲线结果显示, 该模型具有良好的区分度和适用性.
结直肠癌患者预后的影响因素分别为CEA、CA19-9、动脉期CT强化值、静脉期CT强化值、强化CT值, 据此构建患者预后的列线图, 该模型具有良好的预测价值.
核心提要: Lasso-Logistic模型能有效处理高维度数据, 筛选关键的变量, 在肿瘤预测预后模型表现出独特优势, 同时还能避免过拟合现象, 提高模型预测的准确性. 然而基于增强计算机断层扫描和临床资料构建结直肠癌患者预后Lasso-Logistic模型的研究缺乏. 基于此, 本研究对其展开探究, 旨在为评估结直肠癌患者预后提供佐证.
引文著录: 孙文, 方金忠, 吴帆, 徐嘉学. 基于增强CT、临床资料构建结直肠癌预后结局的Lasso-Logistic模型. 世界华人消化杂志 2025; 33(12): 1022-1030
Revised: November 13, 2025
Accepted: December 12, 2025
Published online: December 28, 2025
About 30%-50% of patients with colorectal cancer may develop local recurrence or distant metastasis after surgery. Understanding the factors related to recurrence and metastasis in patients with colorectal cancer has positive significance in improving the prognosis of patients.
To construct a Lasso-Logistic model for predicting the prognosis of colorectal cancer based on enhanced computed tomography (CT) and clinical data, aiming to provide a reference for evaluating patient prognosis.
A total of 260 patients with colorectal cancer admitted to Zhoushan Women and Children's Hospital and Zhoushan Hospital from January 2021 to November 2024 were selected as the research subjects, and they were assigned to either a good prognosis group (208 cases) or a poor prognosis group (52 cases) according to their prognosis. The clinical data and enhanced CT features were compared between the two groups. Lasso-Logistic regression was used to screen the factors affecting the prognosis of colorectal cancer patients, and a nomogram was then constructed and validated.
There were significant differences in carcinoembryonic antigen (CEA), carbohydrate antigen 19-9 (CA19-9), plain scan CT value, arterial phase CT value, venous phase CT value, CT enhancement value in the arterial phase, CT enhancement value in the venous phase, and total CT enhancement value between the two groups (P < 0.05). The variables screened by Lasso regression were CEA, CA19-9, CT enhancement value in the arterial phase, CT enhancement value in the venous phase, and total CT enhancement value. Logistic regression results showed that CEA, CA19-9, CT enhancement value in the arterial phase, CT enhancement value in the venous phase, and total CT enhancement value were the influencing factors of poor prognosis in patients with colorectal cancer (P < 0.05). Based on the Lasso-Logistic regression, a nomogram was developed to predict patient prognosis. The calibration curve, receiver operating characteristic curve, and decision curve results showed that the model had good discrimination and applicability.
The factors influencing the prognosis of patients with colorectal cancer are CEA, CA19-9, CT enhancement value in the arterial phase, CT enhancement value in the venous phase, and total CT enhancement value. Based on these factors, a nomogram for patient prognosis was constructed, and the model demonstrated good predictive value.
- Citation: Sun W, Fang JZ, Wu F, Xu JX. Construction of a Lasso-Logistic model for predicting prognosis of colorectal cancer based on enhanced CT and clinical data. Shijie Huaren Xiaohua Zazhi 2025; 33(12): 1022-1030
- URL: https://www.wjgnet.com/1009-3079/full/v33/i12/1022.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i12.1022
结直肠癌是消化系统常见的恶性肿瘤, 在早期可能无明显症状, 多数患者在初次就诊时处于中晚期, 尽管手术切除、放化疗等综合治疗可提高患者生存率, 但患者复发和转移仍是造成患者死亡的主要原因之一[1]. 有报道显示, 约30%-50%结直肠癌患者在术后可能会出现局部复发或远处转移, 尤其肝、肺和腹膜等部位[2]. 可见了解结直肠癌患者复发转移的相关因素, 对改善患者预后具有积极意义. 相关文献研究显示, 结直肠癌患者预后不良受多种因素影响, 如肿瘤分期、高龄、分化程度等[3]. 近年随着医学影像技术发展, 增强计算机断层扫描(computed tomography, CT)作为一种无创检查手段, 在结直肠癌诊断、临床分期和疗效评估中广泛应用[4]. 虽然国内外有研究报道, 基于影像组学技术和临床资料构建肿瘤患者预后的预测模型[5,6], 但预测预后模型的敏感性和特异性有待提高. Lasso-Logistic模型能有效处理高维度数据, 筛选关键的变量, 在肿瘤预测预后模型表现出独特优势, 同时还能避免过拟合现象, 提高模型预测的准确性[7]. 然而基于增强CT和临床资料构建结直肠癌患者预后Lasso-Logistic模型的研究缺乏. 基于此, 本研究对其展开探究, 旨在为评估结直肠癌患者预后提供佐证.
选取舟山市妇女儿童医院、舟山医院2021-01/2024-12收治的260例结直肠癌患者作为研究对象. 纳入标准: 结直肠癌均符合《中国结直肠癌诊疗规范(2017年版)》[8]诊断标准; 经组织病理学确诊; 临床资料完整; 均完成增强CT检查, 影像图像质量佳. 排除标准: 合并其他恶性肿瘤; 近3 mo内接受手术、放化疗等抗肿瘤治疗; 合并血液系统疾病; 家族结直肠癌病史; 感染性疾病; 精神或智力异常, 不能正常交流沟通; 发生远处转移. 本研究为回顾性队列研究, 已获得我院伦理委员会审批.
1.2.1 预后评估: 通过门诊电话、微信或检索就诊记录等多种方式对所有患者进行随访. 术后1-3年者每3-6 mo随访1次, 术后3年以上者每年随访1次, 随访事件终点为复发、转移和死亡, 随访时间截至2025-5. 患者存在复发、转移、死亡等为预后不良, 反之为预后不良. 260例患者根据预后情况分为预后良好组、预后不良组.
1.2.2 资料收集: 调取患者入院时电子病历, 将患者临床资料、增强CT数据导出, 包括年龄、性别、高血压、糖尿病、大体病理分型、肿瘤直径、分化程度、T分期、N分期、CA125、强化形式、肿瘤部位、增厚形式(评估方法1、评估方法2)、脉管瘤栓、神经侵犯、管腔狭窄、周围脂肪间隙、腹水、癌胚抗原(carcinoembryonic antigen, CEA)、糖抗原(carbohydrate antigen, CA)19-9、动脉期CT强化值、静脉期CT强化值、强化CT值.
采集患者入组时静脉血5 mL(保存在真空采血管内, 未进行抗凝处理), 经3000 r/min离心5 min(半径12 cm), 采用化学发光免疫分析法测定血清CEA、CA19-9、CA125水平所有患者入组时采用Somatom 64排CT(Siemens)进行腹部扫描, 先行常规平扫, 再行增强CT扫描, 参数: 管电压120 kV、管电流Auto、矩阵512×512、层厚5 mm, 组织重建算法, 重组层厚2 mm. 平扫结束后, 经肘静脉注射300 mg/mL碘海醇(速度2.5-3.0 mL/s), 延迟60 s后行门、静脉期扫描, 并获取图像. 图像均由两名经验丰富、工作年限≥5年的影像科医师以盲法进行审阅图像, 尽可能避开坏死和囊变区, 勾画感兴趣区域, 获取CT特征.
统计学处理 本研究采用SPSS 27.0软件分析数据, 计数资料以n(%)描述、χ2检验, 计量资料具备方差齐性、服从正态分布的以(mean±SD)描述、t检验; R语言"glmnet"包执行Lasso回归, 筛选结直肠癌患者预后的变量, "survival"包执行Logistic回归, 分析结直肠癌患者预后的因素, "rms"包构建结直肠癌患者预后的列线图, 采用受试者工作特征曲线(receiver operating characteristic curve, ROC)、决策曲线及校准曲线进行验证. P<0.05表示差异有统计学意义.
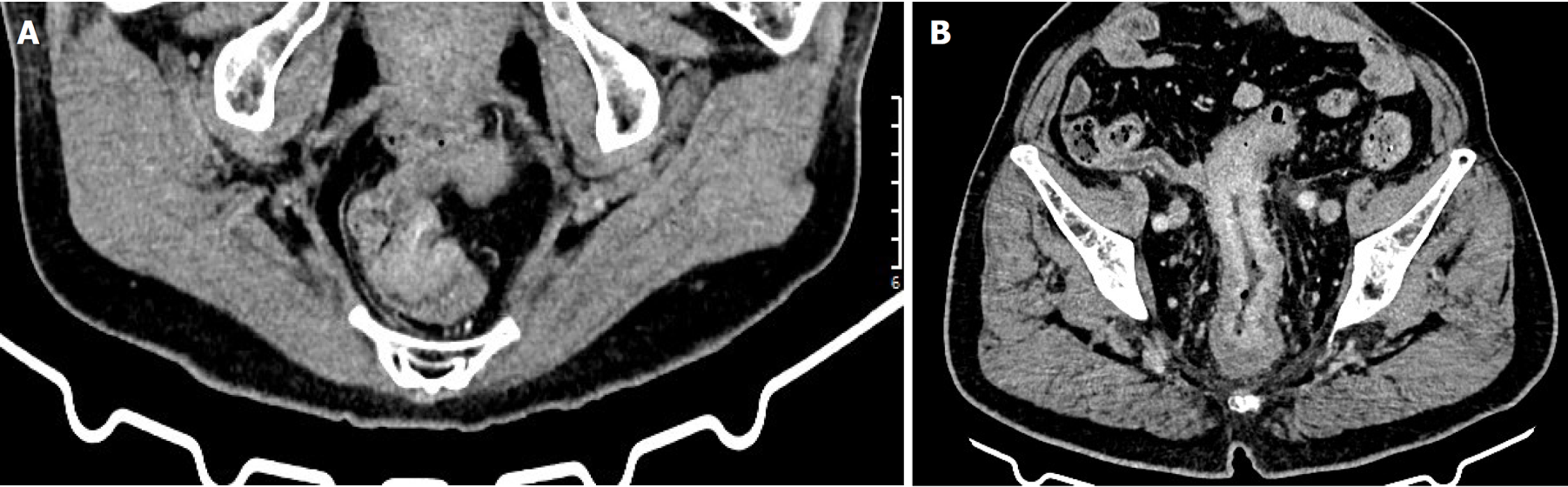
两组CEA、CA19-9、平扫CT值、动脉期CT值、静脉期CT值、动脉期CT强化值、静脉期CT强化值、强化CT值比较, 差异具有统计学意义(P<0.05); 两组年龄、性别、高血压、糖尿病、大体病理分型、肿瘤直径、分化程度、T分期、N分期、CA125、强化形式、肿瘤部位、增厚形式(评估方法1、评估方法2)、脉管瘤栓、神经侵犯、管腔狭窄、周围脂肪间隙、腹水比较, 差异均无统计学意义(P>0.05). 见表1, 经典增强CT图像见图1.
| 资料 | 预后良好组(n = 208) | 预后不良组(n = 52) | t/χ2值 | P值 |
| 临床资料 | ||||
| 年龄(岁) | 68.20±9.78 | 70.75±11.21 | 1.632 | 0.104 |
| 性别 | 0.692 | 0.406 | ||
| 男 | 127(61.06) | 35(67.31) | ||
| 女 | 81(38.94) | 17(32.69) | ||
| 高血压 | 75(36.06) | 25(48.08) | 2.539 | 0.111 |
| 糖尿病 | 30(14.42) | 13(25.00) | 3.372 | 0.066 |
| 大体病理分型 | 1.010 | 0.312 | ||
| 隆起型 | 46(22.12) | 12(23.08) | ||
| 溃疡型 | 140(67.31) | 28(53.85) | ||
| 浸润性 | 7(3.37) | 3(5.77) | ||
| 其他 | 15(7.21) | 9(17.31) | ||
| 肿瘤直径(cm) | 0.135 | 0.713 | ||
| ≤3 cm | 49(23.56) | 11(21.15) | ||
| >3 cm | 159(76.44) | 41(78.85) | ||
| 分化程度 | 2.410 | 0.121 | ||
| 中高分化 | 158(75.96) | 34(65.38) | ||
| 低分化 | 50(24.04) | 18(34.62) | ||
| T分期 | 2.270 | 0.132 | ||
| T1-T2 | 43(20.67) | 6(11.54) | ||
| T3-T4 | 165(79.33) | 46(88.46) | ||
| N分期 | 0.493 | 0.483 | ||
| N0-N1 | 176(84.62) | 46(88.46) | ||
| N2 | 34(15.38) | 6(11.54) | ||
| CEA(ng/mL) | 12.564 | <0.001 | ||
| <5 | 136(65.38) | 20(38.46) | ||
| ≥5 | 72(34.62) | 32(61.54) | ||
| CA19-9(ng/mL) | 8.879 | 0.003 | ||
| <35 | 185(88.94) | 38(73.08) | ||
| ≥35 | 38(11.06) | 14(26.92) | ||
| CA125(U/mL) | 0.063 | 0.760 | ||
| <35 | 187(89.90) | 46(88.46) | ||
| ≥35 | 21(10.10) | 6(11.54) | ||
| 增强CT特征 | ||||
| 平扫CT值(Hu) | 37.89±8.69 | 29.90±9.07 | 5.879 | <0.001 |
| 动脉期CT值(Hu) | 67.65±16.36 | 74.04±16.82 | 2.505 | 0.013 |
| 静脉期CT值(Hu) | 74.09±13.12 | 79.75±14.99 | 2.702 | 0.007 |
| 动脉期CT强化值(Hu) | 29(21, 37) | 44.14±13.27 | 15.631 | <0.001 |
| 静脉期CT强化值(Hu) | 36.20±10.36 | 49.84±9.91 | 8.564 | <0.001 |
| 强化CT值(Hu) | 37.75±11.00 | 51.59±10.98 | 8.118 | <0.001 |
| 强化形式 | 0.005 | 0.945 | ||
| 均匀 | 57(27.40) | 14(26.92) | ||
| 不均匀 | 151(72.60) | 38(73.08) | ||
| 增厚形式(评估方法1) | 0.005 | 0.941 | ||
| 偏心性 | 198(95.19) | 50(96.15) | ||
| 向心性 | 10(4.81) | 2(3.85) | ||
| 增厚形式(评估方法2) | 0.383 | 0.536 | ||
| 局限性 | 61(29.33) | 13(25.00) | ||
| 环形 | 147(70.67) | 39(75.00) | ||
| 肿瘤部位 | 0.004 | 0.949 | ||
| 左半结肠 | 133(63.94) | 33(63.46) | ||
| 右半结肠 | 75(36.06) | 19(36.54) | ||
| 脉管瘤栓 | 44(21.15) | 10(19.23) | 0.093 | 0.760 |
| 神经侵犯 | 21(10.10) | 4(7.69) | 0.277 | 0.599 |
| 管腔狭窄 | 207(99.52) | 52(100.00) | 0.565 | 0.452 |
| 周围脂肪间隙 | 0.065 | 0.948 | ||
| 清晰 | 21(10.10) | 7(13.46) | ||
| 浆膜毛糙 | 130(62.50) | 29(55.77) | ||
| 模糊 | 57(27.40) | 16(30.77) | ||
| 腹水 | 25(12.02) | 6(11.54) | 0.009 | 0.924 |
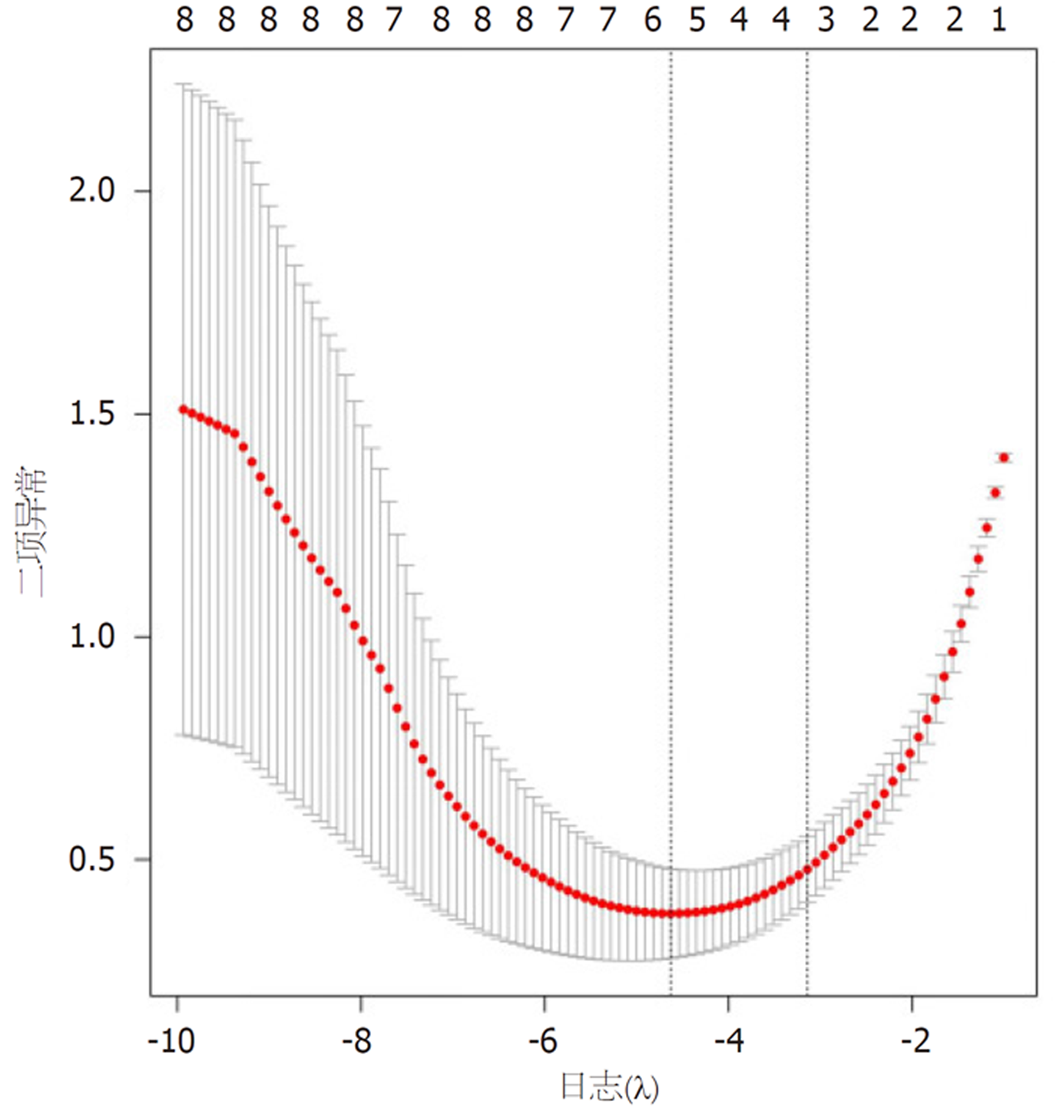
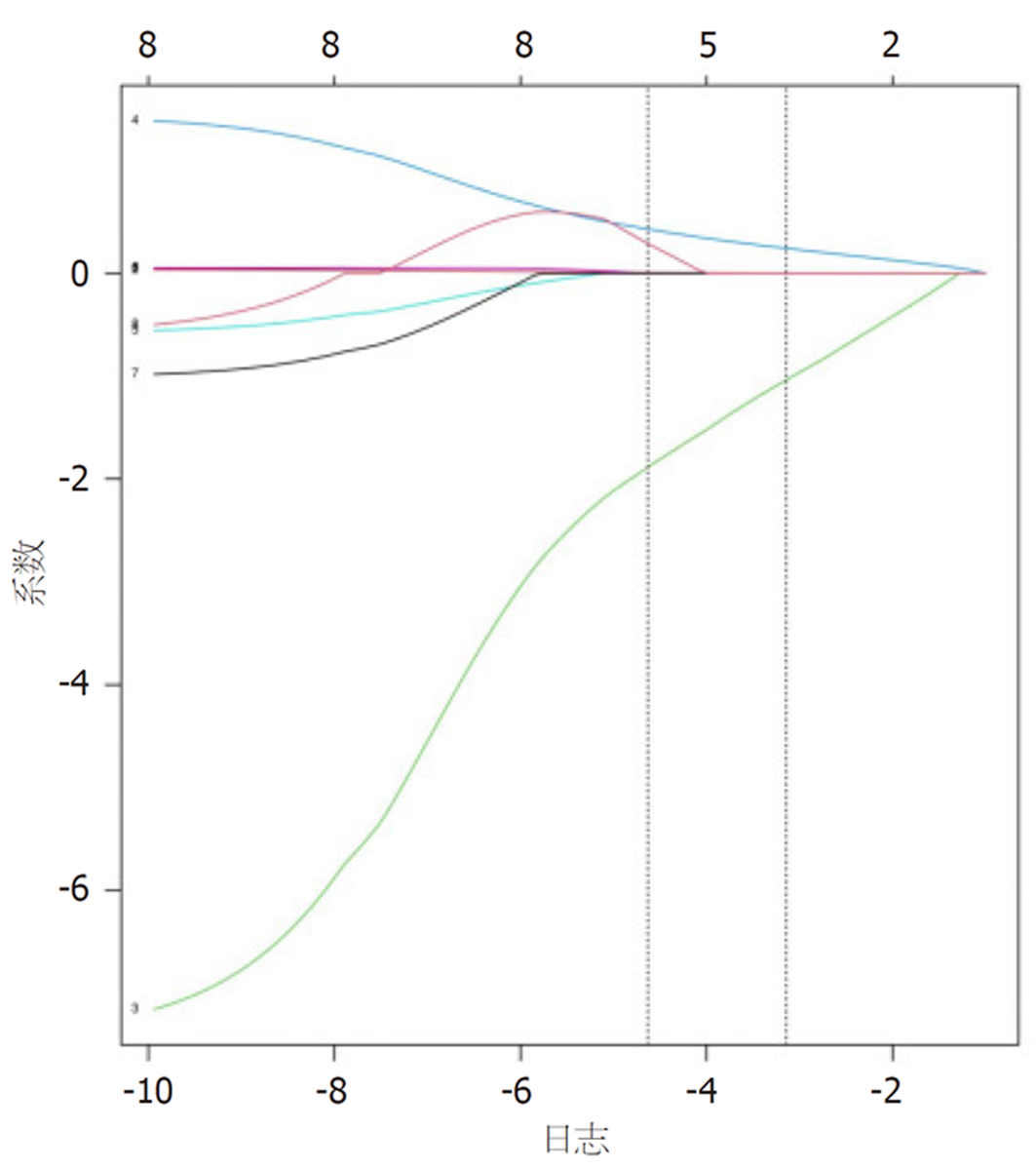
以患者预后不良作为因变量(是 = 1、否 = 0), 将CEA(<5 = 1、>5 = 2)、CA19-9(<35 = 1、>35 = 2)、平扫CT值(实际值)、动脉期CT值(实际值)、静脉期CT值(实际值)、动脉期CT强化值(实际值)、静脉期CT强化值(实际值)、强化CT值(实际值)的8个因素纳入Lasso回归, 用于筛选变量. 在筛选过程中, 初始8个变量惩罚系统λ被压缩, 采用交叉验证寻找最佳λ值, 当λ = 0.028时, 横坐标对应lambda.1se模型变量数量最优, 性能良好, 见图2、图3; 此时Log(λ)值对应筛选的5个变量, 分别为CEA、CA19-9、动脉期CT强化值、静脉期CT强化值、强化CT值.
以结直肠癌患者是否为预后不良作为因变量(是 = 1、否 = 0), 将Lasso回归筛选的5个变量纳入多因素Logistic回归, 赋值方法同Lasso回归, 结果显示, CEA、CA19-9、动脉期CT强化值、静脉期CT强化值、强化CT值是影响结直肠癌患者预后不良的影响因素(P<0.05). 见表2.
| 影响因素 | β | S.E. | OR | Wald χ2 | 95%CI | P值 |
| CA19-9 | 1.594 | 0.135 | 4.925 | 139.465 | 2.269-10.689 | <0.001 |
| CEA | 1.605 | 0.241 | 4.997 | 6.145 | 3.135-7.902 | 0.003 |
| 动脉期CT强化值 | 0.369 | 0.149 | 1.447 | 6.389 | 1.126-8.859 | 0.001 |
| 静脉期CT强化值 | 0.399 | 0.158 | 1.491 | 15.312 | 1.309-1.698 | <0.001 |
| 强化CT值 | 0.634 | 0.162 | 1.885 | 44.345 | 1.658-2.143 | <0.001 |
| 常量 | -0.462 | 0.156 | 21.269 | <0.001 |
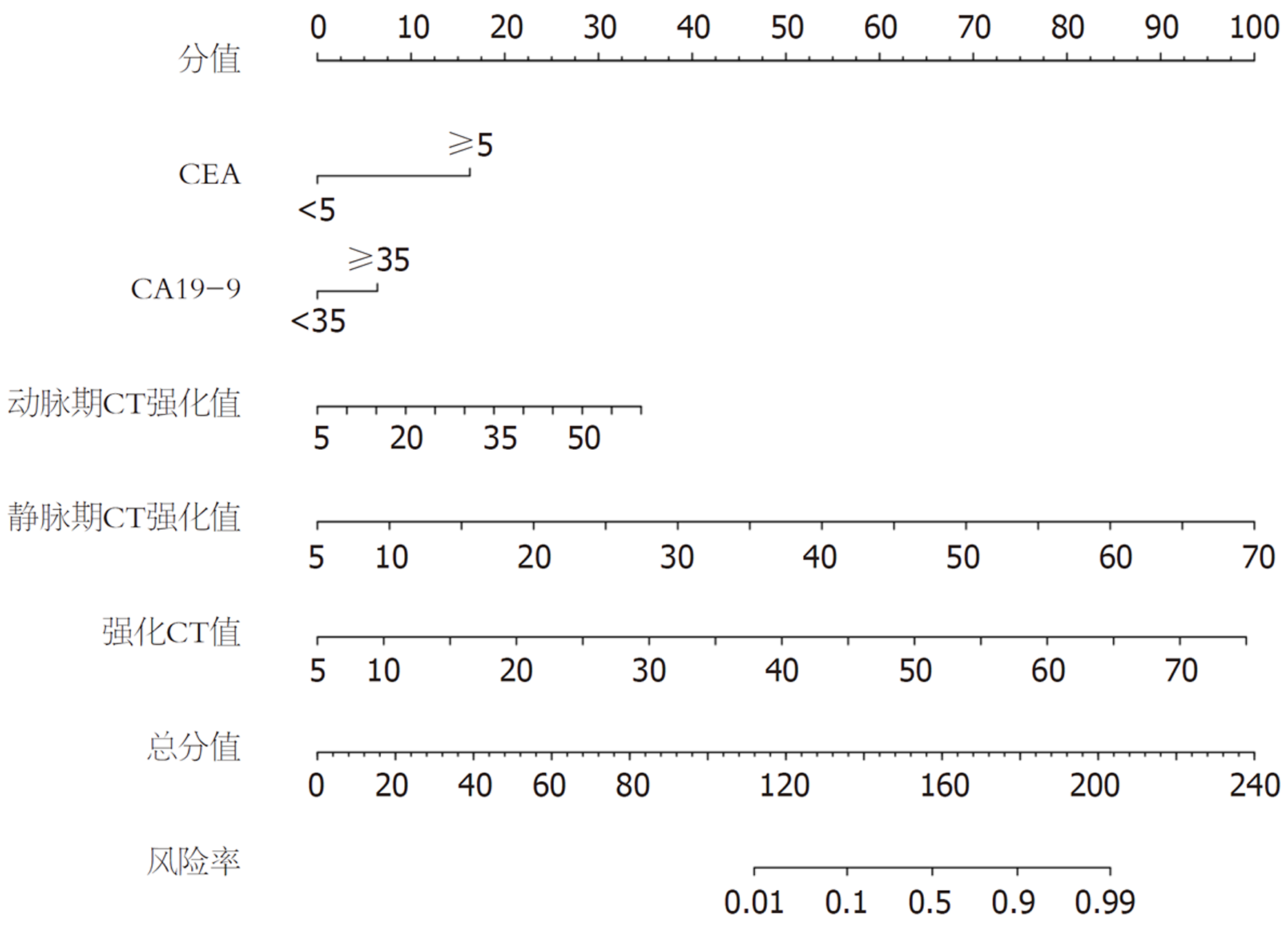
根据Lasso-Logistic回归筛选获得的变量, CEA、CA19-9、动脉期CT强化值、静脉期CT强化值、强化CT值进行可视化展示, 将其作为预测指标, 绘制列线图, 见图4.
近年来我国结直肠癌呈升高趋势, 患者经手术、放化疗等综合治疗后可延长患者生存期, 但仍有部分患者预后未获得明显改善, 复发和转移是影响患者长期生存的关键因素[9,10]. 可见了解结直肠癌患者复发转移的影响因素, 并建立相关预测模型, 对预测患者复发转移具有积极作用.
本研究将单因素有意义的变量(CEA、CA19-9、平扫CT值、动脉期CT值、静脉期CT值、动脉期CT强化值、静脉期CT强化值、强化CT值)经Lasso回归筛选获取最佳变量为CEA、CA19-9、动脉期CT强化值、静脉期CT强化值、强化CT值, 经Logistic回归证实上述因素是影响结直肠癌患者预后不良的影响因素, 可见, 影响结直肠癌患者预后的因素较多, 临床医师应重点关注. CEA是一种酸性糖蛋白, 最初从结直肠癌和胚胎组织中提取, 在结直肠癌诊断、预后评估及复发等具有重要临床价值[11]; CA125多分布在间皮细胞组织, 临床上多用于卵巢癌检测, 而CA19-9是一种黏蛋白性糖类蛋白, 主要用于胰腺癌和胆囊癌等消化系统恶性肿瘤诊断[12,13]. 有研究发现[14,15], 通过检测结直肠癌患者血清CEA、CA125、CA19-9水平发现, 血清CEA、CA125、CA19-9水平升高与患者预后密切相关, 但也有研究显示[16], 血清CEA水平升高与结直肠癌患者预后密切相关, 而血清CA125、CA19-9水平与结直肠癌患者预后无关. 本研究结果发现, CEA、CA19-9是结直肠癌患者预后不良的影响因素, 与上述观点[16]不一致, 可能与纳入样本量、病理类型等因素有关. 分析可能的作用机制: 由于CEA作为细胞黏附蛋白, CEA升高提示结直肠癌肿瘤负荷较大, 分化程度较差, 促进肿瘤细胞黏附和转移, 进而影响患者预后; CA19-9可用于消化系统恶性肿瘤诊断, 且与肿瘤复发转移密切相关[17], CA19-9升高提示患者肿瘤恶性程度较高, 可促进肿瘤细胞异常增殖分化和凋亡失衡, 增强肿瘤侵袭性, 此类患者更易发生远处转移和复发, 是患者预后不良的危险因素.
增强CT是结直肠癌患者治疗前常规检查和术后随访的首选影像检查方法, 通过注射造影剂, 在CT扫描时可观察患者造影剂分布, 清晰地呈现肿瘤形态、位置、大小及周围血供, 能准确判断结直肠癌局部侵犯、肝脏及胸部等转移[18-20]. 本研究基于增强CT特征, 发现动脉期CT强化值、静脉期CT强化值、强化CT值是结直肠癌患者预后不良的影响因素, 分析原因可能是由于动脉期CT强化值是评估注射对比剂后25-30 s变化, 反映肿瘤新生血管密度, 静脉期CT强化值主要评估注射对比剂后60-70 s变化, 主要反映肿瘤实质强化情况, 强化CT值是注射对比剂后, 肿瘤组织CT值相对于平扫的增加值, 主要反映肿瘤组织血供丰富情况和肿瘤血管通透性, 动脉期CT强化值、静脉期CT强化值、强化CT值升高说明结直肠癌患者新生血管密度较大, 病灶内部有丰富血管, 为肿瘤细胞生长提供营养和氧气, 肿瘤细胞进入快速生长阶段, 促进肿瘤细胞增殖分化、迁移和侵袭, 进而影响患者预后[21-23]. 基于上述影响因素构建结直肠癌患者预后的列线图, 验证结果显示, 该模型具有良好的预测效能和正向净收益.
综上所述, 分化程度、N分期、CEA、动脉期CT值、门脉期CT值是结直肠癌患者预后的影响因素, 基于上述因素构建患者预后的列线图具有良好的预测效能和适用性, 旨在为结直肠癌患者个性化治疗和预后管理提供参考, 同时为临床决策提供新的方向.
约30%-50%结直肠癌患者在术后可能会出现局部复发或远处转移. 可见了解结直肠癌患者复发转移的相关因素, 对改善患者预后具有积极意义.
Lasso-Logistic模型, 在肿瘤预测预后模型表现出独特优势, 同时还能避免过拟合现象, 提高模型预测的准确性. 基于增强计算机断层扫描(computed tomography, CT)和临床资料构建结直肠癌患者预后Lasso-Logistic模型的研究缺乏.
基于增强CT、临床资料构建结直肠癌预后结局的Lasso-Logistic模型, 旨在为评估患者预后提供参考.
选取260例结直肠癌患者作为研究对象, 根据患者预后情况分为两组. Lasso-Logistic筛选结直肠癌患者预后的影响因素, 构建列线图, 并对其进行验证.
两组癌胚抗原(carcinoembryonic antigen, CEA)、糖抗原(carbohydrate antigen, CA)19-9、平扫CT值、动脉期CT值、静脉期CT值、动脉期CT强化值、静脉期CT强化值、强化CT值比较, 差异具有统计学意义, 该模型具有良好的区分度和适用性.
结直肠癌患者预后的影响因素分别为CEA、CA19-9、动脉期CT强化值、静脉期CT强化值、强化CT值, 据此构建患者预后的列线图, 该模型具有良好的预测价值.
基于上述影响因素构建结直肠癌患者预后的列线图, 旨在为结直肠癌患者个性化治疗和预后管理提供参考, 同时为临床决策提供新的方向, 该模型具有良好的预测效能和正向净收益.
| 1. | Fabregas JC, Ramnaraign B, George TJ. Clinical Updates for Colon Cancer Care in 2022. Clin Colorectal Cancer. 2022;21:198-203. [PubMed] [DOI] |
| 2. | Cao L, Wei S, Yin Z, Chen F, Ba Y, Weng Q, Zhang J, Zhang H. Identifying important microbial biomarkers for the diagnosis of colon cancer using a random forest approach. Heliyon. 2024;10:e24713. [PubMed] [DOI] |
| 3. | Swartjes H, van Lankveld DWP, van Erning FN, Verheul HMW, de Wilt JHW, Koëter T, Vissers PAJ. Locoregionally Recurrent Colon Cancer: How Far Have We Come? A Population-Based, Retrospective Cohort Study. Ann Surg Oncol. 2023;30:1726-1734. [PubMed] [DOI] |
| 4. | Crimì F, Zanon C, Cabrelle G, Luong KD, Albertoni L, Bao QR, Borsetto M, Baratella E, Capelli G, Spolverato G, Fassan M, Pucciarelli S, Quaia E. Contrast-Enhanced CT Texture Analysis in Colon Cancer: Correlation with Genetic Markers. Tomography. 2022;8:2193-2201. [PubMed] [DOI] |
| 5. | Abbaspour E, Karimzadhagh S, Monsef A, Joukar F, Mansour-Ghanaei F, Hassanipour S. Application of radiomics for preoperative prediction of lymph node metastasis in colorectal cancer: a systematic review and meta-analysis. Int J Surg. 2024;110:3795-3813. [PubMed] [DOI] |
| 7. | Duan Y, Du Y, Mu Y, Guan X, He J, Zhang J, Gu Z, Wang C. Development and validation of a novel predictive model for postpancreatectomy hemorrhage using lasso-logistic regression: an international multicenter observational study of 9631 pancreatectomy patients. Int J Surg. 2025;111:791-806. [PubMed] [DOI] |
| 9. | Meng LK, Zhu D, Zhang Y, Fang Y, Liu WZ, Zhang XQ, Zhu Y. Recurrence of sigmoid colon cancer-derived anal metastasis: A case report and review of literature. World J Clin Cases. 2022;10:1122-1130. [PubMed] [DOI] |
| 10. | Zhang JJ, Liu YM, Li YW, Han ZQ. Development of a risk prediction model for personalized assessment of postoperative recurrence risk in colon cancer patients. Transl Cancer Res. 2024;13:5873-5882. [PubMed] [DOI] |
| 11. | Sun Q, Long L. Diagnostic performances of methylated septin9 gene, CEA, CA19-9 and platelet-to-lymphocyte ratio in colorectal cancer. BMC Cancer. 2024;24:906. [PubMed] [DOI] |
| 12. | Tang J, Li X, Tang N, Lin X, Du Y, Zhang S, Li Q, Zhang Y, Zhang Y, Hang H, Qiu T, Qiu Y, Cheng H, Dai Z, Hong H, Wei W, He J, Yan C. CD44 identified as a diagnostic biomarker for highly malignant CA19-9 negative pancreatic cancer. Cancer Lett. 2025;622:217713. [PubMed] [DOI] |
| 13. | Zhu HQ, Wang DY, Xu LS, Chen JL, Chu EW, Zhou CJ. Correction: Diagnostic value of an enhanced MRI combined with serum CEA, CA19-9, CA125 and CA72-4 in the liver metastasis of colorectal cancer. World J Surg Oncol. 2023;21:92. [PubMed] [DOI] |
| 14. | Yousef A, Yousef M, Zeineddine MA, More A, Fanaeian M, Chowdhury S, Knafl M, Edelkamp P, Ito I, Gu Y, Pattalachinti V, Naini ZA, Zeineddine FA, Peterson J, Alfaro K, Foo WC, Jin J, Bhutiani N, Higbie V, Scally CP, Kee B, Kopetz S, Goldstein D, Strach M, Williamson A, Aziz O, Barriuso J, Uppal A, White MG, Helmink B, Fournier KF, Raghav KP, Taggart MW, Overman MJ, Shen JP. Serum Tumor Markers and Outcomes in Patients With Appendiceal Adenocarcinoma. JAMA Netw Open. 2024;7:e240260. [PubMed] [DOI] |
| 17. | Gramkow MH, Mosgaard CS, Schou JV, Nordvig EH, Dolin TG, Lykke J, Nielsen DL, Pfeiffer P, Qvortrup C, Yilmaz MK, Larsen O, Bojesen SE, Jensen BV, Johansen JS. The prognostic role of circulating CA19-9 and CEA in patients with colorectal cancer. Cancer Treat Res Commun. 2025;43:100907. [PubMed] [DOI] |
| 18. | Huang YQ, Chen XB, Cui YF, Yang F, Huang SX, Li ZH, Ying YJ, Li SY, Li MH, Gao P, Wu ZQ, Wen G, Wang ZS, Wang HX, Hong MP, Diao WJ, Chen XY, Hou KQ, Zhang R, Hou J, Fang Z, Wang ZN, Mao Y, Wee L, Liu ZY. Enhanced risk stratification for stage II colorectal cancer using deep learning-based CT classifier and pathological markers to optimize adjuvant therapy decision. Ann Oncol. 2025;36:1178-1189. [PubMed] [DOI] |
| 19. | Sun D, Ma L, Liu Y, Bao C, Jia G, Wang T, Wang Y. (99m)Tc-FAPI-04 SPECT/CT outperforms contrast-enhanced CT in detecting metastasis in postoperative patients with colorectal cancer. Front Med (Lausanne). 2024;11:1462870. [PubMed] [DOI] |
| 20. | Kato T, Tsukamoto S, Miyake M, Kudose Y, Takamizawa Y, Moritani K, Daiko H, Kanemitsu Y. Prognostic impact of extramural venous invasion detected by contrast-enhanced CT colonography in colon cancer. BJS Open. 2024;8:zrad121. [PubMed] [DOI] |
| 21. | Ye Y, Lu W, Deng Q, Chen Y, Han S, Dai S, Chen Z, Li J, Song Y, Wang Z, Ding K. Tumor enhancement ratio on preoperative abdominal contrast-enhanced CT scan for predicting recurrence risk in stage II colon cancer. Abdom Radiol (NY). 2022;47:1265-1275. [PubMed] [DOI] |
| 22. | Rafaelsen SR, Dam C, Vagn-Hansen C, Møller J, Rahr HB, Sjöström M, Lindebjerg J, Hansen TF, Pedersen MRV. CT and 3 Tesla MRI in the TN Staging of Colon Cancer: A Prospective, Blind Study. Curr Oncol. 2022;29:1069-1079. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁