修回日期: 2025-12-06
接受日期: 2025-12-12
在线出版日期: 2025-12-28
慢性便秘的发生与代谢、心理及盆底功能等多因素互相关联, 这是构建预测模型的理论基础. 本研究假设: 病程、糖尿病、抑郁程度及生物反馈治疗史等因素可共同影响药物反应性, 从而用于建立可靠的个体化预测模型.
探讨慢性便秘患者药物难治性的危险因素, 构建并验证个体化预测模型, 为临床早期识别高危患者提供依据.
回顾性分析2020-01/2024-12在金华市婺城区人民医院消化内科就诊的300例慢性便秘患者的临床资料. 采用LASSO回归筛选预测变量, 通过多因素Logistic回归分析建立预测模型. 将数据按7:3比例随机分为训练集(n = 211)和验证集(n = 89), 采用受试者工作特征曲线评估模型的区分度, 校准曲线评估模型的校准度, 决策曲线分析(decision curve analysis, DCA)评估模型的临床净收益. 构建列线图用于临床应用.
多因素Logistic回归分析显示, 病程[比值比(odds ratio, OR) = 1.04, 95%CI: 1.00-1.08, P = 0.038]、糖尿病(OR = 3.46, 95%CI: 1.76-6.82, P<0.001)、抑郁评分(OR = 1.14, 95%CI: 1.08-1.20, P<0.001)是慢性便秘药物难治性的独立危险因素, 生物反馈治疗史(OR = 0.31, 95%CI: 0.14-0.65, P = 0.002)是保护因素. 预测模型在训练集和验证集的曲线下面积分别为0.775(95%CI: 0.712-0.838)和0.740(95%CI: 0.634-0.846), 显示出良好的区分度. 校准曲线显示模型预测概率与实际发生率吻合度较好. DCA显示该模型具有较高的临床净收益.
基于病程、糖尿病、抑郁评分和生物反馈治疗史构建的预测模型对慢性便秘药物难治性具有较好的预测价值, 可为临床个体化治疗决策提供参考.
核心提要: 本研究首次将病程、糖尿病、抑郁评分与生物反馈治疗史整合, 构建并验证了药物难治性慢性便秘的个体化预测模型, 具有良好区分度和临床实用性. 该模型可帮助临床提前识别高危患者, 优化治疗策略, 为精准管理慢性便秘提供新的工具.
引文著录: 蒋丹, 周锦航. 覆慢性便秘药物难治性预测模型构建与验证. 世界华人消化杂志 2025; 33(12): 1013-1021
Revised: December 6, 2025
Accepted: December 12, 2025
Published online: December 28, 2025
The development of chronic constipation is driven by interacting metabolic, psychological, and pelvic floor factors. This pathophysiological understanding provides the foundation for the development of predictive models. We hypothesized that variables such as disease duration, diabetes, depression severity, and biofeedback therapy history jointly influence drug responsiveness and can therefore be integrated to construct an individualized and reliable prediction model.
To identify the risk factors for drug-refractory chronic constipation and develop an individualized prediction model to provide evidence for early identification of high-risk patients in clinical practice.
A retrospective analysis was conducted on clinical data of 300 patients with chronic constipation treated in our Department of Gastroenterology from January 2020 to December 2024. LASSO regression was used to screen predictive variables, and multivariable logistic regression analysis was performed to establish a prediction model. The data were randomly divided into a training set (n = 211) and a validation set (n = 89) at a ratio of 7:3. The receiver operating characteristic curve was used to evaluate the discrimination of the model, the calibration curve was used to evaluate the calibration, and decision curve analysis (DCA) was conducted to evaluate the clinical net benefit. A nomogram was constructed for clinical application.
Multivariable logistic regression analysis showed that disease duration [odds ratio (OR) = 1.04, 95% confidence interval (CI): 1.00-1.08, P = 0.038], diabetes mellitus (OR = 3.46, 95%CI: 1.76-6.82, P < 0.001), and depression score (OR = 1.14, 95%CI: 1.08-1.20, P < 0.001) were independent risk factors for drug-refractory chronic constipation, while biofeedback therapy history (OR = 0.31, 95%CI: 0.14-0.65, P = 0.002) was a protective factor. The prediction model showed good discrimination with an area under the curve value of 0.775 (95%CI: 0.712-0.838) in the training set and 0.740 (95%CI: 0.634-0.846) in the validation set. The calibration curve showed good agreement between predicted probabilities and actual outcomes. DCA demonstrated high clinical net benefit of the model.
The prediction model developed based on disease duration, diabetes mellitus, depression score, and biofeedback therapy history demonstrates good predictive value for drug-refractory chronic constipation and can provide reference for individualized treatment decisions in clinical practice.
- Citation: Jiang D, Zhou JH. Development and validation of a predictive model for drug-refractory chronic constipation. Shijie Huaren Xiaohua Zazhi 2025; 33(12): 1013-1021
- URL: https://www.wjgnet.com/1009-3079/full/v33/i12/1013.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i12.1013
慢性便秘是消化系统常见的功能性疾病, 在全球范围内患病率为2%-27%, 严重影响患者的生活质量[1]. 根据罗马Ⅳ标准, 慢性便秘的诊断需满足排便困难、排便次数减少或排便不尽感等症状持续至少6 mo[2]. 目前, 慢性便秘的治疗主要包括生活方式调整、药物治疗和生物反馈治疗等. 然而, 约20%-40%的患者对传统治疗反应不佳, 发展为药物难治性便秘[3].
药物难治性慢性便秘的定义尚未统一, 一般是指经过充分剂量和疗程的两种及以上泻药治疗后, 症状仍未得到满意改善的情况[4]. 这类患者往往需要更积极的治疗手段, 包括生物反馈治疗、骶神经刺激甚至手术治疗, 医疗费用显著增加, 生活质量严重下降[5]. 因此, 早期识别可能发展为药物难治性的高危患者, 对于优化治疗策略、改善预后具有重要意义.
既往研究表明, 多种因素与慢性便秘的预后相关, 包括病程长短、合并疾病(如糖尿病、甲状腺功能减退)、心理因素(焦虑、抑郁)以及既往治疗史等[6-8]. 然而, 目前缺乏针对药物难治性慢性便秘的系统性预测工具. 列线图作为一种可视化的预测模型, 能够整合多个预测因素, 直观地计算个体发生某一结局的概率, 在临床决策中得到广泛应用[9].
因此, 本研究旨在通过回顾性分析慢性便秘患者的临床资料, 筛选药物难治性的独立危险因素, 构建并验证个体化预测模型, 为临床早期识别高危患者、制定个体化治疗方案提供依据.
回顾性收集2020-01/2024-12在金华市婺城区人民医院消化内科就诊的慢性便秘患者300例. 纳入标准: (1)符合罗马Ⅳ标准的慢性便秘诊断[2]; (2)年龄≥18岁; (3)接受规范药物治疗至少3 mo; (4)临床资料完整. 排除标准: (1)继发性便秘(肠道器质性病变、药物性便秘等); (2)合并严重心、肝、肾功能不全; (3)恶性肿瘤患者; (4)妊娠期或哺乳期妇女; (5)精神疾病无法配合评估者.
通过电子病历系统收集患者的临床资料, 包括: (1)一般资料: 年龄、性别、体重指数; (2)疾病特征: 病程、便秘亚型(排便困难型、慢传输型、混合型)、每周排便次数、Wexner便秘评分[10]; (3)合并疾病: 糖尿病、甲状腺功能减退等; (4)生活方式: 饮水量、膳食纤维摄入、运动频率; (5)心理评估: 焦虑自评量表评分、抑郁自评量表评分[11]; (6)实验室检查: 甲状腺功能、血清钾; (7)治疗史: 既往使用泻药种类数、生物反馈治疗史.
药物难治性定义为: 经过至少3个月的规范药物治疗(包括渗透性泻药、刺激性泻药、促动力药等至少2种), Wexner评分改善<50%或患者主观症状无明显改善[4]. 由两名消化科医师独立评估, 意见不一致时由第三方裁定.
本研究中生物反馈治疗方案参照国际标准进行: 采用肛门直肠测压联合肌电生物反馈仪进行训练, 每次治疗时间30-45 min, 每周2-3次, 疗程为4-8 wk. 疗效评估标准包括: (1)主观评估: 患者自我报告的排便费力程度、排便完整感和总体满意度评分; (2)客观评估: 肛门直肠测压参数的改善, 包括排便时盆底肌矛盾收缩的纠正、直肠感觉阈值的恢复等; (3)综合评估: Wexner便秘评分降低≥50%或患者总体改善印象量表评分达到"明显改善"及以上定义为治疗有效[10].
统计学处理 采用R软件(版本4.3.0)进行统计分析. 计量资料以均数±标准差(mean±SD)表示, 组间比较采用独立样本t检验; 计数资料以例数(百分比)表示, 组间比较采用χ2检验. 将数据按7:3比例随机分为训练集和验证集. 在训练集中, 采用LASSO回归进行变量筛选, 10折交叉验证选择最优λ值[12]. 将筛选出的变量纳入多因素Logistic回归分析, 建立预测模型. 采用受试者工作特征曲线计算曲线下面积(area under the curve, AUC)评估模型的区分度[13]; 采用Bootstrap重复抽样1000次绘制校准曲线评估模型的校准度; 采用决策曲线分析(decision curve analysis, DCA)评估模型的临床实用性[14]. 构建列线图用于临床应用. 检验水准α = 0.05, 双侧检验.
本研究共纳入300例慢性便秘患者, 其中男性134例(44.7%), 女性166例(55.3%), 年龄20-85岁, 平均(51.84±19.64)岁. 训练集211例, 验证集89例. 药物难治性组135例(45.0%), 非药物难治性组165例(55.0%). 两组患者在病程(P = 0.003)、糖尿病患病率(P<0.001)、抑郁评分(P<0.001)、生物反馈治疗史(P<0.001)等方面差异有统计学意义(表1). 训练集和验证集的基线特征均衡可比(P>0.05).
| 变量 | 总体 (n = 300)1 | 非药物难治性 (n = 165)1 | 药物难治性 (n = 135)1 | P值2 |
| 年龄(岁) | 51.84±19.64 | 50.80±18.81 | 53.12±20.60 | 0.3 |
| 性别 | 0.5 | |||
| 男 | 134 (44.7) | 70 (42.4) | 64 (47.4) | |
| 女 | 166 (55.3) | 95 (57.6) | 71 (52.6) | |
| BMI(kg/m2) | 24.46±4.20 | 24.68±3.99 | 24.20±4.44 | 0.3 |
| 病程(年) | 10.57±8.44 | 9.26±8.19 | 12.16±8.49 | 0.003 |
| 便秘亚型 | 0.2 | |||
| 混合型 | 90 (30.0) | 48 (29.1) | 42 (31.1) | |
| 慢传输型 | 103 (34.3) | 51 (30.9) | 52 (38.5) | |
| 排便困难型 | 107 (35.7) | 66 (40.0) | 41 (30.4) | |
| 每周排便次数(次) | 0.2 | |||
| 1 | 61 (20.3) | 35 (21.2) | 26 (19.3) | |
| 2 | 40 (13.3) | 29 (17.6) | 11 (8.1) | |
| 3 | 48 (16.0) | 23 (13.9) | 25 (18.5) | |
| 4 | 46 (15.3) | 24 (14.5) | 22 (16.3) | |
| 5 | 49 (16.3) | 24 (14.5) | 25 (18.5) | |
| 6 | 56 (18.7) | 30 (18.2) | 26 (19.3) | |
| Wexner评分(分) | 13.16±5.14 | 13.31±5.19 | 12.99±5.10 | 0.6 |
| 糖尿病 | <0.001 | |||
| 否 | 201 (67.0) | 128 (77.6) | 73 (54.1) | |
| 是 | 99 (33.0) | 37 (22.4) | 62 (45.9) | |
| 甲状腺功能减退 | 0.6 | |||
| 否 | 245 (81.7) | 137 (83.0) | 108 (80.0) | |
| 是 | 55 (18.3) | 28 (17.0) | 27 (20.0) | |
| 饮水量(mL/d) | 1943.23±644.66 | 1928.32±646.39 | 1961.46±644.48 | 0.7 |
| 膳食纤维摄入 | 0.9 | |||
| 多 | 72 (24.0) | 39 (23.6) | 33 (24.4) | |
| 极少 | 67 (22.3) | 35 (21.2) | 32 (23.7) | |
| 少 | 77 (25.7) | 42 (25.5) | 35 (25.9) | |
| 中 | 84 (28.0) | 49 (29.7) | 35 (25.9) | |
| 运动频率(次/周) | >0.9 | |||
| 0 | 32 (10.7) | 18 (10.9) | 14 (10.4) | |
| 1 | 39 (13.0) | 20 (12.1) | 19 (14.1) | |
| 2 | 45 (15.0) | 23 (13.9) | 22 (16.3) | |
| 3 | 29 (9.7) | 15 (9.1) | 14 (10.4) | |
| 4 | 40 (13.3) | 21 (12.7) | 19 (14.1) | |
| 5 | 38 (12.7) | 20 (12.1) | 18 (13.3) | |
| 6 | 32 (10.7) | 20 (12.1) | 12 (8.9) | |
| 7 | 45 (15.0) | 28 (17.0) | 17 (12.6) | |
| 焦虑评分(分) | 9.68±6.12 | 9.52±6.02 | 9.87±6.26 | 0.6 |
| 抑郁评分(分) | 8.59±5.99 | 7.32±5.51 | 10.14±6.21 | <0.001 |
| 甲状腺功能(mIU/L) | 2.94±1.43 | 2.95±1.42 | 2.94±1.46 | >0.9 |
| 血清钾(mmoL/L) | 4.01±0.58 | 3.95±0.58 | 4.09±0.57 | 0.031 |
| 既往泻药种类数 | 0.3 | |||
| 1 | 153 (51.0) | 85 (51.5) | 68 (50.4) | |
| 2 | 95 (31.7) | 56 (33.9) | 39 (28.9) | |
| 3 | 52 (17.3) | 24 (14.5) | 28 (20.7) | |
| 生物反馈治疗史 | <0.001 | |||
| 否 | 216 (72.0) | 103 (62.4) | 113 (83.7) | |
| 是 | 84 (28.0) | 62 (37.6) | 22 (16.3) |
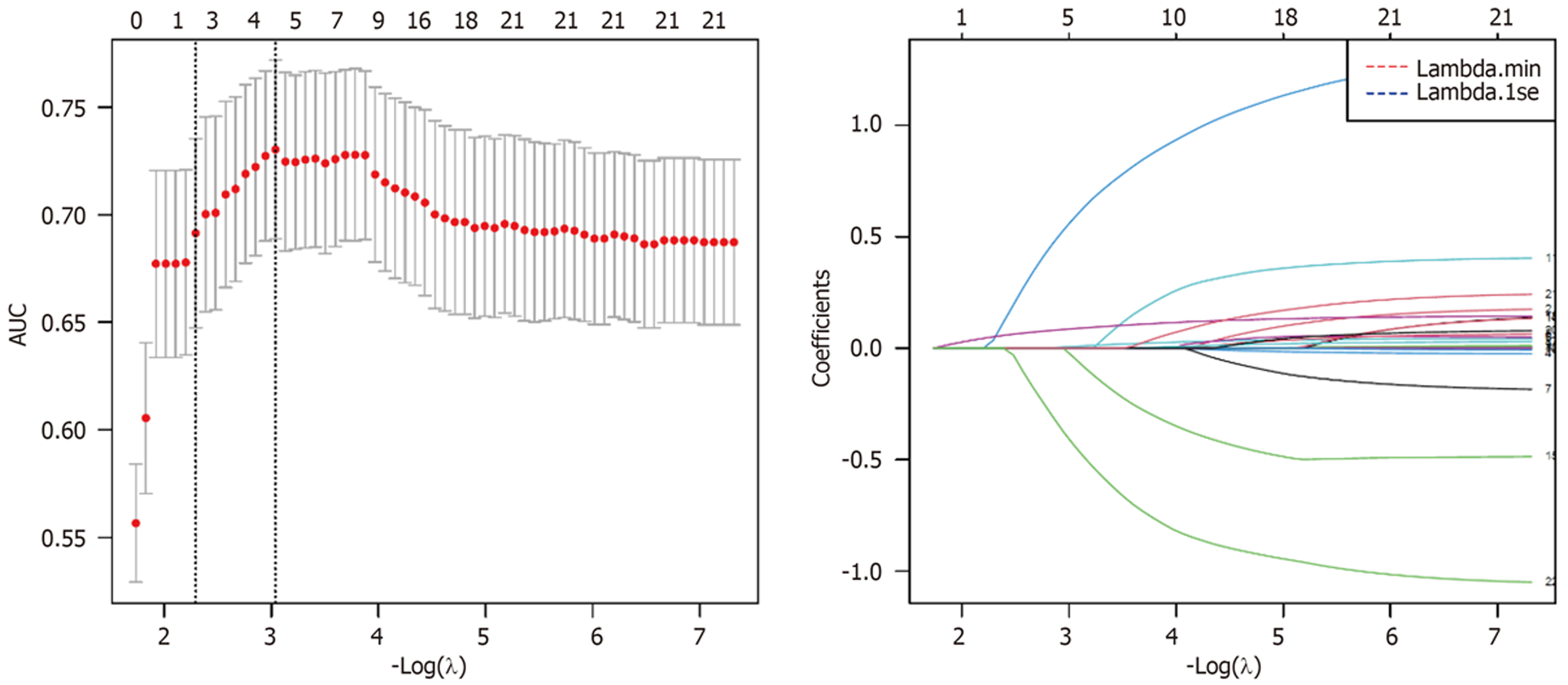
将18个候选变量纳入LASSO回归分析, 通过10折交叉验证确定最优λ值为0.032. 在此λ值下, 筛选出8个非零系数变量, 包括病程、糖尿病、抑郁评分、生物反馈治疗史、便秘亚型、Wexner评分、饮水量和运动频率(图1).
将LASSO筛选的变量纳入多因素Logistic回归分析. 考虑到模型的简洁性和临床可操作性, 最终纳入4个核心预测因素构建模型. 结果显示: 病程[比值比(odds ratio, OR) = 1.04, 95%CI: 1.00-1.08, P = 0.038]、糖尿病(OR = 3.46, 95%CI: 1.76-6.82, P<0.001)、抑郁评分(OR = 1.14, 95%CI: 1.08-1.20, P<0.001)是药物难治性的独立危险因素, 生物反馈治疗史(OR = 0.31, 95%CI: 0.14-0.65, P = 0.002)是独立保护因素(表2). VIF值均<2.0, 提示不存在多重共线性.
| 变量 | β系数 | 标准误 | Z值 | P值 | OR值 | 95%CI | 临床解释 |
| 病程(年) | 0.039 | 0.019 | 2.080 | 0.038 | 1.04 | (1.04-1.00) | 病程每增加1年 |
| 糖尿病(是) | 1.240 | 0.350 | 3.539 | <0.001 | 3.46 | (3.46-1.76) | 糖尿病(是 vs 否) |
| 抑郁评分 | 0.132 | 0.027 | 4.803 | <0.001 | 1.14 | (1.14-1.08) | 抑郁评分每增加1分 |
| 生物反馈治疗史(是) | -1.180 | 0.389 | -3.028 | 0.002 | 0.31 | (0.31-0.14) | 生物反馈治疗史(是 vs 否) |
需要说明的是, 虽然血清钾在单因素分析中两组间差异有统计学意义(P = 0.031), 但未被纳入最终的多因素Logistic回归模型, 原因如下: (1)LASSO回归筛选过程中, 血清钾的回归系数被压缩至零, 提示其在预测模型中的独立贡献相对较小; (2)血清钾水平受多种因素影响(如饮食、用药等), 临床检测的变异性较大; (3)从临床实用性角度, 血清钾作为可变因素, 不如病程、基础疾病等相对稳定的指标更适合作为预测模型的核心变量. 类似地, 便秘亚型、Wexner评分、饮水量和运动频率虽在LASSO初筛中被保留, 但考虑到模型的简洁性、变量间的相关性以及临床可操作性, 最终选择了预测效能最优的4个核心变量构建模型.
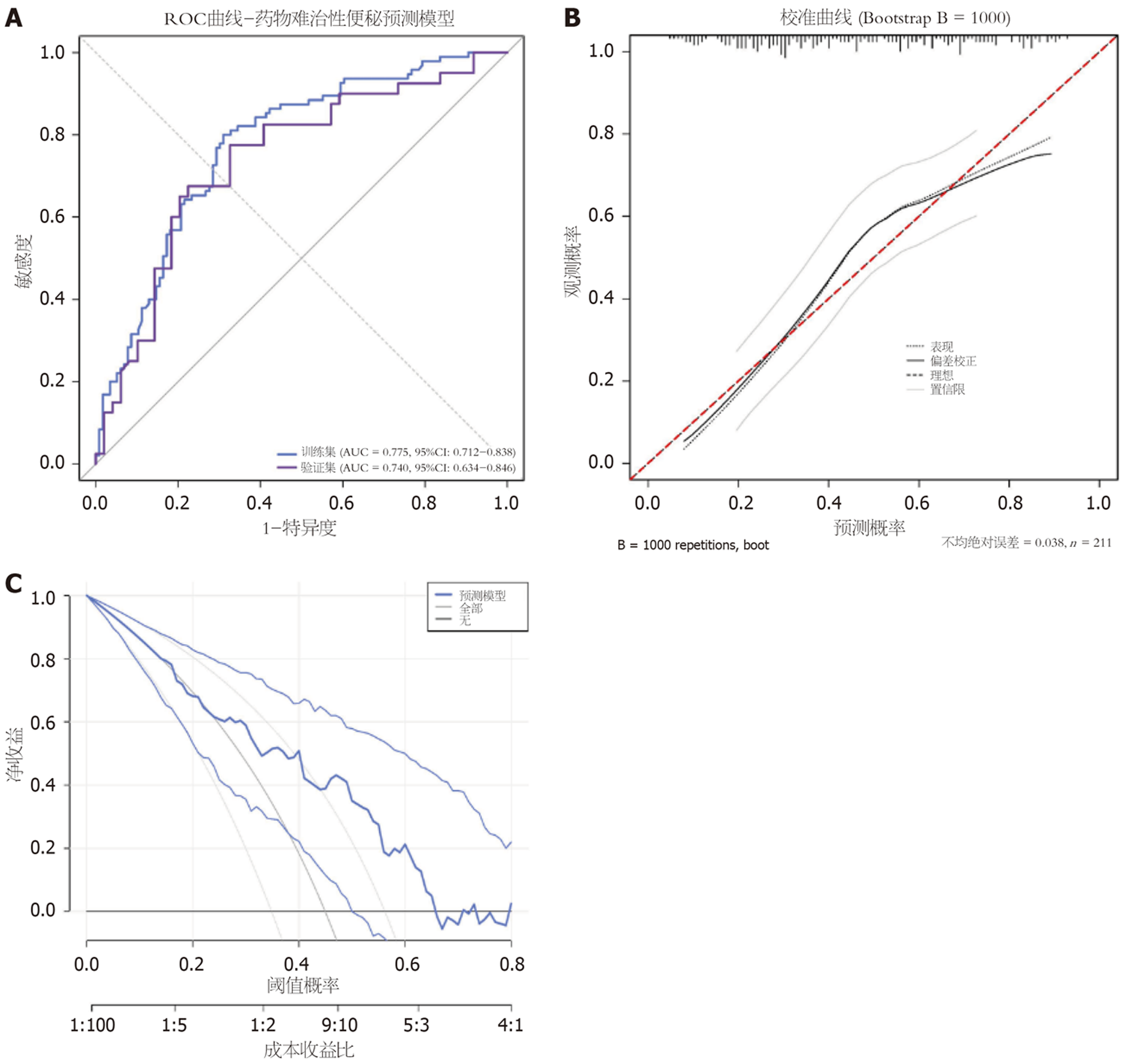
(1)区分度: 预测模型在训练集的AUC为0.775(95%CI: 0.712-0.838), 在验证集的AUC为0.740(95%CI: 0.634-0.846), 表明模型具有良好的区分度(图2A); (2)校准度: 校准曲线显示, 预测模型在训练集和验证集的预测概率与实际发生率均吻合较好(图2B). Bootstrap重复抽样1000次的平均绝对误差为0.036, Hosmer-Lemeshow检验P = 0.42, 提示模型校准度良好; (3)临床实用性: 决策曲线表明该模型具有较好的临床应用价值(图2C).
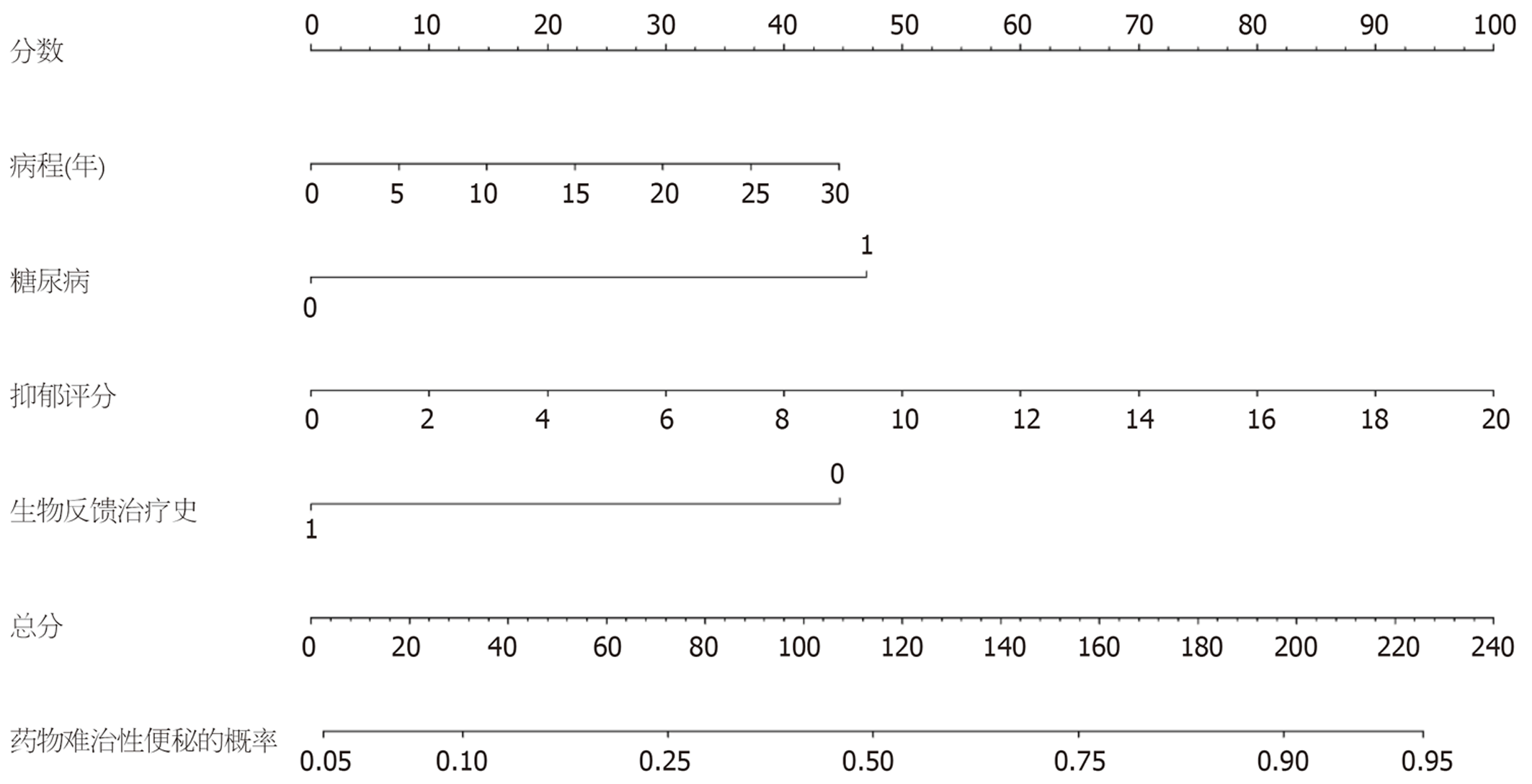
基于多因素Logistic回归模型构建列线图. 列线图包含4个预测变量: 病程(0-30年)、糖尿病(否/是)、抑郁评分(0-20分)、生物反馈治疗史(否/是). 通过对应每个变量的分值, 相加得到总分, 对应到药物难治性的预测概率(图3).
为便于临床应用和验证, 表3提供了列线图的定量评分系统. 临床医师可根据患者的各项指标值查表获取对应分数, 将各项分数相加得到总分, 然后查表4获取药物难治性的预测概率.
| 预测变量 | 变量值 | 评分 |
| 病程(年) | 1-5 | 7.5 |
| 6-10 | 15 | |
| 11-15 | 22.5 | |
| 16-20 | 30 | |
| 20-30 | 45 | |
| 糖尿病 | 否 | 0 |
| 是 | 46 | |
| 抑郁评分(分) | 1-2 | 10 |
| 3-4 | 20 | |
| 5-6 | 30 | |
| 7-8 | 40 | |
| 9-10 | 50 | |
| 11-12 | 60 | |
| 13-14 | 70 | |
| 15-16 | 80 | |
| 17-18 | 90 | |
| 19-20 | 100 | |
| 生物反馈治疗史 | 否 | 45 |
| 是 | 0 |
| 总分 | 预测概率(%) |
| 0-40 | 0-12 |
| 41-80 | 13-28 |
| 81-120 | 29-53 |
| 121-160 | 54-78 |
| 161-200 | 79-90 |
| >200 | >90 |
本研究通过回顾性分析300例慢性便秘患者的临床资料, 采用LASSO回归和多因素Logistic回归分析, 筛选出病程、糖尿病、抑郁评分和生物反馈治疗史4个独立预测因素, 构建了药物难治性慢性便秘的预测模型. 该模型在训练集和验证集均显示出良好的区分度(AUC>0.74)和校准度, 决策曲线分析证实其具有较高的临床净收益, 为临床早期识别高危患者提供了有效工具.
本研究发现病程是药物难治性的独立危险因素, 虽然单年效应量相对较小(OR = 1.04), 但病程的累积效应不容忽视. 病程从5年增加到15年, 药物难治性风险增加约48%. 这可能与长期便秘导致的肠道神经肌肉功能进行性损害、心理因素的累积效应以及对药物的逐渐耐受有关[6]. 此外, 长期使用泻药, 特别是刺激性泻药, 可能导致结肠黑变病, 进一步影响肠道动力. 心理因素的累积效应同样重要: 长期便秘带来的生活质量下降、反复治疗失败的挫败感可能加重患者的焦虑和抑郁情绪, 形成恶性循环. 更重要的是, 病程较长的患者往往已经尝试过多种治疗方案, 可能存在药物耐受或条件反射性治疗抵抗. 因此, 对于病程较长的患者, 应更早地考虑多模式治疗策略.
糖尿病作为重要的系统性疾病, 在本研究中显示出显著的预测价值(OR = 3.46). 糖尿病患者常伴有自主神经病变, 影响胃肠动力和感觉功能, 导致便秘症状[15]. 交感和副交感神经失衡导致肠道平滑肌收缩减弱, 推进性蠕动减慢, 直肠感觉阈值升高, 患者对排便刺激的敏感性下降, 内括约肌静息压降低或外括约肌协调障碍等都可能加重肠道功能障碍. 此外, 糖尿病患者的血糖控制不佳、微血管并发症等也可能影响肠道功能. 本研究结果提示, 对于合并糖尿病的便秘患者, 应积极控制血糖, 同时考虑更积极的治疗方案.
抑郁评分是本研究中另一个重要的预测因素(OR = 1.14). 抑郁等心理因素与功能性胃肠病的关系已得到广泛认可, 脑-肠轴理论为此提供了理论支持[16]. 从神经生物学角度, 抑郁症患者下丘脑-垂体-肾上腺轴功能亢进, 皮质醇水平升高, 可抑制肠道蠕动并改变肠道微生物组成; 同时, 5-羟色胺作为脑-肠轴的关键神经递质, 其合成和代谢异常不仅影响情绪调节, 还直接参与肠道动力和感觉功能的调控. 抑郁不仅影响患者对症状的感知和应对, 还可能通过神经内分泌途径影响肠道动力. 本研究结果强调了在慢性便秘治疗中重视心理评估和干预的重要性. 对于抑郁评分较高的患者, 可能需要联合抗抑郁治疗或心理治疗.
生物反馈治疗史作为保护因素(OR = 0.31)具有重要的临床意义. 生物反馈治疗通过训练患者协调盆底肌肉, 改善排便动力学, 已被证实对排便困难型便秘有效[17]. 生物反馈治疗通过直肠气囊扩张或肌电图反馈, 增强患者对直肠充盈和排便反射的感知能力, 降低直肠感觉阈值. 教导患者在排便时正确地放松盆底肌肉, 同时增强腹肌的推力, 纠正盆底肌肉的矛盾性收缩. 建立规律的排便时间和正确的排便姿势, 改善长期形成的不良排便模式. 本研究结果提示, 既往接受过生物反馈治疗的患者, 即使当前症状未完全缓解, 其发展为药物难治性的风险也显著降低. 这可能与生物反馈治疗带来的长期益处有关, 包括改善的排便习惯、增强的症状应对能力等.
本研究构建的列线图模型简洁实用, 仅需4个容易获取的临床指标即可计算个体化风险. 相比于既往多变量复杂模型, 本模型在保持较好预测性能的同时, 提高了临床可操作性[18]. 然而, 本研究也存在一些局限性: (1)单中心回顾性研究, 可能存在选择偏倚; (2)样本量相对较小, 需要更大样本量和多中心研究进一步验证; (3)缺乏外部验证队列; (4)未纳入某些可能相关的因素, 如肠道菌群、遗传因素等; (5)随访时间相对较短, 长期预测价值有待评估. 未来研究方向包括: (1)开展前瞻性多中心研究验证模型的外部有效性; (2)探索将模型整合到临床决策支持系统中; (3)研究基于模型的个体化治疗策略是否能改善患者预后; (4)纳入更多潜在预测因素(如肠道微生态、基因多态性等)进一步优化模型. 针对上述局限性, 本研究采取了以下措施以最大程度保证研究结果的可靠性: (1)采用严格的纳入和排除标准, 确保研究对象的同质性; (2)结局评估采用双人独立评定, 意见不一致时由第三方裁定, 减少评估偏倚; (3)采用LASSO回归进行变量筛选, 避免传统逐步回归的主观性和过拟合风险; (4)进行内部验证, 将数据按7:3随机分为训练集和验证集, 并采用Bootstrap重复抽样1000次评估模型稳定性; (5)通过多种评价指标(AUC、校准曲线、DCA)全面评估模型的区分度、校准度和临床实用性, 确保结果的可靠性.
综上所述, 本研究构建的基于病程、糖尿病、抑郁评分和生物反馈治疗史的预测模型对慢性便秘药物难治性具有较好的预测价值, 可为临床早期识别高危患者、制定个体化治疗策略提供参考, 有助于优化医疗资源配置, 改善患者预后.
慢性便秘是常见的功能性胃肠疾病, 患病率高且病因复杂, 与肠道动力障碍、代谢因素、心理因素及生活方式密切相关. 尽管药物治疗是主要手段, 仍有约20%-40%的患者对常规药物反应不佳, 形成药物难治性便秘, 导致治疗周期延长、费用增加和生活质量下降. 当前临床缺乏能够整合多因素的预测工具, 难以及时识别高危人群. 已有研究提示病程、代谢疾病及情绪状态可能影响药物反应性, 但尚未建立实用模型. 因此, 本研究通过回顾性分析筛选关键因素, 构建并验证药物难治性便秘预测模型, 为临床早期风险识别和个体化治疗提供参考.
慢性便秘中相当一部分患者对常规药物反应不佳, 形成药物难治性, 给诊治带来挑战. 然而临床目前缺乏可靠工具来提前识别哪些患者更可能治疗失败, 致使大量患者经历长期无效治疗、延误最佳干预时机并增加医疗负担. 本研究旨在解决这一关键问题: 通过系统分析影响药物反应性的多维因素, 筛选出最具预测价值的指标, 并构建可量化、易应用的个体化预测模型. 该问题的解决不仅有助于提高早期风险识别能力, 帮助临床优化治疗策略, 还可推动慢性便秘管理向精准化方向发展, 对提升疗效与资源利用具有重要意义.
本研究的主要目标是构建并验证一个能够预测药物难治性慢性便秘的个体化风险模型, 以实现对高危患者的早期识别. 为此, 本研究通过回顾性分析临床资料, 筛选影响药物反应性的关键因素, 研究成功实现了模型的开发与内部验证, 证明其具有良好的区分度和实用性. 该目标的达成不仅为临床制定个体化治疗策略提供量化依据, 也为慢性便秘管理的精准化和预测模型在功能性胃肠疾病领域的进一步应用奠定基础.
本研究采用回顾性临床研究方法, 收集慢性便秘患者的完整临床资料. 首先应用LASSO回归在18个候选变量中筛选关键因素, 避免传统逐步回归的主观性和过拟合问题. 随后采用多因素Logistic回归构建预测模型, 并通过受试者工作特征曲线、校准曲线及决策曲线对模型的区分度、拟合度与临床价值进行系统验证. 最后构建列线图实现可视化预测. 该方法结合多维临床数据、机器学习筛选与统计模型构建, 具有简洁、客观、可应用性强的特点, 并在预测药物难治性便秘方面具有一定创新性.
本研究成功构建并验证了药物难治性慢性便秘的个体化预测模型, 顺利实现既定研究目标. 通过LASSO筛选和多因素Logistic回归分析, 最终确定病程、糖尿病、抑郁评分及生物反馈治疗史为独立预测指标. 模型在训练集和验证集的曲线下面积分别为0.775和0.740, 显示良好的区分度; 校准曲线拟合度良好, 决策曲线证明其具有稳定的临床净收益, 并构建了直观可用的列线图工具. 本研究结果为药物反应性预测提供了可靠模型, 填补了该领域预测工具不足的空白, 为临床早期识别高危人群和推动慢性便秘精准管理具有重要的促进作用.
本研究首次发现病程、糖尿病、抑郁评分和生物反馈治疗史可共同预测药物难治性慢性便秘, 提出了药物反应受代谢-心理-功能多因素交互影响的理论假说, 并构建了基于LASSO与Logistic回归的全新个体化预测模型. 研究验证了多因素综合预测优于单指标的新观点, 丰富了便秘治疗反应的认知体系. 该模型显示良好性能, 为精准识别高危患者提供了新工具, 并对临床优化治疗路径具有潜在价值.
本研究的经验表明, 高质量临床数据及科学的变量筛选方法对预测模型的可靠性至关重要, 同时也暴露出样本量有限、单中心研究和缺乏外部验证等局限. 未来研究可从三个方向推进: 一是开展多中心、大样本的前瞻性队列研究, 以提高模型的泛化能力; 二是纳入更丰富的生物学指标, 如肠道菌群、炎症因子或基因多态性, 深化对药物难治机制的理解; 三是采用更先进的建模方法, 如机器学习、集成算法或深度学习, 以提升预测精度与临床适用性. 通过不断迭代模型, 有望推动慢性便秘风险预测向精准化、智能化方向发展.
| 1. | Ihara E, Manabe N, Ohkubo H, Ogasawara N, Ogino H, Kakimoto K, Kanazawa M, Kawahara H, Kusano C, Kuribayashi S, Sawada A, Takagi T, Takano S, Tomita T, Noake T, Hojo M, Hokari R, Masaoka T, Machida T, Misawa N, Mishima Y, Yajima H, Yamamoto S, Yamawaki H, Abe T, Araki Y, Kasugai K, Kamiya T, Torii A, Nakajima A, Nakada K, Fukudo S, Fujiwara Y, Miwa H, Kataoka H, Nagahara A, Higuchi K. Evidence-Based Clinical Guidelines for Chronic Constipation 2023. Digestion. 2025;106:62-89. [PubMed] [DOI] |
| 2. | Aziz I, Whitehead WE, Palsson OS, Törnblom H, Simrén M. An approach to the diagnosis and management of Rome IV functional disorders of chronic constipation. Expert Rev Gastroenterol Hepatol. 2020;14:39-46. [PubMed] [DOI] |
| 3. | Hojo M, Shibuya T, Nagahara A. Management of Chronic Constipation: A Comprehensive Review. Intern Med. 2025;64:7-15. [PubMed] [DOI] |
| 4. | Boyd T, Paz M, Ahmad I, Rao F, Samad A, Garcia-Fischer I, Silvernale C, Murray HB, Staller K. Unrecognized Functional Dyspepsia Among Those With Refractory Chronic Constipation: Analysis of a Tertiary Cohort. Gastro Hep Adv. 2023;2:573-579. [PubMed] [DOI] |
| 5. | Heemskerk SCM, Dirksen CD, van Kuijk SMJ, Benninga MA, Baeten CIM, Masclee AAM, Melenhorst J, Breukink SO. Sacral Neuromodulation Versus Conservative Treatment for Refractory Idiopathic Slow-transit Constipation: The Randomized Clinical No.2-Trial. Ann Surg. 2024;279:746-754. [PubMed] [DOI] |
| 6. | Zhao Z, Bai B, Wang S, Zhou Y, Yu P, Zhao Q, Yang B. Physical and psychological correlates of somatic symptom in patients with functional constipation: a cross-sectional study. BMC Psychiatry. 2024;24:134. [PubMed] [DOI] |
| 7. | Włodarczyk J, Waśniewska A, Fichna J, Dziki A, Dziki Ł, Włodarczyk M. Current Overview on Clinical Management of Chronic Constipation. J Clin Med. 2021;10:1738. [PubMed] [DOI] |
| 8. | Yun Q, Wang S, Chen S, Luo H, Li B, Yip P, Yu X, Yang Z, Sha F, Tang J. Constipation preceding depression: a population-based cohort study. EClinicalMedicine. 2024;67:102371. [PubMed] [DOI] |
| 9. | Liu L, Yuan Y, Zeng J, Zhu G, Su X, Gong X, Cui C. Development and validation of a nomogram for predicting postoperative new-onset constipation in elderly patients undergoing hip fracture surgery. Sci Rep. 2025;15:15289. [PubMed] [DOI] |
| 10. | Razavi SZE, Amirak A, Rahimi N, Hosseini M, Azadvari M, Rafiei M. The Effect of Biofeedback on Constipation, Sleep, Depression, Anxiety and Quality of Life in Patients with Dyssynergic Defecation: a QUASI Experimental Study (Before and After Study). Appl Psychophysiol Biofeedback. 2025;50:71-77. [PubMed] [DOI] |
| 11. | Velescu DR, Marc MS, Traila D, Pescaru CC, Hogea P, Suppini N, Crisan AF, Wellmann N, Oancea C. A Narrative Review of Self-Reported Scales to Evaluate Depression and Anxiety Symptoms in Adult Obstructive Sleep Apnea Patients. Medicina (Kaunas). 2024;60:261. [PubMed] [DOI] |
| 12. | Wang YH, Li CP, Wang JX, Cui Z, Zhou Y, Jing AR, Liang MM, Liu Y, Gao J. Advanced Machine Learning to Predict Coronary Artery Disease Severity in Patients with Premature Myocardial Infarction. Rev Cardiovasc Med. 2025;26:26102. [PubMed] [DOI] |
| 13. | Wang J, Xu Y, Liu L, Wu W, Shen C, Huang H, Zhen Z, Meng J, Li C, Qu Z, He Q, Tian Y. Comparison of LASSO and random forest models for predicting the risk of premature coronary artery disease. BMC Med Inform Decis Mak. 2023;23:297. [PubMed] [DOI] |
| 14. | Han A, Zhang S, Yao Y, He J, Wang Y, Yang H. Development and validation of a risk predication model for nutritional risk based on water swallowing test in post-stroke with dysphagia. PLoS One. 2025;20:e0330982. [PubMed] [DOI] |
| 15. | Zhou MX, Zhao Y, Chu CL, Behera TR, Shen QQ, Xing YB. Diabetic gastrointestinal autonomic neuropathy: Integrating neuronal degeneration and gut microbial dysbiosis. World J Diabetes. 2025;16:110053. [PubMed] [DOI] |
| 16. | Guadagnoli L, Heathcote LC, Van Oudenhove L, Elsenbruch S, Keefer L. The psychobiological model of disorders of gut-brain interaction: introduction of a novel, integrated, and testable model. Lancet Gastroenterol Hepatol. 2025;10:1041-1052. [PubMed] [DOI] |
| 17. | Emad N, Elbanna HG, AbdelMawla A, Balata M. Biofeedback training versus botox injection for the treatment of dyssynergic defaecation: A randomized controlled trial. Colorectal Dis. 2025;27:e70109. [PubMed] [DOI] |
| 18. | Miché M, Strippoli MF, Preisig M, Lieb R. Evaluating the clinical utility of an easily applicable prediction model of suicide attempts, newly developed and validated with a general community sample of adults. BMC Psychiatry. 2024;24:217. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁