修回日期: 2025-11-04
接受日期: 2025-11-14
在线出版日期: 2025-11-28
磁共振质子密度脂肪分数(magnetic resonance imaging proton density fat fraction, MRI PDFF)能够量化肝脏脂肪含量, 且不受肝脏炎症或纤维化的影响, 已被多项研究证实与组织学脂肪变程度高度一致, 但存在检查费用昂贵、设备普及率低等不足, 不利于临床筛查和长期随访.
分析超声脂肪分数(ultrasound-derived fat fraction, UDFF)评估代谢相关脂肪性肝病(metabolism-associated fatty liver disease, MAFLD)肝脂肪变程度与磁共振的一致性.
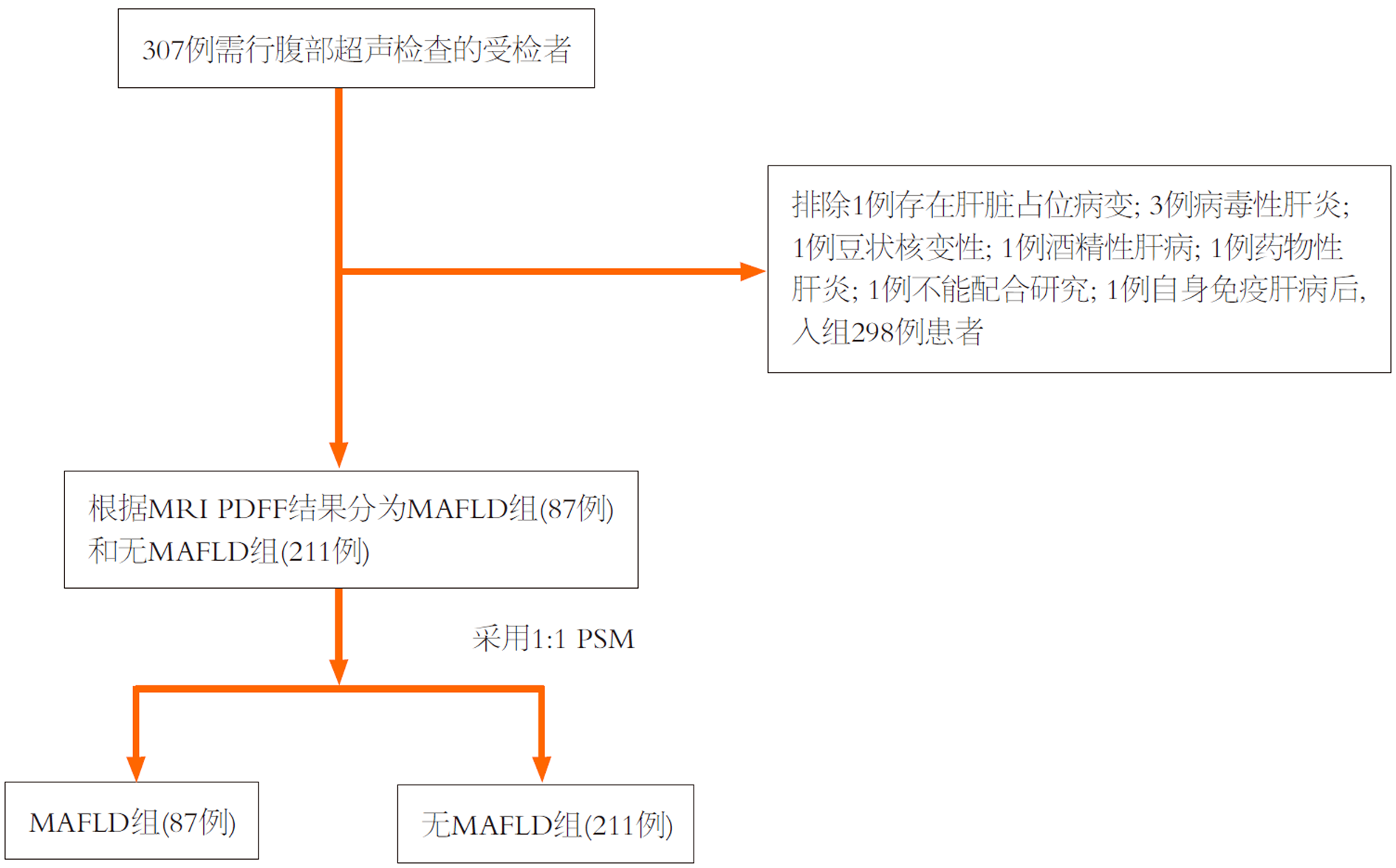
选取金华市中医医院2023-02/2025-03收治的298例需行腹部超声检查的受检者开展前瞻性研究, 使用UDFF和MRI PDFF检测MAFLD及其脂肪变程度. 根据MRI PDFF结果分为MAFLD组(87例)、无MAFLD组(211例), 使用倾向性评分匹配对两组进行1:1配对降低组间偏倚. 其中MAFLD组包括轻度28例, 中度34例, 重度25例. 比较两组及不同肝脂肪变程度患者UDFF、MRI PDFF, 以Pearson相关性分析MAFLD组与无MAFLD组UDFF与MRI PDFF相关性, 以组内相关系数(intra-class correlation coefficient, ICC)评估不同肝脂肪变程度患者中, UDFF与MRI PDFF的一致性; 以Bland-Altman分析偏差(Bias)和95%一致性界限(limits of agreement, LOA); 采用Kappa值检验UDFF评估MAFLD肝脂肪变程度与MRI PDFF的一致性.
MAFLD组患者UDFF、MRI PDFF显著高于无MAFLD组, 差异有统计学意义(P<0.05); Pearson相关性分析显示, 在MAFLD组与无MAFLD组中, UDFF均与MRI PDFF呈显著正相关(均P<0.001); 不同肝脂肪变程度患者之间比较, 轻度、中度、重度患者UDFF、MRI PDFF依次升高, 两两比较差异均有统计学意义(P<0.05); ICC分析显示, 轻度患者中: ICC = 0.723, 提示两者具有中等一致性; 中度与重度患者中, ICC均>0.850, 提示两者均具有优秀的一致性, 即UDFF在较高脂肪变时与MRI-MRI PDFF高度一致; Bland-Altman分析显示, 轻度患者中, Bias = 0.920%, 提示UDFF略高估, LOA范围较宽(-0.980至2.820), 提示低值区间一致性较低; 中度和重度患者中, Bias偏差缩小, 尤其是重度患者几乎无偏差(Bias = -0.25%), LOA变窄, 表明中高脂肪变时两种方法高度一致; Kappa值检验显示, UDFF评估MAFLD肝脂肪变程度与MRI PDFF符合率为95.40%, Kappa值为0.930(95%CI: 0.781-0.998)(P<0.05).
UDFF在中、重度脂肪变时与MRI PDFF呈现出高度的一致性, 可作为MAFLD肝脂肪变程度的一种可行替代方案, 减少对MRI的依赖和不必要的肝活检创伤, 降低医疗成本.
核心提要: 本研究旨在探讨超声脂肪分数(ultrasound-derived fat fraction, UDFF)在评估代谢相关脂肪性肝病(metabolic associated fatty liver disease, MAFLD)肝脂肪变程度方面与磁共振质子密度脂肪分数的一致性, 评估UDFF在临床实践中的潜在应用价值, 为优化MAFLD的无创诊断、推动超声定量技术在MAFLD筛查和监测中的应用提供参考.
引文著录: 王红娟, 何鸣华, 李华威. 超声UDFF与磁共振PDFF评估MAFLD肝脂肪变程度一致性的前瞻性探索性研究. 世界华人消化杂志 2025; 33(11): 902-910
Revised: November 4, 2025
Accepted: November 14, 2025
Published online: November 28, 2025
Magnetic resonance imaging-proton density fat fraction (MRI-PDFF) can quantify liver fat content, which is independent of liver inflammation or fibrosis. Numerous studies have established that its result correlates highly with the histologic steatosis grade. However, it has the disadvantages of expensive examination and low equipment penetration, which is not conducive to clinical screening and long-term follow-up.
To analyze the consistency between ultrasound-derived fat fraction (UDFF) and MRI-PDFF in evaluating hepatic steatosis severity in metabolism-associated fatty liver disease (MAFLD).
A prospective study was conducted on 298 subjects who underwent abdominal ultrasound examinations and were admitted to our hospital from February 2023 to March 2025. UDFF and MRI-PDFF were used to detect MAFLD and the degree of steatosis. According to the MRI-PDFF results, the subjects were divided into an MAFLD group (87 cases) and a non-MAFLD group (211 cases). Propensity score matching was used to perform a 1:1 match between the two groups to reduce inter-group bias. The MAFLD group included 28 cases of mild, 34 cases of moderate, and 25 cases of severe MAFLD. The UDFF and MRI-PDFF values were compared between the two groups and among patients with different degrees of liver steatosis. Pearson correlation analysis was used to analyze the correlation between UDFF and MRI-PDFF in the MAFLD and non-MAFLD groups. The intra-class correlation coefficient (ICC) was used to evaluate the consistency of UDFF and MRI-PDFF among patients with different degrees of liver steatosis. Bland-Altman analysis was used to analyze bias and 95% limits of agreement (LOA). The Kappa value was used to test the consistency between UDFF and MRI-PDFF in assessing the degree of liver steatosis in MAFLD.
The UDFF and MRI-PDFF values in the MAFLD group were significantly higher than those in the non-MAFLD group (P < 0.05). Pearson correlation analysis revealed a significant positive correlation between UDFF and MRI-PDFF in both the MAFLD and non-MAFLD groups (both P < 0.001). Among patients with different degrees of hepatic steatosis, UDFF and MRI PDFF values increased sequentially with the increase of steatosis severity (P < 0.05). ICC analysis indicated a moderate consistency between the two methods in mild patients (ICC = 0.723), while in moderate and severe patients, both ICC values were greater than 0.850, indicating an excellent consistency, suggesting that UDFF was highly consistent with MRI-MRI PDFF in cases of moderate and severe steatosis. Bland-Altman analysis showed that in mild patients, the bias was 0.920%, indicating a slight overestimation of UDFF, and the LOA range was wide (-0.980-2.820), suggesting lower consistency in the low-value range. In moderate and severe patients, the bias decreased, especially in severe patients where there was almost no bias (-0.25%), and the LOA narrowed, indicating high consistency between the two methods in cases of moderate to severe steatosis. The Kappa value test revealed a concordance rate of 95.40% between UDFF and MRI PDFF in assessing the degree of hepatic steatosis in MAFLD, with a Kappa value of 0.930 (95% confidence interval: 0.781-0.998) (P < 0.05).
UDFF shows a high degree of consistency with MRI-PDFF in moderate and severe steatosis, which can be used as a feasible alternative in evaluating the degree of hepatic steatosis in MAFLD. This will reduce dependence on MRI and unnecessary liver biopsy trauma, and decrease medical costs.
- Citation: Wang HJ, He MH, Li HW. Consistency between ultrasound-derived fat fraction and magnetic resonance imaging-proton density fat fraction in evaluating hepatic steatosis severity in MAFLD: A prospective exploratory study. Shijie Huaren Xiaohua Zazhi 2025; 33(11): 902-910
- URL: https://www.wjgnet.com/1009-3079/full/v33/i11/902.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i11.902
代谢相关脂肪性肝病(metabolic associated fatty liver disease, MAFLD)主要病理特征为肝细胞内脂肪过度沉积, 即肝脂肪变[1,2]. 随着全球肥胖和糖尿病等代谢相关疾病发病率的不断攀升, MAFLD已成为慢性肝病的主要病因之一, 并可进一步发展为非酒精性脂肪性肝炎、肝纤维化、肝硬化甚至肝癌, 因此, 准确评估肝脂肪变程度对于疾病诊断、风险分层和治疗监测至关重要[3]. 目前肝活检仍是诊断肝脂肪变和分级的金标准, 但由于其侵入性、取样误差和并发症风险, 临床应用受到限制. 近年来无创影像学技术, 尤其是磁共振质子密度脂肪分数(magnetic resonance imaging proton density fat fraction, MRI PDFF), 因具有高准确性和可重复性的优点, 已成为评估肝脂肪含量的重要替代方法[4,5]. MRI PDFF能够量化肝脏脂肪含量, 且不受肝脏炎症或纤维化的影响, 已被多项研究证实与组织学脂肪变程度高度一致, 但存在检查费用昂贵、设备普及率低等不足, 不利于临床筛查和长期随访[6,7]. 超声检查因其无创、便捷、低成本等优势, 一直是肝脏疾病筛查的首选方法, 其中超声脂肪分数(ultrasound-derived fat fraction, UDFF)技术的发展为肝脂肪变的定量评估提供了新可能, 其基于射频信号分析或超声衰减/散射参数, 能够计算肝脏脂肪含量[8,9]. 但现阶段关于UDFF与MRI PDFF在MAFLD不同肝脂肪变程度的诊断一致性方面的研究有限, 尤其是轻度病变的检测效能, UDFF能否作为一种高准确度的无创、高经济型替代工具值得进一步探讨. 本研究旨在探讨UDFF在评估MAFLD肝脂肪变程度方面与MRI-PDFF的一致性, 评估UDFF在临床实践中的潜在应用价值, 为优化MAFLD的无创诊断、推动超声定量技术在MAFLD筛查和监测中的应用提供参考.
选取金华市中医医院2023-02/2025-03收治的298例需行腹部超声检查的受检者开展前瞻性研究. (1)纳入标准: ①因病情需要, 行腹部超声检查和MRI PDFF检查; ②>18岁; ③无相关检查禁忌症. (2)排除标准: ①存在肝脏占位病变; ②病毒性肝炎; ③豆状核变性; ④酒精性肝病; ⑤药物性肝炎; ⑥不能配合研究; ⑦自身免疫肝病. 本研究获得金华市中医医院伦理委员会批准, 批号: 金华市中医医院伦审2025研第032号-批, 患者签署知情同意书. 患者招募流程图见图1.
1.2.1 UDFF检查: 超声仪(西门子MAGNETOM Vida型), 凸阵探头频率1.0-5.0 MHz(二维超声)或DAX凸阵探头1.0-3.5 MHz(UDFF检查), 实施腹部超声检查[10]. 指导受检者平卧, 右手上举抱于头后, 暴露自胸骨角至脐部的腰腹部皮肤, 必要时可采取左侧卧位. 先对肝脏进行全面扫查, 再激活UDFF, 右侧肋间放置探头, 经肝右叶区域, 滑动轨迹球, 保证定位横杆平行于肝包膜, 且距离肝包膜1.5 cm. 避开肝内较大的管道结构取样, 指导受检者屏气, 测量取样框部分肝脏UDFF值. 在肝脏Ⅴ段及Ⅷ段分别获取5个UDFF值, 取中位数作为最终UDFF. 根据肝右叶肋间能同时显示膈肌和门静脉主干长轴的切面判断脂肪变性程度, 分为0级(肝脏回声均匀, 门静脉和膈肌等结构清晰)、1级(肝脏回声轻度增强, 门静脉和膈肌减弱)、2级(肝脏回声中度增强, 门静脉和膈肌减弱)、3级(肝脏回声严重增强, 门静脉和膈肌几乎不可见), 其中≥1级为存在肝脂肪变.
1.2.2 MRI PDFF: 指导首检者仰卧位, MRI仪(西门子Vida 3.0T), 相控阵体部线圈, 行肝脏vibe-q-dixon序列扫描: 扫描范围整个肝脏, 采集体素为2.8 mm×2.8 mm×3.5 mm, 成像方向轴位, 重建矩阵为640×640, TR/TE 9.00/1.05/2.46/3.69/4.92/6.15/7.38 ms, 层厚3.5 mm, 回波间隔时间为1.3 ms, 6个梯度回波, 采集矩阵为111×160, 翻转角位4°, 重建体素为1.4 mm×1.4 mm×3.5 mm, 扫描视野280 mm×320 mm, 扫描时间16 s. 完成扫描后, 手动描记全肝范围获得全肝MRI PDFF值[11]. 根据MRI PDFF值将肝脂肪变程度分为轻度(5%<MRI PDFF值≤10%)、中度(10%<MRI PDFF值<25%)、重度(MRI PDFF值≥25%). 根据MRI PDFF结果分为MAFLD组(≥5%, 87例)、无MAFLD组(<5%, 211例).
1.2.3 基线资料: 收集两组年龄、性别、体质量指数(body mass index, BMI)、吸烟史、饮酒史、糖尿病、高脂血症、高血压、冠心病、腰臀比、血小板、肝功能[总蛋白、白蛋白、总胆汁酸、总胆红素、丙氨酸转氨酶、天冬氨酸转氨酶]数据资料.
统计学处理 采用SPSS Statistics 25.0软件分析数据, 计数资料用n(%)表示, 两组间行χ2检验; 计量资料以(mean±SD)表示, 两组间行独立样本t检验; 使用倾向性评分匹配(propensity score matching, PSM)对MAFLD组和无MAFLD组进行1:1配对降低组间偏倚; 以Pearson相关性分析MAFLD组与无MAFLD组对象UDFF与MRI PDFF相关性, 用于初步评估两变量间的线性趋势关系; 采用Bland-Altman分析和组内相关系数(intra-class correlation coefficient, ICC)作为评估UDFF与MRI-PDFF一致性的主要统计方法, 其中ICC评估不同肝脂肪变程度患者中, UDFF与MRI PDFF的一致性(ICC>0.75为良好); 以Bland-Altman分析偏差(Bias)和95%一致性界限(limits of agreement, LOA), Bias越小偏差越小, LOA范围越窄, 一致性越高, 在进行Bland-Altman分析时, 采用Pearson相关性检验对差值的绝对值与平均值进行异方差性评估; 采用Kappa值检验UDFF评估MAFLD肝脂肪变程度与MRI PDFF一致性的, 其中Kappa值>0.75为好. P<0.05为差异有统计学意义.
全部对象中, 87例受检者患有MAFLD, 211例无MAFLD, 两组年龄、性别、吸烟史、饮酒史、高血压、冠心病、血小板、肝功能比较差异无统计学意义(P>0.05), 但MAFLD组BMI、糖尿病、高脂血症、腰臀比高于无MAFLD组(P<0.05). 按照PSM进行1:1配对后, MAFLD组与无MAFLD组均筛选出87例, 两组以上各项临床资料比较差异均无统计学意义(P>0.05). 见表1.
| 资料 | PSM前 | PSM后 | ||||||
| MAFLD组(87例) | 无MAFLD组(211例) | t/χ2/Z | P值 | MAFLD组(87例) | 无MAFLD组(87例) | t/χ2/Z | P值 | |
| 年龄(岁) | 46.25±8.09 | 44.97±10.13 | 1.048 | 0.295 | 46.25±8.09 | 45.78±9.25 | 0.357 | 0.722 |
| 性别 | 0.229 | 0.633 | 0.376 | 0.540 | ||||
| 男 | 48(55.17) | 110(52.13) | 48(55.17) | 52(59.77) | ||||
| 女 | 39(44.83) | 101(47.87) | 39(44.83) | 35(40.23) | ||||
| BMI(kg/m2) | 27.52±0.94 | 24.82±1.03 | 21.092 | 0.000 | 27.52±0.94 | 27.19±1.30 | 1.919 | 0.057 |
| 吸烟史 | 39(44.83) | 88(41.71) | 0.245 | 0.620 | 39(44.83) | 33(37.93) | 0.853 | 0.356 |
| 饮酒史 | 4(4.60) | 15(7.11) | 0.651 | 0.420 | 4(4.60) | 2(2.30) | 0.173 | 0.678 |
| 糖尿病 | 54(62.07) | 50(23.70) | 39.923 | 0.000 | 54(62.07) | 42(48.28) | 3.346 | 0.067 |
| 高脂血症 | 61(70.11) | 80(37.91) | 25.622 | 0.000 | 61(70.11) | 55(63.22) | 0.931 | 0.335 |
| 高血压 | 10(11.49) | 18(8.53) | 0.635 | 0.425 | 10(11.49) | 5(5.75) | 1.824 | 0.177 |
| 冠心病 | 5(5.75) | 6(2.84) | 0.758 | 0.384 | 5(5.75) | 3(3.45) | 0.131 | 0.717 |
| 腰臀比 | 0.95±0.25 | 0.82±0.20 | 4.730 | 0.000 | 0.95±0.25 | 0.88±0.24 | 1.884 | 0.061 |
| 血小板(×109/L) | 223.05±26.87 | 226.16±30.48 | -0.828 | 0.408 | 223.05±26.87 | 224.91±28.52 | -0.443 | 0.658 |
| 总蛋白(g/L) | 67.10±5.88 | 68.26±6.04 | -1.519 | 0.130 | 67.10±5.88 | 67.36±4.92 | -0.316 | 0.752 |
| 白蛋白(g/L) | 40.25±2.47 | 40.61±2.59 | -1.106 | 0.270 | 40.25±2.47 | 40.40±2.28 | -0.416 | 0.678 |
| 总胆汁酸(μmol/L) | 3.59±0.91 | 3.82±0.76 | -2.238 | 0.026 | 3.59±0.91 | 3.67±0.83 | -0.606 | 0.545 |
| 总胆红素(μmol/L) | 10.09±2.84 | 10.35±2.65 | -0.754 | 0.451 | 10.09±2.84 | 10.27±2.75 | -0.425 | 0.672 |
| ALT(U/L) | 16.78±4.59 | 15.40±3.00 | 3.063 | 0.002 | 16.78±4.59 | 16.25±3.66 | 0.842 | 0.401 |
| AST(U/L) | 17.03±5.12 | 16.29±4.18 | 1.298 | 0.195 | 17.03±5.12 | 16.84±4.75 | 0.254 | 0.800 |
MAFLD组患者UDFF、MRI PDFF显著高于无MAFLD组, 差异有统计学意义(P<0.05), 见表2.
| 组别 | 例数 | UDFF | MRI PDFF |
| MAFLD组 | 87 | 17.95±4.30 | 17.99±4.32 |
| 无MAFLD组 | 87 | 4.00±0.33 | 3.61±0.45 |
| t | 30.171 | 30.881 | |
| P值 | 0.000 | 0.000 |
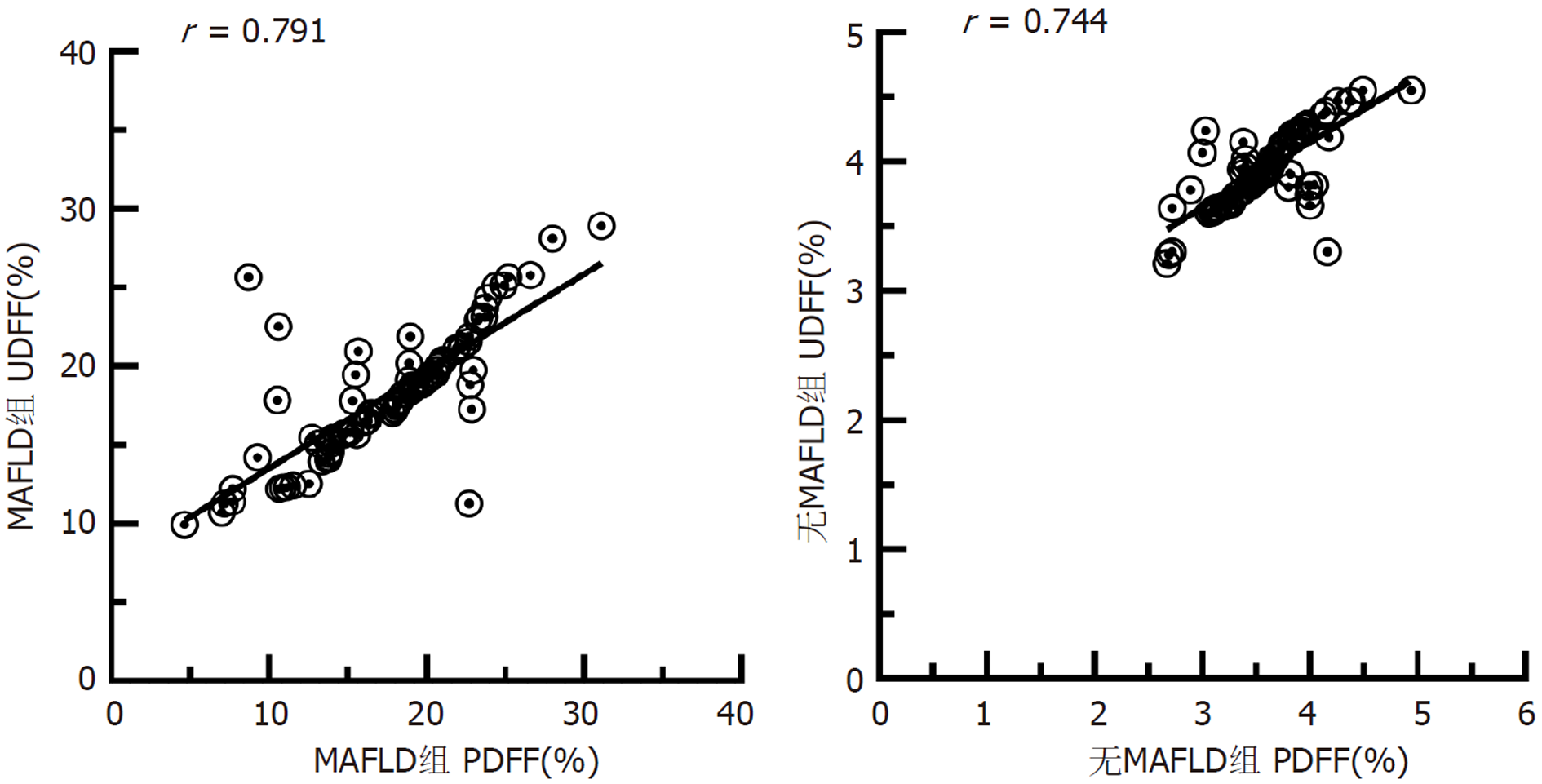
Pearson相关性分析显示, 在MAFLD组与无MAFLD组中, UDFF均与MRI PDFF呈显著正相关(r = 0.791、0.744, 均P<0.001), 见图2.
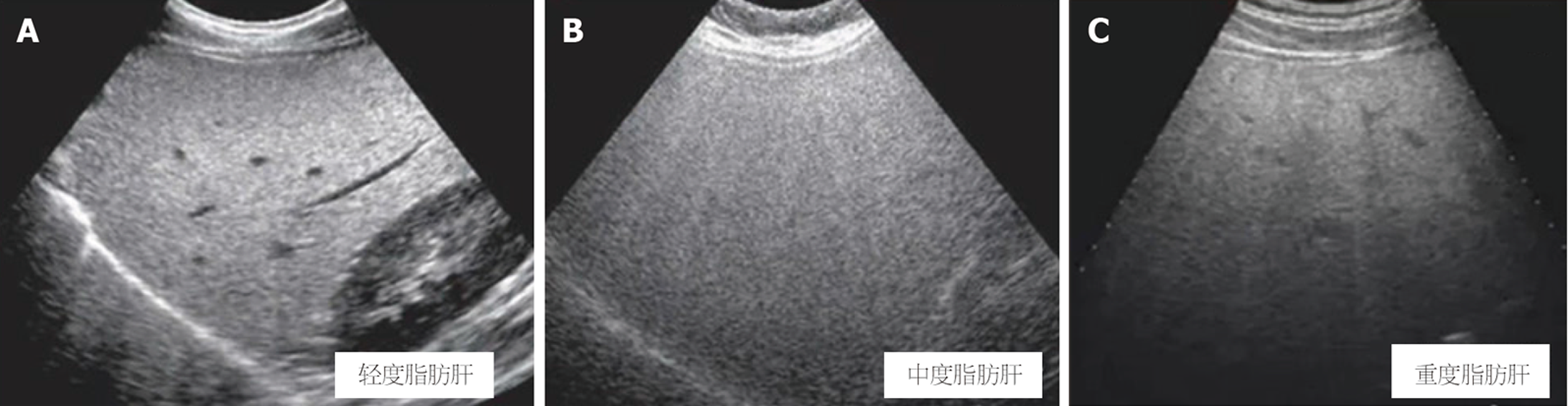
不同肝脂肪变程度患者之间比较, 轻度、中度、重度患者UDFF、MRI PDFF依次升高, 两两比较差异均有统计学意义(P<0.05). ICC分析显示, 轻度患者中: ICC = 0.723, 提示两者具有中等一致性; 中度与重度患者中, ICC均>0.850, 提示两者均具有优秀的一致性, 即UDFF在较高脂肪变时与MRI-MRI PDFF高度一致. Bland-Altman分析显示, 轻度患者中, Bias = 0.920%, 提示UDFF略高估, LOA范围较宽(-0.980至2.820), 提示低值区间一致性较低; 中度和重度患者中, Bias偏差缩小, 尤其是重度患者几乎无偏差(Bias = -0.25%), LOA变窄, 表明中高脂肪变时两种方法高度一致. 异方差性检验显示, 测量差值的绝对值与平均值间无显著相关性(r = 0.182, P = 0.092), 表明数据不存在显著的异方差性, 所报告的总体Bias与LOA在全测量范围内具有稳定性. 见表3. 不同肝脂肪变程度患者超声表现见图3.
UDFF系新型肝脂肪变含量测定技术, 其固定的感兴趣区及系统内置的参照模体数据能显著降低不同超声科技师及不同受检者之间的差异, 提高诊断的准确性[12,13]. 本研究结果发现, MAFLD组患者UDFF、MRI PDFF显著高于无MAFLD组, 且Pearson相关性分析显示, 在MAFLD组与无MAFLD组中, UDFF均与MRI PDFF呈显著正相关, 与Qi等[14]报道一致, 提示两者变化趋势一致.
在以上研究基础上, 本研究根据MAFLD肝脂肪变程度分组, 通过ICC分析发现, UDFF与MRI PDFF的一致性随脂肪变程度加重而提高, 轻度组ICC = 0.723(中等一致性), 中度和重度组ICC>0.85(优秀一致性). 进一步采用Bland-Altman分析发现, 结果发现, 随着肝脂肪变程度增加, UDFF、MRI PDFF依次升高, 可评估MAFLD肝脂肪变程度, 其中UDFF在轻度MAFLD时存在一定高估(Bias = 0.920%), LOA范围较宽(-0.980至2.820), 提示低值区间一致性较低, 而在中、重度脂肪变时偏差缩小(Bias趋近于0), 提示UDFF在较高脂肪含量时的准确性更优. 分析原因发现, MRI PDFF基于多回波化学位移成像, 可精准区分水脂信号, 受肝脏背景影响较小, 因此在低脂肪含量时仍能保持高准确性[15,16]. 而轻度MAFLD时, 肝脏脂肪沉积较少, 超声信号受皮下脂肪、肝脏纤维化或炎症背景噪声干扰较大, UDFF依赖超声射频信号分析, 在低值区间易受设备分辨率和操作者经验影响, 导致UDFF测量值偏高; 而中重度MAFLD时, 脂肪沉积显著, 超声信号变化更易被检测, 与MRI PDFF的一致性提高[17-19]. 可见UDFF在MAFLD筛查中具有重要价值, 尤其在中重度肝脂肪变程度患者中, 可作为MRI PDFF的可靠替代方案.
超声衰减系数、反向散射系数受测量深度的影响, 其值随深度线性减小, Ferraioli等[20]将感兴趣区域的上边缘定位在肝包膜下1.5、2、3、4.5 cm处获得UDFF, 采用感兴趣变量的多项式发展来选择最佳模型, 并校正了包括年龄、性别、皮肤到肝脏包膜的距离、僵硬度等在内的协变量, 结果显示, 1.5 cm位置得到了最佳拟合模型. 本研究首先保证定位横杆平行于肝包膜, 且距离肝包膜1.5 cm, 获得了清晰的图像与预期效果, 临床在应用UDFF评估脂肪变程度时, 应重视并统一测量深度的影响, 避免测量深度引起的结果偏倚. 有研究指出[21], 高BMI患者皮下脂肪常较厚, 声波在进入肝脏前会显著衰减, 故指出BMI是影响UDFF与MRI PDFF测定肝脂肪变是否一致的重要因素. 本研究为克服该问题, 采用PSM对MAFLD组和无MAFLD组进行1:1配对降低组间偏倚, 经PSM后两组包括BMI在内多项资料均衡可比, 所以能提高研究结果的准确度和可信度.
本研究后续的Kappa检验显示, UDFF与MRI PDFF在脂肪变程度分级中的总体符合率达95.40%(Kappa = 0.930), 表明UDFF在区分轻、中、重度脂肪变时具有高度一致性. 有资料显示[22], 在不同级别肝脂肪变性的诊断效力比较中, UDFF优于可控衰减参数和肝/肾比等传统超声指标, UDFF与MRI PDFF的相关性最强, 支持UDFF作为替代手段. 与既往研究相比, 本研究首次揭示UDFF在轻度MAFLD中的高估趋势(Bias = 0.920), 同时本研究还具有以下创新点: (1)方法学创新: 本研究采用PSM的方法, 旨在控制真实世界研究中的混杂偏倚, 从而对UDFF与MRI-PDFF的一致性进行一次相对严谨的探索性评估. 基于本研究发现的UDFF在不同脂肪变程度下的性能差异, 初步探讨了一个分层管理的潜在可行性; (2)识别中重度病变: 对已存在显著脂肪浸润患者, 临床管理更为紧迫, UDFF作为一种便捷、经济的工具, 其主要的临床应用价值在于对中高危人群进行快速初筛, 以有效识别或排除中重度脂肪肝, 从而减少对MRI的依赖. 本研究发现, UDFF在低脂肪含量区间(尤其是临床临界值5%附近)存在系统性高估且测量变异度较大, 导致其无法可靠地区分正常肝脏与轻度脂肪肝. 因此UDFF不推荐用于轻度MAFLD的筛查或排除诊断, 因为其固有的测量误差可能导致大量的假阳性结果, 此类患者仍需依靠MRI-PDFF; (3)技术推广价值: 研究证实UDFF可减少83%的MRI需求, 且通过标准化操作(如统一取样深度)克服传统超声主观性, 这对资源有限地区的MAFLD普筛具有实际意义. 本研究根据目前准确度高的MRI PDFF进行分组, 结果提示UDFF与MRI-MRI PDFF具有良好的一致性, 但肝活检是诊断肝脂肪变和分级的金标准, 为避免给受检者带来不必要的创伤, 本研究未进行肝活检, 未能验证进一步以肝活检为对照, UDFF的诊断价值, 这是本研究不足之处, 下一步仍需积累肝活检病例进行深入的观察分析. 尽管本研究采用了PSM以控制混杂偏倚, 但MAFLD组, 特别是轻度脂肪变亚组的样本量相对有限, 这可能导致该亚组一致性分析(如ICC和Bland-Altman分析)的估计精度不足, 未来需要开展更大样本量的研究, 尤其是纳入更多轻度MAFLD患者, 以进一步精确评估UDFF在该人群中的诊断性能. 需要指出的是, 本研究旨在初步验证UDFF的原理有效性, 所有测量均由固定且经验丰富的超声医师遵循严格标准完成. 然而本研究未对操作者内及操作者间的可重复性进行评估, 这是本研究的一个明确局限, 也是该技术未来实现标准化和多中心应用前必须攻克的关键环节, 因此后续研究应立即着眼于评估UDFF的操作者内及操作者间变异度, 以全面论证其在临床实际环境中的稳健性与可推广性.
综上所述, UDFF在中、重度脂肪变时与MRI PDFF呈现出高度的一致性, 可作为MAFLD肝脂肪变程度的一种可行替代方案, 减少对MRI的依赖和不必要的肝活检创伤, 降低医疗成本, 这一发现不仅解决了"UDFF能否替代MRI"的问题, 还通过量化一致性边界(如Bias、LOA), 回答了"如何替代"及"何时替代"的问题, 为后续技术优化提供了新方向.
磁共振质子密度脂肪分数(magnetic resonance imaging proton density fat fraction, MRI PDFF)能够量化肝脏脂肪含量, 且不受肝脏炎症或纤维化的影响, 已被多项研究证实与组织学脂肪变程度高度一致, 但存在检查费用昂贵、设备普及率低等不足, 不利于临床筛查和长期随访.
现阶段关于超声脂肪分数(ultrasound-derived fat fraction, UDFF)与MRI PDFF在代谢相关脂肪性肝病(metabolism-associated fatty liver disease, MAFLD)不同肝脂肪变程度的诊断一致性方面的研究有限, 尤其是轻度病变的检测效能, UDFF能否作为一种高准确度的无创、高经济型替代工具值得进一步探讨.
分析UDFF评估MAFLD肝脂肪变程度与磁共振的一致性.
本研究对298例腹超受检者进行UDFF与MRI PDFF检测, 按MRI PDFF结果分为MAFLD组(87例, 含轻/中/重度)和无MAFLD组(211例), 经倾向性评分匹配1:1配对. 分析显示: UDFF与MRI PDFF在MAFLD组相关性显著(Pearson), 不同脂肪变程度下两者一致性良好组内相关系数(intra-class correlation coefficient, ICC); Bland-Altman分析显示偏差小、一致性界限(limits of agreement, LOA)窄; UDFF评估脂肪变程度与MRI PDFF一致性较高(Kappa值).
本研究纳入298例腹部超声受检者, 通过UDFF和MRI PDFF检测MAFLD及脂肪变程度. 按MRI PDFF结果分为MAFLD组(87例, 含轻、中、重度)和无MAFLD组(211例), 经倾向性评分匹配1:1配对. 结果显示, UDFF与MRI PDFF在MAFLD组中呈显著相关(Pearson分析), ICC评估显示一致性良好, Bland-Altman分析偏差小, Kappa值检验表明UDFF与MRI PDFF评估肝脂肪变程度一致性较高.
UDFF在中、重度脂肪变时与MRI PDFF呈现出高度的一致性, 可作为MAFLD肝脂肪变程度的一种可行替代方案, 减少对MRI的依赖和不必要的肝活检创伤, 降低医疗成本.
这一发现不仅解决了"UDFF能否替代MRI"的问题, 还通过量化一致性边界(如Bias、LOA), 回答了"如何替代"及"何时替代"的问题, 为后续技术优化提供了新方向.
| 1. | 中国医药生物技术协会慢病管理分会; 中国研究型医院学会肝病(中西医结合)专业委员会; 中华医学会全科医学分会; 代谢相关脂肪性肝病基层诊疗与管理指南制订专家组. 代谢相关脂肪性肝病基层诊疗与管理指南(2025年). 中华全科医师杂志. 2025;24:513-525. [DOI] |
| 3. | Eslam M, Fan JG, Yu ML, Wong VW, Cua IH, Liu CJ, Tanwandee T, Gani R, Seto WK, Alam S, Young DY, Hamid S, Zheng MH, Kawaguchi T, Chan WK, Payawal D, Tan SS, Goh GB, Strasser SI, Viet HD, Kao JH, Kim W, Kim SU, Keating SE, Yilmaz Y, Kamani L, Wang CC, Fouad Y, Abbas Z, Treeprasertsuk S, Thanapirom K, Al Mahtab M, Lkhagvaa U, Baatarkhuu O, Choudhury AK, Stedman CAM, Chowdhury A, Dokmeci AK, Wang FS, Lin HC, Huang JF, Howell J, Jia J, Alboraie M, Roberts SK, Yoneda M, Ghazinian H, Mirijanyan A, Nan Y, Lesmana CRA, Adams LA, Shiha G, Kumar M, Örmeci N, Wei L, Lau G, Omata M, Sarin SK, George J. The Asian Pacific association for the study of the liver clinical practice guidelines for the diagnosis and management of metabolic dysfunction-associated fatty liver disease. Hepatol Int. 2025;19:261-301. [PubMed] [DOI] |
| 4. | Azizi N, Naghibi H, Shakiba M, Morsali M, Zarei D, Abbastabar H, Ghanaati H. Evaluation of MRI proton density fat fraction in hepatic steatosis: a systematic review and meta-analysis. Eur Radiol. 2025;35:1794-1807. [PubMed] [DOI] |
| 5. | Beyer C, Andersson A, Shumbayawonda E, Alkhouri N, Banerjee A, Pandya P, Harisinghani M, Corey K, Dennis A, Pansini M. Quantitative MRI for Monitoring Metabolic Dysfunction-Associated Steatotic Liver Disease: A Test-Retest Repeatability Study. J Magn Reson Imaging. 2025;61:1947-1955. [PubMed] [DOI] |
| 6. | Nishimura T, Tada T, Akita T, Kondo R, Suzuki Y, Imajo K, Kokubu S, Abe T, Kuroda H, Hirooka M, Hiasa Y, Nogami A, Nakajima A, Ogawa S, Toyoda H, Oeda S, Takahashi H, Eguchi Y, Sugimoto K, Yano H, Tanaka J, Moriyasu F, Kage M, Kumada T, Iijima H. Diagnostic performance of attenuation imaging versus controlled attenuation parameter for hepatic steatosis with MRI-based proton density fat fraction as the reference standard: a prospective multicenter study. J Gastroenterol. 2025;60:727-737. [PubMed] [DOI] |
| 7. | El-Kassas M, Mostafa H, Abdellatif W, Shoman S, Esmat G, Brahmania M, Liu H, Lee SS. Lubiprostone Reduces Fat Content on MRI-PDFF in Patients With MASLD: A 48-Week Randomised Controlled Trial. Aliment Pharmacol Ther. 2025;61:628-635. [PubMed] [DOI] |
| 8. | Meng L, Wang J, Yang H, Hu Y, Yang Z. Ultrasound-derived fat fraction to assess liver steatosis in obese patients with polycystic ovary syndrome. Clin Exp Med. 2025;25:130. [PubMed] [DOI] |
| 9. | Hobeika C, Ronot M, Guiu B, Ferraioli G, Iijima H, Tada T, Lee DH, Kuroda H, Lee YH, Lee JM, Kim SY, Cassinotto C, Maiocchi L, Raimondi A, Nishimura T, Kumada T, Kwon EY, Jang JK, Correas JM, Valla D, Vilgrain V, Dioguardi Burgio M. Ultrasound-based steatosis grading system using 2D-attenuation imaging: An individual patient data meta-analysis with external validation. Hepatology. 2025;81:212-227. [PubMed] [DOI] |
| 10. | Ferraioli G, Berzigotti A, Barr RG, Choi BI, Cui XW, Dong Y, Gilja OH, Lee JY, Lee DH, Moriyasu F, Piscaglia F, Sugimoto K, Wong GL, Wong VW, Dietrich CF. Quantification of Liver Fat Content with Ultrasound: A WFUMB Position Paper. Ultrasound Med Biol. 2021;47:2803-2820. [PubMed] [DOI] |
| 12. | Jeon SK, Lee JM. Inter-platform reproducibility of ultrasound-based fat fraction for evaluating hepatic steatosis in nonalcoholic fatty liver disease. Insights Imaging. 2024;15:46. [PubMed] [DOI] |
| 13. | Huang YL, Cheng J, Wang Y, Xu XL, Wang SW, Wei L, Dong Y. Hepatic steatosis using ultrasound-derived fat fraction: First technical and clinical evaluation. Clin Hemorheol Microcirc. 2024;86:51-61. [PubMed] [DOI] |
| 14. | Qi R, Lu L, He T, Zhang L, Lin Y, Bao L. Comparing ultrasound-derived fat fraction and MRI-PDFF for quantifying hepatic steatosis: a real-world prospective study. Eur Radiol. 2025;35:2580-2588. [PubMed] [DOI] |
| 15. | Kubale R, Schneider G, Lessenich CPN, Buecker A, Wassenberg S, Torres G, Gurung A, Hall T, Labyed Y. Ultrasound-Derived Fat Fraction for Hepatic Steatosis Assessment: Prospective Study of Agreement With MRI PDFF and Sources of Variability in a Heterogeneous Population. AJR Am J Roentgenol. 2024;222:e2330775. [PubMed] [DOI] |
| 16. | Malandris K, Korakas E, Sarakapina A, Kalopitas G, Iatridi F, Liakos A, Bekiari E, Giouleme O, Tzatzagou G, Karagiannis T, Paschos P, Vasilakou D, Lambadiari V, Tzamou E, Daravigkas D, Sinakos E, Tsapas A. Accuracy of Controlled Attenuation Parameter for Liver Steatosis in High-Risk Patients for MASLD Using MRI-Proton Density Fat Fraction as Reference Standard. Dig Dis Sci. 2025;70:814-824. [PubMed] [DOI] |
| 17. | Tavaglione F, Flagiello V, Terracciani F, Gallo P, Capparelli E, Spiezia C, De Vincentis A, Palermo A, Scriccia S, Galati G, Napoli N, Daniels SJ, Blau JE, Carlsson B, Khazrai YM, Incalzi RA, Picardi A, Vespasiani-Gentilucci U. Non-invasive assessment of hepatic steatosis by ultrasound-derived fat fraction in individuals at high-risk for metabolic dysfunction-associated steatotic liver disease. Diabetes Metab Res Rev. 2024;40:e3787. [PubMed] [DOI] |
| 18. | Wu S, Pan J, Song M, Zhao YC, Chen W, Huang H, Zhu Y, Chen F. Performance of Magnetic Resonance Imaging and Ultrasound for Identifying the Different Degrees of Hepatic Steatosis: A Systematic Review and Meta-analysis. Acad Radiol. 2025;32:6528-6540. [PubMed] [DOI] |
| 19. | Yagobian SD, Dasyam N, Minervini M, Tublin M, Behari J, Furlan A. Accuracy of Ultrasound-Guided Attenuation Parameter for Diagnosing Hepatic Steatosis. Ultrasound Q. 2025;41:e00702. [PubMed] [DOI] |
| 20. | Ferraioli G, De Silvestri A, Torres G, Barr RG. Ultrasound backscatter coefficient for fat quantification is affected by the measurement depth. Abdom Radiol (NY). 2024;49:2622-2628. [PubMed] [DOI] |
| 21. | Qu J. Advancing Noninvasive Diagnostics for Hepatic Steatosis in MASLD: The Pivotal Role of UDFF. Acad Radiol. 2025;32:1958-1960. [PubMed] [DOI] |
| 22. | Wang P, Song D, Han J, Zhang J, Chen H, Gao R, Shen H, Li J. Comparing Three Ultrasound-Based Techniques for Diagnosing and Grading Hepatic Steatosis in Metabolic Dysfunction-Associated Steatotic Liver Disease. Acad Radiol. 2025;32:1949-1957. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁