修回日期: 2025-08-04
接受日期: 2025-11-14
在线出版日期: 2025-11-28
肝脏局灶性结节增生(focal nodular hyperplasia, FNH), 诊断依赖于影像学检查, 但其无法获取肝细胞特异性摄取的功能学信息, 且存在电离辐射问题; 磁共振成像检查对呼吸运动伪影较为敏感, 影响图像质量.
探讨FNH不同大小和肝背景患者超声造影(contrast-enhanced ultrasound, CEUS)表现差异性.
选取浙江省金华市中心医院2023-02/2025-03收治经病理确诊的118例FNH患者, 均行CEUS检查, 比较分析FNH不同大小[<3 cm(35例)、3-5 cm(66例)、>5 cm(17例)]和肝背景[正常肝(49例)、脂肪肝(39例)、脂肪肝相关性肝硬化(简称为肝硬化, 30例)]患者的CEUS征象.
注射造影剂后, 动脉期早于肝实质的快速高增强88例(74.58%), 迟于肝实质增强30例(25.42%), 其中45例(38.14%)为泉涌状增强, 36例(30.51%)为轮辐状增强, 29例(24.58%)为分枝状增强, 8例(6.78%)为整体增强, 72.03%(85例)患者为快进慢出, 2.54%(3例)患者为快进快出, 25.42%(30例)患者为慢进慢出. FNH<3 cm患者均表现为动脉期早于肝实质的快速高增强, 增强方式以泉涌状增强为主, 未见分枝状增强, 相对肝实质增强-消退变化均表现为快进慢出; >5 cm患者大多表现为迟于肝实质的增强, 以分枝状增强为主, 未见泉涌状增强, 且>5 cm患者中央瘢痕检出率较高, 相对肝实质增强-消退变化大多表现为慢进慢出; 不同FNH大小患者相对肝实质增强时间、动脉期的增强方式、中央瘢痕检出率、相对肝实质增强-消退变化比较, 差异有统计学意义(P<0.05). 正常肝与脂肪肝均早于肝实质增强, 相对肝实质增强-消退变化大多表现为快进慢出, 无慢进慢出; 肝硬化均迟于肝实质增强, 中央瘢痕检出率显著升高, 相对肝实质增强-消退变化均表现为慢进慢出, 不同肝背景患者相对肝实质增强时间、中央瘢痕检出情况、相对肝实质增强-消退变化情况比较, 差异有统计学意义(P<0.05).
不同FNH大小患者CEUS征象明显不同, >5 cm时可能呈现非经典增强模式; 与正常肝相比, 脂肪肝不影响CEUS的征象, 但进展至肝硬化时, FNH灌注迟于周围肝实质, 表现为灌注时间延迟和灌注速度减慢的慢进慢出, 需结合磁共振成像或活检提高鉴别诊断率, 这一发现有助于提升对不同FNH大小和肝背景下CEUS的诊断准确率, 减少误诊和不必要的手术.
核心提要: 本研究探讨肝脏局灶性结节增生(focal nodular hyperplasia, FNH)不同大小和肝背景患者超声造影(contrast-enhanced ultrasound, CEUS)征象异质性及临床意义, 为CEUS在FNH中的应用提供参考.
引文著录: 苏兵强, 葛晓莉, 景道远, 章炳文. 肝脏局灶性结节增生不同大小和肝背景患者超声造影征象异质性. 世界华人消化杂志 2025; 33(11): 883-890
Revised: August 4, 2025
Accepted: November 14, 2025
Published online: November 28, 2025
The diagnosis of hepatic focal nodular hyperplasia (FNH) primarily relies on imaging examinations. However, conventional techniques such as computed tomography involve ionizing radiation and cannot provide functional data on hepatocyte-specific uptake. Moreover, magnetic resonance imaging (MRI) examinations are more sensitive to respiratory motion artifacts, which can significantly compromise image quality.
To investigate the differences in contrast-enhanced ultraso-und (CEUS) manifestations among patients with FNH of varying sizes and liver backgrounds.
A total of 118 patients with FNH confirmed by pathology admitted to our hospital from February 2023 to March 2025 were selected and underwent CEUS examination. The CEUS signs were compared and analyzed among patients with different FNH sizes [< 3 cm (35 cases), 3-5 cm (66 cases), and > 5 cm (17 cases)] and liver backgrounds [normal liver (49 cases), fatty liver (39 cases), and fatty liver-related cirrhosis (hereinafter referred to as cirrhosis, 30 cases)].
After injection of the contrast agent, 88 cases (74.58%) showed rapid enhancement earlier than liver parenchyma in the arterial phase, and 30 (25.42%) showed enhancement later than liver parenchyma. Among all patients included, 45 (38.14%) exhibited gushing-like enhancement, 36 (30.51%) showed spoke-like enhancement, 29 (24.58%) demonstrated branching-like enhancement, and 8 (6.78%) showed overall enhancement; 72.03% (85 cases) of patients exhibited a pattern of fast-in and slow-out, 2.54% (3 cases) showed a pattern characterized by fast-in and fast-out, and 25.42% (30 cases) showed a slow-in and slow-out pattern. Patients with FNH < 3 cm showed rapid and high enhancement earlier than liver parenchyma in the arterial phase, typically presenting a rapid "wash-in" without a branching pattern. The lesions showed a rapid wash-in and slow pattern relative to the liver parenchyma. Patients with FNH > 5 cm mostly exhibited delayed enhancement compared to the surrounding liver parenchyma. Their enhancement pattern was predominantly branching, without a gushing-like pattern. Furthermore, these larger lesions demonstrated a detection rate for the central scar, and the lesions predominantly exhibited a slow wash-in and slow wash-out pattern relative to the liver parenchyma. There were significant differences in the relative enhancement time to the liver parenchyma, the enhancement pattern in the arterial phase, the detection rate of central the scar, and dynamic enhancement patterns among patients with varying FNH sizes (P < 0.05). Normal and fatty livers exhibited earlier enhancement than the surrounding liver parenchyma, with relative enhancement kinetics characterized by a fast-in and slow-out pattern, but never a slow-in and slow-out pattern. Cirrhotic livers exhibited later enhancement than the liver parenchyma, with a significantly higher detection rate of the central scar, and exclusively displayed slow-in and slow-out kinetics. Significant differences were observed in relative enhancement timing, central scar detection, and enhancement-regression kinetics across different liver backgrounds (P < 0.05).
CEUS features of FNH vary significantly with lesion size and liver background. Lesions larger than 5 cm often exhibit atypical enhancement patterns. While fatty liver does not substantially alter CEUS findings, cirrhosis leads to delayed FNH perfusion relative to the parenchyma, characterized by slow wash-in and wash-out kinetics. These hemodynamic alterations underscore the need for integrating MRI or biopsy to improve diagnostic accuracy, reduce misdiagnosis, and avoid unnecessary surgery.
- Citation: Su BQ, Ge XL, Jing DY, Zhang BW. Heterogeneity of contrast-enhanced ultrasound features of hepatic focal nodular hyperplasia across lesion sizes and liver backgrounds. Shijie Huaren Xiaohua Zazhi 2025; 33(11): 883-890
- URL: https://www.wjgnet.com/1009-3079/full/v33/i11/883.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i11.883
肝脏局灶性结节增生(focal nodular hyperplasia, FNH)是一种常见的肝脏良性病变, 其术前诊断主要依赖于影像学检查, 其中常规CT检查虽然能提供良好的解剖学信息, 但其无法获取肝细胞特异性摄取的功能学信息, 且存在电离辐射问题, 这使得其在需要长期随访的患者中应用受限; 磁共振成像(magnetic resonance imaging, MRI)检查虽然具有优异的软组织对比度, 但对呼吸运动伪影较为敏感, 约20%-30%的检查可能因患者配合欠佳而影响图像质量; 此外, 其较高的检查成本和较长的扫描时间也限制了临床可及性, 特别值得注意的是, 当使用肝胆特异性造影剂(如Gd-EOB-DTPA)时, 患者需要等待20 min以上才能获得具有诊断价值的肝胆期图像, 这不仅增加了检查时间成本, 对于肝功能受损(Child-Pugh B/C级)患者, 其肝胆期显像质量还会显著下降(信号强度降低40%-60%). 基于这些客观限制, 超声造影(contrast-enhanced ultrasound, CEUS)因其无创性、高实时性和良好的安全性, 已成为FNH诊断的重要手段之一[1,2]. 但CEUS的诊断准确性可能受到多种因素的影响, 如肝背景、FNH大小等. 近年来随着代谢相关性脂肪肝病的全球流行, 脂肪肝患者的FNH诊断问题日益突出[3]. 若患者存在脂肪肝、脂肪肝相关性肝硬化等肝背景问题, 可能因微循环障碍和肝窦内皮细胞功能异常, 影响造影剂的分布和廓清动力学, 导致漏诊或误诊[4,5]. 同时, 不同大小的FNH在CEUS上的增强表现也可能存在差异, 如陈凯玲等[6]报道<3 cm的FNH表现为高回声增强, 但部分研究[7]指出<3 cm的FNH表现为低回声增强, 尚存在分歧; 较大的FNH则可能因内部出血、坏死或纤维化导致增强模式异质性增加, 易出现假阳性或假阴性[8,9]. 因此深入探讨FNH不同大小和肝背景患者CEUS征象异质性, 对降低漏诊率、误诊率, 提高FNH诊断准确性, 减少误诊和不必要的手术等具有重要意义. 目前, 关于脂肪肝与FNH大小对CEUS诊断结果影响的研究有限, 且结论不一, 所以有必要进一步分析. 基于此本研究探讨FNH不同大小和肝背景患者CEUS征象异质性及临床意义, 为CEUS在FNH中的应用提供参考.
选取金华市中心医院2023-02/2025-03收治经病理确诊的118例FNH患者作为研究对象进行回顾性研究. (1)纳入标准: ①均经手术切除(手术原因: 诊断不明确, 疑似恶性肿瘤1例; FNH引起持续或加重的右上腹疼痛、压迫症状2例; 病灶巨大或压迫关键结构1例)或活检后病理证实为FNH; ②术前行CEUS检查; ③甲胎蛋白等血清肿瘤标志物阴性; ④>18岁. (2)排除标准: ①病毒性肝炎; ②图像质量不佳或临床资料缺失; ③CEUS前有FNH相关治疗史; ④合并其他肝病. 全部对象中, 女63例, 男55例, 年龄20-71岁, 平均(42.86±9.37)岁; FNH大小1.0-9.8 cm, 平均(3.65±1.20)cm; 其中41个位于肝右叶, 2个位于尾状叶, 75个位于肝左叶; 按照病灶大小: <3 cm有35例, 3-5 cm有66例, >5 cm有17例; 按肝背景: 正常肝49例, 脂肪肝39例, 脂肪肝相关性肝硬化30例.
1.2.1 CEUS检查方法: 指导患者取仰卧位, 必要时调整为左侧/右侧卧位. 彩色多普勒仪(Philips iU 22型), 探头C5-1, 探头频率3.5-7.0 MHz(常规超声检查时)或2.0-5.0 MHz(CEUS时). 先进行常规超声检查, 再切换至CEUS模式. 将Sono Vue(Bracco公司)超声造影剂预先加入生理盐水5 mL配置成六氟化硫微泡悬浊液8 μL/mL, 团注于肘前静脉. 指导患者屏气或缓慢呼吸, 连续观察FNH及周围肝组织增强消退情况.
1.2.2 CEUS图像分析: 参考相关指南[10], 将注射造影剂后10-40 s定义为动脉期, 45-120 s定义为门脉期, 120 s后定义为延迟期. CEUS图像采集标准化流程: (1)动态存储要求: 全程动态存储造影过程(≥3 min), 保存DICOM格式原始数据, 帧率≥10帧/秒; (2)至少记录2个切面(最大长轴+典型横断面), 确保病灶全貌覆盖; (3)呼吸控制: 动脉期要求患者屏气, 门脉期及延迟期允许浅慢呼吸, 避免运动伪影. CEUS征象判读标准: 由2名具有5年以上CEUS经验的医师独立分析, 分歧时由第三名资深医师仲裁, 直至意见一致. 质量控制措施: 设备校准: (1)每次检查前进行造影增益优化, 确保机械指数(MI)0.08-0.12; (2)造影剂注射规范: 采用标准团注法, 后续追加5 mL生理盐水冲管; 记录注射时间点, 以首次微泡进入肝动脉为动脉期起点. 根据FNH相对于肝实质的增强强度分为高增强、等增强、低增强. 根据相对肝实质增强时间分为早于肝实质、迟于肝实质. 根据动脉期的增强方式分为整体增强(FNH整体一致性增强)、轮辐状增强(表现为数条由中央向周边辐射的血管最先增强, 然后实质快速增强, 血管犹如轮辐形态)、分枝状增强(FNH内部有不呈轮辐状的显著增强的血管)、泉涌状增强(由FNH中央的一根雪糕开始增强, 增强范围从中心向外周逐渐扩大, 在FNH最大切面可见造影剂像泉水涌出一样由中央血管离心性向周围移动). 中央瘢痕为各期相观察到FNH中央的未增强区域. 滋养动脉为FNH周边增强的动脉. 根据相对肝实质增强-消退变化分为快进慢出、快进快出、慢进慢出. 以上征象名称及判定均参考相关指南[10], 确保图像判读的一致性和可重复性.
统计学处理 采用SPSS Statistics 24.0软件, 计数资料用n(%)表示, 组间行χ2检验, 若多组之间差异有统计学意义(P<0.05), 则两两之间的比较采用卡方分割法, 即P<0.0167表示差异有统计学意义.
注射造影剂后, 动脉期早于肝实质的快速高增强88例(74.58%), 迟于肝实质增强30例(25.42%), 其中45例(38.14%)为泉涌状增强, 36例(30.51%)为轮辐状增强, 29例(24.58%)为分枝状增强, 8例(6.78%)为整体增强. 根据病灶在CEUS各时相的增强-消退表现, 72.03%(85例)患者为快进慢出, 2.54%(3例)患者为快进快出, 25.42%(30例)患者为慢进慢出.
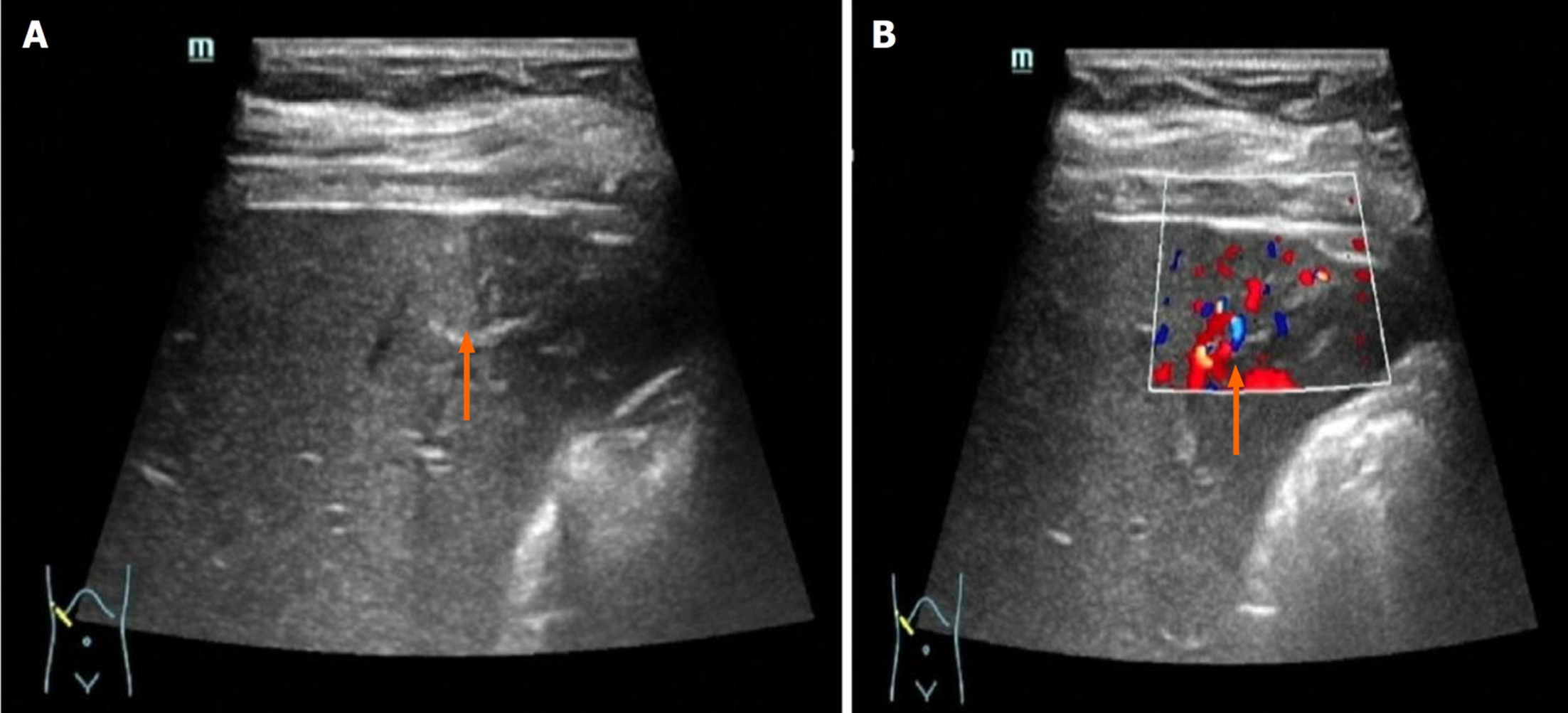
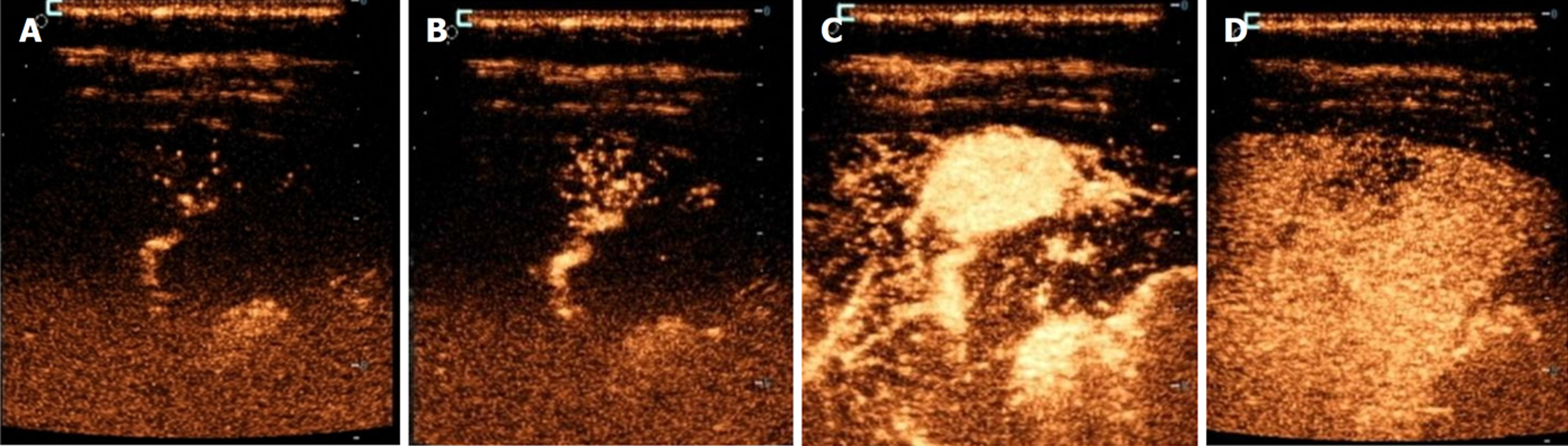
FNH大小<3 cm患者均表现为动脉期早于肝实质的快速高增强, 增强方式以泉涌状增强为主, 未见分枝状增强, 相对肝实质增强-消退变化均表现为快进慢出; >5 cm患者大多表现为迟于肝实质的增强, 以分枝状增强为主, 未见泉涌状增强, 且>5 cm患者中央瘢痕检出率较高, 相对肝实质增强-消退变化大多表现为慢进慢出. 整体比较显示, 不同FNH大小患者相对肝实质增强时间、动脉期的增强方式、中央瘢痕检出率、相对肝实质增强-消退变化比较, 差异有统计学意义(P<0.05); 进一步的卡方分割法比较显示, <3 cm患者早于肝实质增强、泉涌状、快进慢出占比显著高于3-5 cm、>5 cm患者(P<0.0167), 且3-5 cm患者高于>5 cm患者(P<0.0167); >5 cm患者迟于肝实质、分枝状增强、中央瘢痕、慢进慢出占比显著高于<3 cm、3-5 cm患者(P<0.0167), 且3-5 cm患者显著高于<3 cm患者(P<0.0167). 整体比较显示, 不同FNH大小患者滋养动脉检出情况比较差异无统计学意义(P>0.05). 见表1和表2. 不同FNH大小患者CEUS表现见图1.
正常肝与脂肪肝均早于肝实质增强, 相对肝实质增强-消退变化大多表现为快进慢出, 无慢进慢出; 肝硬化均迟于肝实质增强, 中央瘢痕检出率显著升高, 相对肝实质增强-消退变化均表现为慢进慢出. 整体比较显示, 不同肝背景患者相对肝实质增强时间、中央瘢痕检出情况、相对肝实质增强-消退变化情况比较, 差异有统计学意义(P<0.05); 进一步的卡方分割法比较显示, 肝硬化患者迟于肝实质、中央瘢痕、慢进慢出显著高于正常肝、脂肪肝患者(P<0.0167); 不同肝背景患者其他CEUS表现比较差异均无统计学意义(P>0.05). 见表3和表4. 不同肝背景患者CEUS表现见图2.
| 肝背景 | 例数 | 相对肝实质增强时间 | 动脉期的增强方式 | ||||
| 早于肝实质 | 迟于肝实质 | 泉涌状增强 | 轮辐状增强 | 分枝状增强 | 整体增强 | ||
| 正常肝 | 49 | 49(100.00) | 0(0) | 22(44.90) | 14(28.57) | 9(18.37) | 4(8.16) |
| 脂肪肝 | 39 | 39(100.00) | 0(0) | 13(33.33) | 12(30.77) | 12(30.77) | 2(5.13) |
| 肝硬化 | 30 | 0(0) | 30(100.00) | 10(33.33) | 10(33.33) | 8(26.67) | 2(6.67) |
| χ2 | 118.000 | 2.871 | |||||
| P值 | <0.001 | 0.825 | |||||
| 肝背景 | 例数 | 中央瘢痕 | 滋养动脉 | 相对肝实质增强-消退变化 | ||
| 快进慢出 | 快进快出 | 慢进慢出 | ||||
| 正常肝 | 49 | 15(30.61) | 35(71.43) | 47(95.92) | 2(4.08) | 0(0) |
| 脂肪肝 | 39 | 12(30.77) | 32(82.05) | 38(97.44) | 1(2.56) | 0(0) |
| 肝硬化 | 30 | 22(73.33) | 23(76.67) | 0(0) | 0(0) | 30(100.00) |
| χ2 | 16.762 | 1.358 | 118.204 | |||
| P值 | <0.001 | 0.507 | <0.001 | |||
本研究结果发现, 74.58%患者动脉期表现为早于肝实质的快速高增强, 增强模式占比从高到低依次为泉涌状增强、轮辐状增强、分枝状增强、整体增强, 提示以上特征对FNH具有诊断参考价值. FNH的早增强现象主要源于FNH病灶内异常增殖的动脉血管网络, 研究显示[11-13], FNH病灶区的动脉血管密度可达正常肝组织的3-5倍, 且病灶中心瘢痕区常存在动脉-门静脉直接交通, 同时FNH滋养动脉血流速度显著快于正常肝动脉, 从而使FNH病灶呈现动脉期早于肝实质的快速高增强. 泉涌状增强被视为典型FNH表现, 其中心性动脉供血, 放射状分支的血管构筑特征有助于FNH的诊断[14]. 轮辐状增强血管构筑特征为多支滋养动脉, 向心性灌注, 其并非FNH的特异性表现, 腺瘤也可能表现为轮辐状增强, 临床检查时需注意鉴别[15]. 根据病灶在CEUS各时相的增强-消退表现, 72.03%患者为快进慢出, 故这一特征也有助于FNH的诊断.
本研究结果发现, <3 cm的患者表现出典型的早于肝实质的快速高增强(100.00%)和泉涌状增强模式(占该组71.43%), 这一现象与小型FNH特有的血管构筑密切相关. 小型FNH病灶内新生血管密度更高, 血管直径更均匀, 且异常动脉-门脉分流率高, 这解释了其快速均匀增强的特征[16,17]. 本研究中<3 cm FNH均表现为快进慢出模式, 这与既往研究[18]相似. 随着FNH增大, 本研究观察到增强时间延迟(3-5 cm组21.21%迟于肝实质, >5 cm组94.12%迟于肝实质)和分枝状增强占优(3-5 cm组30.30%, >5 cm组52.94%)的特征转变. 这种改变源于大FNH内部的结构异质性: (1)中央纤维瘢痕区域血管密度降低, 且常伴玻璃样变; (2)异常血管迂曲度指数随着FNH增大, 逐渐升高; (3)门脉供血比例显著提升, 这些病理改变导致造影剂在病灶内的分布不均和廓清延迟, 形成特征性的慢进慢出模式(占>5 cm组的94.12%)[19]. 本研究发现>5 cm FNH的中央瘢痕检出率达58.82%, 远高于<3 cm、3-5 cm患者, 这与瘢痕面积与FNH体积的正相关性特征相符[20].
本研究结果显示肝硬化背景对FNH CEUS表现产生显著影响, 而脂肪肝与正常肝之间差异无统计学意义, 肝硬化组100.00%表现为迟于肝实质的增强和慢进慢出模式. 分析其原因发现, 首先肝硬化患者存在肝窦毛细血管化, 可使造影剂通过时间延长[21]; 其次肝硬化门脉压力梯度可较正常肝升高, 导致门脉灌注减少; 最后肝硬化患者肝动脉缓冲效应失调, 使动脉期增强峰值时间延迟, 以上肝硬化特有的血流动力学特点使得FNH患者CEUS表现出不同于正常肝、脂肪肝的征象[22]. 由于脂肪肝患者未进展至肝硬化, 肝血管结构变异与肝组织纤维化程度较轻, 尚可代偿, 使其CEUS表现与正常肝相同. 本研究中肝硬化组中央瘢痕检出率达73.33%, 显著高于其他组, 这与肝硬化背景下纤维间隔增宽有关. 本研究发现正常肝、脂肪肝患者相对肝实质增强时间、中央瘢痕检出情况、相对肝实质增强-消退变化情况等方面比较, 差异无统计学意义, 这与近期研究[23]结果一致, 表明脂肪肝不影响FNH的CEUS表现, CEUS对脂肪肝患者的FNH诊断仍保持较高可靠性.
FNH患者在不同病灶大小和肝背景下CEUS滋养动脉检出率无显著差异, 可能与以下多因素机制有关: (1)FFNH具有特征性的血管构型, 无论病灶大小, 均存在1-3支粗大滋养动脉, 起源于肝动脉分支, 即使直径<1 cm的微小FNH也已建立完整的滋养动脉系统, 病灶增大主要表现为周边新生血管分支增多, 而中央滋养动脉主干直径保持相对恒定; (2)CEUS对微小血管的检测优势明显, 可显示直径40 μmol/L以上的微血管(远小于CT/MRI的检测下限), 时间分辨率达毫秒级, 能捕捉快速血流信号, 动态观察全程不受呼吸运动影响, 造影剂完全血管内分布, 无组织干扰; (3)FNH滋养动脉具有独特的血流特征: 血流速度稳定, 血管走行相对平直, 血流方向恒定, 故不易受病灶大小和肝背景显著的影响.
从肝脏病理演变过程来看, F3与F4期的核心区别在于假小叶形成这一病理特征, 但二者在血管架构改变方面存在连续性, F3期已出现肝窦毛细血管化, 门静脉血流阻力增加, 但肝动脉代偿性增生的程度较F4期轻, F4期特有的结节再生会导致血管扭曲更显著, 但FNH的滋养动脉起源于较大肝动脉分支, 理论上受肝纤维化阶段影响较小. 尽管缺乏直接比较F3/F4期FNH的CEUS研究, 但根据临床经验, 即使进展到F4期, FNH的特征性"中央动脉+辐射状分支"结构仍保持完整, 故F3与F4期FNH的CEUS表现无质的差异, 但可能观察到动脉期增强速度稍快、滋养动脉主干更突出等量的轻微差别, 这种差异通常需要通过定量分析才能识别, 对常规临床诊断的影响有限. 值得注意的是, 本研究目的主要观察不同大小和肝背景患者CEUS征象的不同, 未对F3/F4期进行探讨, 所以以上F3/F4期基于临床经验的分析阐述, 仍需精确分层F3/F4期患者的研究进行验证.
基于本研究结果, 对不同FNH大小和肝背景, 应注意两者对CEUS的影响, 做出正确的诊断结果. 对于<3 cm的FNH, 若影像学表现高度典型(典型的泉涌状增强+快进同出模式等), 且无恶性征象(如假包膜、扩散受限), 可考虑临床确诊, 否则需活检或短期随访; 而>5 cm FNH出现分枝状增强+中央瘢痕+慢进慢出组合时, 应谨慎下诊断, 建议联合MRI肝胆期特异性对比剂检查等, 进一步明确. 针对肝硬化背景患者, 表现为迟于肝实质增强、中央瘢痕、慢进慢出, 也应谨慎下诊断, 需要进一步的检查进行明确. 对于脂肪肝患者, 虽然本研究表明CEUS可靠性保持良好, 但建议注意调节增益设置以克服声衰减影响, 必要时采用二次谐波成像技术提高病灶显示率. 既往有学者尝试分析了病灶大小对CEUS的影响, 但仅分<3 cm vs ≥3 cm, 本研究分组更细化, 且结果表明该分组标准具有临床参考意义; 在肝背景分析中, 既往资料多忽略或为充分重视肝硬化对CEUS的影响, 本研究首次发现, FNH大小>5 cm和合并肝硬化是导致CEUS表现非典型化的两大关键因素, 这一结果修正了传统认为FNH均表现为快进慢出的结论, 并在讨论中指出鉴别要点, 这对减少误诊具有直接的指导价值. 但本研究仍具有一定不足之处: 样本量较小, 可能会造成研究结果的偏倚, 下一步仍需积累与扩展样本量, 进一步对研究结果进行分析.
综上所述, 不同FNH大小患者CEUS征象明显不同, >5 cm时可能呈现非经典增强模式; 与正常肝相比, 脂肪肝不影响CEUS的征象, 但进展至肝硬化时, FNH灌注迟于周围肝实质, 表现为灌注时间延迟和灌注速度减慢的慢进慢出, 需结合MRI或活检提高鉴别诊断率, 这一发现有助于提升对不同FNH大小和肝背景下CEUS的诊断准确率, 减少误诊和不必要的手术.
肝脏局灶性结节增生(focal nodular hyperplasia, FNH), 诊断依赖于影像学检查, 但其无法获取肝细胞特异性摄取的功能学信息, 且存在电离辐射问题; 磁共振成像检查对呼吸运动伪影较为敏感, 影响图像质量.
肝脏局灶性结节增生患者不同大小的FNH在超声造影(contrast-enhanced ultrasound, CEUS)上的增强表现也可能存在差异, 部分研究指出<3 cm的FNH表现为低回声增强, 尚存在分歧; 较大的FNH则可能因内部出血、坏死或纤维化导致增强模式异质性增加, 易出现假阳性或假阴性.
探讨肝脏局灶性结节增生不同大小和肝背景患者超声造影征象异质性.
选取金华市中心医院2023-02/2025-03收治经病理确诊的118例FNH患者, 均行CEUS检查, 比较分析FNH不同大小[<3 cm、3-5 cm、>5 cm(17例)]和肝背景、脂肪肝、脂肪肝相关性肝硬化患者的CEUS征象.
正常肝与脂肪肝的增强早于肝硬化, 相对肝实质增强-消退多呈快进慢出, 无慢进慢出; 肝硬化则迟于增强, 中央瘢痕检出率显著升高, 增强-消退均呈慢进慢出. 不同肝背景患者间, 增强时间、瘢痕检出及增强-消退变化差异有统计学意义.
FNH大小影响CEUS征象: >5 cm时呈非经典增强模式. 脂肪肝不影响CEUS表现, 但肝硬化时FNH灌注迟于周围肝实质, 表现为"慢进慢出". 结合磁共振或活检可提高鉴别诊断率, 减少误诊和不必要手术.
本研究修正了传统认为FNH均表现为快进慢出的结论, 这对减少误诊具有直接的指导价值. 但本研究仍具有一定不足之处: 样本量较小, 可能会造成研究结果的偏倚, 下一步仍需积累与扩展样本量, 进一步对研究结果进行分析.
| 2. | Okino K, Wakasugi S, Ichihara S. Hyperechogenicity and histopathological features of focal liver lesions. J Med Ultrason (2001). 2025;52:55-67. [PubMed] [DOI] |
| 3. | Peris Alvà H, Cano Rodríguez C, Bosch Barragan F, Framis Utset A, Novell Teixidó F, Prieto Del Rey MJ. New-onset hepatic lesions in oncological patients: A challenging diagnosis. Radiologia (Engl Ed). 2025;67:191-201. [PubMed] [DOI] |
| 4. | Wang Z, Yao J, Jing X, Li K, Lu S, Yang H, Ding H, Li K, Cheng W, He G, Jiang T, Liu F, Yu J, Han Z, Cheng Z, Tan S, Wang Z, Qi E, Wang S, Zhang Y, Li L, Dong X, Liang P, Yu X. A combined model based on radiomics features of Sonazoid contrast-enhanced ultrasound in the Kupffer phase for the diagnosis of well-differentiated hepatocellular carcinoma and atypical focal liver lesions: a prospective, multicenter study. Abdom Radiol (NY). 2024;49:3427-3437. [PubMed] [DOI] |
| 5. | Ruan SM, Huang H, Cheng MQ, Lin MX, Hu HT, Huang Y, Li MD, Lu MD, Wang W. Shear-wave elastography combined with contrast-enhanced ultrasound algorithm for noninvasive characterization of focal liver lesions. Radiol Med. 2023;128:6-15. [PubMed] [DOI] |
| 6. | 陈 凯玲, 王 坤, 朱 宇莉, 韩 红, 毛 枫, 罗 荣奎, 王 文平. 小于3 cm肝细胞腺瘤和肝局灶性结节增生超声造影特征对比. 中国临床医学. 2023;30:792-797. [DOI] |
| 8. | Möller K, Tscheu T, De Molo C, Serra C, Cui XW, Dong Y, Hocke M, Lim A, Zadeh ES, Görg C, Srivastava D, Henning S, Jenssen C, Berzigotti A, Jung M, Dietrich CF. Comments and illustrations of the WFUMB CEUS liver guidelines: rare congenital vascular pathology. Med Ultrason. 2022;24:461-472. [PubMed] [DOI] |
| 9. | Tangruangkiat S, Chaiwongkot N, Pamarapa C, Rawangwong T, Khunnarong A, Chainarong C, Sathapanawanthana P, Hiranrat P, Keerativittayayut R, Sungkarat W, Phonlakrai M. Diagnosis of focal liver lesions from ultrasound images using a pretrained residual neural network. J Appl Clin Med Phys. 2024;25:e14210. [PubMed] [DOI] |
| 10. | Dietrich CF, Nolsøe CP, Barr RG, Berzigotti A, Burns PN, Cantisani V, Chammas MC, Chaubal N, Choi BI, Clevert DA, Cui X, Dong Y, D'Onofrio M, Fowlkes JB, Gilja OH, Huang P, Ignee A, Jenssen C, Kono Y, Kudo M, Lassau N, Lee WJ, Lee JY, Liang P, Lim A, Lyshchik A, Meloni MF, Correas JM, Minami Y, Moriyasu F, Nicolau C, Piscaglia F, Saftoiu A, Sidhu PS, Sporea I, Torzilli G, Xie X, Zheng R. Guidelines and Good Clinical Practice Recommendations for Contrast-Enhanced Ultrasound (CEUS) in the Liver-Update 2020 WFUMB in Cooperation with EFSUMB, AFSUMB, AIUM, and FLAUS. Ultrasound Med Biol. 2020;46:2579-2604. [PubMed] [DOI] |
| 11. | Zhang Y, Li Q, Li L, Hong Y, Qiang B, Yu Y, Guo R, Deng H, Han X, Zou X, Guo Z, Zhou J. Diagnostic Performance of Modified Contrast-Enhanced Ultrasound Liver Imaging Reporting and Data System in Patients Without Risk Factors for Hepatocellular Carcinoma: Comparison With World Federation for Ultrasound in Medicine and Biology Guideline. Ultrasound Med Biol. 2024;50:243-250. [PubMed] [DOI] |
| 12. | Paratore M, Garcovich M, Amodeo A, Fianchi F, Santopaolo F, Ponziani FR, Zocco MA, Gasbarrini A, Riccardi L, Pompili M. Evolution of focal nodular hyperplasia during long-term ultrasound follow-up: results from a single-center study. J Ultrasound. 2025;28:421-428. [PubMed] [DOI] |
| 13. | Ryu H, Shin SY, Lee JY, Lee KM, Kang HJ, Yi J. Joint segmentation and classification of hepatic lesions in ultrasound images using deep learning. Eur Radiol. 2021;31:8733-8742. [PubMed] [DOI] |
| 14. | Frenette C, Mendiratta-Lala M, Salgia R, Wong RJ, Sauer BG, Pillai A. ACG Clinical Guideline: Focal Liver Lesions. Am J Gastroenterol. 2024;119:1235-1271. [PubMed] [DOI] |
| 15. | Zeng QQ, Liang P. Super-Resolution US Imaging of Focal Nodular Hyperplasia. Radiology. 2024;311:e233130. [PubMed] [DOI] |
| 16. | Guo H, Pan J, Sun H, Li B. Liver multicentric focal nodular hyperplasia with atypical imaging features. Asian J Surg. 2024;47:3794-3795. [PubMed] [DOI] |
| 17. | Watanabe Y, Ogawa M, Konishi A, Suda S, Tamura Y, Kaneko M, Hirayama M, Matsumoto N, Kogure H. Assessment of drainage vein of focal nodular hyperplasia using contrast-enhanced ultrasound. J Med Ultrason (2001). 2024;51:457-463. [PubMed] [DOI] |
| 18. | 张 炜彬, 王 文平, 董 怡, 汪 瀚韬, 季 正标, 黄 备建. 小于3cm肝局灶性结节性增生的超声造影增强表现特征研究. 中华超声影像学杂志. 2018;27:931-935. [DOI] |
| 19. | Li Z, Wu X, Li X, Tang S. Dynamic contrast-enhanced ultrasound findings of focal nodular hyperplasia-like nodules in cirrhosis: a description of two cases and literature analysis. Quant Imaging Med Surg. 2024;14:2089-2095. [PubMed] [DOI] |
| 20. | Swensson J, McCrate M, Halappa VG, Stethen T, Akisik F. Contrast-Enhanced Ultrasound Compared With Hepatobiliary Agent MRI for Differentiation of Focal Nodular Hyperplasia and Hepatic Adenoma: A Prospective Trial. Ultrasound Q. 2024;40:e00696. [PubMed] [DOI] |
| 21. | Dobek A, Kobierecki M, Wieczorek P, Grząsiak O, Ciesielski W, Fabisiak A, Stefańczyk L. Contrast-enhanced ultrasonography as a method of monitoring focal liver lesions - initial report. Clin Exp Hepatol. 2024;10:120-128. [PubMed] [DOI] |
| 22. | Sawatzki M, Burkart T, Baumeler S, Semela D, Dong Y, Jenssen C, Srivastava D, Dietrich CF. Ultrasound Doppler technique for the diagnosis of focal nodular hyperplasia - case series and systematic review. Med Ultrason. 2024;26:72-82. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁