修回日期: 2025-11-03
接受日期: 2025-11-14
在线出版日期: 2025-11-28
常规磁共振成像(magnetic resonance imaging, MRI)对非典型强化结节的评估存在很大局限性: 有些结节在动脉期强化不明显或模糊, 难以做出准确诊断, 容易导致漏诊或延误治疗.
探讨钆塞酸二钠(gadoxetic acid disodium, Gd-EOB-DTPA)MRI对常规磁共振(magnetic resonance imaging, MRI)不典型强化肝硬化结节恶性转化的预测价值.
回顾性分析金华市人民医院2021-04/2023-12收治的299例有肝硬化异型增生结节病史且常规MRI不典型强化患者的临床资料, 根据恶性转化发生情况分为发生组(44例62个结节)、未发生组(255例357个结节), 对发生组与未发生组进行倾向性评分匹配保证组间均衡可比性. 另选2024-01/2024-05收治的35例患者作为验证集. 比较两组结节大小、T1加权成像(T1 weighted imaging, T1WI)、T2加权成像(T2 weighted imaging, T2WI)、磁共振弥散加权成像(diffusion-weighted imaging, DWI)、肝胆期、动脉期信号强度、门静脉期廓清及结中结表现. Logistic回归分析MRI表现对肝异型增生结节恶性转化的影响, 并绘制肝异型增生结节恶性转化风险的列线图, 采用受试者工作特征曲线、校准曲线、决策分析曲线曲线评估所建立的肝异型增生结节恶性转化风险的模型区分度、校准度及临床效用.
发生组T1WI、T2WI、DWI、肝胆期信号及动脉期高强化、结中结表现与未发生组比较差异有统计学意义(P<0.05); Logistic回归分析显示, T1WI等高信号、肝胆期信号高等信号是肝异型增生结节恶性转化的保护因素, T2WI高信号、DWI高信号、动脉期高强化、结中结表现是肝异型增生结节恶性转化的危险因素(P<0.05); 绘制列线图显示, T1WI等高信号、肝胆期信号高等信号会降低肝异型增生结节恶性转化风险, T2WI高信号、DWI高信号、动脉期高强化、结中结表现会升高肝异型增生结节恶性转化风险, 其C-index为0.978; 内部与外部验证均显示, 所构建的模型具有良好区分度、校准度和临床效用.
基于Gd-EOB-DTPA MRI的预测模型对常规MRI不典型强化肝异型增生结节恶性转化风险具有较高的预测价值, 能为临床随访管理、预防性干预提供决策支持.
核心提要: 本研究探讨钆塞酸二钠磁共振(magnetic resonance imaging, MRI)对常规MRI不典型强化肝异型增生结节恶性转化的预测价值, 构建预测模型, 为肝硬化异型增生结节的准确诊断和精准随访、干预提供参考.
引文著录: 吕小娇, 徐婷婷, 吴琼. 钆塞酸二钠MRI对常规磁共振不典型强化肝硬化结节恶性转化的预测价值. 世界华人消化杂志 2025; 33(11): 873-882
Revised: November 3, 2025
Accepted: November 14, 2025
Published online: November 28, 2025
Conventional magnetic resonance imaging (MRI) has significant limitations in the assessment of atypically enhancing nodules. Some nodules exhibit no obvious enhancement or have blurred enhancement during the arterial phase, making it difficult to make an accurate diagnosis and potentially leading to missed diagnoses or delayed treatment.
To investigate the predictive value of gadoxetic acid disodium (Gd-EOB-DTPA)-enhanced MRI for malignant transformation of liver cirrhosis nodules with atypical enhancement on conventional MRI.
A retrospective analysis was conducted on the clinical data of 299 patients with a history of cirrhotic dysplastic nodules that exhibited atypical enhancement on conventional MRI, admitted to our hospital from April 2021 to May 2024. These patients were divided into a transformation group (44 cases with 62 nodules) and a non-transformation group (255 cases with 357 nodules) based on the occurrence of malignant transformation or not. Propensity score matching was performed to ensure balanced comparability between the groups. Another 35 patients admitted from January 2024 to May 2024 were selected as a validation set. The nodule size, T1 weighted imaging (T1WI), T2 weighted imaging (T2WI), diffusion-weighted imaging (DWI), signal intensity during the hepatobiliary and arterial phases, portal venous phase clearance, and nodule-in-nodule appearance were compared between the two groups. Logistic regression analysis was used to investigate the association of MRI findings with the malignant transformation of liver dysplastic nodules, and a nomogram for the risk of malignant transformation of liver dysplastic nodules was drawn. The established model for predicting the risk of malignant transformation of liver dysplastic nodules was evaluated for discrimination, calibration, and clinical utility using receiver operating characteristic curves, calibration curves, and decision curves.
There were statistically significant differences in T1WI, T2WI, DWI, hepatobiliary phase signal, arterial phase hyperenhancement, and nodule-in-nodule appearance between the two groups (P < 0.05). Logistic regression analysis showed that T1WI isointense signal, high hepatobiliary phase signal, and high T1WI signal were protective factors for malignant transformation of liver dysplastic nodules, while high T2WI signal, high DWI signal, high arterial phase enhancement, and nodule-in-nodule appearance were risk factors for malignant transformation of liver dysplastic nodules (P < 0.05). The nomogram showed that T1WI isointense signal and high hepatobiliary phase signal reduced the risk of malignant transformation of liver dysplastic nodules, while high T2WI signal, high DWI signal, high arterial phase enhancement, and nodule-in-nodule appearance increased the risk of malignant transformation of liver dysplastic nodules, with a C-index of 0.978. Both internal and external validations showed that the constructed model had good discrimination, calibration, and clinical utility.
The predictive model developed based on Gd-EOB-DTPA-enhanced MRI findings has high predictive value for the risk of malignant transformation of liver dysplastic nodules with atypical enhancement on conventional MRI, and can provide decision support for clinical follow-up management and preventive intervention.
- Citation: Lv XJ, Xu TT, Wu Q. Predictive value of gadoxetic acid disodium-enhanced magnetic resonance imaging for malignant transformation of cirrhosis nodules with atypical enhancement on conventional magnetic resonance. Shijie Huaren Xiaohua Zazhi 2025; 33(11): 873-882
- URL: https://www.wjgnet.com/1009-3079/full/v33/i11/873.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i11.873
肝细胞癌是全球范围内最常见的肿瘤之一, 其发生通常遵循肝硬化-异型增生结节-早期肝癌的渐进式演变过程, 在这一癌变序列中, 异型增生结节的恶性转化是临床早期干预的关键窗口期, 对肝癌防治至关重要[1,2]. 目前, 常规磁共振(magnetic resonance imaging, MRI)是筛查肝异型增生结节的主要手段, 但在评估不典型强化结节时存在显著局限性: 部分结节动脉期强化不明显或呈模糊强化等, 难以对其作出准确诊断, 易导致漏诊或延迟治疗[3]. 因此, 探索更精准的影像学手段, 预测肝异型增生结节的恶性转化风险意义重大. 与传统非特异性对比剂相比, 肝胆特异性对比剂钆塞酸二钠(gadoxetic acid disodium, Gd-EOB-DTPA)具有双重成像特性, 一方面其动态增强期可评估结节的动脉期强化、门脉期廓清等血流动力学特征; 另一方面肝胆期通过肝细胞特异性摄取, 能直观反映结节的肝细胞功能缺失程度[4,5]. 循证医学显示[6], Gd-EOB-DTPA MRI能鉴别诊断肝细胞癌和良性病变, 但对常规MRI不典型强化的肝异型增生结节恶性转化风险预测的研究资料有限, 尚不能明确其是否具有预测价值, 这类结节常被归入"不确定结节"范畴, 医生面临是否积极干预的决策困境, 因此值得对此进行深入的探讨. 基于此本研究探讨Gd-EOB-DTPA MRI对常规MRI不典型强化肝异型增生结节恶性转化的预测价值, 构建预测模型, 为肝硬化异型增生结节的准确诊断和精准随访、干预提供参考.
回顾性分析金华市人民医院2021-04/2023-12收治的299例有肝异型增生结节病史且常规MRI不典型强化患者的临床资料(建模集), 其中女135例, 男164例, 年龄29-78岁, 平均(55.24±7.41)岁, 病程6-64个月, 平均(36.12±9.57)个月. (1)纳入标准: ①有肝异型增生结节病史; ②常规MRI不典型强化(动态增强动脉期非明确高强化/门静脉期廓清不显著); ③发病前无恶性肿瘤病史; ④>18岁. (2)排除标准: ①图像质量不能满足临床诊断者; ②血管瘤、转移瘤等其他肝占位性病变; ③过敏体质或有造影剂过敏史; ④临床资料不完整. 另选2024-01/2024-05收治的35例患者作为验证集, 其中女16例, 男19例, 年龄31-77岁, 平均(54.80±7.35)岁, 病程8-63 mo, 平均(35.70±8.16) mo, 发生恶性转化10例14个结节, 未发生恶性转化25例31个结节.
1.2.1 分组: 恶性转化定义: 有肝异型增生结节病史, 经Gd-EOB-DTPA MRI等影像学复查、病理学检查证实转化为肝细胞癌. 将299例患者根据发生恶性转化分为发生组(44例62个结节)、未发生组(255例357个结节). 发生组均经病理学检查证实, 未发生组经手术病理证实(159例)或影像学检查证实(96例, 无恶性转化表现)[7].
1.2.2 基线资料收集: 自电子病历数据系统导出两组年龄、性别、BMI、糖尿病、高血压、冠心病、高脂血症、原发病、Child-Pugh肝功能分级、肝异型增生结节级别资料, 其中肝异型增生结节级别基于肝脏肿瘤病理学分类标准或影像学标准对未活检病例使用改良肝脏成像报告和数据系统(liver imaging reporting and data system, LI-RADS)影像标准, 改良LI-RADS分类LR-3和LR-4.
1.2.3 Gd-EOB-DTPA MRI检查: 通过磁共振仪(西门子area 1.5T磁共振), 阵列空间敏感性编码技术行呼气末屏气扫描, 包括轴位、冠状面MRI平扫、磁共振弥散加权成像(diffusion weighted imaging, DWI)及容积式内插值法屏气检查(volumetric interpolated breath-hold examination, VIBE)动态多时相扫描. T1加权成像(T1 weighted imaging, T1WI): 间隔2 mm, 重复时间(time of repetition, TR)180 ms, 层厚8 mm, 回波时间(time of echo, TE)2 ms; T2加权成像(T2 weighted imaging, T2WI): 间隔2 mm, TR 6000 ms, 层厚8 mm, TE 90 ms; VIBE: TR 3.9 ms, TE 1.8 ms, 翻转角10°, 层厚4.4 mm, 无间隔扫描, 矩阵512×512, 视野40 cm×38 cm; DWI: TE 57.9 ms, TR 5714.0 ms, b = 800 s/mm2. 肝胆期为注射Gd-EOB-DTPA(德国拜耳医药公司)后20 min 完成全肝扫描, 以1.0-1.5 mL/s和0.1 mL/kg团注肘静脉, 立即以2 mL/s氯化钠注射液20 mL冲管.
测量结节大小、T1WI(等高信号、低信号)、T2WI(高信号、低等信号)、DWI(高信号、低等信号)、肝胆期(低信号、高等信号)、动脉期信号强度、门静脉期廓清及结中结表现, 其中信号强度均以正常肝实质为背景, 相对信号比≥1.5为T1WI高信号, 0.9-1.1为等信号, <0.9为低信号; 结中结: 动脉期结节为局灶性富血供区, 外结节为乏血供临界灶, 肝胆期外结节高信号, 内结节低/高信号.
对于多结节患者, 仅将明确恶性转化的结节纳入发生组分析. 由同一名放射科医师阅片.
所有患者均在常规MRI完成后的7 d内行Gd-EOB-DTPA MRI, 以避免病灶自然演变对结果的影响. 首次检查后, 所有入组患者每3 mo接受一次随访(包括甲胎蛋白检测等), 每6 mo复查Gd-EOB-DTPA MRI, 直至结节病理确诊恶性转化或随访满1年.
统计学处理 采用SPSS Statistics 27.0软件, 计数资料用n(%)表示, 等级资料用秩和检验, 组间用χ2检验; 计量资料以(mean±SD)表示, 组间用独立样本t检验; 多因素Logistic回归分析MRI表现对肝异型增生结节恶性转化的影响; 采用R 3.6.1软件包, 通过"Match It"指令对发生组与未发生组进行倾向性评分匹配(propensity score matching, PSM), 匹配项目包括年龄、性别、BMI、糖尿病、高血压、冠心病、高脂血症、原发病、Child-Pugh肝功能分级、肝异型增生结节级别资料, 比例1:1, 邻近法, 卡钳值0.1; 绘制肝异型增生结节恶性转化风险的列线图, 采用受试者工作特征曲线(receiver operating characteristic, ROC)、校准曲线、决策分析曲线(decision curve analysis, DCA)曲线评估所建立的肝异型增生结节恶性转化风险的模型区分度、校准度及临床效用, 其中ROC下面积(area under the curve, AUC)>0.7表示有预测价值, 预测曲线与标准曲线相贴合表示模型的预测结果与实际一致, DCA曲线在0轴以上表示具有临床净获益; 为评估本研究所构建列线图模型的价值, 将其与目前临床广泛应用的肝脏成像报告和数据系统(LI-RADS, 2018版)进行分类性能比较, 由两位具有5年以上腹部影像诊断经验的放射科医师(对临床及病理结果不知情), 依据LI-RADS标准对所有入组结节进行独立评分, 将LR-4和LR-5类别定义为阳性(预测恶性转化), 将LR-3及以下类别定义为阴性(预测未恶性转化), 分别计算LI-RADS标准与本模型在训练集及验证集中的AUC, 并采用DeLong检验比较AUC的差异. P<0.05为差异有统计学意义.
常规MRI不典型强化的全部对象中, 分别为213例(71.24%)、66例(22.07%)、20例(6.69%)患者有1个、2个、及≥3个结节, 其中发生组44例62个结节, 未发生组255例357个结节, 两组年龄、性别、BMI、糖尿病、高血压、冠心病、高脂血症、原发病、Child-Pugh肝功能分级比较差异无统计学意义(P>0.05), 但发生组肝异型增生结节级别与未发生组比较差异有统计学意义(P<0.05). 采用PSM按照患者例数1:1配对后, 筛选出发生组44例62个结节, 未发生组44例个60结节, 配对后的两组以上各项基线资料比较差异均无统计学意义(P>0.05). 见表1.
| 资料 | PSM前 | PSM后 | ||||||
| 发生组(44例62个结节) | 未发生组(255例357个结节) | t/χ2/Z | P值 | 发生组(44例62个结节) | 未发生组(44例60个结节) | t/χ2/Z | P值 | |
| 年龄(岁) | 56.68±7.40 | 54.99±8.13 | 1.289 | 0.198 | 56.68±7.40 | 55.83±8.29 | 0.507 | 0.613 |
| 性别 | 0.081 | 0.776 | 0.411 | 0.521 | ||||
| 男 | 25(56.82) | 139(54.51) | 25(56.82) | 22(50.00) | ||||
| 女 | 19(43.18) | 116(45.49) | 19(43.18) | 22(50.00) | ||||
| BMI(kg/m2) | 23.95±1.02 | 23.88±0.94 | 0.450 | 0.653 | 23.95±1.02 | 23.90±0.98 | 0.234 | 0.815 |
| 糖尿病 | 8(18.18) | 41(16.08) | 0.121 | 0.728 | 8(18.18) | 5(11.36) | 0.812 | 0.367 |
| 高血压 | 11(25.00) | 58(22.75) | 0.107 | 0.743 | 11(25.00) | 7(15.91) | 1.117 | 0.290 |
| 冠心病 | 5(11.36) | 23(9.02) | 0.045 | 0.832 | 5(11.36) | 3(6.82) | 0.138 | 0.711 |
| 高脂血症 | 19(43.18) | 116(45.49) | 0.081 | 0.776 | 19(43.18) | 22(50.00) | 0.183 | 0.669 |
| 原发病 | 0.084 | 0.772 | 0.386 | 0.534 | ||||
| 病毒性肝炎 | 39(88.64) | 222(87.06) | 39(88.64) | 37(84.09) | ||||
| 酒精性肝硬化 | 5(11.36) | 33(12.94) | 5(11.36) | 7(15.91) | ||||
| Child-Pugh肝功能分级 | 0.077 | 0.939 | 0.415 | 0.678 | ||||
| A | 15(34.09) | 82(32.16) | 15(34.09) | 17(38.64) | ||||
| B | 20(45.45) | 124(48.63) | 20(45.45) | 19(43.18) | ||||
| C | 9(20.45) | 49(19.22) | 9(20.45) | 8(18.18) | ||||
| 肝异型增生结节级别 | 4.869 | 0.027 | 0.789 | 0.374 | ||||
| 低级别 | 21(33.87) | 175(49.02) | 21(33.87) | 25(41.67) | ||||
| 高级别 | 41(66.13) | 182(50.98) | 41(66.13) | 35(58.33) | ||||
| 甲胎蛋白(μg/L) | 6.14±1.96 | 5.97±1.89 | 0.548 | 0.584 | 6.14±1.96 | 6.08±1.92 | 0.145 | 0.885 |
两组结节直径、门静脉期廓清比较差异无统计学意义(P>0.05); 发生组T1WI、T2WI、DWI、肝胆期信号及动脉期高强化、结中结表现与未发生组比较差异有统计学意义(P<0.05). 见表2.
| 组别 | 结节数(n) | 结节直径(cm) | T1WI | T2WI | DWI | 肝胆期 | 动脉期高强化 | 门静脉期廓清 | 结中结 | ||||
| 等高信号 | 低信号 | 高信号 | 低等信号 | 高信号 | 低等信号 | 低信号 | 高等信号 | ||||||
| 发生组 | 62 | 1.72±0.58 | 32(51.61) | 30(48.39) | 51(82.26) | 11(17.74) | 52(83.87) | 10(16.13) | 59(95.16) | 3(4.84) | 34(54.84) | 11(17.74) | 25(40.32) |
| 未发生组 | 60 | 1.59±0.51 | 47(78.33) | 13(21.67) | 14(23.33) | 46(76.67) | 17(28.33) | 43(71.67) | 13(21.67) | 47(78.33) | 11(18.33) | 5(8.33) | 1(1.67) |
| t/χ2 | 1.313 | 9.539 | 42.531 | 38.278 | 68.094 | 17.455 | 2.369 | 27.170 | |||||
| P值 | 0.192 | 0.002 | 0.000 | 0.000 | 0.000 | 0.000 | 0.124 | 0.000 | |||||
以肝异型增生结节恶性转化情况为因变量(否 = 0, 是 = 1), 自变量进入模型的筛选标准: 两组比较差异有统计学意义的指标, 包括T1WI、T2WI、DWI、肝胆期信号及动脉期高强化、结中结表现, 多因素Logistic回归结果显示, T1WI等高信号、肝胆期信号高等信号是肝异型增生结节恶性转化的保护因素, T2WI高信号、DWI高信号、动脉期高强化、结中结表现是肝异型增生结节恶性转化的危险因素(P<0.05), 见表3和表4.
| 指标 | VIF | 多重共线性判断 | 赋值 | |
| 数值 | 参考值 | |||
| T1WI | 1.062 | <10 | 否 | 低信号 = 1, 等高信号 = 2 |
| T2WI | 1.284 | <10 | 否 | 低等信号 = 1, 高信号 = 2 |
| DWI | 2.003 | <10 | 否 | 低等信号 = 1, 高信号 = 2 |
| 肝胆期 | 1.475 | <10 | 否 | 低信号 = 1, 高等信号 = 2 |
| 动脉期高强化 | 1.601 | <10 | 否 | 否 = 0, 是 = 1 |
| 结中结 | 1.251 | <10 | 否 | 否 = 0, 是 = 1 |
| 影响因素 | β | SE | Wald χ2 | OR | 95%CI | P值 | |
| 下限 | 上限 | ||||||
| T1WI等高信号 | -1.121 | 0.319 | 12.347 | 0.326 | 0.265 | 0.401 | <0.001 |
| T2WI高信号 | 0.747 | 0.240 | 9.681 | 2.110 | 2.034 | 2.189 | <0.001 |
| DWI高信号 | 0.739 | 0.208 | 12.611 | 2.093 | 1.977 | 2.216 | <0.001 |
| 肝胆期高等信号 | -1.338 | 0.325 | 16.957 | 0.262 | 0.189 | 0.364 | <0.001 |
| 动脉期高强化 | 1.173 | 0.279 | 17.662 | 3.230 | 3.155 | 3.307 | <0.001 |
| 结中结 | 1.008 | 0.282 | 12.775 | 2.740 | 2.663 | 2.819 | <0.001 |
| 常数项 | -1.564 | 0.217 | 14.831 | - | - | - | <0.001 |
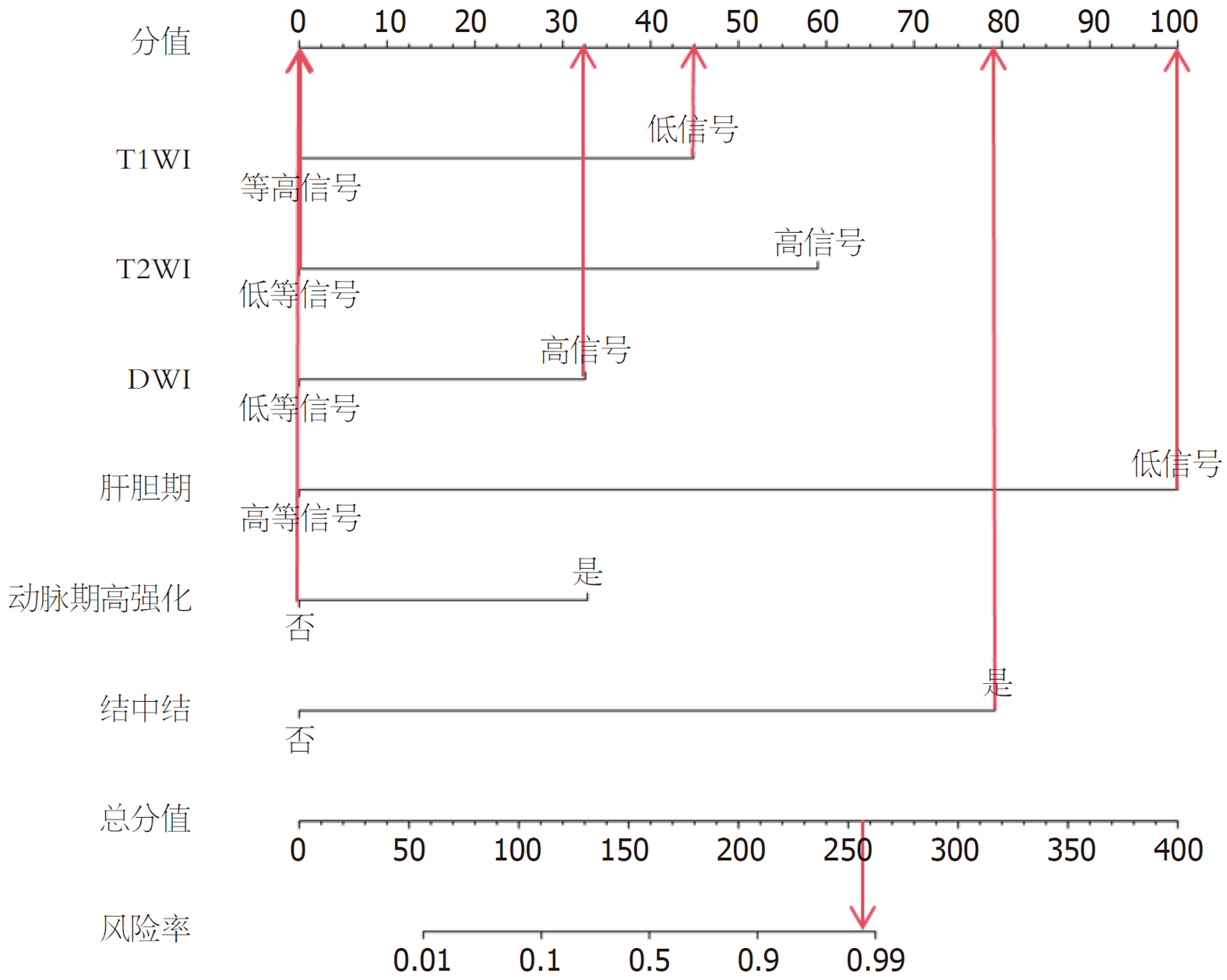
基于Logistic回归分析结果, 绘制肝异型增生结节恶性转化的列线图, 其C-index为0.978. 见图1. 如图1中病例表现为: T1WI低信号, T2WI低等信号, DWI高信号, 肝胆期低信号, 动脉期未高强化、结中结, 对应分值分别为45、0、32.5、100、0、79分, 总分值256.5分, 风险率 = 0.98, 该患者会发生恶性转化, 预测结果与临床实际保持一致.
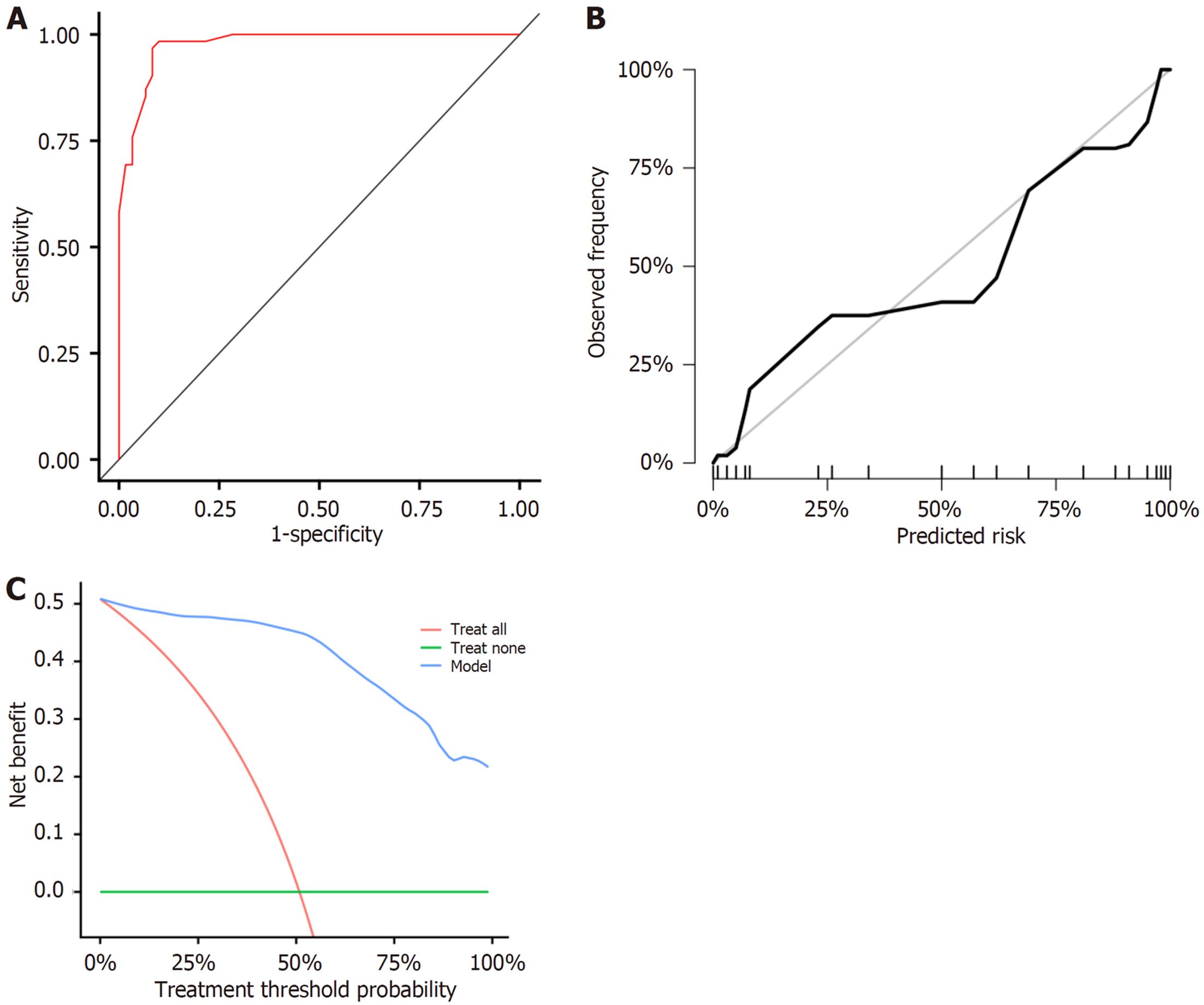
绘制ROC曲线显示, 肝异型增生结节恶性转化风险列线图的AUC为0.978(95%CI: 0.957-0.998), 且预测结果曲线与理想结果曲线高度贴合, 在较宽的阈值概率范围内, 采用所绘制的肝异型增生结节恶性转化的列线图对结局事件进行预测能获得临床净获益. 见图2.
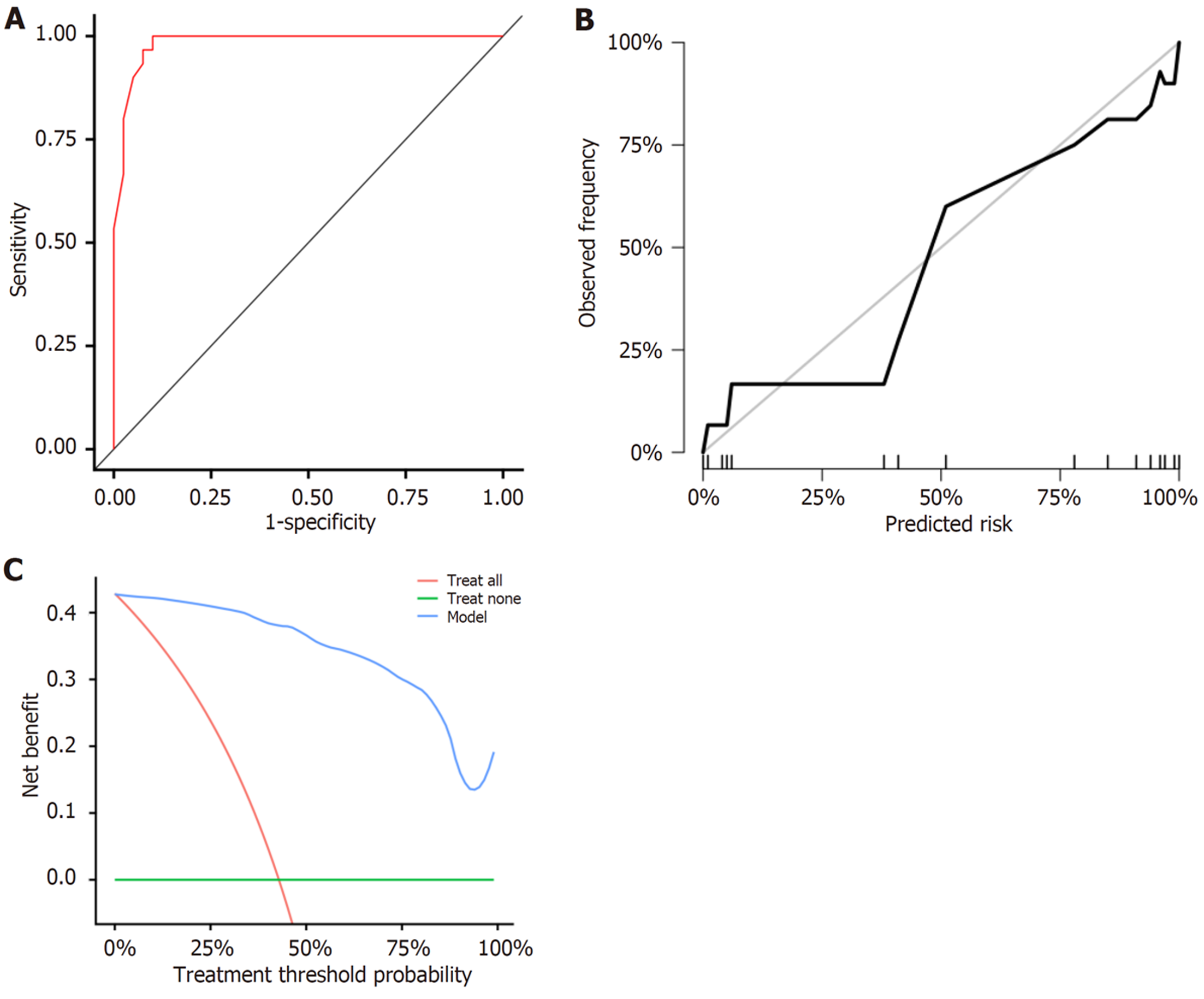
采用ROC曲线、校准曲线、DCA曲线在验证集中进行外部验证显示, 肝异型增生结节恶性转化风险列线图的AUC为0.983(95%CI: 0.960-0.999), 校准曲线、DCA曲线结果基本与内部验证保持一致, 提示所建立的预测模型稳定性良好, 具有泛化能力. 见图3.
在训练集中, 本模型的AUC为0.978, 显著高于LI-RADS的0.872(P<0.001); 在验证集中, 本模型的AUC为0.983, 同样显著高于LI-RADS的0.855(P<0.001). 见表5.
| 模型 | 数据集 | AUC(95%CI) | P值 |
| 本研究列线图 | 训练集 | 0.978(0.957-0.998) | 参考 |
| LI-RADS(LR-4/5为阳性) | 训练集 | 0.872(0.810-0.934) | <0.001 |
| 本研究列线图 | 验证集 | 0.983(0.960-0.999) | 参考 |
| LI-RADS(LR-4/5为阳性) | 验证集 | 0.855(0.780-0.930) | <0.001 |
近年来, Gd-EOB-DTPA MRI在肝脏疾病诊疗领域取得重要突破. 在肝癌诊断方面, Gd-EOB-DTPA MRI联合甲胎蛋白可将准确率明显提高[8]. 在疗效评估方面, Gd-EOB-DTPA MRI对肝癌化疗栓塞术后活性病灶的检出率显著优于CT[9]. 技术创新方面, 新型纳米对比剂的T1弛豫效能提高2倍, 可检出<0.5 cm病灶, 并将肝胆期成像时间缩短至5 min. 因不典型强化肝异型增生结节在常规MRI上常表现为动脉期轻度/模糊强化、缺乏典型快进快出特征, 单纯依赖常规MRI诊断效能有限, 导致这部分结节的恶性潜能被低估, 为患者带来潜在的健康风险[8,9].
本研究通过回顾性分析, 系统性地表明了Gd-EOB-DTPA MRI多项参数对常规MRI不典型强化肝异型增生结节恶性转化的预测价值. 其中T1WI高信号(OR = 0.362, P<0.001)作为保护因素的新发现, 可能与肝异型增生结节内铜结合蛋白或糖原沉积有关, 这些物质在恶性转化过程中会逐渐减少[10]. 由于T2WI主要反映细胞结构信息, 在肝异型增生结节向肝细胞癌转化过程中, 结节内部血供机制得到改善, 组织学上以脂肪沉积及结缔组织减少为主, 随着脂质沉积, 结节体积增大, 内部新的血管逐渐形成, 从而在T2WI呈现出高信号[11,12]. 故T2WI高信号则扮演了危险因素角色(OR = 2.110, P<0.001). 根据病理分级, 肝异型增生结节可分为低级别和高级别, 其中后者恶性转化风险显著提高[13,14]. 范恒亮等[15]报道, 高级别肝异型增生结节高信号T1WI患者占比明显降低, 高信号T2WI患者占比明显升高, 提示T1WI和T2WI能区分低级别和高级别肝异型增生结节, 进而有助于恶性转化风险的评估.
动脉期高强化反映的是结节内异常血管生成情况[16]. 实验表明[17], 动脉期高强化区域CD34微血管密度显著高于周边肝组织. 在肝异型增生结节向肝细胞癌转化过程中, 缺氧诱导因子上调促使血管内皮生长因子、血小板源性生长因子等促血管因子分泌, 导致未成熟毛细血管增生, 这些新生血管结构紊乱、基底膜不完整, 在影像上表现为动脉期显著强化[18]. 以上异常血管生成伴随炎症细胞浸润和细胞外基质降解, 为肝异型增生结节的恶性转变及肿瘤细胞侵袭创造了有利条件[19]. 本研究结果发现, 动脉期高强化是肝异型增生结节恶性转化的危险因素(OR = 3.230, P<0.001), 与以上理论预期相符, 提示动脉期高强化对患者恶性转化风险具有潜在的预警意义. 恶性转化过程中异型细胞增殖导致单位体积内细胞数目显著增多, 细胞外间隙减小直接限制水分子扩散, 且纤维间隔形成和血窦毛细血管化导致微观环境复杂性增加, 使得DWI表现为高信号[20]. 动脉期高强化联合DWI高信号能显著提升对肝异型增生结节恶性转化的评估能力[21].
肝胆期高等信号是恶性转化的保护因素(OR = 0.262, P<0.001), 这一结果与肝细胞功能保留的病理生理学机制高度吻合, 从分子层面看, 肝胆期信号强度直接反映了肝细胞膜上有机阴离子转运多肽1B1和OATP1B3转运体的表达水平, 在肝异型增生结节向肝细胞癌转化过程中, 随着细胞异型性增加, 这些转运体表达逐渐下调, 导致Gd-EOB-DTPA摄取减少, 表现为肝胆期信号降低[22,23]. 本研究中, 与肝胆期低信号相比, 肝胆期高等信号, 可将恶变风险降低0.262倍(95%CI: 0.189-0.364), 这一量化关系为临床提供了一个客观的监测指标. 研究表明[24], 肝细胞癌在肝胆期通常表现为低信号, 而低恶性转化风险结节多保留部分摄取功能, 呈等或高信号, 本研究结论与之存在相似之处, 揭示了肝胆期信号强度对恶性转化的提示意义. 值得注意的是, 本研究中较多患者常规MRI不典型结节在Gd-EOB-DTPA中表现为动脉期高强化、门静脉期廓清典型肝细胞癌征象, 这种影像升级现象提示, Gd-EOB-DTPA对微血管异常更敏感, 常规MRI可能低估部分结节的恶性风险, 这也解释了为何需联合肝胆期功能评估提高预测准确性. 另本研究发现结中结表现是肝异型增生结节恶性转化的危险因素, Gd-EOB-DTPA MRI能检测到常规MRI难以识别的结中结结构, 为早期恶变提供影像学预警.
本研究构建的列线图模型创新性地整合了细胞异类(T1WI)、功能影像(DWI)、细胞结构信息(T2WI)和血流动力学特征(Gd-EOB-DTPA), 突破传统仅依赖动态增强模式的局限, C-index为0.978, 呈现出较高的预测价值, 能为临床提供重要的参考信息. 同时内部与外部验证显示, 所构建的模型具有良好区分度、校准度和临床效用, 泛化能力良好, 为临床早期预测肝异型增生结节恶性转化风险提供了一种预测手段. 本研究的另一重要发现是, 所构建的预测模型在区分不典型强化结节的恶性转化风险时, 其性能显著优于LI-RADS分类标准, 这可能是由于以下原因: 首先LI-RADS主要依赖于动脉期高强化、门脉期廓清等快进快出的典型特征, 而本研究针对的正是缺乏这些典型表现的不典型强化结节, LI-RADS在此类结节的判别上存在不足; 其次本研究建立的模型创新性地整合了LI-RADS未充分强调的肝胆期功能信息和细胞结构信息, 这些参数为早期恶性转化提供了独立的预测价值.
本研究创新点及价值在于: (1)目前LI-RADS对典型肝癌的诊断效能已确立, 但临床实践中部分肝硬化结节表现为不典型强化, 其管理缺乏循证依据, 本研究有助于弥补LI-RADS的不足; (2)且除LI-RADS核心特征外, 本研究发现肝胆期低信号和结中结表现具有独立预测价值, 二者均非LI-RADS必要指标, 扩展了预测维度; (3)同时LI-RADS提供分类, 而本模型输出个体化概率, 更利于制定精准随访计划; (4)采用PSM解决样本偏倚问题, 有助于提高研究结果的可信度. 本研究所建立模型适用于不典型肝硬化结节的风险分层管理, 临床应用时, 若通过列线图预测发现, 患者为恶性转化的高风险群体, 可结合实际情况, 增加影像学随访频次, 缩短随访间隔, 必要时考虑活检, 且当模型预测的恶性转化风险较高时, 可为预防性干预提供强决策支持, 如对于一名肝功能储备良好(Child-Pugh A级)的患者, 若其结节预测风险极高, 临床医生可以更有信心地建议进行预防性消融(如射频消融、微波消融), 从而在肿瘤发生肉眼可见的进展前将其消灭, 可能显著改善患者预后; 同时本研究建立的模型还有助于肝切除术前的决策支持、肝癌局部治疗后的疗效评估、肝移植候选者的筛选等. 本研究不足之处在于, 未纳入ADC值等定量DWI参数, 未来将通过前瞻性队列系统采集多b值DWI数据, 进一步优化模型; 且本研究受限于实际情况, 导致对模型的验证数据不足, 下一步仍需积累病例, 对所建立模型进行进一步的验证. 另本研究通过PSM平衡了配对样本数量及组间差异, 但匹配后样本量的减少可能会导致统计功效降低, 因此模型的普适性和稳定性仍需通过更大规模、多中心、前瞻性的研究来进一步验证.
综上所述, 基于Gd-EOB-DTPA MRI的预测模型对常规MRI不典型强化肝异型增生结节恶性转化风险具有较高的预测价值, 能为临床随访管理、预防性干预提供决策支持.
常规磁共振(magnetic resonance imaging, MRI)在评估不典型强化结节时存在显著局限性: 部分结节动脉期强化不明显或呈模糊强化等, 难以对其作出准确诊断, 易导致漏诊或延迟治疗.
钆塞酸二钠(gadoxetic acid disodium, Gd-EOB-DTPA)MRI对常规MRI不典型强化的肝异型增生结节恶性转化风险预测的研究资料有限, 尚不能明确其是否具有预测价值, 这类结节常被归入"不确定结节"范畴, 医生面临是否积极干预的决策困境, 因此值得对此进行深入的探讨.
探讨Gd-EOB-DTPA MRI对MRI不典型强化肝硬化结节恶性转化的预测价值.
对299例肝硬化异型增生结节患者分析, 44例62个结节发生恶性转化(发生组), 255例357个结节未发生(未发生组), 经倾向性评分匹配后组间均衡. 另选35例患者作为验证集. Logistic回归显示MRI特征对恶性转化有显著影响, 并构建列线图模型. 受试者工作特征曲线、校准曲线及决策分析曲线评估显示, 该模型区分度、校准度及临床效用良好.
T1加权成像/肝胆期信号高可降低肝异型增生结节恶性转化风险, 而T2加权成像高信号、弥散加权成像高信号、动脉期高强化及结中结表现则显著增加风险(P<0.05). 列线图模型C-index达0.978, 验证显示其区分度、校准度及临床效用良好.
基于Gd-EOB-DTPA MRI的预测模型对常规MRI不典型强化肝异型增生结节恶性转化风险具有较高的预测价值, 能为临床随访管理、预防性干预提供决策支持.
本研究对肝异型增生结节恶性转化的预测价值, 构建预测模型, 为肝硬化异型增生结节的准确诊断和精准随访、干预提供参考.
| 1. | Wen KW, Kakar S. Hepatic Precancerous Lesions and Early Hepatocellular Carcinoma. Gastroenterol Clin North Am. 2024;53:109-132. [PubMed] [DOI] |
| 2. | Beaufrère A, Paisley S, Ba I, Laouirem S, Priori V, Cazier H, Favre L, Cauchy F, Lesurtel M, Calderaro J, Kannengiesser C, Paradis V. Differential diagnosis of small hepatocellular nodules in cirrhosis: surrogate histological criteria of TERT promoter mutations. Histopathology. 2024;84:473-481. [PubMed] [DOI] |
| 3. | Daungsupawong H, Wiwanitkit V. Impact of Pre-Examination Video Education in Gd-EOB-DTPA-Enhanced Liver MRI: Correspondence. J Med Radiat Sci. 2025;72:268-269. [PubMed] [DOI] |
| 4. | Nakamura M, Takatsu Y, Yoshizawa M, Yamamura K, Miyati T. Pulsation artifact reduction using compressed sensitivity encoding in Gd-EOB-DTPA contrast-enhanced magnetic resonance imaging. Radiol Phys Technol. 2025;18:86-93. [PubMed] [DOI] |
| 5. | Wang K, Jin X, Zhou J, Wang Z, Zhang X. Differences in the Diagnosis and Treatment of Patients with Early-Stage Hepatocellular Liver Cancer by Multi-Row Spiral CTMDCT and Gd-EOB-DTPA-Enhanced MRI. Altern Ther Health Med. 2024;30:31-35. [PubMed] |
| 6. | 李 文婧, 许 永生, 雷 军强. Gd-EOB-DTPA增强MRI对不典型增生结节和肝细胞癌的鉴别诊断效能的Meta分析. 中国循证医学杂志. 2023;23:1400-1406. [DOI] |
| 8. | Kim HY, Hong S, Heo S, Song IH, Kim J, Yoo Y, Kang HJ, Park SH, Lee SS, Kim SY. Comparison of clinical and MRI features of hepatic angiosarcoma and epithelioid hemangioendothelioma. Abdom Radiol (NY). 2025;50:619-632. [PubMed] [DOI] |
| 9. | Fan J, Ramulu BJ, Mallett CL, Kenney LE, Kauffman N, Bhattacharyya T, Sabbaghan M, Singh S, Zinn KR, Shapiro EM. Species-Specific Hepatic Uptake of [(64)Cu]Cu-EOB-NOTA, A Newly Designed Hepatospecific PET Agent. Mol Imaging Biol. 2025;27:305-312. [PubMed] [DOI] |
| 10. | Xiong J, Luo J, Bian J, Wu J. Overall diagnostic accuracy of different MR imaging sequences for detection of dysplastic nodules: a systematic review and meta-analysis. Eur Radiol. 2022;32:1285-1296. [PubMed] [DOI] |
| 11. | Jiang X, Washington MK, Izzy MJ, Lu M, Yan X, Zu Z, Gore JC, Xu J. Distinguishing Hepatocellular Carcinoma from Cirrhotic Regenerative Nodules Using MR Cytometry. Cancers (Basel). 2025;17:1204. [PubMed] [DOI] |
| 13. | Wu J, Zhao Q, Wang Y, Xiao F, Cai W, Liu S, Du Z, Yu X, Liu F, Yu J, Liang P. Feeding artery: a valuable feature for differentiation of regenerative nodule, dysplastic nodules and small hepatocellular carcinoma in CEUS LI-RADS. Eur Radiol. 2024;34:745-754. [PubMed] [DOI] |
| 14. | Wang Z, Yao J, Jing X, Li K, Lu S, Yang H, Ding H, Li K, Cheng W, He G, Jiang T, Liu F, Yu J, Han Z, Cheng Z, Tan S, Wang Z, Qi E, Wang S, Zhang Y, Li L, Dong X, Liang P, Yu X. A combined model based on radiomics features of Sonazoid contrast-enhanced ultrasound in the Kupffer phase for the diagnosis of well-differentiated hepatocellular carcinoma and atypical focal liver lesions: a prospective, multicenter study. Abdom Radiol (NY). 2024;49:3427-3437. [PubMed] [DOI] |
| 17. | Wagner M, Doblas S, Poté N, Lambert SA, Ronot M, Garteiser P, Paradis V, Vilgrain V, Van Beers BE. Comparison of pulsed and oscillating gradient diffusion-weighted MRI for characterizing hepatocellular nodules in liver cirrhosis: ex vivo study in a rat model. J Magn Reson Imaging. 2020;51:1065-1074. [PubMed] [DOI] |
| 18. | Kwok HM, Chau CM, Lee HCH, Wong T, Chan HF, Luk WH, Yung WTA, Cheng LF, Ma KFJ. Gadoxetic acid in hepatocellular carcinoma and liver metastases: pearls and pitfalls. Clin Radiol. 2023;78:715-723. [PubMed] [DOI] |
| 19. | Chen K, Wang J, Jiang L, Zhao F, Zhang R, Wu Z, Wang D, Jiao Y, Xie H, Qu C. A Blood Hepatocellular Carcinoma Signature Recognizes Very Small Tumor Nodules with Metastatic Traits. J Clin Transl Hepatol. 2024;12:551-561. [PubMed] [DOI] |
| 20. | Zhong X, Li JS, Chen ZJ, Yin JX, Gui S, Sun ZQ, Tang HS. [Texture analysis of diffusion-weighted magnetic resonance imaging to identify atypically enhanced small hepatocellular carcinoma and dysplastic nodules under the background of cirrhosis]. Zhonghua Gan Zang Bing Za Zhi. 2020;28:37-42. [PubMed] [DOI] |
| 21. | Zong X, Li M, Li J, Chen Q, Shi A, Gao X, Guo R. Mean ADC values and arterial phase hyperintensity discriminate small (≤ 3 cm) well-differentiated hepatocellular carcinoma from dysplastic nodule. Abdom Radiol (NY). 2024;49:1132-1143. [PubMed] [DOI] |
| 22. | Zheng G, Wei F, Lu P, Yang G, Li C, Lin C, Zhou Y, Chen Y, Tian J, Wang X, Wang L, Liu W, Zhang G, Cai Q, Huang H, Yun Y. IDEAL-IQ measurement can distinguish dysplastic nodule from early hepatocellular carcinoma: a case-control study. Quant Imaging Med Surg. 2024;14:3901-3913. [PubMed] [DOI] |
| 23. | Mo G, Li X, Jian Y, Xu W, Xiao X, Chen A, Ding Y, Jiang X, Shen J, Fan L, Wang Z, Dai L. Mn(II)-MOF nanoparticles conjugated with EOB-PEG as high-performance hepatobiliary-specific MRI contrast agents. Nanoscale. 2025;17:5743-5754. [PubMed] [DOI] |
| 24. | Xing F, Ma Q, Lu J, Zhu W, Du S, Jiang J, Zhang T, Xing W. Nodule-in-nodule architecture of hepatocellular carcinomas: enhancement patterns in the hepatobiliary phase and pathological features. Abdom Radiol (NY). 2024;49:3834-3846. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁