修回日期: 2025-10-01
接受日期: 2025-11-14
在线出版日期: 2025-11-28
目前, 急性生理学及慢性健康状况评分、手术侵袭度评分及功能状态评分系统等较为繁杂使其在实际临床工作中应用受限. 预后营养指数(prognostic nutritional index, PNI)是通过白蛋白、淋巴细胞计数综合评估营养及免疫状态的综合性指标, 已证实可用于手术部位感染的独立预测.
探究预后PNI、C反应蛋白(C-reactive protein, CRP)、免疫球蛋白对老年胃癌根治术后并发症的早期预测价值.
选取2023-04/2025-02杭州市余杭区第三人民医院200例老年胃癌患者, 根据术后1 mo内并发症情况分为发生组与未发生组, 利用倾向性评分匹配法(Propensity Score Matching, PSM)控制混杂因素影响, 比较手术前后两组PNI、CRP、免疫球蛋白(immunoglobulin, Ig)M、IgG、IgA水平变化, 采用平滑曲线分析其与老年胃癌根治术后并发症的关系, 采用受试者工作特征曲线(receiver operating characteristic, ROC)及曲线下面积(area under the curve, AUC)评价PNI、CRP、免疫球蛋白单独及联合预测价值.
200例老年胃癌患者术后并发症发生率为23.00%, PSM前发生组与未发生组在年龄、合并慢性病数量、脉管浸润、切除范围方面比较, 差异均有统计学意义(P<0.05), PSM后两组基线资料比较无显著差异(P>0.05); 术前1 d、术后1 d、3 d发生组CRP水平显著高于未发生组, PNI、IgM、IgG、IgA水平低于未发生组(P<0.05); 平滑曲线显示, CRP水平与老年胃癌根治术后并发症呈线性正相关关系, 与PNI、IgM、IgG、IgA水平呈线性负相关关系(P<0.05); ROC分析显示, 术前1 d、术后1 d、3 d PNI、CRP、免疫球蛋白水平预测老年胃癌根治术后并发症的AUC均>0.7, 并随时间延长, AUC值逐步升高, 且PNI、CRP、免疫球蛋白联合预测的AUC值最大; 外部验证集中PNI、CRP、免疫球蛋白联合预测老年胃癌根治术后并发症的结果与临床实际一致性为93.88%, Kappa值为0.847(95%CI: 0.736-0.965, P<0.001).
术后早期PNI、CRP及免疫球蛋白水平是预测老年胃癌根治术后并发症的重要指标, 联合检测可显著提升预测效能, 且指标检测普及率高、成本低, 有助于风险预测模型在围术期管理中的应用和推广.
核心提要: 本研究首次同步纳入营养指数、C反应蛋白及免疫球蛋白三类检测简便且成本低廉指标, 旨在为老年胃癌患者提供早期、高效及经济的术后并发症预警体系, 从而指导个体化围手术期管理, 为加速康复进程、改善预后奠定基础.
引文著录: 赵飞娟, 魏晓建. 预后营养指数、C反应蛋白、免疫球蛋白对老年胃癌根治术后并发症的早期预测价值. 世界华人消化杂志 2025; 33(11): 863-872
Revised: October 1, 2025
Accepted: November 14, 2025
Published online: November 28, 2025
The complexity of acute physiology and chronic health status scoring, surgical invasion scoring, and functional status scoring systems hinders their routine clinical application. Prognostic nutritional index (PNI) is an index for the comprehensive evaluation of nutrition and immune status through albumin and lymphocyte counts, which has been confirmed to be used for independent prediction of surgical site infection.
To explore the early predictive value of PNI, C-reactive protein (CRP), and immunoglobulins for complications after radical gastrectomy in elderly patients with gastric cancer.
Two hundred elderly patients with gastric cancer were selected at our hospital from April 2023 to February 2025. They were divided into a complication group and a non-complication group depending on whether complications occurred within one month after surgery. The Propensity Score Matching (PSM) method was used to control for confounding factors. The changes in levels of PNI, CRP, immunoglobulin (Ig) M, IgG, and IgA were compared between the two groups before and after surgery. Smooth curve analysis was used to investigate their relationship with postoperative complications in elderly patients undergoing radical gastrectomy. Receiver operating characteristic (ROC) curves and the area under the curve (AUC) were used to evaluate the predictive value of PNI, CRP, and immunoglobulins alone and in combination.
The incidence of postoperative complications in 200 elderly patients with gastric cancer was 23.00%. There were statistically significant differences in age, number of comorbidities, vascular invasion, and resection range between the two groups before PSM (P < 0.05). However, there were no significant differences in baseline information between the two groups after PSM (P > 0.05). The level of CRP in the complication group was significantly higher than that of the non-complication group at 1 day before operation and 1 day and 3 days after operation, and the levels of PNI, IgM, IgG, and IgA were lower than those of the non-complication group (P < 0.05). Smooth curve analysis indicated a linear positive correlation between CRP levels and postoperative complications after radical gastrectomy in elderly patients with gastric cancer, as well as a linear negative correlation between CRP levels and PNI, IgM, IgG, and IgA levels (P < 0.05). ROC analysis showed that the AUC values for predicting postoperative complications after radical gastrectomy in elderly patients with gastric cancer were all greater than 0.7 for PNI, CRP, and immunoglobulin levels on the day before surgery, the day after surgery, and the third day after surgery; over time, the AUC values gradually increased, and the AUC values of PNI, CRP, and immunoglobulins were the largest. The consistency of PNI, CRP, and immunoglobulins in the external validation set for predicting postoperative complications in elderly patients with gastric cancer after radical gastrectomy was 93.88%, and the Kappa value was 0.847 (95% confidence interval: 0.736-0.965, P < 0.001). Immunoglobulin levels yielded the highest AUC value.
Early postoperative PNI, CRP, and immunoglobulin levels are important indicators for predicting complications after radical gastrectomy in elderly patients with gastric cancer. Combined detection can significantly enhance predictive efficacy, and the indicators have a high prevalence rate and low cost, facilitating the application and promotion of risk prediction models in perioperative management.
- Citation: Zhao FJ, Wei XJ. Early predictive value of prognostic nutritional index, C-reactive protein, and immunoglobulins for complications after radical gastrectomy in elderly patients with gastric cancer. Shijie Huaren Xiaohua Zazhi 2025; 33(11): 863-872
- URL: https://www.wjgnet.com/1009-3079/full/v33/i11/863.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i11.863
胃癌是消化系统常见恶性肿瘤, 2024年流行病学统计, 我国癌症死亡病例为257.42万, 其中胃癌所致死亡人数高达26.04万, 占全国癌症死亡的10.1%, 癌症死亡原因排名第三位[1,2]. 随着老龄化加剧, 60岁以上人群患病率远超其他年龄段, 且老年患者因营养储备不足、生理机能衰退及免疫应答减弱, 胃癌根治术后并发症风险显著增加, 严重影响其康复进程及预后[3,4]. 因此, 早期识别高危患者并予以针对性干预至关重要. 目前, 急性生理学及慢性健康状况评分、手术侵袭度评分及功能状态评分系统等是临床实践中评估术后并发症的常用方法, 但评估方法较为繁杂使其在实际临床工作中应用受限. 此外, 从血清学方面分析, 现有预测模型多依赖单一指标, 缺乏对炎症、营养及免疫协同作用的综合评估. 预后营养指数(prognostic nutritional index, PNI)是通过白蛋白、淋巴细胞计数综合评估营养及免疫状态的综合性指标, 已证实可用于手术部位感染的独立预测[5]. C反应蛋白(C-reactive protein, CRP)作为一种急性炎症标志物, 在胃癌预后预测中展现潜力[6], 但其对胃癌术后并发症的早期监测尚缺乏系统研究. 免疫球蛋白(immunoglobulin, Ig)M、IgG、IgA是一类具有抗菌能力、增强免疫功能的蛋白质, 其水平变化可直接反映机体免疫状态, 而免疫系统紊乱是术后感染的主要诱因[7]. 鉴于此, 本研究首次同步纳入PNI、CRP及免疫球蛋白三类检测简便且成本低廉指标, 旨在为老年胃癌患者提供早期、高效及经济的术后并发症预警体系, 从而指导个体化围手术期管理, 为加速康复进程、改善预后奠定基础.
选取2023-04/2025-02杭州市余杭区第三人民医院200例老年胃癌患者, 纳入标准: 年龄≥60岁, 符合2022年版《胃癌诊疗指南》[8]诊断标准并接受胃癌根治术治疗; 近半年无激素药物或非甾体抗炎药使用史; 患者及其家属知情同意. 排除标准: 胃部手术史者; 合并其他恶性肿瘤者; 严重肝肾功能不全者; 术前存在感染未控制者; 合并全身系统免疫性疾病、血液系统疾病者.
1.2.1 资料收集方法: 术前1 d通过结构化问卷收集患者性别、年龄、体质量指数(body mass index, BMI)、合并慢性病数量等资料; 诊疗过程中实时采集肿瘤部位、肿瘤直径、切除范围、手术时间及出血量, 并根据病理科医师术后标本诊断报告收集分化程度、肿瘤直径、脉管浸润等信息.
1.2.2 CRP、免疫球蛋白、PNI检测: 分别于术前1 d、术后1 d、术后3 d采集患者空腹外周静脉血5 mL, 采用GFX105型离心机(北京万通科盛科技公司), 参数设定: 3000 r/min, 10 min, 半径10 cm, 留取血清置于-20 ℃冰箱保存. 采用酶联免疫吸附法检测血清CRP, 试剂盒购于上海酶联生物科技有限公司; 另取同次采集的全血样本, 采用免疫比浊法检测IgM、IgG、IgA; 根据白蛋白及淋巴细胞计算PNI, PNI = 血清白蛋白(g/L)+淋巴细胞总数(×109/L)×5.
1.2.3 并发症评估及分组: 参照Clavien-Dindo分级标准[9]及术后并发症诊断相关共识[10], 其中Ⅰ级并发症为背离术后恢复过程, 但不许手术、介入或药物干预, 可接受的治疗涉及退热药、止吐药、利尿剂、止痛剂及理疗等; Ⅱ级为需用Ⅰ级以外药物治疗, 包括需要全胃肠外营养和输血; Ⅲa级为干预不需全麻; Ⅲb级为干预并需全麻; Ⅳa级为单脏器功能不全; Ⅳb级为多器官功能不全; Ⅴ级为死亡. 统计胃癌根治术后1个月内≥Ⅱ级并发症, 当同一患者并发多个并发症时统计最严重的并发症, 且不予重复统计. 根据并发症发生情况分为发生组与未发生组.
统计学处理 应用SPSS 26.0统计学分析, 计数资料用n(%)表示, χ2检验; 计量资料用(mean±SD)表示, t检验; 采用1:1最邻近匹配法(卡钳值设为0.02)行倾向性评分匹配法(Propensity Score Matching, PSM)匹配, 以减少混杂因素影响; 平滑曲线分析PNI、CRP、免疫球蛋白与老年胃癌根治术后并发症的关系; 受试者工作特征(receiver operating characteristic, ROC)曲线及曲线下面积(area under the curve, AUC)评价PNI、CRP、免疫球蛋白对老年胃癌根治术后并发症的预测价值. P<0.05即差异有统计学意义.
200例老年胃癌患者术后出现并发症者共有46例(23.00%), 未发生并发症者共有154例(77.00%), 分别归入发生组与未发生组. PSM前发生组与未发生组在年龄、合并慢性病数量、脉管浸润、切除范围方面比较, 差异均有统计学意义(P<0.05); 采用PSM匹配, 最终发生组与未发生组各46例. PSM后两组基线资料比较, 差异均无统计学意义(P>0.05), 均衡可比, 见表1.
| 资料 | PSM前 | PSM后 | ||||||
| 发生组(n = 46) | 未发生组(n = 154) | t/Z/χ2值 | P值 | 发生组(n = 46) | 未发生组(n = 46) | t/Z/χ2值 | P值 | |
| 性别 | 0.023 | 0.878 | 0.044 | 0.834 | ||||
| 男 | 26(56.52) | 89(57.79) | 26(56.52) | 25(54.35) | ||||
| 女 | 20(43.48) | 65(42.21) | 20(43.48) | 21(45.65) | ||||
| 年龄(岁) | 71.35±4.10 | 68.26±3.85 | 4.705 | <0.001 | 71.35±4.10 | 70.12±4.32 | 1.714 | 0.088 |
| BMI(kg/m2) | 19.89±1.56 | 20.23±2.01 | 1.056 | 0.292 | 19.89±1.56 | 20.05±1.98 | 0.503 | 0.615 |
| 合并慢性病数量 | 6.969 | 0.031 | 0.483 | 0.785 | ||||
| 0 | 12(26.09) | 56(36.36) | 12(26.09) | 15(32.61) | ||||
| 1 | 16(34.78) | 67(43.51) | 16(34.78) | 15(32.61) | ||||
| ≥2 | 18(39.13) | 31(20.13) | 18(39.13) | 16(34.78) | ||||
| 肿瘤部位 | 0.218 | 0.897 | 0.651 | 0.722 | ||||
| 胃窦幽门部 | 28(60.87) | 91(59.09) | 28(60.87) | 26(56.52) | ||||
| 胃底贲门部 | 11(23.91) | 35(22.73) | 11(23.91) | 10(21.74) | ||||
| 胃体部 | 7(15.22) | 28(18.18) | 7(15.22) | 10(21.74) | ||||
| 临床分期 | 0.007 | 0.994 | 0.381 | 0.703 | ||||
| Ⅰ期 | 15(32.61) | 52(33.77) | 15(32.61) | 16(34.78) | ||||
| Ⅱ期 | 20(43.48) | 63(40.91) | 20(43.48) | 21(45.65) | ||||
| Ⅲ期 | 11(23.91) | 39(25.32) | 11(23.91) | 9(19.57) | ||||
| 分化程度 | 0.081 | 0.775 | 0.045 | 0.832 | ||||
| 中低分化 | 19(41.3) | 60(38.96) | 19(41.3) | 18(39.13) | ||||
| 高分化 | 27(58.7) | 94(61.04) | 27(58.7) | 28(60.87) | ||||
| 肿瘤直径(cm) | 0.116 | 0.733 | 0.198 | 0.656 | ||||
| <5 | 32(69.57) | 103(66.88) | 32(69.57) | 30(65.22) | ||||
| ≥5 | 14(30.43) | 51(33.12) | 14(30.43) | 16(34.78) | ||||
| 脉管浸润 | 0.086 | 0.769 | 0.806 | 0.369 | ||||
| 有 | 8(17.39) | 24(15.58) | 8(17.39) | 5(10.87) | ||||
| 无 | 38(82.61) | 130(84.42) | 38(82.61) | 41(89.13) | ||||
| 切除范围 | 7.331 | 0.026 | 0.441 | 0.802 | ||||
| 远端胃大部切除术 | 11(23.91) | 46(29.87) | 11(23.91) | 13(28.26) | ||||
| 近端胃切除术 | 16(34.78) | 75(48.70) | 16(34.78) | 16(34.78) | ||||
| 全胃切除术 | 19(41.3) | 33(21.43) | 19(41.3) | 17(36.96) | ||||
| 手术时间(min) | 0.541 | 0.462 | 0.183 | 0.669 | ||||
| <180 | 29(63.04) | 106(68.83) | 29(63.04) | 27(58.7) | ||||
| ≥180 | 17(36.96) | 48(31.17) | 17(36.96) | 19(41.3) | ||||
| 术中出血量 | 0.116 | 0.733 | 0.046 | 0.830 | ||||
| <250 | 28(60.87) | 98(63.64) | 28(60.87) | 29(63.04) | ||||
| ≥250 | 18(39.13) | 56(36.36) | 18(39.13) | 17(36.96) | ||||
术前1 d、术后1 d和术后3 d发生组CRP水平显著高于未发生组, PNI、IgM、IgG、IgA水平显著低于未发生组, 且术后1 d、术后3 d两组CRP水平均较术前1 d升高, PNI、IgM、IgG、IgA水平均较术前1 d降低(P<0.05), 见表2.
| 时间 | 组别 | n | PNI | CRP(mg/L) | IgM(g/L) | IgG(g/L) | IgA(g/L) |
| 术前1 d | 发生组 | 46 | 41.25±3.75 | 64.68±10.65 | 1.25±0.32 | 10.23±1.89 | 2.29±0.43 |
| 未发生组 | 46 | 44.32±4.20 | 56.10±9.77 | 1.40±0.34 | 11.36±1.92 | 2.71±0.41 | |
| t值 | 3.698 | 4.026 | 2.179 | 2.845 | 4.794 | ||
| P值 | 4.026 | <0.001 | 0.032 | 0.006 | <0.001 | ||
| 术后1 d | 发生组 | 46 | 38.71±4.02a | 92.62±13.60a | 1.16±0.30a | 6.53±1.10a | 1.85±0.37a |
| 未发生组 | 46 | 41.26±5.37a | 81.79±15.16a | 1.30±0.31a | 7.26±0.96a | 2.24±0.40a | |
| t值 | 2.578 | 3.601 | 2.201 | 3.391 | 4.854 | ||
| P值 | 0.012 | 0.001 | 0.030 | 0.001 | <0.001 | ||
| 术后3 d | 发生组 | 46 | 36.37±5.37a | 106.44±15.57a | 1.02±0.31a | 4.21±0.53a | 1.21±0.32a |
| 未发生组 | 46 | 39.20±6.15a | 93.62±13.95a | 1.21±0.32a | 5.62±0.74a | 1.75±0.36a | |
| t值 | 2.351 | 4.159 | 2.892 | 10.506 | 7.604 | ||
| P值 | 0.021 | <0.001 | 0.005 | <0.001 | <0.001 |
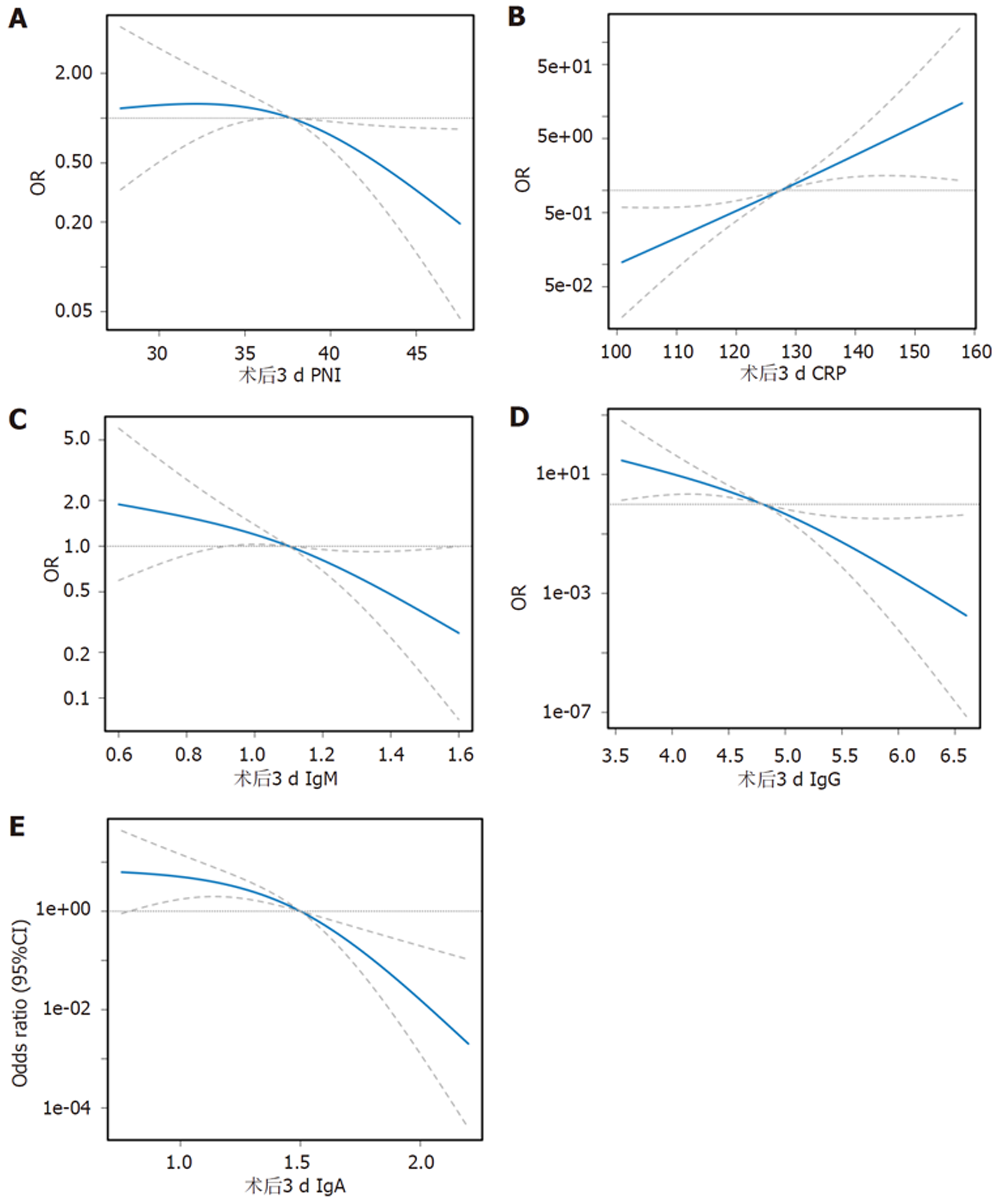
根据近因效应选择术后3 d PNI、CRP、免疫球蛋白水平绘制平滑曲线评估其与老年胃癌根治术后并发症的关系, 拟合发现CRP水平与老年胃癌根治术后并发症呈线性正相关关系, PNI、IgM、IgG、IgA水平与老年胃癌根治术后并发症呈线性负相关关系(P<0.05), 见图1.
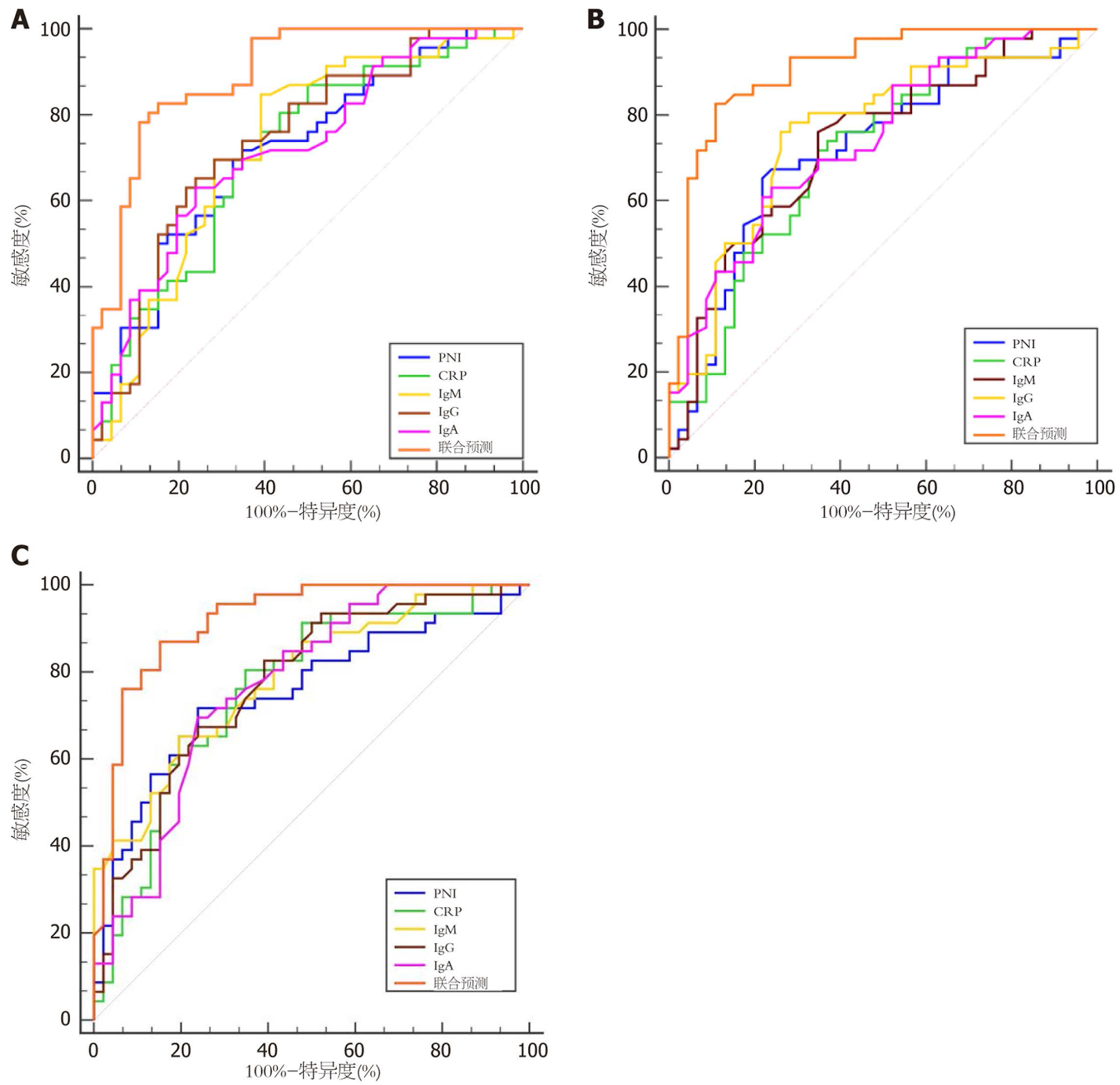
以术后发生并发症为阳性, 术后未发生并发症为阴性, 绘制预测老年胃癌根治术后并发症的ROC曲线. 结果显示, 术后1 d、3 d PNI、CRP、免疫球蛋白水平预测老年胃癌根治术后并发症的AUC均>0.7, 并随时间延长, AUC值逐步升高, 且PNI、CRP、免疫球蛋白联合预测的AUC值最大, 见图2、表3.
| 指标 | AUC | 95%CI | 截断值 | 敏感度 | 特异度 | P值 |
| PNI | ||||||
| 术前1 d | 0.716 | 0.613-0.805 | 36.20 | 71.74 | 65.22 | <0.001 |
| 术后1 d | 0.720 | 0.617-0.809 | 38.96 | 72.32 | 61.57 | <0.001 |
| 术后3 d | 0.753 | 0.652-0.837 | 41.65 | 73.10 | 64.28 | <0.001 |
| CRP | ||||||
| 术前1 d | 0.711 | 0.607-0.801 | 80.53 mg/L | 76.79 | 60.87 | <0.001 |
| 术后1 d | 0.716 | 0.612-0.805 | 118.92 mg/L | 76.09 | 60.87 | <0.001 |
| 术后3 d | 0.761 | 0.661-0.844 | 126.53 mg/L | 80.43 | 65.22 | <0.001 |
| IgM | ||||||
| 术前1 d | 0.730 | 0.627-0.817 | 1.32 g/L | 84.78 | 60.87 | <0.001 |
| 术后1 d | 0.732 | 0.630-0.819 | 1.21 g/L | 76.09 | 65.22 | <0.001 |
| 术后3 d | 0.786 | 0.688-0.865 | 1.09 g/L | 65.22 | 80.43 | <0.001 |
| IgG | ||||||
| 术前1 d | 0.742 | 0.640-0.828 | 10.76 g/L | 63.04 | 78.26 | <0.001 |
| 术后1 d | 0.759 | 0.659-0.842 | 6.85 g/L | 76.09 | 73.91 | <0.001 |
| 术后3 d | 0.774 | 0.675-0.855 | 4.38 g/L | 67.39 | 76.09 | <0.001 |
| IgA | ||||||
| 术前1 d | 0.720 | 0.617-0.809 | 2.46 g/L | 63.04 | 76.09 | <0.001 |
| 术后1 d | 0.742 | 0.640-0.827 | 1.98 g/L | 60.87 | 78.26 | <0.001 |
| 术后3 d | 0.769 | 0.669-0.850 | 1.42 g/L | 69.57 | 76.09 | <0.001 |
| 联合预测 | ||||||
| 术前1 d | 0.896 | 0.815-0.950 | - | 82.61 | 84.78 | <0.001 |
| 术后1 d | 0.909 | 0.831-0.959 | - | 82.61 | 89.13 | <0.001 |
| 术后3 d | 0.920 | 0.844-0.966 | - | 86.96 | 84.78 | <0.001 |
另选取2025-03/2025-06杭州市余杭区第三人民医院49例老年胃癌患者作为外部验证集, 术后发生并发症11例, 未发生并发症38例. 在外部验证集中术后3 d的PNI、CRP、免疫球蛋白联合预测老年胃癌根治术后并发症的结果与临床实际一致性为93.88%, Kappa值为0.847(95%CI: 0.736-0.965, P<0.001), 见表4.
| 联合预测 | 临床实际 | 合计 | 一致性(%) | Kappa值 | 95%CI | P值 | |
| 发生 | 未发生 | ||||||
| 发生 | 9 | 1 | 10 | 93.88 | 0.847 | 0.736-0.965 | <0.001 |
| 未发生 | 2 | 37 | 39 | ||||
| 合计 | 11 | 38 | 49 | ||||
胃癌作为全球高发恶性肿瘤, 根治性手术仍是其主要治疗手段[11]. 受逐渐衰退的生理状态影响, 老年患者术后并发症风险增高, 相关报告指出[12], 相比年轻人群, 老年胃癌患者术后并发症发生率明显升高. 本研究调查发现, 老年患者胃癌根治术后并发症发生率为23.00%, 低于徐少强[13]报道的47.70%, 高于涂远辉[14]报告的16.30%, 这一结果可能源于人群分层、定义及不同地区管理策略的差异, 而建立早期预警系统对高危人群实施预防性干预, 有助于降低并发症相关死亡率和医疗成本.
营养不良是引起恶性肿瘤患者并发症及预后不良的常见原因之一, 目前临床有多种营养筛查工具, 如主观整体评估、微型营养评估及营养风险筛查2002等, 但其操作繁琐且难以准确评估机体内环境[15,16]. PNI涉及白蛋白值及淋巴细胞计数2项参数, 易获取且计算简便, 其中白蛋白主要由肝实质细胞合成, 可反映机体营养状态, 被证实是恶性肿瘤预后不良的独立危险因素[17]. 淋巴细胞在一定程度上可反映机体炎症及免疫状况, 参与肿瘤细胞的凋亡和破坏过程, 是抗肿瘤免疫的重要组成部分, 其数量减少会对肿瘤患者预后造成不良影响[18]. PNI整合了白蛋白、淋巴细胞2个指标进行评价, 相较于单一指标, 其敏感性更强. 本研究发现, 发生组术前1 d PNI已明显低于未发生组, 与以往报道的低PNI增加术后感染风险的结论一致[19], 且术后进一步降低, 考虑与手术创伤及术后营养摄入不足有关. 此外, 本研究新发现PNI与术后并发症呈线性负相关关系, 这种关系可进一步提升其作为预警指标的敏感性. PNI数值变化可准确反映免疫、营养及炎症的微小波动[20]. 线性负相关意味着PNI每降低1个单位, 术后并发症风险即按固定比例增加, 这种量化关系可协助临床通过常规检测即可获取早期风险信号. 此外, 需注意的是术后早期PNI动态监测对术后并发症具有阶梯式预警意义, 其预测价值随时间推移而增加, 推测可能与并发症进程及对机体损害有关.
CRP主要是由肝脏合成的急性时相蛋白, 通常以微量形式存在, 其升高速度和幅度可直接反映组织损伤和感染严重程度[21]. 既往有研究显示[22], 术后1 d、3 d时术后有无并发症患者CRP水平并无明显差异, 但本研究结果与之不同, 在本研究中发生组术后1 d CRP即明显升高, 术后3 d持续攀升, 与未发生组存在显著差异(P<0.05), 印证了CRP作为早期预警指标的可靠性, CRP可在症状出现前24-48 h明显升高, 尤其对于腹腔脓肿、吻合口瘘、肺部感染等并发症具有重要的预警价值. 此外, 老年患者术后CRP持续升高, 受机体代谢及修复能力影响导致炎症持续激活, 通过炎症细胞因子级联反应继续加重组织损伤, 显著增加术后并发症风险[23]. 免疫球蛋白是体液免疫的重要成分, 胃癌患者常因营养障碍、肿瘤消耗及手术创伤等因素致使免疫功能受损, 而免疫球蛋白水平动态变化可有效反映这一过程. 研究显示[24], 胃癌患者术前IgM、IgG、IgA水平明显低于健康人群, 表明其免疫功能处于抑制状态. 另有研究发现[25,26], 持续免疫低下与术后感染风险密切相关. 本研究发现, 发生组患者在术前1 d即存在免疫球蛋白基础水平低下, 且术后1 d 、3 d呈持续性下降趋势, 明显低于未发生组(P<0.05), 这一现象揭示了老年胃癌患者围术期免疫功能的耗竭过程. 值得注意的是, 免疫球蛋白水平与术后并发症发生呈显著线性负相关(P<0.05), 提示免疫球蛋白水平变化与胃癌根治术后并发症的发生具有明显关联性.
本研究首次在老年胃癌群体中构建了PNI、CRP与免疫球蛋白的动态预测术后并发症的早期预警体系, 结果发现其预测效能随术后时间推移而增强, 这一结果揭示了术后并发症发生的病理生理进程: 术前1 d异常反映了患者存在高风险基础, 如老年患者机体功能衰退、营养储备不足、肿瘤慢性消耗及免疫低下等, 术后1 d指标剧变与手术创伤相关, 导致CRP急剧上升, 加速免疫球蛋白耗竭, 而PNI因淋巴细胞重分布及白蛋白加速分解而出现异常; 至术后3 d, CRP持续攀升, PNI、免疫球蛋白进行性下降, 这种随时间动态变化的特征使术后3 d成为预测的最佳窗口, 此时免疫失衡及炎症达到峰值, 且早于诸多并发症的临床表现. 此外, 术后3 d PNI、CRP与免疫球蛋白三联指标的整合使AUC高达0.920, 显著优于任一单个指标(P<0.05), 该联合预测体系涵盖了营养、炎症及免疫防御评估, 且PNI的纳入更契合老年胃癌患者营养不良问题, 对于术后并发症的预测具有积极意义. 同时, 本研究通过ROC明确了在不同时间点各指标的最佳截断值, 这些具体数值能为临床进行风险分层提供直接依据. 如术后3 d PNI≤41.65、CRP≥126.53 mg/L、IgM≤1.09 g/L均可被视为识别高危人群的界值. 基于这些阈值临床可将患者划分为高/低风险群体, 有助于对高危患者实施更积极、更早的靶向干预, 如预防性抗感染、优化免疫调节或强化营养支持等, 最终实现医疗资源的合理配置和并发症的精准预防. 另外, 在外部验证中, 联合预测术后并发症的结果与临床实际一致性为93.88%, 充分证实了联合预测具有良好的可靠性和普适性, 为其临床转化应用提供了有力证据.
综上, 术后早期PNI、CRP及免疫球蛋白水平是预测老年胃癌根治术后并发症的重要指标, 联合检测可显著提升预测效能, 且指标检测普及率高、成本低, 有助于预测体系在围术期管理中的应用和推广. 此外, 本研究尚存局限性: 首先, 尽管采用了PSM控制混杂因素, 但并发症发生组样本量相对有限(仅46例), 且为单中心研究, 这可能会研究结论的普适性产生一定影响; 其次, 虽然进行了外部验证, 但病例均来源于同一家医疗机构, 诊疗模式和患者群体相对固定, 结果的外推性有待进一步验证. 未来有必要开展大样本量的多中心研究, 并纳入更为广泛的临床指标, 以建立更具泛化能力的预测模型, 为临床决策提供更全面的试验依据.
目前, 急性生理学及慢性健康状况评分、手术侵袭度评分及功能状态评分系统等较为繁杂使其在实际临床工作中应用受限. 预后营养指数(prognostic nutritional index, PNI)是通过白蛋白、淋巴细胞计数综合评估营养及免疫状态的综合性指标, 已证实可用于手术部位感染的独立预测.
C反应蛋白(C-reactive protein, CRP)作为一种急性炎症标志物, 在胃癌预后预测中展现潜力, 但其对胃癌术后并发症的早期监测尚缺乏系统研究.
探究预后PNI、CRP、免疫球蛋白对老年胃癌根治术后并发症的早期预测价值.
选取200例老年胃癌患者, 分为发生组与未发生组, 利用倾向性评分匹配法控制混杂因素影响, 比较手术前后两组PNI、CRP、免疫球蛋白M、IgG、IgA水平变化, 采用平滑曲线分析其与老年胃癌根治术后并发症的关系, 采用受试者工作特征曲线及曲线下面积评价PNI、CRP、免疫球蛋白单独及联合预测价值.
200例老年胃癌患者术后并发症发生率23%. PSM前发生组与未发生组在年龄等4方面差异显著, PSM后无差异. 发生组CRP水平显著高于未发生组, PNI及免疫球蛋白水平显著低于未发生组. CRP水平与并发症呈线性正相关, PNI及免疫球蛋白水平呈线性负相关. PNI、CRP、免疫球蛋白联合预测并发症的曲线下面积值最大且随时间延长逐步升高. 外部验证集联合预测结果与临床实际一致性93.88%, Kappa值0.847.
术后早期PNI、CRP及免疫球蛋白水平是预测老年胃癌根治术后并发症的重要指标, 联合检测可显著提升预测效能, 且指标检测普及率高、成本低, 有助于风险预测模型在围术期管理中的应用和推广.
本研究尚存局限性: 首先, 可能会研究结论的普适性产生一定影响; 其次, 结果的外推性有待进一步验证. 未来有必要开展大样本量的多中心研究, 以建立更具泛化能力的预测模型, 为临床决策提供更全面的试验依据.
| 1. | Etoh T, Ohyama T, Sakuramoto S, Tsuji T, Lee SW, Yoshida K, Koeda K, Hiki N, Kunisaki C, Tokunaga M, Otsubo D, Takagane A, Misawa K, Kinoshita T, Cho H, Doki Y, Nunobe S, Shiraishi N, Kitano S; Japanese Laparoscopic Surgery Study Group (JLSSG). Five-Year Survival Outcomes of Laparoscopy-Assisted vs Open Distal Gastrectomy for Advanced Gastric Cancer: The JLSSG0901 Randomized Clinical Trial. JAMA Surg. 2023;158:445-454. [PubMed] [DOI] |
| 3. | Bausys A, Luksta M, Anglickiene G, Maneikiene VV, Kryzauskas M, Rybakovas A, Dulskas A, Kuliavas J, Stratilatovas E, Macijauskiene L, Simbelyte T, Celutkiene J, Jamontaite IE, Cirtautas A, Lenickiene S, Petrauskiene D, Cikanaviciute E, Gaveliene E, Klimaviciute G, Rauduvyte K, Bausys R, Strupas K. Effect of home-based prehabilitation on postoperative complications after surgery for gastric cancer: randomized clinical trial. Br J Surg. 2023;110:1800-1807. [PubMed] [DOI] |
| 4. | Obana A, Iwasaki K, Suwa T. Impact of postoperative complications on gastric cancer survival. Surgery. 2025;178:108873. [PubMed] [DOI] |
| 5. | Huang Z, Wang H, Da Y, Liu S, Zheng W, Li F. Do nutritional assessment tools (PNI, CONUT, GNRI) predict adverse events after spinal surgeries? A systematic review and meta-analysis. J Orthop Surg Res. 2024;19:289. [PubMed] [DOI] |
| 6. | 孟 洁, 康 亚丽, 任 更朴, 张 丽媛, 于 艳艳. 术前外周血纤维蛋白原与前白蛋白比值、C反应蛋白与前白蛋白比值、C反应蛋白与白蛋白比值与胃癌患者预后关系研究. 陕西医学杂志. 2024;53:987-990. [DOI] |
| 7. | Chan K, Loh CYY. Early postoperative infection in patient with IgM deficiency. Int Wound J. 2024;21:e70003. [PubMed] [DOI] |
| 9. | Clavien PA, Barkun J, de Oliveira ML, Vauthey JN, Dindo D, Schulick RD, de Santibañes E, Pekolj J, Slankamenac K, Bassi C, Graf R, Vonlanthen R, Padbury R, Cameron JL, Makuuchi M. The Clavien-Dindo classification of surgical complications: five-year experience. Ann Surg. 2009;250:187-196. [PubMed] [DOI] |
| 11. | Zhang KC, Lu CR, Zhang BL. Preoperative evaluation of gastric cancer and risk factors for postoperative complications. Chin J Gastrointest Surg. 2023;26:144-147. |
| 12. | Junttila A, Helminen O, Helmiö M, Huhta H, Jalkanen A, Kallio R, Koivukangas V, Kokkola A, Laine S, Lietzen E, Louhimo J, Meriläinen S, Pohjanen VM, Rantanen T, Ristimäki A, Räsänen JV, Saarnio J, Sihvo E, Toikkanen V, Tyrväinen T, Valtola A, Kauppila JH; FINEGO Group. Comparison of Postoperative Complications After Gastrectomy for Gastric Cancer with Antecolic Versus Retrocolic Reconstruction: A Population-Based Study. Ann Surg Oncol. 2024;31:5263-5272. [PubMed] [DOI] |
| 15. | Kang MK, Lee HJ. Impact of malnutrition and nutritional support after gastrectomy in patients with gastric cancer. Ann Gastroenterol Surg. 2024;8:534-552. [PubMed] [DOI] |
| 16. | Triantafillidis JK, Papakontantinou J, Antonakis P, Konstadoulakis MM, Papalois AE. Enteral Nutrition in Operated-On Gastric Cancer Patients: An Update. Nutrients. 2024;16:1639. [PubMed] [DOI] |
| 17. | 李 新, 毛 昀, 王 立凤, 张 纯, 张 建伟, 葛 捷. 血清PNI,LMR,ALB/GLB与老年非小细胞肺癌患者治疗疗效及预后的关系研究. 现代生物医学进展. 2024;24:2699-2703,2718. [DOI] |
| 18. | Momokita M, Abe A, Shibata K, Hayashi H, Furuta H, Taniguchi S, Nakayama A. Prognostic Nutritional Index in Patients With End-Stage Oral Cancer. Am J Hosp Palliat Care. 2023;40:396-400. [PubMed] [DOI] |
| 19. | 杨 凯, 侯 丁聪, 段 少先, 毕 怡, 谢 炎, 张 骊, 蒋 文涛. PNI、LMR、MELD对肝移植术后早期肺部感染的预测价值. 天津医药. 2024;52:1041-1045. [DOI] |
| 20. | Tobing E, Tansol C, Tania C, Sihombing AT. Prognostic Nutritional Index (PNI) as Independent Predictor of Poor Survival in Prostate Cancer: A Systematic Review and Meta-Analysis. Clin Genitourin Cancer. 2024;22:102142. [PubMed] [DOI] |
| 21. | Liberale G. Invited Editorial About the Clinical Significance of "Predictive Value of C-Reactive Protein for Infectious Complications After Cytoreductive Surgery and Hyperthermic Intraperitoneal Chemotherapy: A Single-Center Prospective Study" by Charbonneau et al: Postoperative CRP to Predict Postoperative Complications: A Myth or Reality? Ann Surg Oncol. 2024;31:8488-8490. [PubMed] [DOI] |
| 22. | Bona D, Danelli P, Sozzi A, Sanzi M, Cayre L, Lombardo F, Bonitta G, Cavalli M, Campanelli G, Aiolfi A. C-reactive Protein and Procalcitonin Levels to Predict Anastomotic Leak After Colorectal Surgery: Systematic Review and Meta-analysis. J Gastrointest Surg. 2023;27:166-179. [PubMed] [DOI] |
| 23. | Calu V, Piriianu C, Miron A, Grigorean VT. Utilizing C-Reactive Protein (CRP) and CRP Ratios for Early Detection of Postoperative Complications Following Rectal Cancer Surgery. Life (Basel). 2024;14:1465. [PubMed] [DOI] |
| 24. | Zhu RH, Li PC, Zhang J, Song HH. Impact of minimally invasive surgery on immune function and stress response in gastric cancer patients. World J Gastrointest Surg. 2024;16:2484-2493. [PubMed] [DOI] |
| 25. | Van Roy Z, Arumugam P, Bertrand BP, Shinde DD, Thomas VC, Kielian T. Tissue niche influences immune and metabolic profiles to Staphylococcus aureus biofilm infection. Nat Commun. 2024;15:8965. [PubMed] [DOI] |
| 26. | Imlay H, Seibert AM, Hanson KE. Pathogen-agnostic immune biomarkers that predict infection after solid organ transplantation. Transpl Infect Dis. 2023;25:e14020. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): E
科学编辑: 刘继红 制作编辑:张砚梁