修回日期: 2025-10-11
接受日期: 2025-10-20
在线出版日期: 2025-10-28
贝飞达与布拉氏酵母菌可调节肠道菌群平衡, 提高病原菌清除率. 但部分患儿仍达不到临床理想效果可能因单独用药在扭转厌氧菌与需氧菌动态失衡的作用效果较弱. 因此, 临床考虑将两种药物联合治疗以满足厌氧菌与需氧菌的动态平衡.
基于倾向性评分匹配(propensity score matching, PSM)原则分析布拉氏酵母菌与贝飞达单独及联合治疗病毒性肠炎的临床疗效.
选取2022-03/2025-03绍兴市上虞妇幼保健院收治的240例病毒性肠炎患儿, 根据治疗方案分为酵母菌组(98例)、贝飞达组(92例)、联合组(50例). 根据治疗前资料进行1:1:1 PSM, 卡钳值为0.1, 以联合组50例作为匹配基准, 而另外两组样本经筛选, 最终各匹配出50例, 以确保匹配后三组基线特征具有最佳可比性. 比较两3组疗效、临床症状缓解时间、改良Vesikari评分、粪便病毒抗原转阴时间及血炎症因子[白细胞计数(white blood cell count, WBC)、超敏C反应蛋白(high-sensitivity C-reactive protein, hs-CRP)]、不良反应.
联合组总有效率显著高于酵母菌组、贝飞达组(P<0.05); 联合组发热、呕吐、腹痛、腹泻缓解时间早于酵母菌组、贝飞达组(P<0.05); 联合组治疗1 d、3 d、5 d后改良Vesikari评分低于酵母菌组、贝飞达组(P<0.05); 联合组粪便病毒抗原转阴时间及治疗5 d后hs-CRP、WBC低于酵母菌组、贝飞达组(P<0.05); 酵母菌组和贝飞达组发热、呕吐、腹痛、腹泻缓解时间比较, 以及总有效率、改良Vesikari评分、粪便病毒抗原转阴时间、治疗5 d后hs-CRP、WBC比较差异无统计学意义(P>0.05). 3组不良反应发生率比较差异无统计学意义(P>0.05).
贝飞达联合布拉氏酵母菌治疗病毒性肠炎具有显著效果, 可降低机体炎症因子水平, 加速临床症状缓解及病毒转阴进程, 促进病情恢复.
核心提要: 由于既往研究中有关二者联合治疗的研究多为两组对照分析, 存在混杂因素, 无法分离不同微生态制剂的真实贡献. 因此, 本研究开展了此项回顾性研究, 并通过倾向性评分匹配法平衡3组患儿一般资料的协变量分布, 以减少结果偏差, 旨在精准分析布拉氏酵母菌与贝飞达单独及联合治疗病毒性肠炎的临床疗效, 为临床治疗策略提供科学性参考依据.
引文著录: 马德康, 徐燕燕, 吴洪杰. 基于倾向性评分匹配原则分析布拉氏酵母菌与贝飞达单独及联合治疗病毒性肠炎的临床疗效. 世界华人消化杂志 2025; 33(10): 813-820
Revised: October 11, 2025
Accepted: October 20, 2025
Published online: October 28, 2025
Beifeida and Bracella can adjust the balance of intestinal flora and improve the clearance rate of pathogens. However, some children still fail to achieve the ideal clinical effect, which may be because the effect of monotherapy in reversing the dynamic imbalance between anaerobic and aerobic bacteria is weak. Therefore, combination therapy may help achieve a dynamic balance between anaerobic and aerobic bacteria.
To analyze the clinical efficacy of Brachyeuchrys boulardii and Bifidobacterium triple viable (commercially known as Beifeida), alone and in combination, in the treatment of viral enteritis based on the propensity score matching (PSM) principle.
A total of 240 pediatric patients with viral enteritis admitted to our hospital between March 2022 and March 2025 were selected and divided into three groups based on treatment regimens: Yeast group (98 cases), Bifidobacterium triple viable group (92 cases), and combination group (50 cases). A 1:1:1 PSM was performed using pre-treatment data, with a clamp value of 0.1. Taking 50 cases in the combination group as the matching benchmark, the other two groups of samples were screened, and finally 50 cases were matched to ensure the best comparability of baseline characteristics after matching. The efficacy, time to clinical symptom resolution, modified Vesikari score, time to negative fecal viral antigen, and blood inflammatory markers [white blood cell count (WBC) and high-sensitivity C-reactive protein (hs-CRP)] were compared among the three groups, and adverse reactions were recorded.
The total effective rate in the combination group was significantly higher than that of the other two groups (P < 0.05). The combination group showed earlier relief of fever, vomiting, abdominal pain, and diarrhea compared to the other two groups (P < 0.05). The modified Vesikari scores after 1 day, 3 days, and 5 days of treatment in the combination group were lower than those of the other two groups (P < 0.05). The time for fecal viral antigen to turn negative and the levels of hs-CRP and WBC after 5 days of treatment in the combination group were lower than those of the other two groups (P < 0.05). There were no significant differences in the above indicators between the yeast group and the Beifeida group (P > 0.05). There were no significant differences in the incidence of adverse reactions among the three groups (P > 0.05).
Bifidobacterium triple viable combined with Saccharomyces boulardii is highly effective in treating viral enteritis, and can reduce the levels of inflammatory factors in the body, accelerate the relief of clinical symptoms and the process of viral seroconversion, and promote recovery.
- Citation: Ma DK, Xu YY, Wu HJ. Clinical efficacy of monotherapy and combination therapy with Saccharomyces boulardii and Bifidobacterium triple viable for viral enteritis: A propensity score-matched study. Shijie Huaren Xiaohua Zazhi 2025; 33(10): 813-820
- URL: https://www.wjgnet.com/1009-3079/full/v33/i10/813.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i10.813
目前, 微生态制剂已成为临床治疗病毒性肠炎的常用药物, 但临床中微生态制剂多种多样, 使用哪种成分可获得最佳的治疗效果, 临床尚无统一标准. 贝飞达(此为商品名, 以下双歧杆菌三联活菌统称为贝飞达)与布拉氏酵母菌是临床常用微生态制剂. 目前, 已有相关研究表明[1-3], 贝飞达与布拉氏酵母菌在小儿腹泻治疗中均具有良好效果, 可调节肠道菌群平衡, 提高病原菌清除率. 但临床经验发现[4,5], 部分患儿尽管使用上述微生态制剂治疗后仍达不到临床理想效果可能因单独用药在扭转厌氧菌与需氧菌动态失衡的作用效果较弱. 因此, 临床考虑将两种药物联合治疗以满足厌氧菌与需氧菌的动态平衡. 由于既往研究多为两组对照分析[6,7], 且回顾性研究中也存在难以控制的混杂因素, 无法分离不同微生态制剂的真实贡献. 为此, 本研究开展了此项回顾性研究, 并通过倾向性评分匹配(propensity score matching, PSM)法对贝飞达与布拉氏酵母菌单独使用及联合治疗的病毒性肠炎患儿采用进行1:1:1匹配, 以平衡3组患儿一般资料的协变量分布, 减少选择偏差, 旨在精准分析布拉氏酵母菌与贝飞达单独及联合治疗病毒性肠炎的临床疗效, 为临床治疗策略提供科学性参考依据.
样本量选取: 既往研究结果显示[3], 贝飞达或布拉氏酵母菌治疗儿童腹泻的总有效率为91.3%或79.7%. 本研究对比了3种治疗方案的效果, 故按多样本率所需样本量计算, 设检验水准α为0.05, 检验效能1-β为0.9, 样本个数为3个, 预设最小总体样本率为0.78, 最大总体样本率为0.96, 用SPSS 27.0系统计算出每组所需样本量为76例, 总样本量为228, 选取样本时按约5%的样本丢失率估算, 最终回顾性选取2022-03/2025-03绍兴市上虞妇幼保健院收治的240例病毒性肠炎患儿. 因进行回顾性研究故豁免知情同意.
纳入标准: 符合病毒性肠炎诊断标准[8], 大便镜检白细胞数≤5个/高倍镜视野, 大便形状水样改变(糊状、水样黏液、蛋花汤样或水样), 大便次数≥3次/d; 粪便轮状病毒检测为阳性; 年龄3 mo-6岁; 病程<4 d.
排除标准: 先天性功能发育不全者; 合并外伤者; 伴遗传性疾病; 精神障碍者; 因其他病因引发的急性腹泻; 严重营养不良患儿; 伴有心肝肾等重要脏器、造血系统、免疫系统疾病者; 伴低血容量休克、严重脱水者; 未能坚持治疗或临床检查项目不全者; 发病后使用抗生素治疗; 粪便细菌培养阳性者. 根据治疗方案分为酵母菌组(98例)、贝飞达组(92例)、联合组(50例). 统计3组患儿治疗前的临床资料, 包括体质量、身高、免疫球蛋白水平、性别、年龄、病程、大便次数、粪便双歧杆菌含量及大肠杆菌含量等, 本研究选取的免疫球蛋白是预测病情程度的关键因素, 免疫球蛋白A水平越低其病情越严重[9]. 根据治疗前资料进行1:1:1 PSM, 卡钳值为0.1, 以联合组50例作为匹配基准, 而另外两组样本经筛选, 最终各匹配出50例, 以确保匹配后三组基线特征具有最佳可比性.
所有患儿均予以补液盐口服或静脉补液, 并予以止泻、退热、止吐等对症处理. 饮食以米汤、稀粥等易消化饮食为主.
酵母菌组予以布拉氏酵母菌散(法国BIOCODEX, 国药准字SJ20150051, 0.25 g(菌体)/袋)治疗, 根据年龄调整剂量, 其中<3岁, 0.25 g/d, 1次/d; ≥3岁, 0.5 g/d, 早晚各1次.
贝飞达组双歧杆菌三联活菌肠溶胶囊(晋城海斯制药有限公司, 国药准字S19993065, 0.21 g×36粒)治疗, 根据年龄调整剂量, 其中<3岁, 1粒/次, 2次/d; ≥3岁, 2粒/次, 2次/d. 按说明书婴幼儿使用时可将胶囊内容物用温水送服.
联合组予以布拉氏酵母菌+双歧杆菌三联活菌治疗, 方法同酵母菌组与贝飞达组.
3组均连续治疗5 d, 均在常规用药1 h后温水送服.
1.3.1 疗效: 治疗5 d后根据腹泻疗效标准评估: 显效: 排便频率恢复正常(≤2次/d)同时满足布里斯托大便分型为3、4级; 有效: 排便恢复正常(≤2次/d)或满足布里斯托大便分型为4、5级; 无效: 排便次数仍≥3次/d以及布里斯托大便分型为6级、7级[3]. 总有效率(%) = (显效+有效)例数/每组总例数×100%.
1.3.2 临床症状缓解时间: 统计患儿发热、呕吐、腹痛、腹泻缓解时间.
1.3.3 改良Vesikari评分: 治疗前与治疗1 d、3 d、5 d后使用改良Vesikari评分[10]评估患儿病情程度, 该评分包括腹泻持续时间(0-2分)、腹泻频率(0-2分)、呕吐持续时间(0-2分)、呕吐频率(0-2分)、体温(0-2分)、脱水与治疗干预(0-3分)等项目, 分值范围为0-13分, 分值越高表明病情越严重.
1.3.4 粪便病毒抗原转阴时间: 统计患儿粪便转阴时间. 粪便检测: 佩戴无菌手套, 取患儿晨起第一次粪便置于无菌PE管内, 加入200 μL PBC混匀, 放置在离心机中, 以1000 r/min、半径5 cm, 离心10 min, 取上清液, 用酶联免疫试剂盒检测, 肉眼观察粪便变化, 蓝色为阳性, 无色为阴性.
1.3.5 外周血炎症因子: 统计治疗前及治疗5 d后患儿白细胞计数(white blood cell count, WBC)、超敏C反应蛋白(high-sensitivity C-reactive protein, hs-CRP)水平, 检测方法: 采集患儿晨起空腹静脉血1 mL置于含EDTA抗凝剂的采血管中, 使用血液分析仪测定WBC; 采集2 mL静脉血置于不含抗凝剂的采血管中, 放置在离心机中离心处理5 min(半径5 cm、转速3500 r/min、离心时间5 min), 获取血清, 使用酶联免疫法检测hs-CRP.
1.3.6 不良反应: 统计患儿治疗期间不良反应发生情况, 如口干、过敏反应等.
统计学处理 使用SPSS 25.0统计学软件进行样本量评估, 并进行数据分析、处理. 以体质量、身高、免疫球蛋白水平、性别、年龄、病程、大便次数、粪便双歧杆菌含量及大肠杆菌含量为协变量, 用PSM最邻近匹配法进行1:1:1匹配, 卡钳值为0.1, 以联合组50例作为匹配基准, 而另外两组样本经筛选, 最终各匹配出50例, 以确保匹配后三组基线特征具有最佳可比性, 标准化均数差(standard mean differences, SMD)<0.1表示协变量平衡良好. 通过Shapiro-Wilk检验, 符合正态分布的计量资料用(mean±SD)表示, 方差齐性, 多时间点或多组间指标使用重复测量方差结果分析, 并进行Bonferroni校正, 若时间处理因素有交互效应, 需然后分析单独效应(单因素、多变量方差分析时间、组间效应). 计数资料用χ²检验. P<0.05为差异具有统计学意义.
匹配前, 酵母菌组98例、贝飞达组92例、联合组50例, 联合组与贝飞达组、酵母菌组在性别、年龄、病程、大便次数、粪便双歧杆菌含量及大肠杆菌含量多个关键协变量上存在明显不平衡(SMD>0.1), 3组性别、年龄、病程、大便次数、粪便双歧杆菌含量及大肠杆菌含量比较差异有统计学意义(P<0.05), 见表1.
| 组别 | 例数 | 性别 | 年龄(岁) | 体质量(kg) | 身高(cm) | 病程(h) | 大便次数(次/d) | 粪便双歧杆菌含量(log10CFU/g) | 粪便大肠杆菌含量(log10CFU/g) | 免疫球蛋白A(g/L) | |
| 男 | 女 | ||||||||||
| 酵母菌组 | 98 | 58(59.18) | 40(40.82) | 2.23±0.55 | 12.15±1.52 | 90.69±3.92 | 51.63±5.98 | 5.56±0.27 | 4.70±0.25 | 6.08±0.50 | 0.98±0.16 |
| 贝飞达组 | 92 | 42(45.65) | 50(54.35) | 2.10±0.36 | 12.40±2.06 | 91.50±4.05 | 53.69±6.45 | 5.80±0.25 | 4.41±0.32 | 6.30±0.38 | 0.95±0.13 |
| 联合组 | 50 | 16(32.00) | 34(68.00) | 2.02±0.41 | 11.99±1.95 | 91.02±4.16 | 63.60±6.18 | 6.02±0.35 | 4.23±0.30 | 6.51±0.33 | 0.93±0.15 |
| F/χ2 | 10.226 | 3.979 | 0.906 | 0.968 | 64.497 | 46.814 | 49.640 | 17.857 | 2.140 | ||
| P | 0.006 | 0.020 | 0.405 | 0.381 | <0.001 | <0.001 | <0.001 | <0.001 | 0.120 | ||
经过1:1:1倾向性评分匹配后, 性别、年龄、病程、大便次数、粪便双歧杆菌含量及大肠杆菌含量多个协变量的标准化均数差均降至0.1以下, 消除了组间基线差异, 具有可比性. PSM后, 酵母菌组50例、贝飞达组50例、联合组50例, 且3组体质量、身高、免疫球蛋白水平、性别、年龄、病程、大便次数、粪便双歧杆菌含量及大肠杆菌含量比较差异均无统计学意义(P>0.05), 见表2.
| 组别 | 例数 | 性别 | 年龄(岁) | 体质量(kg) | 身高(cm) | 病程(h) | 大便次数(次/d) | 粪便双歧杆菌含量(log10CFU/g) | 粪便大肠杆菌含量(log10CFU/g) | 免疫球蛋白A(g/L) | |
| 男 | 女 | ||||||||||
| 酵母菌组 | 50 | 22(44.00) | 28(56.00) | 2.11±0.45 | 12.21±1.60 | 91.15±3.98 | 61.00±6.41 | 5.89±0.34 | 4.30±0.29 | 6.39±0.40 | 0.95±0.15 |
| 贝飞达组 | 50 | 20(40.00) | 30(60.00) | 2.15±0.40 | 12.35±1.80 | 90.89±4.20 | 61.80±6.25 | 5.92±0.31 | 4.29±0.35 | 6.42±0.35 | 0.91±0.13 |
| 联合组 | 50 | 16(32.00) | 34(68.00) | 2.02±0.41 | 11.99±1.95 | 91.02±4.16 | 63.60±6.18 | 6.02±0.35 | 4.23±0.30 | 6.51±0.33 | 0.90±0.15 |
| F/χ2 | 1.574 | 1.253 | 0.514 | 0.050 | 2.248 | 1.253 | 0.725 | 1.495 | 1.696 | ||
| P值 | 0.455 | 0.289 | 0.599 | 0.951 | 0.109 | 0.289 | 0.486 | 0.228 | 0.187 | ||
3组患儿疗效比较差异有统计学意义(P<0.05), 其中联合组总有效率显著高于酵母菌组、贝飞达组(P<0.05); 酵母菌组和贝飞达组总有效率比较差异无统计学意义(P>0.05). 见表3.
采用重复测量方差单因素分析, 3组患儿发热、呕吐、腹痛、腹泻缓解时间比较差异有统计学意义(P<0.05), 其中联合组发热、呕吐、腹痛、腹泻缓解时间早于酵母菌组、贝飞达组(P<0.05); 酵母菌组和贝飞达组发热、呕吐、腹痛、腹泻缓解时间比较差异无统计学意义(P>0.05). 见表4.
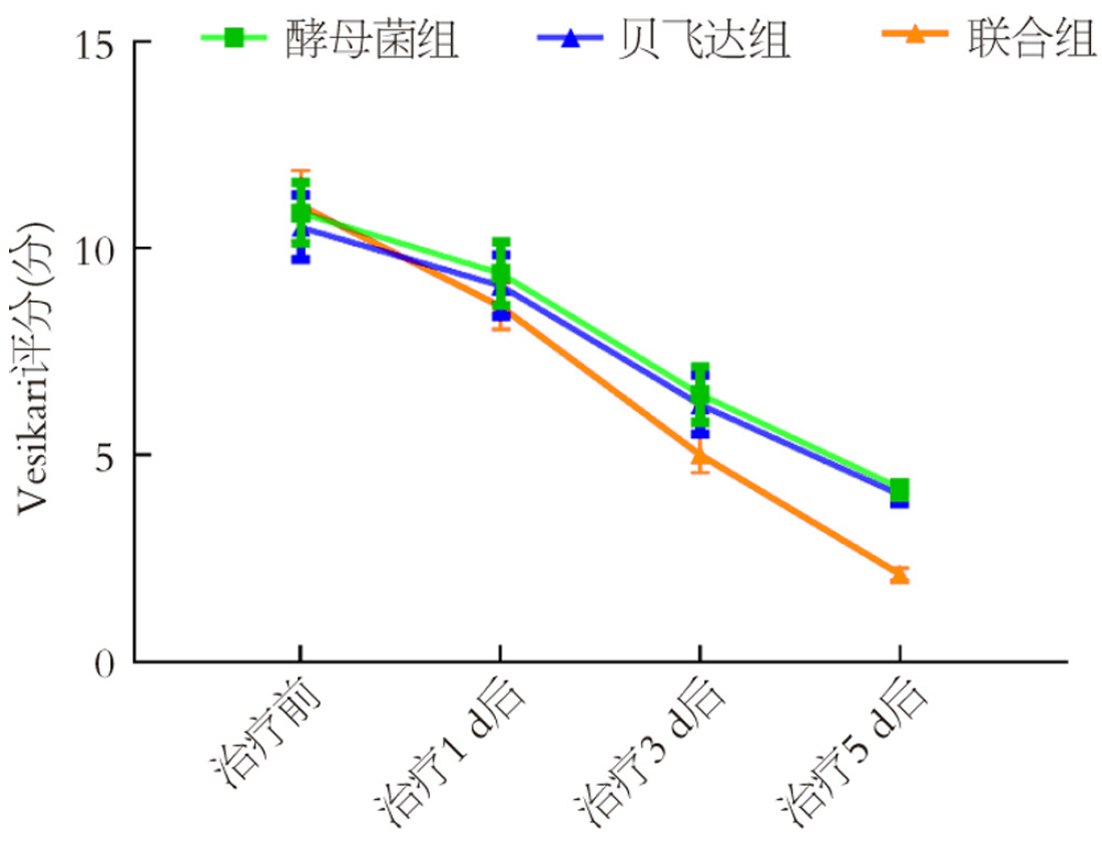
采用重复测量方差分析, 3组改良Vesikari评分时间×组间交互效应显著(P<0.05), 则进行简单效应分析; 组内分析: 3组治疗1 d、3 d、5 d后改良Vesikari评分均呈降低趋势(P<0.05); 组间分析; 联合组治疗1 d、3 d、5 d后改良Vesikari评分低于酵母菌组、贝飞达组(P<0.05), 酵母菌组和贝飞达组改良Vesikari评分比较差异无统计学意义(P>0.05). 见表5、图1.
| 组别 | 例数 | 治疗前 | 治疗1 d后 | 治疗3 d后 | 治疗5 d后 |
| 酵母菌组 | 50 | 10.86±2.59 | 9.39±2.70 | 6.47±2.36 | 4.20±0.75 |
| 贝飞达组 | 50 | 10.51±2.74 | 9.10±2.63 | 6.22±2.50 | 4.05±0.83 |
| 联合组 | 50 | 11.03±3.00 | 8.60±1.94 | 5.01±1.57 | 2.12±0.54 |
| F | F组间 = 15.694, F时间 = 80.302, F交互 = 37.414 | ||||
| P值 | P组间<0.001, P时间<0.001, P交互<0.001 | ||||
采用重复测量方差分析, 3组hs-CRP、WBC时间×组间交互效应显著(P<0.05), 则进行简单效应分析; 组内分析: 3组治疗5 d后hs-CRP、WBC均低于治疗前(P<0.05); 3组粪便病毒抗原转阴时间及治疗5 d后hs-CRP、WBC比较差异有统计学意义(P<0.05). 组间分析: 其中联合组粪便病毒抗原转阴时间及治疗5d后hs-CRP、WBC低于酵母菌组、贝飞达组(P<0.05); 酵母菌组和贝飞达组粪便病毒抗原转阴时间及治疗5 d后hs-CRP、WBC比较差异无统计学意义(P>0.05). 见表6.
| 组别 | 例数 | 粪便病毒抗原转阴时间(d) | hs-CRP(mg/L) | WBC(×109/L) | ||||||
| 治疗前 | 治疗5 d后 | t | P值 | 治疗前 | 治疗5 d后 | t | P值 | |||
| 酵母菌组 | 50 | 8.74±1.95a | 13.01±2.98 | 2.73±0.48a | 18.963 | <0.001 | 13.52±2.34 | 8.71±0.80a | 10.829 | <0.001 |
| 贝飞达组 | 50 | 8.48±2.00a | 12.95±3.07 | 2.69±0.50a | 18.366 | <0.001 | 13.47±2.59 | 8.66±0.75a | 9.932 | <0.001 |
| 联合组 | 50 | 6.02±1.77 | 13.25±2.68 | 1.81±0.47 | 23.410 | <0.001 | 13.70±2.68 | 7.59±0.84 | 12.113 | <0.001 |
| F | 30.903 | 0.148 | 57.835 | 0.113 | 31.468 | |||||
| P值 | <0.001 | 0.862 | <0.001 | 0.893 | <0.001 | |||||
3组患儿不良反应主要是口干, 未见其他不良反应, 其中联合组1例口干, 酵母菌组2例口干, 贝飞达组1例口干, 给予生活方式指导后缓解, 未影响治疗. 3组不良反应发生率比较差异无统计学意义(χ2 = 0.513, P = 0.773).
小儿病毒性肠炎多由粪-口传播, 发病初期常出现呕吐、发热, 随后出现水样大便, 可造成脱水、电解质紊乱等, 随病情发展甚至会影响患儿生长发育[11]. 临床治疗多使用退热、止泻药物治疗, 虽能缓解临床症状, 但止泻治疗可能导致病原体在肠道内无法排出, 且以上药物无法控制肠道内菌群, 同时可能破坏正常菌群[12,13]. 因此, 临床仍需不断探索其他安全有效的治疗方案.
临床发现, 益生菌是附植于肠道内的一种微生物, 其可发挥屏障作用, 保护肠道黏膜, 促进肠道蠕动, 维持正常排便[14,15]. 临床中常见益生菌包括双歧杆菌、酵母菌, 该类微生态制剂已广泛应用于腹泻治疗中. 既往已有多项研究提出[16,17], 布拉氏酵母菌与贝飞达在不同年龄段及不同类型的腹泻中均有良好效果. 但由于既往研究中多采用2组对照实验, 包含多种混杂因素, 且不同研究的结论不同, 临床对于不同微生态制剂的效果仍存在争议. 如方丹萍等[18]研究提出, 在治疗儿童腹泻伴发热中, 使用贝飞达在改善免疫功能, 缩短临床病程方面的效果优于布拉氏酵母菌. 张潇丹等[19]研究进行Meta分析, 布拉氏酵母菌在减少大便次数、缩短腹泻持续时间方面的效果优于贝飞达. 本研究基于PSM原则观察了布拉氏酵母菌与贝飞达单独及联合治疗病毒性肠炎的临床疗效, 结果显示, 使用两种微生态制剂联合治疗患儿总有效率显著高于单独治疗者, 且发热、呕吐、腹痛、腹泻缓解时间及改良Vesikari评分显著少于单独治疗者. 既往研究提出[20], 布拉氏酵母菌可在肠道内快速繁殖, 消耗氧并分解过氧化氢, 为肠道制造厌氧菌环境, 利于双歧杆菌及乳酸菌生产; 而贝飞达中含有双歧杆菌、嗜酸乳杆菌、粪球菌, 其均为肠道正常菌群, 可调节肠道菌群平衡, 拮抗性抑制肠道有害菌繁殖, 减少肠源性毒素产生, 从而减少肠道感染, 并增强肠黏膜防御能力[21]. 也有研究提出[20-22], 布拉氏酵母菌与双歧杆菌三联活菌均可通过竞争性抑制病原体定植、增强肠黏膜屏障, 且双歧杆菌三联活菌具有调节Th1/Th2免疫平衡、促进短链脂肪酸生成作用、提升肠道运转效率[23,24]. 分析认为, 两种药物联合治疗协同作用, 可能通过"菌群-免疫-屏障"轴帮助重建肠道天然屏障, 加速病毒清除, 从而促进临床症状改善, 提高治疗效果, 促进病情恢复. 本研究中两种微生态制剂单独使用的总有效率及临床症状缓解时间无明显差异, 与上述他人研究结果不同, 可能与患儿腹泻的病因不同、治疗疗程不同有关, 另外, 可能也与本研究进行PSM匹配, 平衡了不同治疗方案的协变量分布, 以排除混杂因素, 减少结果偏倚等因素有关.
另外, 本研究为进一步探究两种微生态制剂在抗炎及改善发热方面的效果, 统计了患儿治疗前后hs-CRP、WBC水平发现, 使用联合治疗方案的患儿治疗5 d后hs-CRP、WBC水平显著低于单独治疗患儿, 且粪便病毒抗原转阴时间短于单独治疗患儿, 表明贝飞达与布拉氏酵母菌在减轻机体炎症反应及加速病毒转阴方面具有显著优势. 赵林等[25]研究提出, 轮状病毒感染乳鼠增加布拉氏酵母菌治疗后血清炎症因子水平显著下降. 金小亮等[26]研究也提出, 贝飞达可显著降低血清内毒素、肿瘤坏死因子等水平. 既往研究表明[27-29], 贝飞达与布拉氏酵母菌在肠道机械屏障、免疫屏障、微生物屏障方面均具有积极作用, 如双歧杆菌可与人体免疫细胞相互作用, 调节适应性及先天性免疫特定信号通路; 乳酸杆菌可增强巨噬细胞对大肠杆菌、金黄色葡萄球菌等有害菌的吞噬作用及杀伤作用; 布拉氏酵母菌可通过提高免疫球蛋白水平, 增强肠道抗感染能力. 本研究中将贝飞达与布拉氏酵母菌联合使用可能达到了协同增效作用, 从而显著降低机体炎症因子, 抑制炎症反应, 提高肠道免疫能力, 进而抑制病毒增殖、繁衍, 加速其转阴. 在安全性方面, 本研究中3组患儿均表现为口干, 无其他不良反应事件, 考虑口干可能与腹泻导致脱水有关, 经临床护理措施干预后显著缓解, 表明两种微生物制剂均具有良好安全性.
综上所述, 使用贝飞达联合布拉氏酵母菌治疗病毒性肠炎具有显著效果, 可降低机体炎症因子水平, 加速临床症状缓解及病毒转阴进程, 促进病情恢复. 另外, 本研究采用PSM对3组不均衡资料进行匹配, 以平衡不同治疗方案的协变量分布, 平衡组间混杂因素, 减少选择偏倚, 为临床联合使用微生态制剂治疗小儿病毒性肠炎提供了有益的循证依据. 由此我们建议在临床上治疗病毒性肠炎时, 除合理饮食干预外, 还要从腹泻的发展机制及调节肠道菌群方面出发, 应用微生态制剂联合治疗, 以提高治疗效果, 缩短病程, 减少患儿痛苦. 但本研究也存在不足之处, 由于此为回顾性研究, 临床资料有限, 尽管采用PSM平衡了患儿的基线资料, 控制选择偏倚及混杂因素, 但由于该方法只能平衡已知的因素, 部分效果评价指标无法进行评价, 因此对于未记录的混杂因素的影响仍存在, 如患儿免疫指标、肠道微生态变化等, 这些指标是深入理解治疗具体作用机制的关键因素, 未来还需开展前瞻性研究, 整合肠道菌群测序、代谢组学及多重免疫指标, 深入揭示两种微生态制剂联合治疗的调控机制.
贝飞达与布拉氏酵母菌可调节肠道菌群平衡, 提高病原菌清除率. 但部分患儿仍达不到临床理想效果可能因单独用药在扭转厌氧菌与需氧菌动态失衡的作用效果较弱. 因此, 临床考虑将两种药物联合治疗以满足厌氧菌与需氧菌的动态平衡.
临床考虑将两种药物联合治疗以满足厌氧菌与需氧菌的动态平衡. 由于既往研究多为两组对照分析, 且回顾性研究中也存在难以控制的混杂因素, 无法分离不同微生态制剂的真实贡献.
基于倾向性评分匹配(propensity score matching, PSM)原则分析布拉氏酵母菌与贝飞达单独及联合治疗病毒性肠炎的临床疗效.
选取绍兴市上虞妇幼保健院收治的240例病毒性肠炎患儿, 根据治疗方案分为酵母菌组、贝飞达组、联合组. 根据治疗前资料进行1:1:1 PSM, 卡钳值为0.1, 以联合组50例作为匹配基准, 而另外两组样本经筛选, 最终各匹配出50例, 以确保匹配后三组基线特征具有最佳可比性. 比较两3组疗效、临床症状缓解时间、改良Vesikari评分、粪便病毒抗原转阴时间及血炎症因子、超敏C反应蛋白、不良反应.
联合组总有效率显著高于酵母菌组、贝飞达组; 联合组发热、呕吐、腹痛、腹泻缓解时间早于酵母菌组、贝飞达组; 联合组治疗改良Vesikari评分低于酵母菌组、贝飞达组; 联合组粪便病毒抗原转阴时间及治疗5 d后白细胞计数(white blood cell count, WBC)、超敏C反应蛋白(high-sensitivity C-reactive protein, hs-CRP)低于酵母菌组、贝飞达组; 酵母菌组和贝飞达组发热、呕吐、腹痛、腹泻缓解时间比较, 以及总有效率、改良Vesikari评分、粪便病毒抗原转阴时间、治疗后hs-CRP、WBC比较差异无统计学意义. 3组不良反应发生率比较差异无统计学意义.
贝飞达联合布拉氏酵母菌治疗病毒性肠炎具有显著效果, 可降低机体炎症因子水平, 加速临床症状缓解及病毒转阴进程, 促进病情恢复.
对于未记录的混杂因素的影响仍存在, 如患儿免疫指标、肠道微生态变化等, 这些指标是深入理解治疗具体作用机制的关键因素, 未来还需开展前瞻性研究, 整合肠道菌群测序、代谢组学及多重免疫指标, 深入揭示两种微生态制剂联合治疗的调控机制.
| 1. | Gopalan S, Ganapathy S, Mitra M, Neha, Kumar Joshi D, Veligandla KC, Rathod R, Kotak BP. Unique Properties of Yeast Probiotic Saccharomyces boulardii CNCM I-745: A Narrative Review. Cureus. 2023;15:e46314. [PubMed] [DOI] |
| 2. | Bustos Fernández LM, Man F, Lasa JS. Impact of Saccharomyces boulardii CNCM I-745 on Bacterial Overgrowth and Composition of Intestinal Microbiota in Diarrhea-Predominant Irritable Bowel Syndrome Patients: Results of a Randomized Pilot Study. Dig Dis. 2023;41:798-809. [PubMed] [DOI] |
| 6. | 陶 琳, 梁 军, 冯 绪强, 王 克强, 万 晓莉. 醒脾养儿颗粒联合布拉氏酵母菌散对轮状病毒肠炎患儿肠道微生态及炎症免疫反应的影响. 现代生物医学进展. 2024;24:1787-1791. [DOI] |
| 7. | 牟 丽莉, 张 潇丹, 刘 璐, 陈 春红, 陈 卓, 尹 慧, 闫 美兴. 布拉氏酵母菌治疗儿童腹泻的有效性和安全性分析. 中国临床药理学杂志. 2024;40:2575-2579. [DOI] |
| 10. | Freedman SB, Eltorky M, Gorelick M; Pediatric Emergency Research Canada Gastroenteritis Study Group. Evaluation of a gastroenteritis severity score for use in outpatient settings. Pediatrics. 2010;125:e1278-e1285. [PubMed] [DOI] |
| 12. | Wei Q, Song LY, Rao R, Yang HW, Wen YP, Lv L, Wang L. The Impact of Combined Therapy with Lactobacillus acidophilus and Montmorillonite Powder on the Inflammatory Response in Pediatric Rotavirus Enteritis. Int Arch Allergy Immunol. 2025;186:689-695. [PubMed] [DOI] |
| 13. | Omatola CA, Olaniran AO. Rotaviruses: From Pathogenesis to Disease Control-A Critical Review. Viruses. 2022;14:875. [PubMed] [DOI] |
| 14. | Carías Domínguez AM, de Jesús Rosa Salazar D, Stefanolo JP, Cruz Serrano MC, Casas IC, Zuluaga Peña JR. Intestinal Dysbiosis: Exploring Definition, Associated Symptoms, and Perspectives for a Comprehensive Understanding - a Scoping Review. Probiotics Antimicrob Proteins. 2025;17:440-449. [PubMed] [DOI] |
| 15. | Wampers A, Huysentruyt K, Vandenplas Y. An update on the use of 'biotics' in pediatric infectious gastroenteritis. Expert Opin Pharmacother. 2024;25:1483-1496. [PubMed] [DOI] |
| 16. | Ortiz-Lopez CI, Camacho-Ortiz A. High-Dose Probiotic Mix of Lactobacillus Spp, Bifidobacterium Spp, Bacillus coagulans, and Saccharomyces boulardii to Prevent Antibiotic-Associated Diarrhea in Adults: A Multicenter, Randomized, Double-Blind, Placebo-Controlled Trial (SPAADA). Open Forum Infect Dis. 2025;12:ofaf316. [PubMed] [DOI] |
| 17. | Hodzhev V, Dzhambazov K, Sapundziev N, Encheva M, Todorov S, Youroukova V, Benchev R, Nikolov R, Bogov B, Momekov G, Hadjiev V. High-dose Probiotic Mix of Lactobacillus spp., Bifidobacterium spp., Bacillus coagulans, and Saccharomyces boulardii to Prevent Antibiotic-associated Diarrhea in Adults: A Multicenter, Randomized, Double-blind, Placebo-controlled Trial (SPAADA). Open Forum Infect Dis. 2024;11:ofae615. [PubMed] [DOI] |
| 20. | Waitzberg D, Guarner F, Hojsak I, Ianiro G, Polk DB, Sokol H. Can the Evidence-Based Use of Probiotics (Notably Saccharomyces boulardii CNCM I-745 and Lactobacillus rhamnosus GG) Mitigate the Clinical Effects of Antibiotic-Associated Dysbiosis? Adv Ther. 2024;41:901-914. [PubMed] [DOI] |
| 21. | Banoth D, Wali MH, Bekova K, Abdulla N, Gurugubelli S, Lin YM, Khan S. The Role of Oral Probiotics in Alleviating Inflammation, Symptom Relief, and Postoperative Recurrence and Their Side Effects in Adults With Crohn's Disease: A Systematic Review. Cureus. 2023;15:e50901. [PubMed] [DOI] |
| 25. | 赵 林, 徐 沙沙, 郭 伟胜, 刘 鹏, 席 作武. 益生菌结合蒙脱石散对轮状病毒感染乳鼠肠道黏膜、肠道微生物功能相关基因表达的影响. 中国临床药理学杂志. 2024;40:1903-1907. [DOI] |
| 27. | Pantazi AC, Mihai CM, Lupu A, Balasa AL, Chisnoiu T, Mihai L, Frecus CE, Ungureanu A, Chirila SI, Nori W, Lupu VV, Stoicescu RM, Baciu G, Cambrea SC. Gut Microbiota Profile and Functional Gastrointestinal Disorders in Infants: A Longitudinal Study. Nutrients. 2025;17:701. [PubMed] [DOI] |
| 28. | Altcheh J, Carosella MV, Ceballos A, D'Andrea U, Jofre SM, Marotta C, Mugeri D, Sabbaj L, Soto A, Josse C, Montestruc F, McFarland LV. Randomized, direct comparison study of Saccharomyces boulardii CNCM I-745 versus multi-strained Bacillus clausii probiotics for the treatment of pediatric acute gastroenteritis. Medicine (Baltimore). 2022;101:e30500. [PubMed] [DOI] |
| 29. | Salazar-Parra MA, Cruz-Neri RU, Trujillo-Trujillo XA, Dominguez-Mora JJ, Cruz-Neri HI, Guzmán-Díaz JM, Guzmán-Ruvalcaba MJ, Vega-Gastelum JO, Ascencio-Díaz KV, Zarate-Casas MF, González-Ponce FY, Barbosa-Camacho FJ, Fuentes-Orozco C, Cervantes-Guevara G, Cervantes-Pérez E, Cervantes-Cardona GA, Cortés-Flores AO, González-Ojeda A. Effectiveness of Saccharomyces Boulardii CNCM I-745 probiotic in acute inflammatory viral diarrhoea in adults: results from a single-centre randomized trial. BMC Gastroenterol. 2023;23:229. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D, D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁