修回日期: 2025-10-05
接受日期: 2025-10-20
在线出版日期: 2025-10-28
幽门螺杆菌(Helicobacter pylori, H. pylori)分泌空泡毒素等, 可引起胃酸分泌增加、胃黏膜屏障损伤及炎症反应, 故合并早期胃癌(early gastric cancer, EGC)感染可致使胃黏膜病变风险及内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)术后复发风险持续增加.
分析H. pylori感染的EGC患者ESD术后胃癌复发的影响因素, 并构建列线图预测模型.
选取2019-10/2021-10绍兴市上虞人民医院行ESD治疗的H. pylori感染EGC患者158例, 根据术后随访3年是否复发分为复发组和未复发组. 比较两组一般资料及肿瘤相关资料, Lasso-Logistic回归分析术后复发的影响因素, 构建术后复发的列线图预测模型, 并采用受试者工作特征曲线、校准曲线、决策曲线、一致性分析对该模型进行内、外部验证.
复发组肿瘤直径≥2 cm占比、分化程度为中低分化占比、病灶数目多发占比、浸润深度黏膜下层占比、Ki-67阳性≥50%占比、H. pylori转阴失败占比、术前血清糖类抗原724(carbohydrate antigen 724, CA724)、转化生长因子β诱导蛋白(transforming growth factor beta induced protein, TGFBI)、胃泌素17(gastrin-17, G-17)、外周血中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio, NLR)水平均高于未复发组, R0切除占比低于未复发组(P<0.05); Lasso-Logistic回归分析显示, 分化程度为中低分化、Ki-67阳性≥50%、H. pylori转阴失败、CA724、NLR、TGFBI、G-17均为ESD术后复发的独立危险因素(P<0.05); 基于Lasso-Logistic回归分析结果构建列线图模型, 该模型预测ESD术后复发的曲线下面积(area under curve, AUC)为0.887, 高于美国癌症联合委员会第8版分期系统预测AUC值0.812(Z = 2.014, P = 0.036<0.05), 该模型预测值和实际值的相关性大小Dxy值为0.774, 当阈概率为5%-98%时模型的获益性较高, 且列线图模型预测结果与临床实际结果的Kappa值为0.628.
分化程度为中低分化、Ki-67阳性≥50%、H. pylori转阴失败、CA724、NLR、TGFBI、G-17均是H. pylori感染EGC患者ESD术后复发的独立危险因素, 基于上述指标构建列线图模型, 具有良好预测价值及临床效用, 可作为临床预测术后复发的有效模型, 并可指导临床防治.
核心提要: 既往关于早期胃癌(early gastric cancer, EGC)患者内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)术后复发风险的研究多为影响因素分析, 有关模型构建的风险预测研究尚不多见. 因此, 本研究尝试性分析幽门螺杆菌感染EGC患者ESD术后复发影响因素, 并构建诺莫图预测模型, 以期为临床防治工作提供参考.
引文著录: 于芳芳, 吴世民, 张丽娅, 陈坚强, 项利娟. 幽门螺杆菌感染的早期胃癌患者ESD术后胃癌复发的列线图预测模型构建及验证. 世界华人消化杂志 2025; 33(10): 781-790
Revised: October 5, 2025
Accepted: October 20, 2025
Published online: October 28, 2025
Helicobacter pylori (H. pylori) secretes vacuollicle toxins and other virulence factors, which can cause increased gastric acid secretion, damage to gastric mucosal barrier, and inflammatory reactions. This pathogenic process, when combined with early gastric cancer (EGC), can lead to a continuous increase in the risk of gastric mucosal lesions.
To analyze the influencing factors of gastric cancer recurrence in H. pylori-positive patients with EGC after endoscopic submucosal dissection (ESD), and to construct a nomogram model for recurrence prediction.
A total of 158 H. pylori-positive EGC patients who underwent ESD treatment at Shangyu People's Hospital of Shaoxing from October 2019 to October 2021 were selected. The patients were categorized into a recurrence group and a non-recurrence group based on whether they had a recurrence during the 3-year follow-up period after surgery. The general information and tumor-related data of the two groups were compared, Lasso-Logistic regression analysis was used to identify the factors affecting postoperative recurrence, and a nomogram prediction model for postoperative recurrence was constructed. Receiver operating characteristic curve, calibration curve, decision curve, and consistency analyses were performed to verify the model internally and externally.
The proportions of tumors with a diameter of ≥ 2 cm, moderate to low differentiation, multiple lesions, submucosal invasion, Ki-67 index of ≥ 50%, and failed H. pylori eradication, as well as the preoperative serum levels of carbohydrate antigen 724 (CA724), transforming growth factor beta induced protein (TGFBI), gastrin-17 (G-17), and peripheral blood neutrophil-to-lymphocyte ratio (NLR) in the recurrence group were higher than those in the non-recurrence group, while the proportion of R0 resection was lower than that in the non-recurrence group (P < 0.05). Lasso-Logistic regression analysis showed that moderate to low differentiation, Ki-67 index ≥ 50%, failed H. pylori eradication, CA724, NLR, TGFBI, and G-17 were all independent risk factors for recurrence after ESD surgery (P < 0.05). Based on the results of Lasso-Logistic regression analysis, a nomogram model was constructed. The area under the curve (AUC) of the model for predicting recurrence after ESD was 0.887, which was higher than the AUC value of 0.812 achieved by the American Joint Committee on Cancer 8th edition staging system (Z = 2.014, P = 0.036 < 0.05). The correlation between the predicted value and actual value of the model was 0.774, and the benefit of the model was higher when the threshold probability was 5%-98%. The Kappa value between the predicted results of the nomogram model and the clinical actual results was 0.628.
Moderate to low differentiation, Ki-67 index ≥ 50%, failed eradiction of H. pylori, CA724, NLR, TGFBI, and G-17 are all independent risk factors for recurrence after ESD in H. pylori-positive patients with EGC. Based on these indicators, a nomogram model has been constructed with good predictive value and clinical utility, and can be used as an effective model for predicting postoperative recurrence and guiding clinical prevention and treatment.
- Citation: Yu FF, Wu SM, Zhang LY, Chen JQ, Xiang LJ. Construction and validation of a predictive nomogram for recurrence after endoscopic submucosal dissection in Helicobacter pylori-positive patients with early gastric cancer. Shijie Huaren Xiaohua Zazhi 2025; 33(10): 781-790
- URL: https://www.wjgnet.com/1009-3079/full/v33/i10/781.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i10.781
胃癌是临床高发恶性肿瘤, 具有起病隐匿、病情进展快、致死率高等特征[1]. 对于早期胃癌(early gastric cancer, EGC)且未发现转移证据者, 内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)是其主要干预方式之一, 多数患者术后可实现治愈, 但仍有部分患者可出现ESD术后复发[2,3]. 幽门螺杆菌(Helicobacter pylori, H. pylori)分泌空泡毒素等, 可引起胃酸分泌增加、胃黏膜屏障损伤及炎症反应, 故合并H. pylori感染可致使胃黏膜病变风险及ESD术后复发风险持续增加[4,5]. 因此, 早期识别H. pylori感染EGC患者ESD术后复发风险因素, 预测术后复发情况, 以指导临床采取针对性防控措施, 降低临床复发率, 已成为当前临床亟待解决的难题. 近年来, 多项研究指出, 体质量指数(body mass index, BMI)较大、年龄、胃泌素17(gastrin-17, G-17)异常表达等因素可能与EGC患者ESD术后复发独立相关[6,7]. 但既往关于EGC患者ESD术后复发风险的研究多为影响因素分析, 有关模型构建的风险预测研究尚不多见. 因此, 本研究尝试性分析H. pylori感染EGC患者ESD术后复发影响因素, 并构建诺莫图预测模型, 以期为临床防治工作提供参考.
选取2019-10/2021-10绍兴市上虞人民医院行ESD治疗的H. pylori感染EGC患者158例, 根据术后随访3年是否复发分为复发组和未复发组. 纳入标准: (1)均经临床病理检测确诊为EGC, 并接受ESD治疗; (2)首次确诊, 此前未接受相关抗肿瘤治疗; (3)病灶局限于胃黏膜层或黏膜下层; (4)对本研究方案风险及获益知情且同意. 排除标准: (1)伴精神、心理疾病史, 难以配合相关方案; (2)存在语言交流障碍; (3)合并其他恶性病变; (4)合并严重感染性疾病; (5)合并免疫、循环系统病变; (6)合并重要脏器功能不全; (7)伴淋巴结转移或远处转移. 排除标准: (1)突发其他重大疾病、随访期间失联或意外死亡; (2)自行退出研究者. 本研究经医院医学伦理委员会批准.
1.2.1 资料收集: 于知网、万方、PubMed等在线数据库, 以"HP感染"、"EGC"、"ESD"、"复发"、"风险因素"等为关键词查阅EGC患者ESD术后复发相关文献, 并结合病情等确定可能影响因素. 由两名研究组成员成立信息采集小组, 以病历收集、追踪辅助检查结果为主要形式, 采集患者下列一般临床资料及肿瘤相关信息: 性别、年龄、BMI、吸烟史、饮酒史、高血压、糖尿病、高脂血症、家族肿瘤史、组织类型(腺癌、其他)、肿瘤部位(胃体、胃窦、贲门胃底)、肿瘤直径(<2 cm、≥2 cm)、内镜下分型(凹陷型、平坦型、隆起型)、分化程度(中低分化、高分化)、病灶数目(多发、单发)、浸润深度(黏膜层、黏膜下层)、T分期(T1a、T1b)、Ki-67阳性(<50%、≥50%)、H. pylori转阴失败、R0切除、手术时间、术后溃疡治疗、术后化疗、糖类抗原-125(carbohydrate antigen 125, CA125)、癌胚抗原(carcinoembryonic antigen, CEA)、糖类抗原19-9(carbohydrate antigen 19-9, CA19-9)、糖类抗原724(carbohydrate antigen 724, CA724)、中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio, NLR)、转化生长因子β诱导蛋白(transforming growth factor beta induced protein, TGFBI)、G-17.
1.2.2 随访: 所有患者于ESD术后第1 d起, 以门诊复查为主要形式, 均接受为期3年随访, 第1年复查, 每3 mo 1次, 之后每6 mo 1次, 以出现胃癌复发或到达随访截止时间为终点事件.
1.2.3 复发评估标准: 患者门诊回访时接受胃镜检查, 对疑似病变患者行病理组织活检, 并根据是否发现癌细胞将患者判定为复发、未复发[8].
1.2.4 质量控制: (1)信息采集小组成员需经统一、专业培训及考核; (2)数据录入及核对需采用双人形式, 以保障数据与结果的真实性、可靠性及一致性; (3)检查结果判读均由5年以上临床经验医师, 以双盲形式进行判读, 对有争议病例, 需协商后给出一致结果.
(1)比较两组一般资料及肿瘤相关资料; (2)分析ESD术后复发的影响因素; (3)构建ESD术后复发的列线图预测模型, 并进行内、外部验证.
统计学方法 应用SPSS 27.0统计学软件进行数据分析. 计数资料以n(%)表示, 行χ2检验; 计量资料近似服从正态分布时以(mean±SD)表示, 行t检验; Lasso回归分析筛选变量, Logistic回归分析影响因素; 构建列线图预测模型, 采用受试者工作特征(receiver operating characteristic, ROC)曲线、校准曲线、决策曲线验证该模型预测效能; 通过Kappa检验分析一致性. 以P<0.05为差异有统计学意义. 检验水准α = 0.05.
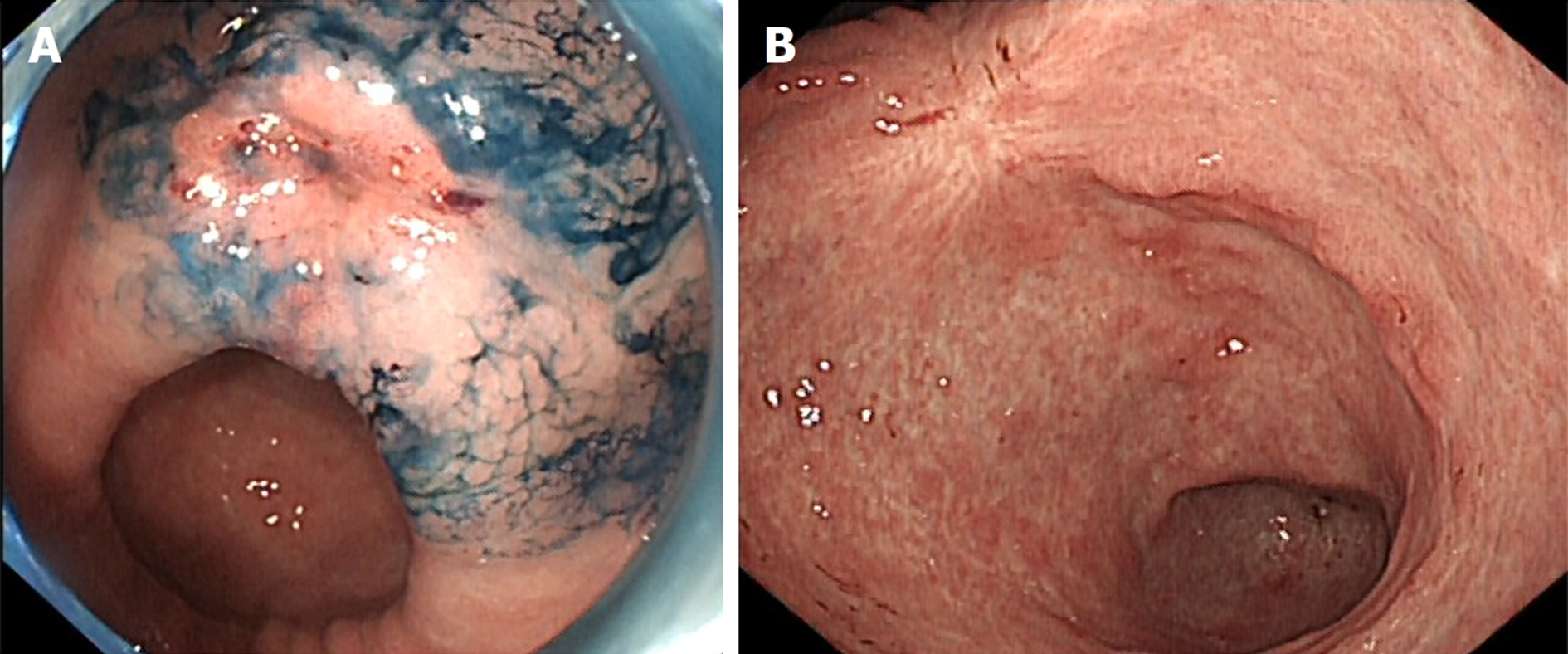
本研究共纳入行ESD治疗的H. pylori感染EGC患者158例, 术后随访期间失访8例, 最终有150例患者完成术后3年随访, 其中复发患者41例, 纳入复发组, 未复发患者109例, 纳入未复发组. 复发组和未复发组性别、年龄、BMI、吸烟史、饮酒史、高血压、糖尿病、高脂血症比较, 差异无统计学意义(P>0.05). 见表1. ESD术前及术后复发的内镜图片见图1.
| 项目 | 复发组(n = 41) | 未复发组(n = 109) | t/χ2 | P值 |
| 性别 | 0.928 | 0.335 | ||
| 男 | 24(58.54) | 73(66.97) | ||
| 女 | 17(41.46) | 36(33.03) | ||
| 年龄(岁) | 57.13±7.29 | 55.84±6.88 | 1.007 | 0.316 |
| BMI(kg/m2) | 22.86±1.71 | 23.15±1.80 | -0.891 | 0.374 |
| 吸烟史 | 0.494 | 0.482 | ||
| 有 | 18(43.90) | 41(37.61) | ||
| 无 | 23(56.10) | 68(62.39) | ||
| 饮酒史 | 0.723 | 0.395 | ||
| 有 | 15(36.59) | 32(29.36) | ||
| 无 | 26(63.41) | 77(70.64) | ||
| 高血压 | 14(34.15) | 28(25.69) | 1.057 | 0.304 |
| 糖尿病 | 10(24.39) | 22(75.61) | 0.314 | 0.575 |
| 高脂血症 | 6(14.63) | 10(9.17) | 0.447 | 0.504 |
复发组和未复发组家族肿瘤史、组织类型、肿瘤部位、内镜下分型、T分期、手术时间、术后溃疡治疗、术后化疗、术前血清CA125、CEA、CA19-9水平比较, 差异无统计学意义(P>0.05); 复发组肿瘤直径≥2 cm占比、分化程度为中低分化占比、病灶数目多发占比、浸润深度黏膜下层占比、Ki-67阳性≥50%占比、H. pylori转阴失败占比、术前血清CA724、TGFBI、G-17、外周血NLR水平高于未复发组, R0切除占比低于未复发组, 差异有统计学意义(P<0.05). 见表2.
| 项目 | 复发组(n = 41) | 未复发组(n = 109) | t/χ2 | P值 |
| 家族肿瘤史 | 0.840 | 0.359 | ||
| 有 | 9(21.95) | 17(15.60) | ||
| 无 | 32(78.05) | 92(84.40) | ||
| 组织类型 | 1.134 | 0.287 | ||
| 腺癌 | 32(78.05) | 93(85.32) | ||
| 其他 | 9(21.95) | 16(14.68) | ||
| 肿瘤部位 | 2.055 | 0.358 | ||
| 胃体 | 19(46.34) | 54(49.54) | ||
| 胃窦 | 12(29.27) | 39(35.78) | ||
| 贲门胃底 | 10(24.39) | 16(14.68) | ||
| 肿瘤直径 | 4.650 | 0.031 | ||
| ≥2 cm | 21(51.22) | 35(32.11) | ||
| <2 cm | 20(48.78) | 74(67.89) | ||
| 内镜下分型 | 0.387 | 0.824 | ||
| 凹陷型 | 21(51.22) | 62(56.88) | ||
| 平坦型 | 11(26.83) | 26(23.85) | ||
| 隆起型 | 9(21.95) | 21(19.27) | ||
| 分化程度 | 9.891 | 0.002 | ||
| 中低分化 | 23(56.10) | 31(28.44) | ||
| 高分化 | 18(43.90) | 78(71.56) | ||
| 病灶数目 | 5.352 | 0.021 | ||
| 多发 | 8(19.51) | 6(5.50) | ||
| 单发 | 33(80.49) | 103(94.50) | ||
| 浸润深度 | 6.359 | 0.012 | ||
| 黏膜层 | 15(36.59) | 65(59.63) | ||
| 黏膜下层 | 26(63.41) | 44(40.37) | ||
| T分期 | 1.730 | 0.188 | ||
| T1a | 26(63.41) | 81(74.31) | ||
| T1b | 15(36.59) | 28(25.69) | ||
| Ki-67阳性 | 12.391 | <0.001 | ||
| ≥50% | 29(70.73) | 42(38.53) | ||
| <50% | 12(29.27) | 67(61.47) | ||
| H. pylori转阴失败 | 12(29.27) | 11(10.09) | 8.439 | 0.004 |
| R0切除 | 27(65.85) | 91(83.49) | 5.520 | 0.019 |
| 手术时间(min) | 80.63±10.59 | 78.21±11.34 | 1.185 | 0.238 |
| 术后溃疡治疗 | 41(100.00) | 109(100.00) | 0.000 | 1.000 |
| 术后化疗 | 5(12.20) | 8(7.34) | 0.380 | 0.538 |
| CA125(kU/mL) | 65.13±6.94 | 62.98±7.15 | 1.654 | 0.100 |
| CEA(μg/L) | 16.08±3.26 | 15.41±3.08 | 1.169 | 0.244 |
| CA19-9(kU/mL) | 24.57±4.18 | 23.36±3.92 | 1.654 | 0.100 |
| CA724(U/mL) | 21.47±3.85 | 17.63±2.94 | 6.524 | <0.001 |
| NLR | 2.71±0.73 | 1.84±0.51 | 8.219 | <0.001 |
| TGFBI(ng/mL) | 25.37±5.42 | 17.89±4.16 | 9.003 | <0.001 |
| G-17(μg/L) | 24.85±5.19 | 16.78±4.52 | 9.351 | <0.001 |
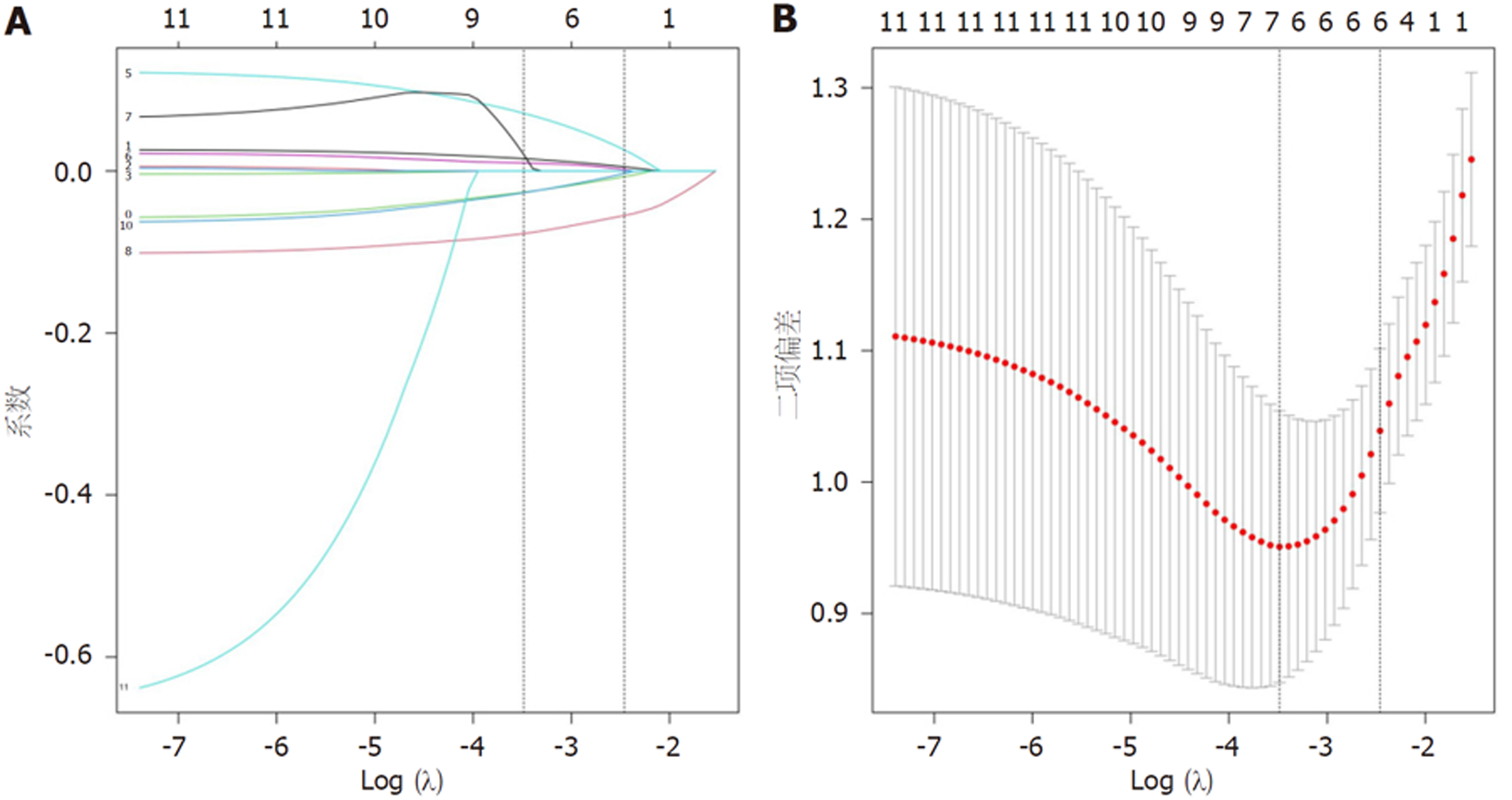
将H. pylori感染EGC患者ESD术后复发为因变量, 将表1中差异有统计学意义的11个指标: 肿瘤直径≥2 cm、分化程度为中低分化、病灶数目多发、浸润深度黏膜下层、Ki-67阳性≥50%、H. pylori转阴失败、R0切除、术前血清CA724、TGFBI、G-17、外周血NLR纳入Lasso分析, 结果显示, 当惩罚系数λ = 0.023时可使模型性能最优化, 最终筛查出7个影响因素: 分化程度为中低分化、Ki-67阳性≥50%、H. pylori转阴失败、CA724、NLR、TGFBI、G-17. 见图2.
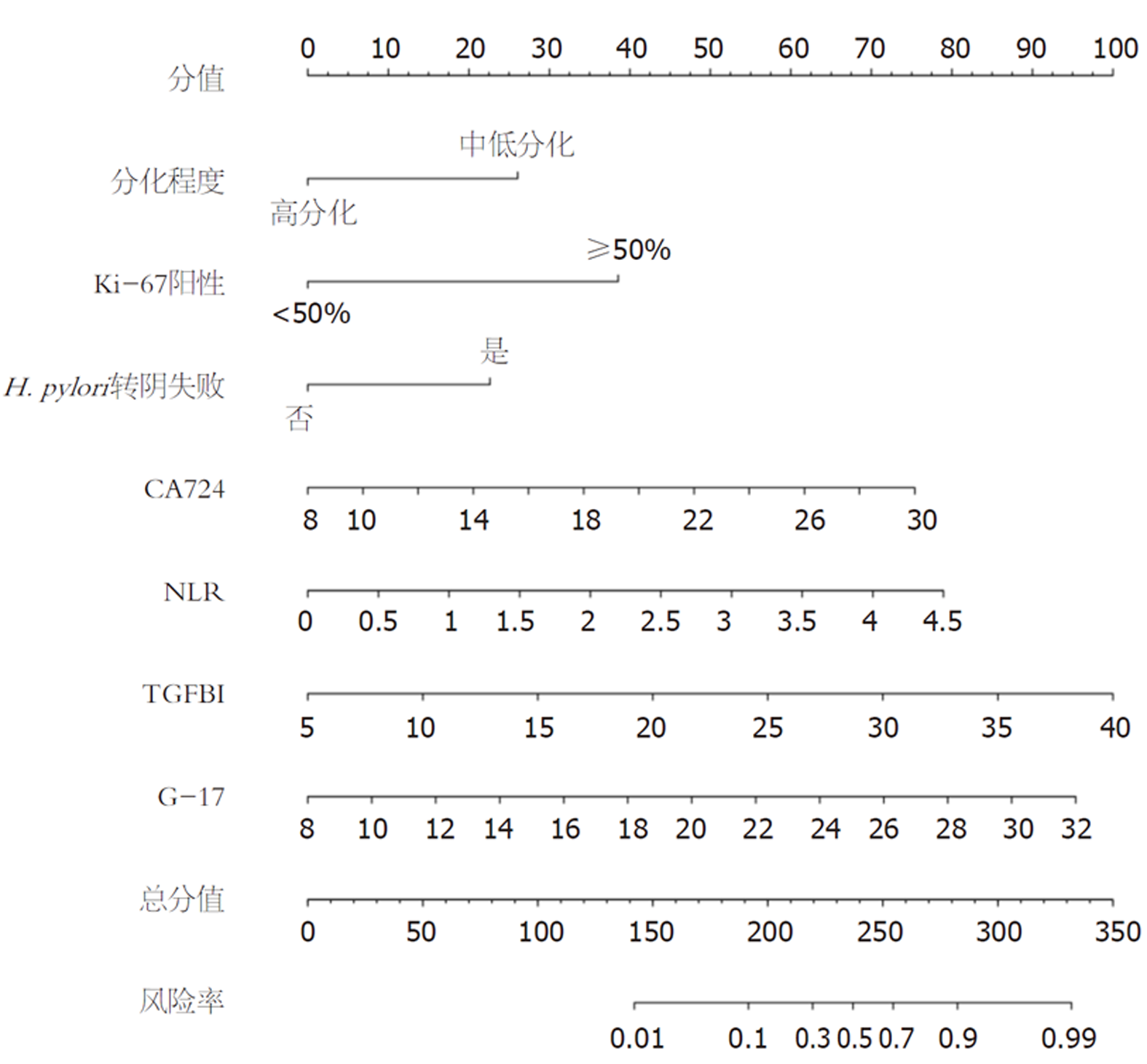
H. pylori感染EGC患者ESD术后复发为因变量(赋值: 未复发 = 0, 复发 = 1), Lasso分析筛查出的影响因素: 分化程度为中低分化、Ki-67阳性≥50%、H. pylori转阴失败、CA724、NLR、TGFBI、G-17作为自变量, 多重共线性诊断显示, 各自变量间不存在共线性(均VIF<10). Logistic回归分析显示, 分化程度为中低分化、Ki-67阳性≥50%、H. pylori转阴失败、CA724、NLR、TGFBI、G-17均为H. pylori感染EGC患者ESD术后复发的独立危险因素(P<0.05). 见表3.
| 变量 | 赋值 | β | SE | Wald χ2 | OR | 95%CI | P值 | |
| 下限 | 上限 | |||||||
| 分化程度为中低分化 | 否 = 0, 是 = 1 | 0.564 | 0.190 | 8.823 | 1.758 | 1.135 | 2.724 | <0.001 |
| Ki-67阳性≥50% | 否 = 0, 是 = 1 | 0.702 | 0.208 | 11.377 | 2.017 | 1.289 | 3.156 | <0.001 |
| H. pylori转阴失败 | 否 = 0, 是 = 1 | 0.449 | 0.165 | 7.393 | 1.566 | 1.096 | 2.238 | 0.001 |
| CA724 | 原值代入 | 0.230 | 0.098 | 5.510 | 1.259 | 1.118 | 1.417 | 0.016 |
| NLR | 原值代入 | 0.383 | 0.142 | 7.276 | 1.467 | 1.264 | 1.702 | 0.003 |
| TGFBI | 原值代入 | 0.261 | 0.091 | 8.249 | 1.299 | 1.135 | 1.486 | <0.001 |
| G-17 | 原值代入 | 0.273 | 0.093 | 8.607 | 1.314 | 1.149 | 1.502 | <0.001 |
将H. pylori感染EGC患者ESD术后复发作为目标事件, Lasso、Logistic回归筛查出的7个影响因素: 分化程度为中低分化、Ki-67阳性≥50%、H. pylori转阴失败、CA724、NLR、TGFBI、G-17作为预测指标, 构建术后复发的列线图预测模型. 见图3.
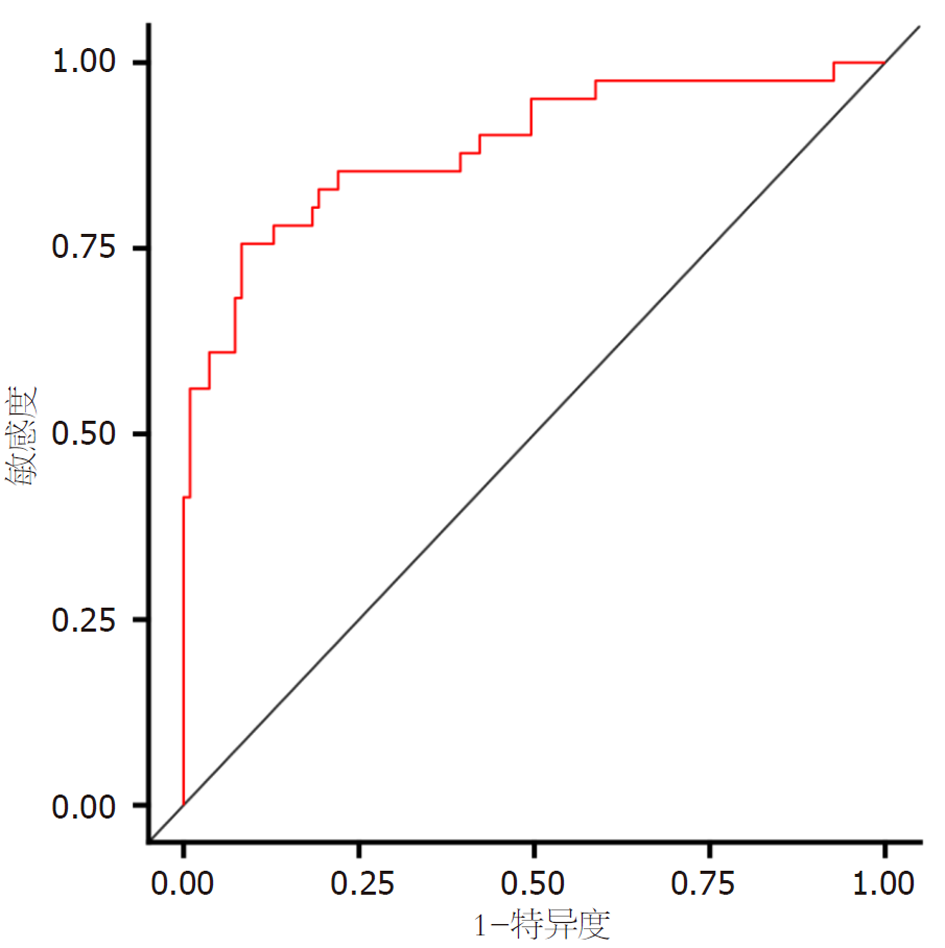
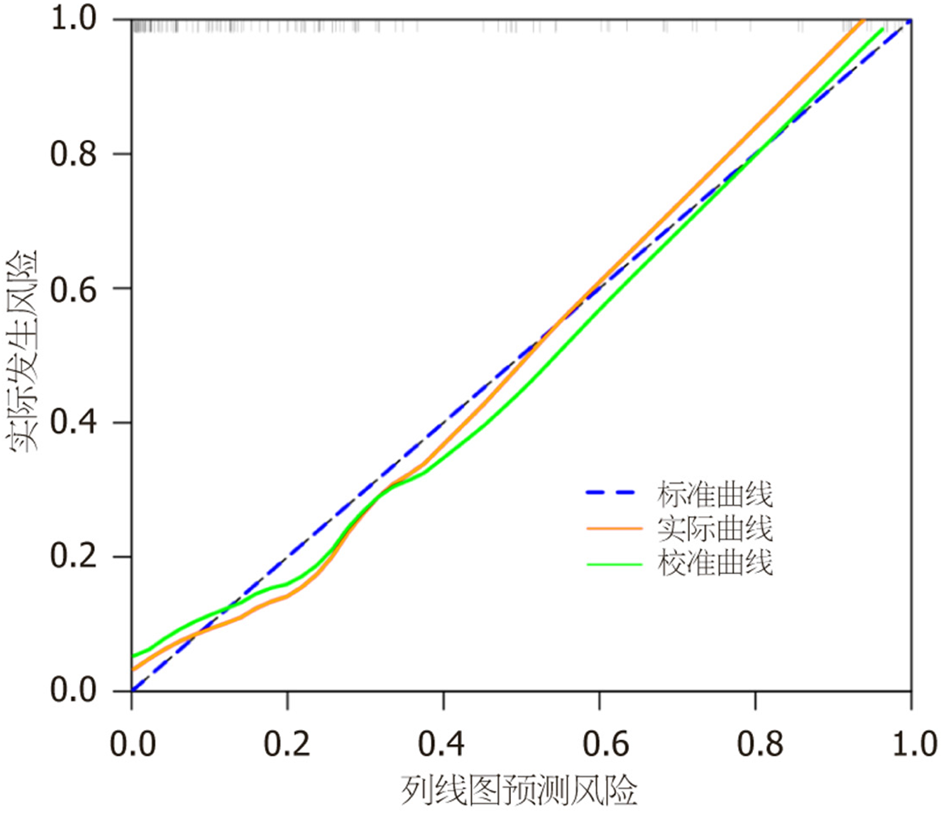
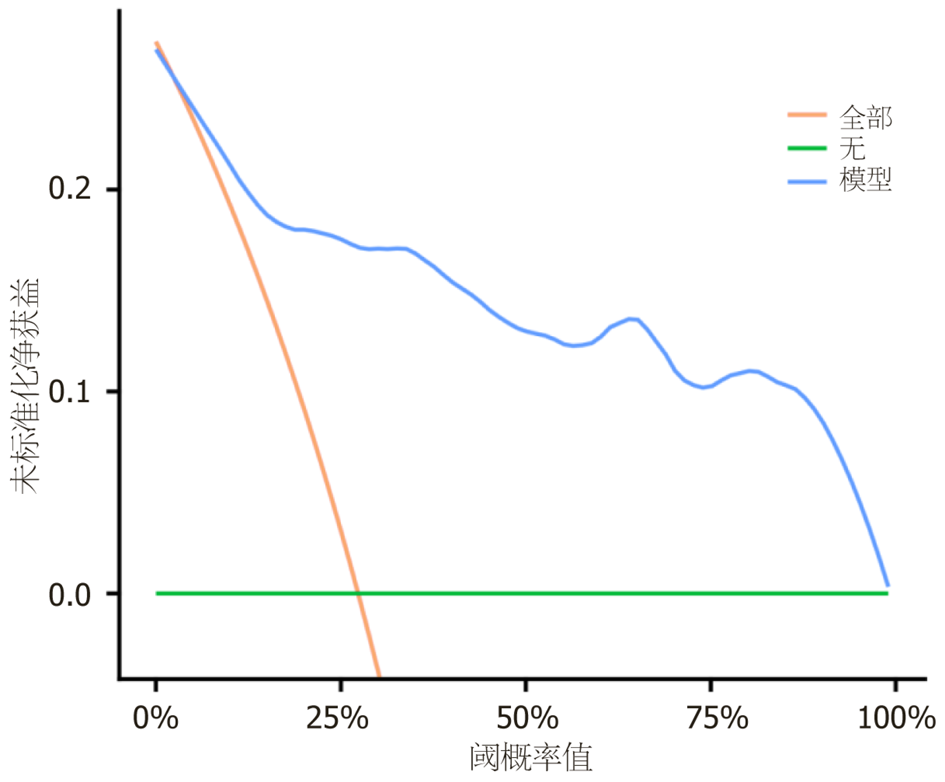
绘制列线图预测模型的ROC曲线, 见图4, 结果显示, 该模型预测H. pylori感染EGC患者ESD术后复发的曲线下面积(area under curve, AUC)为0.887(95%CI: 0.820-0.953), 具有较高预测效能, 且与美国癌症联合委员会(American Joint Committee on Cancer, AJCC)第8版分期系统(本研究验证其AUC为0.812)相比, 本研究模型的AUC明显增大(Z = 2.014, P = 0.036<0.05), 在预测EGC患者ESD术后复发方面显示出更优的判别效能; 绘制列线图预测模型的校准曲线, 见图5, 由图可知, 该模型的校准度较高, 预测值和实际值的相关性大小Dxy值为0.774, 模型预测结果与实际观测结果一致性较高; 绘制列线图预测模型的决策曲线, 见图6, 结果显示, 当阈概率为5%-98%时模型的获益性较高, 具有较高临床效用.
按照1:1比例, 另选取2020-07/2022-07绍兴市上虞人民医院行ESD治疗的H. pylori感染EGC患者150例, 其中复发患者39例, 未复发患者111例, 对列线图预测模型进行外部验证. 外部验证结果显示, 列线图预测模型预测H. pylori感染EGC患者ESD术后胃癌复发的敏感度为87.18%(34/39), 特异度为82.88%(92/111). Kappa检验分析显示, 列线图预测模型预测H. pylori感染EGC患者ESD术后胃癌复发的结果与临床实际结果的符合率为0.840, Kappa值为0.628(95%CI: 0.471-0.784). 见表4.
| 临床实际结果 | 列线图预测模型预测结果 | 合计 | 符合率 | Kappa值 | 95%CI | |
| 复发 | 未复发 | |||||
| 复发 | 34 | 5 | 39 | 0.840 | 0.628 | 0.471-0.784 |
| 未复发 | 19 | 92 | 111 | |||
| 合计 | 53 | 97 | 150 | |||
随着医学技术进步及人们健康意识的提高, 近年来, EGC检出率有所提高, ESD在临床中的应用也越来越普遍, 但是随之而来的是在ESD术后复发人数亦随之增多, 若未及时发现并有效干预, 可致使病情快速进展, 预后较差[9,10]. 本研究150例患者术后3年复发率达27.33%, 略低于魏若愚等[11]近期研究结果, 由此可见, 加强术后复发防治工作已迫在眉睫. 故探寻与H. pylori感染EGC患者ESD术后复发相关的风险因素, 并构建复发预测模型, 有助于早期识别复发高风险人群, 对指导临床防治及降低术后复发率极为重要.
本研究Lasso-Logistic回归分析结果显示, 分化程度为中低分化、Ki-67阳性≥50%、H. pylori转阴失败、CA724、NLR、TGFBI、G-17均为H. pylori感染EGC患者ESD术后复发的独立危险因素. 推测与下列原因相关: (1)分化程度为中低分化. 临床研究已证实[12], 肿瘤病理分化程度越低, 提示肿瘤细胞与正常细胞间存在较强异质性, 肿瘤细胞浸润性、侵袭性较强, 恶性程度高及转移风险较高, 故此类患者术后复发概率较大. 习晓丽等[13]研究认为, 肿瘤病理分化程度是EGC术后复发的独立危险因素; (2)Ki-67阳性≥50%. Ki-67是临床评估肿瘤细胞增殖活性及肿瘤细胞分裂周期的关键指标, 既往研究[14]已证实, Ki-67阳性表达与肿瘤病变、浸润程度密切相关, 上调其阳性表达亦可增加肿瘤术后复发风险; (3)H. pylori转阴失败(即"H. pylori治疗不彻底"). H. pylori感染可引起胃组织局部产生炎症反应, 免疫内环境稳态失衡, 并生成大量尿素酶, 而炎症刺激及尿素酶均可刺激胃泌素表达上调, 进一步加重黏膜病变; 此外, H. pylori感染可刺激上皮间质转化过度激活, 破坏黏附分子稳定性, 增强肿瘤细胞活动性, 促进细胞间分离及肿瘤细胞跨越血管内皮, 亦可加速细胞分裂, 致使基因突变风险增加[15,16]. 因此, 若H. pylori感染EGC患者的ESD术后H. pylori转阴失败, 则术后复发概率较高. 王霞虹等[17]经临床研究指出, 根除H. pylori, 可有效缓解胃黏膜、组织局部炎症反应病理损伤, 从而降低EGC患者的ESD术后复发风险; (4)CA724. CA724属临床常见癌胚抗原, 其过表达与肿瘤分期、浸润及迁移等恶性生物学行为具有紧密联系[18]. Zhou等[19]可为本研究结果提供数据支撑; (5)NLR. NLR可全面反映机体炎症及免疫状态的相互作用, NLR值越高, 提示机体炎症、应激反应及免疫应答失衡越剧烈, 机体处于慢性炎症及免疫失衡内环境, 有利于残余肿瘤细胞再次激活, 并可加快肿瘤细胞核DNA分裂速度, 促进肿瘤细胞增殖, 进而导致术后肿瘤复发[20,21]; (6)TGFBI. TGFBI可与Ⅰ、Ⅳ等多种类型胶原蛋白特异性结合, 参与调控细胞-胶原相互作用, 已有研究表明[22], TGFBI在胃癌等消化系统肿瘤中表达上调, 发挥抑制肿瘤细胞及细胞外基质黏附作用, 并加速肿瘤细胞的上皮间质转化, 从而加速癌细胞侵袭、浸润及转移, 且与肿瘤预后具有紧密联系. 肖萍等[23]研究中存在类似观点; (7)G-17. G-17作为胃肠激素, 可刺激主细胞分泌胃蛋白酶原, 具有促进胃酸分泌、调节消化道功能、反映胃黏膜腺体形态及功能等功效, 临床多用于评估胃黏膜病变性质[24]. 此外, G-17可与胆囊收缩素受体特异性结合, 激活细胞增殖及炎症信号通路, 并抑制细胞凋亡, 与EGC发生密切相关, 而上述通路可在术后残留肿瘤细胞中再次被激活, 增加复发风险[25].
基于上述结果, 本研究进一步绘制H. pylori感染EGC患者ESD术后复发的列线图风险预测模型, 发现该模型对术后复发具有一定预测效能, 且AUC值大于AJCC第8版分期系统预测的AUC值, 弥补了AJCC第8版分期系统信息维度较单一的缺陷, 提升了整体预测效能, 这也是本研究创新性所在; 模型效能内部验证结果显示, 该模型预测值和实际值一致性较高, 具有明显正向净获益及良好临床效用, 且外部验证也证实了模型预测结果与临床实际结果的符合率较高, 可作为临床预测术后复发的有效模型. 建议临床重视H. pylori感染EGC患者上述影响因素, 并将该模型作为临床常用预测模型, 可辅助识别术后复发高风险人群, 指导临床干预, 进而降低复发率, 改善预后.
综上所述, 分化程度为中低分化、Ki-67阳性≥50%、H. pylori转阴失败、CA724、NLR、TGFBI、G-17均与H. pylori感染EGC患者ESD术后复发独立相关, 基于上述指标构建列线图预测模型, 具有良好预测价值及临床效用, 可为临床早期识别术后复发高风险人群提供参考, 并指导临床防治. 本研究尚有不足之处, 局限于单中心研究, 样本来较小, 可能影响统计学效能及结果外推性, 且术后随访时间相对较短, 未来有待开展多中心、大样本量研究, 并延长随访时间, 进一步验证本研究结果.
幽门螺杆菌(Helicobacter pylori, H. pylori)分泌空泡毒素等, 可引起胃酸分泌增加、胃黏膜屏障损伤及炎症反应, 故合并早期胃癌(early gastric cancer, EGC)感染可致使胃黏膜病变风险及黏膜下剥离术(endoscopic submucosal dissection, ESD)术后复发风险持续增加.
早期识别H. pylori感染EGC患者ESD术后复发风险因素, 预测术后复发情况, 以指导临床采取针对性防控措施, 降低临床复发率, 已成为当前临床亟待解决的难题.
本研究尝试性分析H. pylori感染EGC患者ESD术后复发影响因素, 并构建诺莫图预测模型, 以期为临床防治工作提供参考.
选取行ESD治疗的H. pylori感染EGC患者158例, 根据术后随访3年是否复发分为复发组和未复发组. 比较两组一般资料及肿瘤相关资料, Lasso-Logistic回归分析术后复发的影响因素, 构建术后复发的列线图预测模型, 并采用受试者工作特征曲线、校准曲线、决策曲线、一致性分析对该模型进行内、外部验证.
复发组肿瘤直径≥2 cm、中低分化、多发、浸润黏膜下层、Ki-67≥50%、H. pylori未转阴、CA724/TGFBI/G-17/NLR升高及R0切除率低(均P<0.05). Lasso回归确认中低分化、Ki-67≥50%、H. pylori未转阴、CA724/NLR/TGFBI/G-17为独立危险因素. 列线图模型预测复发曲线下面积达0.887(优于AJCC分期0.812), Dxy = 0.774, 阈概率5%-98%时获益显著, Kappa = 0.628.
分化程度为中低分化、Ki-67阳性≥50%、H. pylori转阴失败、CA724、NLR、TGFBI、G-17均是H. pylori感染EGC患者ESD术后复发的独立危险因素, 基于上述指标构建列线图模型, 具有良好预测价值及临床效用, 可作为临床预测术后复发的有效模型, 并可指导临床防治.
指标构建列线图预测模型, 具有良好预测价值及临床效用, 可为临床早期识别术后复发高风险人群提供参考, 并指导临床防治. 本研究尚有不足之处, 局限于单中心研究, 样本来较小, 可能影响统计学效能及结果外推性, 且术后随访时间相对较短, 未来有待开展多中心、大样本量研究, 并延长随访时间, 进一步验证本研究结果.
| 2. | Cao M, Hu C, Pan S, Zhang Y, Yu P, Zhang R, Cheng X, Xu Z. Development and validation of nomogram for predicting early recurrence after radical gastrectomy of gastric cancer. World J Surg Oncol. 2024;22:21. [PubMed] [DOI] |
| 3. | Zheng CY, Wu J, Chen CS, Huang ZN, Tang YH, Qiu WW, He QC, Lin GS, Chen QY, Lu J, Wang JB, Lin JX, Cao LL, Lin M, Tu RH, Xie JW, Li P, Huang CM, Zheng YH, Zheng CH. A scoring model for predicting early recurrence of gastric cancer with normal preoperative tumor markers: A multicenter study. Eur J Surg Oncol. 2023;49:107094. [PubMed] [DOI] |
| 4. | Usui Y, Taniyama Y, Endo M, Koyanagi YN, Kasugai Y, Oze I, Ito H, Imoto I, Tanaka T, Tajika M, Niwa Y, Iwasaki Y, Aoi T, Hakozaki N, Takata S, Suzuki K, Terao C, Hatakeyama M, Hirata M, Sugano K, Yoshida T, Kamatani Y, Nakagawa H, Matsuda K, Murakami Y, Spurdle AB, Matsuo K, Momozawa Y. Helicobacter pylori, Homologous-Recombination Genes, and Gastric Cancer. N Engl J Med. 2023;388:1181-1190. [PubMed] [DOI] |
| 6. | 吉 栋德, 段 旭红, 荣 光宏, 逯 艳艳, 李 晓林, 薛 晓红, 许 国彩, 安 玲, 刘 芝兰. 内镜黏膜下剥离术治疗早期胃癌术后复发的相关因素分析. 中国内镜杂志. 2022;28:66-71. [DOI] |
| 7. | Shang X, Zhao Y, Xu T, Ma Q, Su Z. Differential value of PGI, PGII and G-17 in chronic atrophic gastritis and early gastric cancer. Minerva Pediatr (Torino). 2023;75:753-755. [PubMed] [DOI] |
| 9. | Zeng Y, Yang J, Zhang JW. Early gastric cancer recurrence after endoscopic submucosal dissection: Not to be ignored! World J Gastrointest Oncol. 2024;16:8-12. [PubMed] [DOI] |
| 10. | Qu T, Zhang S, Yang S, Li S, Wang D. Utilizing serum metabolomics for assessing postoperative efficacy and monitoring recurrence in gastric cancer patients. BMC Cancer. 2024;24:27. [PubMed] [DOI] |
| 12. | Li Y, Zhao H. Postoperative recurrence of gastric cancer depends on whether the chemotherapy cycle was more than 9 cycles: Based on a retrospective and observational study of follow-up within 3 years of 843 patients. Medicine (Baltimore). 2022;101:e28620. [PubMed] [DOI] |
| 14. | Razmi M, Tajik F, Hashemi F, Yazdanpanah A, Hashemi-Niasari F, Divsalar A. The Prognostic Importance of Ki-67 in Gastrointestinal Carcinomas: A Meta-analysis and Multi-omics Approach. J Gastrointest Cancer. 2024;55:599-624. [PubMed] [DOI] |
| 15. | Tran SC, Bryant KN, Cover TL. The Helicobacter pylori cag pathogenicity island as a determinant of gastric cancer risk. Gut Microbes. 2024;16:2314201. [PubMed] [DOI] |
| 16. | Shirani M, Pakzad R, Haddadi MH, Akrami S, Asadi A, Kazemian H, Moradi M, Kaviar VH, Zomorodi AR, Khoshnood S, Shafieian M, Tavasolian R, Heidary M, Saki M. The global prevalence of gastric cancer in Helicobacter pylori-infected individuals: a systematic review and meta-analysis. BMC Infect Dis. 2023;23:543. [PubMed] [DOI] |
| 18. | Cao H, Zhu L, Li L, Wang W, Niu X. Serum CA724 has no diagnostic value for gastrointestinal tumors. Clin Exp Med. 2023;23:2433-2442. [PubMed] [DOI] |
| 19. | Zhou CM, Zhao SH. Evaluation of the value of combined detection of tumor markers CA724, carcinoembryonic antigen, CA242, and CA19-9 in gastric cancer. World J Gastrointest Oncol. 2024;16:1737-1744. [PubMed] [DOI] |
| 20. | Karra S, Gurushankari B, Rajalekshmy MR, Elamurugan TP, Mahalakshmy T, Kate V, Nanda N, Rajesh NG, Shankar G. Diagnostic Utility of NLR, PLR and MLR in Early Diagnosis of Gastric Cancer: an Analytical Cross-Sectional Study. J Gastrointest Cancer. 2023;54:1322-1330. [PubMed] [DOI] |
| 21. | Xing X, Zhang Y, Wang Y, Li M. NLR in combination with plasma FIB and RDW is a useful predictor for the diagnosis of early gastric cancer. Asian J Surg. 2023;46:2219-2220. [PubMed] [DOI] |
| 22. | 黄 芳, 陈 晓帆. TGFBI对胃癌MGC-803细胞侵袭转移及血管生成的影响. 中国组织化学与细胞化学杂志. 2023;32:539-546. [DOI] |
| 24. | Gašenko E, Bogdanova I, Sjomina O, Aleksandraviča I, Kiršners A, Ancāns G, Rudzīte D, Vangravs R, Sīviņš A, Škapars R, Tzivian L, Polaka I, Folkmanis V, Leja M. Assessing the utility of pepsinogens and gastrin-17 in gastric cancer detection. Eur J Cancer Prev. 2023;32:478-484. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): B
C级 (良好): 0
D级 (一般): D, D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁