修回日期: 2024-10-20
接受日期: 2024-11-21
在线出版日期: 2024-11-28
慢性萎缩性胃炎(chronic atrophic gastritis, CAG)是胃癌的癌前病变. 虽然内镜检查是监测CAG的标准方法, 但其有侵入性且价格较贵, 这些特点限制了其广泛使用. 因此需要早期识别CAG人群胃癌风险.
本研究旨在识别CAG人群中胃癌的风险因素, 重点关注血细胞比值, 建立能够量化CAG癌变风险的个性化预测模型.
回顾性纳入2018-01/2024-01期间在杭州师范大学附属医院所收治的经内镜和病理判断存在CAG患者, 筛选其中符合入组标准的患者, 共计314例作为此次研究对象. 记录人口学信息、血清学参数和血细胞指标. 通过多因素逻辑回归确定独立危险因素, 并使用R语言构建列线图模型. 通过ROC曲线下面积(area under the ROC curve, AUC)、Hosmer-Lemeshow检验和决策曲线分析(decision curve analysis, DCA)评价模型区分度、校准度及有效性.
在CAG人群中, 男性(OR = 2.214, P<0.05)、幽门螺杆菌(Helicobacter pylori, H. pylori)感染(OR = 2.686, P<0.05)、促胃泌素17(gastrin 17, G-17)(OR = 1.037, P<0.05)、血红蛋白与红细胞分布宽度比值(hemoglobin-to-red blood cell distribution width ratio, HRR)(OR = 0.648, P<0.05)、淋巴细胞与单核细胞比值(lymphocyte-to-monocyte ratio, LMR)(OR = 0.645, P<0.05)是癌变的独立预测因素(P<0.05). 基于性别、H. pylori感染、G-17、HRR、LMR 5项指标建立慢性萎缩性胃炎人群癌变风险预测列线图模型, 计算模型的AUC为0.854(95%CI: 0.8105-0.8967), Hosmer-Lemeshow拟合优度检验显示χ2 = 6.062, P = 0.640(P>0.05), 说明预测概率与实际观测值具有良好的一致性, DCA曲线显示模型阈概率在0到70%区间内, 说明模型具有潜在的泛化能力.
该列线图为CAG患者提供了一种无创、便捷且经济有效的胃癌筛查工具, 具有出色的区分度和校准能力. 需要进一步开展大规模、多中心的研究, 以验证其在不同人群中的有效性.
核心提要: 本研究建立了无创的列线图预测模型, 以识别慢性萎缩性胃炎人群中的胃癌风险因素. 结果表明, 血红蛋白与红细胞分布宽度比值与淋巴细胞与单核细胞比值是独立预测因素. 该模型具有良好的区分度和校准能力, 为胃癌筛查提供了经济有效的工具.
引文著录: 徐阳, 李国栋, 吴沉瀚, 钟雪晴. 慢性萎缩性胃炎胃癌风险的列线图预测模型: 血细胞比值的作用. 世界华人消化杂志 2024; 32(11): 811-820
Revised: October 20, 2024
Accepted: November 21, 2024
Published online: November 28, 2024
Chronic atrophic gastritis (CAG) is a precancerous condition for gastric cancer. Although endoscopy is the standard method for monitoring CAG, its invasive nature and high cost limit its use.
To identify risk factors for gastric cancer in the CAG population, focusing on blood cell ratios, and develop a personalized prediction model using a nomogram.
A retrospective analysis was conducted on 314 GAG patients admitted to Hangzhou Normal University Affiliated Hospital from January 2018 to January 2024. Data collected included demographic, serological, and blood cell parameters. Independent risk factors were identified using multivariate logistic regression and a nomogram model was constructed with R. Model performance was assessed using the area under the ROC curve (AUC), the Hosmer-Lemeshow test, and decision curve analysis (DCA).
Significant predictive factors for gastric cancer in the CAG population included male gender (odds ratio [OR] = 2.214, P < 0.05), Helicobacter pylori (H. pylori) infection (OR = 2.686, P < 0.05), gastrin 17 (G-17) (OR = 1.037, P < 0.05), hemoglobin-to-red blood cell distribution width ratio (HRR) (OR = 0.648, P < 0.05), and lymphocyte-to-monocyte ratio (LMR) (OR = 0.645, P < 0.05). The prediction model, with an AUC of 0.854, demonstrated good fit (Hosmer-Lemeshow test: χ2 = 6.062, P = 0.640). DCA indicated the potential generalizability of the model.
The nomogram provides a noninvasive, convenient, and cost-effective tool for screening gastric cancer in CAG patients, showing excellent discrimination and calibration. Further large-scale, multicenter studies are necessary to validate its efficacy across diverse populations.
- Citation: Xu Y, Li GD, Wu CH, Zhong XQ. Nomogram prediction model for gastric cancer risk in chronic atrophic gastritis: Role of blood cell ratios. Shijie Huaren Xiaohua Zazhi 2024; 32(11): 811-820
- URL: https://www.wjgnet.com/1009-3079/full/v32/i11/811.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i11.811
胃癌(gastric cancer, GC)是全球常见的恶性肿瘤, 根据国际癌症研究机构(IARC)2022年《全球癌症负担报告》[1], 其发病率和癌症相关死亡率均位列第五, 其中近50%的病例数来自我国[2]. 慢性萎缩性胃炎(chronic atrophic gastritis, CAG)代表了GC发展过程中的早期阶段, 可能进展为胃上皮内瘤变, 最终发展为GC[3,4]. 研究表明[3], 与无胃萎缩的人相比, 胃萎缩患者的胃腺癌风险高出3.6倍以上, 随访时间为6.2年±4.8年. 一项中国的队列研究报告称[3], 萎缩性胃炎患者每人每年的GC和高度上皮内瘤变的年发病率为0.53%. 因此, 精准评估CAG患者的GC风险至关重要.
内镜病理活检是仍然是确诊胃癌的金标准, 但内镜属于侵入性检查、其价格较贵, 难以在短时间内重复实施. 对于诊断为CAG的患者, 内镜监测的最佳时间间隔尚不明确[5]. 因此有必要采用合适的筛查方法, 以识别CAG人群中的GC高风险个体, 从而改善临床决策, 及早干预, 降低胃癌死亡率.
炎症在肿瘤的发生和扩散中起着关键作用[6,7], 一些血细胞炎症指标比值, 如淋巴细胞与单核细胞比值(lymphocyte to monocyte ratio, LMR)、中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio, NLR)、血小板与淋巴细胞比值(platelet to lymphocyte ratio, PLR)以及系统免疫炎症指数(systemic immune-inflammation index, SⅡ)间接反映了机体炎症程度, 进而评估癌症患者的疾病进展与预后[8,9]. 血红蛋白与红细胞分布宽度比值(hemoglobin-to-red blood cell distribution width ratio, HRR)可以反应机体贫血、铁缺乏和营养状态的信息, 有助于对癌症患者整体健康状况的综合评估[10]. Su等[11]发现HRR与癌症预后相关. 他们发现, 在上尿路尿路上皮癌患者中, HRR≤1.05与较差的无进展生存期、癌症特异性生存期和总体生存期显著相关[11]. 尽管这些血细胞比值在癌症预后中的价值已经得到证明, 但尚缺乏在CAG人群中用于胃癌筛查的价值方面的研究.
现有的GC筛查模型中包含了血清胃蛋白酶原Ⅰ(pepsinogen Ⅰ, PGⅠ)、胃蛋白酶原Ⅱ(pepsinogen Ⅱ, PGⅡ)、幽门螺杆菌(Helicobacter pylori, H. pylori)IgG抗体检测和胃泌素17(gastrin 17, G-17)等变量, 但针对CAG人群的个性化预测模型尚缺乏[12-14]. 因此, 本研究旨在比较GC和CAG人群, 阐明CAG人群中GC的独立风险因素, 并基于外周血标志物建立预测模型. 该模型以列线图形式呈现, 量化每个影响因素对癌变的贡献程度, 提供个性化的胃癌风险预测, 并为进一步的诊断性胃镜检查提供决策支持.
本研究纳入了2018-01/2024-01在杭州师范大学附属医院接受内镜检查和病理检查诊断为CAG的患者. 患者被分为两组: 胃癌组(GC组)和无胃癌的CAG组.
1.1.1 纳入和排除标准: 纳入标准: (1)年龄在18至79岁之间, 愿意接受胃镜和病理检查并签署知情同意书; (2)胃镜检查及病理结果完整, 确认为CAG. 无严重基础疾病; (3)无精神障碍史; (4)具有血清胃泌素17、胃蛋白酶原I、肿瘤标志物、C14呼气试验和血常规结果. 排除标准: (1)器官功能严重障碍, 如严重心脏、肝脏、肾脏或肺功能障碍; (2)存在其他恶性肿瘤、个人恶性肿瘤史、胃部手术史或胃癌史; (3)临床资料不完整. 最终共纳入了314名患者.
1.1.2 诊断标准: CAG是指原有胃腺体的减少或消失, 伴随正常腺体上皮的丧失[15]. 胃癌的定义依据胃肠上皮瘤变的维也纳分类标准[16,17].
1.1.3 伦理审查: 本研究获得了杭州师范大学附属医院伦理委员会的批准, 并遵循《赫尔辛基宣言》中的原则. 伦理批准编号为2024(E2)-KS-041. 所有参与者均签署了知情同意书.
1.2.1 临床数据收集: 从His系统和随访调查中收集患者的基本临床数据, 包括年龄、性别、体重指数(body mass index, BMI)、吸烟和饮酒史、H. pylori感染、消化道肿瘤家族史、消化系统症状和胃病史. 根据文献和临床经验选择了临床可获得的实验室指标用于分析胃癌的危险因素, 包括PGⅠ、PGⅡ、胃蛋白酶原比值(pepsinogen ratio, PGR)、G-17、糖类抗原50、糖类抗原19-9(carbohydrate antigen 19-9, CA19-9)、糖类抗原72-4(carbohydrate antigen 72-4, CA72-4)、癌胚抗原(carcinoembryonic antigen, CEA)和血常规参数. 此外, 还分析了外周血细胞比值, 如HRR、NLR、LMR、血PLR以及SⅡ.
1.2.2 胃镜病理检查: 签署知情同意书后, 由内镜专家进行胃镜检查, 并取得胃黏膜组织样本以进行病理分析. 记录胃镜和组织病理学的发现, 包括H. pylori感染、糜烂、溃疡、出血、活动性炎症以及胆汁反流黏膜萎缩的程度和范围.
统计学处理 数据分析采用SPSS 27.0统计软件. 连续变量资料以mean±SD或中位数(25%-75%分位数)表示, 分类变量以频数(百分数)表示. 对各变量采用单因素Logistic回归分析, 筛选出具有统计差异的指标, 然后进行多因素Logistic回归分析, 以确定独立影响因素. 统计显著性设定为P<0.05. 使用R软件中的"rms"和"DynNom"包构建预测模型并生成列线图. 通过受试者工作特征(receiver operating characteristic curve, ROC)曲线分析、校准曲线和决策曲线评估模型的区分度、校准度和临床适用性. 使用Hosmer-Lemeshow拟合优度检验和C指数计算模型的拟合度和准确性, P>0.05表示Hosmer-Lemeshow检验拟合良好. 决策曲线分析(decision curve analysis, DCA)评估预测模型的潜在净收益[18]. ROC曲线下面积(area under the ROC curve, AUC)值显示模型的区分能力, DCA则可视化治疗策略的临床结果, 揭示在不同阈值概率下每个决策的净收益.
2.1.1 研究对象基线资料: 本研究共纳入314例患者(男性202例, 女性112例), 其中178例为CAG组, 136例为GC组. GC组和CAG组在性别分布(男性: 72.8% vs 27.2%, P = 0.006)、年龄[(63.27±11.63)岁 vs (60.31±10.53)岁, P = 0.002]、BMI[(22.22±3.88) kg/m² vs (23.82±3.63) kg/m², P<0.001]和吸烟史(44.1% vs 29.8%, P = 0.009)方面显著不同. GC组中吐血和黑便的发生率明显高于CAG组(23.5% vs 11.2%, P = 0.004). 此外, GC组的内镜出血体征也高于CAG组(10.3% vs 3.9%, P = 0.025). 但两组在食欲不振、腹胀、腹痛、恶心、呕吐、酸反流、烧心等症状以及胃病史和基础疾病方面无显著差异.
2.1.2 研究对象实验室指标: GC组H. pylori感染率显著高于CAG组(53.7% vs 39.3%, P = 0.011). 血清标志物分析显示两组存在显著差异: GC组的G-17(10.82 pmol/L)、CEA(3.13 ng/mL)、CA19-9(8.82 U/mL)和CA72-4(2.65 U/mL)水平显著高于CAG组(G-17 7.31 pmol/L、CEA 1.96 ng/mL、CA19-9 5.94 U/mL、CA72-4 1.48 U/mL), 差异具有统计学意义(P<0.05). 然而, 两组在PGⅠ、PGⅡ和PGR的比较中未见显著差异.
2.1.3 外周血细胞比值: 如表1所示, GC组的NLR(3.95)、PLR(155.46)和SⅡ(833.69)水平显著高于CAG组(NLR: 2.40、PLR: 134.48、SⅡ: 527.38). 相反, CAG组的HRR(10.51±1.82)和LMR(4.22)水平高于GC组(HRR: 8.02±2.45, LMR: 2.65), 差异具有统计学意义(P<0.05).
| 参数 | CAG组(n = 178) | GC组(n = 136) | 统计值(χ2/t/Z) | P值 |
| HRR(Hb/RDW) | 10.51±1.82 | 8.02±2.45 | 9.914 | 0.000b |
| NLR(NEU/LYM) | 2.40(1.82-3.43) | 3.95(2.53-5.74) | -6.356 | 0.000b |
| PLR(PLT/LYM) | 134.48(108.33-163.19) | 155.46(119.98-213.87) | -3.622 | 0.000b |
| LMR(LYM/MON) | 4.22(3.08-5.43) | 2.65(1.97-3.76) | -7.696 | 0.000b |
| SII(PLT×NEU/LYM) | 527.38(374.40-730.94) | 833.69(460.51-1232.38) | -4.938 | 0.000b |
对两组的实验室指标、外周血细胞比值及基线特征(包括性别、年龄、吸烟史和BMI)进行了单因素Logistic回归分析. 结果显示性别(OR: 1.948; 95%CI: 1.205-3.151; P = 0.007)、年龄(OR: 1.025; 95%CI: 1.004-1.047; P = 0.020)、BMI(OR: 0.890; 95%CI: 0.835-0.948; P<0.001)、吸烟史(OR: 1.813; 95%CI: 1.138-2.888; P = 0.012)、H. pylori感染(OR: 1.921; 95%CI: 1.222-3.020; P = 0.005)、G-17(OR: 1.036; 95%CI: 1.017-1.055; P<0.001)有显著性差异, 是CAG患者胃癌的风险因素.详细结果见表2.
| 参数 | 回归系数β | OR | 95%CI | P值 |
| 性别 | 0.667 | 1.948 | 1.205-3.151 | 0.007b |
| 年龄(岁) | 0.025 | 1.025 | 1.004-1.047 | 0.020a |
| BMI(kg/m2) | -0.117 | 0.890 | 0.835-0.948 | 0.000b |
| 吸烟史 | 0.595 | 1.813 | 1.138-2.888 | 0.012a |
| H. pylori | 0.653 | 1.921 | 1.222-3.020 | 0.005b |
| 胃泌素17 | 0.035 | 1.036 | 1.017-1.055 | 0.000b |
| 胃蛋白酶原Ⅰ | -0.001 | 0.999 | 0.995-1.003 | 0.692 |
| 胃蛋白酶原Ⅱ | 0.032 | 1.033 | 1.010-1.056 | 0.005b |
| 胃蛋白酶原比值 | -0.035 | 0.965 | 0.900-1.035 | 0.319 |
| 癌胚抗原 | 0.128 | 1.137 | 1.041-1.241 | 0.004b |
| 糖类抗原19-9 | 0.039 | 1.039 | 1.021-1.058 | 0.000b |
| 糖类抗原72-4 | 0.056 | 1.057 | 1.025-1.091 | 0.000b |
| 糖类抗原50 | 0.088 | 1.092 | 1.046-1.139 | 0.000b |
| 白细胞计数 | 0.101 | 1.106 | 0.979-1.250 | 0.106 |
| 红细胞计数 | -0.325 | 0.723 | 0.512-1.02 | 0.065 |
| 平均红细胞体积 | 0.026 | 1.027 | 0.988-1.067 | 0.182 |
| 平均血小板体积 | -0.064 | 0.938 | 0.770-1.142 | 0.522 |
| 血小板分布宽度 | -0.081 | 0.922 | 0.823-1.034 | 0.166 |
| HRR | -0.517 | 0.597 | 0.525-0.678 | 0.000b |
| NLR | 0.391 | 1.479 | 1.296-1.688 | 0.000b |
| PLR | 0.007 | 1.007 | 1.004-1.011 | 0.000b |
| LMR | -0.654 | 0.520 | 0.431-0.627 | 0.000b |
| SⅡ | 0.001 | 1.001 | 1.001-1.002 | 0.000b |
将单因素回归分析中P<0.05的指标纳入多因素Logistic回归模型. 结果显示性别(OR = 2.214)、H. pylori感染(OR = 2.686)、G-17(OR = 1.037)、HRR(OR = 0.648)和LMR(OR = 0.645)为CAG患者胃癌的独立影响因素(P<0.05). 其中, 男性、H. pylori感染和G-17升高是胃癌的风险因素(OR>1), 而HRR和LMR升高则是胃癌的保护因素(OR<1), 详见表3.
| 参数 | 回归系数β | OR | 95%CI | P值 |
| 性别 | 0.795 | 2.214 | 1.015-4.830 | 0.046a |
| 年龄 | 0.008 | 1.008 | 0.980-1.037 | 0.572 |
| BMI | -0.067 | 0.935 | 0.857-1.021 | 0.137 |
| 吸烟 | 0.059 | 1.060 | 0.509-2.211 | 0.876 |
| H. pylori感染 | 0.988 | 2.686 | 1.438-5.019 | 0.002b |
| G-17 | 0.036 | 1.037 | 1.013-1.061 | 0.002b |
| PG-Ⅱ | 0.005 | 1.005 | 0.976-1.036 | 0.733 |
| CEA | 0.019 | 1.019 | 0.967-1.074 | 0.473 |
| CA19-9 | 0.004 | 1.004 | 0.979-1.030 | 0.740 |
| CA72-4 | 0.037 | 1.037 | 0.992-1.084 | 0.107 |
| CA50 | 0.056 | 1.058 | 0.982-1.139 | 0.141 |
| HRR | -0.434 | 0.648 | 0.557-0.754 | 0.000a |
| NLR | -0.151 | 0.860 | 0.599-1.234 | 0.412 |
| PLR | 0.002 | 1.002 | 0.996-1.007 | 0.570 |
| LMR | -0.438 | 0.645 | 0.475-0.877 | 0.005b |
| SⅡ | 0.000 | 1.000 | 0.998-1.002 | 0.993 |
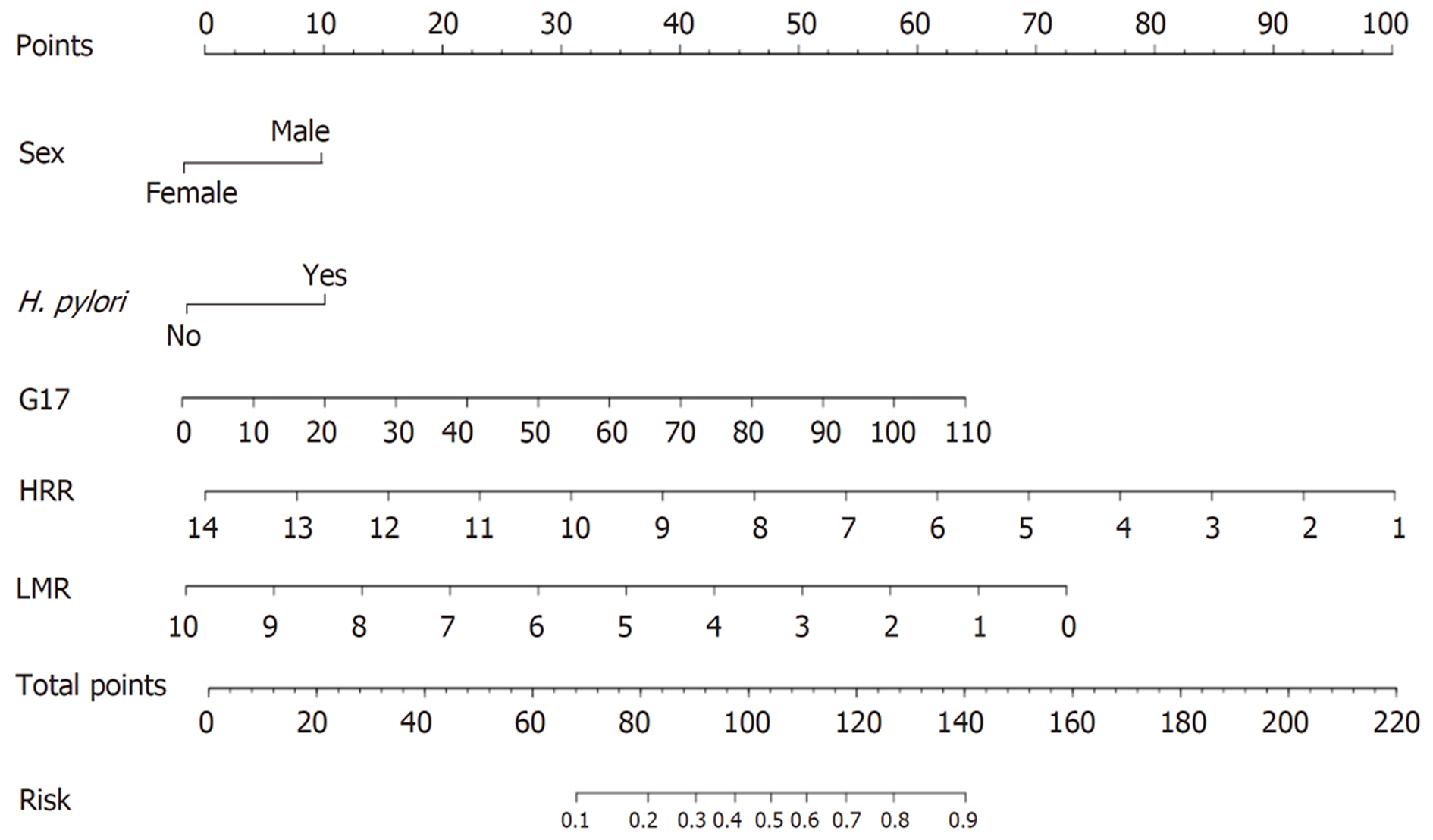
2.4.1 自定义列线图模型的构建: 基于多因素Logistic回归分析, 性别、H. pylori感染、G-17、HRR和LMR被确定为独立的胃癌影响因素(P<0.05). 利用这五个指标建立了胃癌风险预测模型, 并以列线图形式展示(图1).
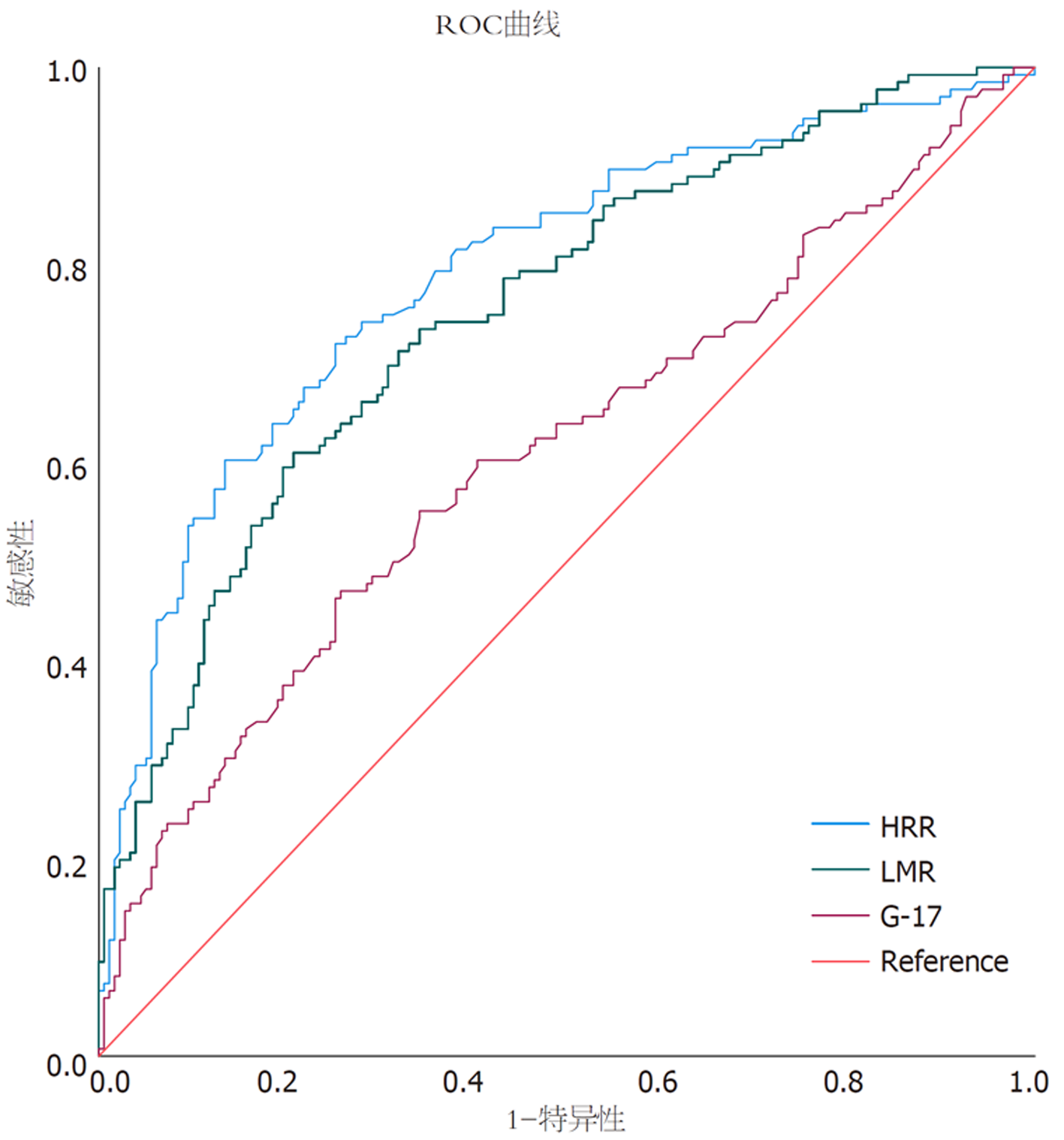
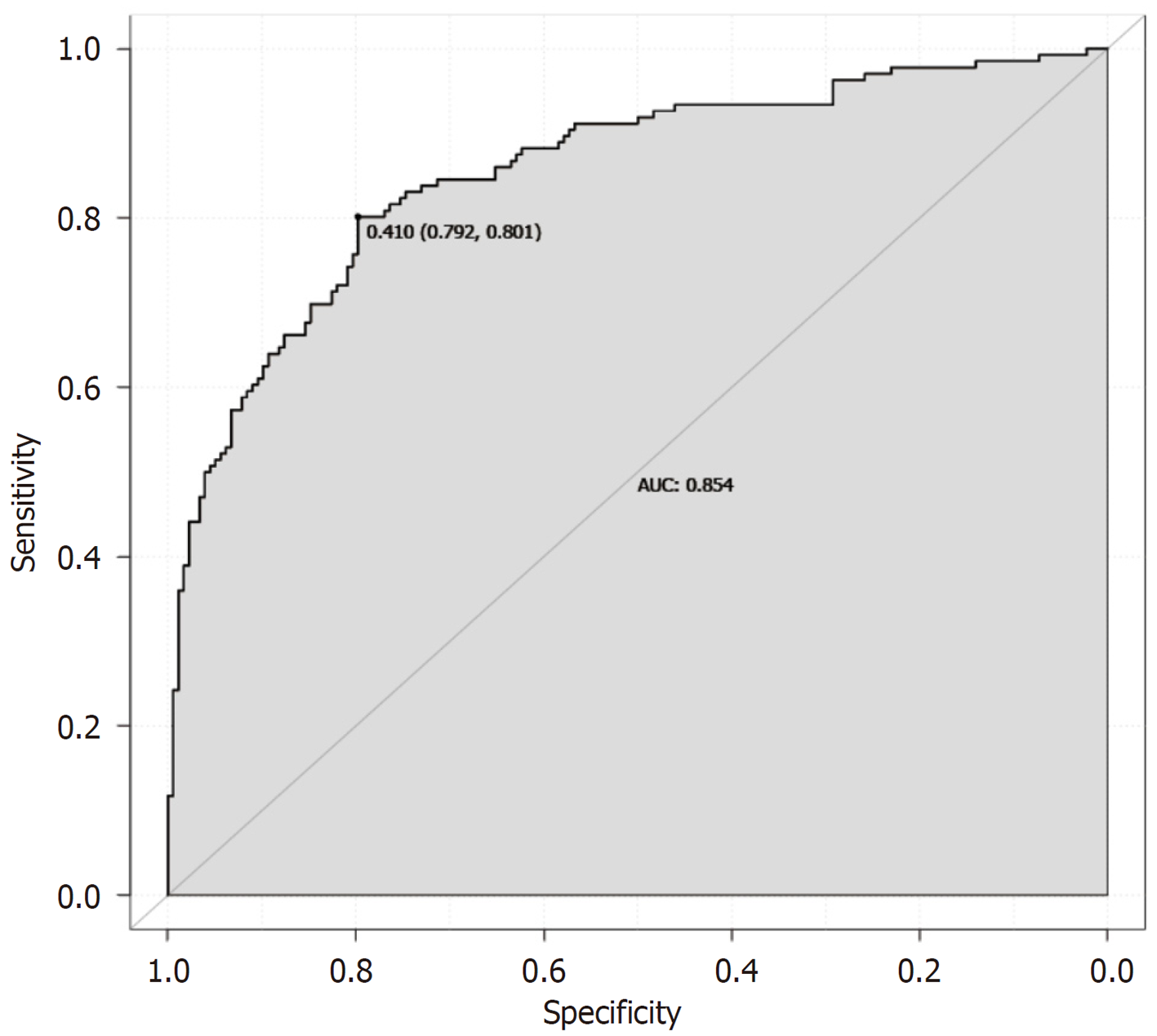
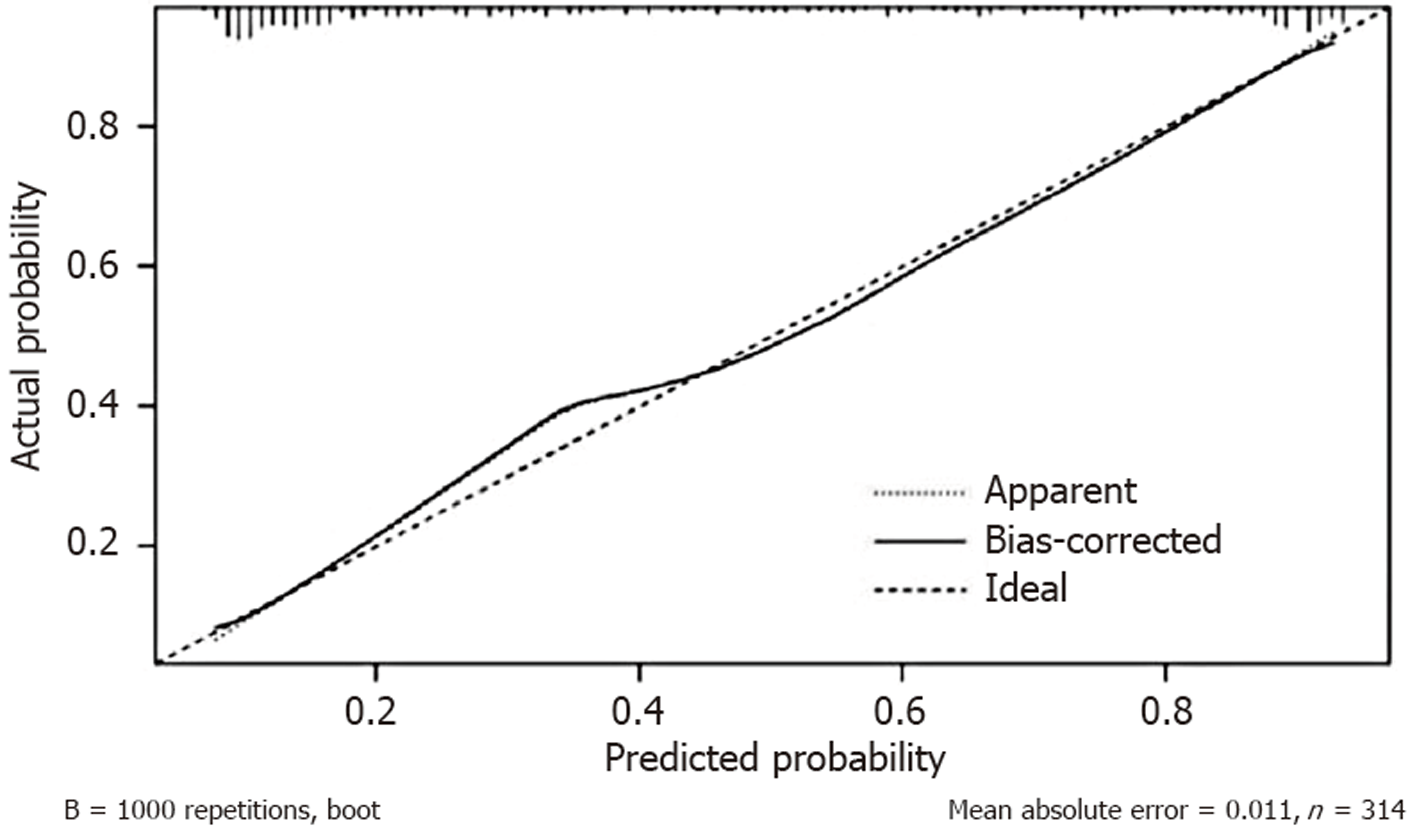
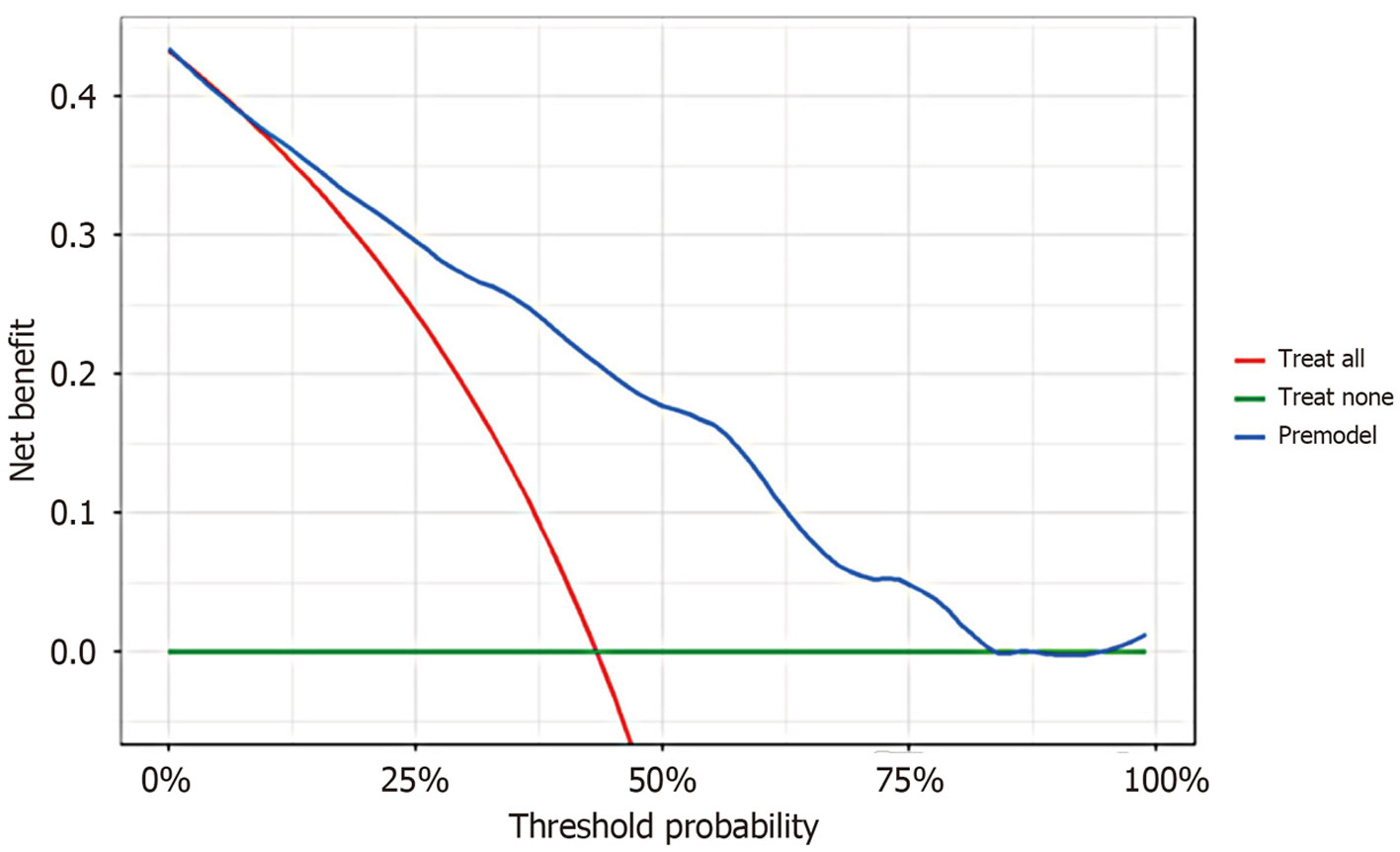
2.4.2 模型验证: 我们绘制了独立影响因素中连续变量G-17、HRR和LMR的ROC曲线(图2). G-17的AUC为0.610(95%CI: 0.546-0.674), LMR的AUC为0.753(95%CI: 0.700-0.807), HRR的AUC为0.792(95%CI: 0.741-0.843). G-17、LMR和HRR均表现出良好的预测能力, 其中HRR显示出最强的预测能力, 如表4所示. 列线图模型的ROC曲线如图3所示, 列线图模型的AUC为0.854(95%CI: 0.8105-0.8967), 表明该预测模型具有出色的区分能力. 使用Bootstrap方法进行了模型的内部验证, 重复1000次以计算一致性指数(C-index), 平均C-index为0.8467(95%CI: 0.8006-0.8926), 表明模型具有良好的一致性. 校准曲线显示实际预测曲线与理想预测曲线高度一致, 表明列线图模型具有良好的预测性能(图4). DCA显示模型在0至75%的阈值概率范围内具有净临床获益, 表明其具有较强的临床实用性(图5). 使用Hosmer-Lemeshow拟合优度检验, 统计值为χ2 = 6.062, 对应P值为0.640(P>0.05), 表明预测值与观察值之间无显著统计差异, 从而确认模型拟合良好.
GC的高发病率和高死亡率, 对社会和家庭造成了沉重的负担[1]. CAG是胃癌前病变[19], 目前萎缩性胃炎患者理想的内镜监测频率仍无标准[5]. 因此通过无创手段在CAG人群中进行胃癌筛查很有必要. 血细胞比值提供了客观且易获取的标志物, 目前关于其在CAG个体中对胃癌风险的影响的证据仍然缺乏.
本研究首次开发了一种基于CAG患者血细胞比值的胃癌风险列线图. 我们的研究发现, GC患者外周血细胞比值显著升高, 包括NLR、PLR和SⅡ, 而CAG组的LMR和HRR则显著降低. 此外, 多变量逻辑回归分析表明, 性别、H. pylori感染、G-17水平、HRR和LMR是CAG患者胃癌风险的独立影响因素. 我们开发并验证了一种直观的风险模型, 用于预测CAG患者的胃癌风险. 该列线图整合了五个关键临床指标: 性别、H. pylori感染、G-17水平、HRR和LMR. 校准曲线证实了模型的预测效力, 而C-index在内部验证后证明了其可靠性. 值得注意的是, 这种预测工具具有成本效益、使用便捷且易于复制, 显示出在临床应用中的巨大潜力.
性别作为CAG人群中胃癌的独立风险因素, 与前人的研究一致[20]. 本研究的多因素逻辑回归分析进一步证实, H. pylori感染是CAG人群中胃癌的独立风险因素, 与此前研究证实H. pylori感染是胃癌的致癌因素一致[21]. H. pylori感染会引起胃黏膜的慢性炎症, 进而导致一系列反应, 最终引发胃癌[22].
最新证据表明[23], 肿瘤的发生不仅仅由肿瘤特异性因素决定, 还受到宿主免疫状态的影响. 外周血细胞的组成反映了机体的整体炎症状态, 进而影响肿瘤细胞的存活和发展[24,25]. 例如, 中性粒细胞会抑制免疫系统功能并促进肿瘤增殖和转移, 而淋巴细胞则通过对抗肿瘤细胞阻碍肿瘤进展[24-26]. NLR、PLR、LMR和SⅡ这些基于全血细胞计数的比值, 可能全面反映炎症状态, 或有助于癌症预后[27-29].
血常规中的红细胞分布宽度(red blood cell distri-bution width, RDW)在评估整体疾病状态和预测预后方面发挥了重要作用[30,31]. 在本研究中, RDW水平是区分CAG人群是否患胃癌的可靠指标. 此外, 胃癌患者比CAG人群更易发生胃肠道出血症状, 这也促成了这些患者中RDW水平较高.
HRR在多种癌症中与预后有关, 但其在CAG人群中是否与胃癌胃癌相关仍无定论[11,32,33]. 本研究表明, 低HRR水平的CAG人群患胃癌的风险更高, HRR是胃癌的独立保护因素. 但仍需大样本和前瞻性的研究来证实这些发现.
本研究中, H. pylori感染和G-17水平在评估CAG人群胃癌风险方面具有显著意义. H. pylori感染引发慢性炎症, 启动胃癌发生的过程, 而G-17水平反映了胃黏膜的分泌功能, 两者对CAG患者是否患有胃癌具有重要预测价值[21,34]. G-17水平受胃内酸度和胃窦G细胞数量的影响[13,35]. 本研究表明, 与CAG组相比, GC组个体的血清G-17水平显著升高, 这与之前的研究结果一致[13,36], 表明G-17水平升高与胃癌风险增加相关.
虽然列线图模型表现出良好的区分能力(AUC: 0.855), 并在临床决策分析曲线上表现出出色的性能(DCA曲线), 相比胃肠镜检查费用更低且引起的不适更少, 但仍存在一些局限性. 首先, 本研究为回顾性研究, 许多样本因数据缺失被排除, 这可能引起偏差. 此外, 本研究中胃癌患者比例较高, 可能是由于临床实践中胃癌患者大部分住院治疗, 数据较为完整, 而CAG患者于门诊治疗, 导致其临床资料不完整, 显著减少了其被纳入的可能性, 这会导致选择偏倚. 其次, 一项系统综述表明, 7.5%的胃腺癌中EB病毒阳性[37], 但本研究没有相关数据, 有必要探讨EB病毒感染是否与胃癌的发生发展相关. 再次, 本研究着重于CAG患者, 缺乏与其他胃部良性疾病如胃溃疡、慢性浅表性胃炎的对比, 未来需要进一步探讨其他胃部良性疾病中胃癌的风险因素. 最后, 本研究样本量较小, 可能限制了研究结果的统计效力和稳健性. 尽管如此, 总体上本研究使得量化CAG人群的胃癌风险成为可能, 从而根据个体胃癌风险调整内镜检查, 降低经济负担. 通过单变量和多变量逻辑回归分析, 我们确定了性别、H. pylori感染、G-17水平、LMR和HRR为CAG患者胃癌的独立预测因子. 这些发现随后被整合到列线图诊断预测模型中. 通过严格的内部验证方法, 包括Bootstrap重采样、AUC计算、Hosmer-Lemeshow拟合优度检验和DCA曲线分析, 确认了该模型的强大预测能力、区分度和临床实用性.
该列线图模型为CAG患者提供了一种成本效益高、便捷、准确、无创且可复制的个体胃癌风险评估方法, 从而有助于临床决策, 对是否行内镜检查有指导作用. 此外, 它补充了现有的胃镜筛查工作, 有助于提高胃癌的检测率.
总之, 本研究突出了血细胞比值, 特别是HRR和LMR, 在CAG患者中作为胃癌筛查指标的潜力. 本研究为回顾性设计且样本量有限, 未来有必要开展大规模、多中心的前瞻性研究, 以验证该模型在CAG人群中的预测效能.
慢性萎缩性胃炎(chronic atrophic gastritis, CAG)是癌前疾病, 其发展过程涉及一系列的病理生理变化. 对CAG患者的胃癌风险的精准评估至关重要. 胃镜监测因其有创性难以广泛应用, 因此, 基于实验室指标量化CAG人群中胃癌的风险有重要意义.
目前缺乏血细胞比值对CAG人群中胃癌风险的预测的研究. 构建基于血细胞比值的列线图模型, 有助于提高对CAG患者胃癌风险的预测精度, 从而提升临床诊疗决策的科学性.
本研究旨在构建一个基于血细胞比值的列线图预测模型, 用于评估CAG人群的胃癌风险.
本研究采用回顾性分析方法, 收集CAG患者的临床数据和血液学检查结果. 通过多变量Cox回归分析筛选出与胃癌风险显著相关的血细胞比值指标, 并基于这些变量构建列线图预测模型. 模型的性能通过一致性指数和校准曲线进行评估, 验证模型的预测能力和适用性.
实验结果显示, 血红蛋白/红细胞分布宽度比值和淋巴细胞/单核细胞比值与CAG患者的胃癌风险显著相关, 基于该两者构建的列线图模型表现出较高的预测准确性和良好的校准效果, 验证了该模型在胃癌风险评估中的潜在应用价值.
本研究构建的列线图预测模型表明, 血细胞比值可以作为CAG患者胃癌风险的有效预测因子. 通过综合考虑血细胞比值与其他临床因素的关联性, 模型能够有效预测个体化胃癌风险, 有望为临床提供一种简便而有效的风险评估工具.
未来, 本模型可通过多中心、大样本的数据验证其在不同人群中的适用性, 进一步优化模型精度和泛化能力, 有助于实现胃癌的个体化预防和早期干预.
| 1. | Bray F, Laversanne M, Sung H, Ferlay J, Siegel RL, Soerjomataram I, Jemal A. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024;74:229-263. [PubMed] [DOI] |
| 2. | Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71:209-249. [PubMed] [DOI] |
| 3. | Shichijo S, Hirata Y, Niikura R, Hayakawa Y, Yamada A, Ushiku T, Fukayama M, Koike K. Histologic intestinal metaplasia and endoscopic atrophy are predictors of gastric cancer development after Helicobacter pylori eradication. Gastrointest Endosc. 2016;84:618-624. [PubMed] [DOI] |
| 4. | Pimentel-Nunes P, Libânio D, Marcos-Pinto R, Areia M, Leja M, Esposito G, Garrido M, Kikuste I, Megraud F, Matysiak-Budnik T, Annibale B, Dumonceau JM, Barros R, Fléjou JF, Carneiro F, van Hooft JE, Kuipers EJ, Dinis-Ribeiro M. Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED) guideline update 2019. Endoscopy. 2019;51:365-388. [PubMed] [DOI] |
| 5. | Shah SC, Piazuelo MB, Kuipers EJ, Li D. AGA Clinical Practice Update on the Diagnosis and Management of Atrophic Gastritis: Expert Review. Gastroenterology. 2021;161:1325-1332.e7. [PubMed] [DOI] |
| 6. | Tanabe S, Ishido K, Matsumoto T, Kosaka T, Oda I, Suzuki H, Fujisaki J, Ono H, Kawata N, Oyama T, Takahashi A, Doyama H, Kobayashi M, Uedo N, Hamada K, Toyonaga T, Kawara F, Tanaka S, Yoshifuku Y. Long-term outcomes of endoscopic submucosal dissection for early gastric cancer: a multicenter collaborative study. Gastric Cancer. 2017;20:45-52. [PubMed] [DOI] |
| 7. | Zhao W, Yao Z, Cao J, Liu Y, Zhu L, Mao B, Cui F, Shao S. Helicobacter pylori upregulates circPGD and promotes development of gastric cancer. J Cancer Res Clin Oncol. 2024;150:104. [PubMed] [DOI] |
| 8. | Kumarasamy C, Tiwary V, Sunil K, Suresh D, Shetty S, Muthukaliannan GK, Baxi S, Jayaraj R. Prognostic Utility of Platelet-Lymphocyte Ratio, Neutrophil-Lymphocyte Ratio and Monocyte-Lymphocyte Ratio in Head and Neck Cancers: A Detailed PRISMA Compliant Systematic Review and Meta-Analysis. Cancers (Basel). 2021;13. [PubMed] [DOI] |
| 9. | Mei P, Feng W, Zhan Y, Guo X. Prognostic value of lymphocyte-to-monocyte ratio in gastric cancer patients treated with immune checkpoint inhibitors: a systematic review and meta-analysis. Front Immunol. 2023;14:1321584. [PubMed] [DOI] |
| 10. | Coradduzza D, Medici S, Chessa C, Zinellu A, Madonia M, Angius A, Carru C, De Miglio MR. Assessing the Predictive Power of the Hemoglobin/Red Cell Distribution Width Ratio in Cancer: A Systematic Review and Future Directions. Medicina (Kaunas). 2023;59. [PubMed] [DOI] |
| 11. | Su YC, Wen SC, Li CC, Su HC, Ke HL, Li WM, Lee HY, Li CY, Yang SF, Tu HP, Wu WJ, Yeh HC. Low Hemoglobin-to-Red Cell Distribution Width Ratio Is Associated with Disease Progression and Poor Prognosis in Upper Tract Urothelial Carcinoma. Biomedicines. 2021;9. [PubMed] [DOI] |
| 12. | Yamaguchi Y, Nagata Y, Hiratsuka R, Kawase Y, Tominaga T, Takeuchi S, Sakagami S, Ishida S. Gastric Cancer Screening by Combined Assay for Serum Anti-Helicobacter pylori IgG Antibody and Serum Pepsinogen Levels--The ABC Method. Digestion. 2016;93:13-18. [PubMed] [DOI] |
| 13. | Cai Q, Zhu C, Yuan Y, Feng Q, Feng Y, Hao Y, Li J, Zhang K, Ye G, Ye L, Lv N, Zhang S, Liu C, Li M, Liu Q, Li R, Pan J, Yang X, Zhu X, Li Y, Lao B, Ling A, Chen H, Li X, Xu P, Zhou J, Liu B, Du Z, Du Y, Li Z; Gastrointestinal Early Cancer Prevention & Treatment Alliance of China (GECA). Development and validation of a prediction rule for estimating gastric cancer risk in the Chinese high-risk population: a nationwide multicentre study. Gut. 2019;68:1576-1587. [PubMed] [DOI] |
| 14. | Tu H, Sun L, Dong X, Gong Y, Xu Q, Jing J, Bostick RM, Wu X, Yuan Y. A Serological Biopsy Using Five Stomach-Specific Circulating Biomarkers for Gastric Cancer Risk Assessment: A Multi-Phase Study. Am J Gastroenterol. 2017;112:704-715. [PubMed] [DOI] |
| 15. | Liu XM, Ma XY, Liu F, Liu ZL, Tang XY, Ji MZ, Zheng JX. Gastric Cancer Screening Methods: A Comparative Study of the Chinese New Gastric Cancer Screening Score and Kyoto Classification of Gastritis. Gastroenterol Res Pract. 2022;2022:7639968. [PubMed] [DOI] |
| 16. | Schlemper RJ, Riddell RH, Kato Y, Borchard F, Cooper HS, Dawsey SM, Dixon MF, Fenoglio-Preiser CM, Fléjou JF, Geboes K, Hattori T, Hirota T, Itabashi M, Iwafuchi M, Iwashita A, Kim YI, Kirchner T, Klimpfinger M, Koike M, Lauwers GY, Lewin KJ, Oberhuber G, Offner F, Price AB, Rubio CA, Shimizu M, Shimoda T, Sipponen P, Solcia E, Stolte M, Watanabe H, Yamabe H. The Vienna classification of gastrointestinal epithelial neoplasia. Gut. 2000;47:251-255. [PubMed] [DOI] |
| 17. | Dixon MF. Gastrointestinal epithelial neoplasia: Vienna revisited. Gut. 2002;51:130-131. [PubMed] [DOI] |
| 18. | Vickers AJ, Elkin EB. Decision curve analysis: a novel method for evaluating prediction models. Med Decis Making. 2006;26:565-574. [PubMed] [DOI] |
| 19. | Ohata H, Kitauchi S, Yoshimura N, Mugitani K, Iwane M, Nakamura H, Yoshikawa A, Yanaoka K, Arii K, Tamai H, Shimizu Y, Takeshita T, Mohara O, Ichinose M. Progression of chronic atrophic gastritis associated with Helicobacter pylori infection increases risk of gastric cancer. Int J Cancer. 2004;109:138-143. [PubMed] [DOI] |
| 20. | Li H, Wei Z, Wang C, Chen W, He Y, Zhang C. Gender Differences in Gastric Cancer Survival: 99,922 Cases Based on the SEER Database. J Gastrointest Surg. 2020;24:1747-1757. [PubMed] [DOI] |
| 21. | Usui Y, Taniyama Y, Endo M, Koyanagi YN, Kasugai Y, Oze I, Ito H, Imoto I, Tanaka T, Tajika M, Niwa Y, Iwasaki Y, Aoi T, Hakozaki N, Takata S, Suzuki K, Terao C, Hatakeyama M, Hirata M, Sugano K, Yoshida T, Kamatani Y, Nakagawa H, Matsuda K, Murakami Y, Spurdle AB, Matsuo K, Momozawa Y. Helicobacter pylori, Homologous-Recombination Genes, and Gastric Cancer. N Engl J Med. 2023;388:1181-1190. [PubMed] [DOI] |
| 22. | Malfertheiner P, Camargo MC, El-Omar E, Liou JM, Peek R, Schulz C, Smith SI, Suerbaum S. Helicobacter pylori infection. Nat Rev Dis Primers. 2023;9:19. [PubMed] [DOI] |
| 23. | Chen DS, Mellman I. Elements of cancer immunity and the cancer-immune set point. Nature. 2017;541:321-330. [PubMed] [DOI] |
| 24. | Bausch D, Pausch T, Krauss T, Hopt UT, Fernandez-del-Castillo C, Warshaw AL, Thayer SP, Keck T. Neutrophil granulocyte derived MMP-9 is a VEGF independent functional component of the angiogenic switch in pancreatic ductal adenocarcinoma. Angiogenesis. 2011;14:235-243. [PubMed] [DOI] |
| 25. | Tecchio C, Cassatella MA. Neutrophil-derived chemokines on the road to immunity. Semin Immunol. 2016;28:119-128. [PubMed] [DOI] |
| 26. | Ferrone C, Dranoff G. Dual roles for immunity in gastrointestinal cancers. J Clin Oncol. 2010;28:4045-4051. [PubMed] [DOI] |
| 27. | Barbetta A, Nobel TB, Sihag S, Hsu M, Tan KS, Bains MS, Isbell JM, Janjigian YY, Wu AJ, Bott MJ, Jones DR, Molena D. Neutrophil to Lymphocyte Ratio as Predictor of Treatment Response in Esophageal Squamous Cell Cancer. Ann Thorac Surg. 2018;106:864-871. [PubMed] [DOI] |
| 28. | Sun Y, Zhang L. The clinical use of pretreatment NLR, PLR, and LMR in patients with esophageal squamous cell carcinoma: evidence from a meta-analysis. Cancer Manag Res. 2018;10:6167-6179. [PubMed] [DOI] |
| 29. | Chen L, Chen Y, Zhang L, Xue Y, Zhang S, Li X, Song H. In Gastric Cancer Patients Receiving Neoadjuvant Chemotherapy Systemic Inflammation Response Index is a Useful Prognostic Indicator. Pathol Oncol Res. 2021;27:1609811. [PubMed] [DOI] |
| 30. | Peng D, Li ZW, Liu F, Liu XR, Wang CY. Predictive value of red blood cell distribution width and hematocrit for short-term outcomes and prognosis in colorectal cancer patients undergoing radical surgery. World J Gastroenterol. 2024;30:1714-1726. [PubMed] [DOI] |
| 31. | Li Y, Li Z, Zhang G. Clinical Utility of Red Blood Cell Distribution Width for the Diagnosis and Prognosis of Cervical Cancer. Int J Gen Med. 2022;15:2597-2606. [PubMed] [DOI] |
| 32. | Zhang X, Tan X, Li J, Wei Z. Relationship between certain hematological parameters and risk of breast cancer. Future Oncol. 2022;18:3409-3417. [PubMed] [DOI] |
| 33. | Petrella F, Casiraghi M, Radice D, Prisciandaro E, Rizzo S, Spaggiari L. Prognostic Value of Red Blood Cell Distribution Width in Resected pN1 Lung Adenocarcinoma. Cancers (Basel). 2020;12. [PubMed] [DOI] |
| 34. | Liou JM, Malfertheiner P, Lee YC, Sheu BS, Sugano K, Cheng HC, Yeoh KG, Hsu PI, Goh KL, Mahachai V, Gotoda T, Chang WL, Chen MJ, Chiang TH, Chen CC, Wu CY, Leow AH, Wu JY, Wu DC, Hong TC, Lu H, Yamaoka Y, Megraud F, Chan FKL, Sung JJ, Lin JT, Graham DY, Wu MS, El-Omar EM; Asian Pacific Alliance on Helicobacter and Microbiota (APAHAM). Screening and eradication of Helicobacter pylori for gastric cancer prevention: the Taipei global consensus. Gut. 2020;69:2093-2112. [PubMed] [DOI] |
| 35. | Schubert ML, Peura DA. Control of gastric acid secretion in health and disease. Gastroenterology. 2008;134:1842-1860. [PubMed] [DOI] |
| 36. | Fan X, Qin X, Zhang Y, Li Z, Zhou T, Zhang J, You W, Li W, Pan K. Screening for gastric cancer in China: Advances, challenges and visions. Chin J Cancer Res. 2021;33:168-180. [PubMed] [DOI] |
| 37. | Hirabayashi M, Georges D, Clifford GM, de Martel C. Estimating the Global Burden of Epstein-Barr Virus-Associated Gastric Cancer: A Systematic Review and Meta-Analysis. Clin Gastroenterol Hepatol. 2023;21:922-930.e21. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁