修回日期: 2025-04-23
接受日期: 2025-05-19
在线出版日期: 2025-05-28
胆管吻合口狭窄是肝移植术后常见并发症, 严重影响患者预后.
对于中高位胆管狭窄或胆管严重狭窄导致内镜逆行胰胆管造影术(endoscopic retrograde cholangiopancreatography, ERCP)插管困难的患者, 本文报道了3例采用经皮经肝穿刺置入导丝联合ERCP(会师技术)成功治疗的病例. ERCP治疗失败后, 通过经肝穿刺胆道引流术(percutaneous transhepatic cholangial drainage, PTCD)置入导丝并成功穿越狭窄区域, 再联合ERCP完成支架置入.
会师技术能显著提高中高位胆管狭窄或胆管严重狭窄ERCP置入支架的成功率, 降低继发胰腺炎发生率以及出血、感染等风险, 改善患者生活质量. 因此, 会师技术应作为肝移植术后中高位胆管狭窄或胆管严重狭窄的替代治疗方案, 在临床实践中广泛推广和应用.
核心提要: 对于肝移植后中高位胆管狭窄或胆管严重狭窄导致内镜逆行胰胆管造影术(endoscopic retrograde cholangiopancreatography, ERCP)插管困难的患者, 采用经皮经肝穿刺置入导丝联合ERCP(会师技术), 能显著提高中高位胆管狭窄或胆管严重狭窄ERCP置入支架的成功率, 降低胰腺炎发生率. 因此, 会师技术在临床实践中广泛推广和应用.
引文著录: 张雨航, 张文杰, 徐庆祥, 刘洋, 彭赵宏, 鲍峻峻, 孙倍成. 经皮经肝穿刺置入导丝联合ERCP治疗肝移植术后胆管吻合口狭窄3例报告. 世界华人消化杂志 2025; 33(5): 423-428
Revised: April 23, 2025
Accepted: May 19, 2025
Published online: May 28, 2025
Biliary anastomotic stenosis is a common complication after liver transplantation, seriously affecting the prognosis of patients.
In three patients with difficult endoscopic retrograde cholangiopancreatography (ERCP) intubation caused by middle and high bile duct stenosis or severe bile duct stenosis, successful treatment with percutaneous transhepatic insertion of guide wire combined with ERCP (realignment technique) was achieved. After the failure of ERCP treatment, the guide wire was inserted through percutaneous transhepatic cholangial drainage (PTCD) and successfully passed through the stenosis area. Subsequently, ERCP was combined to complete stent implantation.
The realignment technique can significantly improve the success rate of ERCP stent placement in middle and high bile duct stenosis or severe bile duct stenosis, and reduce the incidence of secondary pancreatitis and the risk of bleeding and infection, thus improving the quality of life of patients. Therefore, the realignment technique should be widely promoted and applied in clinical practice as an alternative treatment for middle and high bile duct stenosis or severe bile duct stenosis after liver transplantation.
- Citation: Zhang YH, Xu QX, Liu Y, Peng ZH, Bao JJ, Sun BC, Zhang WJ. Percutaneous transhepatic insertion of guide wire combined with ERCP for treatment of biliary anastomotic stenosis after liver transplantation: Report of three cases. Shijie Huaren Xiaohua Zazhi 2025; 33(5): 423-428
- URL: https://www.wjgnet.com/1009-3079/full/v33/i5/423.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i5.423
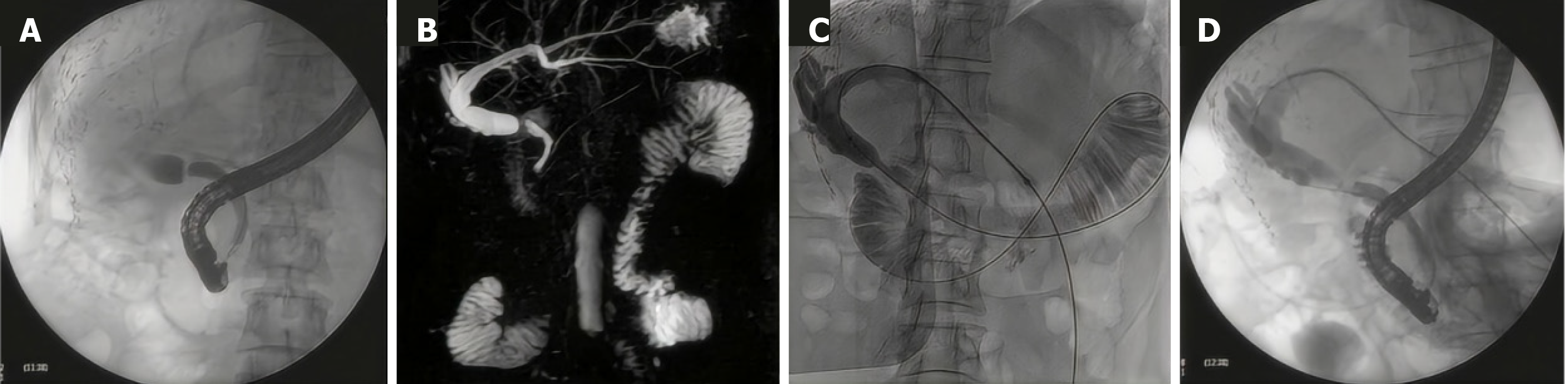
胆管吻合口狭窄作为肝移植术后最为常见的并发症之一, 是导致肝功能衰竭及受体死亡的重要因素. 据研究统计, 其发病率介于4%-9%之间[1]. 目前, 针对胆管吻合口狭窄的治疗方法主要包括治疗性内镜逆行胰胆管造影术(endoscopic retrograde cholangiopancreatography, ERCP)、经皮经肝穿刺胆道引流术(percutaneous transhepatic cholangial drainage, PTCD)以及外科手术[2], 其中ERCP被广泛视为首选治疗方案[3-5]. 然而, 对于部分中高位胆管狭窄或胆管狭窄程度较为严重的患者, ERCP插管可能无法顺利通过狭窄部位, 并增加了产生急性胰腺炎的风险. 此时, 可联合应用PTCD技术, 通过顺行方式插入导丝穿越狭窄区域, 采用会师技术[6], 从而成功实现ERCP插管, 解决胆管狭窄问题(图1). 但该技术在临床上应用并不广泛. 本文旨在报道3例ERCP插管未获成功的病例, 详细阐述了采用经皮经肝穿刺置入导丝联合ERCP(即会师技术)治疗肝移植术后胆管狭窄患者的诊疗过程.
病例1: 患者, 女性, 48岁, 因"检查发现肝功能异常2 wk"于2024-10-08入院.
病例2: 患者, 女性, 50岁, 因"腹胀伴间断性腹痛1 mo余"于2024-08-26入院.
病例3: 患者, 女性, 15岁, 因"皮肤及巩膜黄染1 mo余"入院.
病例1: 患者2 wk前于我院检查发现肝功能异常, 谷丙转氨酶(alanine transaminase, ALT)119 U/L, 天冬氨酸转氨酶(aspartate transaminase, AST)120 U/L, 碱性磷酸酶(alkaline phosphatase, ALP)338 U/L, 谷氨酰转移酶(gamma-glutamyl transferase, GGT)205 U/L, 总胆红素20.6 mmol/L, 直接胆红素13.9 mmol/L.伴有皮肤瘙痒, 无皮肤、巩膜黄染, 无腹痛、腹胀, 为求进一步诊治, 门诊以"肝功能异常"收入我科. 病程中, 患者神清、精神可, 饮食、夜眠正常, 体重无明显变化, 大小便无特殊.
病例2: 患者1 mo余前因肝移植后胆管吻合口狭窄入院置入支架治疗, 术后出现腹胀伴间断性腹痛, 伴有皮肤、巩膜黄染及小便发黄, 查肝功能示: ALT 69.8 U/L, AST 48.8U/L, ALP 412.9 U/L, GGT 345.5 U/L, 总胆红素235.25 mmol/L, 直接胆红素140.58 mmol/L. 为求进一步诊治, 门诊以"肝移植术后胆道吻合口狭窄并发胆管炎"收入我科. 病程中, 患者神清、精神可, 饮食、夜眠尚可, 体重无明显变化, 大便无特殊.
病例3: 患者1 mo余前出现皮肤及巩膜黄染, 伴有小便发黄, 皮肤无瘙痒, 查肝功能示: ALT 371.0 U/L, AST 256.1 U/L, ALP 332.7 U/L, GGT 143.0 U/L, 总胆红素107.54 mmol/L, 直接胆红素69.54 mmol/L. 为求进一步诊治, 门诊以"肝移植术后胆道吻合口狭窄并发胆管炎"收入我科. 病程中, 患者神清、精神可, 饮食、夜眠尚可, 体重无明显变化, 大便无特殊.
病例1: 患者因"乙型肝炎后肝硬化失代偿期"于2024-02-01在本院成功接受同种异体经典原位肝移植术, 术中采用胆管对胆管端端吻合方式. 手术历时700 min, 无肝期48 min, 过程顺利. 患者于2024-03-20顺利出院.
病例2: 2023-10-18因"慢加急性肝衰竭、原发性胆汁性肝硬化及自身免疫性肝炎后肝硬化"在本院接受不带肝中静脉的活体右半肝背驮式肝移植术. 术中采用胆管对胆管端端吻合方式, 手术过程顺利, 总时长420 min, 无肝期35 min. 患者术后恢复良好, 于2024-12-04顺利出院. 2024-07-10, 患者因肝移植后胆管吻合口狭窄再次入院, 并在本院成功置入支架.
病例3: 2024-04-07因"肝母细胞瘤"在本院接受活体扩大左外叶供肝肝移植术, 术中采用胆管对胆管端端吻合方式. 手术过程顺利, 总时长435 min. 患者术后恢复良好, 于2024-05-21顺利出院.
病例1-3: 生于原籍, 否认长期外地居住史, 否认毒物接触史. 无吸烟、饮酒史. 家族中否认遗传性疾病及类似病史.
病例1: 腹平坦, 上腹部可见陈旧性手术瘢痕, 未见腹壁静脉曲张, 未见胃型蠕动波, 未见肠蠕动波. 腹部柔软, 全腹无明显压痛、反跳痛. 肝脏肋下未触及, 脾脏肋下未触及, 腹部移动性浊音阴性. 肠鸣音未见异常.
病例2: 皮肤、巩膜黄染, 体温正常, 腹平坦, 上腹部可见陈旧性手术瘢痕, 未见腹壁静脉曲张, 未见胃型蠕动波, 未见肠蠕动波. 腹部柔软, 右上腹有压痛, 全腹无明显反跳痛. 肝脏肋下未触及, 脾脏肋下未触及, 腹部移动性浊音阴性. 肠鸣音未见异常.
病例3: 皮肤、巩膜黄染, 体温正常, 腹平坦, 上腹部可见陈旧性手术瘢痕, 未见腹壁静脉曲张, 未见胃型蠕动波, 未见肠蠕动波. 腹部柔软, 全腹无明显压痛、反跳痛. 肝脏肋下未触及, 脾脏肋下未触及, 腹部移动性浊音阴性. 肠鸣音未见异常.
病例1: 2024-09-25肝功能: ALT 119 U/L, AST 120 U/L, ALP 338 U/L, GGT 205 U/L, 总胆红素20.6 mmol/L, 直接胆红素13.9 mmol/L. 2024-10-08肝功能: ALT 68.4 U/L, AST 83.1 U/L, ALP 344.2 U/L, GGT 200.8 U/L, 总胆红素21.61 mmol/L, 直接胆红素11.61 mmol/L.
病例2: 肝功能: ALT 69.8 U/L, AST 48.8 U/L, ALP 412.9 U/L, GGT 345.5 U/L, 总胆红素235.25 mmol/L, 直接胆红素140.58 mmol/L.
病例3: 肝功能: ALT 371.0 U/L, AST 256.1 U/L, ALP 332.7 U/L, GGT 143.0 U/L, 总胆红素107.54 mmol/L, 直接胆红素69.54 mmol/L.
病例1: 肝脏核磁共振胰胆管成像(magnetic resonance cholangiopancreatography, MRCP)检查, 发现胆管吻合口狭窄, 胆总管走行迂曲、稍扩张.
病例2: 肝脏MRCP检查, 结果显示肝内胆管扩张, 胆管吻合口处胆管显影不清, 管腔狭窄.
病例3: 胆道造影, 提示胆管吻合口处可见一线样狭窄.
肝移植术后胆道吻合口狭窄.
肝移植术后胆道吻合口狭窄并发胆管炎.
患者于2024-10-12接受ERCP治疗. 术中导丝无法通过狭窄部. 由于ERCP置入支架无法直接完成, 患者于2024-10-17接受PTCD治疗, 于左肝胆管内置入引流管, 引流通畅. 2024-10-18, 患者复查肝功能, 结果显示肝功能指标有所改善: ALT 38.3 U/L, AST 31.2 U/L, ALP 266.2 U/L, GGT 163.5 U/L, 总胆红素16.33 mmol/L, 直接胆红素6.09 mmol/L. 同日上午, 患者行胆道狭窄球囊扩张及引流管置入术. 术中, 经原引流管造影, 提示肝内胆管扩张、胆总管吻合口段狭窄. 随后, 经导丝于狭窄处置入球囊进行扩张. 扩张完毕后, 将导丝留置于肠腔, 以备ERCP置入胆道支架. 支架植入完毕后, 再在数字减影-血管造影(digital subtraction angiography, DSA)引导下, 于胆管内置入胆道外引流管. 手术顺利, 引流通畅. 同日下午, 患者再次接受ERCP术. 术中透视见经皮穿刺导丝已在肠腔成圈. 沿导丝置入探条通过吻合口, 放置塑料支架进行引流并固定支架.
2024-08-28尝试行ERCP, 但导丝在直视下反复探插均无法通过吻合口. 2024-09-03行肝脏MRCP检查, 结果显示肝内胆管扩张, 胆管吻合口处胆管显影不清, 管腔狭窄. 鉴于胆道吻合口狭窄导致ERCP置入支架无法直接完成, 遂于2024-09-06行PTCD, 术中胆道造影显示肝内外胆管扩张, 胆总管中上段梗阻. 随后利用导丝导管技术越过胆总管中段狭窄处, 将鞘管留置于狭窄远端. 同日下午, 患者再次行ERCP, 术中自穿刺鞘管置入导丝并自开口插出, 探条对接后, 沿导丝置入深条通过吻合口, 成功在右前叶放置改制支架及塑料支架.
2024-07-10, 患者接受ERCP治疗, 但导丝反复尝试超选后, 位置无法确定, 操作遂结束. 2024-07-11, 患者行经皮移植肝胆管穿刺置管术, 引流通畅. 2024-07-17, 经原PTCD管行胆道造影, 提示胆管吻合口处可见一线样狭窄. 随后, 在DSA引导下, 利用导丝导管技术成功越过胆管狭窄处, 留置鞘管和导管导丝, 并妥善固定. 同日, 患者再次接受ERCP术, 于内镜下完成胆管导丝对接、胆管扩张及支架置入.
2024-10-21, 患者复查肝功能, 结果显示肝功能较前明显好转: ALT 24.9 U/L, AST 29.5 U/L, ALP 231.0 U/L, GGT 136.8 U/L, 总胆红素14.80 mmol/L, 直接胆红素5.33 mmol/L.
2024-09-11复查肝功能, 结果显示: ALT 16.4 U/L, AST 14.1 U/L, ALP 208.0 U/L, GGT 201.1 U/L, 总胆红素38.87 mmol/L, 直接胆红素16.4 mmol/L, 肝功能较前明显好转.
2024-07-18, 患者行常规肝功能复查, 结果显示: ALT 47.2 U/L, AST 28.1 U/L, ALP 288.7 U/L, GGT 118.7 U/L, 总胆红素30.19 mmol/L, 直接胆红素13.97 mmol/L. 患者黄疸症状较前明显减轻, 肝功能显著好转.
肝移植是目前治疗各种终末期肝病唯一有效的方法[7,8], 但是术后的各种并发症仍对患者术后生活质量和长期存活均有较大的影响, 也是导致手术失败和再次移植的重要原因. 胆道并发症是肝移植术后患者最常见的并发症之一, 其发生率为5%-20%[1], 被称为肝移植的"阿喀琉斯之踵"[9], 可导致长期重复治疗甚至是死亡. 胆道并发症中胆道狭窄的总发生率高达10%-37%, 并且吻合口狭窄占据了胆道狭窄的绝大多数[10-12]. 吻合口狭窄在肝移植术后的任何时间均可发生, 但主要出现于肝移植术后12 mo内[13], 其危险因素主要与手术技术、动脉并发症或胆管局部缺血、胆道重建类型等相关. 更有研究指出供体年龄是吻合口狭窄发生的独立危险因素, 老年供体的使用, 往往伴随着更多胆道并发症的出现[14].
胆道狭窄通常采用内镜治疗、PTCD或手术治疗, 内镜治疗创伤小, 疗效确切, 一般可作为治疗的首选方法[15]. 现在普遍提倡内镜下球囊扩张结合胆道支架放置, 对于一些由于术后水肿和炎症导致的早期吻合口狭窄, 可以仅通过球囊扩张来治疗. 但是针对一些胆管吻合口严重狭窄或高位胆管狭窄的患者, 单纯的ERCP治疗很难发挥作用, 导丝反复探插无法通过狭窄部位, 使得治疗无法顺利完成, 并增加了产生急性胰腺炎的风险. 虽然与无肝移植病史患者相比, 肝移植后患者胰腺炎发生率较低, 但其死亡率明显更高, 预后更差[16].
随着内镜技术的成熟和推广, 括约肌切开术已经成为内镜诊疗的基本操作之一. 为了方便内镜下胆道插管造影、支架植入、放置引流等, Oddi括约肌通常需要被切开, 括约肌被破坏后势必会对患者胆道功能造成影响. 括约肌功能的丧失意味着抗反流机制的消失, 十二指肠液因此得以反流到胆胰管, 并随之带来激活的消化酶和肠道菌群污染. 肠液反流、消化酶的活化、细菌污染破坏了胆胰管正常的生理环境, 胆管壁可存在不同程度的慢性炎症改变和纤维化, 这可能会进一步加重患者胆管狭窄的程度.
胆囊结石是肝胆外科常见疾病, 很多患者往往合并有胆总管结石, 临床上针对这类患者, 常采用一期ERCP取石, 二期再行腹腔镜胆囊切除术(laparoscopic cholecystectomy, LC)治疗, 但ERCP术后常引起高淀粉酶血症、急性胆管炎、急性胰腺炎和Oddi括约肌的破坏, 也有可能导致结石残留[17]. 近年来, LC联合术中ERCP取石的应用, 取得了较好的疗效. 该技术通过LC术中先由胆囊管置入导丝至十二指肠, 再由十二指肠镜医师常规插镜至十二指肠乳头, 夹住导丝, 经十二指肠拉出导丝, 经导丝置入造影导管, 进入胆总管, 完成相关操作. 术中ERCP因其由导丝牵引进入胆总管, 避免了高淀粉酶血症和急性胰腺炎的产生, 保护了Oddi括约肌的功能, 且能直接造影, 避免了结石残留[18].
我们借鉴通过LC置入导丝联合术中ERCP取石这种方法, 对于胆管吻合口严重狭窄或高位胆管狭窄的患者, 当常规ERCP插管不成功时, 我们采用经皮经肝穿刺置入导丝联合ERCP(即会师技术)进行治疗. 此联合疗法不仅能显著提高ERCP置入支架的成功率, 还能有效降低急性胰腺炎的发生率. 在具体实施联合治疗时, 应首先进行PTCD, 因为PTCD的入路部位与胆道狭窄距离较近并且PTCD导管的进入方向与狭窄胆管的走行一致, 有利于导管在稳定的支撑下穿越狭窄的胆道. 随后, 可根据患者的临床情况, 灵活运用多种介入设备和技术进行针对性治疗[19-21]. 随着介入技术和数字减影套件的不断发展, 这一手术过程的安全性也得到了进一步提升[22]. 当PTCD导丝成功插入后, 狭窄段的一端会变得更易辨识, 其尖端位置更加清晰, 这有助于我们准确选择导丝来突破狭窄段, 导丝需选择超滑或超硬类型以穿透狭窄段, 从而顺利完成插管, 并在狭窄部位放置支架, 取得显著的治疗效果. 在第一步PTCD穿刺寻找到胆道狭窄部位到第二步由PTCD和ERCP配合将支架置入狭窄部位过程中, 失败尝试可能多次发生, 操作需要内镜医师与介入医师的密切配合, 对导丝操控、圈套技术等经验要求较高, 甚至需要反复操作. 更有研究指出, 对于狭窄时间超过1 mo, 闭塞区超过1.5 cm的受者要慎重选择. 因为其术中导丝穿过狭窄断困难, 无法到达同一腔隙, 导致手术失败[23].
综上所述, 会师技术已在肝移植术后中高位胆管狭窄或胆管严重狭窄的治疗中展现出显著疗效, 避免了传统开腹行胆肠吻合术所带来的严重创伤. 它不仅能有效提升ERCP胆管支架置入的成功率, 还能降低ERCP后胰腺炎的发生率以及出血、感染等风险. 并且通过支架置入等方式恢复胆汁生理流向, 改善患者生活质量, 避免了长期单纯PTCD外引流易导致电解质紊乱和消化功能减退. 该技术可在术中根据患者解剖特点选择不同的会师路径, 如导丝胆道内会师、肠腔内会师或腹腔内会师, 更进一步增加了其成功率. 因此, 会师技术应被视为高位胆管狭窄或胆管严重狭窄治疗中一种具有前瞻性的替代治疗方案, 值得在临床实践中广泛推广和应用.
学科分类: 胃肠病学和肝病学
手稿来源地: 安徽省
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): B, B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 刘继红 制作编辑:郑晓梅
| 1. | Magro B, Tacelli M, Mazzola A, Conti F, Celsa C. Biliary complications after liver transplantation: current perspectives and future strategies. Hepatobiliary Surg Nutr. 2021;10:76-92. [PubMed] [DOI] |
| 2. | Arain MA, Attam R, Freeman ML. Advances in endoscopic management of biliary tract complications after liver transplantation. Liver Transpl. 2013;19:482-498. [PubMed] [DOI] |
| 3. | Asge Standards of Practice Committee, Buxbaum JL, Freeman M, Amateau SK, Chalhoub JM, Chowdhury A, Coelho-Prabhu N, Das R, Desai M, Elhanafi SE, Forbes N, Fujii-Lau LL, Kohli DR, Kwon RS, Machicado JD, Marya NB, Pawa S, Ruan WH, Sadik J, Sheth SG, Thiruvengadam NR, Thosani NC, Zhou S, Qumseya BJ, ; (ASGE Standards of Practice Committee Chair). American Society for Gastrointestinal Endoscopy guideline on post-ERCP pancreatitis prevention strategies: methodology and review of evidence. Gastrointest Endosc. 2023;97:163-183.e40. [PubMed] [DOI] |
| 4. | Kohli DR, Amateau SK, Desai M, Chinnakotla S, Harrison ME, Chalhoub JM, Coelho-Prabhu N, Elhanafi SE, Forbes N, Fujii-Lau LL, Kwon RS, Machicado JD, Marya NB, Pawa S, Ruan W, Sheth SG, Thiruvengadam NR, Thosani NC, Qumseya BJ; (ASGE Standards of Practice Committee Chair). American Society for Gastrointestinal Endoscopy guideline on management of post-liver transplant biliary strictures: summary and recommendations. Gastrointest Endosc. 2023;97:607-614. [PubMed] [DOI] |
| 5. | Elmunzer BJ, Maranki JL, Gómez V, Tavakkoli A, Sauer BG, Limketkai BN, Brennan EA, Attridge EM, Brigham TJ, Wang AY. ACG Clinical Guideline: Diagnosis and Management of Biliary Strictures. Am J Gastroenterol. 2023;118:405-426. [PubMed] [DOI] |
| 6. | Bai Y, Qi CC, Cheng CL, Zhang YM. Treatment of bile-duct anastomotic stricture after liver transplantation with the rendezvous technique. Asian J Surg. 2022;45:2840-2841. [PubMed] [DOI] |
| 7. | Schwenk L, Rauchfuß F, Ali-Deeb A, Dondorf F, Rohland O, Ardelt M, Settmacher U. [Individualized curative treatment for malignant diseases through liver transplantation]. Chirurgie (Heidelb). 2024;95:122-128. [PubMed] [DOI] |
| 9. | Amateau SK, Kohli DR, Desai M, Chinnakotla S, Harrison ME, Chalhoub JM, Coelho-Prabhu N, Elhanafi SE, Forbes N, Fujii-Lau LL, Kwon RS, Machicado JD, Marya NB, Pawa S, Ruan W, Sheth SG, Thiruvengadam NR, Thosani NC, Qumseya BJ; (ASGE Standards of Practice Committee Chair). American Society for Gastrointestinal Endoscopy guideline on management of post-liver transplant biliary strictures: methodology and review of evidence. Gastrointest Endosc. 2023;97:615-637.e11. [PubMed] [DOI] |
| 10. | DaVee T, Geevarghese SK, Slaughter JC, Yachimski PS. Refractory anastomotic bile leaks after orthotopic liver transplantation are associated with hepatic artery disease. Gastrointest Endosc. 2017;85:984-992. [PubMed] [DOI] |
| 11. | Egea Valenzuela J, Jijón Crespín R, Serrano Jiménez A, Alberca de Las Parras F. Endoscopic retrograde cholangiopancreatography in the management of biliary complications after orthotopic liver transplantation. Rev Esp Enferm Dig. 2019;111:909-913. [PubMed] [DOI] |
| 12. | Chang JH, Lee I, Choi MG, Han SW. Current diagnosis and treatment of benign biliary strictures after living donor liver transplantation. World J Gastroenterol. 2016;22:1593-1606. [PubMed] [DOI] |
| 13. | Macías-Gómez C, Dumonceau JM. Endoscopic management of biliary complications after liver transplantation: An evidence-based review. World J Gastrointest Endosc. 2015;7:606-616. [PubMed] [DOI] |
| 14. | Lué A, Solanas E, Baptista P, Lorente S, Araiz JJ, Garcia-Gil A, Serrano MT. How important is donor age in liver transplantation? World J Gastroenterol. 2016;22:4966-4976. [PubMed] [DOI] |
| 15. | Ryu CH, Lee SK. Biliary strictures after liver transplantation. Gut Liver. 2011;5:133-142. [PubMed] [DOI] |
| 16. | Ghambari K, de Jong DM, Bruno MJ, Polak WG, van Driel LMJW, den Hoed CM. Risks of Post-Endoscopic Retrograde Cholangiopancreatography Pancreatitis After Liver Transplantation. Clin Transplant. 2024;38:e15399. [PubMed] [DOI] |
| 17. | Chen M, Wang L, Wang Y, Wei W, Yao YL, Ling TS, Shen YH, Zou XP. Risk factor analysis of post-ERCP cholangitis: A single-center experience. Hepatobiliary Pancreat Dis Int. 2018;17:55-58. [PubMed] [DOI] |
| 18. | Mallick R, Rank K, Ronstrom C, Amateau SK, Arain M, Attam R, Freeman ML, Harmon JV. Single-session laparoscopic cholecystectomy and ERCP: a valid option for the management of choledocholithiasis. Gastrointest Endosc. 2016;84:639-645. [PubMed] [DOI] |
| 19. | Na GH, Kim DG, Choi HJ, Han JH, Hong TH, You YK. Interventional treatment of a biliary stricture after adult right-lobe living-donor liver transplantation with duct-to-duct anastomosis. HPB (Oxford). 2014;16:312-319. [PubMed] [DOI] |
| 20. | Yoon HM, Kim JH, Ko GY, Song HY, Gwon DI, Sung KB. Alternative techniques for cannulation of biliary strictures resistant to the 0.035" system following living donor liver transplantation. Korean J Radiol. 2012;13:189-194. [PubMed] [DOI] |
| 21. | Kim EH, Lee HG, Oh JS, Chun HJ, Choi BG. Extraluminal Recanalization of Bile Duct Anastomosis Obstruction after Liver Transplantation. J Vasc Interv Radiol. 2018;29:1466-1471. [PubMed] [DOI] |
| 22. | Lorenz JM. Management of Malignant Biliary Obstruction. Semin Intervent Radiol. 2016;33:259-267. [PubMed] [DOI] |