修回日期: 2025-04-16
接受日期: 2025-05-08
在线出版日期: 2025-05-28
荷花碱(neferine, NeF)在多种肝损伤模型中可抑制肝毒性物质诱导的损伤及炎症反应, 或具抗酒精性肝损伤(alcoholic liver injury, ALI)潜力, 但其具体机制和效果需深入研究验证.
探讨NeF对ALI模型小鼠肝脏炎症和氧化应激的影响及其潜在机制.
将42只小鼠随机分为6组, 每组7只: 空白对照组(Control)、NeF对照组(NF)、ALI模型组(Model), 以及低、中、高剂量NeF干预组(Model+NeF-L、Model+NeF-M、Model+NeF-H). 通过慢性结合急性酒精喂养法构建ALI模型. 在ALI造模期间, 低、中、高剂量NeF干预组小鼠分别接受25、50、100 mg/kg NeF灌胃, 持续16 d. 实验结束后, 使用生化分析仪测定血清中丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase, AST)和碱性磷酸酶(alkaline phosphatase, ALP)的活性. 肝组织进行HE染色和油红O染色以观察组织形态学变化. 此外, 采用生化法测定肝组织中甘油三酯(triglycerides, TG)、丙二醛(malondialdehyde, MDA)、晚期氧化蛋白产物(advanced oxidation protein products, AOPP)含量及超氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)活性, 并通过ELISA法检测肝组织中4-羟基壬烯酸(4-hydroxynonenal, 4-HNE)、髓过氧化物酶(myeloperoxidase, MPO)、白介素1β(interleukin-1β, IL-1β)和肿瘤坏死因子α(tumor necrosis factor α, TNF-α)水平. 最后, 利用Western blot检测肝组织中核因子κB(nuclear factor-kappaB, NF-κB)、核因子E2相关因子2(nuclear factor E2-related factor, Nrf-2)和血红素氧合酶-1(heme oxygenase-1, HO-1)的表达.
与模型组相比, NeF干预组小鼠的血清中肝损伤指标(AST、ALT、ALP及TG)、肝组织中的氧化应激标志物(MDA、4-HNE和AOPP)以及炎症指标(MPO、IL-1β和TNF-α)均显著降低, 而抗氧化酶(SOD和CAT)活性则明显升高. 组织学结果显示, NeF干预治疗能够改善酒精诱导的肝损伤、脂肪变性和脂质蓄积等组织形态学改变. Western blot分析表明, 与模型组相比, NeF干预治疗可上调肝组织中Nrf-2和HO-1的表达并下调NF-κB表达. 上述结果均呈现剂量依赖性变化.
NeF通过抗氧化和抗炎作用改善酒精诱导的肝损伤, 其机制可能与其增强肝组织中Nrf-2/HO-1信号通路并抑制NF-κB信号通路有关.
核心提要: 荷花碱(neferine, NeF)作为一种有效的抗氧化剂和抗炎剂, 可以抑制酒精性肝损伤(alcoholic liver injury, ALI)小鼠肝脏中的氧化和炎症现象. 尽管本研究揭示了NeF的多重保护机制, 仍需进一步探讨其生物利用度及组织特异性分布. 未来研究可结合基因敲除模型验证关键信号节点的作用, 并通过结构修饰优化其药代动力学特性, 为其在ALI临床应用奠定基础.
引文著录: 蘧小红, 刘晓君. 荷花碱通过抑制氧化应激与炎症反应减轻酒精诱导的小鼠肝损伤. 世界华人消化杂志 2025; 33(5): 389-396
Revised: April 16, 2025
Accepted: May 8, 2025
Published online: May 28, 2025
Neferine (NeF) inhibits hepatotoxic substance-induced damage and inflammatory responses in various liver injury models and shows potential against alcoholic liver injury (ALI), but its specific mechanisms and efficacy require further in-depth research and validation.
To explore the effects of NeF on liver inflammation and oxidative stress in ALI model mice, and to investigate the underlying mechanisms.
Forty-two mice were randomly divided into six groups, with seven mice in each group: Blank control group (Control), NeF control group (NeF), ALI model group (Model), and low-, medium-, and high-dose NeF intervention groups (Model + NeF-L, Model + NeF-M, and Model + NeF-H, respectively). The ALI model was established using a chronic-plus-binge ethanol feeding method. During the 16-day modeling period, mice in the low-, medium-, and high-dose NeF intervention groups received intragastric administration of 25, 50, and 100 mg/kg NeF, respectively. Serum levels of alanine aminotransferase (ALT), aspartate aminotransferase (AST), and alkaline phosphatase (ALP) were measured using a biochemical analyzer. Liver tissues were subjected to HE staining and oil red O staining to observe morphological changes. Additionally, biochemical methods were used to determine the levels of triglycerides (TG), malondialdehyde (MDA), advanced oxidation protein products (AOPP), superoxide dismutase (SOD), and catalase (CAT) in liver tissues. ELISA was employed to detect the levels of 4-hydroxynonenal (4-HNE), myeloperoxidase (MPO), interleukin-1β (IL-1β), and tumor necrosis factor α (TNF-α) in liver tissues. Finally, Western blot analysis was conducted to evaluate the expression levels of nuclear factor-kappaB (NF-κB), nuclear factor E2-related factor (Nrf-2), and heme oxygenase-1 (HO-1) in liver tissues.
Compared with the model group, the NeF intervention groups exhibited significantly reduced levels of liver injury markers (AST, ALT, ALP, and TG) in serum, oxidative stress markers (MDA, 4-HNE, and AOPP), and inflammatory markers (MPO, IL-1β, and TNF-α) in liver tissue, while the activities of antioxidant enzymes (SOD and CAT) were significantly increased. Histological analysis revealed that NeF intervention improved alcohol-induced liver injury, steatosis, and lipid accumulation. Western blot analysis demonstrated that NeF intervention up-regulated the expression of Nrf-2 and HO-1 and down-regulated the expression of NF-κB in liver tissue compared to the model group. All these results showed dose-dependent changes.
NeF ameliorates alcohol-induced liver injury through its antioxidant and anti-inflammatory effects, and the underlying mechanism may involve the enhancement of the Nrf-2/HO-1 signaling pathway and the inhibition of the NF-κB signaling pathway in liver tissue.
- Citation: Qu XH, Liu XJ. Neferine alleviates alcohol-induced liver injury in mice by inhibiting oxidative stress and inflammation. Shijie Huaren Xiaohua Zazhi 2025; 33(5): 389-396
- URL: https://www.wjgnet.com/1009-3079/full/v33/i5/389.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i5.389
酒精相关性肝病(alcohol-associated liver disease, ALD)是全球范围内一个重大的公共卫生问题, 也是慢性肝病的主要病因之一[1]. ALD涵盖了由长期饮酒或间歇性大量饮酒诱导的单纯性脂肪变性到脂肪性肝炎, 并可能进一步进展为不可逆的肝硬化及肝细胞癌等一系列肝脏病变[1,2]. 根据世界卫生组织的数据, 每年因ALD导致的死亡人数超过200万, 占全球总死亡人数的4%, 已被确认为导致伤残调整生命年的主要风险因素之一[1,3]. 我国酒文化源远流长, 近年来酗酒人数剧增, 且饮酒年龄呈年轻化趋势, 这使得由酒精诱导的ALD或酒精相关肝病造成的肝损伤问题尤为突出[4]. 此外, 酒精成瘾是一种慢性复发性疾病, 伴有强迫性饮酒行为, 这使得治疗更具挑战性. 尽管戒酒被认为是治疗ALD的最佳策略, 但对于已经造成肝损伤的患者的干预选择在过去几十年中进展有限, 这表明迫切需要开发新的ALD治疗方法[4,5].
酒精性肝损伤(alcoholic liver injury, ALI)最初表现为肝脂肪变性, 且随着脂质过载, 肝脏组织会遭受氧化应激损伤, 并引发库普弗细胞、巨噬细胞和中性粒细胞的浸润, 进而产生肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和白细胞介素-1β(interleukin-1β, IL-1β)等炎性细胞因子[2,6]. 此外, 长期饮酒及酗酒等饮酒模式本身在肝内代谢也会导致反复的肝脏损伤、氧化应激和炎症反应[2,5,6]. 荷花碱(neferine, NeF), 一种从睡莲莲心中提取的双苄基异喹啉类生物碱, 具有抗氧化、抗炎、调节血脂、器官保护以及抑制器官纤维化的作用[7-9]. 在肝损伤相关的动物模型中, NeF能够抑制对乙酰氨基酚、D-半乳糖胺和脂多糖等肝毒性物质以及缺血再灌注等因素引起的肝损伤, 抑制组织炎症及氧化应激反应的激活[10-12]. 基于其药理性质, 推测NeF可能是潜在的抗ALI药物, 但其在ALI中的作用尚未得到验证. 因此, 本研究旨在评估NeF在酒精诱导的小鼠ALI中的作用, 并分析其机制.
1.1.1 实验试剂: NeF(纯度>99%, 货号: PR0987)购自信阳莱耀生物科技有限公司; HE染色试剂盒(货号: RC0062)和油红O染色试剂盒(货号: RC0067)购自上海睿远生物医药科技有限公司; 甘油三酯(triglyceride, TG)测定试剂盒(货号: A110-1-1)、丙二醛(malondialdehyde, MDA)测定试剂盒(货号: A003-1-1)、晚期氧化蛋白产物(advanced oxidation protein products, AOPP)测定试剂盒(货号: H596)、超氧化物歧化酶(superoxide dismutase, SOD)测定试剂盒(货号: A001-3-1)和过氧化氢酶(catalase, CAT)测定试剂盒(货号: A007-1-1)购自南京建成生物研究所; 4-羟基壬烯酸(4-hydroxynonenal, 4-HNE)ELISA试剂盒(货号: D751041)、IL-1β ELISA试剂盒(货号: D721017)和TNF-α ELISA试剂盒(货号: D721217)购自上海生工生物工程股份有限公司; 髓过氧化物酶(myeloperoxidase, MPO) ELISA试剂盒(货号: MB-3074A)购自江苏酶标生物科技有限公司; 核因子κB(nuclear factor-κB, NF-κB)抗体(货号: 10745-1-AP)、核因子E2相关因子2(nuclear factor erythroid-derived factor 2-related factor, Nrf-2)抗体(货号: 16396-1-AP)和血红素氧合酶-1(hemeoxygenase-1, HO-1)抗体(货号: 66743-1-Ig)购自武汉三鹰生物技术有限公司; GAPDH抗体(货号: CSB-MA000071M2m)和HRP标记二抗购自武汉华美生物工程有限公司.
1.1.2 实验动物: 42只SPF级雄性C57BL/6J小鼠(10-12周龄, 20-22 g)购自金华市食品药品检验检测研究院[SCXK(浙)2024-0003], 饲养于屏障环境动物房, 饲养条件控制为: 室温24 ℃±4 ℃, 湿度50%-65%, 人工照明12 h/12 h循环交替. 在6 d适应新环境性饲养时, 小鼠以常规的颗粒动物饲料, 不限制饮水; 在动物造模时给予特殊造模饮食.
1.2.1 分组和ALI造模: 动物实验获得了武义第一人民医院动物伦理批准(伦理号: 伦审医研[2023]176)并严格遵循《实验动物护理和使用指南》进行. 42只小鼠随机分为6组, 每组7只: 空白对照组(Control)、NeF对照组(NeF)、ALI模型组(Model), 以及低、中、高剂量NeF干预组(Model+NeF-L、Model+NeF-M、Model+NeF-H). 根据文献[13]方案, 采用慢性结合急性酒精喂养法构建ALI模型. 具体造模步骤如下: 首先, 所有小鼠连续5 d接受Lieber-DeCarli液体对照饲料(货号: TP 4030C, 南通特洛菲饲料科技有限公司); 随后, 除Control组和NeF组外, 其余小鼠连续10 d接受含5%酒精的Lieber-DeCarli标准型酒精液体饲料(货号: TP 4030D, 南通特洛菲饲料科技有限公司). 在第16天, ALI模型组及各剂量NeF干预组给予大剂量酒精(5 g/kg), 而Control组和NeF组则给予等体积的9 g/kg麦芽糊精. 此外, NeF组在整个实验期间(共16天)每天接受100 mg/kg NeF灌胃; 低、中、高剂量NeF干预组分别接受25、50、100 mg/kg NeF灌胃, 每日一次. 最后一次给药后9 h, 对小鼠进行称重, 并通过眼眶静脉采血, 随后实施安乐死并收集肝组织, 称重; 计算肝/体比(肝脏重量/体重比).
1.2.2 血生化检测: 用全自动生化分析仪检测血清中肝损伤标记物丙氨酸氨基转移酶(alanine aminotransferase, ALT), 天冬氨酸氨基转移酶(aspartate aminotransferase, AST)和碱性磷酸酶(alkaline phosphatase, ALP)活性.
1.2.3 组织学染色: 将肝组织分为俩部分, 一部分用于肝组织生化和Western blot检测, 另外一部分用于组织学染色检测. 将肝组织固定和石蜡包埋后, 切片(5 μm厚), 肝组织切片脱蜡至水后, 按厂家说明书, 分别进行HE染色和油红O染色. 显微镜下观察肝组织形态学表现, 按文献[12,13]方法, 统计肝组织损伤评分和脂滴(油红O染色)面积.
1.2.4 肝组织生化检测: 将肝组织匀浆后, 按照厂家说明书, 采用生化法测定肝组织中TG、MDA和AOPP的含量, 以及SOD和CAT的活性; 同时, 采用ELISA法检测肝组织中4-HNE、MPO、IL-1β和TNF-α的水平.
1.2.5 Western blot检测: 将肝组织匀浆后, 使用RIPA裂解液提取蛋白质. 随后, 按照等量蛋白上样原则进行Western blot转印. 将蛋白样品转印至PVDF膜后, 用封闭液封闭非特异性结合位点. 接着, 分别加入以下一抗: NF-κB抗体(工作浓度1:3000)、Nrf-2抗体(工作浓度1:2000)、HO-1抗体(工作浓度1:1000)和GAPDH抗体(工作浓度1:8000), 4 ℃孵育过夜. 次日, 经充分漂洗后, 加入HRP标记的二抗(工作浓度1:1000), 室温孵育60 min. 再次漂洗后, 采用化学发光法显像, 并使用Image J软件量化目标蛋白的相对表达量.
统计学处理 使用Graphpad Prism 9.0软件对数据进行分析. 数据表示为均数±标准差(mean±SD), 组间均数两两比较采用单因素方差分析后的LSD检验. P<0.05认为有统计学差异.
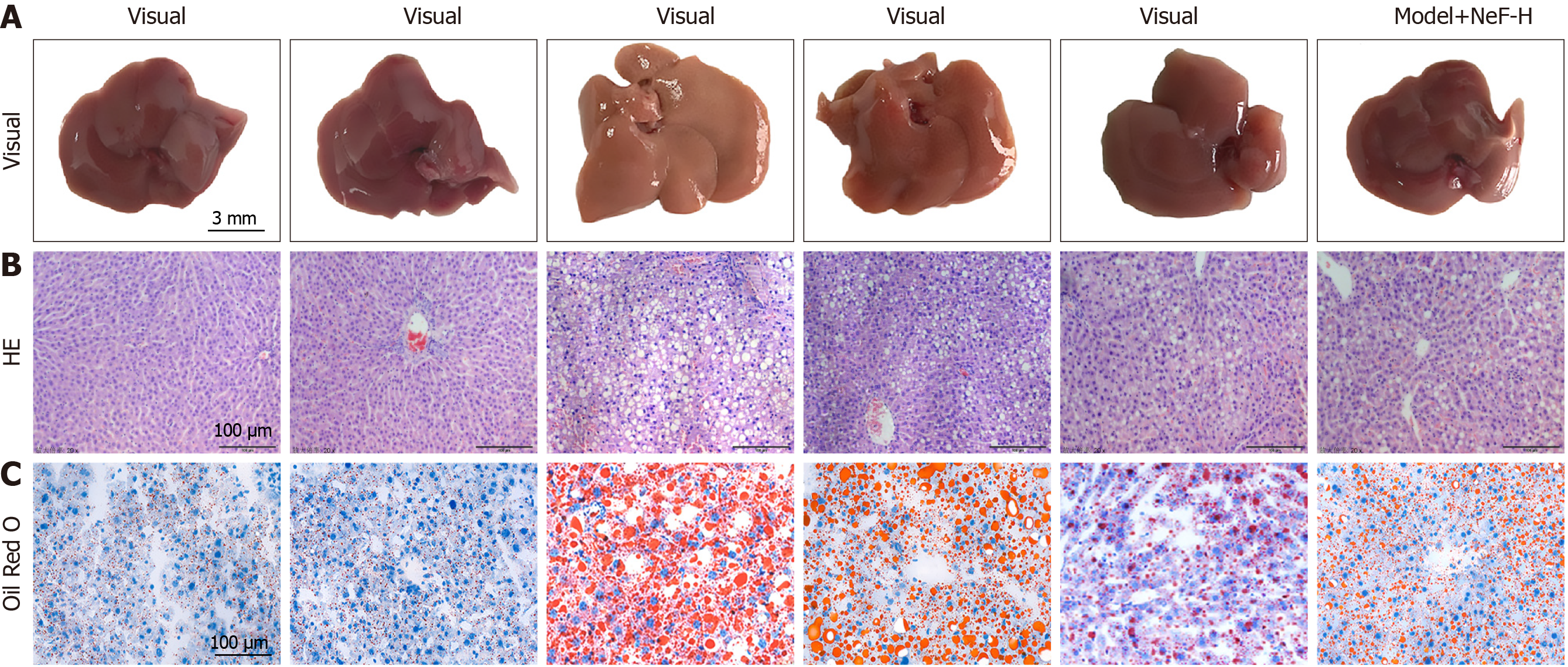
肉眼观察(图1A)显示, Control组和NeF组的肝脏表面光滑且有光泽; Model组的肝脏则呈现水肿形态, 表面泛黄或发白. 低、中、高剂量NeF干预组(Model+NeF-L、Model+NeF-M、Model+NeF-H)的肝脏形态和光泽明显优于Model组. 统计学分析(表1)表明, 与Control组相比, Model组的肝/体比显著升高(P<0.05), 而低、中、高剂量NeF干预组的肝/体比较Model组显著降低(P<0.05). HE染色(图1B)结果显示, Control组和NeF组的肝脏组织结构正常; Model组的肝脏切片中观察到明显的肝细胞气球样变、坏死及炎细胞浸润, 肝组织损伤评分显著高于对照组(P<0.05, 表1). 与Model组相比, 低、中、高剂量NeF干预组的肝组织形态显著改善, 肝组织损伤评分显著降低(P<0.05, 表1). 油红O染色(图1C)显示, Model组的肝脏切片中存在大量脂滴或融合成的大脂滴(油红O染色呈红色), 而低、中、高剂量NeF干预组的脂滴面积显著低于Model组(P<0.05, 表1). 以上结果呈现出NeF的剂量依赖性效应.
与Control组相比, Model组血清中ALT、AST和ALP活性以及肝组织中TG含量均明显增高(P<0.05); 与Model组相比, 低、中、高剂量NeF干预组血清中ALT、AST和ALP活性以及肝组织中TG含量均明显降低(P<0.05), 且呈现出NeF的剂量依赖性效应. 而Control组和NeF组中的上述指标无明显差异. 见表2.
| 组别 | 血清ALT(U/L) | 血清AST(U/L) | 血清ALP(U/L) | 肝组织TG(mg/g 蛋白) |
| Control组 | 51.04±7.38 | 67.56±7.89 | 88.45±18.58 | 2.36±0.36 |
| NeF组 | 58.05±9.54 | 59.82±7.51 | 94.29±10.42 | 2.18±0.47 |
| Model组 | 152.15±24.32b | 178.77±24.38b | 323.54±57.37b | 10.62±1.84b |
| Model+NeF-L组 | 121.35±13.51a | 135.43±19.56a | 245.53±46.24a | 8.41±0.73a |
| Model+NeF-M组 | 90.25±11.26a | 106.73±15.35a | 204.16±21.39a | 5.35±0.66a |
| Model+NeF-H组 | 70.63±9.04a | 80.56±10.68a | 145.86±23.14a | 3.78±0.41a |
与Control组相比, Model组肝组织中MPO、IL-1β和TNF-α的水平均明显增高(P<0.05); 与Model组相比, 低、中、高剂量NeF干预组肝组织中MPO、IL-1β和TNF-α的水平均明显降低(P<0.05), 且呈现出NeF的剂量依赖性效应. 而Control组和NeF组中的上述指标无明显差异. 见表3.
| 组别 | MPO(mg/g 蛋白) | IL-1β(mg/g 蛋白) | TNF-α(mg/g 蛋白) |
| Control组 | 52.15±9.89 | 536.78±75.64 | 41.53±6.84 |
| NeF组 | 46.47±7.13 | 512.53±43.96 | 46.53±8.76 |
| Model组 | 395.69±52.38a | 2475.89±314.56a | 185.36±26.58a |
| Model+NeF-L组 | 243.66±47.52b | 1743.53±412.44b | 144.18±17.32b |
| Model+NeF-M组 | 184.53±29.78b | 1214.45±273.19b | 105.71±11.59b |
| Model+NeF-H组 | 94.75±13.56b | 862.47±95.82b | 74.64±9.84b |
与Control组相比, Model组肝组织中MDA、4-HNE和AOPP的水平均明显增高(P<0.05), 而抗氧化酶(SOD和CAT)活性明显降低(P<0.05); 与Model组相比, 低、中、高剂量NeF干预组肝组织中MDA、4-HNE和AOPP的水平均明显降低(P<0.05), 抗氧化酶(SOD和CAT)活性明显增高(P<0.05), 且呈现出NeF的剂量依赖性效应. 而Control组和NeF组中的上述指标无明显差异. 见表4.
| 组别 | MDA(nmol/g 蛋白) | 4-HNE(μmol/g 蛋白) | AOPP(nmol/g 蛋白) | SOD(U/g 蛋白) | CAT(U/g 蛋白) |
| Control组 | 5.04±0.76 | 7.65±0.83 | 154.65±23.36 | 386.72±56.12 | 58.61±9.54 |
| NeF组 | 5.23±0.87 | 8.04±0.51 | 148.78±20.18 | 373.54±40.86 | 51.47±6.25 |
| Model组 | 27.83±4.62a | 703.54±102.45a | 935.42±78.34a | 78.64±12.15a | 16.44±3.25a |
| Model+NeF-L组 | 18.54±2.38b | 365.56±72.86b | 602.51±83.68b | 152.68±45.53b | 25.17±4.42b |
| Model+NeF-M组 | 13.76±1.89b | 151.13±51.02b | 429.68±67.27b | 259.75±83.56b | 36.89±6.23b |
| Model+NeF-H组 | 8.56±1.16b | 45.69±18.04b | 293.28±47.51b | 397.56±78.64b | 48.75±8.64b |
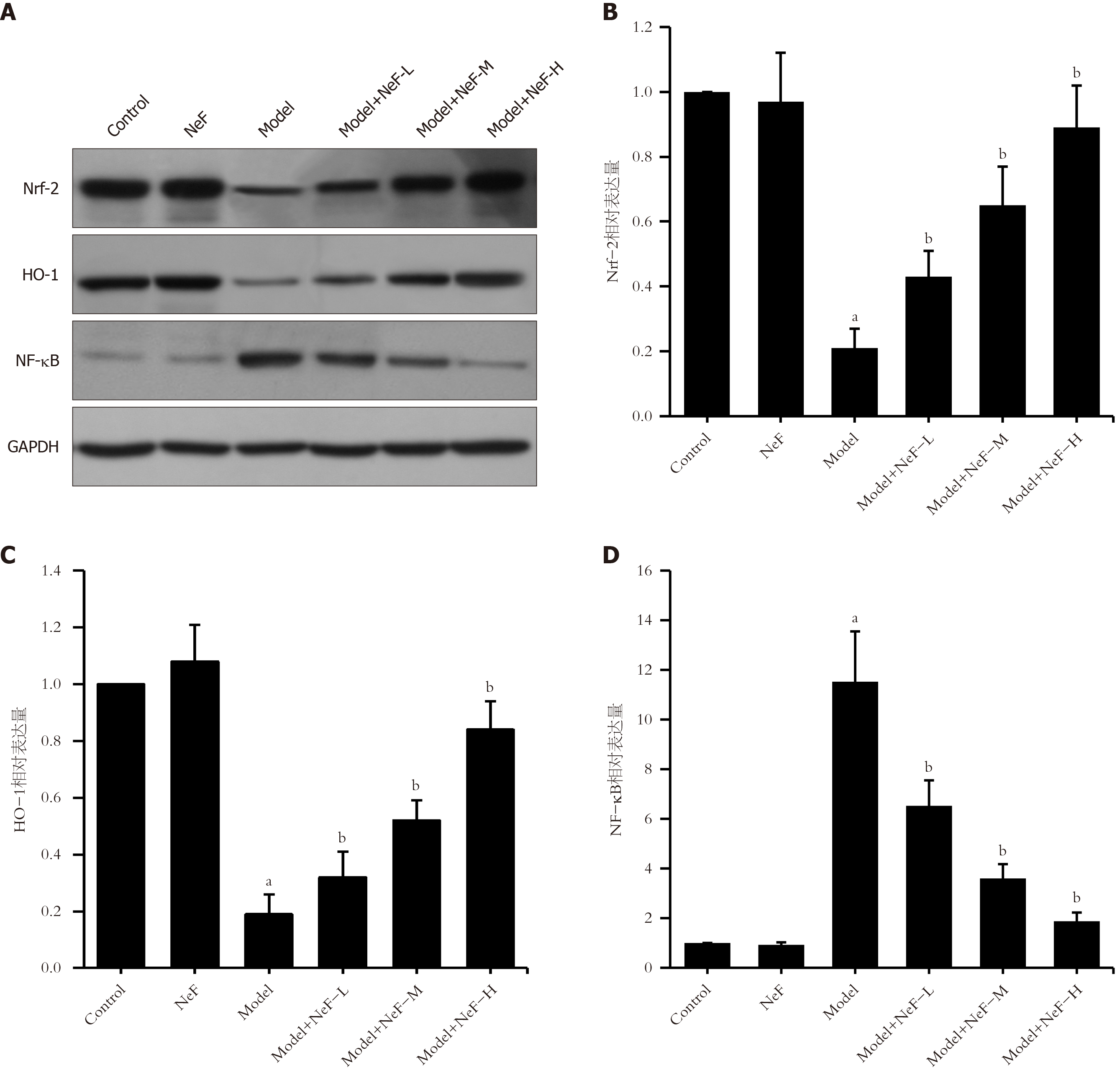
Western blot检测结果(见图2)显示, 与Control组相比, Model组肝组织中Nrf-2和HO-1的表达水平均明显降低(P<0.05), 而NF-κB表达水平明显增高(P<0.05); 与Model组相比, 低、中、高剂量NeF干预组肝组织中Nrf-2和HO-1的表达水平均明显增高(P<0.05), 而NF-κB表达水平明显降低(P<0.05), 且呈现出NeF的剂量依赖性效应. 而Control组和NeF组中的上述指标无明显差异.
NeF在多种因素诱导的器官损伤动物模型中表现出显著的器官保护作用, 其机制涉及抗炎和抗氧化作用[7-11]. ALD的发病机制涉及氧化应激与炎症反应之间的恶性循环以及肝脂代谢障碍[2,5,6], 提示NeF可能是ALD潜在的有效肝保护剂. 本研究通过酒精诱导的小鼠肝损伤模型发现, NeF能够显著降低血清中的AST、ALT、ALP及TG水平, 表明其具有改善肝功能损伤和调节脂质代谢紊乱的双重功效, 初步证实了NeF在ALI中的肝保护效应.
在氧化应激调控方面, NeF通过降低MDA、4-HNE和AOPP等脂质过氧化产物, 并提升SOD和CAT活性, 展现了卓越的抗氧化能力. 这种双向调节作用的关键机制可能与激活Nrf2/HO-1信号通路有关[14]. Nrf2作为氧化应激应答的核心转录因子, 其激活可诱导HO-1等Ⅱ相解毒酶的表达, 进而上调下游抗氧化酶如SOD和CAT, 以保护生物膜免受氧化应激介导的细胞器损伤和脂质过氧化[14,15]. 值得注意的是, 本研究发现NeF能上调Nrf2/HO-1信号通路, 这一过程与经典抗氧化剂的作用机制形成互补, 揭示了天然产物独特的调控方式.
在炎症调控方面, NeF对MPO活性和IL-1β、TNF-α水平的抑制作用提示其可以有效阻断中性粒细胞浸润和炎性因子级联反应. 深入机制研究表明, 这种抗炎效应与NF-κB信号通路的抑制密切相关. NF-κB信号通路各种因素诱导的炎症反应的中枢调节通路之一[16]. 本研究显示, 在ALI小鼠模型中NF-κB信号活性显著增强, 而给予NeF治疗则抑制了NF-κB的表达. 值得注意的是, Nrf2激活与NF-κB抑制之间可能存在交互调控, Nrf2可通过竞争性消耗共同转录辅因子或直接结合NF-κB亚基[7], 形成抗氧化-抗炎的协同网络. 然而, 二者的具体关系仍需进一步研究.
从转化医学的角度来看, NeF的双通路调控特性具有重要价值. 酒精代谢产生的乙醛不仅直接激活NF-κB, 还耗竭抗氧化酶引发氧化应激[5-6,17]. 传统治疗多采用单一靶点策略, 而NeF通过同时增强内源性抗氧化防御系统和抑制炎症信号传导, 可能更有效地阻断ALD的病理进程. 此外, HO-1的诱导不仅增强了抗氧化能力, 其代谢产物胆红素和一氧化碳本身也具有抗炎特性[18], 但这些效应需经进一步检测.
综上所述, 以上结果均表明NeF作为一种有效的抗氧化剂和抗炎剂, 可以抑制ALI小鼠肝脏中的氧化和炎症现象. 尽管本研究揭示了NeF的多重保护机制, 仍需进一步探讨其生物利用度及组织特异性分布. 未来研究可结合基因敲除模型验证关键信号节点的作用, 并通过结构修饰优化其药代动力学特性, 为其在ALI临床应用奠定基础.
酒精相关性肝病(alcohol-associated liver disease, ALD)系全球重大公共卫生问题. 我国酗酒年轻化加剧ALD负担, 酒精成瘾伴强迫性饮酒致治疗困难. 戒酒虽为首选疗法但收效有限, 亟需开发新型治疗策略.
荷花碱(neferine, NeF)具有抗炎、抗氧化和肝保护作用, 或具抗酒精性肝损伤(alcoholic liver injury, ALI)潜力, 具体机制及疗效需深入研究.
验证NeF是否具有抗ALI的作用, 并探讨其机制.
构建ALI小鼠, 并给予NeF干预. 用生化法和病理法研究NeF对ALI小鼠肝损伤、氧化应激以及炎症反应的影响, 用Western blot法分析肝组织中核因子κB(nuclear factor-kappaB, NF-κB)以及核因子E2相关因子2(nuclear factor E2-related factor, Nrf-2)/血红素氧合酶-1(heme oxygenase-1, HO-1)通路相关蛋白表达.
NeF能改善ALI小鼠肝损伤、氧化应激以及炎症. 机制研究表明, NeF能增强肝组织中Nrf-2/HO-1信号并抑制NF-κB信号活性.
NeF可改善ALI小鼠肝损伤, 抑制肝脏中的氧化和炎症现象.
NeF可能是潜在的抗ALI的药物.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): B
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 刘继红 制作编辑:郑晓梅
| 1. | Mackowiak B, Fu Y, Maccioni L, Gao B. Alcohol-associated liver disease. J Clin Invest. 2024;134. [PubMed] [DOI] |
| 2. | Wu X, Fan X, Miyata T, Kim A, Cajigas-Du Ross CK, Ray S, Huang E, Taiwo M, Arya R, Wu J, Nagy LE. Recent Advances in Understanding of Pathogenesis of Alcohol-Associated Liver Disease. Annu Rev Pathol. 2023;18:411-438. [PubMed] [DOI] |
| 3. | Devarbhavi H, Asrani SK, Arab JP, Nartey YA, Pose E, Kamath PS. Global burden of liver disease: 2023 update. J Hepatol. 2023;79:516-537. [PubMed] [DOI] |
| 4. | Han S, Yang Z, Zhang T, Ma J, Chandler K, Liangpunsakul S. Epidemiology of Alcohol-Associated Liver Disease. Clin Liver Dis. 2021;25:483-492. [PubMed] [DOI] |
| 5. | Jophlin LL, Singal AK, Bataller R, Wong RJ, Sauer BG, Terrault NA, Shah VH. ACG Clinical Guideline: Alcohol-Associated Liver Disease. Am J Gastroenterol. 2024;119:30-54. [PubMed] [DOI] |
| 6. | Huai Q, Zhu C, Zhang X, Dai H, Li X, Wang H. Mesenchymal stem/stromal cells armored by FGF21 ameliorate alcohol-induced liver injury through modulating polarization of macrophages. Hepatol Commun. 2024;8. [PubMed] [DOI] |
| 7. | Sun X, Gu Y, Liu X, Korla PK, Hao J. Neferine Pretreatment Attenuates Isoproterenol-Induced Cardiac Injury Through Modulation of Oxidative Stress, Inflammation, and Apoptosis in Rats. Appl Biochem Biotechnol. 2024;196:7404-7428. [PubMed] [DOI] |
| 8. | Zhang X, Li J, Cao C, Liu Z, Chen Q, Gu Z, Wang W, Fang D, Ge Q, Ding L, Pang C, Wang X. Nrf2 activation by neferine mitigates microglial neuroinflammation after subarachnoid hemorrhage through inhibiting TAK1-NF-κB signaling. Int Immunopharmacol. 2024;130:111693. [PubMed] [DOI] |
| 9. | Wang MY, Zhang SS, An MF, Xia YF, Fan MS, Sun ZR, Zhang LJ, Zhao YL, Sheng J, Wang XJ. Neferine ameliorates nonalcoholic steatohepatitis through regulating AMPK pathway. Phytomedicine. 2023;114:154798. [PubMed] [DOI] |
| 10. | Wang Y, Wang S, Wang R, Li S, Yuan Y. Neferine Exerts Antioxidant and Anti-Inflammatory Effects on Carbon Tetrachloride-Induced Liver Fibrosis by Inhibiting the MAPK and NF-κB/IκBα Pathways. Evid Based Complement Alternat Med. 2021;2021:4136019. [PubMed] [DOI] |
| 13. | Chao X, Wang S, Zhao K, Li Y, Williams JA, Li T, Chavan H, Krishnamurthy P, He XC, Li L, Ballabio A, Ni HM, Ding WX. Impaired TFEB-Mediated Lysosome Biogenesis and Autophagy Promote Chronic Ethanol-Induced Liver Injury and Steatosis in Mice. Gastroenterology. 2018;155:865-879.e12. [PubMed] [DOI] |
| 14. | Lu C, Jiang B, Xu J, Zhang X, Jiang N. Neferine protected cardiomyocytes against hypoxia/oxygenation injury through SIRT1/Nrf2/HO-1 signaling. J Biochem Mol Toxicol. 2023;37:e23398. [PubMed] [DOI] |
| 15. | Jiang XX, Zhang R, Wang HS. Neferine mitigates angiotensin II-induced atrial fibrillation and fibrosis via upregulation of Nrf2/HO-1 and inhibition of TGF-β/p-Smad2/3 pathways. Aging (Albany NY). 2024;16:8630-8644. [PubMed] [DOI] |
| 16. | Xiong Y, Zhong J, Chen W, Li X, Liu H, Li Y, Xiong W, Li H. Neferine alleviates acute kidney injury by regulating the PPAR-α/NF-κB pathway. Clin Exp Nephrol. 2024;28:969-987. [PubMed] [DOI] |
| 17. | Wang W, Liu M, Fu X, Qi M, Zhu F, Fan F, Wang Y, Zhang K, Chu S. Hydroxysafflor yellow A ameliorates alcohol-induced liver injury through PI3K/Akt and STAT3/NF-κB signaling pathways. Phytomedicine. 2024;132:155814. [PubMed] [DOI] |
| 18. | Ryter SW. Heme Oxygenase-1: An Anti-Inflammatory Effector in Cardiovascular, Lung, and Related Metabolic Disorders. Antioxidants (Basel). 2022;11. [PubMed] [DOI] |