修回日期: 2025-11-05
接受日期: 2025-12-12
在线出版日期: 2025-12-28
肠道超声(intestinal ultrasound, IUS)作为一种无创、安全、可重复性高的影像学工具, 在溃疡性结肠炎(ulcerative colitis, UC)的临床诊疗中具有重要价值. 本文系统阐述IUS在UC诊断、疾病活动度评估、治疗反应监测及并发症识别中的应用, 并探讨其与内镜、计算机断层扫描肠道成像、磁共振肠道成像等多模态影像技术的协同策略. 研究表明, IUS量化参数(如肠壁厚度、血流信号)与内镜评分具有良好相关性, 可早期预测治疗反应, 尤其在儿童、妊娠期等特殊人群中优势显著. 尽管IUS仍存在操作标准化不足、直肠评估局限等问题, 但通过推进多中心研究、建立统一评分系统及融合人工智能等新技术, IUS有望成为UC个体化精准管理中的核心工具.
核心提要: 本文提出以肠道超声(intestinal ultrasound, IUS)为核心的阶梯式多模态影像路径, 突出其在溃疡性结肠炎(ulcerative colitis, UC)管理中实现早期(2-4 wk)预测治疗反应的前瞻性价值; 创新整合人工智能辅助IUS定量分析, 提升评估客观性; 并强调经会阴超声弥补直肠评估短板, 构建从筛查、随访到精准评估的全程无创监测体系, 为UC个体化精准管理提供新策略.
引文著录: 李梅珊, 翁一洁. 肠道超声在溃疡性结肠炎诊疗中的价值. 世界华人消化杂志 2025; 33(12): 968-977
Revised: November 5, 2025
Accepted: December 12, 2025
Published online: December 28, 2025
Intestinal ultrasound (IUS), as a non-invasive, safe, and highly reproducible imaging modality, holds significant value in the clinical diagnosis and treatment of ulcerative colitis (UC). This article systematically elaborates on the applications of IUS in UC diagnosis, disease activity assessment, treatment response monitoring, and complication identification, and explores its synergistic strategies with multimodal imaging techniques such as endoscopy, computed tomographic enterography, and magnetic resonance elastography. Research indicates that IUS quantitative parameters (such as bowel wall thickness and blood flow signals) correlate well with endoscopic scores and can early predict treatment response, demonstrating significant advantages particularly in special populations like children and pregnant individuals. Although IUS still faces challenges such as insufficient operational standardization and limitations in rectal assessment, IUS has the potential to become a core tool in the personalized and precise management of UC. Realizing this potential requires advancing multicenter studies, establishing unified scoring systems, and integrating new technologies like artificial intelligence.
- Citation: Li MS, Weng YJ. Value of intestinal ultrasound in diagnosis and treatment of ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2025; 33(12): 968-977
- URL: https://www.wjgnet.com/1009-3079/full/v33/i12/968.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i12.968
溃疡性结肠炎(ulcerative colitis, UC)是一种慢性、易复发的非特异性炎症性肠病, 以腹痛、腹泻、黏液脓血便及里急后重为主要临床表现, 严重影响患者生活质量[1,2]. 其病变主要累及结肠黏膜及黏膜下层, 部分患者可伴肠外表现, 长期活动性病变还可能增加结肠癌变风险[3,4]. 近年来, UC在全球范围内发病率与患病率呈上升趋势, 尤其在亚洲国家, 随着工业化进程和生活方式的改变, 疾病负担日益加重[4,5].
目前, 内镜检查被视为UC诊断与疾病活动度评估的"金标准", 能够直视黏膜病变并进行活检以评估黏膜愈合[1,6]. 然而, 其为侵入性操作, 需肠道准备, 患者耐受性与依从性较差, 且存在出血、穿孔及感染等风险[1,6,7]. 此外, 结肠镜无法评估肠壁分层结构及肠外病变, 对小儿及长期随访患者造成较大身心负担[7-9]. 其他影像学方法如计算机断层扫描肠道成像(computed tomographic enterography, CTE)虽能提供更多信息, 但因辐射问题不适用于重复随访[10]; 非侵入性生物标志物如CRP和FC在判断病变范围与界定临界值方面仍有局限[9].
因此, 寻找一种安全、便捷、可重复的辅助评估工具成为临床迫切需求. 肠道超声(intestinal ultrasound, IUS)作为一种无创、无辐射、无需肠道准备的影像学手段, 日益展现出其在UC评估中的潜力[1,6,11]. IUS可实时观察肠壁分层结构、肛周病变及透壁性改变, 操作简便、价格低廉, 具有良好的患者接受度, 适用于门诊及基层推广[11,12]. 研究显示[10,13], IUS参数在治疗开始后4周即可出现变化, 有助于早期评估疗效及监测疾病演变.
尽管超声在急性腹部疾病(如阑尾炎)诊断中准确性已获公认, 但其在UC中的应用价值, 特别是在疾病诊断、活动度判断及并发症识别方面, 尚存争议. 本综述旨在系统阐述IUS在UC诊断、病情监测与治疗评估中的临床应用价值, 并与其他影像学方法进行比较, 以期为临床实践提供循证参考.
IUS检查效能的发挥很大程度上取决于规范的操作手法及对图像特点的认识, 一般先用3.5-6 MHz低频凸阵探头做全腹部扫查, 对腹腔内肠道有个大致印象, 再用7-15 MHz高频线阵探头对从盲肠到乙状结肠的各段结肠做细致检查, 以便清楚显示肠壁的五层显微结构[6,11,14], 操作中常采用的"分级压迫法", 即在病人呼气相时顺势对腹壁施压, 可有效驱散干扰性肠气和脂肪, 改善深部肠段(如盆腔内的乙状结肠和直肠上段)的显像效果. 虽然严格的肠道准备不是必需的, 但患者至少应该禁食4 h, overnight fasting(>8 h)可进一步提高成像质量, 但是巧妙地利用充盈的胃或膀胱作为声窗, 反而对某些部位(胃十二指肠、直肠)的观察是有利的[14].
正常肠壁在高频超声下表现为经典的五层"三高两低"回声结构, 依次是黏膜界面回声、黏膜层(含黏膜肌层)、黏膜下层、固有肌层及浆膜层, 这成为评判一切病理改变的解剖基础[15,16], 在评估直肠炎症时, 经腹肠道超声因受耻骨遮挡、肠气干扰及深度限制, 对直肠的显示存在显著局限性. 为弥补这一不足, 经会阴超声(transperineal ultrasound, TPUS)被引入临床实践. TPUS通过会阴部进行扫描, 有效避开耻骨及肠气的干扰, 能够清晰显示直肠壁的层次结构、厚度及血流情况[10,17]. 研究显示[17], TPUS对直肠炎的检测敏感性超过95%, 特异性接近100%, 显著优于经腹途径. 该技术操作简便、无创、无辐射, 尤其适用于直肠孤立性病变或经腹超声显示不清的患者, 是对IUS评估范围的重要补充[13,17].
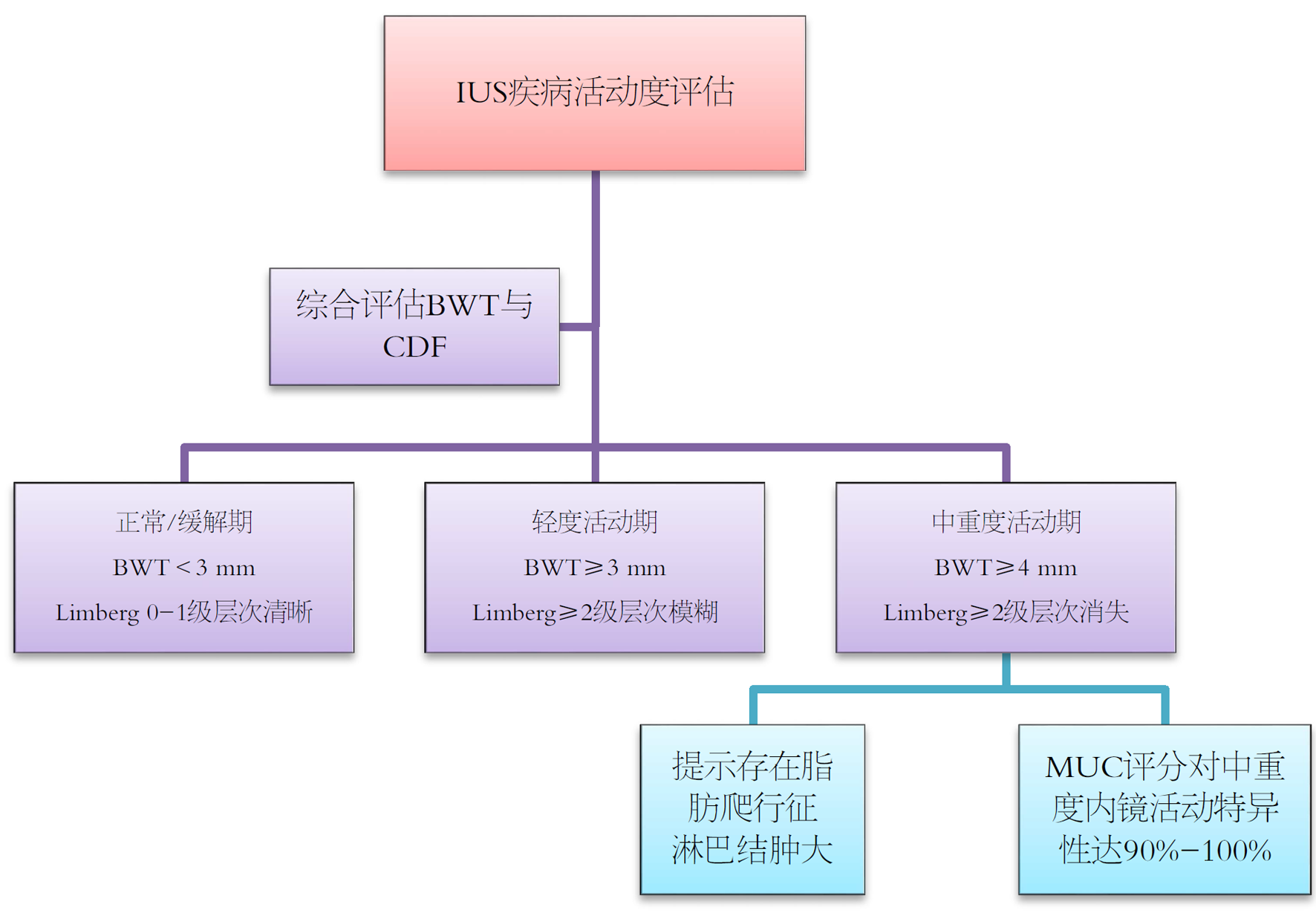
活动期UC在IUS检查中呈现一系列可量化的形态学与血流动力学改变. 其中, 肠壁厚度(bowel wall thickness, BWT)增加是最客观且核心的量化指标. 尽管不同研究对具体临界值略有差异(通常结肠为3-4 mm), 但普遍认为BWT≥4 mm提示存在活动性炎症[10,11,18]. 在UC中, 肠壁增厚最显著的部位通常是黏膜下层, 与其主要病理改变区域相符[19].
此外, 肠壁层次结构模糊或消失也是活动期UC的典型表现, 提示炎症已破坏肠壁的正常显微结构[10,20]. 彩色多普勒信号增强是另一项反映活动性炎症的重要征象, 直接体现组织因炎症引起的血管增生与充血状态. 临床上常采用Limberg分级进行半定量评估, 一般认为≥2级(即出现条状或更丰富的血流信号)具有明确的提示意义[7,18,21].
除肠壁本身改变外, IUS还可检测到若干继发性变化, 如结肠袋消失(提示慢性纤维化重塑)、肠周脂肪组织炎性增生(即"脂肪爬行征")以及区域淋巴结肿大等, 共同构成UC的完整超声图像[10,18,19,22]. UC病变呈连续性分布(从直肠向近端蔓延, 不累及末端回肠), 这也是其与克罗恩病(Crohn's disease, CD)鉴别的重要依据之一[23,24].
值得注意的是, IUS对UC的诊断效能存在明显的部位差异. 其对左半结肠(如乙状结肠、降结肠)和横结肠的评估准确性极高, 敏感性可达89%-100%[13,22,24], 为在这些部位应用BWT标准提供了可靠基础. 然而, 经腹超声对直肠的评估能力有限, 敏感性较低(约15%), 此时需借助经会阴超声(transperineal ultrasound, TPUS), 其指标如直肠壁厚度(relative wall thickness, RWT)>4.1 mm 更具诊断价值[13,17].
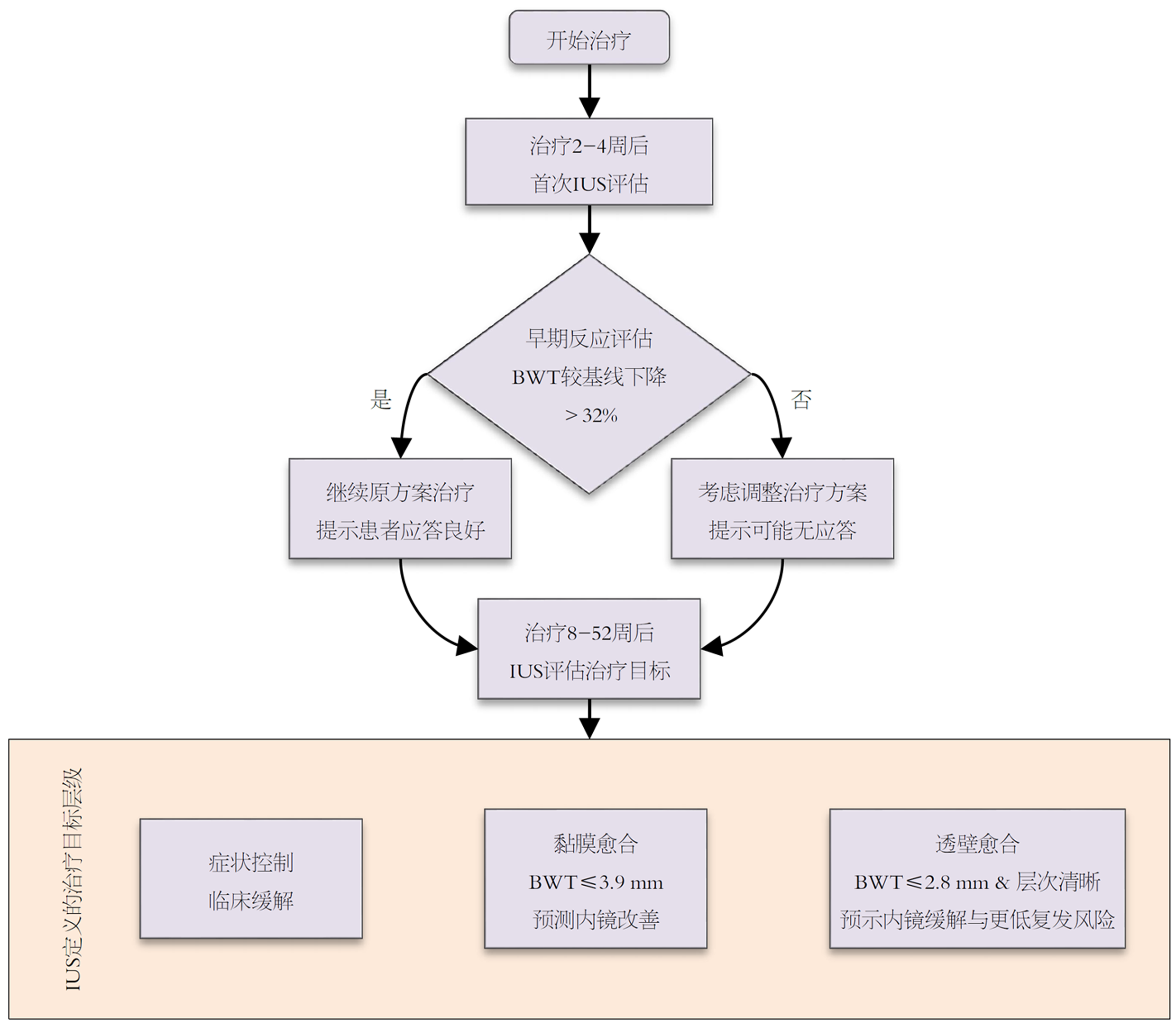
除诊断外, BWT的动态变化还为疾病分层管理提供了可能. 研究已确立与内镜目标直接对应的BWT临界值: 例如在乙状结肠, BWT降至3.9 mm以下提示内镜改善, 而≤2.8 mm则强烈预示内镜缓解, 两者均具备100%的特异性[19]. 此外, BWT>3.4 mm被证实与内镜复发风险显著相关[25].
最有效的诊断策略是将BWT与其他超声特征相结合. 例如, 米兰超声标准(Milan ultrasound criteria, MUC)通过公式1.4×BWT+2.0×CWF(彩色血流评分)整合肠壁厚度与血流信号, 评分>6.2时可高度准确地识别中重度内镜活动(敏感性0.83, 特异性0.90)[22]. 同样, 在TPUS中, 联合RWT与微血管信号可将诊断准确性提升至约90%[17]. 这些综合评分策略标志着IUS从单一参数测量迈向多维度整合评估的成熟阶段(图1).
很多证据显示, IUS对溃疡性结肠炎的诊断效能良好, 不过其准确性表现出明显的节段差异性, 其对结肠病变的敏感性处于67%-100%这个区间内, 特异性则介于77%到100%之间[7,10,24]. 尽管肠道超声对UC的诊断价值有限, 但对疾病活动度的评估及黏膜愈合的判断非常有帮助, 其核心价值正从辅助诊断向精准监测不断演进[26].
就病变部位而言, IUS对左半结肠(降结肠、乙状结肠)及横结肠的评估准确性最高, 敏感性可达92.7%-100%. 然而, 经腹IUS对直肠的评估效果不佳, 敏感性可低至15%, 这一局限性凸显了经TPUS的互补价值-TPUS对直肠炎的评估敏感性超过95%, 特异性接近100%[10,17,24].
就病变部位而言, IUS的诊断准确性在左半结肠及横结肠最高, 敏感性可达92.7%-100%, 而对直肠的评估则是其薄弱环节, 经腹扫描的敏感性可低至15%. 这一局限可通过经会阴超声进行有效弥补, 后者对直肠炎的评估敏感性超过95%, 特异性接近100%[10,17,24]. 就疾病严重程度而言, IUS的诊断效能随炎症活动度而变化. 在中重度活动期患者中, 由于肠壁明显增厚、层次结构模糊及血流信号显著增强等典型改变, IUS表现出卓越的诊断准确性, 其参数与Mayo内镜评分及UC内镜严重程度指数呈中高度相关[9,10,19]. 相比之下, 在轻度活动期或缓解期患者中, 因肠壁增厚不明显且血流改变轻微, IUS的敏感性相对有限, 尤其对浅表黏膜糜烂的识别能力较弱[13].
值得注意的是, IUS在预测黏膜愈合方面展现出重要价值. 研究已确立具体的肠壁厚度截断值, 如乙状结肠肠壁厚度≤3.9 mm提示内镜改善, 而≤2.8 mm则强烈预示内镜缓解, 两者均具备100%的特异性[19]. 这种客观量化能力使IUS能够在治疗过程中动态监测黏膜愈合进程, 为临床决策提供依据. 随着治疗理念的革新, "透壁愈合"已成为溃疡性结肠炎的新治疗目标. IUS在此领域展现出独特优势, 能够无创评估肠壁全层结构, 其表现为肠壁厚度恢复正常、层次结构清晰、血流信号消失及肠周炎症消退[19,21,22]. 米兰超声标准等复合评分系统通过整合肠壁厚度与血流信号等多维参数, 可高度特异性地识别中重度内镜活动, 标志着IUS评估体系的成熟[13,22].
因此, 将IUS纳入溃疡性结肠炎的达标治疗策略, 不仅为实现从黏膜愈合到透壁愈合的深层治疗目标提供了重要的非侵入性监测工具[27,28], 而且在勾勒全结肠病变范围时能提供内镜未能获取的信息, 特别是在评估内镜难以到达的近端结肠病变方面具有独特优势[9]. 这一特点使IUS成为溃疡性结肠炎全程管理中不可或缺的评估手段.
在炎症性肠病(inflammatory bowel disease, IBD)的鉴别诊断中, IUS凭借其直观显示肠壁透壁性改变及肠外并发症的能力, 发挥着重要作用. 其鉴别逻辑主要基于病变的分布特征、肠壁受累层次及肠外表现. UC通常表现为自直肠开始的连续性、向心性炎症, 肠壁增厚以黏膜层和黏膜下层为主, 早期层次结构多可保留, 肠周脂肪炎症程度较轻[10,16]. 相比之下, CD多呈节段性、跳跃性病变, 常累及末端回肠, 肠壁呈透壁性增厚, 黏膜下层增厚尤为显著, 更易出现层次结构消失、非对称性肠壁增厚、明显肠系膜脂肪肥大, 以及瘘管、脓肿、狭窄等CD特征性并发症[9,10,15]. 经TPUS检测到的直肠壁厚度(RWT>4.1-4.5 mm)结合微血管信号, 进一步增强了IUS对UC与非IBD性直肠炎的鉴别能力[17].
在UC的IUS评估中, 与其他常见结肠炎的准确鉴别是确保诊断精准的关键. 感染性结肠炎在IUS中常呈现特定影像学特征: 例如沙门氏菌和弯曲菌感染多累及回盲部, 表现为末端回肠和盲肠的黏膜及黏膜下层明显高回声增厚, 偶伴淋巴结肿大, 但肠系膜脂肪和阑尾通常不受累; 耶尔森菌肠炎则常见末端回肠炎及肠系膜淋巴结炎, 特征性表现为圆形回盲部淋巴结及盲肠周围高回声区, 后者形态类似CD中的"爬行脂肪", 且具有较高特异性. 此外, 重症感染性结肠炎可呈现肠壁增厚、黏膜下水肿、溃疡形成及假膜, 腹水出现频率亦高于IBD. 巨细胞病毒结肠炎多见于免疫抑制患者, IUS可见肠壁增厚和结肠周围脂肪条索, 淋巴结肿大不常见, 但其表现缺乏特异性, 需在排除IBD后考虑该诊断[29]. 缺血性结肠炎作为最常见的肠道缺血类型, 其IUS特征主要包括节段性、环周性肠壁增厚和肠壁层次结构消失. 尽管超声与CT在诊断该病方面准确性相当, 但CT在检测肠壁气肿方面更具优势. 多普勒超声中血流信号的缺失或减弱, 可为缺血性结肠炎的诊断提供关键依据, 有助于在疑似病例中增强诊断把握[30].
在UC与上述疾病的IUS鉴别中, 病变分布模式、肠壁层次受累程度及肠外表现具有重要区分价值. UC通常表现为自直肠开始的连续性、向心性炎症, 肠壁增厚以黏膜和黏膜下层为主, 早期层次结构尚可保留, 肠周脂肪炎症较轻[28,31]. 相比之下, 感染性结肠炎虽可致肠壁增厚, 但其分布不一定符合UC的连续性模式, 且某些病原体感染可伴有特殊的周围高回声或淋巴结形态;缺血性结肠炎则表现为节段性增厚伴层次结构丧失, 且多普勒血流信号减弱可作为其与UC鉴别的关键点[15,28-30]. 因此, 在临床实践中, 综合评估IUS所揭示的病变分布、肠壁结构完整性、血流信号特征及肠周改变, 有助于提高UC与其他类型结肠炎的鉴别诊断准确性.
IUS的无创、无辐射特性使其在特殊人群中展现出独特优势. 对于儿童患者, IUS可避免镇静需求[如磁共振肠道成像(magnetic resonance elastography, MRE)所需]和反复CT扫描的辐射风险, 正常BWT参考值也较成人更低(如<2 mm), 是理想的监测工具[6,28]. 对于妊娠期患者, IUS可在妊娠各期(前两孕期可评估末端回肠)安全地用于评估结肠疾病活动度, 为孕期IBD管理提供了宝贵手段[28]. 此外, 对于无法耐受或拒绝内镜检查、存在内镜检查禁忌症(如急性重度结肠炎、中毒性巨结肠风险)的患者, IUS成为一种有效的替代或补充检查方案[7,16,21,23].
UC的"达标治疗(Treat-to-Target)"策略中, IUS逐渐成为实现治疗目标的关键监测工具, BWT的动态改变同临床活动指数(SCCAI, Lichtiger评分)以及内镜活动度都有明显的相关性[19]. CDF存在与否及其强度为评估肠壁炎症性血管生成提供直观依据[20], 而像MUC这样的复合评分体系结合了BWT、血流、分层等众多维度, 其评分结果与内镜活动度保持极高的对应性, 从而实现更全面且精确的疾病状态评估[21,22]. 相较于患者的主观临床症状, IUS所评估的疾病活动度与内镜所见更为密切相关. 这一发现表明, IUS能够客观、真实地反映肠道内部的炎症负荷, 从而避免临床症状可能带来的误导[24,27].
IUS最有潜力的应用之一是能够比常规内镜复查更早地预示出治疗反应, 即治疗开始几周后就可以观察到BWT和血流信号的显著下降, 而这种动力学变化因药物而异[12,14], 在2-6 wk时, 早期(2 wk)BWT的降低, 与随后8-26 wk达到内镜缓解及改善显著相关[12], 黏膜下层是肠壁中对治疗最敏感的层次[15]. 有学者认为[15,23], 把BWT较基线值下降32%当作预测内镜反应的阈值(曲线下面积: 0.87), 把BWT绝对值降到≤2.8 mm当作预示内镜缓解的最佳临界值(曲线下面积: 0.87), 这种"前瞻性"的监测能力, 让临床医生能够在传统的评估时间点前几周就察觉到可能会出现无应答情况的人, 从而可以及时调整治疗计划, 更好地调配医疗资源, 甚至改善患者的长期预后情况[9,12,22].
IUS在UC并发症的识别与监测中具有重要价值, 其应用不仅限于评估肠壁本身, 还包括对肠外病变的检测. IUS能够有效显示腹腔内并发症, 如腹腔脓肿、反应性淋巴结肿大和腹腔积液等[21,24]. 研究表明[6], 在合并原发性硬化性胆管炎的UC患者中, IUS检出肝周淋巴结肿大的阳性预测值可达94%. 此外, IUS对肠系膜脂肪炎症(表现为系膜高回声增厚)和结肠袋消失的检出能力也较好, 分别达64%和73%, 但在反应性淋巴结检测方面的敏感性相对较低, 约为45%[22].
在肠道本身并发症的评估中, IUS对狭窄的检测灵敏度较高(79%-97.5%), 但特异性差异较大(0%-100%);对瘘管的诊断灵敏度为56%-96%, 特异性为88%-100%; 对脓肿的检测灵敏度达89%-100%, 特异性为80%-95%[32]. 值得注意的是, IUS对狭窄的识别与内镜检查结果一致性较高, 有研究报道IUS检出的所有狭窄病例均经内镜确认[33]. 然而, 在评估中毒性巨结肠方面, IUS的作用尚存争议. 其典型超声表现为肠壁显著变薄(<2 mm)伴肠腔扩张(横结肠内径>6 cm), 管腔内可见水样粪便内容物[15,21,34], 但也有观点认为超声在此类急腹症评估中价值有限[33].
与其他影像学方法相比, IUS具备实时、无创、可重复性强等优势, 适用于动态监测肠腔狭窄、穿孔及脓肿等并发症的演变[21,23]. 不过, 对于解剖结构复杂或位置较深的瘘管或脓肿, 仍建议联合MRE或CTE进行全面评估[27]. 总体而言, IUS作为一种重要辅助工具, 可为UC并发症的早期发现与治疗策略调整提供有价值的信息, 尤其在评估肠系膜改变、腹腔积液和部分狭窄性病变方面展现出良好的临床应用潜力.
在溃疡性结肠炎的病程中, 肠壁增厚是常见的超声表现, 通常呈弥漫性、连续性分布. 活动期UC的肠壁厚度常超过3 mm, 层次结构模糊, 黏膜下层回声增强或减低, 反映黏膜水肿及炎性细胞浸润. 彩色多普勒超声可显示病变肠段血流信号增加, 提示炎症处于活动状态.
随着疾病进展, 慢性反复炎症可导致肠壁纤维化, 表现为肠壁僵硬、蠕动减弱, 严重时可继发肠腔狭窄. UC相关的肠腔狭窄主要源于肠壁纤维化, 超声检查可显示狭窄段肠壁弥漫性增厚、管腔直径缩小(常小于1 cm). 间接征象包括狭窄近端肠管扩张(直径大于2.5 cm)及肠蠕动亢进. 与CD不同, UC的狭窄通常不伴有穿透性病变如瘘管, 这一点有助于两者的鉴别诊断. 尽管肠瘘在UC中相对少见, 但在长期活动性或重症病例中仍可能发生. 超声图像上可观察到肠壁全层连续性中断, 周围出现不规则低回声区, 边界模糊, 可能伴有气体强回声. 这些表现提示黏膜屏障破坏及穿透性病变形成, 需注意与CD相关瘘管进行鉴别. 脓肿形成在UC中较为罕见, 通常与肠壁深溃疡穿透有关. 超声上多表现为边界不清的低回声或无回声区, 内部可见液化坏死形成的液性暗区, 偶见细密点状回声. 动态扫查时内部回声可流动, 后方回声增强, 这些特征有助于早期识别感染性并发症[35,36].
此外, IUS可通过系统评估肠壁层次结构和血流状态, 有效区分UC的活动期与慢性期病变. 正常结肠壁厚度一般小于3 mm, 层次清晰; 活动期UC表现为肠壁增厚、层次模糊及血流增加; 慢性期则以肠壁纤维化和蠕动减弱为主要特征[35,36](图2).
在UC的现代诊疗体系中, 单一影像学方法往往难以全面满足临床评估需求. 因此, 整合不同影像模态的优势, 构建协同应用策略, 对实现精准、高效且个体化的患者管理至关重要.
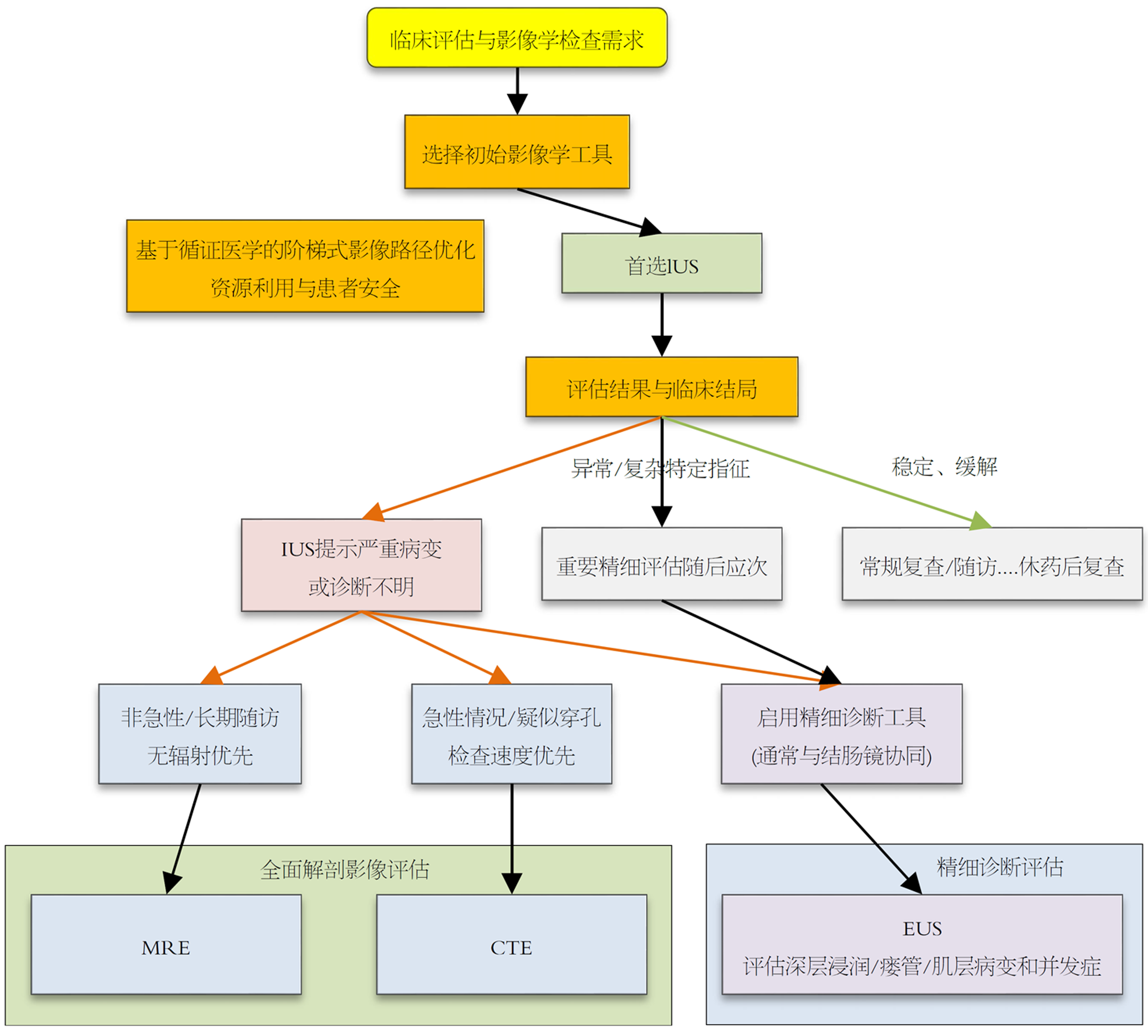
IUS凭借其无创、无辐射、操作简便、成本低及可重复性强等优势, 已成为UC影像评估流程中的基础工具, 尤其适用于疾病初筛、常规随访、治疗反应动态监测以及儿童、孕妇等特殊人群的管理[37]. IUS参数如BWT与内镜评分具良好相关性, 使其能在治疗早期(如2-4 wk)提示治疗反应, 为临床决策提供及时参考[38]. 然而, IUS也存在一定局限, 如对操作者经验依赖较强、对直肠评估需借助经TPUS补充, 以及对复杂肠外并发症的整体评估视野相对有限[37,39,40]. 这些局限性进一步凸显了其与其他影像技术协同的必要性.
在评估层次与范围上, IUS与超声内镜(endoscopic ultrasonography, EUS)形成有效互补. IUS提供宏观的肠道及肠周概况, 而EUS则能提供肠壁层次的超高分辨率图像, 在需要精确评估炎症浸润深度(如区分黏膜下层与肌层)、鉴别UC与CD(灵敏度可达92.3%)、诊断UC相关肿瘤浸润深度(准确率94%)以及评估肛周并发症(如瘘管、脓肿)方面, EUS具有不可替代的作用[39,41,42]. 尤其在直肠评估中, 虽然经腹IUS敏感性较低(约15%), 但TPUS可将其提升至95%以上; 而对精确度要求更高的场景, 经直肠EUS仍为金标准[38]. 这种"IUS广筛, EUS精查"的模式, 实现了从宏观到微观的无缝衔接.
在评估肠腔及肠外整体情况方面, IUS与横断面成像技术-CTE和MRE的协同尤为关键. IUS擅长快速、床旁评估结肠活动度, 而CTE和MRE则能提供更全面的腹腔视野、精确的小肠成像以及复杂肠外并发症(如深部脓肿、复杂瘘管)的信息[43-45]. CTE诊断UC具有较高灵敏度(81.25%)和特异度(98.44%), 但其电离辐射风险限制了其在长期随访中的应用[40,46]. MRE则凭借无辐射、卓越的软组织对比度和多参数成像能力, 成为评估疾病活动度、尤其适合儿童和年轻患者长期监测的理想选择[45,47]. 因此, 合理策略是将IUS作为纵向监测的主要工具, 在急性、重症或诊断不明的复杂病例中, 或需术前规划获取全局解剖细节时, 再升级至CTE(急诊首选)或MRE(长期随访优选)[45,48,49]. IUS在多数情况下可替代昂贵的MRE和有辐射的CTE进行动态监测, 对需终身管理的UC患者具有显著效益[27,43].
基于上述互补关系, 构建以IUS为基础的阶梯式影像路径是实现高效、低风险诊疗的合理范式. 该路径建议将IUS作为所有UC患者一线筛查和常规随访的首选工具[41,45]. 若IUS提示中重度活动、治疗效果不佳或怀疑复杂并发症(如深部脓肿、瘘管), 则可根据具体情况选择进一步精准评估手段: 对疑似肛周或直肠局部复杂问题, 可考虑EUS; 当需全面评估腹腔内情况, 特别是怀疑小肠受累或存在复杂瘘管时, 可升级至MRE(无辐射, 首选)或CTE(检查速度快, 适用于急诊)[42,45,48,49]. 这一阶梯式模式充分发挥了IUS作为核心监测工具的便捷性与安全性, 同时仅在必要时调用更高级、具侵入性或存在辐射的影像资源, 从而优化医疗配置, 减轻患者负担, 实现个体化精准管理.
在UC的影像评估体系中, IUS与内镜检查分别扮演互补且不可完全替代的角色. IUS在特定临床场景下已展现出作为疾病评估工具的潜力. 研究表明[41], IUS所测参数(如BWT)与内镜评分系统(如Mayo评分、溃疡性结肠炎内镜下严重程度指数)呈中高度相关, 为其客观量化疾病活动度提供了依据. 更重要的是, IUS可在治疗启动后2-4 wk内早期监测到BWT与血流信号改变, 从而先于常规内镜复查时间点预测治疗反应, 为调整治疗方案提供宝贵窗口[50,51]. 对儿童、孕妇及无法耐受或拒绝侵入性内镜检查的人群, IUS凭借其安全性成为理想的替代监测工具[38,51]. 此外, 在门急诊需快速评估病情活动度或床旁排查急性重度并发症(如中毒性巨结肠)时, IUS的实时性与便捷性使其具备内镜所不及的优势[41,42]. 尽管经腹IUS对直肠评估存在局限, 但TPUS的引入有效弥补了这一不足, 其在直肠炎检测中的敏感性与特异性均极高, 使直肠评估也可部分规避内镜[39].
然而, 内镜检查在UC管理中仍具有不可替代的地位, 尤其在关键诊断环节. 当诊疗决策依赖组织病理学证据时, 内镜活检是获取黏膜标本的唯一途径, 此为IUS无法替代的技术局限[41]. 对黏膜形态的精细观察、肿瘤性病变(如异型增生)的识别与定性, 以及UC相关结直肠癌的早期发现, 仍需依赖内镜的直接可视化能力[41,50]. 在疑难病例鉴别诊断中, 特别是区分UC与CD, EUS能提供独特的透壁信息, 通过评估肠壁分层结构、淋巴结与黏膜下血管特征, 显示出极高的鉴别诊断价值[52]. EUS在精确评估炎症垂直浸润深度方面被视为金标准, 对预测药物治疗反应和手术必要性至关重要[51]. 此外, 在评估肛周及直肠周围并发症(如瘘管与脓肿)时, EUS被反复证实为卓越工具, 其诊断准确性优于其他影像学方法[52]. 因此, 尽管IUS在疾病监测和筛查中作用显著, 但在获取组织学诊断、进行黏膜细节评估、实现精准鉴别诊断以及评估复杂并发症时, 内镜及其延伸技术(EUS)仍为不可动摇的基石.
综上所述, 在UC的多模态影像评估体系中, IUS凭借其独特优势理应占据核心地位. 通过与EUS、CTE、MRE等技术的智能互补与整合, 形成了覆盖从初筛、随访到精准诊断不同层次的完整评估链条(图3)未来发展方向在于进一步标准化IUS操作流程和评分系统, 并通过前瞻性研究验证这种以IUS为基础的阶梯式路径在改善患者长期预后和优化卫生经济学效益方面的核心价值.
人工智能(artificial intelligence, AI)技术在IUS影像分析中的应用, 显著提升了UC评估的客观性与效率. 基于深度学习的方法, 尤其是卷积神经网络, 能够自动识别并量化IUS图像中的关键特征, 如BWT和血流信号, 从而减少人工测量带来的主观误差, 提高评估的可重复性[53]. 研究表明[54], AI自动获取的IUS参数与Mayo内镜评分具有显著相关性, 能够有效区分UC的活动期与缓解期, 其判别准确率可超过80%. 在儿童UC的诊断中, AI模型通过整合IUS影像特征与生物标志物(如粪便钙卫蛋白、C反应蛋白)数据, 进一步提升了筛查的灵敏度, 使其超过90%[55]. 此外, AI还能辅助鉴别UC与CD, 通过分析病变的分布模式(连续性 vs 节段性)及超声影像特征的差异, 为临床鉴别诊断提供重要参考.
在治疗反应预测方面, AI展现出强大的动态监测能力. 通过分析治疗前后IUS参数的时序变化, 如肠壁厚度的减小和血流信号的恢复情况, AI模型能够在治疗早期(例如2 wk后)识别出可能对生物制剂或免疫抑制剂产生应答的患者群体, 为个体化治疗策略的调整提供前瞻性依据[56]. 这种基于纵向数据的智能分析, 提升了疗效判断的敏感性, 有助于避免治疗不足或过度干预. 结合临床信息与影像动态演变, AI技术有望构建智能决策支持系统, 尤其适用于需要长期随访的儿童UC患者或重症患者的床旁快速评估, 其无创、无需严格肠道准备的特点在此类场景中优势尤为突出.
肠道超声凭借其无创、便捷、可重复的独特优势, 已在溃疡性结肠炎的现代管理体系中确立了不可替代的价值. 其量化参数与内镜及组织学活动度的高度相关性, 使其从一种辅助诊断工具, 成功转型为疾病动态监测与治疗目标达成的核心评估手段. 在"达标治疗"策略中, IUS通过提供客观、量化的炎症负荷数据, 为实现从症状控制到黏膜愈合, 乃至更深层次的"透壁愈合"目标提供了可行的非侵入性路径. 其早期预测治疗反应的能力, 使临床医生能够前瞻性地调整方案, 为真正实现个体化精准医疗奠定了基础.
展望未来, IUS的进一步发展有赖于三大支柱的协同并进. 首先, 是技术与标准的革新. 亟待通过大规模多中心研究, 建立并验证全球统一的IUS操作规范与评分系统(如MUC、IBUS-SAS), 同时积极融合剪切波弹性成像、对比增强超声及AI等新技术, 以突破当前在纤维化评估、操作者依赖性和浅表病变检测方面的局限. 其次, 是诊疗路径的整合. 将IUS深度嵌入UC的标准化诊疗路径, 构建以IUS为基础的阶梯式影像监测与床旁即时决策模型, 能有效优化医疗资源配置, 提升管理效率. 最后, 是人才的培养与技术的普及. 通过系统化的规范培训与质量控制, 推动IUS技术从顶尖学术中心向广大基层医疗机构的纵深发展, 是惠及更广泛患者群体的关键.
综上所述, 肠道超声正从一项优秀的辅助检查, 演进为溃疡性结肠炎长期管理的基石性工具. 随着循证证据的积累与技术生态的完善, 它有望成为临床医生手中如同听诊器一般不可或缺的延伸, 最终为改善UC患者的长期预后与生活质量贡献核心力量.
| 2. | 胡 俊聪, 裴 文婧, 李 军祥. 《溃疡性结肠炎中医诊疗专家共识(2023)》解读. 中国中西医结合消化杂志. 2024;32:420-425. |
| 3. | Bots S, De Voogd F, De Jong M, Ligtvoet V, Löwenberg M, Duijvestein M, Ponsioen CY, D'Haens G, Gecse KB. Point-of-care Intestinal Ultrasound in IBD Patients: Disease Management and Diagnostic Yield in a Real-world Cohort and Proposal of a Point-of-care Algorithm. J Crohns Colitis. 2022;16:606-615. [PubMed] [DOI] |
| 6. | 张 福桃, 张 雅乐, 孙 圆圆, 陈 平, 杜 春. 肠道超声在溃疡性结肠炎诊治中的研究进展. 胃肠病学和肝病学杂志. 2025;34:448-452. [DOI] |
| 7. | 徐 晓蓉, 徐 辉雄, 刘 畅, 林 辉, 赵 玉洁, 夏 玉敬, 施 嫣红, 翁 韵, 刘 占举. 肠道超声对炎症性肠病诊断和活动性评估的前瞻性研究. 胃肠病学和肝病学杂志. 2013;22:1013-1016. [DOI] |
| 9. | de Voogd FA, Bots SJ, van Wassenaer EA, de Jong M, Pruijt MJ, D'Haens GR, Gecse KB. Early Intestinal Ultrasound Predicts Clinical and Endoscopic Treatment Response and Demonstrates Drug-Specific Kinetics in Moderate-to-Severe Ulcerative Colitis. Inflamm Bowel Dis. 2024;30:1992-2003. [PubMed] [DOI] |
| 10. | Mu K, Sun Q, Li X, Du X, Gao H, Zhang W. The value of oral contrast-enhanced gastric ultrasonography in the diagnosis and staging of benign peptic ulcer. Sci Rep. 2024;14:17390. [PubMed] [DOI] |
| 11. | Christian M, Giovanni M, Torsten K, Mariangela A. Ultrasonography in inflammatory bowel disease - So far we are? United European Gastroenterol J. 2022;10:225-232. [PubMed] [DOI] |
| 12. | Allocca M, Calabrese E. Ultrasound-guided strategies in ulcerative colitis: early prediction and targeting. J Crohns Colitis. 2025;19:jjaf113. [PubMed] [DOI] |
| 13. | Frias-Gomes C, Torres J, Palmela C. Intestinal Ultrasound in Inflammatory Bowel Disease: A Valuable and Increasingly Important Tool. GE Port J Gastroenterol. 2022;29:223-239. [PubMed] [DOI] |
| 14. | Nishida M, Hasegawa Y, Hata J. Correction: Basic practices for gastrointestinal ultrasound. J Med Ultrason (2001). 2023;50:311. [PubMed] [DOI] |
| 15. | Zhao JY, Ju JY, Luo Y, Zhuang H. Validation of intestinal ultrasound scores in assessing endoscopic activity of colonic and small intestinal Crohn's disease in a southwest Chinese cohort: a retrospective cross-sectional study. Quant Imaging Med Surg. 2024;14:8374-8386. [PubMed] [DOI] |
| 17. | Dal Buono A, Armuzzi A. Transperineal Ultrasonography in the Assessment of Rectal Inflammation: Beyond the Monitoring of Ulcerative Colitis. Inflamm Bowel Dis. 2024;30:1437-1438. [PubMed] [DOI] |
| 19. | de Voogd F, van Wassenaer EA, Mookhoek A, Bots S, van Gennep S, Löwenberg M, D'Haens GR, Gecse KB. Intestinal Ultrasound Is Accurate to Determine Endoscopic Response and Remission in Patients With Moderate to Severe Ulcerative Colitis: A Longitudinal Prospective Cohort Study. Gastroenterology. 2022;163:1569-1581. [PubMed] [DOI] |
| 20. | Kucharzik T, Kannengiesser K, Petersen F. The use of ultrasound in inflammatory bowel disease. Ann Gastroenterol. 2017;30:135-144. [PubMed] [DOI] |
| 22. | Rispo A, Calabrese G, Testa A, Imperatore N, Patturelli M, Allocca M, Guarino AD, Cantisani NM, Toro B, Castiglione F. Hocus Pocus: the Role of Hand-held Ultrasonography in Predicting Disease Extension and Endoscopic Activity in Ulcerative Colitis. J Crohns Colitis. 2023;17:1089-1096. [PubMed] [DOI] |
| 24. | Lim KY, Raja Ali RA, Wong Z, Zaki FM, Maktar JF, Muhammad Nawawi KN. Evaluation of intestinal ultrasound for disease activity assessment in patients with inflammatory bowel disease: A cross-sectional study at a tertiary centre in Malaysia. Saudi J Gastroenterol. 2023;29:300-308. [PubMed] [DOI] |
| 25. | Yebra Carmona J, Poza Cordón J, Suárez Ferrer C, Martín Arranz E, Lucas Ramos J, Andaluz García I, Sánchez Azofra M, Rueda García JL, Martín Arranz MD. Correlation between endoscopy and intestinal ultrasound for the evaluation of postoperative recurrence of Crohn's disease. Gastroenterol Hepatol. 2022;45:40-46. [PubMed] [DOI] |
| 26. | 中华医学会消化病学分会炎症性肠病学组; 中国炎症性肠病诊疗质量控制评估中心; 吴 开春, 陈 旻湖, 钱 家鸣. 中国溃疡性结肠炎诊治指南(2023年·西安). 胃肠病学. 2024;29:145-173. [DOI] |
| 27. | Abraham BP, Reddy D, Saleh A. Integrating Intestinal Ultrasound into an Inflammatory Bowel Disease Practice: How to Get Started. Crohns Colitis 360. 2023;5:otad043. [PubMed] [DOI] |
| 28. | Dolinger MT, Kayal M. Intestinal ultrasound as a non-invasive tool to monitor inflammatory bowel disease activity and guide clinical decision making. World J Gastroenterol. 2023;29:2272-2282. [PubMed] [DOI] |
| 29. | Aprile F, Vangeli M, Allocca M, Zilli A, Argollo MC, D'amico F, Parigi TL, Danese S, Furfaro F. Gastrointestinal Ultrasound in Infectious Diseases: A Comprehensive Review. Medicina (Kaunas). 2024;60:1402. [PubMed] [DOI] |
| 30. | Liu HH, Lin Y, Lin G, Wang LJ, Wan YL. Ultrasonography of acute retroperitoneum. Ultrasonography. 2024;43:179-192. [PubMed] [DOI] |
| 31. | Hata J, Imamura H. The Use of Transabdominal Ultrasound in Inflammatory Bowel Disease. Korean J Radiol. 2022;23:308-321. [PubMed] [DOI] |
| 32. | Norouzi H, Dehghan P, Zamani S, Kaveh M, Mohammadzadeh M, Amin, Moghaddam M, Iravani S. Ultrasonography in inflammatory bowel disease, current status and future prospects: A review on findings, diagnostic performance and ultrasound-based scoring systems. Jpn J Gastroenterol. 2022;2:1089. |
| 33. | Rispo A, Testa A, Nardone OM, Guarino AD, Imperatore N, Fierro G, Castiglione F, Calabrese G. Intestinal Ultrasound and its Application as Point-of-Care Procedure for Diagnosing and Detecting Inflammatory Bowel Disease and Related Complications: A Narrative Review. Med Res Arch. 2023;11:1-15. [DOI] |
| 34. | Andrzejewska M, Grzymisławski M. The role of intestinal ultrasound in diagnostics of bowel diseases. Prz Gastroenterol. 2018;13:1-5. [PubMed] [DOI] |
| 35. | 颜 丽华, 骆 小冬, 刘 志, 张 妍琰, 覃 辉, 陈 烁淳, 李 颖嘉. 经腹肠道超声诊断克罗恩病合并肠瘘及肠腔狭窄. 中国医学影像技术. 2022;38:1192-1196. [DOI] |
| 38. | Tian J, Wang W, Liu Y, Zhang X, Zhao H, Qu H. Role of endoscopic ultrasound as a predictor of histological healing in ulcerative colitis. Ann Med. 2025;57:2499961. [PubMed] [DOI] |
| 39. | Wijers OB, Tio TL, Tytgat GN. Ultrasonography and endosonography in the diagnosis and management of inflammatory bowel disease. Endoscopy. 1992;24:559-564. [PubMed] [DOI] |
| 40. | 吴 朔春, 孙 雪峰, 王 文燕, 杨 梅. CT小肠造影对小儿溃疡性结肠炎临床活动分期的应用价值. 中国临床医学影像杂志. 2025;36:275-278, 284. [DOI] |
| 41. | Kobayashi K, Kawagishi K, Ooka S, Yokoyama K, Sada M, Koizumi W. Clinical usefulness of endoscopic ultrasonography for the evaluation of ulcerative colitis-associated tumors. World J Gastroenterol. 2015;21:2693-2699. [PubMed] [DOI] |
| 42. | Maple JT, Edmundowicz S. Using EUS to forecast the clinical course of ulcerative colitis: still a cloudy outlook. Gastrointest Endosc. 2007;65:261-262. [PubMed] [DOI] |
| 43. | 胡 亚辉. CT小肠造影对炎症性肠病的诊断价值. 中国CT和MRI杂志. 2018;16:128-130. [DOI] |
| 46. | 王 欣, 刘 静静, 王 雪莲, 顾 长青, 孙 冬雪, 陈 刘成. CT小肠造影影像对结肠型克罗恩病与溃疡性结肠炎的诊断价值. 分子影像学杂志. 2023;46:232-237. [DOI] |
| 48. | Gu P, Ziring D, Khanna PV, Ahmed W, Vasiliauskas E, Yarur A, Targan S, McGovern DPB, Rabizadeh S, Fleshner P, Abreu MT, Melmed GY. Relationship of Intestinal Ultrasound With Clinical, Biochemical, and Endoscopic Disease Severity in Acute Severe Ulcerative Colitis: A Blinded, Prospective Study. Clin Transl Gastroenterol. 2025;16:e00881. [PubMed] [DOI] |
| 49. | Hameed M, Kumar S, Taylor SA. How I Do It: Cross-sectional Imaging in Small-Bowel Crohn Disease and Ulcerative Colitis. Radiology. 2025;314:e241452. [PubMed] [DOI] |
| 50. | Shimizu S, Myojo S, Nagashima M, Okuyama Y, Sugeta N, Sakamoto S, Kutsumi H, Otsuka H, Suyama Y, Fujimoto S. A patient with rectal cancer associated with ulcerative colitis in whom endoscopic ultrasonography was useful for diagnosis. J Gastroenterol. 1999;34:516-519. [PubMed] [DOI] |
| 51. | Yoshizawa S, Kobayashi K, Katsumata T, Saigenji K, Okayasu I. Clinical usefulness of EUS for active ulcerative colitis. Gastrointest Endosc. 2007;65:253-260. [PubMed] [DOI] |
| 52. | Lew RJ, Ginsberg GG. The role of endoscopic ultrasound in inflammatory bowel disease. Gastrointest Endosc Clin N Am. 2002;12:561-571. [PubMed] [DOI] |
| 54. | Tsuga K, Haruma K, Fujimura J, Hata J, Tani H, Tanaka S, Sumii K, Kajiyama G. Evaluation of the colorectal wall in normal subjects and patients with ulcerative colitis using an ultrasonic catheter probe. Gastrointest Endosc. 1998;48:477-484. [PubMed] [DOI] |
| 55. | 彭 苗苗, 濮 田, 李 燕, 贺 晓, 赵 晔. 肠道超声在评估溃疡性结肠炎内镜活动中的应用. 中华炎性肠病杂志(中英文). 2024;8:429-433. [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 广东省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B, B
C级 (良好): 0
D级 (一般): D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁