修回日期: 2025-10-08
接受日期: 2025-11-14
在线出版日期: 2025-11-28
胃黏膜下肿瘤(submucosal tumor, SMT)样癌是指起源于粘膜内但在粘膜下生长的肿瘤, 在内窥镜检查中外观类似于良性粘膜下肿瘤. 极易在内镜检查中被误诊为良性病变(如间质瘤、平滑肌瘤等), 因此诊断挑战性极大.
本病例报告回顾性分析了4例经病理证实的胃SMT样癌. 患者年龄分布在46至66岁之间. 所有病例胃镜下均表现为黏膜下隆起性病变. 最终病理结果包括粘液腺癌、印戒细胞癌及低分化腺癌. 在治疗方面, 3例早期患者接受了根治性手术切除; 1例因确诊时已属晚期胃癌, 接受了系统性化疗. 本报告详细描述了这4例患者的临床表现、内镜、诊疗过程及结局.
对于胃黏膜下隆起性病变, 即使表面光滑, 也必须保持高度警惕. 结合超声内镜仔细评估病变层次和性质, 并进行深挖活检或内镜黏膜下剥离术诊断性切除, 对准确诊断黏膜下隆起样胃癌、避免漏诊至关重要.
核心提要: 常规的内窥镜活检诊断胃黏膜下肿瘤(submucosal tumor, SMT)样胃癌非常困难, 大多数胃癌来源于黏膜上皮细胞, 而SMT样胃癌几乎完全被正常黏膜覆盖. 由于迄今为止报告的病例数量有限, SMT样胃癌的临床病理特征仍不清楚. 大多数胃SMT样癌发生在胃的上、中三分之一, 与以往研究结果不同的是, 在我们本次报道的病例中, 病灶均位于胃体下部大弯侧. 我们展示了4例SMT样胃癌, 并对数据和相关文献进行了综合回顾, 以概述 SMT样胃癌的临床病理特征.
引文著录: 康海锋, 戴晓燕, 张燕, 仇建伟, 吴小飞. 胃黏膜下肿瘤样癌临床分析并文献复习: 4例. 世界华人消化杂志 2025; 33(11): 937-944
Revised: October 8, 2025
Accepted: November 14, 2025
Published online: November 28, 2025
Submucosal tumor (SMT)-like gastric cancer describes a tumor that originates within the mucosa but grows submucosally, resembling a benign submucosal tumor in appearance during endoscopy. It is easily misdiagnosed as a benign lesion (e.g., gastrointestinal stromal tumor and leiomyoma), posing a significant diagnostic challenge.
This case report retrospectively analyzes four cases of pathologically confirmed SMT-like gastric cancer. The patients ranged in age from 46 to 66 years. Gastroscopy revealed submucosal elevated lesions in all cases. The final pathological diagnosis included mucinous adenocarcinoma, signet-ring cell carcinoma, and poorly differentiated adenocarcinoma. Regarding treatment, three early-stage patients underwent curative surgical resection, while one patient, diagnosed with advanced gastric cancer, received systemic chemotherapy. The clinical presentations, endoscopic manifestations, diagnostic workup, management, and outcomes of these four cases are described in detail.
Maintenance of a high index of suspicion is mandatory for gastric submucosal elevated lesions, even those with a smooth surface. Accurate diagnosis of SMT gastric cancer and prevention of missed diagnoses rely on a thorough endoscopic ultrasonography evaluation of the lesion's layer and nature, followed by deep bite biopsy or diagnostic endoscopic submucosal dissection.
- Citation: Kang HF, Dai XY, Zhang Y, Qiu JW, Wu XF. Submucosal tumor-like gastric cancer: Clinical analysis of four cases with a literature review. Shijie Huaren Xiaohua Zazhi 2025; 33(11): 937-944
- URL: https://www.wjgnet.com/1009-3079/full/v33/i11/937.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i11.937
2025年癌症统计报告, 胃癌是中国癌症相关死亡的第三大原因[1]. 尽管该疾病症状各异, 但表现为胃黏膜下肿瘤(submucosal tumor, SMT)样胃癌的却极为罕见, 占所有切除胃癌的0.2%-0.62%[2]. 常规的内窥镜活检难以诊断胃SMT样癌, 大多数胃癌来源于黏膜上皮细胞, 而胃SMT样癌几乎完全被正常黏膜覆盖. 由于迄今为止报告的病例数量有限, 胃SMT样癌的临床病理特征仍不清楚. 在本文中, 我们报告了4例胃SMT样癌病例, 并对数据和相关文献进行了综合回顾, 以概述 胃SMT样癌的临床病理特征.
从2021-2024我们诊断出4例具有黏膜下肿瘤特征的胃癌病例, 所有病例均由经验丰富且专业的病理医生确认.
病例1: 患者, 女, 66岁, 因"反复上腹部胀痛3 mo余"于2021-02入院.
病例2: 患者, 男, 56岁, 因"进食不畅3 mo余"于2024-06门诊就诊.
病例3: 患者, 女, 46岁, 因"黑便2 d"于2024-07入院.
病例4: 患者, 女, 64岁, 因"乏力纳差伴腹胀不适1 mo余"于2024-07入院.
病例1: 患者3 mo余前开始出现进食后上腹饱胀明显, 伴嗳气, 无腹痛, 无恶心呕吐, 无呕血黑便, 遂至如皋中医院查胃镜: 胃底体交界大弯侧见一隆起, 大小约2 cm×2 cm, 中央凹陷, 覆黄苔, 凹陷边缘毛细血管增生. 诊断: 胃底体交界隆起型病变改变. 后为进一步诊疗, 门诊拟"胃肿物"收住入院. 病程中患者神清、精神可, 食纳欠佳, 大小便通畅.
病例2: 患者3 mo余前开始出现有时进食不畅, 有阻塞感, 进食干饭明显, 无恶心呕吐, 无嗳气泛酸, 遂至南通大学第二附属医院门诊就诊, 发病以来患者神清、精神可, 食纳欠佳, 大小便通畅.
病例3: 患者2 d前无明显诱因下解黑便1次, 量不多, 感上腹部不适、全身乏力, 无腹痛腹胀, 无恶心呕吐, 遂至南通大学第二附属医院急诊就诊, 查急诊血常规: 白细胞: 7.1×109/L; 红细胞: 2.46×1012/L↓; 血红蛋白: 71 g/L↓; 血小板: 207.0×109/L; CT全腹部平扫: 肝脏钙化灶; 左肾小结石. 子宫形态欠规则, 必要时超声. 腰椎术后改变. 急诊予抑酸护胃、抗感染、抑制内脏血流、输血等治疗. 现为求进一步诊治, 急诊拟"消化道出血"收住入院. 病程中, 患者神清、精神可, 饮食、夜眠欠佳, 体重无明显变化, 大便无特殊.
病例4: 患者1 mo余前无明显诱因开始出现乏力纳差, 伴上腹部阵发性胀痛, 夜间明显, 2024-10-22至南通大学第二附属医院查血常规: 白细胞: 5.4×109/L; 中性粒细胞%: 59.4%; 红细胞: 4.20×1012/L; 血红蛋白: 132 g/L; 血小板: 280.0×109/L; 后完善激光超声胃镜: 胃体粘膜下隆起. 上腹部CT平扫: 胃体、胃窦部胃壁增厚, 大网膜、腹膜、系膜多发结节伴渗出, 建议内镜及增强检查. 右侧输尿管腹段、肾盂扩张, 建议完善下腹部CT检查. 肝脏钙化灶或肝内胆管结石; 左侧肾上腺增粗. 进一步诊治, 门诊拟"乏力"收住入院. 病程中, 患者神清、精神可, 饮食、夜眠正常, 体重无明显变化, 大小便无特殊.
病例1-4: 无特殊.
病例1-4: 生于原籍, 否认长期外地居住史, 否认毒物接触史. 无吸烟、饮酒史. 家族中否认遗传性疾病及类似病史. 家族无肿瘤病史.
病例1: 神志清, 精神可, 腹平软, 全腹无明显压痛、反跳痛.
病例2: 神志清, 精神可, 腹平软, 全腹无明显压痛、反跳痛.
病例3: 神志清, 精神欠佳, 贫血貌, 腹平软, 无压痛、反跳痛及肌紧张.
病例4: 神志清, 精神可, 腹平软, 中上腹有压痛, 无反跳痛.
病例1: 血常规、肿瘤指标正常.
病例2: 血常规、肿瘤指标正常.
病例3: 血常规: 白细胞: 7.1×109/L; 红细胞: 2.46×1012/L↓; 血红蛋白: 71 g/L↓; 血小板: 207.0×109/L; 血清肿瘤标志物未见异常.
病例4: 血常规、血清肿瘤标志物正常.
病例1: 胸腹部增强CT: 胃底部见一类圆形强化结节, 大小约2.0 cm×1.2 cm, 边界清晰, 增强后明显强化. 腹膜后淋巴结未见肿大. 腺瘤伴上皮异型增生、癌变, 位于黏膜下层.
病例2: 暂无.
病例3: CT全腹部平扫+增强: 胃部充盈可, 壁光整, 未见明显异常增厚及强化. 腹腔淋巴结未见肿大.
病例4: 腹部CT增强: 右侧输尿管壁增厚伴强化、周围渗出, 膀胱右后壁占位, 右侧尿路梗阻, 考虑恶性病变可能大. 胃体、胃窦部胃壁增厚, 大网膜、腹膜、肠系膜多发结节, 伴渗出. 考虑输尿管或膀胱占位腹膜转移侵犯胃壁可能. 正电子发射计算机断层显像(positron emission tomography-computed tomography, PET-CT): (1)胃体、胃窦部胃壁增厚, 氟脱氧葡萄糖(fluorodeoxyglucose, FDG)代谢轻度增高; 大网膜、腹膜及系膜多发絮状影, 结节影, FDG代谢轻度增高; 部分结肠管壁见片状、结节状FDG代谢轻度增高; 综上, 考虑胃Ca伴腹膜多发转移、部分肠管浆膜面转移可能, 建议结合内镜病理明确; (2)右侧输尿管上段管壁增厚伴周围絮状影, 右侧肾盂及输尿管上段稍扩张, 考虑胃Ca继发性改变不除外; (3)膀胱右后方软组织密度影, FDG代谢未见增高, 考虑膀胱外来源, 倾向良性, 宫颈肌瘤可能, 建议结合B超. 腹腔多发渗出. 盆腔积液. 结合PET-CT考虑胃来源可能大.
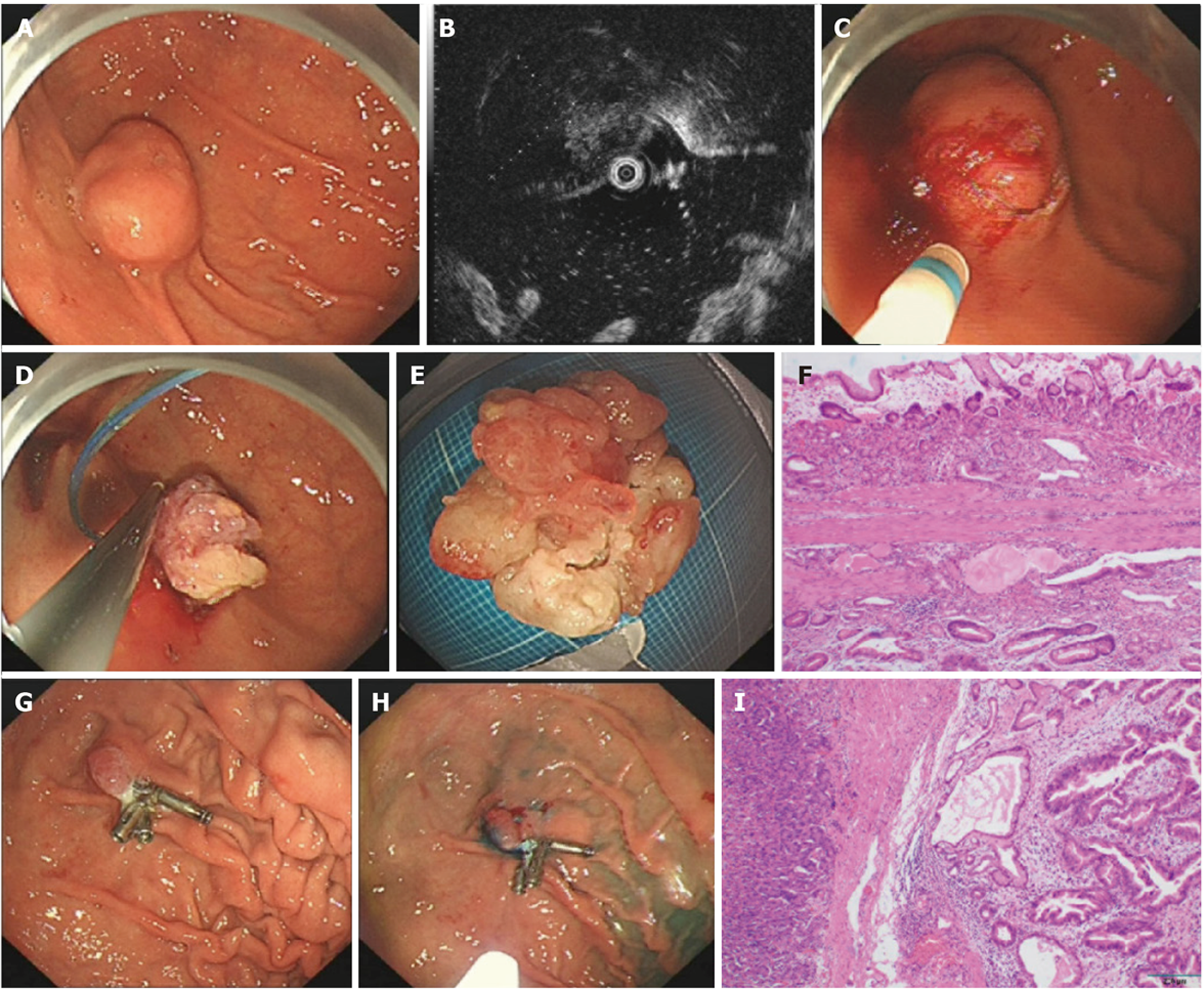
病例1: 胃镜: 胃体见2.0 cm半球形黏膜下隆起, 表面脐样凹陷(图1A). 超声胃镜(endoscopic ultrasonography, EUS)检查(图1B): 超声探头显示局部2.1 cm×1.7 cm椭圆形低回声区, 内部类圆形无回声区, 边界清, 来源超声第4层结构.
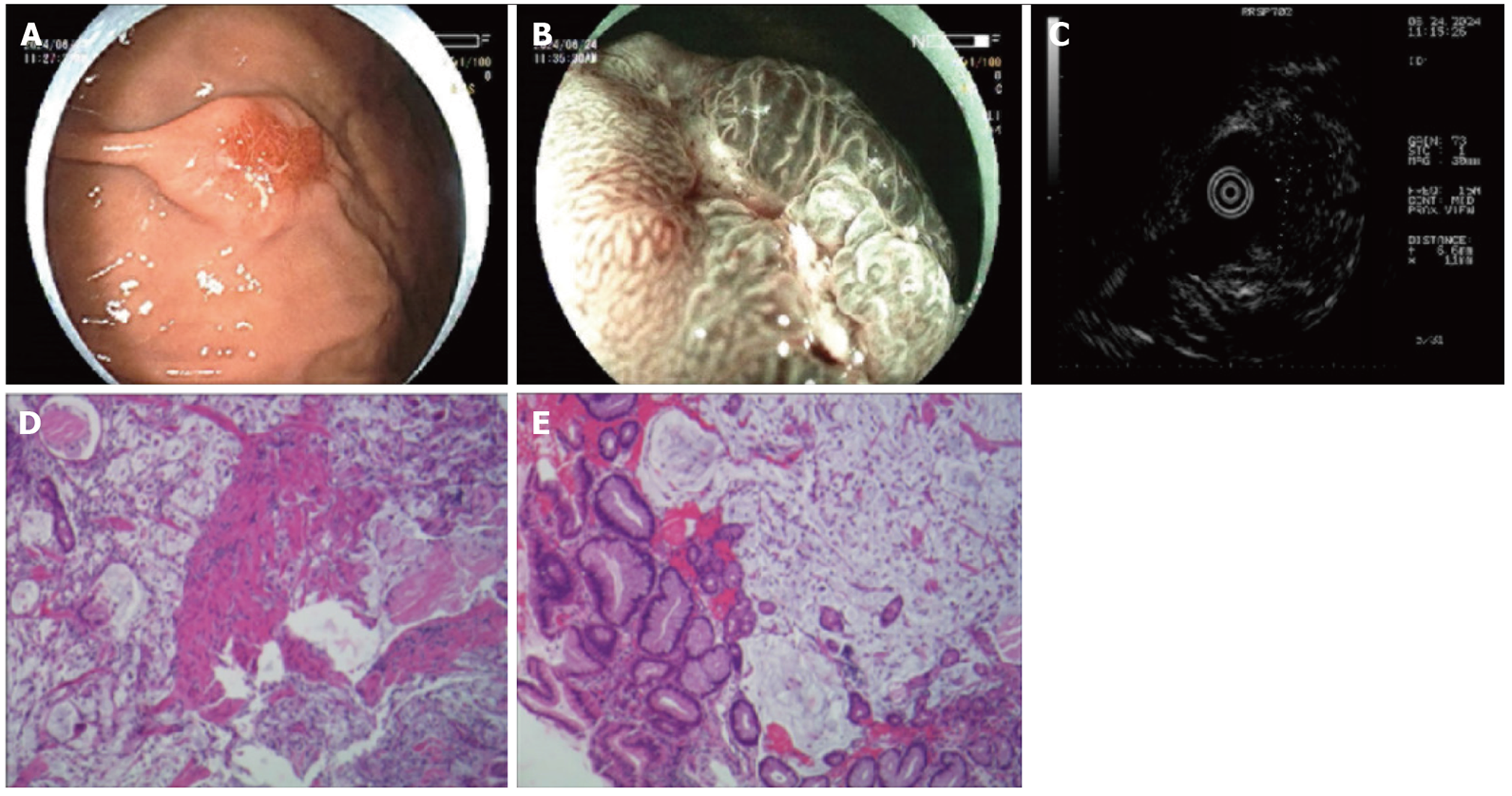
病例2: 激光超声胃镜示胃体下部前壁1.2 cm×0.8 cm Ⅱa型病变, 表面充血、糜烂, 蓝激光成像(blue laser imaging, BLI)放大观察腺管结构稍紊乱, IMVP(-), DL(-); FUJINON SP702 MPS 15MHz超声探查局部胃壁增厚, 第1、2层呈低回声改变, 3-5层结构尚清晰(图2A和B); 活检病理: (胃体下部前壁)低粘附性癌(粘液腺癌)(图2C).
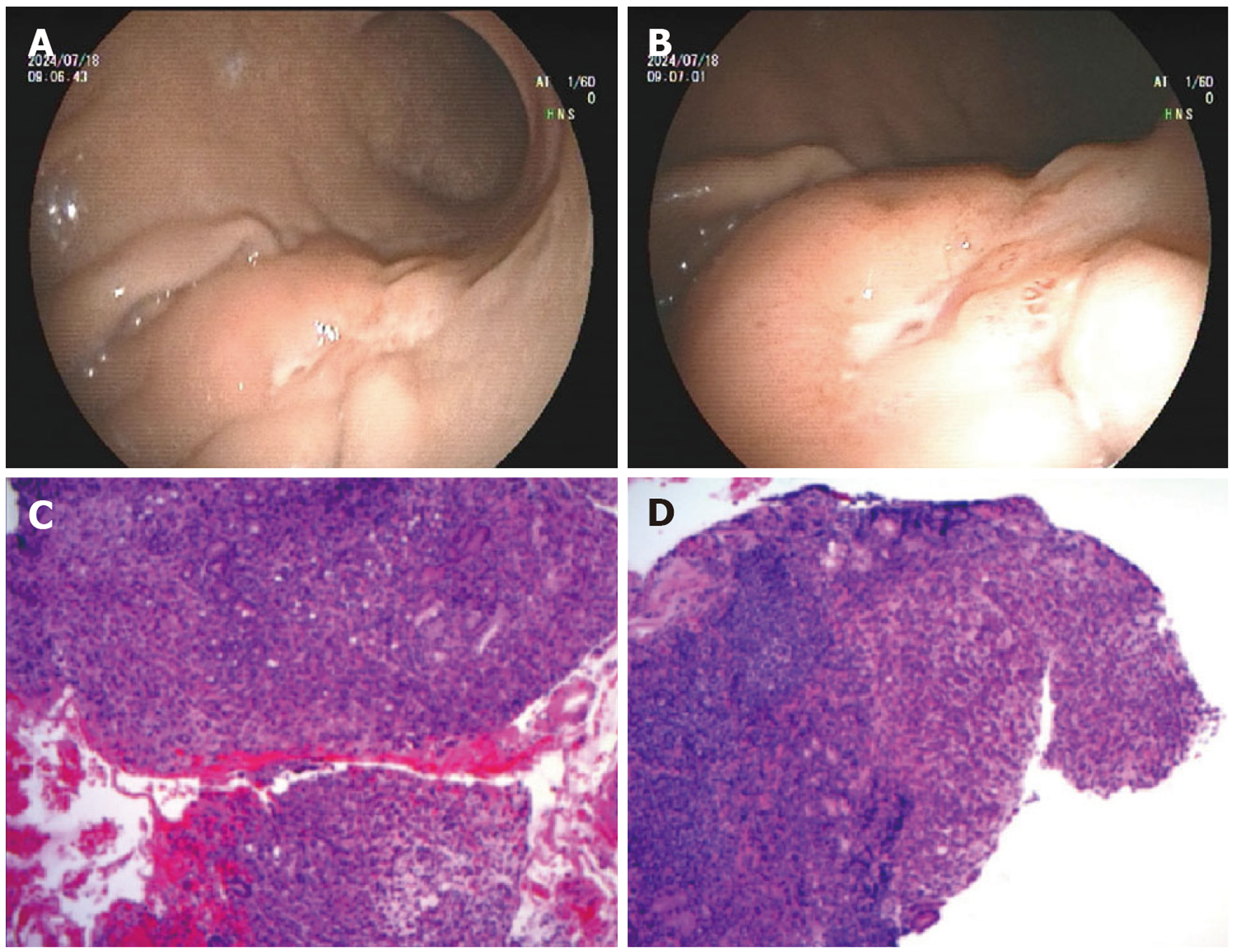
病例3: 胃镜: 胃体下部大弯侧见2.5 cm×2.0 cm隆起型病灶, 表面褪色调, 局部溃疡形成、中央见血管裸露. 活检病理: 胃体低分化腺癌(图3).
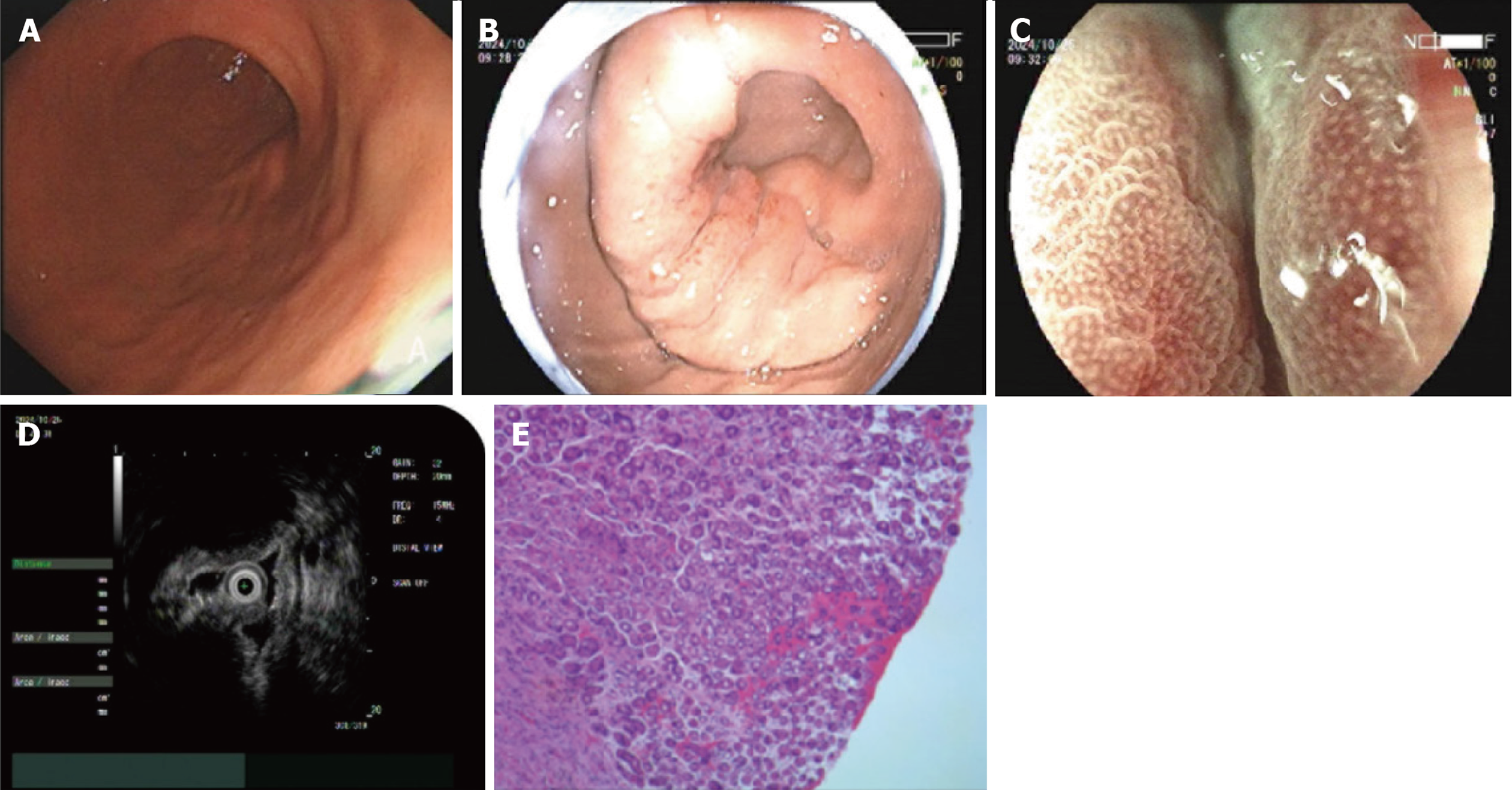
病例4: 激光超声胃镜提示: 胃体下部大弯侧见黏膜下隆起, 表面充血, 局部胃壁僵硬、蠕动消失. BLI放大观察示IMSP(-), IMVP(-), FUJINON SP702 MPS 15 MHz超声探查见第1、2层回声存在, 第3-5层回声消失、呈低回声改变, 大小约2.6 cm×1.5 cm; 深挖活检后病理提示胃差分化粘液癌. 免疫组化: CKpan(+), CK18(+), CEA(部分弱+), Syn(-), CgA(-), CD56(-), Ki-67(高表达), CD68(-), Vimentin(-), GATA-3(-), P63(-)(图4).
病例1-3: 胃癌; 病例4: 胃癌伴多发转移.
病例1: 结合腹部影像学及超声未见检查考虑来源于固有肌层的间质瘤可能大, 行胃黏膜下剥离术(endoscopic submucosal dissection, ESD)(图1C-E). 但术中我们使用器械触碰瘤体时发现瘤体柔软, 内部疑似有波动感, 切开部分黏膜发现有液化组织流出, 考虑诊断存疑. 最终病理示胃体: 腺瘤伴上皮异型增生、癌变, 位于黏膜下层(图1F). 根据eCura评分系统, 外科行腹腔镜胃癌根治术(D2全胃切除, 食管空肠ROUX-en-Y吻合). 术前我们在病变处进行钛夹术前定位(图1G), 术后病理: B:Her-2(-), MUC2(-), MUC5AC(少数细胞+), MUC6(-), MLH1(+), PMS2(+), MSH2(+), MSH6(+), CD10(+), E-Cadherin(+), P53(30%+), CDX-2(+), Ki-67(1+), EBER(-). (胃体)内翻性增生性息肉, 伴部分腺上皮高级别上皮内瘤变, 局部癌变(Tub1),并印戒细胞癌(Sig), Lauren分型: 混合型(Tub1+Sig), 浸润黏膜下层(pT1b/sm3);未见血管/淋巴管浸润(图1H).
病例2: 行胃癌根治手术+免疫治疗.
病例3: 外科行腹腔镜下胃癌根治术(胃大部切除伴胃空肠吻合术, 远端胃, 毕Ⅱ式+腹腔镜下胃D2淋巴结清扫+空肠侧侧吻合术), 术后病理: "胃体大弯"印戒细胞癌, 5.5 cm×1.0 cm, 见神经侵犯, 脉管内见痂栓, 侵犯浆膜, 上、下切缘未见肿瘤, 送检淋巴结19枚, 未见癌转移(0/19, 小弯淋巴结0/13, 大弯淋巴结0/4, 第14V淋巴结0/2); IHC: 肿瘤细胞Claudin18.2(30%弱), TROP2(-), HER2(0), Ki67(15%), PMS2(+), MLH1(+), MSH2(+), MSH6(+), PD-L1 22C3(TPS 0, CPS<1), cdx2(少数+), GATA-3(-), ER(-), PR(-). 予奥沙利铂+替吉奥50 mg化疗.
病例4: 患方选择了经典的免疫治疗+SOX方案, 目前已治疗12个周期.
病例1: 术后恢复良好, 术后4年定期复查胃镜及腹部CT未见复发迹象. 该病例突出了术前诊断的困难性以及ESD的诊断价值.
病例2: 至今复查未见明显转移迹象. 该病例强调了EUS下深挖活检的重要性.
病例3: 2025-07复查胃镜吻合口光滑, 腹部CT未见转移复发迹象. 该病例展示了内镜初筛的重要性.
病例4: 2025-08复查腹部增强CT: 腹网膜转移较前大致相仿, 胃周、后腹膜小淋巴结较前部分稍有缩小. 目前患者一般情况可. 该病例展示了胃SMT样癌的晚期弥漫性改变.
胃SMT样癌描述的一种具有欺骗性的生长模式, 即肿瘤是黏膜内起源, 但黏膜下优势生长, 从而内镜下模拟良性黏膜下肿瘤的形态. 以间质瘤(gastrointestinal stromal tumor, GIST)、胃神经内分泌瘤、神经鞘瘤、平滑肌瘤、脂肪瘤、异位胰腺和淋巴瘤多见[3]. 胃SMT样癌是一种特殊类型的胃癌, 组织学上类似SMT, 但具有癌的生物学行为. 由于疾病罕见, 目前临床病理特征仍不清楚.
胃SMT样癌的发病机制尚不完全明确. 随着早期胃癌检测和诊断方式的多样化, 胃SMT样癌检出率逐步增加, 包括胃腺癌[2]、胃粘液腺癌[4]和淋巴上皮瘤样癌[5]. 胃粘液腺癌相对罕见, 仅占所有胃癌病例的2.1%-8.1%[6]. 我们本次报道的4个病例中3例为胃粘液腺癌, 世界卫生组织规定细胞外含有大量黏液, 并且黏液量超过瘤体50%的胃癌为胃粘液腺癌, 其之所有容易形成黏膜下肿瘤样的形态, 可能与其独特的生物学行为[7]相关包括: (1)粘液腺癌具有强烈的浸润和扩散倾向, 癌细胞产生的大量粘液更容易沿着组织间隙横向扩散, 而非向上破坏黏膜层, 这就使得肿瘤早期阶段表面黏膜被顶起尚未完全被破坏, 从而内镜下呈现出黏膜下肿瘤的假象; (2)由于黏膜下层或黏膜中粘蛋白积聚, 黏膜下层明显增厚, 对周围组织产生推挤和分离作用, 相对疏松的结缔组织为粘液积聚和肿瘤横向蔓延提供了空间, 故大多胃黏液腺癌大体分型表现为隆起型[4]外观, 在上述机制下, 肿瘤主体位于黏膜下层, 表面黏膜可能仅表现为充血水肿, 所以内镜下极可能被误诊为良性肿瘤, 因而对于胃SMT病变, 即使胃镜病理提示良性特征, 应注意细微的变化, 如是否存在侵蚀、凹陷和肿瘤边缘的状态, 积极行EUS深挖活检或ESD诊断性切除是必要的. 胃粘液腺癌的生物学行为与非粘液腺癌相似, 其结果与肿瘤分化、大小和位置、浸润深度、淋巴结转移和临床分期有关, 与粘蛋白含量无关. 多变量分析结果表明, 粘液组织亚型不是胃癌患者的独立预后因素; 然而, 早期胃粘液腺癌患者术后预后良好[8]. 本文中2例粘液腺癌, 1例经胃癌根治术治疗+免疫治疗, 随访了15 mo, 在此期间没有观察到明显复发或转移, 1例免疫+化疗, 随访15 mo未见明显进展. 低分化腺癌中淋巴细胞过度浸润、黏膜下淋巴滤泡及间质结缔组织增生, 往往使其在早期即表现出更深层浸润的生物学倾向[2]. 另外, 黏膜下异位胃腺在慢性炎症的作用及基因突变的积累上可发展为浸润性腺癌[9]. 深部囊性胃炎是一种特殊类型的慢性萎缩性胃炎, 长期的、持续的黏膜损伤、修复、再生和异型增生, 打破了正常胃黏膜细胞的生长平衡, 最终可导致恶性转化[10].
胃是消化道SMT最好发部位, 大多数胃SMT样癌发生在胃的上、中三分之一, 并伴有黏膜中央凹陷和肌层浸润[2]. 具有中央溃疡、桥形皱襞或不规则红斑变化的胃SMT应怀疑恶性肿瘤[11,12]. 与以往研究结果不同的是, 在我们本次报道的病例中, 病灶均位于胃体下部大弯侧, 可能是由于大弯侧黏膜皱襞更丰富, 黏膜下层更疏松, 为癌细胞在黏膜下层进行横向浸润和扩散提供更广阔的空间, 如上文所述, 粘液腺癌富含粘液, 这种疏松的黏膜下层是其理想的"扩散温床". 当然我们病例数量相对较少, 其分布特点可能与基于大规模人群的文献数据存在偏差. 文献数据可能基于特定国家, 其幽门螺杆菌感染率、饮食习惯等都可能因地域差异存在偏颇, 都可能影响癌的亚型分布及好发位置. 胃体中下部大弯侧的高发也暗示了这类肿瘤具有更强的弥散浸润性及黏膜下播散能力, 这与印戒细胞癌和粘液腺癌的恶性特征是相符的. 一般<2 cm的消化道SMT通常没有明显的临床症状, CT图像上胃壁本身就是一条软组织密度影, 小的密度相近的黏膜下隆起"隐匿"其中, 很难被发现, 再加上这种肿瘤是横向黏膜下层浸润, 而非垂直向胃腔外突出或形成巨大肿块[13], 所以早期SMT样胃癌的诊断通常很困难. 常规白光内镜可以提供病变位置、大小、活动度、黏膜色泽、形态、糜烂出血等情况, 但无法判断病变的性质及来源, 也无法与腔外压迫性病变进行鉴别. 美国胃肠病学协会2023年发布的关于胃肠道上皮下病变诊断和管理临床实践指南提到EUS是评估胃肠道不确定的上皮下病变和或通过钳夹活检未明确诊断组织的首选方式[14]. EUS可以提供有关肿瘤及其周围结构的信息及可视化胃SMT的起源层, 深挖活检、EUS引导下细针穿刺活检或先进的内窥镜技术(去顶或内窥镜黏膜下切除术)进行取样尤为重要. Kawamoto等[15]报道EUS下恶性SMT的特征如下: (1)肿瘤大小>30-50 mm; (2)肿瘤快速生长; (3)回声异质性; (4)边缘不规则. 本文3例主要表现为EUS下第一层回声正常, 大部分是2 cm左右的大小病灶, 内镜表现也多样化比如脐样凹陷、隆起型病灶、溃疡形成等. 关于治疗也大相径庭, 2003版中国消化道黏膜下肿瘤内镜诊治专家共识提出[7], 术前检查怀疑或活检病理证实存在恶性潜能的肿瘤, 特别是对于术前评估肿瘤长径≤2 cm疑似GIST且复发转移风险低并可能完整切除的可内镜下切除(内镜黏膜下挖除术、经黏膜下隧道内镜肿瘤切除术等), 但内镜下切除的主要角色是诊断性而非根治性, 对于本身就是印戒细胞癌或粘液癌的病变, ESD过程中的电凝、切割、注水, 理论上存在导致肿瘤细胞脱落、经创面进入淋巴管或血管, 甚至导致腹膜种植可能, 像病例1ESD后追加手术, 有可能导致延误时机, ESD局部炎症增加手术难度以及影响淋巴结清扫等; 对于部分明确发生淋巴结或远处转移的SMT, 为获取病理需大块活检, 可视为相对禁忌证; 明确发生淋巴结或远处转移的病变是内镜下治疗的禁忌; 在治疗局部晚期或临界可切除的GIST时, 由于淋巴转移很少见, 一般进行楔形切除术, 而不进行区域淋巴结清扫术; 而对于浸润深度超过黏膜下层, 或病理为高危类型(印戒、低分化、粘液腺癌)或存在淋巴管侵犯的SMT样癌需要根治性胃切除术和淋巴结清扫术, 术后辅助化疗能显著提高生存率. 第4个病例中, 诊断即为晚期, 病人往往更多只能选择全身化疗的姑息性治疗, 因此, 对于任何怀疑SMT样癌的病变, EUS深挖活检应作为首选诊断手段, 除非有极强把握为低度恶性、浅表病变, 应慎用ESD/EMR作为一线治疗. 尽一切努力在治疗前获得准确的诊断将对个体化多学科治疗提供更多治疗依据.
综上所述, 胃SMT样癌的诊断需要结合内镜、影像学和病理学检查. 内镜检查是诊断胃SMT样癌的首选方法, EUS可以提高诊断的准确性. 常规内镜检查观察到边界不规则、表面溃疡、体积明显增加、病灶内异质性或局部淋巴结扩张等高危特征, 推荐"白光内镜+EUS+深挖活检/EUS-FNA"的诊断流程, 以减少误诊, 延误治疗. 本文分享介绍了4例胃SMT样癌的临床特点、诊断要点, 展示了胃SMT样癌的多样性及复杂性, 强调了早期EUS活检病理诊断的重要性及多学科协作的必要性. 为临床诊断和治疗提供了参考.
| 1. | Siegel RL, Kratzer TB, Giaquinto AN, Sung H, Jemal A. Cancer statistics, 2025. CA Cancer J Clin. 2025;75:10-45. [PubMed] [DOI] |
| 2. | Umehara Y, Kimura T, Okubo T, Sano Y, Nakai K, Oi S, Higashi Y, Funai K. Gastric carcinoma resembling submucosal tumor. Gastric Cancer. 1999;2:191-193. [PubMed] [DOI] |
| 3. | Yang B, Lu X. The malignancy among gastric submucosal tumor. Transl Cancer Res. 2019;8:2654-2666. [PubMed] [DOI] |
| 4. | Yasuda K, Shiraishi N, Inomata M, Shiroshita H, Ishikawa K, Kitano S. Clinicopathologic characteristics of early-stage mucinous gastric carcinoma. J Clin Gastroenterol. 2004;38:507-511. [PubMed] [DOI] |
| 5. | Kato M, Hayashi Y, Fukumoto K, Nagai K, Tsujii Y, Shinzaki S, Iijima H, Takehara T. Early gastric cancer with lymphoid stroma presenting as a subepithelial lesion diagnosed by endoscopic submucosal dissection. Clin J Gastroenterol. 2018;11:382-385. [PubMed] [DOI] |
| 6. | Wang C, Ye F, Zhang H, Chen J, Meng L, He X. Case Report: Clinicopathological characteristics of patients with gastric cancer with features of a submucosal tumour. Front Oncol. 2023;13:1059815. [PubMed] [DOI] |
| 7. | 中华医学会消化内镜分会NOTES、外科学组; 中国医师协会内镜医师分会消化内镜专业委员会; 中华医学会外科学分会胃肠外科学组. 中国消化道黏膜下肿瘤内镜诊治专家共识(2023版). 中国实用外科杂志. 2003;43:241-251. [DOI] |
| 8. | Kume K, Yoshikawa I, Yamazaki M, Abe S, Murata I, Otsuki M. A case of gastric cancer with features of submucosal tumor. Gastrointest Endosc. 2001;53:247-249. [PubMed] [DOI] |
| 9. | Manabe S, Mukaisho KI, Yasuoka T, Usui F, Matsuyama T, Hirata I, Boku Y, Takahashi S. Gastric adenocarcinoma of fundic gland type spreading to heterotopic gastric glands. World J Gastroenterol. 2017;23:7047-7053. [PubMed] [DOI] |
| 10. | Itami H, Morita K, Nakai T, Uchiyama T, Sugimoto S, Sasaki S, Matsuoka M, Myojin T, Nitta Y, Okabe F, Fujii T, Hatakeyama K, Mitoro A, Sho M, Ohbayashi C. Gastritis cystica profunda is associated with aberrant p53 and Epstein-Barr virus in gastric cancer: A clinicopathological, immunohistochemical and in situ hybridization study. Pathol Int. 2021;71:42-50. [PubMed] [DOI] |
| 11. | Torres JMK, Uy TCF, Maralit RM. Gastric Adenocarcinoma Presenting as a Submucosal Tumor: A Case Report. Acta Med Philipp. 2024;58:76-81. [PubMed] [DOI] |
| 12. | Cho JH, Lee SH. Early gastric cancer presenting as a typical submucosal tumor cured by endoscopic submucosal dissection: A case report. World J Gastroenterol. 2022;28:2994-3000. [PubMed] [DOI] |
| 13. | Yang H, Li Z, Wei Z, Li G, Li Y, Wu S, Ji R. Coexistence of early gastric cancer and benign submucosal lesions mimic invasive cancer: a retrospective multicenter experience. BMC Gastroenterol. 2023;23:409. [PubMed] [DOI] |
| 14. | Jacobson BC, Bhatt A, Greer KB, Lee LS, Park WG, Sauer BG, Shami VM. ACG Clinical Guideline: Diagnosis and Management of Gastrointestinal Subepithelial Lesions. Am J Gastroenterol. 2023;118:46-58. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 江苏省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D, D, D, D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁