修回日期: 2025-09-03
接受日期: 2025-10-15
在线出版日期: 2025-10-28
乙型肝炎病毒(hepatitis B virus, HBV)感染引起的慢性乙型肝炎(chronic hepatitis B, CHB)会显著影响肠道菌群的构成. 通过"肠-肝轴", 肠道微生态反过来亦能调控肝脏免疫代谢状态, 从而影响CHB的病情演变及预后, 促使疾病向肝硬化甚至肝细胞癌发展. HBV与肠道菌群之间存在双向调控机制, 是推动CHB持续进展的重要因素. 本文从肠道菌群失衡、代谢产物变化及免疫机制等方面系统阐述肠道微生态在CHB中的作用, 并总结肠道菌群干预策略的最新进展, 旨在为CHB的精准治疗提供新思路.
核心提要: 通过益生菌、合生元、粪菌移植等手段干预肠道微生态, 可有效改善慢性乙型肝炎相关肠-肝轴功能障碍, 辅助实现抗病毒治疗目标及延缓疾病进展, 有望推动临床治愈的实现. 未来研究进一步聚焦于"肠-肝轴"在乙型肝炎病毒免疫清除过程中的调控机制.
引文著录: 李博驹, 王欣钰, 李亚萍. 肠-肝轴视角下肠道菌群对慢性乙型肝炎的调控作用. 世界华人消化杂志 2025; 33(10): 765-770
Revised: September 3, 2025
Accepted: October 15, 2025
Published online: October 28, 2025
Chronic hepatitis B (CHB) caused by hepatitis B virus (HBV) infection can significantly alter the composition of the gut microbiota. Through the gut-liver axis, the intestinal microecosystem in turn modulates hepatic immune and metabolic states, thereby influencing the progression and prognosis of CHB and promoting disease advancement toward liver fibrosis and even hepatocellular carcinoma. A bidirectional regulatory relationship exists between HBV and the gut microbiota, which serves as a driving force in the persistent progression of CHB. This review systematically summarizes the roles of gut dysbiosis, microbial metabolites, and immune mechanisms in the pathogenesis of CHB, and highlights recent advances in gut microbiota-targeted therapeutic strategies, aiming to provide new insights for precision treatment of CHB.
- Citation: Li BJ, Wang XY, Li YP. Regulatory role of gut microbiota in chronic hepatitis B: A perspective from the gut-liver axis. Shijie Huaren Xiaohua Zazhi 2025; 33(10): 765-770
- URL: https://www.wjgnet.com/1009-3079/full/v33/i10/765.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i10.765
乙型肝炎病毒(hepatitis B virus, HBV)感染是全球性的公共卫生问题. 据报道[1], 全球慢性HBV感染者约有3.16亿. 尽管我国在过去四十年中HBV感染率已显著下降, 仍有超过7500万人患有慢性乙型肝炎(chronic hepatitis B, CHB)[2], 其带来的公共卫生压力依旧严峻. CHB患者人数依然庞大与多种因素相关, 包括病毒毒力、肝功能状态及个体免疫应答等. 近年来, 随着"肠-肝轴"研究的不断深入, 肠道微生态对肝病的影响逐渐受到重视. CHB的病程演变与抗病毒治疗可导致微生物组与代谢组的显著变化, 反过来, 肠道菌群的结构及代谢产物的改变亦可影响CHB的肝功能状态及肝细胞癌的发生风险. 因此, 探讨肠道微生态在CHB发展与预后中的作用, 有助于深化对HBV感染机制的理解, 并为临床治疗策略提供新的方向.
肠道微生态由正常菌群及其所处环境共同构成, 其核心即为定植于肠道的正常菌群. 肠道菌群通过肠-脑、肠-肺、肠-肝等轴与多系统密切联通, 维持宿主健康. 在CHB患者中, HBV感染可通过多种机制破坏肠道菌群构成, 形成特异性失衡状态, 影响菌群功能. 正常人群肠道菌群构成受解剖部位、年龄、种族、地理和饮食因素影响. 陈赛娟等[3]研究发现, 中国人群的肠道菌群可划分为普氏菌型、拟杆菌型、埃希氏菌型及混合型. 功能上, 肠道菌群可发酵不可消化食物、合成维生素、清除毒物、抑制病原、增强屏障功能, 其稳定性对宿主健康至关重要. 研究表明, 不论CHB患者处于慢性感染、肝硬化或肝癌阶段, 其肠道菌群普遍存在失衡. 其中, 拟杆菌门/厚壁菌门比值升高, 变形菌门显著增多[3]. 具体表现为双歧杆菌、乳酸杆菌水平降低, 肠球菌、肠杆菌水平升高[4]. 随着疾病进展, 菌群多样性下降, 条件致病菌比例上升. 对于不同病毒载量, 肠道菌群多样性呈现层次变化, 低载量相比高载量患者肠道菌群的多样性较高[5]. 对于HBV相关的慢加急性肝衰竭, 有研究认为肠道微生态的改变是"炎症风暴"发生的前驱因素[6]. 随着病情进展为肝硬化期或肝癌过程中, 肠道菌群多样性随着疾病进展不断降低, 条件致病菌占比增加, 如在HBV相关的肝硬化肝癌患者粪便中大肠杆菌数量明显增加[7]. 同样的, 在HBV感染的不同免疫时期, 肠道菌群也存在差异, 拟杆菌属、普雷沃氏菌属和巨单胞菌属在免疫耐受期的患者中丰度较高, 而经黏液真杆菌属和粪杆菌属在免疫活跃期患者中富集[8]. 患者菌群失衡破坏了肠道黏膜屏障, 增加细菌移位和内毒素血症风险, 从而通过肠-肝轴促进CHB病情发展.
肠道微生态通过其产生的代谢产物影响宿主代谢与免疫状态. 在CHB患者中, 菌群失调引发的代谢组异常常具有双向性, 即菌群失衡引起代谢物改变, 反过来这些代谢物亦会重塑微生态环境, 影响疾病进程. 短链脂肪酸(short-chain fatty acid, SCFA)、胆汁酸、色氨酸代谢产物是其中关键. SCFA尤其是丁酸盐具有维护屏障、抗炎与抗病原能力, 其由厚壁菌门特定菌种合成[9], 上皮细胞摄取后可调节HIF表达、制造低氧环境、抑制需氧病原[10]. 研究表明, 丁酸盐可上调miR-22表达、抑制SIRT-1, 诱导肝细胞凋亡及ROS产生, 从而抑制HBV复制及肝细胞癌(hepatocellular carcinoma, HCC)发生[11]. CHB患者中厚壁菌比例降低, 丁酸盐合成减少, 削弱屏障功能与免疫抑制作用. 胆汁酸代谢在CHB中亦发生显著变化. 纤维化CHB患者血清中总胆汁酸及初级胆汁酸升高, 粪便中次级胆汁酸下降[12]. 胆汁酸可激活FXR、PXR, 调控炎症反应, 维持屏障功能, 减少其分泌削弱上述作用. 次级胆汁酸减少亦会降低TGR5激活, 增强促炎反应[13]. 此外, 胆汁酸异常与HCC发生密切相关[14], 尤其对于较高浓度的胆汁酸, 特别是结合的初级胆汁酸, 与HCC风险增加有关[15]. 色氨酸代谢异常通过犬尿氨酸(kynurenine, KYN)通路影响免疫微环境. TDO、IDO等酶催化TRP代谢, KYN活化AHR促进Treg生成[16], 增强免疫抑制, 推动CHB进展及肿瘤转移. KYN/TRP比值升高被视为HCC不良预后标志. 综上, SCFA、胆汁酸与色氨酸代谢改变在CHB中通过影响免疫与代谢通路, 加速疾病进展, 反映出代谢组在肠-肝互作中的桥梁作用.
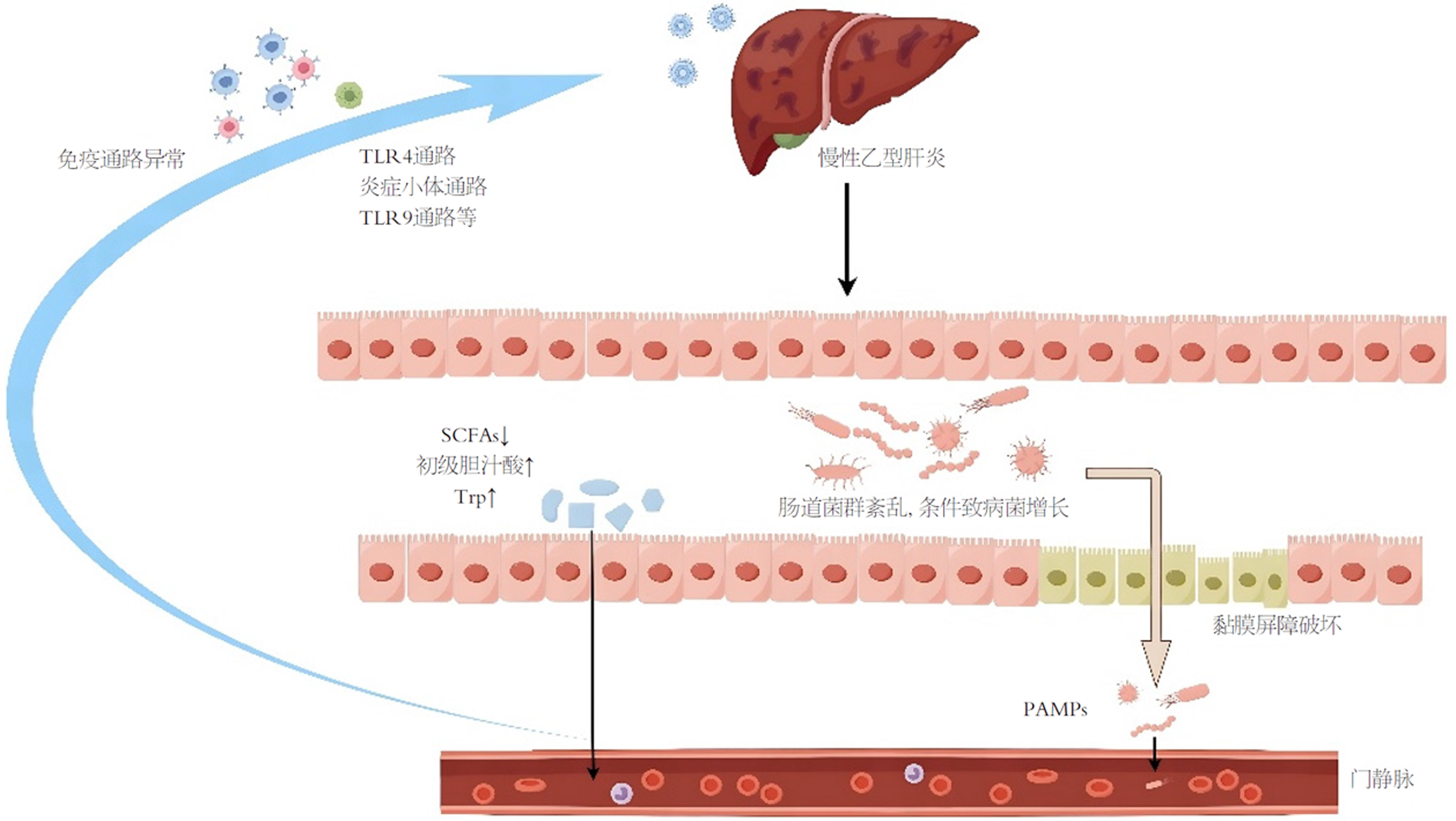
肝脏与肠道在胚胎发育上同源, 二者通过"肠-肝轴"形成密切的功能联系. 该轴不仅调节胃肠道功能, 也是外源性信号介导宿主免疫与代谢反应的重要通路[17](图1).
CHB患者中, 随着菌群失调及条件致病菌增殖, 肠道黏膜屏障遭到破坏, 表现为绒毛萎缩、上皮细胞损伤及炎症反应增强. 致病菌如变形菌门菌株可直接损伤上皮屏障并诱发炎症. 屏障的维持需要与肠道微生物群相互作用, 然而在CHB患者中, 变形菌门(Proteobacteria)类群的相对丰度显著上升, 常富集如大肠杆菌等条件致病菌. 这些菌群可通过分泌脂多糖(lipopolysaccharide, LPS)等病原相关分子, 激活TLR4等黏膜免疫通路, 诱发炎症反应并损伤肠上皮屏障. 除了破坏性因素的增加, 保护性物质的减少也是肠道屏障破坏的原因之一, 如SCFA发挥的抗炎作用通过多种方式上调抗炎和下调促炎细胞因子机制促进黏膜稳态[18], 能促进GLP-1和PYY的分泌[19]、促进抗菌肽分泌[20]、促进初始T淋巴细胞转化为Treg细胞[21]、促进IL-22的合成[22]等来减轻炎症并加强肠道屏障功能, 其中Treg作为关键的抗炎效应因子, 丁酸盐通过调节适应性免疫反应, 在Treg细胞极化条件下也促进幼稚T细胞向Treg的转化. 其上调Foxp3的组蛋白H3乙酰化, 促进了Treg的分化, 抑制炎症反应[23]. 由此像SCFA这样的保护物质含量的减少对于肠道粘膜屏障的保护产生削弱作用.
肠道屏障的破坏允许微生物产物和活细菌从肠腔经门静脉转移到肝脏, 因此肝脏是首先接触肠源性细菌和病原体相关分子模式的器官. 移位的细菌产物通过与特定病原体识别受体结合而促进肝病进展, 其中包括与LPS的主要受体Toll样受体4(toll-like receptor 4, TLR4)作用来诱导肝脏炎症[24]. 使用广谱抗生素净化肠道微生物群来降低血浆LPS水平, 发现其有抑制肝纤维化的作用[25], 进一步的研究使用TLR4突变小鼠, 发现在与普通小鼠的LPS水平相当的情况下, TLR4突变的小鼠肝纤维化受到抑制[26], 说明肠道细菌所产生的LPS能够激活肝脏的纤维化过程. 对于CHB患者, 其B细胞功能受损, TLR4表达增加, NF-κB通路激活[27], 认为CHB患者TLR4通路参与到了肝脏免疫调节中同时也发现在肝硬化与肝癌的患者中多种TLRs表达增加[28]. 以上实验证明源自肠道微生物群的移位与其LPS介导肝脏中的TLR4活化, 对促进肝脏纤维化、癌变倾向等有促进作用.
炎症小体也被认为在促进CHB患者肝病进展的机制之一, 炎症小体能够识别病原相关分子模式与宿主来源的危险信号分子, TLRs通路激活促进NLRP3的转录激活炎症进而产生相应的成熟细胞因子[29]. 多种研究表明, NLRP3炎症小体在CHB患者的进展过程中被激活并可通过调节肝脏炎症在其发病机制中起关键作用. 在CHB患者中, 肠道菌群移位明显, 产生大量的LPS激活炎性小体, 同时炎性小体的激活与HBV病毒感染相协调促进肝脏炎症的发生. 实验者用LPS刺激细胞观察NLRP3炎性体的活化以及IL-1β和IL-18的水平, 发现HBcAg促进了LPS诱导的NLRP3炎性体激活和IL-1β产生[30], 其中IL-1β在HBV慢性肝病的发病机制中起促进作用[31].
未甲基化的CpG DNA-TLR9途径同样作为可能的影响途径之一. 在CHB患者中, Tout等[32]学者发现TLR9的表达和功能被显着抑制, 通过抑制TLR9的表达导致循环pDC功能障碍[33], 从而影响患者的固有免疫反应. TLR9的表达有一定的分布特点, 小肠和大肠中的表达高于肝脏[34], 因此肠道微生态能显著参与到其中进行调节. CHB患者肠道菌群处于失调状态, 其益生菌如乳酸杆菌的含量降低, 而乳酸杆菌能激活肠道淋巴细胞产生的IL-22, 其能增强粘膜屏障功能并促进调节性cDC向肝脏的募集, 通过TLR9激活产生IL-10和TGF-β防止进一步的肝脏炎症[35].
CHB患者由于肠道屏障的破坏, 激活了肝脏多通路的免疫反应, 固有免疫的激活进而促进特异性免疫的发生, 但CHB患者肠道菌群的破坏严重紊乱了特异性免疫的进行. Yan等[36]通过样本人群检测外周血免疫反应指标, 评估肠道微生物与外周免疫反应之间的相关性, 结果发现患者外周血中CD3+T、CD4+T和CD8+T细胞比例降低与Treg增加. 既往研究表明, CHB患者向肝硬化和HCC进展过程里, 适应性免疫细胞(包括CD4+T、CD8+T及NK细胞)上共抑制分子(如PD-1、TIGIT和TIM-3)的表达水平升高[37], 这一现象在HBV相关HCC患者尤为明显. 值得注意的是, HCC肿瘤微环境中T细胞免疫抑制状态的形成, 不仅与局部炎症反应增强有关, 还与产丁酸肠道细菌的减少存在密切关联[36]. 以上的研究均提示, HBV感染患者面临着显著的特异性免疫异常, 该异常与肠道微生态失调密切相关.
肠道菌群干预逐渐成为CHB辅助治疗的重要方向. 益生菌可改善菌群失衡, 增强屏障功能, 缓解炎症环境. 乳酸杆菌与双歧杆菌是肠道稳态的关键菌属, 在CHB患者中显著减少[38,39]. 研究者使用益生菌(包括双歧双歧杆菌, 乳酸双歧杆菌, 长双歧杆菌, 嗜酸乳杆菌、鼠李糖乳杆菌和嗜热链球菌)治疗4 wk可改善慢性肝病患者的肠道菌群过度生长及消化道症状[40]. 此外, 像鼠李糖乳杆菌这样的益生菌还能成为预防或治疗替诺福韦(Tenofovir Disoproxil Fumarate, TDF)引起的骨质疏松症的潜在治疗策略[41]. 有日本学者[42]基于临床研究(接受干扰素治疗的CHB患者)粪便样本分析, 结合宏基因组测序发现, 功能性治愈者肠道中富集丁酸菌属、粪球菌属和短双歧杆菌等产SCFAs的有益菌, 提示这些菌群可能通过促进短链脂肪酸生成、增强免疫反应, 间接抑制HBV复制, 为CHB治疗提供了微生态干预的新方向. 这一发现为我们提供了新的思路: 通过调节肠道菌群结构、提升SCFAs水平、恢复肠道屏障功能, 可有助于增强肝脏的抗病毒免疫应答, 为HBsAg清除创造有利免疫环境. 特别是在Peg-IFNα或核苷类药物治疗基础上联合应用益生菌, 有望进一步提高乙型肝炎的临床治愈率, 为探索综合免疫与微生态联合干预策略提供理论支持. 此外, Laivacuma等[43]学者进一步指出, 饮食和药物因素在调控肠道菌群及其对肝病演进的影响中同样发挥关键作用. 他们建议采用富含膳食纤维、多不饱和脂肪酸和天然益生元的地中海饮食模式, 有助于维护菌群多样性、提升抗炎代谢物如SCFAs的生成, 并改善肠黏膜屏障功能. 其中益生元目前多数研究都是在动物模型中进行, 而作为益生菌菌株和益生元的协同组合的合生元, 有研究证实[44]四种益生菌菌株(戊糖片球菌+肠膜明串珠菌+副干酪乳杆菌+植物乳杆菌)和三种纤维(β-葡聚糖、果胶和抗性淀粉)组合的合生元对于肝硬化患者肝功能有潜在改善作用组成. 此外, 抗生素利福昔明可作为肝硬化炎症调节剂, 可降低肠源性内毒素水平同时减少肝性脑病的发生[45]. 生活方式干预在肠-肝轴层面同样具有重要调节潜力, 对CHB等慢性肝病的转归可能产生积极影响.
近年研究也表明, 肠道菌群紊乱对于肠道黏膜屏障有显著破坏作用, 因此CHB患者若能有效纠正肠道微生态紊乱, 将有助于改善其疾病进展与长期预后. 在常规抗病毒治疗基础上, 辅助使用益生菌可改善菌群组成、增强黏膜屏障及免疫稳态, 进一步发挥协同治疗作用. 此外, Kang等[46]学者中指出, 肠道菌群失衡与慢性乙肝患者炎症状态、肝脏损伤之间存在紧密联系, 强调了粪菌移植(fecal microbiota transplantation, FMT)在HBV相关慢性肝病中的潜在干预价值. FMT不仅能够重建菌群多样性、恢复代谢功能, 还可能通过增强宿主的抗病毒免疫反应, 改善HBV感染所致的免疫耐受状态, 成为有希望的免疫辅助治疗手段之一. FMT是通过将健康供者的粪便菌群转移至患者肠道, 以实现肠道微生态的重建和功能恢复. 该技术可有效改善肠道菌群多样性、增强肠屏障功能, 并通过调控免疫反应抑制病原体定植, 从而缓解由菌群失调引发的慢性炎症状态. 在CHB患者中, FMT被认为有潜力作为抗病毒治疗的辅助策略. 一项最新研究显示, 在恩替卡韦(Entecavir, ETV)或TDF等核苷类药物基础上联合实施FMT, 可显著降低HBeAg滴度并改善HBV特异性免疫应答[46,47]. 结果提示FMT不仅能从微生态层面打破免疫耐受屏障, 还可能通过"重编程"肠-肝轴信号通路, 增强抗病毒免疫活性. 整体而言, FMT为慢性乙型肝炎的综合管理提供了新的方向, 有望成为实现临床治愈目标的重要辅助手段之一.
现有研究揭示肠道微生态紊乱在CHB进展中扮演重要角色. 菌群失衡不仅引起代谢产物(如SCFAs、胆汁酸、色氨酸代谢产物)组成变化, 还可通过调控肠-肝轴信号通路, 影响肝脏免疫环境, 进而加剧肝组织损伤和炎症反应. 肠道菌群构成、代谢组特征与免疫状态三者形成高度耦合的动态互作网络, 系统性地参与疾病的发生、发展及预后. 在此基础上, 越来越多证据支持通过益生菌、合生元、FMT等手段干预肠道微生态, 可有效改善CHB相关肠-肝轴功能障碍, 辅助实现抗病毒治疗目标及延缓疾病进展, 甚至有望推动临床治愈的实现. 未来研究应进一步聚焦于"肠-肝轴"在HBV免疫清除过程中的调控机制, 借助宏基因组、代谢组与免疫组学等多组学整合手段, 识别关键微生态节点与治疗靶点, 推动个体化、精准化治疗策略的临床转化.
| 1. | GBD 2019 Hepatitis B Collaborators. Global, regional, and national burden of hepatitis B, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet Gastroenterol Hepatol. 2022;7:796-829. [PubMed] [DOI] |
| 2. | Hui Z, Yu W, Fuzhen W, Liping S, Guomin Z, Jianhua L, Feng W, Ning M, Jian L, Guowei D, Tongtong M, Lin T, Shuang Z, Mingshuang L, Yuan L, Xiaoqi W, Qianqian L, Qian Z, Dan W, Tingting Y, Qiudong S, Miao W, Li L, Qian H, Yixing L, Yi L, Shaodong Y, Zhijie A, Rodewald LE, Jidong J, Huaqing W, Wenzhou Y, Zhongfu L, Qun L, Zijian F, Zundong Y, Yu W. New progress in HBV control and the cascade of health care for people living with HBV in China: evidence from the fourth national serological survey, 2020. Lancet Reg Health West Pac. 2024;51:101193. [PubMed] [DOI] |
| 3. | Lu J, Zhang L, Zhai Q, Zhao J, Zhang H, Lee YK, Lu W, Li M, Chen W. Chinese gut microbiota and its associations with staple food type, ethnicity, and urbanization. NPJ Biofilms Microbiomes. 2021;7:71. [PubMed] [DOI] |
| 4. | Kim HN, Cheong HS, Kim B, Sohn W, Cho YK, Kwon MJ, Kim J, Song Y, Joo EJ. Human gut microbiota from hepatitis B virus-infected individuals is associated with reduced triglyceride level in mice: faecal transplantation study. Microbes Infect. 2024;26:105281. [PubMed] [DOI] |
| 5. | Joo EJ, Cheong HS, Kwon MJ, Sohn W, Kim HN, Cho YK. Relationship between gut microbiome diversity and hepatitis B viral load in patients with chronic hepatitis B. Gut Pathog. 2021;13:65. [PubMed] [DOI] |
| 7. | Zeng Y, Chen S, Fu Y, Wu W, Chen T, Chen J, Yang B, Ou Q. Gut microbiota dysbiosis in patients with hepatitis B virus-induced chronic liver disease covering chronic hepatitis, liver cirrhosis and hepatocellular carcinoma. J Viral Hepat. 2020;27:143-155. [PubMed] [DOI] |
| 8. | Li YN, Kang NL, Jiang JJ, Zhu YY, Liu YR, Zeng DW, Wang F. Gut microbiota of hepatitis B virus-infected patients in the immune-tolerant and immune-active phases and their implications in metabolite changes. World J Gastroenterol. 2022;28:5188-5202. [PubMed] [DOI] |
| 9. | Blaak EE, Canfora EE, Theis S, Frost G, Groen AK, Mithieux G, Nauta A, Scott K, Stahl B, van Harsselaar J, van Tol R, Vaughan EE, Verbeke K. Short chain fatty acids in human gut and metabolic health. Benef Microbes. 2020;11:411-455. [PubMed] [DOI] |
| 10. | Kelly CJ, Colgan SP. Breathless in the Gut: Implications of Luminal O2 for Microbial Pathogenicity. Cell Host Microbe. 2016;19:427-428. [PubMed] [DOI] |
| 11. | Pant K, Yadav AK, Gupta P, Islam R, Saraya A, Venugopal SK. Butyrate induces ROS-mediated apoptosis by modulating miR-22/SIRT-1 pathway in hepatic cancer cells. Redox Biol. 2017;12:340-349. [PubMed] [DOI] |
| 12. | Wang X, Chen L, Wang H, Cai W, Xie Q. Modulation of bile acid profile by gut microbiota in chronic hepatitis B. J Cell Mol Med. 2020;24:2573-2581. [PubMed] [DOI] |
| 13. | Biagioli M, Carino A, Cipriani S, Francisci D, Marchianò S, Scarpelli P, Sorcini D, Zampella A, Fiorucci S. The Bile Acid Receptor GPBAR1 Regulates the M1/M2 Phenotype of Intestinal Macrophages and Activation of GPBAR1 Rescues Mice from Murine Colitis. J Immunol. 2017;199:718-733. [PubMed] [DOI] |
| 14. | Jia W, Xie G, Jia W. Bile acid-microbiota crosstalk in gastrointestinal inflammation and carcinogenesis. Nat Rev Gastroenterol Hepatol. 2018;15:111-128. [PubMed] [DOI] |
| 15. | Petrick JL, Florio AA, Koshiol J, Pfeiffer RM, Yang B, Yu K, Chen CJ, Yang HI, Lee MH, McGlynn KA. Prediagnostic concentrations of circulating bile acids and hepatocellular carcinoma risk: REVEAL-HBV and HCV studies. Int J Cancer. 2020;147:2743-2753. [PubMed] [DOI] |
| 16. | Marszalek-Grabska M, Walczak K, Gawel K, Wicha-Komsta K, Wnorowska S, Wnorowski A, Turski WA. Kynurenine emerges from the shadows - Current knowledge on its fate and function. Pharmacol Ther. 2021;225:107845. [PubMed] [DOI] |
| 17. | Tilg H, Adolph TE, Trauner M. Gut-liver axis: Pathophysiological concepts and clinical implications. Cell Metab. 2022;34:1700-1718. [PubMed] [DOI] |
| 18. | Maslowski KM, Vieira AT, Ng A, Kranich J, Sierro F, Yu D, Schilter HC, Rolph MS, Mackay F, Artis D, Xavier RJ, Teixeira MM, Mackay CR. Regulation of inflammatory responses by gut microbiota and chemoattractant receptor GPR43. Nature. 2009;461:1282-1286. [PubMed] [DOI] |
| 19. | Cani PD, Jordan BF. Gut microbiota-mediated inflammation in obesity: a link with gastrointestinal cancer. Nat Rev Gastroenterol Hepatol. 2018;15:671-682. [PubMed] [DOI] |
| 20. | Raqib R, Sarker P, Bergman P, Ara G, Lindh M, Sack DA, Nasirul Islam KM, Gudmundsson GH, Andersson J, Agerberth B. Improved outcome in shigellosis associated with butyrate induction of an endogenous peptide antibiotic. Proc Natl Acad Sci U S A. 2006;103:9178-9183. [PubMed] [DOI] |
| 21. | Arpaia N, Campbell C, Fan X, Dikiy S, van der Veeken J, deRoos P, Liu H, Cross JR, Pfeffer K, Coffer PJ, Rudensky AY. Metabolites produced by commensal bacteria promote peripheral regulatory T-cell generation. Nature. 2013;504:451-455. [PubMed] [DOI] |
| 22. | Yang W, Yu T, Huang X, Bilotta AJ, Xu L, Lu Y, Sun J, Pan F, Zhou J, Zhang W, Yao S, Maynard CL, Singh N, Dann SM, Liu Z, Cong Y. Intestinal microbiota-derived short-chain fatty acids regulation of immune cell IL-22 production and gut immunity. Nat Commun. 2020;11:4457. [PubMed] [DOI] |
| 23. | Sun M, Wu W, Liu Z, Cong Y. Microbiota metabolite short chain fatty acids, GPCR, and inflammatory bowel diseases. J Gastroenterol. 2017;52:1-8. [PubMed] [DOI] |
| 24. | Balmer ML, Slack E, de Gottardi A, Lawson MA, Hapfelmeier S, Miele L, Grieco A, Van Vlierberghe H, Fahrner R, Patuto N, Bernsmeier C, Ronchi F, Wyss M, Stroka D, Dickgreber N, Heim MH, McCoy KD, Macpherson AJ. The liver may act as a firewall mediating mutualism between the host and its gut commensal microbiota. Sci Transl Med. 2014;6:237ra66. [PubMed] [DOI] |
| 25. | Seki E, Schnabl B. Role of innate immunity and the microbiota in liver fibrosis: crosstalk between the liver and gut. J Physiol. 2012;590:447-458. [PubMed] [DOI] |
| 26. | Seki E, De Minicis S, Osterreicher CH, Kluwe J, Osawa Y, Brenner DA, Schwabe RF. TLR4 enhances TGF-beta signaling and hepatic fibrosis. Nat Med. 2007;13:1324-1332. [PubMed] [DOI] |
| 27. | Li Y, Yin S, Chen Y, Zhang Q, Huang R, Jia B, Jie W, Yao K, Wang J, Tong X, Liu Y, Wu C. Hepatitis B virus-induced hyperactivation of B cells in chronic hepatitis B patients via TLR4. J Cell Mol Med. 2020;24:6096-6106. [PubMed] [DOI] |
| 28. | Sun L, Dai JJ, Hu WF, Wang J. Expression of toll-like receptors in hepatic cirrhosis and hepatocellular carcinoma. Genet Mol Res. 2016;15. [PubMed] [DOI] |
| 29. | Triantafilou K. Enigmatic inflammasomes. Immunology. 2021;162:249-251. [PubMed] [DOI] |
| 30. | Ding X, Lei Q, Li T, Li L, Qin B. Hepatitis B core antigen can regulate NLRP3 inflammasome pathway in HepG2 cells. J Med Virol. 2019;91:1528-1536. [PubMed] [DOI] |
| 31. | Molyvdas A, Georgopoulou U, Lazaridis N, Hytiroglou P, Dimitriadis A, Foka P, Vassiliadis T, Loli G, Phillipidis A, Zebekakis P, Germenis AE, Speletas M, Germanidis G. The role of the NLRP3 inflammasome and the activation of IL-1β in the pathogenesis of chronic viral hepatic inflammation. Cytokine. 2018;110:389-396. [PubMed] [DOI] |
| 32. | Tout I, Gomes M, Ainouze M, Marotel M, Pecoul T, Durantel D, Vaccarella S, Dubois B, Loustaud-Ratti V, Walzer T, Alain S, Chemin I, Hasan U. Hepatitis B Virus Blocks the CRE/CREB Complex and Prevents TLR9 Transcription and Function in Human B Cells. J Immunol. 2018;201:2331-2344. [PubMed] [DOI] |
| 33. | Xie Q, Shen HC, Jia NN, Wang H, Lin LY, An BY, Gui HL, Guo SM, Cai W, Yu H, Guo Q, Bao S. Patients with chronic hepatitis B infection display deficiency of plasmacytoid dendritic cells with reduced expression of TLR9. Microbes Infect. 2009;11:515-523. [PubMed] [DOI] |
| 34. | Huhta H, Helminen O, Kauppila JH, Salo T, Porvari K, Saarnio J, Lehenkari PP, Karttunen TJ. The Expression of Toll-like Receptors in Normal Human and Murine Gastrointestinal Organs and the Effect of Microbiome and Cancer. J Histochem Cytochem. 2016;64:470-482. [PubMed] [DOI] |
| 35. | Nakamoto N, Amiya T, Aoki R, Taniki N, Koda Y, Miyamoto K, Teratani T, Suzuki T, Chiba S, Chu PS, Hayashi A, Yamaguchi A, Shiba S, Miyake R, Katayama T, Suda W, Mikami Y, Kamada N, Ebinuma H, Saito H, Hattori M, Kanai T. Commensal Lactobacillus Controls Immune Tolerance during Acute Liver Injury in Mice. Cell Rep. 2017;21:1215-1226. [PubMed] [DOI] |
| 36. | Yan F, Zhang Q, Shi K, Zhang Y, Zhu B, Bi Y, Wang X. Gut microbiota dysbiosis with hepatitis B virus liver disease and association with immune response. Front Cell Infect Microbiol. 2023;13:1152987. [PubMed] [DOI] |
| 37. | Yu L, Liu X, Wang X, Yan F, Wang P, Jiang Y, Du J, Yang Z. TIGIT(+) TIM-3(+) NK cells are correlated with NK cell exhaustion and disease progression in patients with hepatitis B virusrelated hepatocellular carcinoma. Oncoimmunology. 2021;10:1942673. [PubMed] [DOI] |
| 38. | Xia X, Chen J, Xia J, Wang B, Liu H, Yang L, Wang Y, Ling Z. Role of probiotics in the treatment of minimal hepatic encephalopathy in patients with HBV-induced liver cirrhosis. J Int Med Res. 2018;46:3596-3604. [PubMed] [DOI] |
| 39. | Liu Q, Li F, Zhuang Y, Xu J, Wang J, Mao X, Zhang Y, Liu X. Alteration in gut microbiota associated with hepatitis B and non-hepatitis virus related hepatocellular carcinoma. Gut Pathog. 2019;11:1. [PubMed] [DOI] |
| 40. | Kwak DS, Jun DW, Seo JG, Chung WS, Park SE, Lee KN, Khalid-Saeed W, Lee HL, Lee OY, Yoon BC, Choi HS. Short-term probiotic therapy alleviates small intestinal bacterial overgrowth, but does not improve intestinal permeability in chronic liver disease. Eur J Gastroenterol Hepatol. 2014;26:1353-1359. [PubMed] [DOI] |
| 42. | Honda T, Ishigami M, Ishizu Y, Imai N, Ito T, Yamamoto K, Yokoyama S, Muto H, Inukai Y, Kato A, Murayama A, Yoshio S, Ishikawa T, Fujishiro M, Kawashima H, Kato T. Gut microbes associated with functional cure of chronic hepatitis B. Hepatol Int. 2025;19:519-528. [PubMed] [DOI] |
| 43. | Laivacuma S, Oblate O, Derovs A. Gut Microbiota and the Gut-Liver Axis in Liver Disease: From Chronic Viral Hepatitis to Cirrhosis, Hepatocellular Carcinoma, and Microbiome-Based Therapies. Microorganisms. 2025;13:1053. [PubMed] [DOI] |
| 44. | Liu Q, Duan ZP, Ha DK, Bengmark S, Kurtovic J, Riordan SM. Synbiotic modulation of gut flora: effect on minimal hepatic encephalopathy in patients with cirrhosis. Hepatology. 2004;39:1441-1449. [PubMed] [DOI] |
| 46. | Kang Y, Cai Y. Gut microbiota and hepatitis-B-virus-induced chronic liver disease: implications for faecal microbiota transplantation therapy. J Hosp Infect. 2017;96:342-348. [PubMed] [DOI] |
| 47. | Ren YD, Ye ZS, Yang LZ, Jin LX, Wei WJ, Deng YY, Chen XX, Xiao CX, Yu XF, Xu HZ, Xu LZ, Tang YN, Zhou F, Wang XL, Chen MY, Chen LG, Hong MZ, Ren JL, Pan JS. Fecal microbiota transplantation induces hepatitis B virus e-antigen (HBeAg) clearance in patients with positive HBeAg after long-term antiviral therapy. Hepatology. 2017;65:1765-1768. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 陕西省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): D, D
E级 (差): E
科学编辑: 刘继红 制作编辑:张砚梁