修回日期: 2024-11-02
接受日期: 2024-11-21
在线出版日期: 2024-11-28
我国直肠癌发病率随着年龄增加而增加, 发病率常年居高不下, 现有检查手段对早期发现直肠癌效果不理想, 寻求一种高效、敏感的检查手段对直肠癌早期鉴别诊断提供理论参考.
探讨增强计算机断层扫描(computerized tomography, CT)参数、微小核糖核苷酸-10a(microRNA-10a, miR-10a)、微小核糖核苷酸-21(microRNA-21, miR-21)在直肠癌中表达及意义.
选取宁波市海曙区人民医院2020-06/2023-06就诊的100例直肠癌患者作为研究组, 另纳入同期100例直肠良性肿瘤患者作为对照组, 均行增强CT、miR-10a、miR-21检查. 统计两组患者△CT值、miR-10a、miR-21, Spearman分析△CT值、miR-10a、miR-21与临床病理参数相关性, 受试者工作特征曲线及曲线下面积分析△CT值、miR-10a、miR-21诊断直肠癌效能, 卡普兰-迈耶生存曲线分析△CT值、miR-10a、miR-21与直肠癌预后关系.
研究组动脉期、静脉期、延迟期△CT值及miR-10a、miR-21表达较对照组高(P<0.05); Spearman相关性分析显示, 直肠癌患者动脉期、静脉期、延迟期△CT值及miR-10a、miR-21表达与肿瘤直径、TNM分期、血管侵犯、神经侵犯呈正相关, 与分化程度呈负相关(P<0.05); 动脉期、静脉期、延迟期△CT值+miR-10a+miR-21诊断直肠癌价值高于单一诊断价值(0.914 vs 0.807、0.821、0.787、0.766、miR-21); 动脉期、静脉期、延迟期△CT值及miR-10a、miR-21高表达患者生存率低于低表达患者, 但差异无统计学意义.
△CT值、miR-10a、miR-21与直肠癌临床病理参数、生存预后有关, 联合检测有助于提高直肠癌诊断效能, 指导临床决策, 控制病情进展.
核心提要: 增强计算机断层扫描联合微小核糖核苷酸-10a、微小核糖核苷酸-21可取长补短, 充分发挥各自早检优势, 在直肠癌和直肠良性肿瘤鉴别诊断中凸显独特优势.
引文著录: 夏玲燕, 徐诚成, 倪丽欣. 增强CT参数及miR-10a、miR-21在直肠癌中表达及意义. 世界华人消化杂志 2024; 32(11): 843-850
Revised: November 2, 2024
Accepted: November 21, 2024
Published online: November 28, 2024
The incidence of rectal cancer is still high in China and increases with age. The existing screening methods are not ideal for early detection of rectal cancer, and it is necessary to find an efficient and sensitive screening method to provide theoretical reference for early differential diagnosis of rectal cancer.
To evaluate the significance of contrast-enhanced compu-terized tomography (CT) parameters and microRNA-10a (miR-10a) and microRNA-21 (miR-21) expression in rectal cancer.
A total of 100 patients with rectal cancer in Haishu District People's Hospital in Ningbo from June 2020 to June 2023 were selected as a study group, and another 100 patients with benign rectal tumors in the same period were selected as a control group. All patients underwent contrast-enhanced CT examinations as well as miR-10a and miR-21 expression detection. The △CT values and mir-10a and miR-21 expression of the two groups were statistically analyzed. Spearman analysis was used to analyze the correlation of △CT values and miR-10a and miR-21 expression with clinicopathological parameters. Receiver operating characteristic curve and area under the curve were used to analyze the diagnostic efficacy of △CT values and miR-10a and miR-21 expression for rectal cancer. Kaplan-Meier survival curve analysis was performed to explore the relationship of △CT values and miR-10a and miR-21 expression with the prognosis of rectal cancer.
The △CT values and the expression of miR-10a and miR-21 in the arterial phase, venous phase, and delayed phase of the study group were significantly higher than those of the control group (P < 0.05). Spearman correlation analysis showed that the △CT values and miR-10a and miR-21 expression in the arterial, venous, and delayed phases were positively correlated with tumor diameter, TNM stage, vascular invasion, and nerve invasion, and negatively correlated with differentiation degree in rectal cancer patients (P < 0.05). The diagnostic efficacy of △CT value + miR-10a + miR-21 in the arterial phase, venous phase, and delayed phase for rectal cancer was significantly higher than that of any one of them alone (0.914 vs 0.807, 0.821, 0.787, and 0.766). The survival rate of patients with high expression of miR-10a and miR-21 in the arterial phase, venous phase, and delayed phase was lower than that of patients with low expression, but the difference was not statistically significant (P > 0.05).
△CT value and miR-10a and miR-21 expression are associated with clinicopathological parameters and survival prognosis in rectal cancer. Combined detection can help improve the diagnostic efficacy for rectal cancer, guide clinical decision-making, and control disease progression.
- Citation: Xia LY, Xu CC, Ni LX. Significance of contrast-enhanced computed tomography parameters and miR-10a and miR-21 expression in rectal cancer. Shijie Huaren Xiaohua Zazhi 2024; 32(11): 843-850
- URL: https://www.wjgnet.com/1009-3079/full/v32/i11/843.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i11.843
直肠癌发病率居我国所有恶性肿瘤第三位, 发病初期无典型临床症状及体征, 误诊及漏诊率高, 早期鉴别诊断显得尤为重要[1,2]. 肠镜检查虽能及早明确直肠病变, 但其无法显现肿瘤病灶整体状况, 有关肿瘤定性、分期需结合计算机断层扫描(computerized tomography, CT)进一步明确[3]. 多层螺旋CT检查具有图像分辨率高、重复性好、无创等诸多优势, 包含平扫和增强扫描两种模式, 可清晰显现肿瘤病灶形态、大小、部位、有无转移等情况, 为直肠癌早期定性诊断提供客观依据[4]. 微小RNA(microRNA, miRNA)是非编码RNA分子, 可通过调控细胞分裂、代谢及物质运输等参与恶性肿瘤发生发展. miR-21具有促肿瘤细胞侵袭、增殖、迁移等作用, 在直肠癌、胃癌患者中表达上调[5,6]. miR-10a是miR-10家族成员, 在多种恶性肿瘤中均有表达[7], 但在直肠癌中表达及与预后关系研究资料有限, 能否成为潜在生物学标志物仍需更多研究阐明. 本研究初步探究CT结合miR-10a、miR-21与直肠癌临床病理参数关系, 分析其诊断效能及与预后关系, 为本病防治提供借鉴. 结果如下.
选取宁波市海曙区人民医院2020-06/2023-06就诊的100例直肠癌患者作为研究组, 男52例, 女48例; 年龄40-80(58.98±5.43)岁;肿瘤、淋巴结和转移(tumor node metastasis, TNM)分期: 42例Ⅰ期, 58例Ⅱ期. 另纳入同期100例直肠良性肿瘤患者作为对照组, 男55例, 女45例; 年龄45-80(60.01±4.04)岁; 66例直肠腺瘤, 19例直肠脂肪瘤, 15例直肠平滑肌瘤. 两组性别、年龄均衡可比(P>0.05).
纳入标准: 经临床诊断标准[8]及病理学检查证实直肠癌及直肠良性肿瘤; CT检查与手术间隔时间<2 wk; 初次诊治, 入组前无肿瘤治疗史; 患者家属自愿签署知晓同意书. 排除标准: 其他恶性肿瘤(胃癌、肝癌、食管癌等); 感染性疾病; 自身免疫性疾病; 严重心脑血管疾病; 妊娠期或哺乳期女性.
1.2.1 CT检查方法: 检查前1 d摄取流质食物, 口服泻药(200 mL 10%甘露醇注射液+200 mL温水)清洁肠道, 充分排空肠道. 检查当日提前2 h口服温水2500 mL. 选用Revolution256排多层螺旋CT(美国GE公司), 受试者取仰卧位, 手臂向上伸展, 平静呼吸, 自双膈至耻骨下段进行平扫, 电压120 kV, 电流300 mAs, 螺距1.5 mm, 层厚1.0 mm, 后行三期动脉增强CT检查. 更换为左侧卧位, 经肛门注入1 mL-2 mL空气, 取仰卧位, 经肘静脉注入1.5 mL/kg碘海醇, 流速3 mL/s-5 mL/s, 分别于扫描30 s、70 s、3 min后获取动脉期、静脉期、延迟期成像. 将CT图像上传至ADW4.7图像处理工作站, 勾画肿瘤组织感兴趣区域, 选择病灶最大径线所在横断层面及相邻上下两层勾画, 避开钙化、囊变坏死、血管及周围脂肪, 尽可能多地覆盖肿瘤组织, 正常组织感兴趣区域位于正常肠壁外缘5 mm范围内正常脂肪间隙处, 感兴趣区域宽度≤5 mm的圆形, 测定动脉期、静脉期、延迟期肿瘤组织和正常组织CT值, △CT值 = 肿瘤组织-正常组织, 取3次测定均值. 由两位工作年限10年以上影像科医师共同判断, 出现分歧结论时应请教上级医师, 得出统一结论.
1.2.2 miR-10a、miR-21检查方法: 入院次日, 取清晨空腹肘静脉血4 mL, 离心15 min(3000 r/min), 取上清液, 提取血清总RNA, 逆转录呈cDNA, 采用实时荧光定量PCR法测定miR-10a、miR-21, miR-10a上游引物序列: 5'-TAGACTACCTGAAGTGTGCAG-3', 下游引物序列: 5'-ACGTCATCGTCAGATCTC-3'; miR-21上游引物序列: 5'-AGCTGGATGCTG-GCATGAT-3', 下游引物序列: 5'-CTGTAAGCTGAAGTCGAAG-5-3'; 以U6为内参, 上游引物序列: 5'-CGTAATCTGCCTATCGATGC-3', 下游引物序列: 5'-CATGCTTACGGATGTGCATC-3'. 聚合酶链反应反应条件95 ℃预变性10 min, 95 ℃变性15 s, 60 ℃退火1 min, 共40个循环. 采用2-△△Ct法计算miR-10a、miR-21.
1.2.3 治疗方案及预后判定标准[9]: 研究组患者均接受腹腔镜直肠癌根治术, 术后定期到院复查, 根据实际情况采取放化疗或免疫治疗. 术后1年采用门诊或电话形式随访, 随访终点事件为全因死亡.
(1)两组患者△CT值及miR-10a、miR-21表达; (2)不同临床病理参数患者△CT值及相关性; (3)不同临床病理参数患者miR-10a、miR-21表达及相关性; (4)△CT值及miR-10a、miR-21诊断直肠癌效能; (5)△CT值及miR-10a、miR-21与直肠癌患者预后关系.
统计学处理 应用SPSS 28.0软件包处理数据, 采用ICC评价两位影像科医师测量参数的一致性, ICC>0.80、0.61-0.80、0.41-0.60、<0.40分别为一致性良好、中等、一般、差, 计量资料符合正态分布采用(mean±SD)表示, 组间比较采用独立样本t检验, 计数资料采用χ2检验和Spearman分析相关性, 探讨△CT值、miR-10a、miR-21与直肠癌患者临床病理参数之间的相关性, 受试者工作特征曲线(receiver operating characteristic curve, ROC)及曲线下面积(area under the ROC curve, AUC)分析△CT值、miR-10a、miR-21单一及联合诊断直肠癌效能, 采用Delong检验比较AUC, 卡普兰-迈耶生存曲线分析△CT值、miR-10a、miR-21与直肠癌生存预后关系. 检验水准α = 0.05.
两位影像学医师对增强CT定量参数的测量结果一致性良好, ICC为0.800-0.912. 与对照组比较, 研究组动脉期、静脉期、延迟期△CT值及miR-10a、miR-21表达较高, 差异有统计学意义(P<0.05), 见表1.
| 组别 | n | miR-10a | miR-21 | △CT值(HU) | ||
| 动脉期 | 静脉期 | 延迟期 | ||||
| 研究组 | 100 | 4.76±1.40 | 5.11±1.43 | 20.77±6.20 | 23.66±7.05 | 15.36±4.55 |
| 对照组 | 100 | 3.33±0.96 | 3.64±1.10 | 14.14±4.27 | 16.60±4.91 | 10.73±3.21 |
| t | 8.424 | 8.148 | 8.807 | 8.217 | 8.315 | |
| P | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | |
不同肿瘤直径、分化程度、TNM分期、血管侵犯、神经侵犯患者动脉期、静脉期、延迟期△CT值及miR-10a、miR-21比较差异有统计学意义(P<0.05), 见表2.
| 项目 | 例数 | 动脉期△CT值(HU) | 静脉期△CT值(HU) | 延迟期△CT值(HU) | miR-10a | miR-21 |
| 性别 | ||||||
| 男 | 52 | 20.65±5.56 | 23.53±4.46 | 14.98±3.34 | 4.72±1.34 | 5.07±1.35 |
| 女 | 48 | 20.90±5.31 | 23.80±4.12 | 15.77±2.89 | 4.80±1.12 | 5.15±1.21 |
| t, P | 0.230, 0.820 | 0.314, 0.754 | 1.260, 0.211 | 0.323, 0.748 | 0.311, 0.756 | |
| 年龄(岁) | ||||||
| <60 | 55 | 20.49±5.48 | 22.99±5.50 | 15.12±4.15 | 4.59±1.26 | 5.10±1.02 |
| ≥60 | 45 | 21.11±4.96 | 24.48±3.98 | 15.65±3.73 | 4.97±1.05 | 5.12±1.49 |
| t, P | 0.587, 0.558 | 1.520, 0.132 | 0.665, 0.508 | 1.615, 0.110 | 0.080, 0.937 | |
| 肿瘤直径(cm) | ||||||
| <4 | 49 | 18.51±3.35 | 20.04±3.89 | 13.35±1.86 | 4.11±1.02 | 4.30±1.38 |
| ≥4 | 51 | 22.94±4.16 | 27.14±4.25 | 17.29±3.40 | 5.38±1.48 | 5.89±1.60 |
| t, P | 5.851, <0.001 | 8.704, <0.001 | 7.148, <0.001 | 4.977, <0.001 | 5.312, <0.001 | |
| 分化程度 | ||||||
| 低分化 | 26 | 24.73±4.42 | 27.14±4.12 | 18.89±1.68 | 5.63±1.57 | 5.92±1.53 |
| 中分化 | 36 | 20.62±3.28 | 23.58±3.56 | 15.30±1.40 | 4.70±1.23 | 5.09±1.42 |
| 高分化 | 38 | 18.20±2.94 | 21.35±2.65 | 13.00±1.24 | 4.22±1.00 | 4.57±1.13 |
| F, P | 26.998, <0.001 | 22.271, <0.001 | 132.538, <0.001 | 9.884, <0.001 | 7.743, <0.001 | |
| TNM分期 | ||||||
| Ⅰ期 | 42 | 18.05±3.17 | 19.95±2.65 | 13.01±3.01 | 3.96±1.42 | 4.35±1.43 |
| Ⅱ期 | 58 | 22.74±4.58 | 26.35±3.87 | 17.06±3.78 | 5.34±1.86 | 5.66±1.61 |
| t, P | 5.715, <0.001 | 9.255, <0.001 | 5.746, <0.001 | 4.030, <0.001 | 4.206, <0.001 | |
| 肿瘤位置 | ||||||
| 上段 | 19 | 20.80±4.46 | 23.70±3.34 | 15.40±3.76 | 4.82±1.51 | 5.08±1.44 |
| 中段 | 39 | 20.75±4.57 | 23.63±3.19 | 15.38±3.85 | 4.72±1.66 | 5.10±1.42 |
| 下段 | 42 | 20.78±4.50 | 23.67±3.40 | 15.32±4.11 | 4.77±1.62 | 5.13±1.40 |
| F, P | 0.001, 0.999 | 0.003, 0.997 | 0.004, 0.996 | 0.026, 0.974 | 0.009, 0.991 | |
| 血管侵犯 | ||||||
| 有 | 44 | 23.34±5.39 | 26.12±4.48 | 17.53±4.25 | 5.45±1.34 | 5.60±1.46 |
| 无 | 56 | 18.75±3.45 | 21.73±3.01 | 13.66±3.11 | 4.22±1.05 | 4.73±1.33 |
| t, P | 5.170, <0.001 | 5.847, <0.001 | 5.257, <0.001 | 5.148, <0.001 | 3.110, <0.001 | |
| 神经侵犯 | ||||||
| 有 | 40 | 22.89±4.68 | 25.87±4.46 | 16.89±3.97 | 5.53±1.42 | 5.74±1.51 |
| 无 | 60 | 19.36±3.17 | 22.19±3.25 | 14.34±2.03 | 4.25±1.57 | 4.69±1.30 |
| t, P | 4.500, <0.001 | 4.772, <0.001 | 4.222, <0.001 | 4.147, <0.001 | 3.708, <0.001 |
Spearman相关性分析显示, 直肠癌患者动脉期、静脉期、延迟期△CT值、miR-10a、miR-21与肿瘤直径、TNM分期、血管侵犯、神经侵犯呈正相关, 与分化程度呈负相关(P<0.05). 见表3.
| 项目 | 肿瘤直径 | TNM分期 | 血管侵犯 | 神经侵犯 | 分化程度 |
| △CT值 | |||||
| 动脉期 | 0.574/<0.001 | 0.623/<0.001 | 0.588/<0.001 | 0.600/<0.001 | -0.615/<0.001 |
| 静脉期 | 0.600/<0.001 | 0.648/<0.001 | 0.654/<0.001 | 0.612/<0.001 | -0.646/<0.001 |
| 延迟期 | 0.556/<0.001 | 0.574/<0.001 | 0.548/<0.001 | 0.591/<0.001 | -0.582/<0.001 |
| miR-10a | 0.600/<0.001 | 0.656/<0.001 | 0.678/<0.001 | 0.612/<0.001 | -0.634/<0.001 |
| miR-21 | 0.611/<0.001 | 0.634/<0.001 | 0.650/<0.001 | 0.602/<0.001 | -0.617/<0.001 |
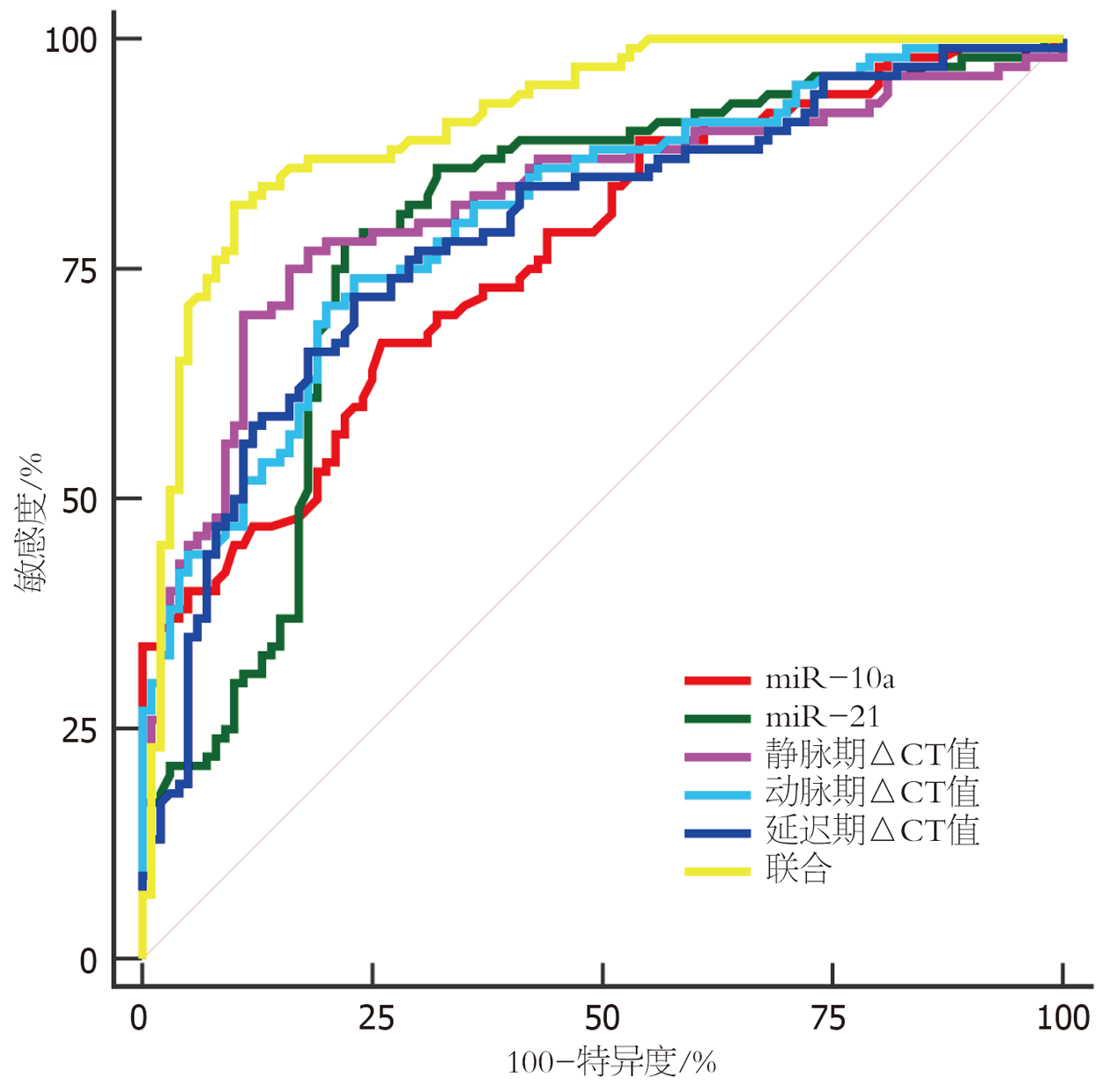
以研究组为阳性标本, 对照组为阴性标本绘制ROC曲线. 采用Logistic二元回归拟合法将动脉期、静脉期、延迟期△CT值及miR-10a、miR-21联合应用于直肠癌诊断, 返回预测概率Logit(P)作为独立检验变量, 获取联合诊断AUC为0.914, 敏感性及特异性分别为82.00%、90.00%. 经Delong检验, 联合诊断直肠癌的AUC高于静脉期、动脉期、延迟期△CT值及miR-10a、miR-21单一诊断价值, 差异有统计学意义(Z = 1.966、2.038、2.867、2.105、1.923, P均<0.001). 见表4和图1.
| 项目 | AUC | 95%CI | 截断值 | 敏感性 | 特异性 | P |
| △CT值 | ||||||
| 动脉期 | 0.807 | 0.746-0.860 | 20.40 HU | 74.00% | 77.00% | <0.001 |
| 静脉期 | 0.821 | 0.760-0.871 | 23.11 HU | 77.00% | 82.00% | <0.001 |
| 延迟期 | 0.787 | 0.724-0.842 | 14.67 HU | 72.00% | 77.00% | <0.001 |
| miR-10a | 0.766 | 0.701-0.823 | 4.67 | 67.00% | 74.00% | <0.001 |
| miR-21 | 0.789 | 0.726-0.843 | 4.77 | 78.00% | 78.00% | <0.001 |
| 联合 | 0.914 | 0.866-0.949 | - | 82.00% | 90.00% | <0.001 |
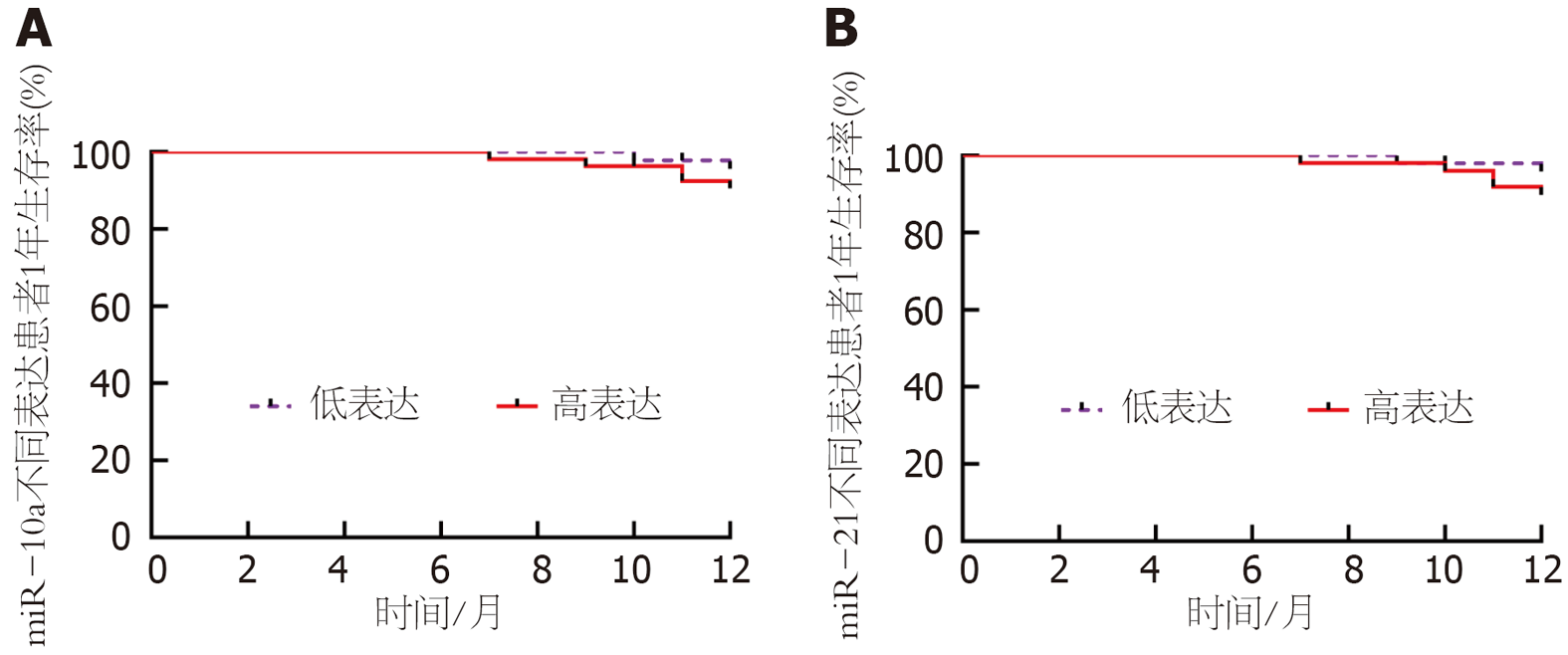
根据△CT值及miR-10a、miR-21截断值进行分层, 静脉期、动脉期、延迟期△CT值及miR-10a、miR-21高表达患者生存率分别为87.50%(42/48)、90.00%(45/50)、86.96%(40/46)、90.20%(46/51)、89.36%(42/47), 低于低表达患者97.87%(46/47)、95.56%(43/45)、97.96%(48/49)、95.45%(42/44)、95.83%(46/48), 但组间比较差异无统计学意义(χ2 = 2.378、0.412、2.750、0.342、0.663, P = 0.123、0.521、0.097、0.559、0.415). 见图2和3.
直肠癌起病隐匿, 一旦确诊病情已进展至中晚期, 即使进行根治性手术, 仍有50%患者复发、转移, 尽早发现直肠癌, 并个体化治疗是当前研究重点方向[10]. 影像学检查是诊断直肠癌最直接的重要手段, 以多层螺旋CT应用居多. 多层螺旋CT除平扫外, 还可进行动态增强扫描, 可多方位、多角度显现肿瘤病灶生长及浸润情况. 加以其具有速度快、容积扫描等优势, 可有效避免胃肠蠕动伪影干扰, 减少临床医师判读误差, 提高直肠癌诊断效能, 受到诸多研究者认可与肯定[11,12]. 本研究测定两组动脉期、静脉期、延迟期△CT值发现, 以研究组升高尤为明显, 与杜灵艳等[13]研究结果相似. 测定△CT值对直肠癌发生具有提示作用. 从数据来看, 研究组静脉期△CT值最高, 其次是动脉期、延迟期, 静脉期是指静脉血管内充盈造影剂的时期, 属于持续强化阶段, 有利于区分肿瘤组织与正常组织. 相关性分析发现, 动脉期、静脉期、延迟期△CT值与直肠癌临床病理参数明显相关, 说明三期动态增强CT可直观显现肠腔内外及邻近组织, 明确病灶浸润程度、淋巴结转移情况等, 评估其恶性生物学行为. 绘制ROC曲线发现, 动脉期、静脉期、延迟期△CT值诊断直肠癌的AUC分别为0.807、0.821、0.787, 可为本病后续诊治提供理论依据. 另需注意的是, 多层螺旋CT检查在直肠癌中存在少许漏诊及误诊, 可能与两方面因素有关, 一方面是脏器间脂肪浑浊、病灶组织大, 另一方面是胃肠准备不足[14].
近年越来越多研究证实miRNA表达异常可引起直肠癌、非小细胞肺癌、胃癌等恶性肿瘤发生发展, 有望成为肿瘤治疗靶点[15,16]. 本研究测定两组组织miR-21表达, 以直肠癌患者组织miR-21升高尤为明显, 且与肿瘤直径、TNM分期、分化程度等密切相关. miR-21是最早被检测到的miRNA之一, 可通过促进或抑制靶基因表达来调控肿瘤细胞侵袭、转移过程. 郝剑等[17]指出, 结直肠癌患者血清外泌体miR-21表达明显高于健康体检人群, 且具备结直肠癌诊断效能. 吴永力等[18]发现, 结直肠癌患者外周血miR-21表达与临床分期呈正相关. 究其原因在于, 高miR-21可直接作用于PDCD4靶基因, 促进细胞增殖、凋亡、血管生成, 从而诱发直肠癌[19]. 随着直肠癌病情进展, 可启动体内致癌基因, 释放过量炎症细胞因子, 促进miR-21转录, 形成恶性循环[20,21]. 进一步研究发现, 当miR-21截断值为4.77时, 直肠癌诊断敏感度及特异度均为78%, 且miR-21高表达患者的生存率低于低表达患者, 临床实践中一旦发现miR-21超出截断值, 应立即采取防治措施, 这对降低直肠癌发生风险, 提高生存预后具有积极意义.
本研究数据显示, 研究组的组织miR-10a表达高于对照组, 与甘建琛[22]研究结果相似. 说明miR-10a在直肠癌发病过程中具有致癌作用. miR-10a具有组织特异性, 在不同肿瘤中具有特定表达模式, 已知研究表明, miR-10a在肺癌、肝癌、结直肠癌中呈过表达, 在食管癌、乳腺癌中呈低表达, 推测与其作用基因位点或信号传导途径不同有关[23-25]. 同时miR-10a表达与TNM分期、血管侵犯、神经侵犯等呈正相关, 提示miR-10a与直肠癌恶性生物学行为密切相关, 可协同参与直肠癌发生发展整个过程. 考虑原因与高miR-10a影响机体过氧化脂质及Wnt信号通路有关, 具体机制未明, 需后续研究. 本研究还发现, miR-10a具备直肠癌诊断价值, 根据其截断值分为高表达和低表达, 其中高表达患者生存率相对较低, 但并无统计学意义, 有待更为深入研究论证.
鉴于△CT值、miR-10a、miR-21单一诊断直肠癌价值有限, 本研究创新性绘制联合ROC曲线显示, 其AUC达0.914, 诊断敏感度、特异度均超过80.00%. 说明△CT值与miR-10a、miR-21可协同促进直肠癌发生发展, 联合检测有助于提高诊断效能, 制定个体化治疗措施, 促使疾病良好转归.
综上, △CT值、miR-10a、miR-21与直肠癌临床病理参数、生存预后有关, 联合检测诊断效能高, 可帮助临床学者识别高风险人群, 采取合理诊治措施. 本研究不足之处在于: 病例数过少, 同时直肠癌大多数是从直肠息肉恶变发展而来, 直肠高级别上皮内病变的△CT值、miR-10a、miR-21表达量如何未可知, 直肠癌术后及肿瘤复发后的△CT值、miR-10a、miR-21表达量如何未可知, 同时未纳入常规肿瘤标志物, 日后研究中应纳入更多病例, 针对上述方向进行更为深入研究证实.
直肠癌起病隐匿, 一旦确诊病情已进展至中晚期, 即使进行根治性手术, 仍有50%患者复发、转移, 尽早发现直肠癌, 并个体化治疗是当前研究重点方向. 影像学检查是诊断直肠癌最直接的重要手段, 以多层螺旋计算机断层扫描(computerized tomography, CT)应用居多.多层螺旋CT除平扫外, 还可进行动态增强扫描, 可多方位、多角度显现肿瘤病灶生长及浸润情况. 加以其具有速度快、容积扫描等优势, 可有效避免胃肠蠕动伪影干扰, 减少临床医师判读误差, 提高直肠癌诊断效能, 受到诸多研究者认可与肯定.
探讨增强CT参数、微小核糖核苷酸-10a(microRNA-10a, miR-10a)、微小核糖核苷酸-21(microRNA-21, miR-21)在直肠癌中表达及意义.
本研究初步探究CT结合miR-10a、miR-21与直肠癌临床病理参数关系, 分析其诊断效能及与预后关系, 为本病防治提供借鉴.
选取宁波市海曙区人民医院2020-06/2023-06就诊的100例直肠癌患者作为研究组, 另纳入同期100例直肠良性肿瘤患者作为对照组, 均行增强CT、miR-10a、miR-21检查. 统计两组患者△CT值、miR-10a、miR-21, Spearman分析△CT值、miR-10a、miR-21与临床病理参数相关性, 受试者工作特征曲线及曲线下面积分析△CT值、miR-10a、miR-21诊断直肠癌效能, 卡普兰-迈耶生存曲线分析△CT值、miR-10a、miR-21与直肠癌预后关系.
研究组动脉期、静脉期、延迟期△CT值及miR-10a、miR-21表达较对照组高(P<0.05); Spearman相关性分析显示, 直肠癌患者动脉期、静脉期、延迟期△CT值及miR-10a、miR-21表达与肿瘤直径、TNM分期、血管侵犯、神经侵犯呈正相关, 与分化程度呈负相关(P<0.05); 动脉期、静脉期、延迟期△CT值+miR-10a+miR-21诊断直肠癌价值高于单一诊断价值(0.914 vs 0.807、0.821、0.787、0.766、miR-21); 动脉期、静脉期、延迟期△CT值及miR-10a、miR-21高表达患者生存率低于低表达患者, 但差异无统计学意义.
综上, △CT值、miR-10a、miR-21与直肠癌临床病理参数、生存预后有关, 联合检测诊断效能高, 可帮助临床学者识别高风险人群, 采取合理诊治措施.
△CT值、miR-10a、miR-21与直肠癌临床病理参数、生存预后有关, 联合检测有助于提高直肠癌诊断效能, 指导临床决策, 制定个体化治疗措施,控制病情进展, 促使疾病良好转归.
| 1. | Benson AB, Venook AP, Al-Hawary MM, Azad N, Chen YJ, Ciombor KK, Cohen S, Cooper HS, Deming D, Garrido-Laguna I, Grem JL, Gunn A, Hecht JR, Hoffe S, Hubbard J, Hunt S, Jeck W, Johung KL, Kirilcuk N, Krishnamurthi S, Maratt JK, Messersmith WA, Meyerhardt J, Miller ED, Mulcahy MF, Nurkin S, Overman MJ, Parikh A, Patel H, Pedersen K, Saltz L, Schneider C, Shibata D, Skibber JM, Sofocleous CT, Stotsky-Himelfarb E, Tavakkoli A, Willett CG, Gregory K, Gurski L. Rectal Cancer, Version 2.2022, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2022;20:1139-1167. [PubMed] [DOI] |
| 2. | Lee S, Kassam Z, Baheti AD, Hope TA, Chang KJ, Korngold EK, Taggart MW, Horvat N. Rectal cancer lexicon 2023 revised and updated consensus statement from the Society of Abdominal Radiology Colorectal and Anal Cancer Disease-Focused Panel. Abdom Radiol (NY). 2023;48:2792-2806. [PubMed] [DOI] |
| 3. | Stjärngrim J, Ekbom A, Widman L, Hultcrantz R, Forsberg A. Post-colonoscopy rectal cancer in Swedish patients with Crohn's disease 2001-2015: a population-based case review study. Eur J Gastroenterol Hepatol. 2023;35:1334-1340. [PubMed] [DOI] |
| 4. | Luo Y, Liu L, Liu D, Shen H, Wang X, Fan C, Zeng Z, Zhang J, Tan Y, Zhang X, Wu J, Zhang J. Extracellular volume fraction determined by equilibrium contrast-enhanced CT for the prediction of the pathological complete response to neoadjuvant chemoradiotherapy for locally advanced rectal cancer. Eur Radiol. 2023;33:4042-4051. [PubMed] [DOI] |
| 5. | Lopes C, Chaves J, Ortigão R, Dinis-Ribeiro M, Pereira C. Gastric cancer detection by non-blood-based liquid biopsies: A systematic review looking into the last decade of research. United European Gastroenterol J. 2023;11:114-130. [PubMed] [DOI] |
| 6. | 刘 凯东, 白 月奎, 张 乐, 刘 铭. 快速康复外科对腹腔镜结直肠癌手术老年患者miR-21, VEGF, MMP-9, 炎症因子及胃肠功能的影响. 临床消化病杂志. 2022;34:355-360. [DOI] |
| 7. | Singh R, Ha SE, Park HS, Debnath S, Cho H, Baek G, Yu TY, Ro S. Sustained Effectiveness and Safety of Therapeutic miR-10a/b in Alleviating Diabetes and Gastrointestinal Dysmotility without Inducing Cancer or Inflammation in Murine Liver and Colon. Int J Mol Sci. 2024;25. [PubMed] [DOI] |
| 10. | Del Rosario M, Chang J, Ziogas A, Clair K, Bristow RE, Tanjasiri SP, Zell JA. Differential Effects of Race, Socioeconomic Status, and Insurance on Disease-Specific Survival in Rectal Cancer. Dis Colon Rectum. 2023;66:1263-1272. [PubMed] [DOI] |
| 11. | Park J, Block M, Bock D, Kälebo P, Nilsson P, Prytz M, Haglind E. A Comparison of Liver MRI and Contrast-Enhanced CT as Standard Workup Before Treatment for Rectal Cancer in Usual Care - A Retrospective Study. Curr Med Imaging. 2022;18:256-262. [PubMed] [DOI] |
| 12. | Omarov N, Uymaz DS, Kulle CB, Ozkan ZG, Azamat S, Keskin M, Bulut MT. The Role of FDG Positron Emission Tomography/Contrast--Enhanced Computed Tomography in Preoperative Staging and Postoperative Follow-up in Rectal Cancer Surgery. Pol Przegl Chir. 2022;94:10-16. [PubMed] [DOI] |
| 14. | 张 学勤, 张 涛, 杨 浩然. CT增强扫描与高分辨MRI在直肠癌术前分期评估中的应用. 中国CT和MRI杂志. 2022;20:146-148. [DOI] |
| 15. | Al-Awsi GRL, Jasim SA, Fakri Mustafa Y, Alhachami FR, Ziyadullaev S, Kandeel M, Abulkassim R, Sivaraman R, M Hameed N, Mireya Romero Parra R, Karampoor S, Mirzaei R. The role of miRNA-128 in the development and progression of gastrointestinal and urogenital cancer. Future Oncol. 2022;18:4209-4231. [PubMed] [DOI] |
| 16. | Rajakumar S, Jamespaulraj S, Shah Y, Kejamurthy P, Jaganathan MK, Mahalingam G, Ramya Devi KT. Long non-coding RNAs: an overview on miRNA sponging and its co-regulation in lung cancer. Mol Biol Rep. 2023;50:1727-1741. [PubMed] [DOI] |
| 18. | 吴 永力, 方 汉刚, 陈 静, 闫 瑞承. 术前外周血微小RNA-21,血管内皮生长因子, 糖类抗原19-9水平与结直肠癌病人临床分期和术后复发转移的关系. 临床外科杂志. 2022;30:771-774. [DOI] |
| 19. | 耿 冬梅, 葛 兴萍, 阚 相明, 徐 露露. 晚期结直肠癌西妥昔单抗治疗前后循环肿瘤DNA, 循环B细胞特异性莫洛尼白血病病毒插入位点1 mRNA和微小RNA-21水平变化. 中国医师进修杂志. 2022;45:452-459. [DOI] |
| 23. | Ghaemi Z, Mowla SJ, Soltani BM. Novel splice variants of LINC00963 suppress colorectal cancer cell proliferation via miR-10a/miR-143/miR-217/miR-512-mediated regulation of PI3K/AKT and Wnt/β-catenin signaling pathways. Biochim Biophys Acta Gene Regul Mech. 2023;1866:194921. [PubMed] [DOI] |
| 24. | Zhou Y, Dong X, Zhang L. Dexmedetomidine Can Reduce the Level of Oxidative Stress and Serum miR-10a in Patients with Lung Cancer after Surgery. Thorac Cardiovasc Surg. 2023;71:197-205. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁