修回日期: 2024-11-04
接受日期: 2024-11-21
在线出版日期: 2024-11-28
原发性小肠腺癌(small bowel adenocarcinoma, SBA), 是极为罕见的消化道恶性肿瘤, 其中小肠印戒细胞癌更加少见, 属于SBA的一种. 据流行病学研究统计, SBA仅占所有消化道恶性肿瘤的2%-3%, 早期阶段病情隐匿, 极易漏诊或误诊, 临床医生需进行深入鉴别方可确诊.
本文描述了一例罕见的SBA患者, 以慢性腹痛伴腹水为主要症状, 最后通过体外腹部超声引导下经皮腹腔内靶点穿刺获取组织病理并行免疫组化而确诊. 并通过基因检测, 选择个性化免疫治疗, 随访患者4个月, 患者因原发病去世.
本文通过对此病例的诊疗分析及文献复习, 强调了对SBA伴发腹痛、腹水的深入诊断和及时治疗的重要性, 有望增加临床医生对SBA的整体认识, 以期提高临床医生对此类罕见疾病的临床诊断水平.
核心提要: 本文报告以腹痛伴腹水为主要症状的罕见原发性小肠印戒细胞癌的病例, 因其小肠腺癌早期阶段病情隐匿, 极易漏诊或误诊, 临床医师需要全面收集患者既往病史, 寻找诊突破口, 借助排除法, 逐一鉴别, 尽早明确诊断, 干预病情进展.
引文著录: 王如意, 武剑, 顾页, 范震. 腹痛伴腹水为主要症状的罕见原发性小肠印戒细胞癌1例及文献复习. 世界华人消化杂志 2024; 32(11): 851-858
Revised: November 4, 2024
Accepted: November 21, 2024
Published online: November 28, 2024
Primary small bowel adenocarcinoma (SBA) is an extremely rare malignant tumor of the digestive tract. Small bowel signet ring cell carcinoma, a form of SBA, is even more rare. According to epidemiological statistics, SBA only accounts for 2%-3% of all gastrointestinal malignancies, and the disease is hidden in the early stage, which is easy to miss or misdiagnose, and clinicians need to conduct in-depth identification before diagnosis.
This paper describes a rare case of SBA, characterized by chronic abdominal pain with ascites as the main symptoms, which was finally diagnosed by histopathology and immunohistochemistry obtained through percutaneous intraperitoneal target puncture guided by external abdominal ultrasound. Through genetic testing, personalized immunotherapy was selected. The patient was followed for half a year, and no symptoms such as abdominal pain and ascites were found.
The present case stresses the importance of in-depth diagnosis and timely treatment of SBA accompanied by abdominal pain and ascites, which is expected to increase the overall understanding of SBA and improve the clinical diagnosis of this rare disease.
- Citation: Wang RY, Wu J, Gu Y, Fan Z. Primary signet ring cell carcinoma of the small intestine with abdominal pain and ascites as main symptoms: A rare case report and literature review. Shijie Huaren Xiaohua Zazhi 2024; 32(11): 851-858
- URL: https://www.wjgnet.com/1009-3079/full/v32/i11/851.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i11.851
小肠腺癌(small bowel adenocarcinoma, SBA), 是一种临床相对罕见的恶性肿瘤. 早期阶段症状不典型, 病情发展缓慢, 临床表现缺乏特异性, 病程隐匿, 因此很容易被忽视. 目前, SBA的诊断和治疗方法还处于研究阶段, 尚无关于SBA特异诊断方法的研究支持. 文报告了一例腹痛伴腹水的SBA患者. 通过对该病例的诊疗分析和文献复习, 我们强调了对SBA伴发腹痛伴腹水深入诊断和及时治疗的重要性, 为临床医生提供宝贵的临床经验和参考, 以期增加临床医生对SBA的整体认识和临床诊断水平.
腹痛伴腹胀10月余.
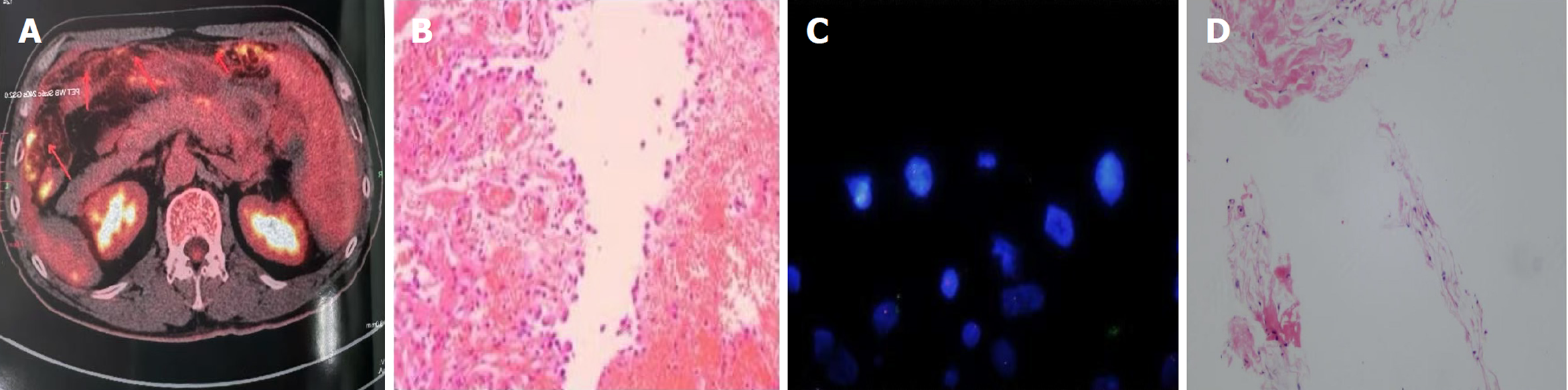
患者10月前无明显诱因出现腹痛, 伴有腹胀, 性质不剧. 遂至当地医院完善腹部超声提示急性阑尾炎, 选择阑尾切除手术. 术后症状不缓解, 患者因腹痛多次就诊于当地医院, C反应蛋白(c-reactive protein, CRP)水平波动在70-100 mg/L,后完善正电子发射计算机断层显像(positron emission tomography-computed tomography, PET-CT)检查, 结果提示阑尾术后缺如, 右前下腹壁术后改变. 网膜、腹腔及盆腔系膜多发模糊絮片样稍厚伴氟脱氧葡萄糖(fluorodeoxyglucose, FDG)代谢不均匀略增高, 腹膜后、肠系膜间隙多发小淋巴结伴FDG代谢略增高, 腹盆腔肠管水肿稍厚伴条样FDG代谢增高(见图1A), 当地医师予以行无痛肠镜, 由于肠腔狭窄, 无法进镜. 家属又将阑尾术后标本送上级医院化验,病理结果及进一步的基因检测未见异常(见图1B和1C). 2023-12-24, 当地医院决定从患者右下腹行腹膜穿刺活检, 结果显示纤维脂肪组织内存在少量的炎性细胞(见图1D). 最终当地医院考虑该患者腹痛由慢性肠道炎症所致, 予以抗炎治疗后症状有所改善, 但不明显. 现为进一步明确诊断及治疗至我院就诊.
高血压病史10余年, 最高血压150/90 mmHg,目前口服"马来酸左氨氯地平分散片2.5 mg 每日1次, 1次1片", "氯沙坦钾片100 mg 每日1次, 1次1片".
无吸烟饮酒史, 无消化性溃疡病史, 无家族性腺瘤性息肉病史.
体温36.2 ℃, 脉率80次/分, 呼吸20次/分, 血压32/90 mmHg(1 mmHg = 0.133 kPa). 腹部呈膨隆状态, 腹围达88 cm, 压痛弱阳性, 无反跳痛, 移动性浊音阳性, 余无殊.
2024-02-29血常规、肝肾功能和大小便检查均正常, CRP为91.2 mg/L, 淋巴细胞斑点试验(T-cell Spot Test, T-SPOT)及结核菌素试验结果阴性. 癌胚抗原(carcinoembryonic antigen, CEA)、糖类抗原(carbohydrate antigen199, CA19-9)、甲胎蛋白(alpha-fetoprotein, AFP)等指标在正常范围内.
2024-03-04超声引导下放腹水, 并留取标本行腹水脱落细胞学检查及腹水生化、肿瘤、腺苷酸脱氨酶(adenosine deaminase, ADA)化验, 脱落细胞学未检测肿瘤细胞, 腹水肿瘤标志物AFP 0.8 ug/L, CEA<0.5 ug/L, CA19-9<2.0 kU/L, 铁蛋白4407.74 ug/L, ADA 10.5 U/L. 腹水外观淡红色浑浊, 核细胞计数1530 μ/L,中性粒细胞32%, 淋巴细胞58%, 间皮细胞4%, 单核吞噬细胞6%. 腹水生化结果总蛋白51.2 g/L, 葡萄糖5.1 mmol/L, 乳酸脱氢酶355 U/L, ADA 10.50 U/L.
2024-03-05自身抗体检测结果示 抗核提取物抗体(抗ENA抗体)和抗多发性肌炎硬皮病抗体(抗PM-Scl抗体)阳性.
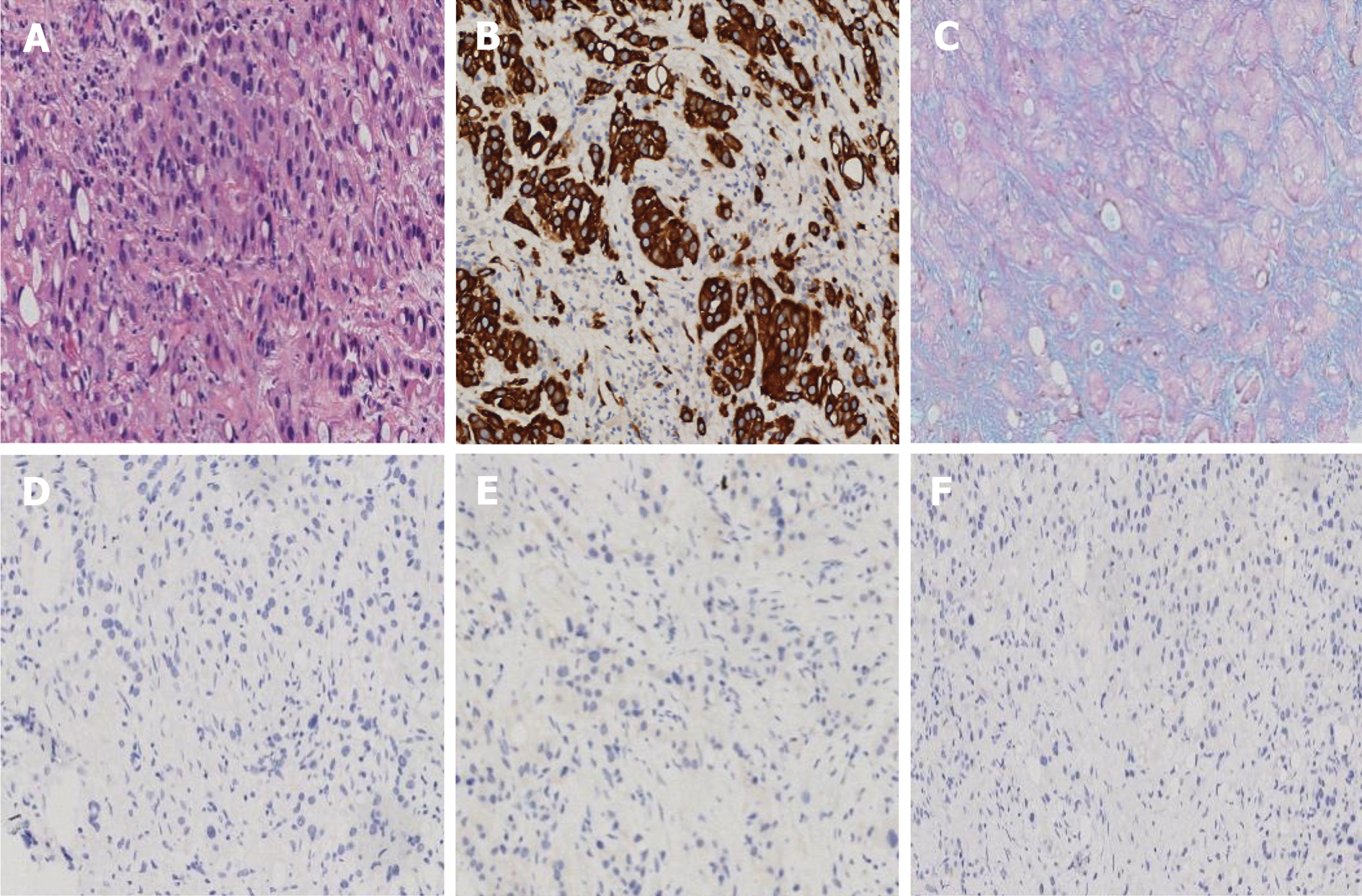
2024-03-15术后病理结果显示小肠壁肿物穿刺条索状纤维组织内存在异型细胞巢团, 呈腺管样、条索状及印戒细胞样形态, 考虑小肠印戒细胞癌.
2024-03-21免疫组化结果: TF1[-]、Cg A[-]、Syn[-]、PAX8[-]、CK7[+]、CK20[-]、CDX2[-]、SATB2[-]、CerbB2[0]、Ki-67[+]40%, 特染: AB/PAS [+], 错配修复蛋白检测: MSH2、MSH6、PMS2、MLH1表达均存在(见图2).
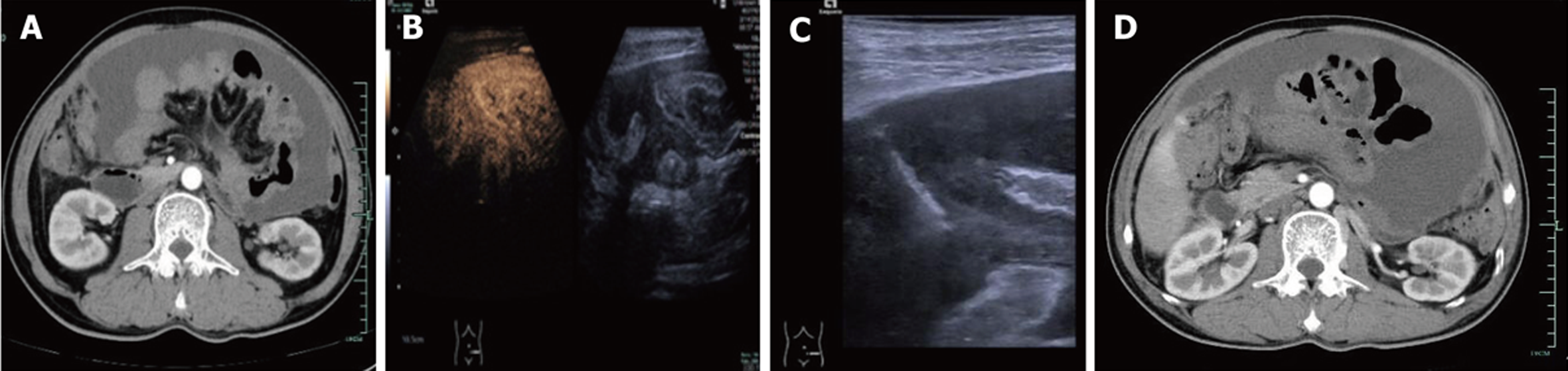
2024-02-29全腹计算机断层扫描(computed tomography, CT)平扫+增强显示中下腹小肠壁增厚, 呈现不完全肠梗阻表现, 肠壁增厚、毛糙, 部分肠腔积气、积液扩张, 肠腔内可见多发的气液平面, 腹腔存在中大量积液(见图3A).
2024-02-29胃镜检查结果: 胃幽门息肉, 直径约10 mm, 行内镜下黏膜切除术, 病理结果显示间质淋巴细胞增生. 电子结肠镜下显示肠腔狭窄、粘连, 视野不清, 无法进入.
2024-03-14体外腹部超声引导下经皮腹腔内靶点穿刺活检过程: 超声科医生结合外院PET-CT报告和我院腹部增强CT影像, 选择中下腹部稍偏左侧进针. 使用超声探头定位于体表并初步探查增厚网膜, 通过18G静脉留置针注射造影剂1.5 mL, 并使用5 mL生理盐水推入, 同时开始计时. 增厚的网膜在13秒开始增强, 19秒达到峰值, 呈均匀低增强, 周边肠壁在12秒开始增强. 造影剂在增厚网膜造影处呈慢进同出均匀低增强. 最后, 使用18G 100 mm穿刺枪从肚脐下偏左侧部位进针, 沿小肠系膜间隙, 分3次穿入, 共取出苍白色组织3条, 长约15-20 mm(见图3B和3C).
2024-03-18再次复查腹部CT, 显示中下腹小肠壁仍有增厚, 腹腔积液及大网膜增厚情况与之前基本相似(见图3D).
消化内科牵头组织多学科团队进行讨论.
胃肠外科医师认为, 患者既往阑尾切除术后, 术后肠道粘连可导致不完全性肠梗阻, 但腹部CT显示回盲部以上小肠未见明显扩张, 建议行腹腔镜或剖腹探查, 获取组织病理明确诊断.
风湿免疫科医生认为, 患者抗ENA抗体和抗PM-Scl抗体阳性, 自身免疫性疾病不能排除, 使用小剂量激素后, 腹水未见消退, 免疫性疾病有待商榷. 肿瘤科医师认为, 腹部CT提示肠壁广泛增厚, 放腹水治疗后, 液体并未见减退, 肠壁增厚考虑癌灶浸入, 癌性腹水不能排除, 肿瘤标志物存在假阴性, 需病理组织确诊.
消化科医生认为, 患者PET-CT、右下腹部网膜穿刺病理及P16基因检测均阴性, PET-CT高代谢部位与外院腹膜穿刺部位可能存在偏差, 外院病理诊断需进一步证实, 必要时可行腹腔镜定点活检或体外腹部超声引导下经皮腹腔内靶点穿刺活检.
原发性小肠腺癌(印戒细胞癌).
初期予以患者抑酸、调理肠道菌群、促进消化、保钾利尿、抗感染、放腹水等内科保守治疗, 效果不佳.后为排查自身免疫性疾病所致, 予以患者甲泼尼龙片5 mg/次, 1次/d, 共口服5 d, 效果仍不佳. 2024-03-21免疫组化提示小肠腺癌后, 2024-03-25患者要求出院, 前往中国科学院大学附属肿瘤医院(浙江省肿瘤医院)进行专科治疗. 专科医师结合我院病理标本, 对其进行基因溯源, 根据基因检测结果、SBA原发肿瘤转移情况及患者自身情况综合考虑, 最终采取免疫治疗. 具体治疗方案为卡度尼利也即细胞毒性T淋巴细胞相关蛋白4(cytotoxic T-lymphocyte-associated protein 4, CTLA4)和程序性死亡受体(programmed death 1, PD-1)的双特异性单克隆抗体, 简称CTLA4/PD1双特异性抗体, 每21天进行一次免疫治疗.
出院后随访4个月, 患者因原发病去世.
"慢性腹痛"是一个具有挑战性的主诉, 因其病因复杂而诊断困难. 根据2019年《慢性腹痛基层诊疗指南》, 慢性腹痛分为器质性疾病和功能性疾病[1], 需要广泛而深入的检查才能明确病因, 这对临床医师提出了较高的要求[2]. 本例患者腹痛伴腹胀10月余, 腹部CT提示腹腔积液(腹水), 腹水的出现是一个重要的信号, 提示临床医生寻找病因. 为了确定腹水的病因, 需要进行诊断性腹腔穿刺术, 并进行腹水化验, 以判断是渗出性腹水还是漏出性腹水. 在此病例中, 患者的心、肝、肺、肾功能指标未见明显异常, 腹部CT提示中下腹小肠壁增厚, 腹腔大量积液, 加之内镜医师在操作肠镜时无法进镜. 因此, 需重点考虑消化道相关疾病, 如腹膜炎、肠结核、结缔组织病、消化道肿瘤等.
(1)自发性细菌性腹膜炎: 其典型症状为腹痛、腹水、发热, 需借助腹水化验结果诊断. 腹水细胞数>0.5×109/L, 中性粒细胞>50%, 或者腹水培养有致病菌生长或者涂片阳性者可确诊[3,4]. 常见于失代偿性肝硬化. 然而本例患者腹水中性粒细胞32%, 未达到确诊标准; (2)结核性腹膜炎: 通常由肠结核引起, 肠结核在内镜下呈现出横向溃疡, 组织学检查可见干酪样坏死和肉芽肿, 同时微生物学上酸性结核杆菌染色阳性[5]. 结核性腹水诊断标准ADA>45 U/L, 该患者目前腹水ADA 10.50 U/L(正常<40 U/L), 且TSPOT与结核菌素试验均为阴性, 因此可排除结核性腹水; (3)自身免疫性疾病: 该患者自身免疫性指标抗ENA抗体阳性, 抗PM-Scl抗体阳性, 需与系统性硬化症、多发性肌炎及皮肌炎相鉴别, 系统性硬化症的特征是自身免疫指标异常和进行性纤维化表现[6], 其特异性抗体包括抗Scl70抗体、抗拓扑异构酶、抗着丝点抗体以及抗PM-Scl抗体等[7]. 研究发现, 系统性硬化症引起的肠道病变中, 90%以小肠为主[8-12]. 多发性肌炎和皮肌炎属于炎症性肌病, 表现为近端肌无力[13-15]. 可结合肌酶、肌电图和肌肉活检特点而确诊. 此病例抗ENA抗体阳性, 抗PM-Scl抗体阳性, 但该患者并无全身纤维化表现, 加之血清酶在正常范围内. 且该患者口服激素治疗后腹水并未见减退. 因此可排除自身免疫性疾病; (4)消化道癌性腹水: 与腹水相关的最常见消化道癌症是肝癌、结肠癌及胰腺癌等, 另外, 原发恶性肿瘤不明确者也可高达20%, 癌性腹水的形成机制包括腹膜癌引流淋巴管的恶性阻塞、门静脉血栓形成及腹腔感染等因素[16]. 尽管患者血CEA、CA19-9、AFP均正常, 腹水肿瘤指标也未见异常. 但影像上表现为下腹部小肠壁增厚及腹腔积液, 加之肠腔狭窄, 无法进镜, 不能排除消化道肿瘤, 而最终在超声引导下经皮腹腔内靶点穿刺活检, 病理结果提示为SBA.
原发性小肠肿瘤(primary tumors of the small intestine, PTID)是一种罕见的胃肠道恶性肿瘤. 世界卫生组织国际癌症研究机构及国家癌症中心, 在近期的癌症流行报道中, 对小肠癌的涉及很少. 小肠是胃肠道最长的部分, 占消化道总长度的75% , 且占据黏膜表面的90%, 尽管如此, PTID的发病率要比结直肠癌低50倍, 发病机制至今还未明确. PTID最常见的受累节段为十二指肠及空肠[17,18], 但该例患者的腹部CT提示病变部位累及回肠为主. PTID是一种异质性肿瘤, 由大约40种不同的组织学亚型组成, 常见的是SBA和神经内分泌肿瘤, SBA占比56.5%[19,20]. SBA常表现为腹痛、肠梗阻、胃肠道出血及贫血等. 由于筛查工具和症状模糊, 诊断具有挑战性, 往往在疾病中晚期才能确诊. 研究发现, SBA与一些易感疾病如炎症性肠病、乳糜泻及遗传综合征有关[21,22]. 然而, 该患者口服激素5天, 腹水并未见减少, 因此炎症性肠病可不考虑.
选择合适的诊断技术对于确诊SBA具有极大的临床价值, 临床常用的检查包括CT、PET-CT、内镜检查及超声介入等. SBA在CT上的特征性表现很少, 因此往往会被误诊[23]. SBA合并肠梗阻时, 在CT上有时显示出一些相对特征, 例如小肠肿块、长狭窄伴异质性粘膜下层、短且重度狭窄伴近端小肠扩张和囊状小肠袢, 伴不规则和不对称圆周增厚[24-26]; 而增强CT多表现为内生性生长、肠梗阻和异质性增强模式[27]. 光谱CT成像作为一种新的影像技术, 诊断SBA的灵敏度为94%和特异性为85%, 明显高于常规CT[28]. 此例患者全腹CT增强提示中下腹小肠壁增厚, 呈现不完全肠梗阻, 与文献报道一致, 同时肠壁增厚范围广, 提示癌肿浸润范围较大.
PET-CT是一种反映病变分子、代谢及功能状态的显像设备. 它利用正电子核素标记葡萄糖等人体代谢物作为显像剂, 通过病灶对显像剂的摄取来反映其代谢变化. 对于SBA, PET-CT上显像剂在受累肠袢的摄取增加, 腹部和纵隔淋巴结显示代谢亢进. 研究表明, PET-CT可作为指导活检的首选成像方法[29]. 小肠壁增厚阶段可与 PET-CT扫描的节段性高代谢过程相对应[30], 全腹CT增强和PET-CT成像的结合可更好地显示SBA的肿瘤范围和代谢情况, 有助于确定诊断并指导治疗. 本例患者的PET-CT成像显示FDG高代谢部位指向中下腹部盆腔肠系膜、网膜及小肠, 小肠肠管水肿稍厚伴条状FDG代谢增高, 患者外院PET-CT的FDG高代谢已有所体现癌灶的部位, 这也暗示了SBA可能已经在10个月前开始"萌芽"或处于"潜伏期". 外院医师侧重于PET-CT高代谢病变, 选择右下腹膜穿刺, 但未能有效获取病变组织, 导致病理结果出现偏差. 近年来随着内镜技术不断发展, 胶囊内镜和视频胶囊内镜已成为小肠疾病的重要诊断工具, 具有简单、安全及可靠等优点, 对小肠肿瘤和炎性病变均有较高的早期诊断价值[31]. 然而, 该患者存在肠梗阻而无法行胶囊内镜检查.
体外腹部超声引导穿刺诊疗技术作为介入超声的一种常规技术, 对于辅助临床医师明确诊断具有重要作用. 它是指在实时超声的引导或监视下, 以穿刺针代替手术刀达到穿刺目标位置, 完成各种穿刺活检、置管、抽吸、注药、消融治疗等操作, 具有精准、微创、安全、痛苦小等优点, 符合当代医学的诊疗理念, 已经成为精准医疗的有机组成部分之一, 开启微创医学的时代, 尤其对于早期阶段无法借助影像确诊者, 具有诊断及鉴别诊断价值. 我院超声科医师结合患者PET-CT和我院的增强CT影像, 在超声引导下选择中下腹部进针, 活检针偏左侧入路, 有效获取3条病灶组织. 最终通过组织病理并行免疫组化而确诊.
该患者病理结果及免疫组化提示: TF1[-]、Cg A[-]、Syn[-]、PAX8[-]、CK7[+]、CK20[-]、CDX2[-]、SATB2[-]、CerbB2[0]、Ki-67[+]40%, 特染: AB/PAS[+], DNA错配修复蛋白检测: MSH2、MSH6、PMS2、MLH1表达均存在. 该患者免疫组化提示了一些重要的特征. TF1、Cg A、Syn、PAX8、CerbB2呈阴性, 可排除甲状腺癌、肺癌、乳腺癌及神经内分泌肿瘤. AB/PAS染色阳性, 这可能暗示肿瘤中存在黏液分泌. Ki-67表达高(40%), 表明肿瘤具有较高的增殖活性, 提示潜在的肿瘤侵袭性. 细胞角蛋白(cytokeratin, CK)是一类中间丝蛋白, 存在腺上皮和移行上皮, CK7和CK20是CK家族的成员. 在消化系统中, CK7多表达为阴性. 研究发现, 在结直肠癌中呈现CK7阴性, 而在前列腺癌和卵巢腺癌中呈现阳性[32]. 而CK20在结肠腺癌、胃腺癌和胰腺癌等肿瘤中呈现阳性. CDX-2是一种肠特异性的核转录因子, 其主要在小肠和结直肠中表达, 在结直肠癌中多呈现阳性. 当CK7和CK20无法提供诊断信息时, CDX-2阳性表达可提高肿瘤来源的准确性和敏感性. 研究已证实, CK7[-]、CK20[+]及CDX-2[+]的免疫表达模式是结直肠癌来源的高度特异性和敏感性标志物[33]. SATB2是一种参与成骨细胞和神经元分化的转录调节因子, 在结直肠癌中具有高度敏感性, 准确率超过95%[34,35]. 研究发现[36], 在92.8%的结直肠癌患者中可检测到SATB2表达. SATB2在原发性结直肠癌和其转移部位之间具有完美的一致性[37]. SATB2的阳性表达与CDX-2的阳性表达结合被认为是检测结直肠癌的最佳组合. DNA错配修复系统由多个基因组成, 包括MSH2、MSH6、MSH3、MLH1和PMS2[38], 这些基因的表达缺失会导致DNA修复机制的失效, 从而增加细胞发生突变和癌症的风险. 临床上病理科医生可通过检测DNA错配修复基因缺失确定检测癌细胞中的微卫星不稳定(microsatellite instability, MSI), 从而帮助诊断结直肠癌. DNA错配修复系统的任何一项基因表达缺失, 都可定义为MSI. 此病例错配修复蛋白检测表达均存在, 提示MSI结果阴性. DNA错配修复基因的检测对于结直肠癌的诊断和治疗具有重要意义. 目前尚未有特异性的SBA免疫标志物, 主要是通过排除法进行诊断. 本例患者病灶免疫组化CK7[+]、CK20[-]、CDX-2[-]、SATB2[-], 加之未发现DNA错配修复蛋白的缺失. 这与结直肠癌相关的免疫标志物均呈相反表达, 表明未检测到结直肠癌的存在, 这与此例患者影像学检查相一致, 因此可排除原发性结直肠癌的可能性.
在SBA的免疫组化中, CK的表达特异性相对较高. 在小肠腺瘤性上皮中, CK7的阳性表达更为常见, 而CK20的表达较少[39]. Chen等[40]研究发现, 在24例SBA患者中, 18例SBA患者CK7呈阳性表达. 多因素回归分析研究表明, CK7的阳性表达和CK20的阴性表达是与SBA生存相关的重要独立因素[41]. 本例患者的肿瘤免疫组化CK7[+]和CK20[-], 进一步佐证SBA的存在, 病理科医师对免疫组化标记物逐一排查, 在排除其他原发恶性肿瘤及结直肠肿瘤的前提下, 结合小肠穿刺病理标本, HE染色显示出异型细胞巢团, 呈腺管样、条索状及印戒细胞样形态, 最终确诊为原发性小肠印戒细胞癌. 确诊病因后, 专科医生对我院病理切片进行基因溯源, 结合患者基因检测结果及自身状况, 予患者卡度尼利(CTLA4/PD-1双抗)免疫治疗. 免疫治疗是一种具有前景的全身性肿瘤治疗方法, 其在癌症治疗中具有较高的获益性. 卡度尼利作为中国自主研发的全球首创的CTLA4/PD-1双抗, 具有同时作用于CTLA-4和PD-1免疫检查点靶点的特性, 可减少肿瘤细胞对相关免疫抑制通路的激活, 并增强T细胞介导的免疫应答[42].
SBA早期诊断面临着许多挑战, 因其临床表现缺乏特异性, 肿瘤标记物有时处于正常范围内. 这使得临床医师在早期阶段容易漏诊或误诊, 导致发现时已处于中晚期阶段, 尽早通过微创的方法获取组织病理明确诊断至关重要. 在面对慢性腹痛伴腹水的患者时, 临床医师需通过排除法, 深入鉴别诊断, 仔细询问病史, 收集患者既往的诊疗信息, 并进行前后对比, 寻找突破口. 本文通过此病例的分享及文献复习, 为临床医生提供宝贵的临床经验和参考, 有望增加临床医生对SBA的整体认识, 以期提高临床医生对此类罕见疾病的临床诊断水平.
| 2. | Sabo CM, Grad S, Dumitrascu DL. Chronic Abdominal Pain in General Practice. Dig Dis. 2021;39:606-614. [PubMed] [DOI] |
| 3. | Popoiag RE, Fierbințeanu-Braticevici C. Spontaneous bacterial peritonitis: update on diagnosis and treatment. Rom J Intern Med. 2021;59:345-350. [PubMed] [DOI] |
| 4. | Long B, Gottlieb M. Emergency medicine updates: Spontaneous bacterial peritonitis. Am J Emerg Med. 2023;70:84-89. [PubMed] [DOI] |
| 5. | Kedia S, Das P, Madhusudhan KS, Dattagupta S, Sharma R, Sahni P, Makharia G, Ahuja V. Differentiating Crohn's disease from intestinal tuberculosis. World J Gastroenterol. 2019;25:418-432. [PubMed] [DOI] |
| 6. | Jerjen R, Nikpour M, Krieg T, Denton CP, Saracino AM. Systemic sclerosis in adults. Part I: Clinical features and pathogenesis. J Am Acad Dermatol. 2022;87:937-954. [PubMed] [DOI] |
| 7. | Stochmal A, Czuwara J, Trojanowska M, Rudnicka L. Antinuclear Antibodies in Systemic Sclerosis: an Update. Clin Rev Allergy Immunol. 2020;58:40-51. [PubMed] [DOI] |
| 8. | Sakkas LI, Simopoulou T, Daoussis D, Liossis SN, Potamianos S. Intestinal Involvement in Systemic Sclerosis: A Clinical Review. Dig Dis Sci. 2018;63:834-844. [PubMed] [DOI] |
| 9. | Nassar M, Ghernautan V, Nso N, Nyabera A, Castillo FC, Tu W, Medina L, Ciobanu C, Alfishawy M, Rizzo V, Eskaros S, Mahdi M, Khalifa M, El-Kassas M. Gastrointestinal involvement in systemic sclerosis: An updated review. Medicine (Baltimore). 2022;101:e31780. [PubMed] [DOI] |
| 10. | McMahan ZH, Kulkarni S, Chen J, Chen JZ, Xavier RJ, Pasricha PJ, Khanna D. Systemic sclerosis gastrointestinal dysmotility: risk factors, pathophysiology, diagnosis and management. Nat Rev Rheumatol. 2023;19:166-181. [PubMed] [DOI] |
| 11. | Renaud A, Jirka A, Durant C, Connault J, Espitia O, Takoudju C, Agard C. [Gastrointestinal tract involvement in systemic sclerosis]. Rev Med Interne. 2023;44:410-422. [PubMed] [DOI] |
| 12. | Suzon B, Louis-Sidney F, Abel A, Moinet F, Bagoée C, Henry K, Coco-Viloin I, Cougnaud R, Wolff S, Guilpain P, Rivière S, Flori N, Deligny C, Maria A. [Severe small bowel involvement and chronic intestinal pseudo-obstruction in systemic sclerosis (scleroderma): Pathophysiological, diagnostic and therapeutic basis, including parenteral nutrition]. Rev Med Interne. 2024;45:147-155. [PubMed] [DOI] |
| 13. | Findlay AR, Goyal NA, Mozaffar T. An overview of polymyositis and dermatomyositis. Muscle Nerve. 2015;51:638-656. [PubMed] [DOI] |
| 14. | Tomaras S, Kekow J, Feist E. [Idiopathic Inflammatory Myopathies]. Dtsch Med Wochenschr. 2020;145:903-910. [PubMed] [DOI] |
| 15. | Baig S, Paik JJ. Inflammatory muscle disease - An update. Best Pract Res Clin Rheumatol. 2020;34:101484. [PubMed] [DOI] |
| 16. | Saif MW, Siddiqui IA, Sohail MA. Management of ascites due to gastrointestinal malignancy. Ann Saudi Med. 2009;29:369-377. [PubMed] [DOI] |
| 17. | Khalid W, Ali D, Rehman A, Kaiser MA, Fatima T, Afzal MF. An atypical presentation of small bowel adenocarcinoma; a case report. J Pak Med Assoc. 2021;71:1255-1257. [PubMed] [DOI] |
| 18. | Alfagih A, Alrehaili M, Asmis T. Small Bowel Adenocarcinoma: 10-Year Experience in a Cancer Center-The Ottawa Hospital (TOH). Curr Oncol. 2022;29:7439-7449. [PubMed] [DOI] |
| 19. | Vlachou E, Koffas A, Toumpanakis C, Keuchel M. Updates in the diagnosis and management of small-bowel tumors. Best Pract Res Clin Gastroenterol. 2023;64-65:101860. [PubMed] [DOI] |
| 20. | de Bree E, Rovers KP, Stamatiou D, Souglakos J, Michelakis D, de Hingh IH. The evolving management of small bowel adenocarcinoma. Acta Oncol. 2018;57:712-722. [PubMed] [DOI] |
| 21. | Zaanan A, Afchain P, Carrere N, Aparicio T. [Small bowel adenocarcinoma]. Gastroenterol Clin Biol. 2010;34:371-379. [PubMed] [DOI] |
| 22. | Faye AS, Holmer AK, Axelrad JE. Cancer in Inflammatory Bowel Disease. Gastroenterol Clin North Am. 2022;51:649-666. [PubMed] [DOI] |
| 23. | Laurent F, Drouillard J, Lecesne R, Bruneton JN. CT of small-bowel neoplasms. Semin Ultrasound CT MR. 1995;16:102-111. [PubMed] [DOI] |
| 24. | Soyer P, Hristova L, Boudghène F, Hoeffel C, Dray X, Laurent V, Fishman EK, Boudiaf M. Small bowel adenocarcinoma in Crohn disease: CT-enterography features with pathological correlation. Abdom Imaging. 2012;37:338-349. [PubMed] [DOI] |
| 25. | Azim D, Kumar S, Rai L, Ahmed Samo K, Siraj Memon A. Jejunal Adenocarcinoma as a Rare Cause of Small Bowel Obstruction: A Case Report. Cureus. 2020;12:e10763. [PubMed] [DOI] |
| 26. | Patel J, Zhang H, Sohail CS, Montanarella M, Butt M. Jejunal Adenocarcinoma: A Rare Cause of Small Bowel Obstruction. Cureus. 2022;14:e21195. [PubMed] [DOI] |
| 27. | Lee S, Hwang J, Kim H, Hong Y, Lee G, Chung D, Kim J, Eom K. Computed tomographic findings may be useful for differentiating small intestinal adenocarcinomas, lymphomas, and spindle cell sarcomas in dogs. Vet Radiol Ultrasound. 2023;64:233-242. [PubMed] [DOI] |
| 28. | Mellnick VM. Invited Commentary on "Spectral CT Imaging in the Differential Diagnosis of Small Bowel Adenocarcinoma From Primary Small Intestinal Lymphoma". Acad Radiol. 2019;26:e131-e133. [PubMed] [DOI] |
| 29. | Cerci JJ, Tabacchi E, Bogoni M. Fluorodeoxyglucose-PET/Computed Tomography-Guided Biopsy. PET Clin. 2016;11:57-64. [PubMed] [DOI] |
| 30. | Mohamedkhair A, Al-Ibraheem A, Saad Abdlkadir A, Jaber O. Challenging Results on FDG PET/CT in a Patient with Uncontrolled Celiac Disease and small bowel adenocarcinoma. Asia Ocean J Nucl Med Biol. 2022;10:155-160. [PubMed] [DOI] |
| 31. | Li X, Gui Y, Shen F, Zhao CL, Yang Y, Han W. The application value of capsule endoscopy in diagnosing small intestinal carcinoma. J Cancer Res Ther. 2018;14:57-60. [PubMed] [DOI] |
| 32. | Dum D, Menz A, Völkel C, De Wispelaere N, Hinsch A, Gorbokon N, Lennartz M, Luebke AM, Hube-Magg C, Kluth M, Fraune C, Möller K, Bernreuther C, Lebok P, Clauditz TS, Jacobsen F, Sauter G, Uhlig R, Wilczak W, Steurer S, Minner S, Marx AH, Simon R, Burandt E, Krech T. Cytokeratin 7 and cytokeratin 20 expression in cancer: A tissue microarray study on 15,424 cancers. Exp Mol Pathol. 2022;126:104762. [PubMed] [DOI] |
| 33. | Bayrak R, Haltas H, Yenidunya S. The value of CDX2 and cytokeratins 7 and 20 expression in differentiating colorectal adenocarcinomas from extraintestinal gastrointestinal adenocarcinomas: cytokeratin 7-/20+ phenotype is more specific than CDX2 antibody. Diagn Pathol. 2012;7:9. [PubMed] [DOI] |
| 34. | Berg KB, Schaeffer DF. SATB2 as an Immunohistochemical Marker for Colorectal Adenocarcinoma: A Concise Review of Benefits and Pitfalls. Arch Pathol Lab Med. 2017;141:1428-1433. [PubMed] [DOI] |
| 35. | Moh M, Krings G, Ates D, Aysal A, Kim GE, Rabban JT. SATB2 Expression Distinguishes Ovarian Metastases of Colorectal and Appendiceal Origin From Primary Ovarian Tumors of Mucinous or Endometrioid Type. Am J Surg Pathol. 2016;40:419-432. [PubMed] [DOI] |
| 36. | Cígerová V, Adamkov M, Drahošová S, Grendár M. Immunohis-tochemical expression and significance of SATB2 protein in colorectal cancer. Ann Diagn Pathol. 2021;52:151731. [PubMed] [DOI] |
| 37. | Elnady MS, Eltatawy FA, Nosseir AG, Zamzam YA, El-Guindya DM. Diagnostic accuracy of SATB2 in identifying primary and metastatic colorectal carcinoma: a comparative immunohistochemical study. Ecancermedicalscience. 2022;16:1491. [PubMed] [DOI] |
| 38. | Mousavi M, Goodarzi MT, Kassaee SM, Jafari Heidarloo A, Fathi M. Clinicopathological, Immunohistochemical, and PMS2 Gene Expression Profiling of Patients with Sporadic Colorectal Cancer. Arch Iran Med. 2021;24:86-93. [PubMed] [DOI] |
| 39. | Whitcomb E, Liu X, Xiao SY. Crohn enteritis-associated small bowel adenocarcinomas exhibit gastric differentiation. Hum Pathol. 2014;45:359-367. [PubMed] [DOI] |
| 40. | Chen ZM, Wang HL. Alteration of cytokeratin 7 and cytokeratin 20 expression profile is uniquely associated with tumorigenesis of primary adenocarcinoma of the small intestine. Am J Surg Pathol. 2004;28:1352-1359. [PubMed] [DOI] |
| 41. | Yun SP, Seo HI. Prognostic impact of immunohistochemical expression of CK7 and CK20 in curatively resected ampulla of Vater cancer. BMC Gastroenterol. 2015;15:165. [PubMed] [DOI] |
| 42. | Gao X, Xu N, Li Z, Shen L, Ji K, Zheng Z, Liu D, Lou H, Bai L, Liu T, Li Y, Li Y, Fan Q, Feng M, Zhong H, Huang Y, Lou G, Wang J, Lin X, Chen Y, An R, Li C, Zhou Q, Huang X, Guo Z, Wang S, Li G, Fei J, Zhu L, Zhu H, Li X, Li F, Liao S, Min Q, Tang L, Shan F, Gong J, Gao Y, Zhou J, Lu Z, Li X, Li J, Ren H, Liu X, Yang H, Li W, Song W, Wang ZM, Li B, Xia M, Wu X, Ji J. Safety and antitumour activity of cadonilimab, an anti-PD-1/CTLA-4 bispecific antibody, for patients with advanced solid tumours (COMPASSION-03): a multicentre, open-label, phase 1b/2 trial. Lancet Oncol. 2023;24:1134-1146. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁