修回日期: 2025-11-08
接受日期: 2026-01-21
在线出版日期: 2026-01-28
获得性耐药已成为胃癌临床治疗的主要障碍, microRNA-21(miR-21)在胃癌组织以及胃癌细胞系中表达上调, 抑制其表达可以延缓胃癌细胞的增殖, 促进凋亡, 但罕见关于其调节胃癌细胞化疗耐药性确切机制的报道.
探讨miR-21表达水平变化与人胃癌细胞MKN-45对奥沙利铂耐药性变化之间的关系.
建立对奥沙利铂耐药的人胃癌细胞系MKN-45, 反转录酶-聚合酶链锁反应分别检测正常胃粘膜上皮细胞GSE-1、MKN-45和耐药细胞miR-21的表达水平; 通过分别转染miR-21模拟物与抑制物上调、下调细胞miR-21的表达水平, 检测细胞增殖、凋亡变化及P糖蛋白的表达水平.
MKN-45和耐药细胞系中miR-21表达明显上调; 过表达miR-21可促进MKN-45细胞增殖, 抑制凋亡, 降低耐药细胞系对奥沙利铂的敏感性, 抑制miR-21表达可提高耐药细胞系对奥沙利铂的敏感性.
下调miR-21表达可在一定程度上逆转对奥沙利铂耐药的MKN-45的耐药性, miR-21可能成为胃癌治疗的新靶点.
核心提要: MicroRNA-21(miR-21)可能在胃癌细胞对化疗药物耐药过程中发挥作用. 本研究显示, 下调其表达可在一定程度上逆转对奥沙利铂耐药的MKN-45的耐药性, miR-21可能成为胃癌治疗的新靶点.
引文著录: 金博, 刘林, 刘玉婷. MicroRNA-21表达调节对人胃癌细胞MKN-45对奥沙利铂耐药性的影响. 世界华人消化杂志 2026; 34(1): 78-84
Revised: November 8, 2025
Accepted: January 21, 2026
Published online: January 28, 2026
Acquired drug resistance has become a major obstacle in the clinical treatment of gastric cancer. MicroRNA-21 (miR-21) is upregulated in gastric cancer tissues and cell lines. Inhibiting its expression can delay the proliferation of gastric cancer cells and promote apoptosis. However, there are few reports on the exact mechanism by which it regulates the chemoresistance of gastric cancer cells.
To investigate the relationship between miR-21 expression levels and oxaliplatin resistance in the human gastric cancer cell line MKN-45.
A human gastric cancer cell line MKN-45 resistant to oxaliplatin was established, and the expression levels of miR-21 in GSE-1, MKN-45, and oxaliplatin-resistant cells were detected by quantitative reverse-transcription polymerase chain reaction. miR-21 mimetics and inhibitors were used to transfect cells to upregulate and downregulate the expression levels of miR-21, respectively, and changes in cell proliferation, apoptosis, and expression levels of P-glycoprotein were detected.
The expression of miR-21 was significantly upregulated in MKN-45 and drug-resistant cells. Overexpression of miR-21 promoted MKN-45 cell proliferation, inhibited apoptosis, and reduced the sensitivity of drug-resistant cells to oxaliplatin. Inhibition of miR-21 expression increased the sensitivity of drug-resistant cells to oxaliplatin.
Downregulation of miR-21 expression could reverse the resistance of MKN-45 to oxaliplatin to some extent, and miR-21 might be a potential new target for the treatment of gastric cancer.
- Citation: Jin B, Liu L, Liu YT. Effect of microRNA-21 expression regulation on oxaliplatin resistance in human gastric cancer MKN-45 cells. Shijie Huaren Xiaohua Zazhi 2026; 34(1): 78-84
- URL: https://www.wjgnet.com/1009-3079/full/v34/i1/78.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v34.i1.78
胃癌是世界范围内常见的恶性肿瘤之一, 全球发病率约13.8/10万, 在全球癌症中排名第五位, 病死率约9.4/10万, 是导致癌症相关死亡的第五大原因, 是危及人类生命的严重疾病[1,2]. 除了手术, 化疗是治疗胃癌的主要手段之一, 尤其对于诊断较晚或术后复发的患者, 化疗的获益程度明显取决于患者对化疗药物的反应.
MicroRNAs(miRNAs)是一类内生的、高度保守的非编码小RNA, 是动物、植物乃至病毒中大量存在的短非编码RNA分子, 长度约22个核苷酸, 是各种细胞活动如生长、分化、发育和凋亡的强大调节因子, 参与基因转录后表达水平的调控, 在肿瘤发生、发展中发挥着重要的作用[3,4]. 目前关于miRNAs的一些研究已显示出其应用于肿瘤治疗的良好结果, 其中microRNA-21(miR-21)在许多实体癌(如胃腺癌)中异常表达, 并参与调节肿瘤细胞的增殖和转移, 有望成为理想的生物学标志物和治疗干预靶标[5-7].
奥沙利铂(oxaliplatin, L-OHP)是一种铂类化疗药物, 主要用于胃癌、结直肠癌等恶性肿瘤的临床治疗, 常与其他化疗药物如氟尿嘧啶、亚叶酸钙联合使用. 奥沙利铂通过形成DNA交联, 阻碍肿瘤细胞的分裂和增殖, 从而发挥抗肿瘤作用, 其活性主要通过与DNA结合形成铂-DNA复合物, 干扰DNA的复制和转录, 进而导致肿瘤细胞周期停滞, 最终诱发细胞凋亡[8,9].
在本研究中, 我们建立了对奥沙利铂耐药的人MKN-45胃癌细胞株, 通过上调和下调miR-21的表达探讨其与胃癌耐药性之间的关系. 研究结果显示, 与亲代细胞系相比, 对奥沙利铂耐药的MKN-45表现出显著的miR-21表达上调; 调节miR-21的表达可以导致对奥沙利铂耐药的MKN-45发生耐药性变化, 下调miR-21表达可在一定程度上逆转对奥沙利铂耐药的MKN-45的耐药性; miR-21可能通过调节P-糖蛋白的表达来影响耐药性的变化.
1.1.1 耐药细胞系建立: 正常胃粘膜上皮细胞GSE-1与人胃癌细胞MKN-45(购自上海中桥新舟公司)分别培养于含10%胎牛血清DMEM, 置于含有5% CO2的培养箱, 37 ℃饱和湿度培养. 待细胞融合达85%, 用0.25%的胰酶消化传代. 采用药物浓度递增法[10]建立化疗耐药胃癌细胞系, 人胃癌细胞MKN-45持续暴露于浓度梯度逐渐增加的化疗药物奥沙利铂(100 μM, 200 μM, 400 μM)中. 药物诱导历时6-8 mo, 直到细胞能够在药物中稳定生长. MTT法测定化疗药物对亲本细胞和耐药细胞的半数抑制率(IC50), 根据IC50值计算出耐药指数(resistance index, RI). RI = 耐药细胞系的IC50/亲代细胞系的IC50, RI>5认为耐药细胞系的耐药性符合耐药株要求.
1.1.2 基因转染: 取转染量miRNA体积, 加入稀释体积的无血清培养基, 孵育5 min; 同时取上述转染量的Lipofectamine™ RNAiMAX Transfection Reagent, 加入上述稀释体积的无血清培养基, 孵育5 min; 将上述混合物均匀加入细胞培养液中, 置于5% CO2, 37 ℃培养箱培养6 h, 随后更换对应的新鲜完全培养基, 置于5% CO2, 37 ℃培养箱继续培养至48 h, 收集样品, 进行后续操作. 使用Lipofectamine 2000将miR-21模拟物、抑制物或miR-21模拟物、抑制物对照, 转染入人胃癌MKN-45细胞中, 转染后继续培养用于后续实验. 以未转染miR-21模拟物或抑制物的小干扰RNA的MKN-45细胞作为空白对照.
1.2.1 反转录酶-聚合酶链锁反应: 使用TRIzol从细胞分离总RNA, 采用反转录试剂盒(R323-01, 诺唯赞, 中国), 在thermocycle仪器(T100, Bio-Rad, 美国)上进行cDNA合成, 反转录条件为42 ˚C, 5 min, 37 ˚C, 15 min, 85 ˚C, 5 s. 然后, 在ABI QuantStudio 5仪器上进行定量聚合酶链反应, 设置的程序为95 ˚C预变性10 min, 95 ˚C变性15 s, 60 ˚C退火延伸1 min, 变性和延伸执行40个循环, 每个样品进行3次技术重复. 计算每个转录本mRNA的相对表达量, 使用GAPDH作为内参基因, 进行标准化, 使用2-ΔΔCT方法进行分析(Livak和Schmittgen 2001).
Western blotting: 细胞在预冷的RIPA缓冲液(Proteintech, 中国)中裂解, 并加入蛋白酶抑制剂(sigma, 美国), 在冰上孵育30 min. 样品在沸水中煮沸10 min, 加入蛋白上样缓冲液(Solarbio, 中国), 上样于10% SDS-PAGE凝胶上, 转移到0.45 mm PVDF膜上(Millipore, 美国). PVDF膜在室温下用牛奶封闭1 h, 在4 ℃下一抗孵育过夜, 然后用辣根过氧化物酶偶联二抗(抗兔抗体, 1:10000, Proteintech, 中国; 或抗小鼠, 1:10000, ABclonal, 中国), 室温下孵育45 min. 然后, 使用增强型ECL试剂(Beyotime, 中国)通过化学发光对膜进行曝光可视化.
1.2.2 细胞增殖实验: 采用CCK-8试剂盒(Yeasen, 上海, 中国)进行检测. 将细胞以每孔适当细胞量接种在96孔板中, 对对照组和实验组的细胞进行相应处理, 并以无细胞的培养基作为空白对照. 在37 ℃和5%二氧化碳下培养0、24、48和72 h后, 每孔直接加入10 μL CCK-8溶液, 37 ℃下孵育3 h后, 用酶标仪(ELX800, Biotek, 美国)检测450 nm, 620 nm的吸光度值. 细胞增殖率的计算公式如下: 增殖率 = (实验OD值-空白OD值)/(对照OD值-空白OD值)×100%.
1.2.3 凋亡检测: 使用Annexin V-APC/7-ADD细胞凋亡检测试剂盒(Yeasen, 上海, 中国)检测细胞凋亡. 将细胞接种于24孔板中, 进行相应细胞处理. 将处理后的细胞和对照细胞分别与5 μL Annexin V-APC在室温避光孵育15 min, 然后加入10 μL PI试剂室温避光孵育15 min, 流式细胞仪(FACSCanto, BD, United States)上机检测细胞凋亡水平.
统计学处理 采用SPSS 22.0进行统计学分析. 数据以平均值±标准差表示, 多组间比较采用单因素方差分析, 两两比较采用t检验. 以P<0.05认为差异具有统计学意义.
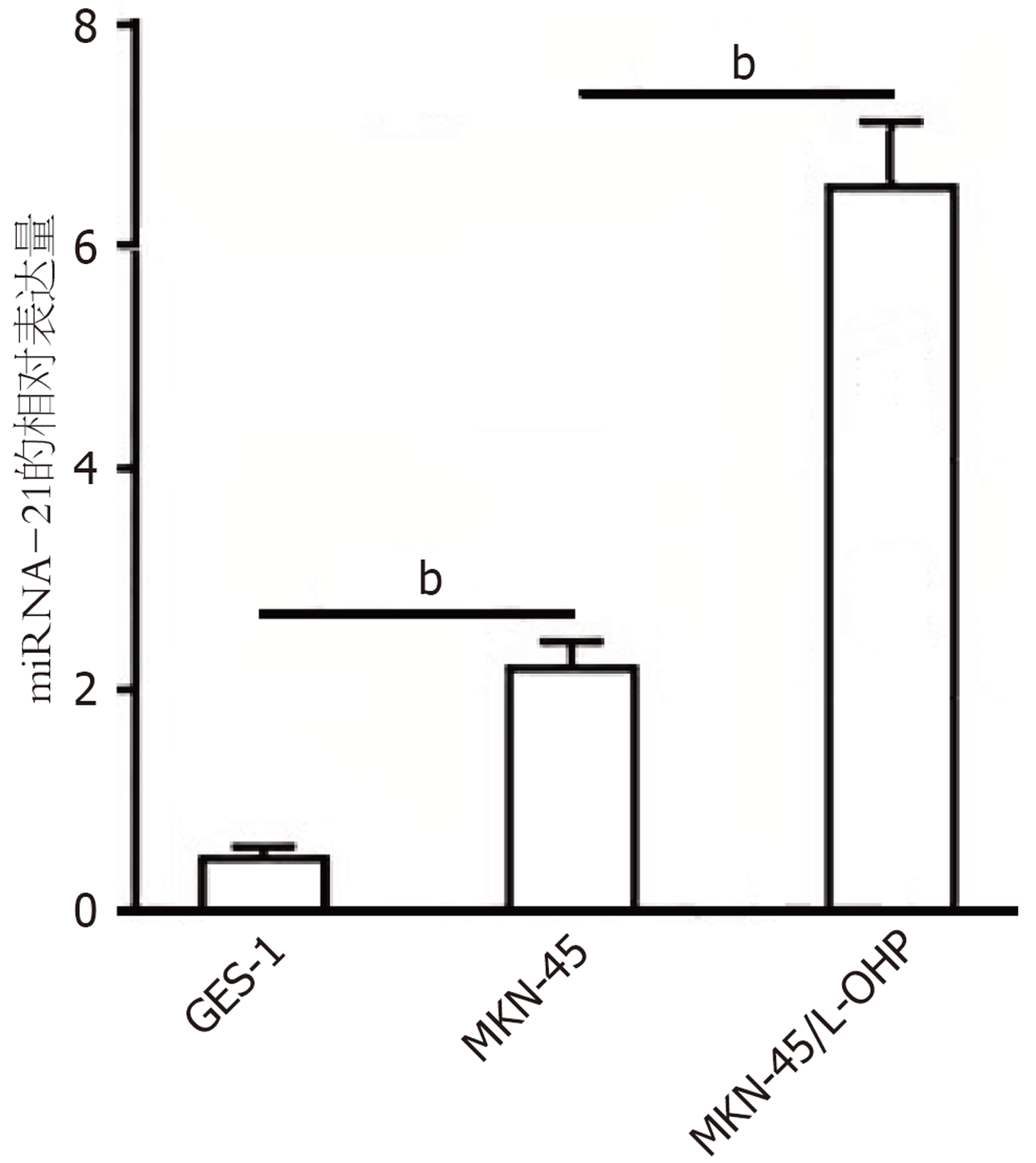
反转录酶-聚合酶链锁反应检测结果显示, 相较于正常胃粘膜上皮细胞GES-1, 人胃癌细胞MKN-45中miR-21的表达水平显著升高(图1, P<0.01). 与亲代MKN-45细胞相比, 耐L-OHP的MKN-45细胞(MKN-45/L-OHP)中miR-21的表达水平显著升高(图1, P<0.01).
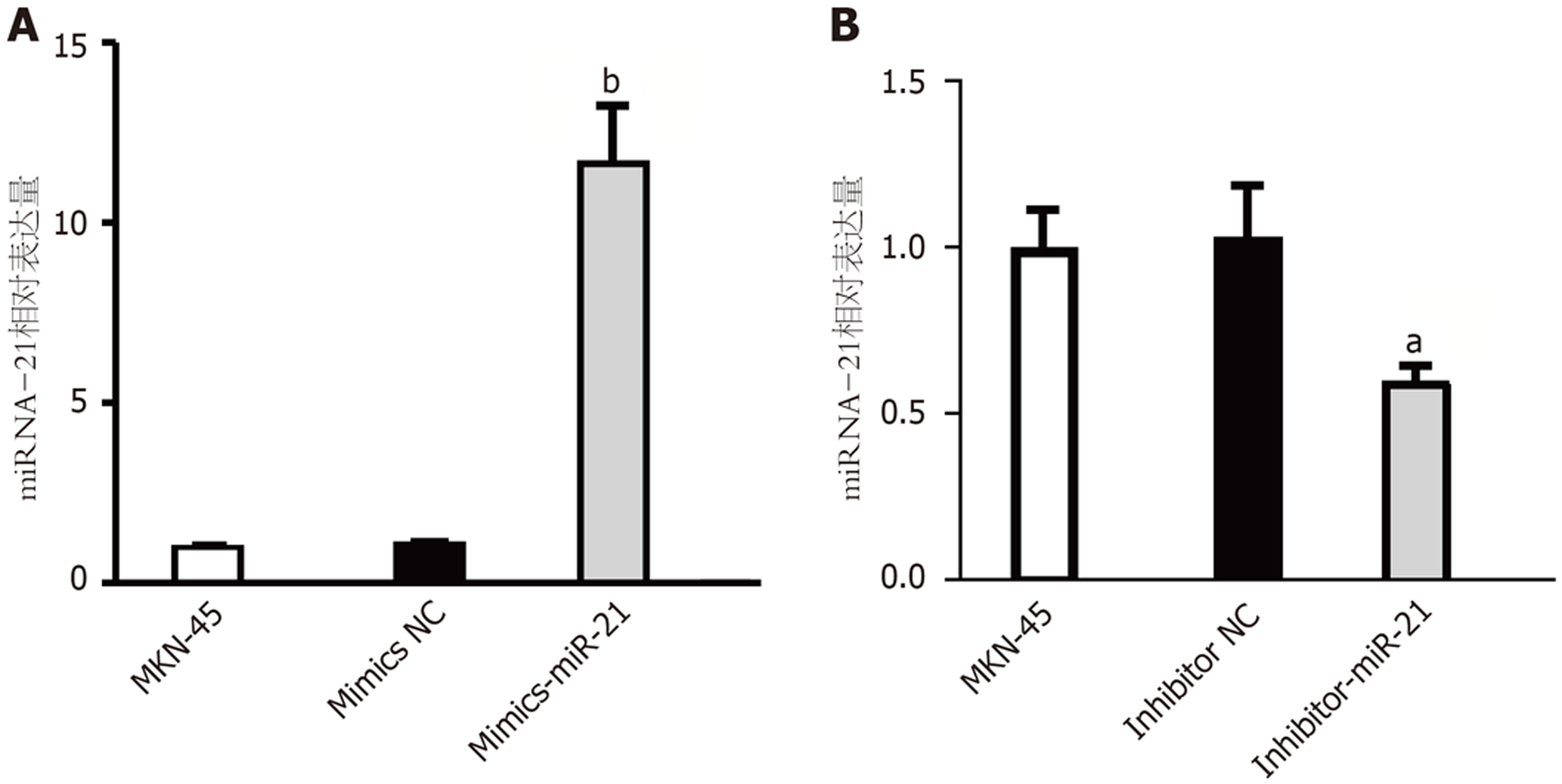
如图2所示, 转染miRNA-21模拟物后, miRNA-21的mRNA表达水平明显高于亲代MKN-45和阴性对照组(P<0.01); 相反, 转染miRNA-21抑制物后, miRNA-21的表达水平明显低于亲代MKN-45和阴性对照组(P<0.05).
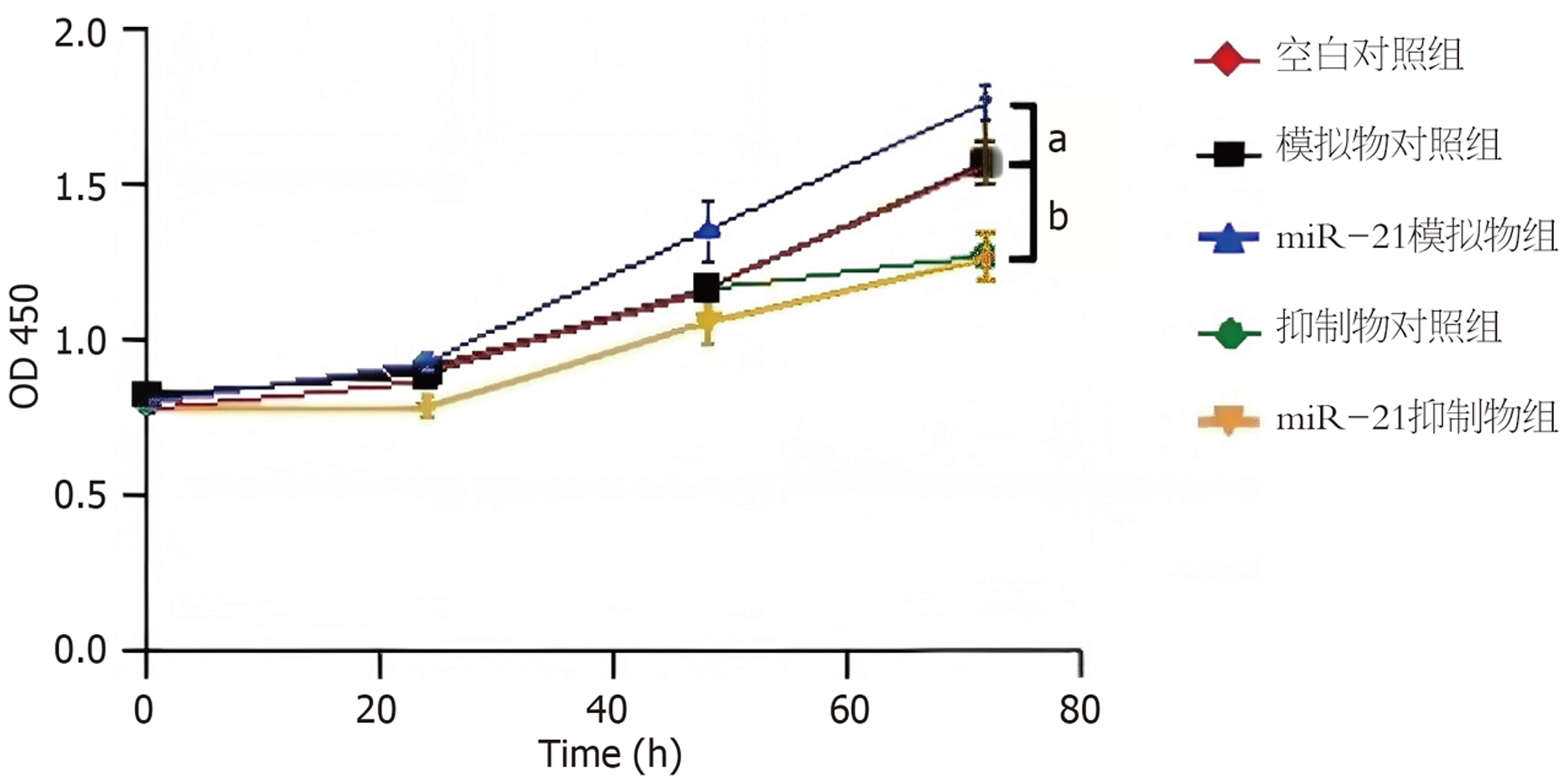
CCK-8实验结果提示, 过表达miR-21显著增强MKN-45的细胞增殖能力(P<0.05), 干扰miR-21表达则显著抑制MKN-45的细胞增殖能力(P<0.01)(图3).
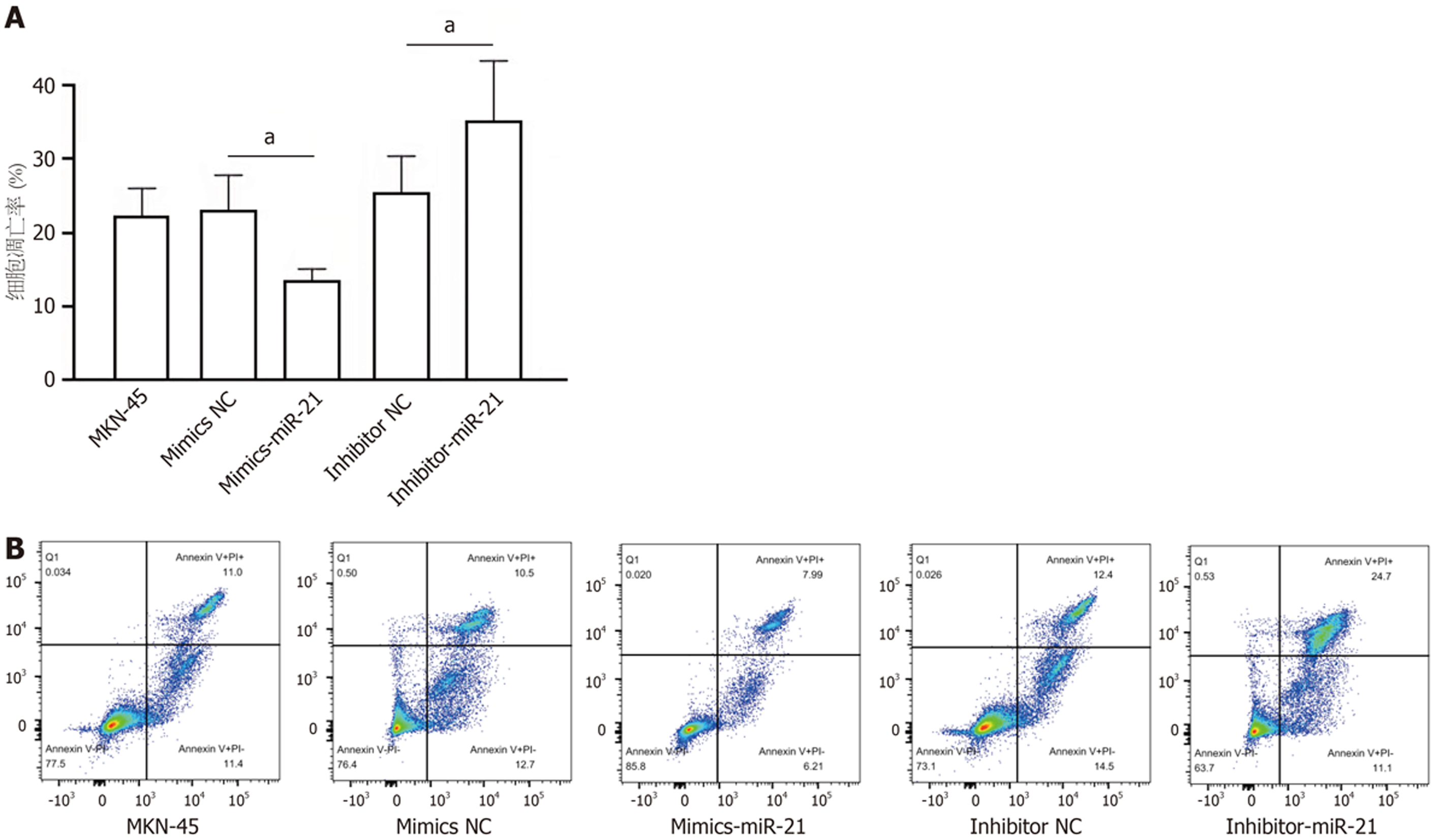
MKN-45细胞转染miR-21模拟物后, 细胞凋亡呈现抑制趋势; 相反, 转染miR-21抑制物可促进细胞凋亡(图4, P<0.05).
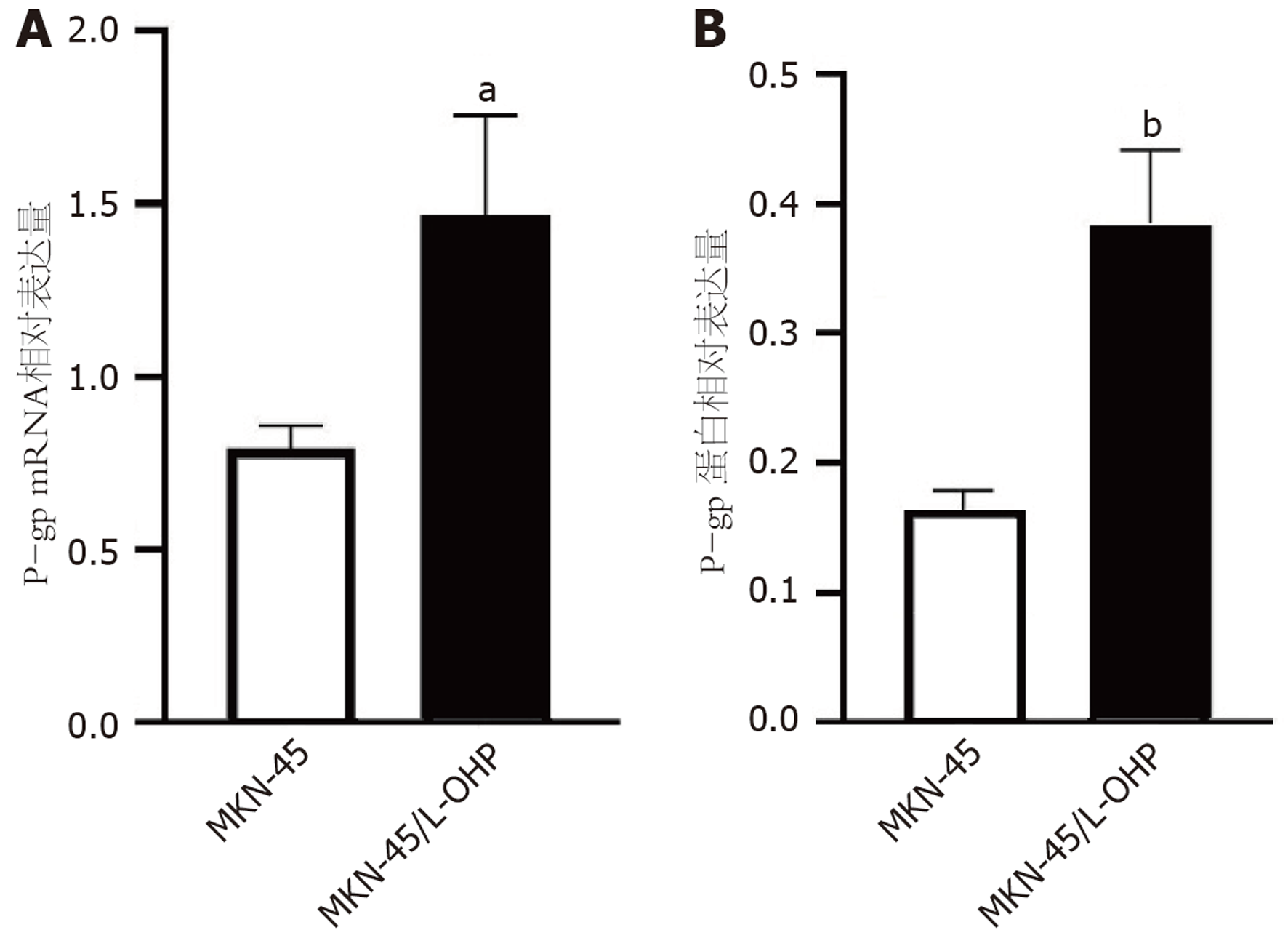
与亲本细胞系相比, MKN-45/L-OHP细胞中P糖蛋白(P-glycolprotein, P-gp)的mRNA表达水平(图5A, P<0.05)和蛋白表达水平(图5B, P<0.01)均显著升高. 结合研究组前期的研究结果[8], 我们进一步假设miR-21可能通过调节P-gp来促进MKN-45细胞对奥沙利铂的耐药性.
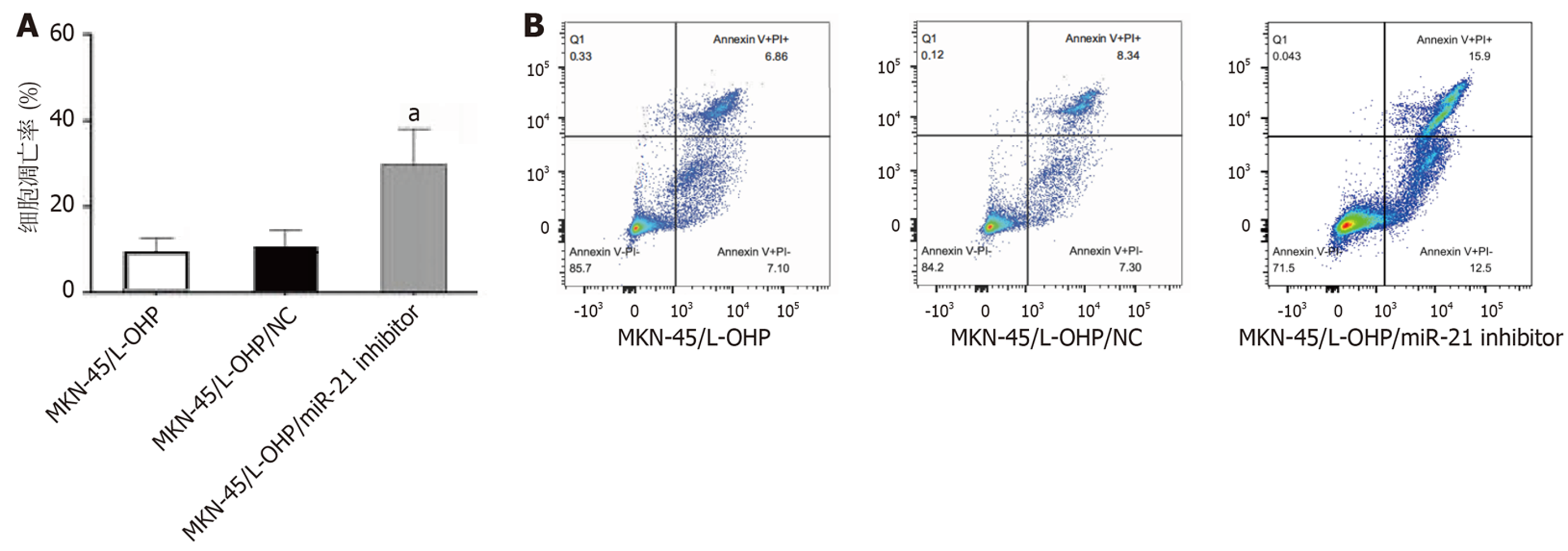
与MKN-45/L-OHP或阴性对照组细胞相比, 转染有miR-21抑制物的MKN-45/L-OHP细胞凋亡率显著上升, 提示拮抗miR-21的表达可以部分提高MKN-45/L-OHP细胞对L-OHP的敏感性, 即逆转MKN-45/L-OHP细胞对L-OHP的耐药性(图6, P<0.05).
随着耐药性的出现, 化疗药物在胃癌患者中的临床应用受到了严重限制. 有研究显示, miR-21在胃癌等多种肿瘤细胞中表现出表达上调的趋势, 且miR-21与胃癌细胞对紫杉醇、顺铂、氟脲嘧啶、阿霉素等化疗药物的耐药性相关[11-13]. 基于本研究的结果, 相比于正常胃粘膜上皮细胞, 胃癌细胞中miR-21的表达水平明显升高; 与亲代MKN-45细胞相比, 耐奥沙利铂的MKN-45细胞中miR-21的表达水平进一步显著升高. 另一方面, 抑制耐药细胞中miR-21的表达会增加MKN-45细胞对奥沙利铂的敏感性并促进细胞凋亡. 据Zheng等[14]报道, MiR-21可能通过靶向抑制一些肿瘤抑制基因(如PTEN、PDCD4等)促进癌细胞增殖、抑制凋亡, 这种机制令癌细胞对化疗药物的杀伤作用更具抵抗能力. 就胃癌细胞而言, miR-21表达水平上调能够增强癌细胞对顺铂和氟尿嘧啶等常用化疗药物的耐药性[15,16].
关于miR-21促进胃癌细胞对奥沙利铂的耐药机制, Liu等[17]的研究发现, miR-21可能靶向抑制某些与药物代谢、排除相关的基因, 从而影响奥沙利铂的有效性, 比如通过调节转运蛋白的表达, 改变奥沙利铂在肿瘤细胞内的浓度. miR-21还可能通过下调细胞凋亡相关的基因(如PTEN、Bcl-2家族成员等), 促进癌细胞存活以降低对化疗药物的敏感性[18]. 此外, miR-21还可能激活某些促进生长的信号通路(如PI3K/Akt通路), 从而增强细胞的增殖能力, 进一步导致耐药现象的出现[19].
P-gp是一种由MDR基因编码的三磷酸腺苷酶活性跨膜泵, 通过与细胞内的药物结合而促发耐药机制, 导致三磷酸腺苷发生水解, 能量增加, 药物从细胞内逆浓度梯度泵出, 因此细胞内的药物浓度不断下降, 最终呈现出耐药性[20,21]. Bourguignon等[22]提出, 在耐药的乳腺癌细胞中, 高表达的P-gp与化疗耐药性相关. 本研究的结果提示耐药MKN-45/L-OHP细胞中P-gp在mRNA和蛋白水平的表达均明显高于亲代细胞MKN-45, 与上述研究报道一致. 结合相关研究结果, MKN-45细胞对奥沙利铂的耐药性可能与P-gp表达上调有关.
综上所述, 本研究的结果提示, miR-21在对奥沙利铂耐药的MKN-45细胞中表达水平明显升高, 抑制miR-21表达可促进耐药细胞凋亡, 从而增加MKN-45细胞对奥沙利铂的敏感性, 在一定程度上逆转细胞的耐药性. MKN-45细胞对奥沙利铂的耐药性可能与P-gp表达上调有关.
进展期胃癌的治疗效果往往与化疗相关, 化疗耐药是影响治疗效果的关键因素. 研究显示, microRNA-21(miR-21)在胃癌组织以及胃癌细胞系中表达上调, 抑制miR-21的表达可以延缓胃癌细胞的增殖, 促进凋亡, 但罕见关于miR-21调节胃癌细胞化疗耐药性确切机制的报道.
本研究以miR-21为研究对象, 通过构建人胃癌细胞MKN-45对奥沙利铂的耐药模型, 上调和下调胃癌细胞miR-21的表达来比较耐药细胞株耐药性的变化, 以探讨miR-21与胃癌细胞耐药性之间的关系.
确定miR-21表达水平变化与对奥沙利铂耐药的MKN-45耐药性变化之间的关系.
采用药物浓度递增法建立对奥沙利铂耐药的人胃癌细胞系MKN-45, 通过分别转染miR-21模拟物与抑制物来上调、下调miR-21的表达水平, 检测细胞增殖与凋亡的变化.
过表达miR-21降低耐药细胞系对奥沙利铂的敏感性, 反之, 抑制miR-21表达可提高耐药细胞系对奥沙利铂的敏感性.
miR-21的表达水平与对奥沙利铂耐药的MKN-45的耐药性相关, 下调miR-21表达可在一定程度上逆转其耐药性.
miR-21可能参与胃癌细胞耐药过程, 有望成为胃癌治疗的新靶点.
| 1. | Bray F, Laversanne M, Sung H, Ferlay J, Siegel RL, Soerjomataram I, Jemal A. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024;74:229-263. [PubMed] [DOI] |
| 2. | López MJ, Carbajal J, Alfaro AL, Saravia LG, Zanabria D, Araujo JM, Quispe L, Zevallos A, Buleje JL, Cho CE, Sarmiento M, Pinto JA, Fajardo W. Characteristics of gastric cancer around the world. Crit Rev Oncol Hematol. 2023;181:103841. [PubMed] [DOI] |
| 4. | Giordo R, Ahmadi FAM, Husaini NA, Al-Nuaimi NRAM, Ahmad SMS, Pintus G, Zayed H. microRNA 21 and long non-coding RNAs interplays underlie cancer pathophysiology: A narrative review. Noncoding RNA Res. 2024;9:831-852. [PubMed] [DOI] |
| 5. | Saliminejad K, Khorram Khorshid HR, Soleymani Fard S, Ghaffari SH. An overview of microRNAs: Biology, functions, therapeutics, and analysis methods. J Cell Physiol. 2019;234:5451-5465. [PubMed] [DOI] |
| 6. | Zhou H, Liu H, Jiang M, Zhang S, Chen J, Fan X. Targeting MicroRNA-21 Suppresses Gastric Cancer Cell Proliferation and Migration via PTEN/Akt Signaling Axis. Cell Transplant. 2019;28:306-317. [PubMed] [DOI] |
| 7. | Tse J, Pierce T, Carli ALE, Alorro MG, Thiem S, Marcusson EG, Ernst M, Buchert M. Onco-miR-21 Promotes Stat3-Dependent Gastric Cancer Progression. Cancers (Basel). 2022;14:264. [PubMed] [DOI] |
| 8. | Baek JH, Kang BW, Kang H, Cho M, Kwon OK, Park JY, Park KB, Seo AN, Kim JG. Clinical implications and chemo-sensitivity of adjuvant chemotherapy in patients with poorly cohesive cells-gastric cancer. Cancer Chemother Pharmacol. 2023;92:279-290. [PubMed] [DOI] |
| 9. | Han J, Sun W, Liu R, Zhou Z, Zhang H, Chen X, Ba Y. Plasma Exosomal miRNA Expression Profile as Oxaliplatin-Based Chemoresistant Biomarkers in Colorectal Adenocarcinoma. Front Oncol. 2020;10:1495. [PubMed] [DOI] |
| 10. | Li Z, Hu S, Wang J, Cai J, Xiao L, Yu L, Wang Z. MiR-27a modulates MDR1/P-glycoprotein expression by targeting HIPK2 in human ovarian cancer cells. Gynecol Oncol. 2010;119:125-130. [PubMed] [DOI] |
| 11. | Jin B, Liu Y, Wang H. Antagonism of miRNA-21 Sensitizes Human Gastric Cancer Cells to Paclitaxel. Cell Biochem Biophys. 2015;72:275-282. [PubMed] [DOI] |
| 12. | Farasati Far B, Vakili K, Fathi M, Yaghoobpoor S, Bhia M, Naimi-Jamal MR. The role of microRNA-21 (miR-21) in pathogenesis, diagnosis, and prognosis of gastrointestinal cancers: A review. Life Sci. 2023;316:121340. [PubMed] [DOI] |
| 13. | Liu Y, Ao X, Ji G, Zhang Y, Yu W, Wang J. Mechanisms of Action And Clinical Implications of MicroRNAs in the Drug Resistance of Gastric Cancer. Front Oncol. 2021;11:768918. [PubMed] [DOI] |
| 14. | Zheng P, Chen L, Yuan X, Luo Q, Liu Y, Xie G, Ma Y, Shen L. Exosomal transfer of tumor-associated macrophage-derived miR-21 confers cisplatin resistance in gastric cancer cells. J Exp Clin Cancer Res. 2017;36:53. [PubMed] [DOI] |
| 15. | Yue Y, Lin X, Qiu X, Yang L, Wang R. The Molecular Roles and Clinical Implications of Non-Coding RNAs in Gastric Cancer. Front Cell Dev Biol. 2021;9:802745. [PubMed] [DOI] |
| 16. | Qi M, Liu D, Zhang S. MicroRNA-21 contributes to the discrimination of chemoresistance in metastatic gastric cancer. Cancer Biomark. 2017;18:451-458. [PubMed] [DOI] |
| 17. | Liu Q, Liu S, Wang D. Overexpression of microRNA-21 decreased the sensitivity of advanced cervical cancer to chemoradiotherapy through SMAD7. Anticancer Drugs. 2020;31:272-281. [PubMed] [DOI] |
| 18. | Sun X, Chen J, Chen X, Gao Q, Chen W, Zou X, Zhang F, Gao S, Qiu S, Yue X, Yao H, Liu X, Li M. A Systematic Review of Clinical Validated and Potential miRNA Markers Related to the Efficacy of Fluoropyrimidine Drugs. Dis Markers. 2022;2022:1360954. [PubMed] [DOI] |
| 19. | He G, Ding J, Zhang Y, Cai M, Yang J, Cho WC, Zheng Y. microRNA-21: a key modulator in oncogenic viral infections. RNA Biol. 2021;18:809-817. [PubMed] [DOI] |
| 20. | Wu B, Li P, Qiu E, Chen J. Metformin alleviates adriamycin resistance of osteosarcoma by declining YY1 to inhibit MDR1 transcriptional activity. BMC Pharmacol Toxicol. 2023;24:50. [PubMed] [DOI] |
| 21. | Zhang S, Xing Z, Ke J. Using β-Elemene to reduce stemness and drug resistance in osteosarcoma: A focus on the AKT/FOXO1 signaling pathway and immune modulation. J Bone Oncol. 2025;50:100655. [PubMed] [DOI] |
| 22. | Bourguignon LY, Spevak CC, Wong G, Xia W, Gilad E. Hyaluronan-CD44 interaction with protein kinase C(epsilon) promotes oncogenic signaling by the stem cell marker Nanog and the Production of microRNA-21, leading to down-regulation of the tumor suppressor protein PDCD4, anti-apoptosis, and chemotherapy resistance in breast tumor cells. J Biol Chem. 2009;284:26533-26546. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 新疆维吾尔自治区
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁