修回日期: 2025-05-26
接受日期: 2025-07-01
在线出版日期: 2025-07-28
高迁移率族蛋白N5(high mobility group ncleosomal binding domain 5, HMGN5)作为核内非组蛋白, 广泛参与染色质重塑及肿瘤恶性进展调控. 然而, 其在结直肠癌(colorectal cancer, CRC)5-氟尿嘧啶(5-fluorouracil, 5-FU)耐药性中的生物学功能及其分子机制尚未阐明.
揭示HMGN5对CRC细胞5-FU耐药性的调控作用及初步分子机制, 为逆转CRC化疗耐药提供潜在干预靶点.
基于CTR-DB数据库分析含5-FU化疗的CRC患者(分为化疗响应组和无响应组)肿瘤组织中HMGN5表达差异. 采用浓度梯度递增法联合间歇性冲击策略构建CRC 5-FU耐药细胞模型; 通过Western blot比较耐药细胞与亲本细胞中HMGN5的表达差异; 利用shRNA技术构建HMGN5稳定敲低细胞系, 结合CCK-8实验、EdU染色及流式细胞术分析HMGN5缺失对细胞增殖、凋亡及5-FU敏感性的影响; 通过Western blot和免疫荧光检测Hippo通路关键分子的蛋白表达与亚细胞定位.
与5-FU化疗响应组相比, CRC组织中HMGN5的表达在不响应组显著上调. 此外, 5-FU耐药细胞系中的HMGN5表达水平较亲本细胞显著升高. HMGN5敲低显著增强了-FU耐药CRC细胞对5-FU的敏感性. HMGN5敲低通过促进Hippo通路核心激酶巨噬细胞刺激蛋白1、大肿瘤抑制因子1的磷酸化水平以及Yes关联蛋白1(Yes-associated protein 1, YAP1)表达, 抑制YAP1核转位.
敲低HMGN5能部分恢复5-FU耐药CRC细胞对其敏感性, 其机制可能与增强5-FU诱导的凋亡通路与激活Hippo-YAP1信号轴有关.
核心提要: 敲低高迁移率族蛋白N5能部分恢复5-氟尿嘧啶耐药结直肠癌细胞对其敏感性, 其机制可能与抑制Hippo-YAP1信号轴有关.
引文著录: 李军益, 冯星星. 敲低HMGN5增强5-FU耐药结直肠癌细胞对其的敏感性. 世界华人消化杂志 2025; 33(7): 590-598
Revised: May 26, 2025
Accepted: July 1, 2025
Published online: July 28, 2025
As a nuclear non-histone protein, high mobility group ncleosomal binding domain 5 (HMGN5) is extensively involved in chromatin remodeling and the regulation of tumor malignant progression. However, its biological role and molecular mechanisms in 5-fluorouracil (5-FU) resistance in colorectal cancer (CRC) remain unclear.
To elucidate the regulatory role of HMGN5 in 5-FU resistance of CRC cells and its preliminary molecular mechanism, aiming to provide potential intervention targets for reversing chemotherapy resistance in CRC.
HMGN5 expression was detected in tumor tissues between responders and non-responders to 5-FU-containing chemotherapy in CRC patients using the CTR-DB database. A 5-FU-resistant CRC cell model was established using a concentration gradient escalation method combined with intermittent pulse exposure. Western blot analysis was employed to compare HMGN5 expression between resistant and parental cells. A cell line with stable HMGN5 knockdown was generated using shRNA technology. The effects of HMGN5 depletion on cell proliferation, apoptosis, and 5-FU sensitivity were evaluated via CCK-8 assay, EdU staining, and flow cytometry. Western blot and immunofluorescence were used to assess protein expression and subcellular localization of key Hippo pathway proteins.
Compared with the 5-FU chemotherapy response group, the expression of HMGN5 in CRC tissues was significantly upregulated in the non-response group. Additionally, the expression level of HMGN5 in 5-FU-resistant cells was significantly higher than that in parental cells. HMGN5 knockdown markedly enhanced the sensitivity of 5-FU-resistant CRC cells to 5-FU. HMGN5 knockdown promoted the phosphorylation levels of the Hippo pathway core kinases macrophage stimulating protein 1 and larger tumor suppressor 1, as well as the expression of Yes-associated protein 1 (YAP1), and inhibits the nuclear translocation of YAP1.
HMGN5 knockdown can partially restore the sensitivity of 5-FU-resistant CRC cells to 5-FU, and the mechanism may be related to enhancing the apoptosis pathway induced by 5-FU and activating the Hippo-YAP1 signaling axis.
- Citation: Li JY, Feng XX. Downregulation of HMGN5 enhances sensitivity of 5-fluorouracil-resistant colorectal cancer cells to chemotherapy. Shijie Huaren Xiaohua Zazhi 2025; 33(7): 590-598
- URL: https://www.wjgnet.com/1009-3079/full/v33/i7/590.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i7.590
结直肠癌(colorectal cancer, CRC)是全球范围内最常见的恶性肿瘤之一, 其发病率和死亡率在消化系统肿瘤中位居前列[1]. 尽管近年来在CRC的早期诊断和治疗方面取得了显著进展, 但化疗耐药性, 尤其是5-氟尿嘧啶(5-fluorouracil, 5-FU)的耐药性, 已成为限制CRC治疗效果的主要障碍之一[2]. 5-FU作为CRC治疗中广泛使用的化疗药物, 其主要作用机制是通过抑制胸苷酸合成酶或干扰核酸代谢来抑制肿瘤细胞的增殖. 然而, 随着治疗时间的延长, 肿瘤细胞可通过多种机制产生5-FU耐药性, 如DNA修复能力增强、5-FU代谢途径的改变、凋亡信号通路的抑制以及肿瘤微环境的重塑等, 这些机制共同作用导致了治疗失败和肿瘤复发[3]. 因此, 深入解析5-FU耐药的分子靶点及其调控网络, 对于开发新型靶向治疗策略, 逆转耐药性并提高CRC患者生存率具有重要意义.
近年来, 高迁移率家族(high mobility group, HMG)蛋白因其在染色质重塑、基因转录调控及肿瘤发生发展中的重要作用而受到广泛关注[4]. HMG蛋白是一类通过与染色质结合并调节核小体稳定性来直接影响基因表达的核蛋白[5]. 高迁移率族蛋白N5(high mobility group ncleosomal binding domain 5, HMGN5)作为该家族的重要成员, 具有独特的结构和功能特性, 能够在特定基因组区域增强或抑制转录活性. 已有研究表明[6], HMGN5在多种肿瘤中表现出重要的致癌作用, 例如通过调控增殖、侵袭和转移相关的信号通路(如PI3K/AKT、Wnt/β-catenin等)促进肿瘤进展. 此外, HMGN5还可能通过调节染色质结构影响肿瘤细胞的表观遗传状态, 进而参与肿瘤对化疗药物的敏感性调控[7]. 尽管HMGN5在多种癌症中的功能逐渐被揭示, 其在CRC中的具体作用及其在5-FU耐药性调控中的潜在机制仍未被充分研究. 基于此, 本研究旨在探讨HMGN5在CRC中对5-FU耐药性的调控作用及其潜在分子机制, 并希望为克服5-FU耐药性并改善CRC患者的临床治疗效果提供新的思路和策略.
胎牛血清和DMEM培养基购自美国Gibco; 青霉素和链霉素均购自美国Sigma; 人结直肠癌细胞系HCT-8和HCT-116购自武汉普诺赛生命科技有限公司; 抗巨噬细胞刺激蛋白1(macrophage stimulatory protein 1, MST1)(abs155521)、抗磷酸化(phosphorylated, p)-MST1(abs172571)、抗大肿瘤抑制因子1(larger tumor suppressor 1, LATS1)(abs147075)、抗p-LATS1(abs172461)、抗Cleaved caspase 9抗体(abs174433)、抗多聚ADP核糖聚合酶(poly-ADP-ribose polymerase, PARP)抗体(abs155772)、抗Cleaved PARP抗体(abs132006)购自上海爱必信生物技术有限公司; 抗Yes关联蛋白1(Yes-associated protein 1, YAP1)(ab52771)和抗GAPDH(ab9485)购自美国Abcam公司; HRP标记的羊抗兔IgG(A0216)、Cy3标记的羊抗兔IgG(A0516)、抗Caspase 3抗体(AF6370)、抗Caspase 9抗体(AF1264)、抗Cleaved caspase 3抗体(AC033)、BCA快速蛋白定量试剂盒(P0009)、Beyo ECL Plus试剂盒(P0018S)、BeyoClick EdU细胞增殖检测试剂盒(C0078L)和Annexin V-FITC细胞凋亡检测试剂盒(C1062M)购自上海碧云天生物技术有限公司; RNA isolater试剂(R401-01)购自南京诺唯赞生物科技有限公司; 逆转录试剂盒(4897030001)购自瑞士Roche; SYBR Green Master Mix试剂盒(ALH185)购自北京百奥莱博科技有限公司.
1.2.1 CTR-DB数据库检测5-FU耐药CRC组织中HMGN5表达: 通过CTR-DB数据库(http://ctrdb.cloudna.cn)筛选以5-FU化疗(包含FOLFOX4、FOLFIRI、FOLFOX和FOLFOX6等含5-FU的化疗)的结直肠癌患者, 比较响应化疗和不响应化疗的肿瘤组织中HMGN5表达差异.
1.2.2 CRC细胞系的培养与耐药细胞模型的构建: 人结直肠癌细胞系HCT-8和HCT-116在含10%胎牛血清、1%青霉素-链霉素双抗的DMEM培养基中, 于37 ℃、5% CO2的恒温培养箱中进行常规培养. 采用浓度递增法联合间歇性冲击策略构建5-FU耐药细胞系. 具体步骤如下: 以HCT-8和HCT-116为亲本细胞, 首先通过CCK-8法检测5-FU对亲本细胞的半数抑制浓度(IC50)值. 随后, 将亲本细胞分别接种于含其IC50值10%浓度的5-FU培养基中培养12 h, 之后将残存细胞转移至正常培养基中继续培养24 h. 此过程反复多次, 直至细胞能够在含10% IC50浓度的5-FU培养基中稳定生长. 随后逐步增加5-FU浓度(每次递增量为IC50的5%), 并重复上述刺激方法, 持续诱导3 mo, 最终筛选出具有稳定耐药表型的细胞亚群(HCT-8/5-FU和HCT-116/5-FU), 并通过计算耐药指数(resistance index, RI)来评估耐药细胞构建是否成功. RI = 耐药细胞IC50值/亲本细胞IC50值.
1.2.3 IC50值测定: 分别将1×104个细胞/孔接种于96孔板, 24 h后加入梯度稀释的5-FU(终浓度范围1-100 μg/mL), 继续培养24 h. 每孔加入10 μL CCK-8试剂, 37 ℃孵育2 h后, 酶标仪450 nm波长测定吸光度(optical density, OD)值, 以药物浓度为横坐标、细胞存活率为纵坐标绘制剂量-效应曲线, 通过GraphPad Prism 8.0计算IC50值.
1.2.4 细胞转染: 针对HMGN5的shRNA载体(HMGN5-shRNA)由广州锐博生物技术有限公司构建, 将靶向HMGN5的shRNA序列插入载体质粒中, 阴性对照载体作为阴性对照(Con-shRNA). 构建的耐药细胞分别以1×106个/孔接种于6孔板, 待细胞融合度达80%时, 使用Lipofectamine 3000转染试剂(Invitrogen)分别将HMGN5-shRNA或Con-shRNA载体转染至细胞中. 转染后48 h, 通过RT-qPCR(检测HMGN5 mRNA水平)和Western Blot(检测HMGN5蛋白水平)验证转染效率.
1.2.5 RT-qPCR检测基因表达: 总RNA采用RNA isolater试剂提取总RNA, 经NanoDrop 2000测定浓度后, 使用Roche逆转录试剂盒合成cDNA. qPCR反应体系包含2 μL cDNA、0.4 μL上下游引物(10 μM)、0.4 μL ROX Reference Dye、10 μL 2×SYBR Green Master Mix, 反应条件为95 ℃预变性2 min, 95 ℃变性10 s、60 ℃退火30 s, 共40个循环. 以GAPDH为内参, 采用2−△△Ct方法计算HMGN5 mRNA相对表达量.
1.2.6 细胞增殖的测定: 将用5-FU处理转染后的细胞接种于96孔板后, 分别用CCK-8法和EdU法检测细胞的增殖情况. CCK-8法: 待细胞贴壁(6 h)后, 加入CCK-8试剂(检测方法同"1.2.3")检测450 nm波长测定OD值, 细胞活性 = 处理组OD值/对照组OD值×100%. EdU法: 待细胞贴壁(6 h)后, 加入EdU试剂(50 μmol/L)孵育2 h, 随后固定细胞并透化, 用Click反应液(Click 标记594荧光染料)标记增殖细胞, DAPI复染细胞核. 荧光显微镜40×视野下观察, 随机选取5个视野计数EdU阳性细胞比例.
1.2.7 细胞凋亡流式分析: 转染后的细胞经5-FU处理24 h后, 按试剂盒方法, 分别用Annexin V-FITC/PI双染试剂标记细胞, 避光孵育15 min后通过流式细胞仪检测. 采用FlowJo软件分析细胞凋亡亚型, 并统计细胞凋亡率.
1.2.8 Western Blot分析: 转染后的细胞经5-FU处理24 h后, 用RIPA裂解细胞, 提取总蛋白. BCA法测定蛋白浓度. 蛋白样品经10% SDS-PAGE分离后, 采用湿转法转移至甲醇预活化的PVDF膜, 5%脱脂奶粉封闭1 h, 随后加入一抗(抗HMGN5、抗MST1、抗LATS1、抗YAP1、抗PARP抗体、抗caspase 9和抗caspase 3, 稀释比均1:3000; 抗p-MST1、抗p-LATS1、抗Cleaved caspase 9、抗Cleaved caspase 3和抗Cleaved PARP, 稀释比均1:1000; 抗-GAPDH, 1:8000)4 ℃孵育过夜. 洗涤后, 用HRP标记的羊抗兔(稀释比1:2000)37 ℃孵育1 h后, 用ECL化学发光试剂显像, 以GAPDH为内参蛋白, Image J软件对蛋白表达进行半定量分析.
1.2.9 免疫荧光定位分析: 将用5-FU处理转染后的细胞接种于无菌盖玻片, 4%多聚甲醛固定15 min后, 0.1% Triton X-100透化5 min. 用5%山羊血清封闭30 min, 加入抗-YAP1一抗(1:1000稀释), 4 ℃孵育过夜. 次日用Cy3标记的羊抗兔IgG二抗(1:500稀释)37 ℃孵育1 h, DAPI复染后封片. 荧光显微镜400×镜下采集图像, 分析蛋白亚细胞定位.
统计学处理 实验数据以均数±标准差(mean±SD)表示. 两组间比较采用独立样本t检验, 多组间均数的多重比较采用单因素方差分析的事后Tukey法, P<0.05为差异具有统计学意义.
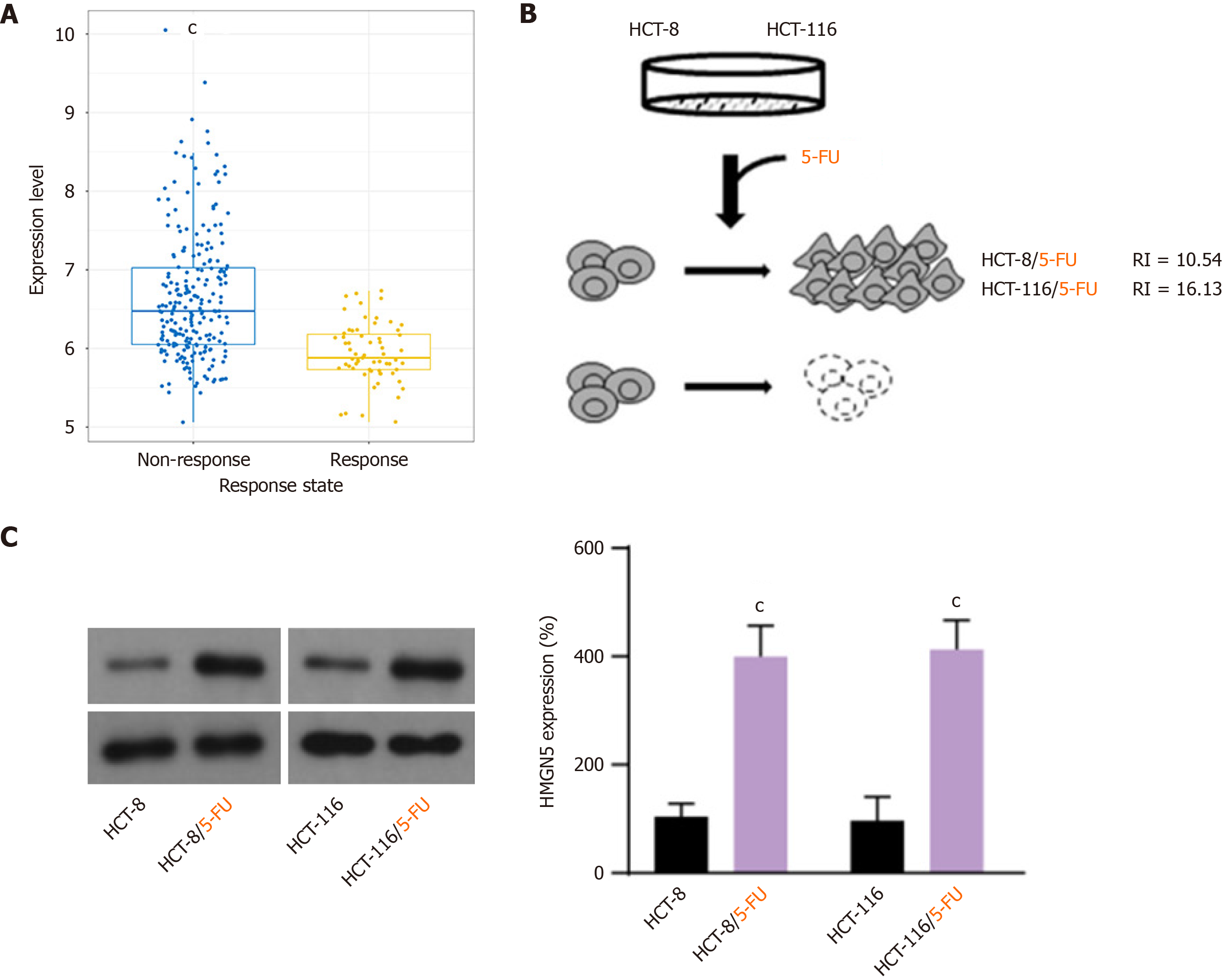
CTR-DB数据库检索结果(图1A)表明, 与含5-FU的化疗响应组相比, CRC组织中HMGN5的表达在不响应组显著上调(P<0.001). 为探究HMGN5在CRC获得性5-FU耐药中的作用, 本研究构建5-FU耐药CRC细胞系(HCT-8/5-FU和HCT-116/5-FU), CCK-8法验证显示, 耐药细胞对5-FU的IC50值显著高于亲本细胞, HCT-8/5-FU的RI = 10.54; HCT-116/5-FU的RI = 16.13, 见图1B; 依据Snow标准(RI>3判定耐药), 确认耐药细胞系构建成功. Western blot分析表明, 与亲本细胞系相比, 耐药细胞系中HMGN5蛋白表达水平显著上调(P<0.001; 图1C), 提示HMGN5可能参与5-FU耐药机制.
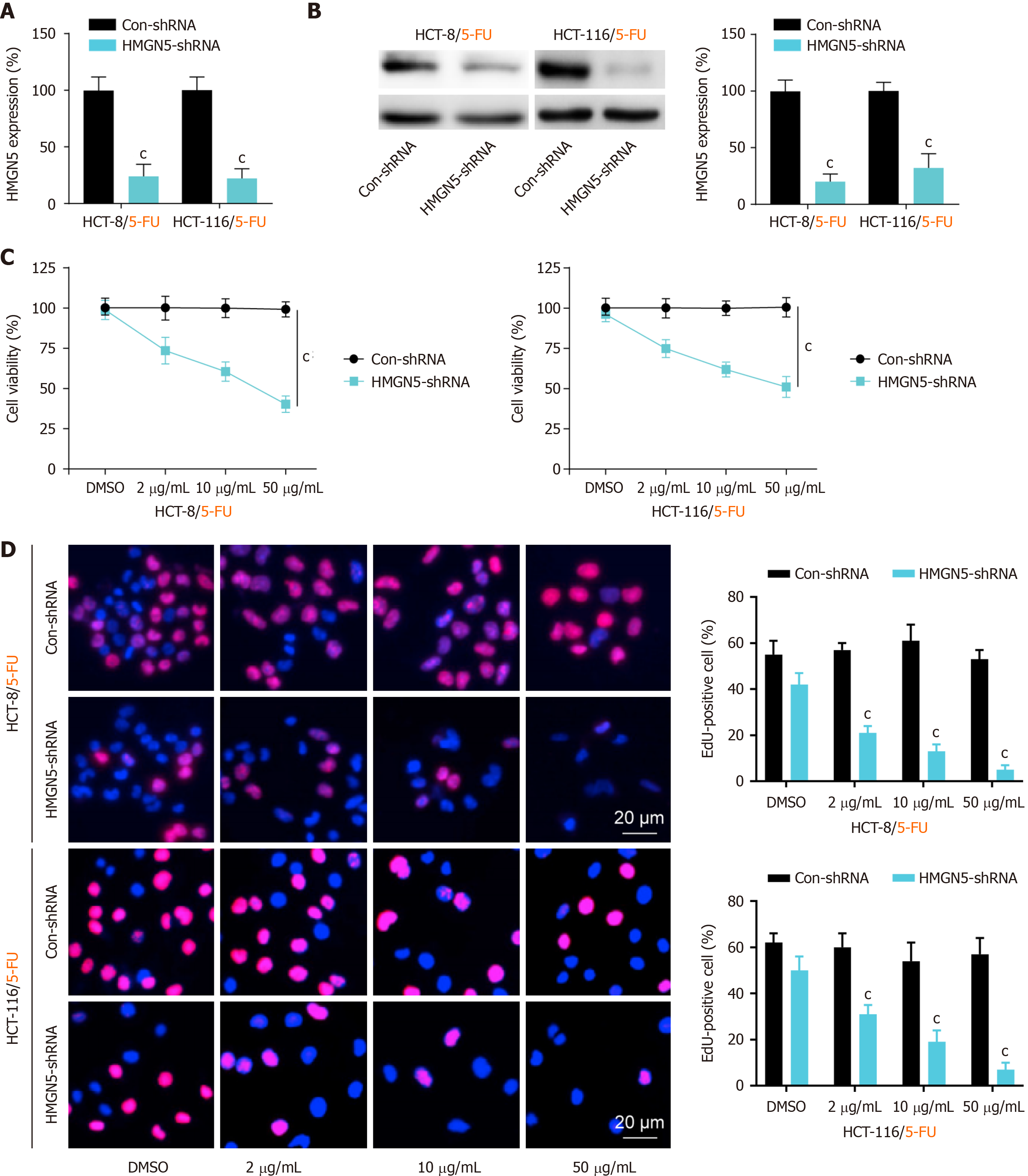
分别将Con-shRNA和HMGN5-shRNA转入5-FU耐药CRC细胞系(HCT-8/5-FU与HCT-116/5-FU)细胞, 通过mRNA和蛋白表达水平进行了验证, 与Con-shRNA组比较, HMGN5-shRNA组HMGN5的mRNA和蛋白表达水平均显著降低(P<0.001; 图2A和B), 提示成功构建了HMGN5敲低细胞系构建成功. 通过CCK-8实验和EdU染色实验在5-FU剂量依赖性条件下验证了敲低HMGN5对细胞增殖的抑制作用(图2C和D).
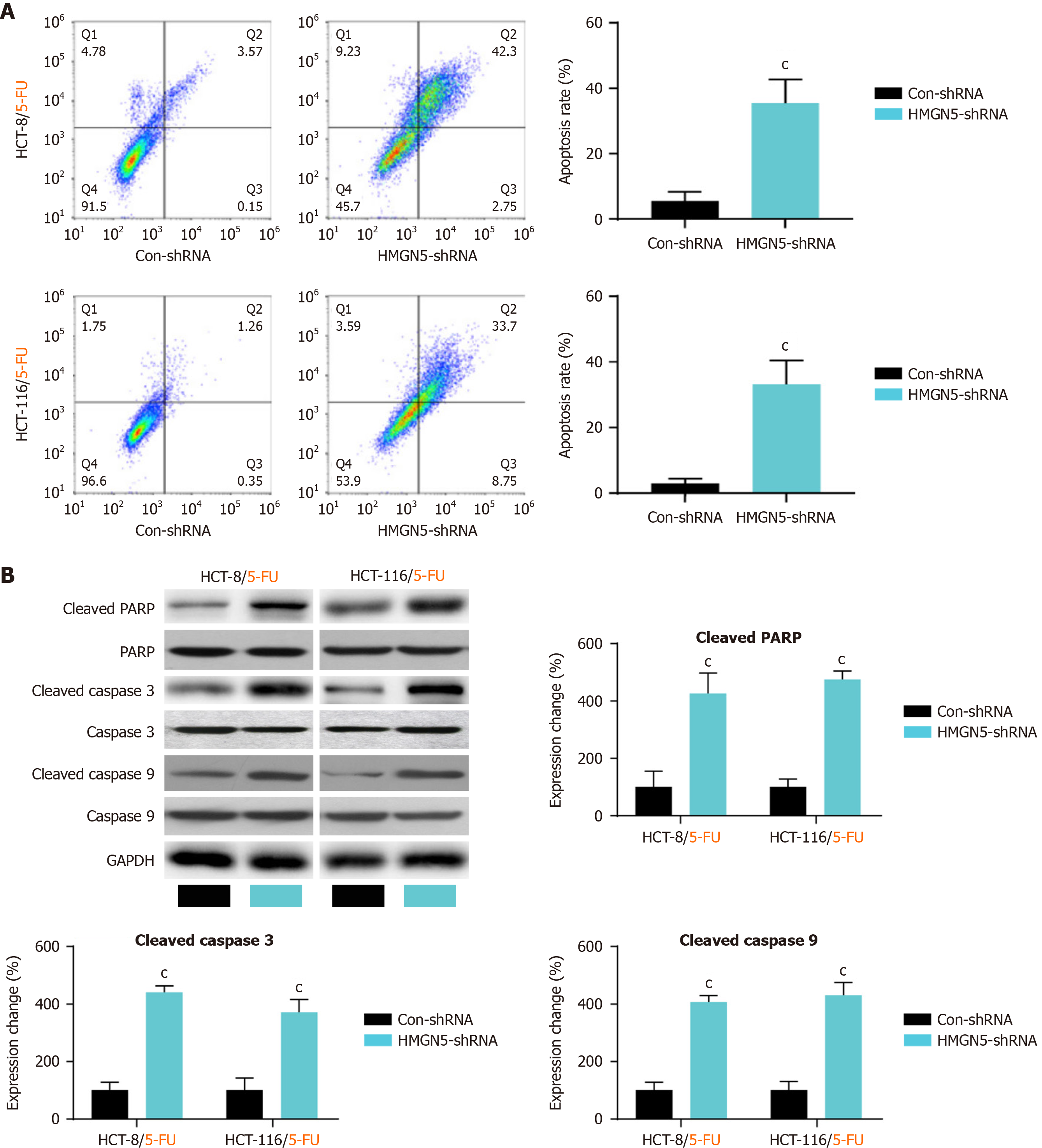
流式细胞术结果显示, HMGN5敲低显著增强了CRC耐药细胞系对5-FU治疗的凋亡敏感性(P<0.001; 图3A). Western blot检测表明, 在5-FU处理下, HMGN5敲低的5-FU耐药CRC细胞中凋亡标志物Cleaved-caspase 3、Cleaved-caspase 9和Cleaved-PARP的表达较Con-shRNA组显著上调(均P<0.001; 图3B). 上述结果提示, HMGN5下调可有效增强5-FU诱导的细胞凋亡效应.
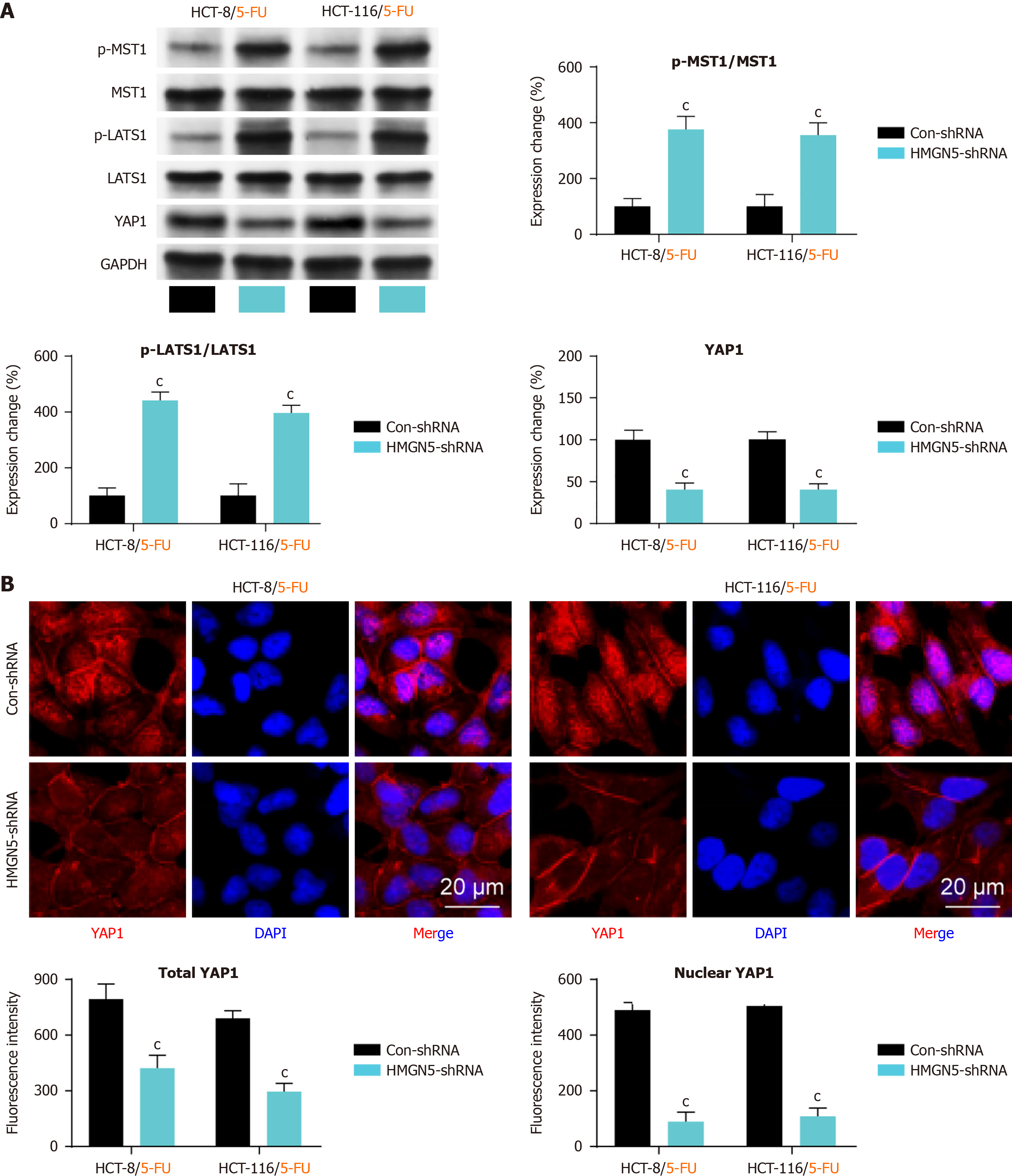
为探讨5-FU耐药CRC细胞中HMGN5的下游调控机制, 我们验证了Hippo-YAP1信号通路是否为其潜在靶通路. 通过Western blot检测Hippo-YAP1信号通路关键蛋白的表达水平, 结果显示(图4A), HMGN5敲低显著增强了p-MST1和p-LATS1蛋白的表达, 同时显著降低了YAP1蛋白的表达(均P<0.001; 图4A). 免疫荧光检测进一步证实, HMGN5敲低不仅抑制了YAP1蛋白的表达, 还阻断了YAP1的核转位(图4B). 上述结果表明, HMGN5敲低可激活Hippo-YAP1信号通路.
CRC化疗耐药性是临床治疗的关键挑战. 作为一线化疗药物, 5-FU的耐药机制主要涉及肿瘤细胞通过多重分子机制逃逸药物杀伤. 本研究发现, 在含5-FU化疗不响应的患者CRC组织以及5-FU耐药的CRC细胞系中HMGN5呈现显著高表达特征, 提示其不仅是耐药性生物标志物, 更可能是驱动耐药形成的关键调控因子. 通过系统性的功能实验, 我们证实HMGN5敲低可显著逆转CRC细胞对5-FU的耐药表型, 为靶向HMGN5的精准治疗策略提供了理论支撑.
现有研究表明[8-10], HMGN5在乳腺癌、膀胱癌及胶质瘤等多种恶性肿瘤中异常高表达, 但其在CRC中的生物学功能尚未明确. 本研究揭示HMGN5过表达与CRC细胞5-FU耐药性存在显著关联. 作为HMG家族的成员, HMGN5可能通过以下三重分子机制CRC细胞的5-FU耐药性: (1)通过与核小体相互作用, 改变染色质空间构象, 抑制DNA损伤修复相关基因(BRCA1、RAD51等)的转录, 从而增强细胞对5-FU诱导DNA损伤的耐受性[11,12]; (2)通过招募组蛋白去乙酰化酶和甲基化酶等表观修饰因子, 调控PI3K-AKT信号通路关键基因(如PTEN)的表达, 形成多维度耐药网络[13]; (3)通过拮抗Hippo-YAP1信号通路维持YAP1的核转位及促癌功能[14-16]. 本实验数据显示, 敲低HMGN5可显著激活Hippo通路核心激酶MST1和LATS1的磷酸化, 同时抑制YAP1表达及其核转位. 这一结果提示了敲低HMGN5消除CRC细胞对5-FU的耐药性的作用机制在一定程度上与此有关.
此外, 在凋亡调控层面, 本研究证实HMGN5敲低可显著增强5-FU诱导的caspase依赖性凋亡, 具体表现为cleaved-caspase 3、cleaved-caspase 9及cleaved-PARP等凋亡标志物的表达上调. 这一结果直接反映了HMGN5敲低能够提升CRC细胞对5-FU的敏感性. 该发现与HMGN5在肿瘤中普遍表现出的抗凋亡功能特性一致, 但其具体的特异性作用靶点仍需进一步深入解析.
综上, 本研究阐明了HMGN5在CRC的5-FU耐药性中的作用并初步揭示了敲低HMGN5恢复5-FU耐药CRC细胞的5-FU敏感性的机制可能与其增强5-FU诱导的细胞凋亡以及增强Hippo-YAP1信号通路活性有关. 这一发现为基于HMGN5靶向治疗的新型策略提供了重要的理论依据. 此外, 针对HMGN5的小分子抑制剂可能成为逆转CRC中5-FU耐药的有效工具, 但其临床转化潜力仍需通过动物实验及其他体内研究进一步验证.
5-氟尿嘧啶(5-Fluorouracil, 5-FU)是结直肠癌(colorectal cancer, CRC)的重要化疗药物, 但其耐药性导致治疗失败和肿瘤复发. 研究5-FU耐药的分子机制对改善治疗效果具有重要意义.
高迁移率族蛋白N5(high mobility group ncleosomal binding domain 5, HMGN5)在多种肿瘤中发挥重要作用, 但其在CRC及5-FU耐药性中的作用尚不清楚. 本研究聚焦HMGN5对CRC细胞5-FU耐药性的调控作用及机制.
本研究的主要目标是阐明HMGN5在CRC细胞5-FU耐药性中的调控机制, 并为逆转化疗耐药提供潜在的干预靶点.
通过CTR-DB数据库分析CRC患者肿瘤组织中HMGN5的表达差异, 构建5-FU耐药细胞模型, 并利用Western blot、CCK-8实验、流式细胞术等方法评估HMGN5的表达及其对细胞增殖和凋亡的影响.
研究发现, HMGN5在5-FU耐药细胞中显著上调, 敲低HMGN5可增强耐药细胞对5-FU的敏感性, 并激活Hippo-YAP1信号通路, 促进细胞凋亡.
HMGN5的敲低能够部分恢复5-FU耐药CRC细胞的敏感性, 其机制可能与增强5-FU诱导的凋亡及激活Hippo-YAP1信号通路有关, 为靶向HMGN5的治疗策略提供了理论依据.
未来的研究应关注HMGN5的小分子抑制剂在逆转CRC中5-FU耐药的临床应用潜力, 并通过动物实验验证其有效性.
| 1. | Patel SG, Dominitz JA. Screening for Colorectal Cancer. Ann Intern Med. 2024;177:ITC49-ITC64. [PubMed] [DOI] |
| 2. | Singh U, Kokkanti RR, Patnaik S. Beyond chemotherapy: Exploring 5-FU resistance and stemness in colorectal cancer. Eur J Pharmacol. 2025;991:177294. [PubMed] [DOI] |
| 3. | Qin J, Hu S, Lou J, Xu M, Gao R, Xiao Q, Chen Y, Ding M, Pan Y, Wang S. Selumetinib overcomes ITGA2-induced 5-fluorouracil resistance in colorectal cancer. Int Immunopharmacol. 2024;137:112487. [PubMed] [DOI] |
| 4. | Rapoport BL, Steel HC, Theron AJ, Heyman L, Smit T, Ramdas Y, Anderson R. High Mobility Group Box 1 in Human Cancer. Cells. 2020;9:1664. [PubMed] [DOI] |
| 5. | He B, Kram V, Furusawa T, Duverger O, Chu EY, Nanduri R, Ishikawa M, Zhang P, Amendt BA, Lee JS, Bustin M. Epigenetic Regulation of Ameloblast Differentiation by HMGN Proteins. J Dent Res. 2024;103:51-61. [PubMed] [DOI] |
| 6. | Shi Z, Tang R, Wu D, Sun X. Research advances in HMGN5 and cancer. Tumour Biol. 2016;37:1531-1539. [PubMed] [DOI] |
| 7. | Guo Z, Zhang X, Li X, Xie F, Su B, Zhang M, Zhou L. Expression of oncogenic HMGN5 increases the sensitivity of prostate cancer cells to gemcitabine. Oncol Rep. 2015;33:1519-1525. [PubMed] [DOI] |
| 8. | Mou J, Huang M, Wang F, Xu X, Xie H, Lu H, Li M, Li Y, Kong W, Chen J, Xiao Y, Chen Y, Wang C, Ren J. HMGN5 Escorts Oncogenic STAT3 Signaling by Regulating the Chromatin Landscape in Breast Cancer Tumorigenesis. Mol Cancer Res. 2022;20:1724-1738. [PubMed] [DOI] |
| 9. | Yao K, He L, Gan Y, Liu J, Tang J, Long Z, Tan J. HMGN5 promotes IL-6-induced epithelial-mesenchymal transition of bladder cancer by interacting with Hsp27. Aging (Albany NY). 2020;12:7282-7298. [PubMed] [DOI] |
| 10. | Ma Q, Wang X, Wang H, Song W, Wang Q, Wang J. HMGN5 Silencing Suppresses Cell Biological Progression via AKT/MAPK Pathway in Human Glioblastoma Cells. Biomed Res Int. 2020;2020:8610271. [PubMed] [DOI] |
| 11. | Moretti F, Rolando C, Winker M, Ivanek R, Rodriguez J, Von Kriegsheim A, Taylor V, Bustin M, Pertz O. Growth Cone Localization of the mRNA Encoding the Chromatin Regulator HMGN5 Modulates Neurite Outgrowth. Mol Cell Biol. 2015;35:2035-2050. [PubMed] [DOI] |
| 12. | Kitayama S, Ikeda K, Sato W, Takeshita H, Kawakami S, Inoue S, Horie K. Testis-expressed gene 11 inhibits cisplatin-induced DNA damage and contributes to chemoresistance in testicular germ cell tumor. Sci Rep. 2022;12:18423. [PubMed] [DOI] |
| 13. | Gan Y, He L, Yao K, Tan J, Zeng Q, Dai Y, Liu J, Tang Y. Knockdown of HMGN5 increases the chemosensitivity of human urothelial bladder cancer cells to cisplatin by targeting PI3K/Akt signaling. Oncol Lett. 2017;14:6463-6470. [PubMed] [DOI] |
| 14. | Peng L, Zhou L, Li H, Zhang X, Li S, Wang K, Yang M, Ma X, Zhang D, Xiang S, Duan Y, Wang T, Sun C, Wang C, Lu D, Qian M, Wang Z. Hippo-signaling-controlled MHC class I antigen processing and presentation pathway potentiates antitumor immunity. Cell Rep. 2024;43:114003. [PubMed] [DOI] |
| 15. | Ma S, Meng Z, Chen R, Guan KL. The Hippo Pathway: Biology and Pathophysiology. Annu Rev Biochem. 2019;88:577-604. [PubMed] [DOI] |
| 16. | Zanconato F, Cordenonsi M, Piccolo S. YAP/TAZ at the Roots of Cancer. Cancer Cell. 2016;29:783-803. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 刘继红 制作编辑:郑晓梅