修回日期: 2025-06-06
接受日期: 2025-07-01
在线出版日期: 2025-07-28
免疫检查点抑制剂相关性肺炎(checkpoint inhibitor-related pneumonitis, CIP)是恶性肿瘤治疗过程中使用免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)后出现的一种急性非特异性的间质性肺炎, 严重影响了患者的预后. 中晚期肝细胞癌患者使用ICIs后出现的CIP早期难以诊断, 有潜在致命风险, 如何做好肝癌免疫治疗后发生CIP的临床管理是近年来的关注重点之一. 因此, 本文从CIP的发生机制、流行病学、诊断与鉴别诊断及治疗作一阐述, 以帮助临床医生快速识别和治疗CIP从而改善患者预后.
核心提要: 本文重点介绍了肝细胞癌患者发生免疫检查点抑制剂相关肺炎(checkpoint inhibitor-related pneumonitis, CIP)的机制、流行病学、诊断与鉴别诊断及治疗, 分析了CIP临床管理面临的困境和未来研究方向与管理思维的转变, 为CIP的诊治提供了参考.
引文著录: 邓楷飞, 张靓, 李乐, 费书珂. 肝细胞癌免疫检查点抑制剂相关性肺炎的机制与治疗进展. 世界华人消化杂志 2025; 33(7): 513-521
Revised: June 6, 2025
Accepted: July 1, 2025
Published online: July 28, 2025
Checkpoint inhibitor (ICI)-related pneumonitis (CIP) is a form of acute, nonspecific interstitial pneumonia that occurs following the use of ICIs in cancer treatment, significantly impacting patient prognosis. In advanced-stage hepatocellular carcinoma patients treated with ICIs, CIP is a challenge to diagnose early and carries potentially life-threatening risks. Effective clinical management of CIP in this population has become a major focus of recent research. Therefore, this article provides a comprehensive overview of the pathogenesis, epidemiology, diagnosis, and differential diagnosis, as well as treatment strategies for CIP in patients with hepatocellular carcinoma, aiming to assist clinicians in its timely identification and effective management to improve patient outcomes.
- Citation: Deng KF, Zhang L, Li L, Fei SK. Mechanisms and therapy of checkpoint inhibitor-related pneumonitis in patients with hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2025; 33(7): 513-521
- URL: https://www.wjgnet.com/1009-3079/full/v33/i7/513.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i7.513
肝细胞癌(hepatocellular carcinoma, HCC)是我国发病率与死亡率皆居前5位的恶性肿瘤[1], 早期HCC可采取手术切除或射频消融等治疗方式, 然而大部分患者确诊时已处于中晚期, 甚至没有手术机会. 这些患者通常需要药物治疗以寻求手术机会或控制疾病进展, 近年来以免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)为代表的免疫治疗在不可切除的中晚期HCC或术后辅助治疗中取得广泛应用, ICIs包括细胞毒性T淋巴细胞抗原4(cytotoxic T lymphocyte associated antigen-4, CTLA-4)抑制剂、程序性死亡受体1(programmed death-1, PD-1)抑制剂和程序性死亡配体1(programmed death ligand-1, PD-L1)抑制剂[1]. 但ICIs在激活免疫系统杀灭癌细胞的同时还会诱发免疫相关不良事件(immune-related adverse events, irAEs), 其中免疫检查点抑制剂相关肺炎(checkpoint inhibitor-related pneumonitis, CIP)是一种发病率低(约3%-7%), 导致免疫治疗中断并且严重威胁患者生命安全的irAEs[2,3]. 由于CIP临床表现及影像学缺乏特异性, 临床中难以早期明确诊断, 严重影响患者的预后, 因此本文就CIP的发生机制、流行病学、临床特点及治疗进行总结, 以期快速识别和治疗从而改善患者预后及生活质量.
CIP是指接受ICIs治疗的患者出现以新发呼吸困难、持续性咳嗽及活动性气促为主的临床表现, 伴随胸部影像学显示新发的肺部浸润性病变(磨玻璃影、实变影或网格影), 且排除肿瘤肺转移、感染性肺炎及其他非免疫性肺损伤[4-6]. CIP发生机制目前尚不明确, 可能涉及ICIs过度激活免疫系统导致的肺组织免疫损伤, 其具体发生如下.
ICIs通过阻断PD-1/PD-L1和/或CTLA-4通路, 增强T细胞的活化与增殖, 使其能够有效识别并杀伤肿瘤细胞, 但T细胞会因为脱靶效应而过度活化. 研究显示, CIP患者的支气管肺泡灌洗液中富集CD4+T和CD8+T淋巴细胞, 且CTLA-4和PD-1表达降低[7-9]. CD4+T细胞亚群中的1型辅助T细胞(T-helper 1 cell, Th1)、Th17明显增加, 一方面释放粒细胞-巨噬细胞集落刺激因子, 使促炎性M1型单核细胞分化增加并释放白细胞介素(Interleukin, IL)-6、IL-12等细胞因子促进幼稚CD4+T细胞分化为Th1和Th17; 另一方面释放干扰素-γ(interferon-γ, IFN-γ)、IL-17A等促炎因子, 加剧Th1和Th17免疫应答引起的肺损伤[7,10]. CD4+T细胞亚群中调节性T细胞(regulatory T cell, Treg)和Th2明显减少, 可能是ICIs介导Treg耗竭或者促炎性单核细胞抑制Treg和Th2的分化[7,11,12], 减弱对T细胞的抑制作用, 加之Th1释放的IL-2, 诱导细胞毒性T细胞的异常活化和增殖, 发挥细胞毒作用[11]. 总的来说, ICIs引起的T细胞亚群紊乱及免疫失衡可能是CIP发生的关键原因[13].
因Treg耗竭及肺组织生理性表达的PD-L1被抑制等免疫耐受机制的减弱或破坏[7], 抗原呈递细胞通过交叉反应与肿瘤细胞所表达或模拟的正常肺组织抗原结合[14-16], 并将抗原提呈给T细胞使之活化. 这一过程中T细胞不仅攻击肿瘤细胞, 还可能错误地识别交叉抗原并攻击正常肺组织, 导致T细胞在肺组织内异常聚集并产生免疫毒性作用, 进而发生CIP[10,16,17].
在HCC及其他肿瘤患者接受ICIs治疗等多项研究中, CIP患者的支气管肺泡灌洗液中肺泡巨噬细胞高度活化[18], 树突状细胞及M1型巨噬细胞明显增加[7,19]. 此外在CIP患者的肺组织活检和灌洗液中也发现了中性粒细胞增多[20], 发生机制可能是分化的Th1分泌大量IFN-γ激活树突状细胞并趋化巨噬细胞至炎症部位, 释放大量肿瘤坏死因子α(tumor necrosis factor, TNF-α)、IL-6、IL-1β等促炎细胞因子, IL-6还可以刺激Th17分化; 而Treg耗竭会使IL-10等抗炎因子明显减少[7], 这些先天免疫及炎症细胞和T细胞互相干扰与调节, 形成了复杂的串扰机制. 在这个过程中, 大量免疫、炎症细胞在肺部聚集并释放TNF-α、IFN-γ、IL-6、IL-17A、IL-35等促炎因子造成细胞因子失衡导致肺组织损伤, 从而引起 CIP[15,21]. 诊断为CIP的患者血清及肺泡灌洗液中CRP、IL-6、IL-17A、IL-35水平明显升高, 将患者CIP病情控制后, 促炎因子均有下降, 这些数据有力地佐证了炎性细胞因子在发病过程中的作用[22].
基础研究表明, CTLA-4抑制剂与垂体中生理性表达的CTLA-4结合后, 可触发补体系统活化进而募集炎性白细胞浸润并形成膜攻击复合物直接损伤垂体细胞, 最终导致垂体炎[16,22,23]. 值得注意的是, 肺组织内同样存在CTLA-4的组成性表达, 提示补体介导的损伤通路可能参与CIP的发生[15].
综上所述, 目前我们认为CIP的核心发病机制源于ICIs打破肺组织免疫稳态, 导致T细胞亚群紊乱、交叉抗原识别及先天免疫系统过度激活的级联反应. 这些机制相互串扰从而形成"免疫失衡-炎症放大-组织损伤"的恶性循环, 最终导致CIP. 但现有研究仍存在局限性, 如缺乏基础机制研究, 其中多数研究聚焦单一通路且缺乏对多机制协同作用的解析与联系. 未来我们希望通过构建类器官与人工智能模型模拟CIP发生过程, 借助单细胞测序与蛋白组学等技术解析肺组织内T细胞等免疫细胞和炎症细胞之间复杂的机制网, 为CIP的临床诊断及治疗提供指导.
CIP的危险因素可能包括高龄、吸烟史、联合其他治疗(如双免疫治疗、联合化疗等)、合并肺部基础疾病(如间质性肺疾病、慢性阻塞性肺疾病等)及自身免疫性疾病等[2,15,24-31]. 临床实验显示CIP的总发生率为3%-7%、重度(≥3级)CIP的发生率为0.8%-2.0%[2,15,32], 而现实世界中CIP的总发生率可能升至13%-19%[33-35]. 现有证据显示CIP在ICIs相关死亡事件中占17%-28%[36,37], PD-1抑制剂单药治疗的CIP总发生率(3.6%)及重度CIP发生率(1.1%)均显著高于PD-L1抑制剂单药治疗(1%; 0.4%)[37-40]; CTLA-4抑制剂单药治疗(如伊匹木单抗)的CIP发生率(<1%)显著低于PD-1/PD-L1抑制剂(3%-5%). 研究显示双免疫(如纳武利尤单抗+伊匹木单抗)、免疫联合化疗等联合治疗可使CIP发生风险显著提升[2,32,40-42], 免疫联合靶向治疗(如阿替利珠单抗+贝伐珠单抗)总体安全性可接受, CIP等irAEs的发生率未显著增加[43,44]. 肝细胞癌不同ICIs方案治疗后CIP总发生率及重度CIP发生率不一致(见表1). CIP的中位发病时间为ICIs治疗后2-3 mo, 发病时间从首次给药后数小时至24 mo, 且部分病例发生于ICI治疗终止后[35,45,46]. 重度CIP一般发生于启动治疗后3-6 mo[15,39], 双免疫治疗可显著提前CIP发病时间[41,47].
CIP的症状主要包括咳嗽、呼吸困难、发热、胸闷等, 胸痛则较少见, 约1/3的CIP患者发病时无明显症状[46,48], 可发展为急性呼吸窘迫综合征、呼吸衰竭[49], 体征可有口唇发绀、呼吸加快、呼吸音减弱等, 双肺可闻及湿啰音或velcro啰音. 胸部CT是首选的影像学检查, 多见磨玻璃影或斑片实变浸润影, 两肺下叶常见, 其次为中叶, 上叶最少见[2,4,50]. CIP最常见的影像学表现是非特异性间质性肺炎, 还可表现为机化性肺炎、过敏性肺炎、弥漫性肺泡损伤综合征(diffuse alveolar damage syndrome, DADs)等[4,48,51-53]. 完善支气管肺泡灌洗或支气管镜检查下的细胞学和病原学检查, 可用于排除肺部感染和肝癌进展. 目前CIP并无特异性的病理表现或诊断, 其最常见的病理学改变是间质性肺炎、机化性肺炎和弥漫性肺泡损伤, 若影像学特点比较符合CIP表现时, 不建议行活检[2,4,7,40].
因CIP临床表现及影像学表现均缺乏特异性, 应使用排除性诊断. 诊断要点: (1)ICIs用药史; (2)胸部CT新出现的肺部阴影(如磨玻璃影、斑片实变影、小叶间隔增厚、网格影、牵拉性支气管扩张等); (3)除外肺部感染、肝癌肺转移、其他原因引起的肺间质性疾病、肺水肿等[4,48,54]. 同时符合以上3条可诊断为CIP[4,15].
(1)感染性肺炎: 通常包括细菌、病毒和真菌等感染. 常见高热、咳嗽、咳痰等症状. 病原学检查(如痰培养、血培养、病毒核酸检测或GM试验等)、胸部CT及经验性使用抗生素有助于鉴别. 需注意的是两者可合并存在, 尤其是在CIP激素治疗期间因免疫抑制继发肺内机会性感染, CIP继发机会性感染是难治性肺炎、呼吸衰竭甚至死亡的重要原因之一[54]; (2)肝癌肺转移: 患者可能出现肝脏原发病灶进展或其他部位的转移, 可有新发咳嗽、胸闷、呼吸困难等症状, 胸部CT可见肺野散在多发圆形结节, 甲胎蛋白、异常凝血酶原等肿瘤标志物较前升高, 可完善PET-CT明确肝外转移情况, 肺部穿刺活检可明确诊断; 若患者使用ICIs后仍出现肺部转移, 需重新评估患者病情并调整治疗方案; (3)放射性肺炎: 常有明确的放疗史且肺部炎症多与放射野相对应, 伴或不伴呼吸道症状, 症状可包括咳嗽、呼吸困难、低热、气短、乏力等. 影像学多表现为放射野出现的斑片、实变或纤维条索影, 需要更长时间的激素治疗[4]. 放疗联合ICIs治疗后出现的肺炎难以截然区分为CIP或放射性肺炎, 需要临床综合评估[4]. 此外, 如癌性淋巴管炎、肺栓塞、心源性肺水肿(如高心病、免疫相关心肌炎等)等疾病均需与CIP鉴别[4,48].
综上所述, 目前早期识别并诊断CIP的关键是排他性诊断. 在意识到患者可能并发CIP后, 应完善血常规、CRP、PCT、血气分析、病原学检查及胸部CT, 应用气管镜活检肺泡灌洗等特殊检查, 结合患者肝癌病史及ICIs用药史进行鉴别, 其中快速排除肺部感染与肝癌转移是关键. 同时应启动MDT, 通过多学科协作提高诊断率及效率. CIP缺乏特异性指标, 过度依赖"排除法"可能导致延迟或难以诊断. 在此背景下, MDT价值凸显但仍受限于会诊人员对CIP的认识及诊疗水平不一致. 基于此, 影像科可建立AI影像模型综合分析与学习, 肿瘤科、呼吸科及肝胆外科等临床科室可进行临床研究与治疗从而积累诊疗经验, 最终建立肝癌免疫治疗毒性快速响应团队, 通过培训与学习实现快速主动地识别CIP.
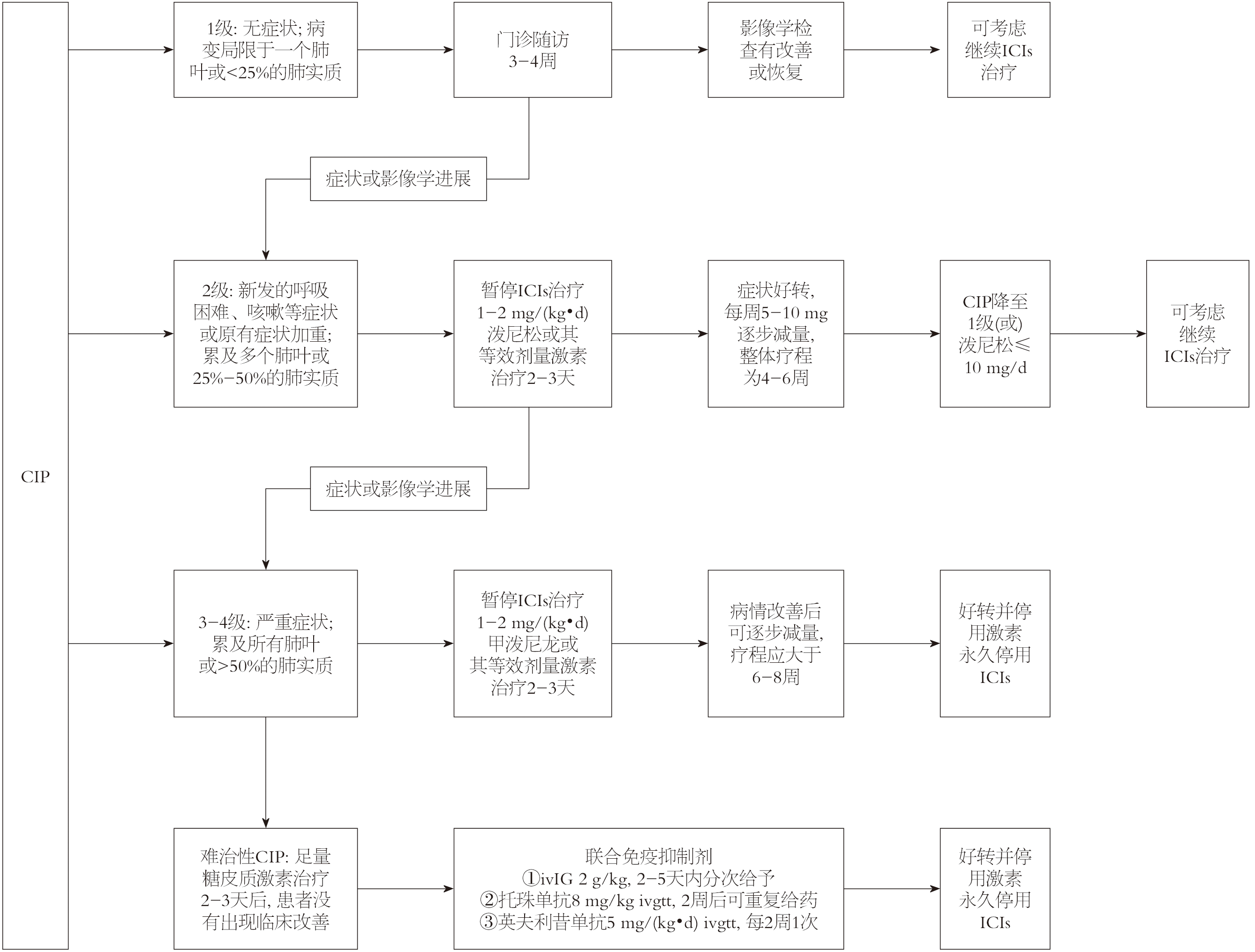
依据CSCO、ASCO、ESMO等国内外权威机构发布的临床指南可以将CIP的严重程度根据临床症状及影像学表现分为4级[3,40,48,55]. 1级: 无症状; 病变局限于一个肺叶或<25%的肺实质; 仅限临床或诊断观察. 2级: 新发的呼吸困难、咳嗽等症状或原有症状加重; 累及多个肺叶或25%-50%的肺实质; 需要医疗干预; 限制工具性日常活动. 3级: 严重症状; 累及所有肺叶或>50%的肺实质; 需要住院治疗; 自理能力受限; 需氧疗. 4级: 危及生命的呼吸功能损害, 需要气管插管等紧急干预.
当前, CIP的治疗策略主要基于CSCO、ASCO、ESMO等国内外权威机构发布的临床指南, 并无绝对的最佳的治疗方案, 应当根据收治医院的诊疗水平及患者的具体情况制定个体化方案. 停用ICIs并使用糖皮质激素(glucocorticoids, GCs)是主要的治疗方案.
4.2.1 治疗原则: 可以参考"早期识别、停用ICIs、分级干预、个体化方案"的治疗原则: 完善实验室及影像学检查, 同时启动MDT从而早期识别CIP; 患者出现1级CIP时, 可门诊随访观察, 2级CIP建议在治疗期间暂时停用ICIs, 3-4级患者则建议永久停用ICIs; 治疗要个体化, 如HBV/HCV携带者使用英夫利昔单抗可能激活肝炎病毒, 使用前后应监测病毒活动情况[2-4].
4.2.2 分级治疗: 1级: 门诊随访. 3-4 wk内影像学检查有改善或恢复, 考虑继续 ICIs 治疗; 若无改善或加重, 按更高级别CIP处理[3]. 2级: 暂停ICIs治疗, 住院治疗. 同时开始全身GCs治疗, 起始剂量为1-2 mg/(kg•d)泼尼松或其等效剂量激素, 若治疗2-3 d后患者病情改善则维持初始剂量至1-2 wk或CIP降至1级, 可按每周5-10 mg逐步减量[56,57](具体减少量和时间需依据病人肺炎严重程度和对治疗的反应调整), 减至每日口服10 mg的维持剂量, 整体疗程为4-6 wk; 若激素治疗2-3 d后患者病情无改善或加重, 按更高级别CIP处理[2,3,58].
症状持续的2级和3-4级: 考虑永久停用ICIs治疗. 使用1-2 mg/(kg•d)甲泼尼龙或其等效剂量激素, 2-3 d后病情改善后可逐步减量, 疗程应大于6-8 wk[3]. 若治疗2-3 d后病情无改善, 按难治性CIP处理[2].
难治性CIP也被称为激素不敏感型CIP, 是指足量GCs治疗2-3 d后患者没有出现临床改善[40,58,59]. 一项回顾性研究显示CIP患者中约18.5%为激素不敏感型[60]. 对于难治性CIP, 目前尚无统一的治疗方案. 根据CSCO等机构发布的指南[2,15,40], 可以考虑以下治疗方案: (1)静脉注射免疫球蛋白(ivIG): 尤其适用于感染不能完全除外的患者. 初次应用, 总剂量为2 g/kg, 2-5 d内分次给予, 可采用400-500 mg/kg ivgtt, 必要时可重复使用[15,48]; (2)IL-6抑制剂: 托珠单抗8 mg/kg ivgtt, 在2 wk后可重复给药[40]; (3)TNF-α抑制剂: 目前对类固醇抵抗毒性证据充分的免疫抑制剂[61]. 用法: 英夫利昔单抗5 mg/(kg•d) ivgtt, 每2 wk 1次[3,15,48]; (4)吗替麦考酚酯: 起效较慢, 但可辅助GCs的逐步减量; 用法: 0.5-1.0 g po, 每12 h 1次, 并根据症状减量[3,15]; (5)血浆置换: 可清除促炎细胞因子、致病性抗体以及ICIs, 可能延缓CIP进展, 但其在CIP中的应用尚未获得广泛认可[62,63]; (6)激素冲击治疗: 目前尚无指南或共识推荐激素冲击治疗用于CIP. 对于病情进展快的或重度CIP患者, 如能除外感染, 理论上可以考虑激素冲击治疗, 静脉甲泼尼龙500-1000 mg/d治疗3 d, 后减到1-2 mg/(kg•d)泼尼松[57,58,64]; (7)还可酌情选用其他免疫抑制剂, 如环磷酰胺等[3,40,48].
难治性CIP影像学表现最常见的是DADs, 常进展迅速, 导致呼吸衰竭且预后不佳. 常需要联合免疫抑制剂治疗, 这就要求我们明确免疫抑制剂治疗CIP的疗效与安全性[40,48]. 托珠单抗在大部分激素不敏感型CIP中表现出良好的临床疗效和可控的安全性[65,66]. 在一项回顾性研究中, 12例难治性CIP患者中7例接受ivIG, 2例接受英夫利西单抗, 3例接受ivIG联合英夫利西单抗; 其中, 接受英夫利西单抗的5例患者均死于难治性CIP或感染并发症, 而接受ivIG的患者共有6例死于CIP或感染并发症[60]. 另一项回顾性研究分析了26例难治性CIP患者中20例接受英夫利西单抗, 6例接受吗替麦考酚酯; 10例患者持续改善, 13例患者死于CIP或感染并发症[67]. 基于以上数据与临床经验, 笔者认为可考虑使用ivIG或托珠单抗治疗难治性CIP, 但建议多科室多中心联合进行回顾性或前瞻性研究, 以期获得更科学合理的数据支持的治疗方案.
4.4.1 经验性抗生素的使用: 在CIP的早期, 若不能完全排除感染, 建议加用经验性抗感染治疗[2]. 积极寻找病原学证据的同时, 可按社区获得性肺炎抗菌原则选用β-内酰胺类联合大环内酯类或喹诺酮类单药治疗, 有长期或反复住院病史者推荐覆盖耐甲氧西林金葡菌及革兰阴性菌( 如铜绿假单胞菌)[68]. 在除外感染、控制CIP的情况下, 应尽早停用广谱抗生素或进行抗生素降阶梯治疗.
4.4.2 糖皮质激素的使用: (1)使用超过20 mg/d泼尼松或等效剂量激素至少4 wk的患者应考虑预防卡氏肺孢子菌等真菌感染[2,48]; (2)当大剂量[泼尼松>1 mg/(kg•d)]或冲击剂量使用时, 可诱发金葡菌、真菌感染及结核扩散等致命性感染, 建议有相关感染证据及时加用抗菌药物[54]; (3)长期使用糖皮质激素, 应注意补充维生素D和钙剂预防骨质疏松, 加用胃黏膜保护剂或抑酸药预防消化性溃疡或出血[57,64]; (4)注意停药反应. 如连续使用泼尼松(20-30 mg/d)2 wk以上突然停药, 则可能出现肾上腺皮质功能不全的撤药反应, 应更加缓慢减量; 若患者病情反复, 需考虑重新将糖皮质激素加量[57,64].
4.4.3 其他免疫抑制剂的使用: 使用英夫利昔单抗可激活肝炎病毒或结核病, 一般来说使用前后应监测病毒复制水平或检测结核的活动性, 紧急情况下可先用药, 无需等待检测结果[48]. 免疫抑制剂可抑制免疫系统, 可增加对感染的易感性, 包括条件机会性感染, 致死感染和败血症等并发症, 视情况使用抗菌药物.
目前研究显示重启ICIs治疗后近50%患者会再次出现irAEs, 其中CIP复发率为25%左右[4,40], 所以重启ICIs治疗需谨慎. 当前对重启ICIs治疗尚无定论, 笔者总结以下原则以供参考:
4.5.1 重启前评估: (1)因ICIs主要用于不可切除的中晚期肝癌患者, 对于部分患者而言, ICIs能控制疾病的进展, 延长他们的生存时间, 重启前应充分评估当前肿瘤应答状态[1]. 初始ICIs治疗后肝癌进展, 不考虑重启治疗; 若已取得完全缓解, 建议观察; 部分缓解、疾病稳定或尚无应答者, 控制CIP后应尽快重启[40,58]; (2)评估CIP复发风险, 如CIP严重程度、CIP激素敏感性等; 患者全身情况, 包括目前日常活动状态、肺功能受损程度及对再发CIP的耐受性等[2,58]. 对于肺功能受损严重、激素治疗不敏感或部分敏感的患者, 不建议重启治疗. 再次发生的CIP, 建议永久停用ICIs[40,58].
4.5.2 重启时机选择: 1级CIP如显示肺部影像学改善, 可重启治疗. 2级CIP降至1级时即可考虑重启治疗, 此前提下部分患者尚在减量或不能完全停用激素, 只要泼尼松≤10 mg/d(或等效剂量)且同时没有使用其他免疫抑制剂, 可考虑重启. 出现严重或危及生命的肺炎即3-4级CIP, 不考虑重启治疗[40].
4.5.3 重启药物选择: 重启药物选择似有争议, 《肝癌免疫检查点抑制剂相关不良反应管理中国专家共识(2021版)》认为应选用初始ICIs进行重启治疗, CSCO认为重启治疗时应选择不同类型的ICIs治疗药物[2,40]. 双免疫治疗建议改用单药重启治疗[2].
综上, CIP诊疗流程见图1. 虽然当前CIP的分级治疗框架为临床实践提供了基本规范, 但仍有其局限性, 如难治性CIP有多种替代治疗但缺乏大规模的临床研究支持其疗效和安全性、重启ICIs有争议等. 未来通过多中心临床研究, 探索新的治疗靶点和药物组合, 制定个体化治疗方案并开展长期随访研究, 评估免疫抑制剂对ICIs治疗肝癌的疗效的影响及重启ICIs治疗的预后, 为临床决策提供更充分的依据.
CIP作为肝癌免疫治疗中威胁生命的并发症, 其发生机制复杂, 主要涉及T细胞亚群紊乱及免疫失衡等所引发的肺组织损伤. 不同类型的ICIs诱发的CIP发病率有所差别, 发病时间为一般治疗后2-3 mo, CIP的临床表现及影像学特征缺乏特异性, 需排除其他肺部疾病来诊断CIP. 常通过分级评估CIP严重程度指导治疗, 大部分CIP可通过停用ICIs并及时使用糖皮质激素得到缓解或治愈, 难治性CIP需加用免疫抑制剂. 重启ICIs治疗前应充分评估ICIs疗效、时机及药物等. 现有研究的局限性主要体现在重度和难治性CIP的管理困难、感染与免疫抑制的平衡、CIP复发与ICIs重启的争议、MDT协作的实践差距、精准管理体系的缺失等方面. 主要争议具体表现为难治性CIP的免疫抑制剂选择缺乏循证支持, 部分治疗可能加剧感染风险; NCCN指南推荐预防性抗感染, 但临床实践中抗生素滥用可能诱发耐药性, 且缺乏标准化方案; 重启后CIP复发率约25%, 但ICIs的生存获益可能驱动高风险决策, 需权衡疗效与安全性; MDT能否真正缩短诊断延迟或改善预后仍缺乏数据支持; 肺活检或灌洗液分析能否推广至临床常规应用仍存争议. 我们应深入解析CIP具体发生机制和开发CIP的特异性生物标志物, 筛选促炎因子(如IL-17A、IL-6)作为治疗靶点并验证治疗靶点和药物组合的临床疗效; 开展多中心前瞻性研究, 对比托珠单抗、ivIG、血浆置换等方案在激素耐药患者中的疗效与安全性; 开发AI-CT模型联合生物标志物(肺泡灌洗液中的T细胞亚群比例), 实现早期诊断与风险预测; 建立MDT团队, 定期培训及学术交流以提高团队的整体诊疗水平. 通过这些方法去促使CIP的管理思维从"被动排除"转向"主动识别". 未来研究应聚焦机制解析、靶向治疗开发及精准管理体系建设, 为提高肝癌免疫治疗安全性提供科学依据, 从而追求个体化精准治疗.
| 2. | 施 国明, 黄 晓勇, 任 正刚, 陈 漪, 程 蕾蕾, 杜 世锁, 方 艺, 葛 宁灵, 李 爱民, 李 苏, 李 晓牧, 卢 倩, 陆 品相, 孙 建方, 王 汉萍, 魏 来, 徐 立, 杨 国欢, 曾 昭冲, 张 岚, 张 力, 赵 海涛, 赵 灵, 赵 明, 周 爱萍, 刘 荣乐, 刘 新会, 伍 家鸣, 张 莹, 樊 嘉, 周 俭, 中华医学会肿瘤学分会肝癌学组. 肝癌免疫检查点抑制剂相关不良反应管理中国专家共识(2021版). 中华消化外科杂志. 2021;20:1241-1258. [DOI] |
| 3. | Schneider BJ, Naidoo J, Santomasso BD, Lacchetti C, Adkins S, Anadkat M, Atkins MB, Brassil KJ, Caterino JM, Chau I, Davies MJ, Ernstoff MS, Fecher L, Ghosh M, Jaiyesimi I, Mammen JS, Naing A, Nastoupil LJ, Phillips T, Porter LD, Reichner CA, Seigel C, Song JM, Spira A, Suarez-Almazor M, Swami U, Thompson JA, Vikas P, Wang Y, Weber JS, Funchain P, Bollin K. Management of Immune-Related Adverse Events in Patients Treated With Immune Checkpoint Inhibitor Therapy: ASCO Guideline Update. J Clin Oncol. 2021;39:4073-4126. [PubMed] [DOI] |
| 5. | Johkoh T, Lee KS, Nishino M, Travis WD, Ryu JH, Lee HY, Ryerson CJ, Franquet T, Bankier AA, Brown KK, Goo JM, Kauczor HU, Lynch DA, Nicholson AG, Richeldi L, Schaefer-Prokop CM, Verschakelen J, Raoof S, Rubin GD, Powell C, Inoue Y, Hatabu H. Chest CT Diagnosis and Clinical Management of Drug-Related Pneumonitis in Patients Receiving Molecular Targeting Agents and Immune Checkpoint Inhibitors: A Position Paper From the Fleischner Society. Chest. 2021;159:1107-1125. [PubMed] [DOI] |
| 6. | Sangro B, Chan SL, Meyer T, Reig M, El-Khoueiry A, Galle PR. Diagnosis and management of toxicities of immune checkpoint inhibitors in hepatocellular carcinoma. J Hepatol. 2020;72:320-341. [PubMed] [DOI] |
| 7. | Franken A, Van Mol P, Vanmassenhove S, Donders E, Schepers R, Van Brussel T, Dooms C, Yserbyt J, De Crem N, Testelmans D, De Wever W, Nackaerts K, Vansteenkiste J, Vos R, Humblet-Baron S, Lambrechts D, Wauters E. Single-cell transcriptomics identifies pathogenic T-helper 17.1 cells and pro-inflammatory monocytes in immune checkpoint inhibitor-related pneumonitis. J Immunother Cancer. 2022;10:e005323. [PubMed] [DOI] |
| 8. | Yanagihara T, Hata K, Matsubara K, Kunimura K, Suzuki K, Tsubouchi K, Ikegame S, Baba Y, Fukui Y, Okamoto I. Exploratory mass cytometry analysis reveals immunophenotypes of cancer treatment-related pneumonitis. eLife. 2024;12:RP87288. [DOI] |
| 9. | Chen R, Shi Y, Fang N, Shao C, Huang H, Pan R, Xu Y, Wang M, Liu X, Xu K, Zhu R, Wang M. Bronchoalveolar lavage fluid analysis in patients with checkpoint inhibitor pneumonitis. Cancer Immunol Immunother. 2024;73:235. [PubMed] [DOI] |
| 10. | Zhang Z, Zhang L, Wang K, Xie T, Zhang X, Yu W, Li Y, Shen L, Li R, Peng Z. Single-cell landscape of bronchoalveolar immune cells in patients with immune checkpoint inhibitor-related pneumonitis. NPJ Precis Oncol. 2024;8:226. [PubMed] [DOI] |
| 11. | Arce Vargas F, Furness AJS, Litchfield K, Joshi K, Rosenthal R, Ghorani E, Solomon I, Lesko MH, Ruef N, Roddie C, Henry JY, Spain L, Ben Aissa A, Georgiou A, Wong YNS, Smith M, Strauss D, Hayes A, Nicol D, O'Brien T, Mårtensson L, Ljungars A, Teige I, Frendéus B; TRACERx Melanoma; TRACERx Renal; TRACERx Lung consortia, Pule M, Marafioti T, Gore M, Larkin J, Turajlic S, Swanton C, Peggs KS, Quezada SA. Fc Effector Function Contributes to the Activity of Human Anti-CTLA-4 Antibodies. Cancer Cell. 2018;33:649-663.e4. [PubMed] [DOI] |
| 12. | Wang PM, Zhang ZW, Zhang S, Xing Q, Zhao ZY, Lin QH, Shen LH, Xia ZL, Li FF, Zhu B. Characterization of immunomodulatory factors and cells in bronchoalveolar lavage fluid for immune checkpoint inhibitor-related pneumonitis. J Cancer Res Clin Oncol. 2023;149:8019-8026. [PubMed] [DOI] |
| 13. | Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012;12:252-264. [PubMed] [DOI] |
| 14. | Okiyama N, Tanaka R. Immune-related adverse events in various organs caused by immune checkpoint inhibitors. Allergol Int. 2022;71:169-178. [PubMed] [DOI] |
| 15. | 《中国消化道肿瘤免疫治疗不良反应专家共识(2023年版)》编写组, 刘 天舒, 沈 琳, 余 一祎, 艾 罗燕, 丁 宁, 杜 世锁, 胡 洁, 林 瑾仪, 刘 青, 骆 肖群, 王 伟光, 吴 薇, 袁 源智, 张 宁萍, 章 晓燕, 赵 琳. 中国消化道肿瘤免疫治疗不良反应专家共识(2023年版). 肿瘤综合治疗电子杂志. 2023;9:26-60. |
| 16. | Postow MA, Sidlow R, Hellmann MD. Immune-Related Adverse Events Associated with Immune Checkpoint Blockade. N Engl J Med. 2018;378:158-168. [PubMed] [DOI] |
| 17. | Berner F, Flatz L. Autoimmunity in immune checkpoint inhibitor-induced immune-related adverse events: A focus on autoimmune skin toxicity and pneumonitis. Immunol Rev. 2023;318:37-50. [PubMed] [DOI] |
| 18. | Zhou G, Sprengers D, Boor PPC, Doukas M, Schutz H, Mancham S, Pedroza-Gonzalez A, Polak WG, de Jonge J, Gaspersz M, Dong H, Thielemans K, Pan Q, IJzermans JNM, Bruno MJ, Kwekkeboom J. Antibodies Against Immune Checkpoint Molecules Restore Functions of Tumor-Infiltrating T Cells in Hepatocellular Carcinomas. Gastroenterology. 2017;153:1107-1119.e10. [PubMed] [DOI] |
| 19. | Lin X, Deng J, Deng H, Yang Y, Sun N, Zhou M, Qin Y, Xie X, Li S, Zhong N, Song Y, Zhou C. Comprehensive Analysis of the Immune Microenvironment in Checkpoint Inhibitor Pneumonitis. Front Immunol. 2021;12:818492. [PubMed] [DOI] |
| 20. | Kowalski B, Valaperti A, Bezel P, Steiner UC, Scholtze D, Wieser S, Vonow-Eisenring M, Widmer A, Kohler M, Franzen D. Analysis of cytokines in serum and bronchoalveolar lavage fluid in patients with immune-checkpoint inhibitor-associated pneumonitis: a cross-sectional case-control study. J Cancer Res Clin Oncol. 2022;148:1711-1720. [PubMed] [DOI] |
| 21. | Esfahani K, Elkrief A, Calabrese C, Lapointe R, Hudson M, Routy B, Miller WH, Calabrese L. Moving towards personalized treatments of immune-related adverse events. Nat Rev Clin Oncol. 2020;17:504-515. [PubMed] [DOI] |
| 22. | Zhai X, Zhang J, Tian Y, Li J, Jing W, Guo H, Zhu H. The mechanism and risk factors for immune checkpoint inhibitor pneumonitis in non-small cell lung cancer patients. Cancer Biol Med. 2020;17:599-611. [PubMed] [DOI] |
| 23. | Casagrande S, Sopetto GB, Bertalot G, Bortolotti R, Racanelli V, Caffo O, Giometto B, Berti A, Veccia A. Immune-Related Adverse Events Due to Cancer Immunotherapy: Immune Mechanisms and Clinical Manifestations. Cancers (Basel). 2024;16:1440. [PubMed] [DOI] |
| 24. | Wong SK, Nebhan CA, Johnson DB. Impact of Patient Age on Clinical Efficacy and Toxicity of Checkpoint Inhibitor Therapy. Front Immunol. 2021;12:786046. [PubMed] [DOI] |
| 25. | Atallah E, Welsh SJ, O'Carrigan B, Oshaughnessy A, Dolapo I, Kerr AS, Kucharczak J, Lee CYC, Crooks C, Hicks A, Chimakurthi CR, Rao A, Franks H, Patel PM, Aithal GP. Incidence, risk factors and outcomes of checkpoint inhibitor-induced liver injury: A 10-year real-world retrospective cohort study. JHEP Rep. 2023;5:100851. [PubMed] [DOI] |
| 26. | Yang K, Li J, Sun Z, Bai C, Zhao L. Effect of age on the risk of immune-related adverse events in patients receiving immune checkpoint inhibitors. Clin Exp Med. 2023;23:3907-3918. [PubMed] [DOI] |
| 27. | Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2022. CA Cancer J Clin. 2022;72:7-33. [PubMed] [DOI] |
| 28. | Atchley WT, Alvarez C, Saxena-Beem S, Schwartz TA, Ishizawar RC, Patel KP, Rivera MP. Immune Checkpoint Inhibitor-Related Pneumonitis in Lung Cancer: Real-World Incidence, Risk Factors, and Management Practices Across Six Health Care Centers in North Carolina. Chest. 2021;160:731-742. [PubMed] [DOI] |
| 29. | Zhou P, Zhao X, Wang G. Risk Factors for Immune Checkpoint Inhibitor-Related Pneumonitis in Cancer Patients: A Systemic Review and Meta-Analysis. Respiration. 2022;101:1035-1050. [PubMed] [DOI] |
| 30. | Hata H, Matsumura C, Chisaki Y, Nishioka K, Tokuda M, Miyagi K, Suizu T, Yano Y. A Retrospective Cohort Study of Multiple Immune-Related Adverse Events and Clinical Outcomes Among Patients With Cancer Receiving Immune Checkpoint Inhibitors. Cancer Control. 2022;29:10732748221130576. [PubMed] [DOI] |
| 31. | Sun Z, Wang S, Du H, Shen H, Zhu J, Li Y. Immunotherapy-induced pneumonitis in non-small cell lung cancer patients: current concern in treatment with immune-check-point inhibitors. Invest New Drugs. 2021;39:891-898. [PubMed] [DOI] |
| 32. | Yau T, Park JW, Finn RS, Cheng AL, Mathurin P, Edeline J, Kudo M, Harding JJ, Merle P, Rosmorduc O, Wyrwicz L, Schott E, Choo SP, Kelley RK, Sieghart W, Assenat E, Zaucha R, Furuse J, Abou-Alfa GK, El-Khoueiry AB, Melero I, Begic D, Chen G, Neely J, Wisniewski T, Tschaika M, Sangro B. Nivolumab versus sorafenib in advanced hepatocellular carcinoma (CheckMate 459): a randomised, multicentre, open-label, phase 3 trial. Lancet Oncol. 2022;23:77-90. [PubMed] [DOI] |
| 33. | Tiu BC, Zubiri L, Iheke J, Pahalyants V, Theodosakis N, Ugwu-Dike P, Seo J, Tang K, Sise ME, Sullivan R, Naidoo J, Mooradian MJ, Semenov YR, Reynolds KL. Real-world incidence and impact of pneumonitis in patients with lung cancer treated with immune checkpoint inhibitors: a multi-institutional cohort study. J Immunother Cancer. 2022;10:e004670. [PubMed] [DOI] |
| 34. | Ghanbar MI, Suresh K. Pulmonary toxicity of immune checkpoint immunotherapy. J Clin Invest. 2024;134:e170503. [PubMed] [DOI] |
| 35. | Banavasi H, Kim S, Alkassis S, Daoud A, Laktineh A, Nagasaka M, Sukari A, Soubani AO. Immune Checkpoint Inhibitor-induced Pneumonitis: Incidence, Clinical Characteristics, and Outcomes. Hematol Oncol Stem Cell Ther. 2023;16:144-150. [PubMed] [DOI] |
| 36. | Wang Y, Zhou S, Yang F, Qi X, Wang X, Guan X, Shen C, Duma N, Vera Aguilera J, Chintakuntlawar A, Price KA, Molina JR, Pagliaro LC, Halfdanarson TR, Grothey A, Markovic SN, Nowakowski GS, Ansell SM, Wang ML. Treatment-Related Adverse Events of PD-1 and PD-L1 Inhibitors in Clinical Trials: A Systematic Review and Meta-analysis. JAMA Oncol. 2019;5:1008-1019. [PubMed] [DOI] |
| 37. | Abou-Alfa GK, Lau G, Kudo M, Chan SL, Kelley RK, Furuse J, Sukeepaisarnjaroen W, Kang YK, Van Dao T, De Toni EN, Rimassa L, Breder V, Vasilyev A, Heurgué A, Tam VC, Mody K, Thungappa SC, Ostapenko Y, Yau T, Azevedo S, Varela M, Cheng AL, Qin S, Galle PR, Ali S, Marcovitz M, Makowsky M, He P, Kurland JF, Negro A, Sangro B. Tremelimumab plus Durvalumab in Unresectable Hepatocellular Carcinoma. NEJM Evid. 2022;1:EVIDoa2100070. [PubMed] [DOI] |
| 38. | Verset G, Borbath I, Karwal M, Verslype C, Van Vlierberghe H, Kardosh A, Zagonel V, Stal P, Sarker D, Palmer DH, Vogel A, Edeline J, Cattan S, Kudo M, Cheng AL, Ogasawara S, Daniele B, Chan SL, Knox JJ, Qin S, Siegel AB, Chisamore M, Hatogai K, Wang A, Finn RS, Zhu AX. Pembrolizumab Monotherapy for Previously Untreated Advanced Hepatocellular Carcinoma: Data from the Open-Label, Phase II KEYNOTE-224 Trial. Clin Cancer Res. 2022;28:2547-2554. [PubMed] [DOI] |
| 39. | Merle P, Kudo M, Edeline J, Bouattour M, Cheng AL, Chan SL, Yau T, Garrido M, Knox J, Daniele B, Breder V, Lim HY, Ogasawara S, Cattan S, Chao Y, Siegel AB, Martinez-Forero I, Wei Z, Liu CC, Finn RS. Pembrolizumab as Second-Line Therapy for Advanced Hepatocellular Carcinoma: Longer Term Follow-Up from the Phase 3 KEYNOTE-240 Trial. Liver Cancer. 2023;12:309-320. [PubMed] [DOI] |
| 41. | Melero I, Yau T, Kang YK, Kim TY, Santoro A, Sangro B, Kudo M, Hou MM, Matilla A, Tovoli F, Knox J, He AR, El-Rayes B, Acosta-Rivera M, Lim HY, Soleymani S, Yao J, Neely J, Tschaika M, Hsu C, El-Khoueiry AB. Nivolumab plus ipilimumab combination therapy in patients with advanced hepatocellular carcinoma previously treated with sorafenib: 5-year results from CheckMate 040. Ann Oncol. 2024;35:537-548. [PubMed] [DOI] |
| 42. | El-Khoueiry AB, Trojan J, Meyer T, Yau T, Melero I, Kudo M, Hsu C, Kim TY, Choo SP, Kang YK, Yeo W, Chopra A, Soleymani S, Yao J, Neely J, Tschaika M, Welling TH, Sangro B. Nivolumab in sorafenib-naive and sorafenib-experienced patients with advanced hepatocellular carcinoma: 5-year follow-up from CheckMate 040. Ann Oncol. 2024;35:381-391. [PubMed] [DOI] |
| 43. | Cheng AL, Qin S, Ikeda M, Galle PR, Ducreux M, Kim TY, Lim HY, Kudo M, Breder V, Merle P, Kaseb AO, Li D, Verret W, Ma N, Nicholas A, Wang Y, Li L, Zhu AX, Finn RS. Updated efficacy and safety data from IMbrave150: Atezolizumab plus bevacizumab vs. sorafenib for unresectable hepatocellular carcinoma. J Hepatol. 2022;76:862-873. [PubMed] [DOI] |
| 44. | Kudo M, Finn RS, Galle PR, Zhu AX, Ducreux M, Cheng AL, Ikeda M, Tsuchiya K, Aoki KI, Jia J, Lencioni R. IMbrave150: Efficacy and Safety of Atezolizumab plus Bevacizumab versus Sorafenib in Patients with Barcelona Clinic Liver Cancer Stage B Unresectable Hepatocellular Carcinoma: An Exploratory Analysis of the Phase III Study. Liver Cancer. 2023;12:238-250. [PubMed] [DOI] |
| 45. | Hsu C, Rimassa L, Sun HC, Vogel A, Kaseb AO. Immunotherapy in hepatocellular carcinoma: evaluation and management of adverse events associated with atezolizumab plus bevacizumab. Ther Adv Med Oncol. 2021;13:17588359211031141. [PubMed] [DOI] |
| 46. | Hazim A, Guiance IR, Shreve J, Ruan G, McGlothlin D, LeMahieu A, Haemmerle R, Mcconn K, Godby RC, Kottschade L, Schwecke A, Fazer-Posorske C, Peikert T, Edell E, Leventakos K, Egan A. Clinical characteristics, outcomes, and predictive modeling of patients diagnosed with immune checkpoint inhibitor therapy-related pneumonitis. Cancer Immunol Immunother. 2025;74:194. [PubMed] [DOI] |
| 47. | Su Q, Zhu EC, Wu JB, Li T, Hou YL, Wang DY, Gao ZH. Risk of Pneumonitis and Pneumonia Associated With Immune Checkpoint Inhibitors for Solid Tumors: A Systematic Review and Meta-Analysis. Front Immunol. 2019;10:108. [PubMed] [DOI] |
| 49. | Yu X, Wu J, Su C. Progress in diagnosis and treatment of checkpoint inhibitor pneumonitis. Curr Opin Oncol. 2023;35:31-36. [PubMed] [DOI] |
| 50. | 柴 晓明, 杨 秀荣. 免疫检查点抑制剂相关性肺炎的CT特征. 中国呼吸与危重监护杂志. 2023;22:232-236. |
| 52. | Horiuchi K, Ikemura S, Sato T, Shimozaki K, Okamori S, Yamada Y, Yokoyama Y, Hashimoto M, Jinzaki M, Hirai I, Funakoshi T, Mizuno R, Oya M, Hirata K, Hamamoto Y, Terai H, Yasuda H, Kawada I, Soejima K, Fukunaga K. Pre-existing Interstitial Lung Abnormalities and Immune Checkpoint Inhibitor-Related Pneumonitis in Solid Tumors: A Retrospective Analysis. Oncologist. 2024;29:e108-e117. [PubMed] [DOI] |
| 53. | Bocchini G, Imperato MC, Valente T, Guarino S, Lieto R, Massimo C, Muto E, Romano F, Scaglione M, Sica G, Vitagliano Torre D, Masala S, Bocchino M, Rea G. Pulmonary Adverse Events in Cancer Immunotherapy: Case Studies of CT Patterns. Diagnostics (Basel). 2024;14:613. [PubMed] [DOI] |
| 55. | Haanen J, Obeid M, Spain L, Carbonnel F, Wang Y, Robert C, Lyon AR, Wick W, Kostine M, Peters S, Jordan K, Larkin J; ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Management of toxicities from immunotherapy: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2022;33:1217-1238. [PubMed] [DOI] |
| 58. | 王 汉萍, 郭 潇潇, 周 佳鑫, 段 炼, 斯 晓燕, 张 丽, 李 玥, 刘 小伟, 王 孟昭, 施 举红, 张 力. 免疫检查点抑制剂相关肺炎的临床诊治建议. 中国肺癌杂志. 2019;22:621-626. |
| 59. | Ertl C, Tomsitz D, Ben Khaled N. [Side effects of Immune Checkpoint Inhibitors : Diagnostics and Management-an Update]. Inn Med (Heidelb). 2024;65:899-911. [PubMed] [DOI] |
| 60. | Balaji A, Hsu M, Lin CT, Feliciano J, Marrone K, Brahmer JR, Forde PM, Hann C, Zheng L, Lee V, Illei PB, Danoff SK, Suresh K, Naidoo J. Steroid-refractory PD-(L)1 pneumonitis: incidence, clinical features, treatment, and outcomes. J Immunother Cancer. 2021;9:e001731. [PubMed] [DOI] |
| 61. | Chen AY, Wolchok JD, Bass AR. TNF in the era of immune checkpoint inhibitors: friend or foe? Nat Rev Rheumatol. 2021;17:213-223. [PubMed] [DOI] |
| 62. | Katsumoto TR, Wilson KL, Giri VK, Zhu H, Anand S, Ramchandran KJ, Martin BA, Yunce M, Muppidi S. Plasma exchange for severe immune-related adverse events from checkpoint inhibitors: an early window of opportunity? Immunother Adv. 2022;2:ltac012. [PubMed] [DOI] |
| 63. | Onwuemene OA, Nnoruka CI, Patriquin CJ, Connelly-Smith LS. Therapeutic plasma exchange in the management of immune checkpoint inhibitor-associated immune-related adverse effects: A review. Transfusion. 2022;62:2370-2390. [PubMed] [DOI] |
| 65. | Campochiaro C, Farina N, Tomelleri A, Ferrara R, Lazzari C, De Luca G, Bulotta A, Signorelli D, Palmisano A, Vignale D, Peretto G, Sala S, Esposito A, Garassino M, Gregorc V, Dagna L. Tocilizumab for the treatment of immune-related adverse events: a systematic literature review and a multicentre case series. Eur J Intern Med. 2021;93:87-94. [PubMed] [DOI] |
| 66. | Moi L, Bouchaab H, Mederos N, Nguyen-Ngoc T, Perreau M, Fenwick C, Vaucher J, Sempoux C, Peters S, Obeid M. Personalized Cytokine-Directed Therapy With Tocilizumab for Refractory Immune Checkpoint Inhibitor-Related Cholangiohepatitis. J Thorac Oncol. 2021;16:318-326. [PubMed] [DOI] |
| 67. | Beattie J, Rizvi H, Fuentes P, Luo J, Schoenfeld A, Lin IH, Postow M, Callahan M, Voss MH, Shah NJ, Betof Warner A, Chawla M, Hellmann MD. Success and failure of additional immune modulators in steroid-refractory/resistant pneumonitis related to immune checkpoint blockade. J Immunother Cancer. 2021;9:e001884. [PubMed] [DOI] |
| 68. | Martin-Loeches I, Torres A, Nagavci B, Aliberti S, Antonelli M, Bassetti M, Bos LD, Chalmers JD, Derde L, de Waele J, Garnacho-Montero J, Kollef M, Luna CM, Menendez R, Niederman MS, Ponomarev D, Restrepo MI, Rigau D, Schultz MJ, Weiss E, Welte T, Wunderink R. ERS/ESICM/ESCMID/ALAT guidelines for the management of severe community-acquired pneumonia. Intensive Care Med. 2023;49:615-632. [PubMed] [DOI] |
| 69. | Qin S, Kudo M, Meyer T, Bai Y, Guo Y, Meng Z, Satoh T, Marino D, Assenat E, Li S, Chen Y, Boisserie F, Abdrashitov R, Finn RS, Vogel A, Zhu AX. Tislelizumab vs Sorafenib as First-Line Treatment for Unresectable Hepatocellular Carcinoma: A Phase 3 Randomized Clinical Trial. JAMA Oncol. 2023;9:1651-1659. [PubMed] [DOI] |
| 70. | Ren Z, Xu J, Bai Y, Xu A, Cang S, Du C, Li Q, Lu Y, Chen Y, Guo Y, Chen Z, Liu B, Jia W, Wu J, Wang J, Shao G, Zhang B, Shan Y, Meng Z, Wu J, Gu S, Yang W, Liu C, Shi X, Gao Z, Yin T, Cui J, Huang M, Xing B, Mao Y, Teng G, Qin Y, Wang J, Xia F, Yin G, Yang Y, Chen M, Wang Y, Zhou H, Fan J; ORIENT-32 study group. Sintilimab plus a bevacizumab biosimilar (IBI305) versus sorafenib in unresectable hepatocellular carcinoma (ORIENT-32): a randomised, open-label, phase 2-3 study. Lancet Oncol. 2021;22:977-990. [PubMed] [DOI] |
| 71. | Qin S, Chan SL, Gu S, Bai Y, Ren Z, Lin X, Chen Z, Jia W, Jin Y, Guo Y, Hu X, Meng Z, Liang J, Cheng Y, Xiong J, Ren H, Yang F, Li W, Chen Y, Zeng Y, Sultanbaev A, Pazgan-Simon M, Pisetska M, Melisi D, Ponomarenko D, Osypchuk Y, Sinielnikov I, Yang TS, Liang X, Chen C, Wang L, Cheng AL, Kaseb A, Vogel A; CARES-310 Study Group. Camrelizumab plus rivoceranib versus sorafenib as first-line therapy for unresectable hepatocellular carcinoma (CARES-310): a randomised, open-label, international phase 3 study. Lancet. 2023;402:1133-1146. [PubMed] [DOI] |
| 72. | Shi Y, Han G, Zhou J, Shi X, Jia W, Cheng Y, Jin Y, Hua X, Wen T, Wu J, Gu S, Bai Y, Wang X, Zhang T, Chen Z, Zhang B, Huang M, Liu H, Mao Y, Zhou L, Wang R, Shan Y, Zhang W, Song T, Guo Y, Zhou F, Shao B, Zhang M, Liang B, Zheng J, Zhang G, Shen J, Su W, Zhang F, He Y, Hu S, Liu R, Zhang C, Shen S, Zeng H, Wang TE, Guo W, Shen Y, Chen Y, Li Y, Samol J, Hu H, Zhang W, Du C, Li E, Liu C, Pin CS, Li X, Xu H, Huang JF, Hao C, Lv J, Wang W, Xu Q, Bai A, Zhang X, Liu B, Jin C, Fan J. Toripalimab plus bevacizumab versus sorafenib as first-line treatment for advanced hepatocellular carcinoma (HEPATORCH): a randomised, open-label, phase 3 trial. Lancet Gastroenterol Hepatol. 2025;10:658-670. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 湖南省
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 刘继红 制作编辑:郑晓梅