修回日期: 2025-12-10
接受日期: 2025-12-16
在线出版日期: 2025-12-28
程序性细胞死亡(programmed cell death, PCD)是指细胞的死亡方式取决于特定的基因编码信号或活动. PCD包括凋亡、焦亡、自噬、坏死(程序性坏死)、铁下垂、铜凋亡及泛凋亡等. 目前PCD的发生机制已得到认识, PCD是由穿孔素(GSDM蛋白)家族介导的, GSDMD蛋白是细胞焦亡的执行者, 并伴有炎症和免疫反应, 其结构特点使其能破坏离子稳态并诱导细胞死亡. PCD与肝细胞癌(hepatocellular carcinoma, HCC)之间的关系非常复杂, 至今尚不完全明了. 一方面, PCD可以抑制肿瘤的发生和发展; 另一方面, PCD作为一种促炎性死亡, 通过创造适合肿瘤细胞生长的微环境, 促进肿瘤生长. 近几年来研究显示PCD与HCC的抗肿瘤作用机制逐渐确立, 此为HCC的抗癌治疗带来新途径与前景.
核心提要: 近年细胞凋亡、坏死下垂、焦亡、铁下垂、铜凋亡、泛凋亡和免疫原性细胞死亡等在肝细胞癌(hepatocellular carcinoma, HCC)患者中被广泛研究. 本文重点介绍程序性细胞死亡(programmed cell death, PCD)导致HCC的细胞死亡机制, 在HCC中的双刃剑作用及PCD在HCC抗肿瘤治疗中的作用.
引文著录: 池肇春. 细胞程序性死亡与肝细胞癌相关性研究进展与展望. 世界华人消化杂志 2025; 33(12): 945-961
Revised: December 10, 2025
Accepted: December 16, 2025
Published online: December 28, 2025
Programmed cell death (PCD) is a form of cell demise regulated by specific gene-encoded signals or activities. It encompasses multiple modalities, including apoptosis, pyroptosis, autophagy, necroptosis (programmed necrosis), ferroptosis, cuproptosis, and PANoptosis. The mechanistic basis of PCD is now well established and is known to be mediated in part by members of the perforin (GSDM protein) family. For example, GSDMD protein acts as the executor protein in pyroptosis, driving inflammatory and immune responses through its ability to disrupt ionic homeostasis and induce lytic cell death. The relationship between PCD and hepatocellular carcinoma is highly complex and remains incompletely understood. On one hand, PCD can function as a tumor-suppressive mechanism, restraining cancer initiation and progression. On the other hand, certain proinflammatory forms of PCD may facilitate tumor growth by shaping a tumor-favorable microenvironment. Emerging evidence indicates that the anti-tumor mechanisms of PCD in hepatocellular carcinoma are gradually being elucidated, offering novel avenues and promising prospects for therapeutic interventions against this malignancy.
- Citation: Chi ZC. Programmed cell death and hepatocellular carcinoma: Research progress and prospects. Shijie Huaren Xiaohua Zazhi 2025; 33(12): 945-961
- URL: https://www.wjgnet.com/1009-3079/full/v33/i12/945.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i12.945
肝细胞癌(hepatocellular carcinoma, HCC)是最常见的原发性肝癌(primary liver cancer, PLC), 是全球癌症相关死亡的第三大常见原因. 其5年生存率仅为18%. 目前, 手术是治疗HCC的唯一方法, 而替代疗法, 如靶向治疗和免疫治疗, 由于反应率低和耐药倾向而受到限制[1,2]. 为了提高HCC治疗的有效性应深入了解HCC的细胞死亡机制, 这对于制定更有效的治疗策略至关重要. HCC的程序性细胞死亡(programmed cell death, PCD)途径, 包括细胞凋亡、坏死凋亡、焦亡、铁下垂和免疫原性细胞死亡(immunogenic cell death, ICD)、泛凋亡等. 它们相互关联并相互作用. 这些机制触发特异性细胞死亡级联反应, 影响HCC的发生和进展. 目前不同细胞死亡途径在HCC中的确切作用以及哪种细胞死亡途径起主要作用尚不完全清楚. 靶向细胞程序性死亡通路中的关键分子, 或与抗肿瘤药物协同作用, 可以增强抗肿瘤疗效, 为肝癌治疗提供了一条有前景的途径[3].
自1972年发现细胞凋亡以来, 许多新形式的非凋亡性PCD被发现并进行了广泛的研究[4,5]. 近几年对细胞凋亡、坏死性凋亡、焦亡、铁下垂和ICD在HCC患者中被广泛研究, 尽管这些PCD过程各不相同, 但大多数是由半胱天冬酶和氧化应激介导的, 它们通常由受体相互作用蛋白激酶-1(receptor-interacting protein kinase 1, RIPK1)调节. 研究表明[3], 大多数PCD形式是HCC病理生理的组成部分, 显著影响HCC的发生和进展. 本文综述探讨了HCC中PCD通路的病理机制和潜在调控因素, 并探讨了利用这些细胞死亡通路的当前和新兴治疗干预措施.
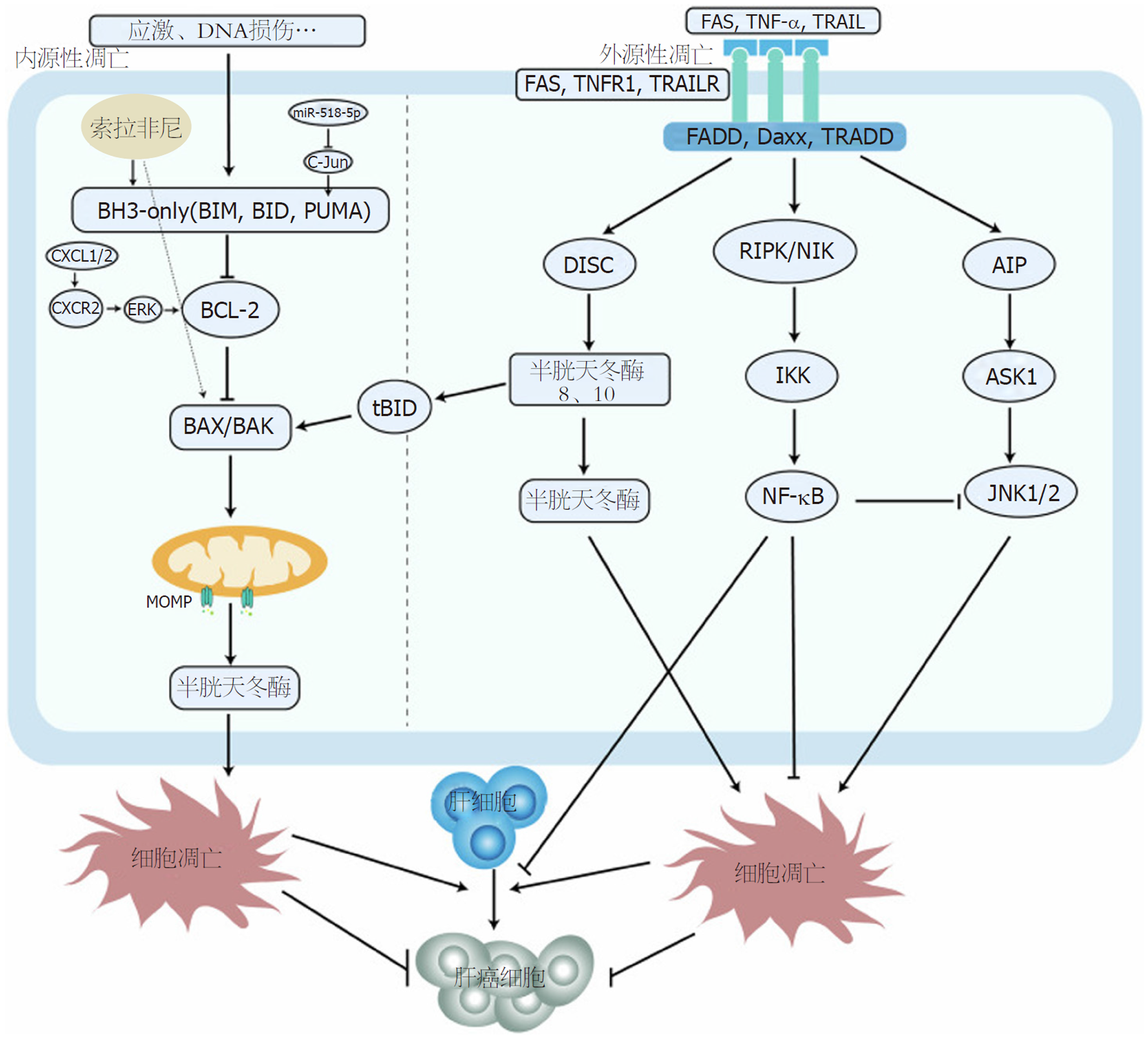
细胞凋亡是最早被描述的PCD形式, 其特征是细胞质收缩、核凝聚、碎裂和凋亡体的出现. 这一过程分为内在和外在途径, 前者以线粒体信号为中心, 后者以死亡受体参与为中心[6]. 在内在途径中, BCL-2蛋白通过与BCL-2同源-3(BH3)蛋白结合, 促进BCL-2相关X蛋白(BAX)或BCL-2拮抗剂/杀伤蛋白(BAK)的激活, 从而诱导线粒体外膜通透, 并随之释放促凋亡因子, 最终导致caspase激活、蛋白分解和细胞死亡[7]. 相反, 外源性途径是由膜结合死亡受体启动的, 特别是肿瘤坏死因子受体超家族成员6和肿瘤坏死因子受体1, 它们触发caspase 8和10[3].
此外, 核因子κB(nuclear factor kappaB, NF-κB)通路参与抑制细胞凋亡和肝癌的发生. 肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)可能通过结合核因子kappa B激酶(IkappaB kinase, IKK)、C-Jun N末端激酶(C-Jun N-terminal kinase, JNK)和半胱天冬酶抑制剂等蛋白来调控细胞凋亡. 此外, NF-κB活化可通过调节IKK抑制caspase活性, 抵消TNF-α-诱导的JNK活化, 从而抑制凋亡[8]. Ikk2介导的NF-κB活化可以预防肝细胞损伤并阻碍HCC的发展, 但受体相互作用RIPK1和肿瘤坏死因子受体相关因子2等因子的缺失可能导致NF-κB活性受到抑制, 进而导致HCC的自发发展[9]. 然而, 在现有HCC中异常的NF-κB活化可推动HCC进展并促进化疗耐药发生[4](图1).
内源性凋亡由应激或DNA损伤触发, 激活BH3-only蛋白与BCL-2蛋白结合形成BAX/BAX低聚物, 导致线粒体通透性和凋亡因子的释放. 在HCC中, 它受C-X-C基元趋化因子配体-1(C-X-C unit chemokine ligand-1, CXCL1)/2-CXCR2-ERK等信号通路调控. 外源性途径由死亡受体信号和特异性死亡配体介导, 形成三聚体, 激活caspase级联、IKK/NF-κB和JNK通路. IKK/NF-κB通路促进细胞存活, 抑制JNK介导的细胞凋亡. 来自外在途径的tBID可以与BAX和BAK1结合形成线粒体外膜通透性. 细胞凋亡促进HCC的形成, 但随后抑制HCC的形成. 索拉非尼等药物可促进细胞凋亡, 起到抗肿瘤作用.
在HCC中, 一些抗肿瘤药物可诱导癌细胞凋亡, 凋亡通路中某些分子的缺失可导致耐药. 解决这些分子有望恢复HCC细胞对治疗的敏感性. 例如, 索拉非尼已被证明可以刺激肝癌细胞中的BAX/BAK, 主要是通过BCL-2同源3结构域(BH3-only)蛋白p53上调凋亡调节因子(p53-upregulated modulator of apoptosis, PUMA), 从而促进肿瘤细胞的凋亡[10]. 此外, 已知CXCL1和CXCL2通过C-X-C趋化因子受体-2(chemokine receptor 2, CXCR2)/细胞外调节蛋白激酶(extracellular signal-regulated kinase, ERK)信号通路影响. 从而增强HCC细胞活性, 降低索拉非尼的凋亡作用, 从而促进耐药. 因此, 靶向CXCL1、CXCL2和从属的CXCR2/ERK信号通路可能是克服HCC中这种耐药的有效策略[11]. 此外, 一种经过特殊化学修饰的成熟miRNA的互补单链(miR-518d-5p抑制剂全链进行甲氧基修饰, 在5'端和3'端分别有2个和4个硫代骨架修饰, 并在3'端连接有高亲和性胆固醇修饰. miR-518d-5p通过干扰C-Jun/PUMA介导的细胞凋亡, 参与促进索拉非尼耐药, 血清miR-518d-5p水平升高与索拉非尼治疗后持续时间和生存率缩短相关[12].
因此, 细胞凋亡的失调可能在HCC的发生发展中起作用. NF-κB通路在抑制细胞凋亡和肿瘤发生中至关重要, 但在HCC发病后却可能促进肿瘤细胞存活和耐药. 因此, 细胞凋亡途径和NF-κB途径的调节成分可能会增强HCC的治疗反应性(图1).
死亡受体、Toll样受体或病毒通过RIPK1、Toll样受体适配器分子1和Z-DNA结合蛋白1激活RIPK3, 可诱导坏死性凋亡发生. 这进而激活混合谱系激酶结构域样蛋白(mixed lineage kinase-like protein, MLKL), 导致质膜破裂和细胞内内容物的释放[13].
坏死性凋亡与慢性肝脏炎症有关, 可发展为纤维化、慢性肝病, 并可能发展为HCC[14,15]. RIPK3表达减弱的肝细胞可能在NF-κB平行活化的情况下经历亚致死性坏死过程, 导致细胞因子释放, 促进HCC进展[16]. 相反, 抑制NF-κB可能导致致死性坏死下垂, 阻止细胞因子的释放和HCC的发生. 在HCC中, 巨噬细胞内RIPK3的下调与M2型巨噬细胞肿瘤相关巨噬细胞(tumor-associated macrophages, TAM)的积累和极化增加相关, 促进了HCC的肿瘤发生[17]. 相反, HCC中山梨醇脱氢酶水平升高似乎会增强坏死性下垂信号, 促进肿瘤环境中的M1巨噬细胞极化, 并可能抑制肿瘤生长[18]. 此外, HCC的坏死下垂与肿瘤中表达坏死相关基因的肿瘤浸润淋巴细胞[19], 特别是CD8+ T细胞有关. 此外, 研究表明[20], 重组腺病毒通过磷脂酰乙醇胺结合蛋白1, 途径诱导糖尿病和肥胖小鼠的急性肝损伤、坏死和HCC发生, 这表明它是这些人群中潜在的HCC危险因素.
因此, 坏死性凋亡在肝脏病理中起着矛盾的作用; 它促进炎症、纤维化和HCC的演变; 然而, 在现有的HCC中, 它也可以通过调节坏死肿瘤微环境(tumor microenvironment, TME), 包括巨噬细胞极化和CD8+ T细胞浸润, 引发肿瘤细胞死亡并发挥抗杀肿瘤作用.
坏死性凋亡途径及其相关机制为HCC治疗提供了巨大的潜力. 目前用于HCC治疗的化疗药物已有多种, 其中索拉非尼降低微血管密度, 导致肿瘤内缺氧, 进而激活缺氧诱导因子(hypoxia-inducible factor, HIF)介导的细胞反应, 包括热休克蛋白90(heat shock protein 90, HSP90)的升高. HSP90与RIPK1/RIPK3/MLKL复合物相互作用, 促进伴侣介导的自噬降解, 被认为是索拉非尼耐药的主要原因. Ganetespib是一种HSP90抑制剂, 已被证明在缺氧条件下诱导坏死性凋亡和破坏HIF-1α的稳定, 从而增强索拉非尼的治疗效果. 因此, Ganetespib和Sorafenib联合使用可能引发坏死性凋亡, 破坏HIF-1α的稳定, 抑制巨噬细胞, 并产生抗血管生成作用[21]. IgM单克隆抗体, 特别是克隆M6-1D4, 靶向CD147并在HCC细胞中引起显著肿胀. 当用急性红白血病-ID4基因(M6-1D4)治疗时, MLKL的抑制降低了人肝癌细胞HepG2细胞对坏死性凋亡的易感性, 这表明一种触发坏死性凋亡的创新癌症治疗方法[22].
此外, 转录调控因子核蛋白1抑制剂(inhibitor of nuclear protein 1, NUPR1)是三氟拉嗪的衍生物ZZW-115是一种有效的NUPR1抑制剂, ZZW-115通过与NUPR1的相互作用显示出明显的抗肿瘤活性, 通过坏死和凋亡诱导肝癌细胞死亡. 具有抗癌活性. ZZW-115诱导HCC细胞凋亡和坏死, 导致明显的线粒体功能障碍和三磷酸腺苷(adenosine triphosphate, ATP)水平显著降低, 使其成为HCC患者可行的药理学候选药物[23]. 此外, 紫草素是一种来自中草药紫草的小分子, 当肿瘤细胞凋亡被抑制时, 它会诱导肿瘤细胞坏死; 虽然声动力疗法(sonodynamic therapy, SDT)通过超声空化以及单线态氧、羟基自由基和吲哚菁绿(indocyanine green, ICG)等声敏剂的化学作用来靶向肿瘤, 产生活性氧(reactive oxygen species, ROS), 但单独使用SDT对凋亡抵抗肿瘤的影响有限. 然而, 将ICG-纳米泡介导的SDT与紫草素结合, 通过增加ROS来促进HCC的坏死性凋亡, 从而调节RIPK1/RIPK3坏死性凋亡途径而起到抗癌作用[24].
焦亡是一种PCD形式, 其特征是细胞膜破裂和强烈的炎症反应. 越来越多的证据表明, 焦亡通过释放损伤相关分子模式(damage-associated molecular patterns, DAMPs)和促炎介质显著影响TME和抗肿瘤免疫, 从而使其成为癌症免疫治疗的关键靶点[25].
在一个健康的机体中, 免疫系统, 尤其是T细胞, 可以检测并消除体内的异常蛋白质或抗原. 然而, 癌细胞通过各种机制逃避或抑制免疫反应, 包括低免疫原性、抗原变异和免疫抑制微环境的建立, 使肿瘤不受控制地生长 . 焦亡是生物体内抑制感染和内源性损伤信号的重要免疫反应机制. 这一过程的特点是内稳态、组织完整性和整体健康. 虽然焦亡的激活可能导致炎症介质的释放, 可能促进肿瘤的发生和进展[26], 但越来越多的研究表明, 焦亡细胞死亡不仅直接杀死肿瘤细胞, 而且通过释放肿瘤抗原和炎症介质启动强大的抗肿瘤免疫反应, 从而突出了其增强癌症免疫治疗疗效的潜力. 当肿瘤细胞发生焦亡时, 它们释放DAMPs和促炎细胞因子, 改变局部微环境, 促进树突状细胞成熟并增强T细胞浸润. 这个过程将免疫上的"冷"肿瘤转化为对治疗更有反应的"热"肿瘤[27]. 因此, 了解焦亡的特征和分子机制及其在抗肿瘤免疫中的作用, 对于提高治疗策略和疗效至关重要.
焦亡其特征是炎症小体激活, 随后释放促炎细胞因子, 如白细胞介素-1β(interleukin-1beta, IL-1β)和白细胞介素-18(interleukin-18, IL-18). 负责焦亡的炎性小体分为经典caspase-1依赖型和非经典caspase-11依赖型. 这些炎性小体的激活导致穿孔素-D(Gasdermin-D, GSDMD)分裂为22 kDa的C端片段(GSDMD-C)和31 kDa的N端片段(GSDMD-N). GSDMD-N迅速移动到质膜的内层, 在那里与磷脂结合并引发孔形成, 最终导致膜破裂. 相反, GSDMD-C抑制GSDMD-N的成孔能力[28]. 虽然caspase-3以其在细胞凋亡中的重要作用, 但它也通过GSDME的裂解, 在细胞膜中产生孔而参与焦亡.
焦亡对HCC有双重作用. 一方面, 缺氧HCC细胞通过高迁移率组盒1(high mobility histone 1, HMGB1)诱导, 通过TLR4和晚期糖基化终末产物受体信号通路激活caspase-1, 通过上调IL-1β和IL-18等促炎因子, 促进侵袭转移. 相反, 焦亡主要抑制HCC进展. 例如, 携带电荷的多泡体蛋白3是运输所需的内吞体分选转运复合体的一部分, 在HCC中过度表达. 它的敲低可能触发caspase-1介导的焦亡途径, 从而阻碍HCC的进展, 这一作用可被caspase-1抑制剂如一种选择性caspase-1(IL-1β转化酶, ICE)抑制剂AYC逆转[29]. 此外, 在HCC细胞中, 沉默丝氨酸/苏氨酸激酶, 可显著增加焦亡标志物, 如NOD样受体热蛋白结构域相关蛋白3(NOD-, LRR- and pyrin domain-containing protein 3, NLRP3)、caspase-1和GSDMD, 促进焦亡并减少肿瘤-基质相互作用[30].
炎症小体激活引发焦亡, 导致半胱天冬酶1(caspase-1, CASP1)或CASP11裂解GSDMD, 形成GSDMD-C和GSDMD-N. GSDMD-N在细胞膜上形成孔隙, 导致细胞膜破裂, 而GSDMD-C抑制这一过程. Caspase-3也可以通过切割GSDME在细胞膜上产生GSDME-N孔而诱导细胞焦亡. 焦亡有助于防止肿瘤生长, 并由各种分子和药物控制. 然而, 焦亡的Caspase-1途径可以增加IL-1β和IL-18的水平, 促进HCC的进展. 此外, 不充分的射频消融诱导的焦亡可导致程序性死亡配体-1(programmed cell death ligand 1, PD-L1)的产生, 有助于肝癌细胞的免疫逃避[3].
最近的研究表明, GSDME和GSDME介导的焦亡在HCC的发生发展中起着至关重要的作用. 通常, GSDME在细胞质中无活性, 不会导致细胞死亡. 然而, 在细胞应激或损伤后, 活化的caspase-3分裂并激活GSDME, 释放其N-和C-末端. N端与细胞膜上的脂质结合, 寡聚形成Gasdermin(GSDM)孔, 破坏细胞膜的完整性, 触发促炎细胞因子如IL-1β和IL-18的释放, 引起焦亡, 促进肿瘤细胞死亡. 大量研究表明[31], 焦亡可以抑制HCC的发生和发展. 目前关于GSDME介导的HCC焦亡的研究较少; GSDME在HCC中的相关机制仍需进一步阐明.
研究显示PLC的癌前和恶性发展与焦亡有关. 肝纤维化和肝硬化是HCC发展的起始因素, 肝硬化在一定程度上是肝癌的癌前阶段. 造血干细胞(hematopoietic stem cell, HSC)是肝纤维化细胞的主要类型, 其增殖和活化是肝纤维化的关键步骤. 研究表明[32], 当HSC受到胚细胞或炎症细胞释放的介质刺激时, 炎性小体通过激活caspase-1并释放促炎因子IL-1β和IL-18诱导热焦亡, 进而推动肝纤维化的进展. NLRP3炎性体可能在HSC活化和肝纤维化中起直接作用. 在NLRP3过表达的HCC小鼠中, 发现小鼠存活时间较短, 生长不良, 中性粒细胞浸润和肝星状细胞活化, 肝炎反应严重, 肝纤维化明显. 体外实验表明, 细胞外ATP可通过嘌呤能P2X7受体(P2X7R)激活HSC NLRP3, 促进α-SMA、I型胶原等纤维化标志物的释放, 导致肝纤维化. P2x7R介导的NLRP3激活参与肝星状细胞IL-1β的产生, 可能与细胞外基质沉积有关, 这表明阻断P2X7R-NLRP3轴可能是肝纤维化的潜在治疗靶点. 转化生长因子-β1(transforming growth factor-β1, TGF-β1)是组织纤维化的关键介质, TGF-β1通路失调是肝纤维化的重要致病机制[33]. HSC的激活导致TGF-β1的产生, TGF-β1与转化生长因子β(transforming growth factor-β, TGFβ)结合, 导致TGFβ通路激活和HSC激活, 从而促进肝纤维化过程[34]. 醛固酮可通过促进NLRP3的组装和表达诱导小鼠HSC活化和肝纤维化[35]. 焦亡介导的炎症可诱导HSC活化, 促进肝纤维化.
此外, 血管紧张素Ang Ⅱ通过上调肝细胞中活性氧和尼克酰胺腺嘌呤二核苷酸磷酸氧化酶4蛋白的水平, 促进NLRP3炎性小体分泌轴相关蛋白(NLRP3、ASC、Caspase-1、IL-1β)的表达, 诱导Caspase-1介导的肝细胞凋亡. 这表明NLRP3激活肝细胞导致半胱天冬酶活性显著增加, 进而诱导肝细胞焦亡. 因此, caspase抑制剂可用于抑制肝细胞焦亡, 从而抑制肝纤维化的进展. 除了炎性小体外, IL-1β和E蛋白也是导致肝硬化和肝纤维化的重要分子. IL-1β可诱导微血管内皮细胞转化成肌成纤维细胞, 导致胶原组织增生. 还可直接激活肝星状细胞, 促进TNF-α等炎症因子的表达, 刺激炎症级联反应, 逐渐发展为肝纤维化甚至肝硬化. TGF-β1是导致肝纤维化的重要途径之一[33]. 发现TGF-β1可抑制caspase-1表达, 抑制IL-1β释放, 但该途径对IL-18无显著影响. 上述数据提示, 在PLC的发展过程中, 肝组织焦亡导致肝组织纤维化, 从而导致PLC的发展.
在肿瘤发生发展的不同阶段, 焦亡的作用是不同的. 在肝纤维化和肝硬化癌前阶段, 炎性体和炎性因子的积累会加剧肝硬化向PLC的转变; 而在肿瘤阶段, 当癌细胞形成时, 焦亡被抑制, 形成内在的恶性微环境, 阻止癌细胞死亡, 加速PLC向恶性水平发展. 雌激素受体β(estrogen receptor β, ERβ)和NLRP3在HCC患者肝组织中表达显著下调, 且两者表达水平呈正相关; 雌激素可以通过ERβ/丝裂原活化蛋白激酶途径激活NLRP3, 从而抑制HCC细胞的增殖和转移. 研究发现肝癌组织中干扰素诱导核蛋白16(interferon gamma inducible protein 16, IFI16)水平低于正常组织. 过表达IFI16可降低细胞活力, 从而显著抑制肝癌细胞的肿瘤生长和缩小肿瘤大小. 同时, 过表达IFI16可通过caspase-1激活炎性体, 从而使IL-1β和IL-18水平升高. Caspase-1抑制剂(Ac-YVAD-CMK)能有效抑制IFI16的抑瘤作用, 推测IFI16的抑瘤作用可能与Caspase-1介导的焦亡密切相关. 线粒体自噬的重要自噬伴侣FUN14结构域蛋白1(FUN14 domain-containing protein 1, FUNDC1)是大多数人类HCC的特特性有丝分裂受体, 在二乙基亚硝胺(DEN)诱导的小鼠肝癌过程中, 敲低FUNDC1激活NLRP3炎性体, 促进HCC的发生. HMGB1是在缺氧胁迫下释放的核损伤相关分子, 激活caspase-1促进HCC细胞侵袭和转移. 丙型肝炎病毒也通过其对NLRP3炎性体的作用影响HCC引起焦亡[36]. 综上所述, NLRP3作为焦亡的关键分子, 其激活与HCC的发病密切相关.
HCC抗肿瘤药物通过诱导肝细胞焦亡引起抗肿瘤反应. 例如, 据报道, 索拉非尼通过靶向caspase-1依赖性炎症小体诱导巨噬细胞焦亡, 从而激活细胞毒性自然杀伤细胞, 加速肿瘤细胞死亡[37]. 已知三氧化二砷通过激活caspase-3介导的GSDME裂解, 在HCC中引发焦亡, 随后阻止肿瘤进展[38]. 同样, 从丹参中提取的醌类衍生物米替龙通过促进GSDME水解和caspase-3活化, 诱导HCC细胞焦亡, 从而促进肿瘤细胞死亡[39]. 然而, Liang等[40]发现, 不完全射频消融通过caspase-3/GSDME途径促进细胞焦亡, 导致残余HCC细胞中PD-L1表达增加, 从而通过增强T细胞衰竭对抗PD-L1免疫治疗产生耐药性.
因此, 焦亡及其相关分子表现出促肿瘤和抗肿瘤的作用. 此外, 抗肿瘤药物可能刺激焦亡来对抗肿瘤细胞, 不完全消融可通过焦亡促进HCC对抗PD-L1的耐药性.
铁下垂是一种由铁依赖性脂质过氧化引起的受调控的细胞死亡, 在形态学上不同于细胞凋亡、焦亡、坏死性凋亡、自噬依赖性细胞死亡和铜凋亡. 肿瘤代谢在铁下垂中起相反的作用. 一方面, 碳水化合物代谢可产生NADPH维持谷胱甘肽过氧化酶4(glutathione peroxidase 4, GPX4)和铁死亡抑制蛋白1(ferroptosis-suppressor-protein 1, FSP1)的功能, 氨基酸代谢可为GPX4的合成提供底物; 另一方面, 脂质代谢可能合成多不饱和脂肪酸引发铁下垂[41]. 长期以来, 人们对肿瘤代谢影响铁下垂的机制进行了广泛研究; 然而, 一些机制至今尚未阐明.
铁下垂与铁超载和氧化应激引起的脂质过氧化密切相关. 形态学上, 铁下垂的特征是线粒体体积缩小, 线粒体膜密度增加, 线粒体嵴消失或减少, 线粒体外膜破裂, 细胞膜保持完整, 细胞核大小正常, 没有染色质凝聚. 生物化学上, 这一过程的特征是谷胱甘肽耗竭、GPX4活性降低、细胞抗氧化能力降低、脂质过氧化作用增强、代谢功能障碍和脂质ROS水平升高, 这些共同促进了铁下垂. 铁下垂的调控包括三个主要抑制系统: 半胱氨酸/GSH/GPX4轴(XC-system)、NAD(P)H/FSP1/辅酶Q10(CoQ10)系统和GTP环化水解酶1/四氢生物蝶呤/二氢叶酸还原酶(GCH1/BH4/DHFR)系统[42]. 铁下垂还受多种因素的调控, 包括磷酸化、乙酰化、甲基化、二氢叶酸还原酶、内质网应激和线粒体蛋白, 从而调节HCC的进展. HCC的抗肿瘤治疗通过调节这些途径起作用, 这些途径的破坏可能导致耐药性发生[42].
在HCC中, 铁下垂受到多种因素的影响, 包括翻译后修饰, 如磷酸化、乙酰化和甲基化, 以及非编码RNA(noncoding RNAs, ncRNA)、线粒体蛋白和内质网应激. 这些因素主要影响监管体系. 例如, HCC细胞中胰岛素样生长因子1受体的激活使GPX4水平升高, 肌酸激酶B使GPX4磷酸化, 抑制其降解, 从而抑制铁下垂, 促进肿瘤发生[43]. 同样, 羟甲基戊二酰辅酶A裂解酶通过β-羟丁酸影响组蛋白H3赖氨酸9乙酰化, 从而以剂量依赖性方式调节二肽基肽酶4的表达, 促进HCC细胞铁下垂[44]. Wilm's肿瘤1相关蛋白, 一种已知的m6A RNA甲基转移酶, 通过ythd_2相关机制促进自噬性铁下垂[45]. 线粒体转位蛋白通过p62/KEAP1/Nrf2途径上调抗氧化基因和PD-L1表达, 从而抵抗铁下垂并抑制肝癌中的抗肿瘤免疫[46].
上述所有凋亡相关过程均参与抗肿瘤活性. 然而, 激活铁下垂信号也可能诱导肿瘤细胞对内质网应激的适应性耐受, 从而使它们逃避内质网应激诱导的细胞死亡. 机制上, 已发现激活铁下垂信号可促进含有错误折叠和未折叠蛋白的外泌体的形成和分泌, 减轻内质网应激并支持肿瘤细胞存活[47].
铁下垂是一种独特的调节细胞死亡类型, 在抑制肿瘤恶性肿瘤中起着至关重要的作用, 为HCC的治疗提供了新的机会. Sun等[48]报道非编码RNA包括微小RNA、lncRNA和环状RNA(circular RNA, circRNA)的表观遗传修饰可以决定肝癌中癌细胞对铁下垂的易感. 越来越多的证据表明, 表观遗传修饰的失调通过异常的基因表达、蛋白质特征和转化为恶性表型诱导疾病的发生和进展[49]. ncRNA越来越被认为是铁下垂的重要调节介质. 新出现的证据表明, 表观遗传修饰在基因转录、转录后或翻译后水平上影响铁下垂. 靶向表观遗传和翻译后修饰调节铁下垂为癌症治疗提供了新的方向[50,51]. 近年来, ncRNAs已被证明通过调节铁代谢、线粒体相关蛋白、谷胱甘肽代谢和脂质过氧化物来调节铁下垂的生物学过程, 从而影响癌症生物学[52]. 在癌症中, ncRNAs调控铁死亡的机制是ncRNAs调控铁下垂相关基因, 这些基因作为铁下垂防御系统或铁下垂促进因子发挥作用. ncRNAs通过影响铁代谢、脂质代谢、溶质载体家族7成员11(solute carrier family 7 member 11, SLC7A11)/GSH/GPX4网络、谷氨酰胺代谢、KEAP1/Nrf2通路等调控癌细胞铁下垂[53].
4.2.1 miRNA在HCC中铁下垂的调节作用: 激活转录因子4(activate transcription factor 4, ATF4)通过增强热休克蛋白5(heat shock 70 kDa protein 5, HSPA5)介导的GPX4蛋白稳定性或上调肿瘤抑制跨膜蛋白SLC7A11来抑制癌症中的铁下垂[54]. miRNA-214-3p通过抑制肝癌中的 ATF4促进埃拉斯汀(也被称为铁死亡激活剂, Erastin)诱导的铁下垂[55]. miRNA-214-3p过表达会下调70 kDa HSPA5, 但研究并未显示miRNA-214-3p是否通过抑制HSPA5来调节GPX4[55]. 在索拉非尼耐药患者中观察到ETS原癌基因1(ETS proto-oncogene 1, transcription factor, ETS1)介导的miR-23a-3p上调, 并与预后不良相关[56]. miR-23a-3p的缺失增加了HCC细胞和原位HCC肿瘤对索拉非尼的敏感性. miR-23a-3p通过抑制酰基辅酶A合成酶长链家族成员4(acyl-coa synthetase long chain family member 4, ACSL4)抑制索拉非尼诱导的铁下垂. miR-23a-3p抑制剂通过挽救索拉非尼诱导的HCC细胞中ACSL4的表达来诱导铁凋亡. 联合使用miR-23a-3p抑制剂和ACSL4 siRNA可消除对索拉非尼的反应. 总之, 这些结果表明, ETS1依赖性miR-23a-3p上调通过抑制ACSL4轴抑制铁凋亡导致索拉非尼耐药, 强调靶向miR-23a-3p是HCC患者克服索拉非尼耐药的潜在靶点. miR-552-5p通过抑制HCC中的ACSL4抑制铁下垂. 过表达锌指蛋白8抗体可降低细胞内miR-552-5p水平, 增强对铁下垂的敏感性[57].
在HCC中发现miR-21-5p和母系胚胎亮氨酸拉链蛋白激酶(maternal embryonic leucine zipper kinase, MELK)的表达增加, MELK是一种参与肿瘤生长、干细胞转换、肿瘤生长和化疗耐药性的细胞周期调节因子[58]. miR-21-5p和MELK的过表达促进HCC细胞的肿瘤恶性. 沉默miR-21-5p可抑制肿瘤恶性及MELK的表达. MELK通过激活AKT/mTOR信号通路抑制铁下垂. 铁下垂诱导剂Erastin逆转mir-21-5p介导的铁下垂和EMT的抑制. 综上所述, 这些结果表明miR-21-5p通过上调MELK水平激活AKT/mTOR信号通路抑制铁下垂[58]. 在索拉非尼耐药的HCC细胞中观察到热休克蛋白家族B成员1(heat shock protein beta-1, HSPB1)升高. HSPB1上调介导的铁GH下垂耐药导致对索拉非尼的耐药[59]. miR-654-5p通过结合降低HSPB1蛋白水平促进索拉非尼诱导的铁下垂. miR-654-5p通过工程细胞外囊泡递送至HCC细胞, 通过抑制HSPB1并恢复其对索拉非尼耐药的肝癌细胞和异种移植物肿瘤中索拉非尼的敏感性, 增加索拉非尼诱导的铁凋亡. miR-654-5p通过抑制HSPB1促进铁下垂减轻索拉非尼耐药[59].
具有高转移潜力的肝癌细胞表现出铁下垂抵抗. miR-612过表达通过增加脂质ROS水平增加HCC细胞对铁下垂的敏感性. miR-612通过下调β-羟酰基脱氢酶(hydroxyacyl-coa dehydrogenase, HADHA)促进铁下垂抑制HCC细胞增殖和转移[60]. HADHA上调甲羟戊酸关键途径酶的表达. 过表达的HADHA上调CoQ10的表达, 降低PUFA水平和脂质过氧化物丰度. 综上所述, 这些结果表明miR-612可以通过HADHA介导的甲羟戊酸途径降低CoQ10, 诱导铁下垂, 从而抑制肿瘤恶性[60]. miR-339在HCC中表达升高[61]. 沉默miR-339可通过激活自噬相关蛋白7(autophagy related protein 7, ATG7)介导的FTH1自噬降解抑制肝癌进展并诱导铁下垂. miR-339通过抑制ATG7介导的FTH1自噬降解而发挥铁下沉抑制剂的作用[61]. 载脂蛋白M(apolipoprotein M, ApoM)促进肝癌细胞铁下垂. 粘蛋白1(Mucin 1, MUC1)基因可阻止ApoM上调介导的铁下垂. miR-4489抑制MUC1的表达. 综上所述, 这些结果表明ApoM通过上调miR-4489下调细胞表面相关的凋亡抑制基因, MUC1, 从而抑制肿瘤并诱导铁下垂[62].
4.2.2 lncRNA在HCC中对铁下垂的调节作用: lncRNA 双同源盒A假基因8(double homologous box A pseudogene 8, DUXAP8)在肝癌中表达上调, 是与预后不良相关的lncRNA. DUXAP8通过增加SLC7A11降低HCC对索拉非尼介导的铁下下下垂的敏感性, 导致索拉非尼耐药. lncRNA DUXAP8通过促进SLC7A11的棕榈酰化, 抑制溶酶体介导的SLC7A11降解, 从而增强SLC7A11, 防止铁下垂. 总之, 这些结果强调了将IncRNA DUXAP8沉默与索拉非尼结合的治疗策略, 以克服晚期HCC对索拉非尼的耐药[63]. 既往研究表明[64], lncRNA癌症易感性候选基因11(cancer susceptibility candidate 11, CASC1)1通过结合稳定泛素结合酶E2T mRNA, 促进HCC的生长和转移. 进一步研究发现[65], lncRNA CASC11通过抑制铁下垂促进HCC肿瘤的恶性程度. 沉默lncRNA CASC11或过表达lncRNA CASC11分别增强或抑制索拉非尼诱导的HCC细胞铁下垂. 沉默lncRNA CASC11介导的sorafenib增强抗癌作用被铁抑制素-1逆转, 铁抑制素是HCC细胞中的铁下垂抑制剂. 研究表明[66], lncRNACASC11结合稳定SLC7A11 mRNA. LncRNA CASC11通过稳定SLC7A11抑制索拉非尼诱导的铁下垂[64]. SLC7A11-1通过稳定SLC7A11 mRNA, 促进HCC细胞生长和抵抗Erastin诱导的铁下垂. LncRNA HEPFAL通过促进SLC7A11的泛素化从而降低其蛋白稳定性来加速铁下垂[67]. LncRNA NRAV通过海绵化miR-375-3P上调SLC7A11抑制铁下垂, 促进HCC肿瘤发生, 减弱其对SLC7A11的抑制作用[68].
IncRNA PVT1和GPX4的过表达阻碍氯胺酮诱导的铁下垂. 奥沙利铂治疗预后判断的分子标志物LINC01134通过上调GPX4抑制铁下垂而降低奥沙利铂敏感性[69]. HCC中lncRNA人绒毛膜促性腺激素18(human chorionic gonadotropin 18, HCG18)的上调与索拉非尼耐药相关. 沉默lncRNA HCG18可通过增强铁下垂抑制对索拉非尼的耐药, 这可通过GPX4过表达逆转[70]. IncRNA HCG18抑制miR-450b-5p下调GPX4. 综上所述, 这些结果表明沉默lncRNA HCG18通过海绵化miR-450b-5p抑制HCC中的GPX4诱导铁凋亡来克服索拉非尼耐药. LncRNA作为miR-195-5p的海绵, 上调PLAG1的表达, 增强GPX4的表达, 从而引起铁下垂信号通路的抑制[71].
高密度脂蛋白结合蛋白介导的铁死亡抑制蛋白1稳定通过减少三重结构域蛋白69依赖的FSP1降解来促进铁下垂抗性[72]. 在索拉非尼耐药患者样本中观察到HIF-1α诱导的IncRNA不健康的核糖体蛋白-反义RNA 1上调, 这与HCC生存率低有关[73].
lncRNA核富集转录本1通过上调肝癌细胞中的MIOX来促进谷胱甘肽过氧化物酶4抑制剂, 细胞铁死亡诱导剂erastinand和rsl3诱导的铁凋亡[74]. lncRNA HULC降低通过抑制miR-3200-5p/ATF4轴诱导铁下垂. lncRNA表皮生长因子受体途径底物15样1通过降低EPS15的表达, 从而下调醛糖还原酶抑制剂的表达, 抑制HCC细胞活性, 诱导铁下垂[75].
4.2.3 CircRNA在HCC中对铁下垂中的调节作用: 环状白介素4受体(circinterleukin-4 receptor, circIL4R)通过海绵和抑制miR541-3p提高GPX4的表达促进肿瘤发生和抑制铁下垂[76]. circIL4R通过海绵吸收miR-19b-3p提高RNA结合基序单链相互作用蛋白1的表达, 从而降低GPX4的表达, 导致抑制HCC细胞生长并促进铁下垂[77]. circ0060467通过海绵和抑制miR-6085提高人线粒体相关凋亡诱导因子2和GPX4的表达, 促进肿瘤发生, 抑制铁下垂[78]. 沉默circ0016142通过miR-188-3p/GPX4轴诱导铁凋亡抑制HCC细胞增殖[79].
Circ0097009通过海绵和抑制miR-1261上调SLC7A11抑制铁下垂[80]. circ无义转录物(UPF2 regulator of nonsense transcripts homolog, UPF2)通过上调肝癌细胞中SLC7A11的表达抑制铁凋亡, 从而促进对索拉非尼的耐药性. 机制上, 外泌体circUPF2通过增强形成由circUPF2-胰岛素样生长因子2-mRNA结合蛋白2(IGF2BP2)-SLC7A11组成的三元复合物来稳定SLC7A11 mRNA, 因此外泌体circUPF2促进SLC7A11的表达, 导致HCC对索拉非尼的耐药[81].
Bcirpias1过表达通过海绵和抑制miR-455-3p抑制铁下垂, 导致NUPR1上调, 从而增强HCC细胞中FTH1的转录和铁的储存, 从而赋予铁下垂抗性. NUPR1抑制剂ZZW-115逆转cirpias1的促瘤作用, 增加HCC细胞对仑伐替尼(lenvatinib)的敏感性[82]. 索拉非尼治疗后, HCC细胞中hsa_circ_0008367 (cIARS)表达上调. 沉默cIARS可抑制sorafenib或erastin诱导的铁凋亡, MDA和Fe2+降低, 同时细胞内GSH升高, 表明cIARS可作为HCC细胞铁凋亡的诱导性因子. cIARS与RNA结合蛋白烷基化修复同源蛋白5(alkylation repair homologous protein 5, ALKRH5)相互作用, m6A去甲基化酶作为HCC自噬通量的负调节因子. 沉默cIARS阻断ALKBH5沉默介导的BCL-2/BECN1复合物的解离. 沉默ALKBH5可抑制cIARS敲低介导的自噬通量和铁蛋白自噬. 综上所述, cIARS通过抑制alkbh5介导的自噬抑制来抑制铁凋亡, 从而促进对sorafenib的耐药性[83].
ICD是指由选定的抗癌疗法引发的先天和适应性免疫反应的激活. 这一过程是由DAMPs的释放介导的, DAMPs随后被模式识别受体识别, 导致产生特异性CD8+ T淋巴细胞, 通过免疫细胞毒性作用诱导细胞死亡[35]. 信号转导和转录激活因子3(signal transducer and activator of transcription-3, STAT3)在HCC诱导ICD中起关键作用. 抑制STAT3可通过"吃我"分子钙网蛋白易位到细胞表面, 并显著降低"不要吃我"分子白细胞表面抗原CD47的表达, 诱导HCC细胞发生ICD. 此外, 靶向STAT3可增强DC的激活, 增强HCC细胞中巨噬细胞的识别和吞噬作用, 培养抗HCC免疫记忆, 并在TME内积累关键的抗肿瘤效应CD8+ T细胞[3].
包括靶向治疗、化疗和消融在内的各种干预措施可引起HCC细胞的ICD, 从而产生抗肿瘤作用. 例如, Lenvatinib通过TLR4提高PD-L1表达, 并通过TLR3刺激细胞死亡, 从而促进HCC的ICD[84]. 奥沙利铂增强ICD相关的生物标志物, 增加CD8+ T细胞和成熟DC群体, 并减少Treg细胞[85]. 经动脉化疗栓塞与肿瘤浸润性Tregs减少、免疫衰竭减轻、细胞毒性和显著的促炎途径激活相[86]. 冷冻消融触发ICD, 激活DC, 增强HCC的抗肿瘤免疫, 可能将"冷"肿瘤转化为"热"肿瘤[87]. 这些抗肿瘤治疗策略与ICIs联合可增强对肝癌细胞的免疫细胞毒作用, 产生协同效应.
此外, 新兴的治疗方法, 如纳米材料和肿瘤新抗原疫苗, 在HCC诱导ICD的临床前试验中表现出相当大的希望, 具有显著的抗肿瘤作用. Zhao等[88]开发了一种由磷化锗(germanium phosphide, GeP)和盐酸安罗替尼(anlotinib)组成的纳米纤维贴片, 作为将分子靶向光热疗法与ICIs相结合的综合三模式治疗策略的多方面平台. 近红外光下GeP介导的温度升高增强了可控的anlotinib释放, 降低了血管内皮生长因子受体的表达, 诱导肿瘤细胞的ICD, 促进DC成熟. 同时应用ICI治疗可提高治疗效果, 最终阻止HCC的进展和转移. 此外, 新抗原疫苗联合抗PD-1通过增强CD8+组织驻留记忆T细胞浸润, 在HCC中诱导了强大的抗肿瘤反应和持续的肿瘤特异性免疫记忆, 使其成为HCC中潜在的免疫治疗靶点[89]. 因此, ICD在HCC抗肿瘤治疗中发挥着不可或缺少的作用.
铜凋亡特指细胞内铜离子浓度异常升高引起的一种细胞死亡模式, 其特征是细胞内铜的耗竭和异常积累. 研究表明[90], 铜离子与特定的蛋白质相互作用, 如铜运输蛋白CTR1和ATP7A/B, 它们对调节铜离子在细胞内的运输和分布至关重要. 过量的铜离子会损害线粒体功能, 破坏能量代谢, 最终阻止细胞维持正常的代谢状态, 导致细胞死亡. 铜凋亡主要通过细胞氧化应激、焦亡、铁下垂等途径发挥作用.
细胞中过量的铜可以通过产生ROS引起氧化应激, ROS是细胞代谢的有害副产物. 这种氧化应激源于铜离子的氧化还原循环, 特别是Cu(Ⅰ)和Cu(Ⅱ)态之间的转变, 在氧气和还原剂(如抗坏血酸和谷胱甘肽)存在的情况下, 可以催化ROS的形成. ROS的积累可导致脂质过氧化、蛋白质损伤, 最终通过细胞凋亡或坏死导致细胞死亡[91]. 表明, HCC患者血清铜离子水平明显升高, 这可能与肿瘤的侵袭性及其预后密切相关.
在肝癌中, 升高的铜浓度与肝癌细胞的生长、迁移和侵袭增加有关. 高细胞外铜水平可以使肝细胞对转化敏感, 这表明铜可能在代谢相关脂肪性肝病和肝硬化到HCC的进展中发挥作用. 铜中毒的机制涉及三羧酸循环中铜与脂肪酰化蛋白的结合, 导致这些蛋白的聚集和随后的蛋白质毒性应激. 这一过程导致铁硫(iron-sulfur, Fe-S)簇蛋白的下调, 而Fe-S簇蛋白对包括线粒体呼吸在内的各种细胞功能至关重要. 这些蛋白质的丢失导致铜超载的毒性作用, 最终导致细胞死亡[92]. 一项研究构建了一个基于铜硫核糖核酸的预后特征, 发现这些lncRNAs与HCC患者的免疫微环境和治疗反应相关. 这一特征能够根据患者的生存可能性将其分为高风险和低风险组, 表明相关途径可以用于预后评估和治疗策略[93,94]. 此外, 铜转运体的表达, 如溶质载体家族31成员1和铜离子转运ATP酶铜转运α(ATPase copper transporting alpha, ATP7A), 在HCC中发生改变. 特别是, ATP7A的表达在癌组织中经常上调, 这表明肝癌细胞可能通过增强其铜的摄取和输出机制来适应高铜水平. 这种适应可以导致对铜诱导的毒性的抵抗, 允许癌细胞增殖[95]. 综上所述, 铜凋亡(cuprotosis)通过影响细胞代谢和存活途径在肝癌细胞增殖中起关键作用.
Cuprotosis在HCC中的作用仍在探索中, 但初步研究表明, 它可能对预后和治疗策略具有重要意义. 最近的研究已经确定了与cuprotosis相关的特异性lncRNAs, 可以作为HCC的预后标志物. HCC组织中铜浓度经常升高, 这一事实突出了铜调控与癌症进展之间的联系. 这种积累可以促进肿瘤的发展和扩散, 将铜定位为可能的治疗靶点. 铜螯合剂和离子载体作为潜在的治疗选择的研究越来越受到关注, 因为这些药物可能通过触发癌细胞中的铜沉降来抑制肿瘤的生长. 例如, 铜离子载体在临床前研究中显示出前景, 表明控制铜水平可能是HCC治疗的可行策略[96].
在HCC中, 免疫微环境在肿瘤的发生发展中起着至关重要的作用. 最近的研究表明[97], 铜凋亡与TME内免疫细胞浸润的变化有关. 例如, HCC中不同亚型的铜质增生调节已被确定, 揭示了与患者预后相关的不同免疫细胞浸润模式[97]. 高风险人群以铜裂相关基因表达升高为特征, 表现出更多的免疫和基质细胞浸润, 这通常与较差的预后相关. 此外, 还探讨了铜质增生与免疫检查点通路之间的关系. 免疫检查点分子, 如PD-L1的表达在HCC患者的高危组和低危组之间存在显著差异, 提示cuprotosis可能影响免疫治疗的疗效[98]. 免疫抑制细胞的存在, 如调节性T细胞(Tregs)和髓源性抑制细胞, 在HCC的TME中经常升高, 有助于形成促进肿瘤生长和转移的免疫抑制环境[99]. 这种免疫抑制环境会阻碍免疫检查点抑制剂的有效性, 而免疫检查点抑制剂也越来越多地用于HCC治疗. 铜稳态与免疫反应之间的相互作用也至关重要. 铜是一种必需的微量元素, 可以调节多种免疫功能, 包括免疫细胞的激活和分化. 铜水平失调可导致免疫反应改变, 潜在地促进肿瘤发生. 例如, 铜缺乏已被证明会损害先天免疫细胞的功能, 而过量的铜可以增强某些免疫细胞群的免疫抑制能力. 铜的这种双重作用强调了其在HCC和免疫微环境中的复杂性.
综上所述, 在HCC中, 铜凋亡是细胞死亡的重要机制, 与免疫微环境密切相关. 铜浓度的调节与铜凋亡相关基因的表达可以影响免疫细胞的浸润并塑造肿瘤的整体免疫环境. 对这些关系的深入了解可以为靶向治疗的创建提供重要的见解, 并提高对HCC患者的免疫治疗的有效性. 需要进一步的研究来阐明铜凋亡影响免疫微环境的具体机制, 并确定利用这一信息改善HCC临床结果的可能治疗方法.
铜水平升高与包括HCC在内的各种恶性肿瘤有关, 它们有助于肿瘤进展和治疗耐药性. 铜影响治疗抗性的关键机制之一是通过其对细胞信号通路的影响. 例如, 已知铜与参与细胞增殖和存活的几种蛋白质相互作用. 在HCC中, 高水平的铜可以促进癌基因的表达, 如原癌基因MYC, 这与肿瘤细胞增殖和侵袭性增加有关. 这种相互作用表明, 铜可能会增强HCC细胞的恶性特征, 使其对治疗剂更具抵抗力[100]. 此外, 铜还参与了自噬的调节, 这一过程可能导致耐药性. 研究表明[101], 铜可以调节HCC细胞的自噬反应, 这可能有助于这些细胞在应激条件下存活, 它可能促进自噬, 从而增加耐药性.
泛凋亡(PANoptosis)是2019年由美国学者Malireddi等提出的一种全新程序性死亡方式. 泛凋亡受到PANoptosome(泛凋亡体)复合物的调控, 具有细胞焦亡(pyroptosis)、凋亡(apoptosis)和/或坏死性凋亡(necroptosis)的关键特征, 这也是PANoptosis术语中"P"、"A"和"N"的来源, 但泛凋亡却不能用这3种PCD途径单独解释. 以往的研究中, 一般认为凋亡、焦亡、坏死性凋亡三者都是独立运行的, 但是随着研究的深入, 越来越多的研究结果表明这三者之间存在着某种串扰, 它们之间可以相互交叉调节. 如: 凋亡执行者Caspase-3和Caspase-7可以通过氨基端分裂灭活GSDMD, 还可以裂解GSDME, 使细胞死亡的形态由凋亡转变为焦亡; 坏死性凋亡的执行和MLKL孔的形成可通过膜损伤激活细胞凋亡. 这些发现促成了PANoptosis(泛凋亡)概念的建立[102].
由此可见PANoptosis是一种独特的、免疫调节形式的PCD, 它是一种协调的PCD机制, 集焦亡、凋亡和坏死性凋亡于一体. PANoptosis是PCD的一种炎症型, 可由TNF和干扰素-γ诱导, 可能引发细胞因子风暴[103]. 它可以通过多种细胞死亡途径协同消灭肿瘤细胞, 同时激活抗肿瘤免疫反应, 在癌症治疗中具有重要的潜力[104]. 在HCC中, DNA酶Ⅰ样蛋白3(deoxyribonuclease 1 like 3, DNASE1L3)高表达的肿瘤细胞通过激活黑色素瘤2通路诱导PANoptosis, 从而促进抗肿瘤免疫的激活[105]. 此外, PANoptos靶向药物联合抗pd-1治疗在胶质瘤模型中显示出很强的协同作用. 在HCC中, DNASE1L3高表达的肿瘤细胞通过激活黑色素瘤2通路诱导PANoptosis, 从而促进抗肿瘤免疫的激活[106]. 然而, HCC PANoptosis与TME之间的关系尚不清楚. 因此对PANoptosis在HCC TME中的作用进行深入的多组学分析有望为HCC患者的临床治疗提供新的策略.
TME在影响治疗反应和预后中起着关键作用. TME由肿瘤细胞和各种相互作用的细胞类型组成, 包括免疫细胞和基质细胞, 如TAM[107]、癌症相关成纤维细胞(cancer-related fibroblasts, CAFs)[108]和肿瘤内皮细胞(endothelial cells, ECs). 这些细胞类型与肿瘤的进展、侵袭和转移密切相关. TME细胞的特定亚型与癌症的治疗结果密切相关[109]. 例如, 巨噬细胞是TME中最常见的免疫细胞, 通过血管生成和癌细胞重塑等机制促进肿瘤进展[110]. CAFs通过多种途径支持免疫逃避[111], 而ECs促进血管生成和肿瘤转移[112]. 尽管有这些见解, 这些细胞簇在HCC PANoptosis过程中的确切作用仍不清楚. 因此, 揭示TME中不同细胞类型之间的相互作用对于推进HCC的科学认识和临床治疗策略至关重要[113].
免疫细胞在抗肿瘤免疫中的重要作用也被广泛认识. 因此, 有可能是免疫细胞数量和功能的减少导致了高危疾病患者的不良预后. TIDE评分作为免疫治疗应答的指标发挥了至关重要的作用[114,115]. 研究表明[113], 与高风险类别相比, 低风险类别的TIDE评分明显降低. 结果表明, 与高危HCC患者相比, 低危HCC患者对免疫治疗的反应可能更高. 此外, 该研究的实际意义还包括为HCC患者的免疫治疗和化疗的临床实施提供指导, 从而更深入地了解PANoptosis在HCC中的作用.
TME中肿瘤细胞与多种免疫细胞的相互作用对肿瘤的发生发展至关重要. 免疫细胞通过分泌各种因子与肿瘤细胞进行串扰, 帮助形成这一过程[116]. 先前的研究表明, 单细胞RNA测序(single-cell RNA sequencing, scRNA-seq)在评估TME方面表现出出色的能力, 能够描述人类HCC中存在的复杂免疫景观和细胞间相互作用. Tang等[117]利用scRNA-seq技术分析了15例Ⅲ期和Ⅳ期肝癌患者的免疫景观, 发现FABP1在Ⅲ期HCC组织的TAM中过表达, 通过与TAM中的PPARG/CD36相互作用促进HCC的免疫逃逸. 这些发现有助于更深入地了解与肿瘤复发相关的免疫逃逸机制.
肿瘤免疫治疗中, 促炎细胞因子如干扰素和肿瘤坏死因子可以起到双刃剑的作用. 最初, 它们可以增强免疫反应, 促进肿瘤清除, 但随后, 它们可以通过慢性炎症抑制免疫反应. 例如, 干扰素信号可以诱导非小细胞肺癌和其他癌症类型中与耐药相关的干扰素刺激基因的高表达[118,119]. 研究表明[120], 在HCC中, 脂肪酸通过脂肪酸β-氧化转化为乙酰辅酶A, 然后通过氧化磷酸化为肿瘤细胞的增殖和转移提供能量支持. 然而, 在EC中, 脂肪酸β-氧化产生的乙酰辅酶A主要用于与碳供体底物结合, 促进脱氧核糖核苷酸三磷酸的合成, 从而为EC中DNA合成提供必要的物质基础, 这一过程对细胞增殖和修复至关重要. 值得注意的是, 功能分析结果显示APO+ ECs的脂质和糖代谢明显上调. 这表明APO+ ECs可能通过调节脂肪酸的摄取、氧化和代谢产物的产生来影响HCC细胞的增殖. 此外, 内皮细胞的配体-受体对分析显示淀粉样前体蛋白-B细胞、单核/巨噬细胞、树突状细胞、朗格汉斯细胞及胸腺上皮细胞等多种免疫细胞的标志物, 同时也在部分上皮细胞和小胶质细胞中表达淀粉样前体蛋白通讯频率显著上调. 此外, 利用免疫荧光技术, 发现APO+ ECs家族中过表达载脂蛋白H基因, 并将转染后的人脐静脉内皮细胞(HUVEC细胞)与肝癌Huh-7和HCCLM3细胞在上下两层用Transwell腔室共培养. 结果表明, 与未共培养的Huh-7和HCCLM3细胞相比, 共培养的Huh-7和HCCLM3细胞具有明显的增殖抑制作用[108,113].
研究表明[121], 预后模型在预测HCC患者预后方面具有明显优势. 因此, 构建并验泛凋亡相关基因预后模型, 利用多数据集评估患者HCC诊断后的预后, 有助于指导临床决策.
Wang等[122]研究中, 从癌症基因组图谱(The Cancer Genome Atlas, TCGA)和国际肿瘤基因组协会(International Cancer Genome Consortium, ICGC)中获得HCC相关数据集, 随后采用随机分配的方法将肝癌基因组图谱-HCC划分为训练组和测试组. 作为努力发现由六个基因组成的预测特征的一部分, 使用TCGA训练数据集进行了单变量Cox回归和LASSO回归分析. 采用TCGA-test、TCGA-all和ICGC-LI-JP数据集对PRG特征预后进行评价. 为了增强PRG的特征功能, 开发了一种新的诺谟图(列线图, nomogram)结合了HCC患者的临床病理特征和风险评分. 校准曲线显示出很强的线性拟合, 表明nomogram对预测预后评估的能力.
最新报告创建的PRG标记与HCC患者的预后有显著相关性. 该特征包括6个基因, 特别是细胞色素P450家族成员26B1(CYP26B1)、细胞骨架相关蛋白2(CKAP2)、SLAM家族中的一种自配体受体(SLAMF6)、S100钙结合蛋白A9(S100A9)、白细胞介素 7 受体(IL7R)和含三联基元54重组蛋白(TRIM54), 它们与不同形式的癌症广泛相关. 先前研究发现CYP26B1基因在槟榔饮诱导的口腔鳞状细胞癌发病机制中有新的参与. 研究表明[123], S100A9-CXCL12信号轴的激活促进了BRCA1突变乳腺癌中免疫抑制微环境的发展, 这与对免疫治疗药物的耐药性有关. 在食管鳞状细胞癌中, Kim等[124]提供的证据表明, 组蛋白去乙酰化酶抑制剂通过调节乙酰化的fox01来抑制致癌的IL7R. 然而, 这些基因对HCC的贡献水平仍未得到充分了解.
总之, 目前已经成功地利用PANoptosis开发了一个分子簇和预后特征, 这对生存预测、免疫治疗和临床治疗指导具有重要意义.
炎症和细胞异常死亡是慢性肝病发展为HCC的关键因素. 鉴于调控细胞死亡的信号通路的复杂性, 仍然需要进一步的研究来澄清基于抑制关键分子, 如受体相互作用丝氨酸/苏氨酸蛋白激酶1或caspase-8的实验所获得的相互矛盾的结果. 根据肝脏疾病的分期, 靶向细胞死亡可能是一种有益的治疗策略. 例如, 细胞死亡抑制剂可以通过限制细胞损伤和炎症来预防早期HCC的发展, 从而最大限度地减少对TME的影响. 然而, 抗凋亡策略可能对晚期HCC无效, 在晚期HCC中, 抑制细胞死亡也会促进肿瘤生长. 在这种情况下, 利用促凋亡/坏死途径的细胞毒性与目前的化疗和/或免疫调节药物联合使用, 也可能是一种潜在的有趣的治疗方法, 以提高患者对HCC治疗的敏感性.
众所周知, 促炎肝微环境促进转移前生态位. 肿瘤及其周围区域富含非恶性细胞, 如CAFs、TAM和肿瘤相关内皮细胞, 它们促进炎症、血管生成和纤维化进展. 同样, 巨噬细胞极化有助于HSC活化和肝窦内皮细胞的毛细血管化. 进行性细胞外基质沉积和细胞窗孔丧失限制了氧气和营养物质的供应, 从而引发肝细胞凋亡, 随后引发慢性炎症. 此外, 非实质细胞和肿瘤细胞之间存在动态相互作用, 可能改变肝肿瘤的行为和侵袭性. 因此, 需要更好地了解基质成分与癌细胞之间的相互作用, 以及所涉及的不同信号通路, 才能全面了解肝脏的整体致癌过程.
抗肿瘤免疫不仅可以防止肿瘤的发生, 而且是肿瘤免疫治疗成功的前提. 越来越多的证据一致表明, 基于热解法的治疗策略可以与免疫治疗相结合, 以改善癌症的全身控制.
诱导肿瘤细胞焦亡已被证明可以增强肿瘤的免疫原性, 通过吸引更多的抗肿瘤淋巴细胞, 使肿瘤"冷"变"热". 最近的研究表明, 包括化疗和靶向治疗在内的常规治疗可以逆转肿瘤细胞周围的免疫抑制微环境, 通过诱导肿瘤细胞的热噬细胞死亡来重建局部或全身的抗肿瘤免疫. 除了直接杀伤肿瘤细胞外, 化疗和靶向治疗有可能通过诱导ICD诱导局部和全身免疫反应. 诱导肿瘤细胞焦亡可为恢复抗肿瘤免疫提供抗原来源. 据推测, 通过化疗、放疗或靶向治疗"恢复"宿主抗肿瘤免疫是在给予治疗方式后肿瘤完全消退的必要条件. 另一方面, 化疗和放疗均可引起免疫细胞或造血细胞焦亡, 导致抗肿瘤免疫功能受损. 在这种情况下, 通过防止抗癌治疗引起的免疫细胞热噬细胞死亡来减少常规治疗的副作用是至关重要的. 需要深入的研究来开发新的策略, 可以特异性地激活肿瘤细胞的焦亡, 但不损害免疫系统. 为此, 通过激活GSDME特异性诱导癌细胞焦亡可能是一种很有希望的激发抗肿瘤免疫的策略. 启动子DNA的高甲基化使人类癌症中GSDME的转录沉默. 未来的研究需要恢复GSDME在肿瘤细胞中的表达, 并开发特异性的GSDME激动剂.
在HCC联合治疗中, 铁下垂被抑制, 凋亡和坏死上调占主导地位, 核中NF-κB的表达在所有治疗中都被抑制, 联合治疗通过PCD和NF-κB信号修饰显示出附加的抗肿瘤作用.
焦亡靶向治疗与化疗有相似之处, 但副作用更小, 是一种很有前途的抗肿瘤免疫治疗方法. 虽然焦亡可以增强抗肿瘤免疫, 但它的双重性质也可能带来缺点. 在抗肿瘤治疗中使用焦亡的主要好处是它有可能通过提高局部促炎细胞因子和肿瘤抗原来增加肿瘤的免疫原性, 使肿瘤更容易被检测到, 更容易受到免疫攻击. 然而, 高水平的促炎因子可导致过度炎症, 潜在地引发对患者有害的全身炎症反应. 不受控制的焦亡激活也可能增加对感染的易感性, 并可能通过为癌细胞增殖和免疫逃避创造有利条件, 无意中促进肿瘤的生长和转移.
未来的研究应探讨GSDM表达、免疫状态和TME等因素如何影响焦亡结局. 这包括检查焦亡与其他细胞死亡途径(如凋亡、坏死和铁下垂)之间的相互作用, 以及这些相互作用如何影响抗肿瘤免疫反应.
PANoptosome是由一种称为PANoptosome的细胞质多蛋白复合物调节的, 它可以同时涉及三种PCD模式, 包括焦亡、凋亡和坏死. PANoptosome由凋亡关键调控因子caspase-8、焦亡成分caspase-1和caspase-11以及坏死成分RIPK1和RIPK3组成, 将三种PCD机制整合为一个统一的机制.
HCC PANoptosis相关的分子和免疫特性的研究为肝癌PANoptosis提供了新的认识, 后续的研究有望阐明更多潜在的PANoptosis分子机制, 从而为癌症的预防和治疗提供更多证据. 目前, HCC PANoptosis的深入机制尚未见报道.
总之, PCD与HCC之间具有错综复杂的联系, 但两者之间的关系直至目前为止尚未完全阐明. 因此深入探讨HCC靶向PCD治疗, 提高HCC综合治疗能力具有重大现实和远景的意义.
| 1. | Jose A, Bavetta MG, Martinelli E, Bronte F, Giunta EF, Manu KA. Hepatocellular Carcinoma: Current Therapeutic Algorithm for Localized and Advanced Disease. J Oncol. 2022;2022:3817724. [PubMed] [DOI] |
| 2. | Heimbach JK, Kulik LM, Finn RS, Sirlin CB, Abecassis MM, Roberts LR, Zhu AX, Murad MH, Marrero JA. AASLD guidelines for the treatment of hepatocellular carcinoma. Hepatology. 2018;67:358-380. [PubMed] [DOI] |
| 3. | Wu X, Cao J, Wan X, Du S. Programmed cell death in hepatocellular carcinoma: mechanisms and therapeutic prospects. Cell Death Discov. 2024;10:356. [PubMed] [DOI] |
| 4. | Park W, Wei S, Kim BS, Kim B, Bae SJ, Chae YC, Ryu D, Ha KT. Diversity and complexity of cell death: a historical review. Exp Mol Med. 2023;55:1573-1594. [PubMed] [DOI] |
| 5. | Liu X, Nie L, Zhang Y, Yan Y, Wang C, Colic M, Olszewski K, Horbath A, Chen X, Lei G, Mao C, Wu S, Zhuang L, Poyurovsky MV, James You M, Hart T, Billadeau DD, Chen J, Gan B. Actin cytoskeleton vulnerability to disulfide stress mediates disulfidptosis. Nat Cell Biol. 2023;25:404-414. [PubMed] [DOI] |
| 6. | Kerr JF, Wyllie AH, Currie AR. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. Br J Cancer. 1972;26:239-257. [PubMed] [DOI] |
| 7. | Singh R, Letai A, Sarosiek K. Regulation of apoptosis in health and disease: the balancing act of BCL-2 family proteins. Nat Rev Mol Cell Biol. 2019;20:175-193. [PubMed] [DOI] |
| 8. | Schneider AT, Gautheron J, Feoktistova M, Roderburg C, Loosen SH, Roy S, Benz F, Schemmer P, Büchler MW, Nachbur U, Neumann UP, Tolba R, Luedde M, Zucman-Rossi J, Panayotova-Dimitrova D, Leverkus M, Preisinger C, Tacke F, Trautwein C, Longerich T, Vucur M, Luedde T. RIPK1 Suppresses a TRAF2-Dependent Pathway to Liver Cancer. Cancer Cell. 2017;31:94-109. [PubMed] [DOI] |
| 9. | Xie C, Zhang LZ, Chen ZL, Zhong WJ, Fang JH, Zhu Y, Xiao MH, Guo ZW, Zhao N, He X, Zhuang SM. A hMTR4-PDIA3P1-miR-125/124-TRAF6 Regulatory Axis and Its Function in NF kappa B Signaling and Chemoresistance. Hepatology. 2020;71:1660-1677. [PubMed] [DOI] |
| 10. | Fernando J, Sancho P, Fernández-Rodriguez CM, Lledó JL, Caja L, Campbell JS, Fausto N, Fabregat I. Sorafenib sensitizes hepatocellular carcinoma cells to physiological apoptotic stimuli. J Cell Physiol. 2012;227:1319-1325. [PubMed] [DOI] |
| 11. | Wang HC, Haung LY, Wang CJ, Chao YJ, Hou YC, Yen CJ, Shan YS. Tumor-associated macrophages promote resistance of hepatocellular carcinoma cells against sorafenib by activating CXCR2 signaling. J Biomed Sci. 2022;29:99. [PubMed] [DOI] |
| 12. | Fernández-Tussy P, Rodríguez-Agudo R, Fernández-Ramos D, Barbier-Torres L, Zubiete-Franco I, Davalillo SL, Herraez E, Goikoetxea-Usandizaga N, Lachiondo-Ortega S, Simón J, Lopitz-Otsoa F, Juan VG, McCain MV, Perugorria MJ, Mabe J, Navasa N, Rodrigues CMP, Fabregat I, Boix L, Sapena V, Anguita J, Lu SC, Mato JM, Banales JM, Villa E, Reeves HL, Bruix J, Reig M, Marin JJG, Delgado TC, Martínez-Chantar ML. Anti-miR-518d-5p overcomes liver tumor cell death resistance through mitochondrial activity. Cell Death Dis. 2021;12:555. [PubMed] [DOI] |
| 13. | Wu X, Nagy LE, Gautheron J. Mediators of necroptosis: from cell death to metabolic regulation. EMBO Mol Med. 2024;16:219-237. [PubMed] [DOI] |
| 14. | Mohammed S, Thadathil N, Selvarani R, Nicklas EH, Wang D, Miller BF, Richardson A, Deepa SS. Necroptosis contributes to chronic inflammation and fibrosis in aging liver. Aging Cell. 2021;20:e13512. [PubMed] [DOI] |
| 15. | Mohammed S, Nicklas EH, Thadathil N, Selvarani R, Royce GH, Kinter M, Richardson A, Deepa SS. Role of necroptosis in chronic hepatic inflammation and fibrosis in a mouse model of increased oxidative stress. Free Radic Biol Med. 2021;164:315-328. [PubMed] [DOI] |
| 16. | Vucur M, Ghallab A, Schneider AT, Adili A, Cheng M, Castoldi M, Singer MT, Büttner V, Keysberg LS, Küsgens L, Kohlhepp M, Görg B, Gallage S, Barragan Avila JE, Unger K, Kordes C, Leblond AL, Albrecht W, Loosen SH, Lohr C, Jördens MS, Babler A, Hayat S, Schumacher D, Koenen MT, Govaere O, Boekschoten MV, Jörs S, Villacorta-Martin C, Mazzaferro V, Llovet JM, Weiskirchen R, Kather JN, Starlinger P, Trauner M, Luedde M, Heij LR, Neumann UP, Keitel V, Bode JG, Schneider RK, Tacke F, Levkau B, Lammers T, Fluegen G, Alexandrov T, Collins AL, Nelson G, Oakley F, Mann DA, Roderburg C, Longerich T, Weber A, Villanueva A, Samson AL, Murphy JM, Kramann R, Geisler F, Costa IG, Hengstler JG, Heikenwalder M, Luedde T. Sublethal necroptosis signaling promotes inflammation and liver cancer. Immunity. 2023;56:1578-1595.e8. [PubMed] [DOI] |
| 17. | Wu L, Zhang X, Zheng L, Zhao H, Yan G, Zhang Q, Zhou Y, Lei J, Zhang J, Wang J, Xin R, Jiang L, Peng J, Chen Q, Lam SM, Shui G, Miao H, Li Y. RIPK3 Orchestrates Fatty Acid Metabolism in Tumor-Associated Macrophages and Hepatocarcinogenesis. Cancer Immunol Res. 2020;8:710-721. [PubMed] [DOI] |
| 18. | Lee SY, Kim S, Song Y, Kim N, No J, Kim KM, Seo HR. Sorbitol dehydrogenase induction of cancer cell necroptosis and macrophage polarization in the HCC microenvironment suppresses tumor progression. Cancer Lett. 2022;551:215960. [PubMed] [DOI] |
| 19. | Nicolè L, Sanavia T, Cappellesso R, Maffeis V, Akiba J, Kawahara A, Naito Y, Radu CM, Simioni P, Serafin D, Cortese G, Guido M, Zanus G, Yano H, Fassina A. Necroptosis-driving genes RIPK1, RIPK3 and MLKL-p are associated with intratumoral CD3(+) and CD8(+) T cell density and predict prognosis in hepatocellular carcinoma. J Immunother Cancer. 2022;10:e004031. [PubMed] [DOI] |
| 20. | Cheng Y, Zhang Z, Gao P, Lai H, Zhong W, Feng N, Yang Y, Yu H, Zhang Y, Han Y, Dong J, He Z, Huang R, Zhai Q. AAV induces hepatic necroptosis and carcinoma in diabetic and obese mice dependent on Pebp1 pathway. EMBO Mol Med. 2023;15:e17230. [PubMed] [DOI] |
| 21. | Saber S, Hasan AM, Mohammed OA, Saleh LA, Hashish AA, Alamri MMS, Al-Ameer AY, Alfaifi J, Senbel A, Aboregela AM, Khalid TBA, Abdel-Reheim MA, Cavalu S. Ganetespib (STA-9090) augments sorafenib efficacy via necroptosis induction in hepatocellular carcinoma: Implications from preclinical data for a novel therapeutic approach. Biomed Pharmacother. 2023;164:114918. [PubMed] [DOI] |
| 22. | Pomlok K, Pata S, Kulaphisit M, Pangnuchar R, Wipasa J, Smith DR, Kasinrerk W, Lithanatudom P. An IgM monoclonal antibody against domain 1 of CD147 induces non-canonical RIPK-independent necroptosis in a cell type specific manner in hepatocellular carcinoma cells. Biochim Biophys Acta Mol Cell Res. 2022;1869:119295. [PubMed] [DOI] |
| 23. | Lan W, Santofimia-Castaño P, Xia Y, Zhou Z, Huang C, Fraunhoffer N, Barea D, Cervello M, Giannitrapani L, Montalto G, Peng L, Iovanna J. Targeting NUPR1 with the small compound ZZW-115 is an efficient strategy to treat hepatocellular carcinoma. Cancer Lett. 2020;486:8-17. [PubMed] [DOI] |
| 24. | Tian H, Shang H, Chen Y, Wu B, Wang C, Wang X, Cheng W. Sonosensitizer Nanoplatforms Augmented Sonodynamic Therapy-Sensitizing Shikonin-Induced Necroptosis Against Hepatocellular Carcinoma. Int J Nanomedicine. 2023;18:7079-7092. [PubMed] [DOI] |
| 25. | Huang C, Li J, Wu R, Li Y, Zhang C. Targeting pyroptosis for cancer immunotherapy: mechanistic insights and clinical perspectives. Mol Cancer. 2025;24:131. [PubMed] [DOI] |
| 26. | Liu W, Peng J, Xiao M, Cai Y, Peng B, Zhang W, Li J, Kang F, Hong Q, Liang Q, Yan Y, Xu Z. The implication of pyroptosis in cancer immunology: Current advances and prospects. Genes Dis. 2023;10:2339-2350. [PubMed] [DOI] |
| 27. | Kayagaki N, Stowe IB, Lee BL, O'Rourke K, Anderson K, Warming S, Cuellar T, Haley B, Roose-Girma M, Phung QT, Liu PS, Lill JR, Li H, Wu J, Kummerfeld S, Zhang J, Lee WP, Snipas SJ, Salvesen GS, Morris LX, Fitzgerald L, Zhang Y, Bertram EM, Goodnow CC, Dixit VM. Caspase-11 cleaves gasdermin D for non-canonical inflammasome signalling. Nature. 2015;526:666-671. [PubMed] [DOI] |
| 28. | Ding J, Wang K, Liu W, She Y, Sun Q, Shi J, Sun H, Wang DC, Shao F. Pore-forming activity and structural autoinhibition of the gasdermin family. Nature. 2016;535:111-116. [PubMed] [DOI] |
| 29. | Zheng Y, Yang S, Dai W, Wang J, Bi S, Zhang X, Zheng Z, Sun Y, Wu S, Kong J. CHMP3 promotes the progression of hepatocellular carcinoma by inhibiting caspase1dependent pyroptosis. Int J Oncol. 2024;64:8. [PubMed] [DOI] |
| 30. | Yan Z, Da Q, Li Z, Lin Q, Yi J, Su Y, Yu G, Ren Q, Liu X, Lin Z, Qu J, Yin W, Liu J. Inhibition of NEK7 Suppressed Hepatocellular Carcinoma Progression by Mediating Cancer Cell Pyroptosis. Front Oncol. 2022;12:812655. [PubMed] [DOI] |
| 31. | Lu Y, Xu J, Lin H, Zhu M, Li M. Gasdermin E mediates pyroptosis in the progression of hepatocellular carcinoma: a double-edged sword. Gastroenterol Rep (Oxf). 2024;12:goae102. [PubMed] [DOI] |
| 32. | Takahashi T, Yoshioka M, Uchinami H, Nakagawa Y, Otsuka N, Motoyama S, Yamamoto Y. Hepatic Stellate Cells Play a Functional Role in Exacerbating Ischemia-Reperfusion Injury in Rat Liver. Eur Surg Res. 2019;60:74-85. [PubMed] [DOI] |
| 33. | Hu HH, Chen DQ, Wang YN, Feng YL, Cao G, Vaziri ND, Zhao YY. New insights into TGF-β/Smad signaling in tissue fibrosis. Chem Biol Interact. 2018;292:76-83. [PubMed] [DOI] |
| 34. | Liu D, Wang K, Li K, Xu R, Chang X, Zhu Y, Sun P, Han X. Ets-1 deficiency alleviates nonalcoholic steatohepatitis via weakening TGF-β1 signaling-mediated hepatocyte apoptosis. Cell Death Dis. 2019;10:458. [PubMed] [DOI] |
| 35. | Li Y, Zhang Y, Chen T, Huang Y, Zhang Y, Geng S, Li X. Role of aldosterone in the activation of primary mice hepatic stellate cell and liver fibrosis via NLRP3 inflammasome. J Gastroenterol Hepatol. 2020;35:1069-1077. [PubMed] [DOI] |
| 36. | Chen J, Chen ZJ. PtdIns4P on dispersed trans-Golgi network mediates NLRP3 inflammasome activation. Nature. 2018;564:71-76. [PubMed] [DOI] |
| 37. | Hage C, Hoves S, Strauss L, Bissinger S, Prinz Y, Pöschinger T, Kiessling F, Ries CH. Sorafenib Induces Pyroptosis in Macrophages and Triggers Natural Killer Cell-Mediated Cytotoxicity Against Hepatocellular Carcinoma. Hepatology. 2019;70:1280-1297. [PubMed] [DOI] |
| 38. | Hu J, Dong Y, Ding L, Dong Y, Wu Z, Wang W, Shen M, Duan Y. Local delivery of arsenic trioxide nanoparticles for hepatocellular carcinoma treatment. Signal Transduct Target Ther. 2019;4:28. [PubMed] [DOI] |
| 39. | Zhang X, Zhang P, An L, Sun N, Peng L, Tang W, Ma D, Chen J. Miltirone induces cell death in hepatocellular carcinoma cell through GSDME-dependent pyroptosis. Acta Pharm Sin B. 2020;10:1397-1413. [PubMed] [DOI] |
| 40. | Liang X, Liu Q, Zhu S, Li Z, Chen H, Su Z. GSDME has prognostic and immunotherapeutic significance in residual hepatocellular carcinoma after insufficient radiofrequency ablation. Transl Oncol. 2024;39:101796. [PubMed] [DOI] |
| 41. | Ye L, Wen X, Qin J, Zhang X, Wang Y, Wang Z, Zhou T, Di Y, He W. Metabolism-regulated ferroptosis in cancer progression and therapy. Cell Death Dis. 2024;15:196. [PubMed] [DOI] |
| 42. | Zheng J, Conrad M. The Metabolic Underpinnings of Ferroptosis. Cell Metab. 2020;32:920-937. [PubMed] [DOI] |
| 43. | Wu K, Yan M, Liu T, Wang Z, Duan Y, Xia Y, Ji G, Shen Y, Wang L, Li L, Zheng P, Dong B, Wu Q, Xiao L, Yang X, Shen H, Wen T, Zhang J, Yi J, Deng Y, Qian X, Ma L, Fang J, Zhou Q, Lu Z, Xu D. Creatine kinase B suppresses ferroptosis by phosphorylating GPX4 through a moonlighting function. Nat Cell Biol. 2023;25:714-725. [PubMed] [DOI] |
| 44. | Cui X, Yun X, Sun M, Li R, Lyu X, Lao Y, Qin X, Yu W. HMGCL-induced β-hydroxybutyrate production attenuates hepatocellular carcinoma via DPP4-mediated ferroptosis susceptibility. Hepatol Int. 2023;17:377-392. [PubMed] [DOI] |
| 45. | Li Y, Guo M, Qiu Y, Li M, Wu Y, Shen M, Wang Y, Zhang F, Shao J, Xu X, Zhang Z, Zheng S. Autophagy activation is required for N6-methyladenosine modification to regulate ferroptosis in hepatocellular carcinoma. Redox Biol. 2023;69:102971. [PubMed] [DOI] |
| 46. | Zhang D, Man D, Lu J, Jiang Y, Ding B, Su R, Tong R, Chen J, Yang B, Zheng S, Chen D, Wu J. Mitochondrial TSPO Promotes Hepatocellular Carcinoma Progression through Ferroptosis Inhibition and Immune Evasion. Adv Sci (Weinh). 2023;10:e2206669. [PubMed] [DOI] |
| 47. | Yang J, Xu H, Wu W, Huang H, Zhang C, Tang W, Tang Q, Bi F. Ferroptosis signaling promotes the release of misfolded proteins via exosomes to rescue ER stress in hepatocellular carcinoma. Free Radic Biol Med. 2023;202:110-120. [PubMed] [DOI] |
| 48. | Sun L, Cao H, Wang Y, Wang H. Regulating ferroptosis by non-coding RNAs in hepatocellular carcinoma. Biol Direct. 2024;19:80. [PubMed] [DOI] |
| 49. | Shu F, Xiao H, Li QN, Ren XS, Liu ZG, Hu BW, Wang HS, Wang H, Jiang GM. Epigenetic and post-translational modifications in autophagy: biological functions and therapeutic targets. Signal Transduct Target Ther. 2023;8:32. [PubMed] [DOI] |
| 50. | Wang Y, Hu J, Wu S, Fleishman JS, Li Y, Xu Y, Zou W, Wang J, Feng Y, Chen J, Wang H. Targeting epigenetic and posttranslational modifications regulating ferroptosis for the treatment of diseases. Signal Transduct Target Ther. 2023;8:449. [PubMed] [DOI] |
| 51. | Yang M, Luo H, Yi X, Wei X, Jiang DS. The epigenetic regulatory mechanisms of ferroptosis and its implications for biological processes and diseases. MedComm (2020). 2023;4:e267. [PubMed] [DOI] |
| 52. | Ensoy M, Bumin ZS, Jama HA, Cansaran-Duman D. The Regulation Role of Ferroptosis Mechanism of Anti-Cancer Drugs and Noncoding RNAs. Curr Med Chem. 2023;30:1638-1656. [PubMed] [DOI] |
| 53. | Valashedi MR, Bamshad C, Najafi-Ghalehlou N, Nikoo A, Tomita K, Kuwahara Y, Sato T, Roushandeh AM, Roudkenar MH. Non-coding RNAs in ferroptotic cancer cell death pathway: meet the new masters. Hum Cell. 2022;35:972-994. [PubMed] [DOI] |
| 54. | He F, Zhang P, Liu J, Wang R, Kaufman RJ, Yaden BC, Karin M. ATF4 suppresses hepatocarcinogenesis by inducing SLC7A11 (xCT) to block stress-related ferroptosis. J Hepatol. 2023;79:362-377. [PubMed] [DOI] |
| 55. | Bai T, Liang R, Zhu R, Wang W, Zhou L, Sun Y. MicroRNA-214-3p enhances erastin-induced ferroptosis by targeting ATF4 in hepatoma cells. J Cell Physiol. 2020;235:5637-5648. [PubMed] [DOI] |
| 56. | Lu Y, Chan YT, Tan HY, Zhang C, Guo W, Xu Y, Sharma R, Chen ZS, Zheng YC, Wang N, Feng Y. Epigenetic regulation of ferroptosis via ETS1/miR-23a-3p/ACSL4 axis mediates sorafenib resistance in human hepatocellular carcinoma. J Exp Clin Cancer Res. 2022;41:3. [PubMed] [DOI] |
| 57. | Yang H, Sun W, Bi T, Sun J, Lu Z, Li J, Wei H. ZNF8-miR-552-5p Axis Modulates ACSL4-Mediated Ferroptosis in Hepatocellular Carcinoma. DNA Cell Biol. 2023;42:336-347. [PubMed] [DOI] |
| 58. | Hu Z, Li L, Li M, Zhang X, Zhang Y, Ran J, Li L. miR-21-5p Inhibits Ferroptosis in Hepatocellular Carcinoma Cells by Regulating the AKT/mTOR Signaling Pathway through MELK. J Immunol Res. 2023;2023:8929525. [PubMed] [DOI] |
| 59. | Sun J, Liu Q, Jiang Y, Cai Z, Liu H, Zuo H. Engineered small extracellular vesicles loaded with miR-654-5p promote ferroptosis by targeting HSPB1 to alleviate sorafenib resistance in hepatocellular carcinoma. Cell Death Discov. 2023;9:362. [PubMed] [DOI] |
| 60. | Xing K, Bian X, Shi D, Dong S, Zhou H, Xiao S, Bai J, Wu W. miR-612 Enhances RSL3-Induced Ferroptosis of Hepatocellular Carcinoma Cells via Mevalonate Pathway. J Hepatocell Carcinoma. 2023;10:2173-2185. [PubMed] [DOI] |
| 61. | Cao F, Hao W, Liang W, Zeng H, Zheng J. MiR-339-5p Inhibits Ferroptosis by Promoting Autophagic Degradation of FTH1 Through Targeting ATG7 in Liver Cancer Cells. Clin Med Insights Oncol. 2024;18:11795549241244783. [PubMed] [DOI] |
| 62. | Liu M, Hu M, Liu R, Wang L, Wang J, Wang Y, Zhang R, Wang H, Liu M, Zhang Y, Wang L, Pei W, Zhang Y. Unveiling the role of APOM gene in liver cancer: Investigating the impact of hsa-miR-4489/MUC1-mediated ferroptosis on the advancement of hepatocellular carcinoma cells. Gene. 2024;925:148591. [PubMed] [DOI] |
| 63. | Shi Z, Li Z, Jin B, Ye W, Wang L, Zhang S, Zheng J, Lin Z, Chen B, Liu F, Zhang B, Ding X, Yang Z, Shan Y, Yu Z, Wang Y, Chen J, Chen Q, Roberts LR, Chen G. Loss of LncRNA DUXAP8 synergistically enhanced sorafenib induced ferroptosis in hepatocellular carcinoma via SLC7A11 de-palmitoylation. Clin Transl Med. 2023;13:e1300. [PubMed] [DOI] |
| 64. | Chen F, Li M, Wang L. LncRNA CASC11 Promotes Hepatocellular Carcinoma Progression via Upregulation of UBE2T in a m(6)A-Dependent Manner. Front Oncol. 2021;11:772671. [PubMed] [DOI] |
| 65. | Chen F, Wang L. Long noncoding RNA CASC11 suppresses sorafenib-triggered ferroptosis via stabilizing SLC7A11 mRNA in hepatocellular carcinoma cells. Discov Oncol. 2023;14:145. [PubMed] [DOI] |
| 66. | Yuan X, Wang Y, Jiao S, Gao H, Zhang M, Wang X, Zhou X, Wu C, Bao J. Identification of SLC7A11-AS1/SLC7A11 pair as a ferroptosis-related therapeutic target for hepatocellular carcinoma. J Cell Mol Med. 2024;28:e18496. [PubMed] [DOI] |
| 67. | Zhang B, Bao W, Zhang S, Chen B, Zhou X, Zhao J, Shi Z, Zhang T, Chen Z, Wang L, Zheng X, Chen G, Wang Y. LncRNA HEPFAL accelerates ferroptosis in hepatocellular carcinoma by regulating SLC7A11 ubiquitination. Cell Death Dis. 2022;13:734. [PubMed] [DOI] |
| 68. | Zong K, Lin C, Luo K, Deng Y, Wang H, Hu J, Chen S, Li R. Ferroptosis-related lncRNA NRAV affects the prognosis of hepatocellular carcinoma via the miR-375-3P/SLC7A11 axis. BMC Cancer. 2024;24:496. [PubMed] [DOI] |
| 69. | Kang X, Huo Y, Jia S, He F, Li H, Zhou Q, Chang N, Liu D, Li R, Hu Y, Zhang P, Xu A. Silenced LINC01134 Enhances Oxaliplatin Sensitivity by Facilitating Ferroptosis Through GPX4 in Hepatocarcinoma. Front Oncol. 2022;12:939605. [PubMed] [DOI] |
| 70. | Li X, Li Y, Lian P, Lv Q, Liu F. Silencing lncRNA HCG18 regulates GPX4-inhibited ferroptosis by adsorbing miR-450b-5p to avert sorafenib resistance in hepatocellular carcinoma. Hum Exp Toxicol. 2023;42:9603271221142818. [PubMed] [DOI] |
| 71. | Li J, Li Y, Wang D, Liao R, Wu Z. PLAG1 interacts with GPX4 to conquer vulnerability to sorafenib induced ferroptosis through a PVT1/miR-195-5p axis-dependent manner in hepatocellular carcinoma. J Exp Clin Cancer Res. 2024;43:143. [PubMed] [DOI] |
| 72. | Yuan J, Lv T, Yang J, Wu Z, Yan L, Yang J, Shi Y. HDLBP-stabilized lncFAL inhibits ferroptosis vulnerability by diminishing Trim69-dependent FSP1 degradation in hepatocellular carcinoma. Redox Biol. 2022;58:102546. [PubMed] [DOI] |
| 73. | Gao Y, Tong M, Wong TL, Ng KY, Xie YN, Wang Z, Yu H, Loh JJ, Li M, Ma S. Long Noncoding RNA URB1-Antisense RNA 1 (AS1) Suppresses Sorafenib-Induced Ferroptosis in Hepatocellular Carcinoma by Driving Ferritin Phase Separation. ACS Nano. 2023;17:22240-22258. [PubMed] [DOI] |
| 74. | Zhang Y, Luo M, Cui X, O'Connell D, Yang Y. Long noncoding RNA NEAT1 promotes ferroptosis by modulating the miR-362-3p/MIOX axis as a ceRNA. Cell Death Differ. 2022;29:1850-1863. [PubMed] [DOI] |
| 75. | Man Q, Zhang G, Chen X, Na SR, Bai S, Zhi H, Sun L, Pang H. EPS15-AS1 Inhibits AKR1B1 Expression to Enhance Ferroptosis in Hepatocellular Carcinoma Cells. J Cancer. 2024;15:1030-1040. [PubMed] [DOI] |
| 76. | Xu Q, Zhou L, Yang G, Meng F, Wan Y, Wang L, Zhang L. CircIL4R facilitates the tumorigenesis and inhibits ferroptosis in hepatocellular carcinoma by regulating the miR-541-3p/GPX4 axis. Cell Biol Int. 2020;44:2344-2356. [PubMed] [DOI] |
| 77. | Zhai H, Zhong S, Wu R, Mo Z, Zheng S, Xue J, Meng H, Liu M, Chen X, Zhang G, Zheng X, Du F, Li R, Zhou B. Suppressing circIDE/miR-19b-3p/RBMS1 axis exhibits promoting-tumour activity through upregulating GPX4 to diminish ferroptosis in hepatocellular carcinoma. Epigenetics. 2023;18:2192438. [PubMed] [DOI] |
| 78. | Tan YR, Jiang BH, Feng WJ, He ZL, Jiang YL, Xun Y, Wu XP, Li YH, Zhu HB. Circ0060467 sponges miR-6805 to promote hepatocellular carcinoma progression through regulating AIFM2 and GPX4 expression. Aging (Albany NY). 2024;16:1796-1807. [PubMed] [DOI] |
| 79. | Liu Y, Li J. Circular RNA 0016142 Knockdown Induces Ferroptosis in Hepatocellular Carcinoma Cells via Modulation of the MicroRNA-188-3p/Glutathione Peroxidase 4 Axis. Biochem Genet. 2024;62:333-351. [PubMed] [DOI] |
| 80. | Lyu N, Zeng Y, Kong Y, Chen Q, Deng H, Ou S, Bai Y, Tang H, Wang X, Zhao M. Ferroptosis is involved in the progression of hepatocellular carcinoma through the circ0097009/miR-1261/SLC7A11 axis. Ann Transl Med. 2021;9:675. [PubMed] [DOI] |
| 81. | Dong FL, Xu ZZ, Wang YQ, Li T, Wang X, Li J. Exosome-derived circUPF2 enhances resistance to targeted therapy by redeploying ferroptosis sensitivity in hepatocellular carcinoma. J Nanobiotechnology. 2024;22:298. [PubMed] [DOI] |
| 82. | Zhang XY, Li SS, Gu YR, Xiao LX, Ma XY, Chen XR, Wang JL, Liao CH, Lin BL, Huang YH, Lian YF. CircPIAS1 promotes hepatocellular carcinoma progression by inhibiting ferroptosis via the miR-455-3p/NUPR1/FTH1 axis. Mol Cancer. 2024;23:113. [PubMed] [DOI] |
| 83. | Liu Z, Wang Q, Wang X, Xu Z, Wei X, Li J. Circular RNA cIARS regulates ferroptosis in HCC cells through interacting with RNA binding protein ALKBH5. Cell Death Discov. 2020;6:72. [PubMed] [DOI] |
| 84. | Zhou C, Yang ZF, Sun BY, Yi Y, Wang Z, Zhou J, Fan J, Gan W, Ren N, Qiu SJ. Lenvatinib Induces Immunogenic Cell Death and Triggers Toll-Like Receptor-3/4 Ligands in Hepatocellular Carcinoma. J Hepatocell Carcinoma. 2023;10:697-712. [PubMed] [DOI] |
| 85. | Zhu H, Shan Y, Ge K, Lu J, Kong W, Jia C. Oxaliplatin induces immunogenic cell death in hepatocellular carcinoma cells and synergizes with immune checkpoint blockade therapy. Cell Oncol (Dordr). 2020;43:1203-1214. [PubMed] [DOI] |
| 86. | Pinato DJ, Murray SM, Forner A, Kaneko T, Fessas P, Toniutto P, Mínguez B, Cacciato V, Avellini C, Diaz A, Boyton RJ, Altmann DM, Goldin RD, Akarca AU, Marafioti T, Mauri FA, Casagrande E, Grillo F, Giannini E, Bhoori S, Mazzaferro V. Trans-arterial chemoembolization as a loco-regional inducer of immunogenic cell death in hepatocellular carcinoma: implications for immunotherapy. J Immunother Cancer. 2021;9:e003311. [PubMed] [DOI] |
| 87. | Qian L, Xie L, Zhu Y, Huang C, Meng Z. Potent induction of antitumor immunity by combining cryo-thermal ablation with immune checkpoint inhibitors in hepatocellular carcinoma. Liver Int. 2024;44:723-737. [PubMed] [DOI] |
| 88. | Zhao Y, Liu Y, Liu Z, Ren K, Jiao D, Ren J, Wu P, Li X, Wang Z, Han X. In Situ Nanofiber Patch Boosts Postoperative Hepatocellular Carcinoma Immune Activation by Trimodal Combination Therapy. ACS Nano. 2024;18:245-263. [PubMed] [DOI] |
| 89. | Chen H, Li Z, Qiu L, Dong X, Chen G, Shi Y, Cai L, Liu W, Ye H, Zhou Y, Ouyang J, Cai Z, Liu X. Personalized neoantigen vaccine combined with PD-1 blockade increases CD8(+) tissue-resident memory T-cell infiltration in preclinical hepatocellular carcinoma models. J Immunother Cancer. 2022;10:e004389. [PubMed] [DOI] |
| 90. | Zhu H, Zhao Y, Wang Y, Wei G, Liu J. Understanding the relationship between cuproptosis and the development of hepatocellular carcinoma: implications for targeted therapies. Front Immunol. 2025;16:1557223. [PubMed] [DOI] |
| 91. | Falcone E, Stellato F, Vileno B, Bouraguba M, Lebrun V, Ilbert M, Morante S, Faller P. Revisiting the pro-oxidant activity of copper: interplay of ascorbate, cysteine, and glutathione. Metallomics. 2023;15:mfad040. [PubMed] [DOI] |
| 92. | Tsvetkov P, Coy S, Petrova B, Dreishpoon M, Verma A, Abdusamad M, Rossen J, Joesch-Cohen L, Humeidi R, Spangler RD, Eaton JK, Frenkel E, Kocak M, Corsello SM, Lutsenko S, Kanarek N, Santagata S, Golub TR. Copper induces cell death by targeting lipoylated TCA cycle proteins. Science. 2022;375:1254-1261. [PubMed] [DOI] |
| 93. | Yuan W, Xiao JH, Zhang JS, Mao BL, Wang PZ, Wang BL. Identification of a cuproptosis and copper metabolism gene-related lncRNAs prognostic signature associated with clinical and immunological characteristics of hepatocellular carcinoma. Front Oncol. 2023;13:1153353. [PubMed] [DOI] |
| 94. | He J, Li W, Zhao W, Shen H, Chang Y, Liu B, He Q, Yu H, Wang Y, Shi L, Cai X. Potential of lncRNAs to regulate cuproptosis in hepatocellular carcinoma: Establishment and validation of a novel risk model. Heliyon. 2024;10:e24453. [PubMed] [DOI] |
| 95. | Torrez CZ, Easley A, Bouamar H, Zheng G, Gu X, Yang J, Chiu YC, Chen Y, Halff GA, Cigarroa FG, Sun LZ. STEAP2 promotes hepatocellular carcinoma progression via increased copper levels and stress-activated MAP kinase activity. Sci Rep. 2024;14:12753. [PubMed] [DOI] |
| 96. | Tang L, Wang T, Li W, Yu S, Yao S, Cheng H. Construction of cuproptosis-related lncRNAs/mRNAs model and prognostic prediction of hepatocellular carcinoma. Am J Cancer Res. 2022;12:4693-4707. [PubMed] |
| 97. | Li S, Zhu Z, Lu J, Cao W, Song F, Xiao C, Zhang P, He Z, Weng J, Xu J. Prediction of prognosis, immune infiltration, and personalized treatment of hepatocellular carcinoma by analysis of cuproptosis-related long noncoding RNAs and verification in vitro. Front Oncol. 2023;13:1159126. [PubMed] [DOI] |
| 98. | Foka P, Dimitriadis A, Karamichali E, Kochlios E, Eliadis P, Valiakou V, Koskinas J, Mamalaki A, Georgopoulou U. HCV-Induced Immunometabolic Crosstalk in a Triple-Cell Co-Culture Model Capable of Simulating Systemic Iron Homeostasis. Cells. 2021;10:2251. [PubMed] [DOI] |
| 99. | Teng KY, Han J, Zhang X, Hsu SH, He S, Wani NA, Barajas JM, Snyder LA, Frankel WL, Caligiuri MA, Jacob ST, Yu J, Ghoshal K. Blocking the CCL2-CCR2 Axis Using CCL2-Neutralizing Antibody Is an Effective Therapy for Hepatocellular Cancer in a Mouse Model. Mol Cancer Ther. 2017;16:312-322. [PubMed] [DOI] |
| 100. | Li X, Wang J, Guo Z, Ma Y, Xu D, Fan D, Dai P, Chen Y, Liu Q, Jiao J, Fan J, Wu N, Li X, Li G. Copper metabolism-related risk score identifies hepatocellular carcinoma subtypes and SLC27A5 as a potential regulator of cuproptosis. Aging (Albany NY). 2023;15:15084-15113. [PubMed] [DOI] |
| 101. | Zhang SR, Li J, Chen JX, Chen G, Chen JY, Fu HW, Zhou B. SMC4 enhances the chemoresistance of hepatoma cells by promoting autophagy. Ann Transl Med. 2022;10:1308. [PubMed] [DOI] |
| 102. | Zhu J, Huang Q, Peng X, Luo C, Liu Z, Liu D, Yuan H, Yuan R, Cheng X. Identification of molecular subtypes based on PANoptosis-related genes and construction of a signature for predicting the prognosis and response to immunotherapy response in hepatocellular carcinoma. Front Immunol. 2023;14:1218661. [PubMed] [DOI] |
| 103. | Ocansey DKW, Qian F, Cai P, Ocansey S, Amoah S, Qian Y, Mao F. Current evidence and therapeutic implication of PANoptosis in cancer. Theranostics. 2024;14:640-661. [PubMed] [DOI] |
| 104. | Liu Z, Sun L, Peng X, Zhu J, Wu C, Zhu W, Huang C, Zhu Z. PANoptosis subtypes predict prognosis and immune efficacy in gastric cancer. Apoptosis. 2024;29:799-815. [PubMed] [DOI] |
| 105. | Cai Y, Xiao H, Xue S, Li P, Zhan Z, Lin J, Song Z, Liu J, Xu W, Zhou Q, Qi S, Zhang X, Luo Z. Integrative analysis of immunogenic PANoptosis and experimental validation of cinobufagin-induced activation to enhance glioma immunotherapy. J Exp Clin Cancer Res. 2025;44:35. [PubMed] [DOI] |
| 106. | Wang J, Chen Y, Xu Y, Zhang J, Yang S, Zhou Y, Lei J, Ren R, Chen Y, Zhao H, Li Y, Yang S. DNASE1L3-mediated PANoptosis enhances the efficacy of combination therapy for advanced hepatocellular carcinoma. Theranostics. 2024;14:6798-6817. [PubMed] [DOI] |
| 107. | Güç E, Pollard JW. Redefining macrophage and neutrophil biology in the metastatic cascade. Immunity. 2021;54:885-902. [PubMed] [DOI] |
| 108. | Sahai E, Astsaturov I, Cukierman E, DeNardo DG, Egeblad M, Evans RM, Fearon D, Greten FR, Hingorani SR, Hunter T, Hynes RO, Jain RK, Janowitz T, Jorgensen C, Kimmelman AC, Kolonin MG, Maki RG, Powers RS, Puré E, Ramirez DC, Scherz-Shouval R, Sherman MH, Stewart S, Tlsty TD, Tuveson DA, Watt FM, Weaver V, Weeraratna AT, Werb Z. A framework for advancing our understanding of cancer-associated fibroblasts. Nat Rev Cancer. 2020;20:174-186. [PubMed] [DOI] |
| 109. | de Visser KE, Joyce JA. The evolving tumor microenvironment: From cancer initiation to metastatic outgrowth. Cancer Cell. 2023;41:374-403. [PubMed] [DOI] |
| 110. | Mantovani A, Allavena P, Marchesi F, Garlanda C. Macrophages as tools and targets in cancer therapy. Nat Rev Drug Discov. 2022;21:799-820. [PubMed] [DOI] |
| 111. | Cogliati B, Yashaswini CN, Wang S, Sia D, Friedman SL. Friend or foe? The elusive role of hepatic stellate cells in liver cancer. Nat Rev Gastroenterol Hepatol. 2023;20:647-661. [PubMed] [DOI] |
| 112. | Zeng Q, Mousa M, Nadukkandy AS, Franssens L, Alnaqbi H, Alshamsi FY, Safar HA, Carmeliet P. Understanding tumour endothelial cell heterogeneity and function from single-cell omics. Nat Rev Cancer. 2023;23:544-564. [PubMed] [DOI] |
| 113. | Cheng Z, Yang X, Ren Y, Wang H, Zhang Q, Lin S, Wu W, Yang X, Zheng J, Liu X, Tao X, Chen X, Qian Y, Li X. Investigating the molecular mechanisms and clinical potential of APO+ endothelial cells associated with PANoptosis in the tumor microenvironment of hepatocellular carcinoma using single-cell sequencing data. Transl Oncol. 2025;57:102402. [PubMed] [DOI] |
| 114. | Zhang C, Zhang Z, Sun N, Zhang Z, Zhang G, Wang F, Luo Y, Che Y, He J. Identification of a costimulatory molecule-based signature for predicting prognosis risk and immunotherapy response in patients with lung adenocarcinoma. Oncoimmunology. 2020;9:1824641. [PubMed] [DOI] |
| 115. | Li X, Song D, Su S, He X, Cao F, Yang C, Li K, Huang S, Li C, Wang C, Zhang A, Pang P, Zheng Y. Critical role of guanylate binding protein 5 in tumor immune microenvironment and predictive value of immunotherapy response. Front Genet. 2022;13:984615. [PubMed] [DOI] |
| 116. | Sharma P, Aaroe A, Liang J, Puduvalli VK. Tumor microenvironment in glioblastoma: Current and emerging concepts. Neurooncol Adv. 2023;5:vdad009. [PubMed] [DOI] |
| 117. | Tang W, Sun G, Ji GW, Feng T, Zhang Q, Cao H, Wu W, Zhang X, Liu C, Liu H, Huang T, Liu L, Xia Y, Wang X. Single-cell RNA-sequencing atlas reveals an FABP1-dependent immunosuppressive environment in hepatocellular carcinoma. J Immunother Cancer. 2023;11:e007030. [PubMed] [DOI] |
| 118. | Qiu J, Xu B, Ye D, Ren D, Wang S, Benci JL, Xu Y, Ishwaran H, Beltra JC, Wherry EJ, Shi J, Minn AJ. Cancer cells resistant to immune checkpoint blockade acquire interferon-associated epigenetic memory to sustain T cell dysfunction. Nat Cancer. 2023;4:43-61. [PubMed] [DOI] |
| 119. | Memon D, Schoenfeld AJ, Ye D, Fromm G, Rizvi H, Zhang X, Keddar MR, Mathew D, Yoo KJ, Qiu J, Lihm J, Miriyala J, Sauter JL, Luo J, Chow A, Bhanot UK, McCarthy C, Vanderbilt CM, Liu C, Abu-Akeel M, Plodkowski AJ, McGranahan N, Łuksza M, Greenbaum BD, Merghoub T, Achour I, Barrett JC, Stewart R, Beltrao P, Schreiber TH, Minn AJ, Miller ML, Hellmann MD. Clinical and molecular features of acquired resistance to immunotherapy in non-small cell lung cancer. Cancer Cell. 2024;42:209-224.e9. [PubMed] [DOI] |
| 120. | Liu Y, Wu Z, Li Y, Chen Y, Zhao X, Wu M, Xia Y. Metabolic reprogramming and interventions in angiogenesis. J Adv Res. 2025;70:323-338. [PubMed] [DOI] |
| 121. | Gao Z, Chen J, Zhou Y, Deng P, Sun L, Qi J, Zhang P. A Novel Metabolism-Related Gene Signature for Predicting the Prognosis of HBV-Infected Hepatocellular Carcinoma. J Oncol. 2022;2022:2391265. [PubMed] [DOI] |
| 122. | Wang X, Qu L, Wen Z, Wu Z, Xue Y, Yang X, Yuan Z, Guo Y, Lin X. PANoptosis-related genes in the prognosis and immune landscape of hepatocellular carcinoma. Immunol Res. 2025;73:51. [PubMed] [DOI] |
| 123. | Li J, Shu X, Xu J, Su SM, Chan UI, Mo L, Liu J, Zhang X, Adhav R, Chen Q, Wang Y, An T, Zhang X, Lyu X, Li X, Lei JH, Miao K, Sun H, Xing F, Zhang A, Deng C, Xu X. S100A9-CXCL12 activation in BRCA1-mutant breast cancer promotes an immunosuppressive microenvironment associated with resistance to immunotherapy. Nat Commun. 2022;13:1481. [PubMed] [DOI] |
| 124. | Kim MJ, Choi SK, Hong SH, Eun JW, Nam SW, Han JW, You JS. Oncogenic IL7R is downregulated by histone deacetylase inhibitor in esophageal squamous cell carcinoma via modulation of acetylated FOXO1. Int J Oncol. 2018;53:395-403. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 山东省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁