修回日期: 2025-08-01
接受日期: 2025-09-29
在线出版日期: 2025-10-28
丝氨酸蛋白酶抑制剂家族E成员1(serine protease inhibitor family E member 1, SERPINE1)蛋白表达与多种癌细胞的增值、迁移和侵袭密切相关, 目前缺乏对消化系统疾病的系统研究和报道.
基于生物信息技术探究SERPINE1调节消化系统癌症的内在机制.
使用基因表达谱交互分析(gene expression profile analysis)进行SERPINE1表达分析, 并使用Kaplan-Meier分析分析SERPINE1在临床预后中的潜力.
SERPINE1表达与CD14、CD163以及CCL20相关, SERPINE1高表达可能通过促进巨噬细胞介导炎症, 从而参与消化系统癌症的发生和发展.
SERPINE1高表达可能通过促进巨噬细胞介导炎症, 在消化系统癌症炎症和纤维化的调节中发挥重要作用.
核心提要: 丝氨酸蛋白酶抑制剂家族E成员1(serine protease inhibitor family E member 1, SERPINE1)表达与CD14、CD163以及CCL20相关, SERPINE1高表达可能通过促进巨噬细胞介导炎症, 从而参与消化系统癌症的发生和发展.
引文著录: 保亚明, 孟令真, 汤武亨, 潘赐明, 曹春宇. 消化系统癌症中SERPINE1的表达、预后和机制研究. 世界华人消化杂志 2025; 33(10): 838-846
Revised: August 1, 2025
Accepted: September 29, 2025
Published online: October 28, 2025
The protein expression of serine protease inhibitor family E member 1 (SERPINE1) is closely related to the proliferation, migration, and invasion of various cancer cell types. Currently, there is a lack of systematic research and reports on SERPINE1 in digestive system diseases.
To explore the underlying mechanism by which SERPINE1 regulates digestive system cancer using bioinformatic analyses.
SERPINE1 expression was analyzed using Gene Expression Profiling Interactive Analysis, and the prognostic potential of SERPINE1 was analyzed using Kaplan-Meier analysis.
SERPINE1 expression was related to CD14, CD163, and CCL20. High expression of SERPINE1 may be involved in the occurrence and development of digestive system cancer by promoting macrophage mediated inflammation.
Macrophages play an important role in the regulation of inflammation and fibrosis in digestive system cancer by producing pro-inflammatory cytokines and pro-fibrotic factors.
- Citation: Bao YM, Meng LZ, Tang WH, Pan CM, Cao CY. Expression, prognostic potential, and regulatory mechanism of SERPINE1 in digestive system cancer. Shijie Huaren Xiaohua Zazhi 2025; 33(10): 838-846
- URL: https://www.wjgnet.com/1009-3079/full/v33/i10/838.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i10.838
消化系统癌症负担日益增长, 从2010/2019消化系统的患病率、死亡负担、伤残负担呈现上升趋势[1], 随着自然环境和生活节奏的变化[2], 人体消化系统处于负荷状态, 这增加了癌变的概率. 除此之外, 吸烟、焦虑和过度饮酒都会增加消化系统炎症和癌变[3,4]. 据2020年全球最新癌症负担数据显示: 2020年全球新发癌症病例1929万例, 其中中国新发癌症456.8万人, 占全球23.7%; 2020年中国确诊的所有癌症病例中, 41.5%为消化系统癌症. 丝氨酸蛋白酶抑制剂家族E成员1(serine protease inhibitor family E member 1, SERPINE1), 又称纤溶酶原激活物抑制剂1(plasminogen activator inhibitor 1, PAI-1), 是丝氨酸蛋白酶抑制剂超家族的一员, 编码PAI-1[5].
PAI-1, 属丝氨酸蛋白酶抑制剂超家族成员, SERPINE1参与控制降解血凝块和调节细胞粘附、扩散以及细胞迁移、衰老及损伤修复等, 影响着多种疾病进展[6]. 近年来, 更多的报道显示SERPINE1参与多种癌症的病变, 譬如肝癌[7]、头颈部鳞状细胞癌[8], 卵巢癌等[9]; 然而, 其在消化系统患者中的表达情况及在肿瘤免疫细胞浸润中的具体作用尚未得到深入研究. 本研究旨在通过生物信息学技术对消化系统中SERPINE1的表达进行全面分析, 探讨SERPINE1在消化肿瘤免疫细胞浸润中的可能作用机制.
1.1.1 解偶联蛋白的转录表达: 用GEPIA数据库(Gene Expression Profiling Interactive Analysis)(http://gepia.cancer-pku.cn/)中mRNA的SERPINE1形成肿瘤组织与正常组织中SERPINE1表达的比较[10]. 用Pan-Cancer数据库(Assistant for clinical Bioin for matics)(https://www.aclbi.com/static/index.html#/pan_cancer)进行来泛癌分析.
1.1.2 SERPINE1在消化系统癌症患者中的预后价值: Kaplan-Meier绘图仪(http://www.kmplot.com)是一种用于评估癌症存活率的基因表达在线工具, 用于评估LUAD患者中SERPINE1 mRNA的预后意义. 将SERPINE1基因分别输入数据库绘制生存曲线, 在网页上计算log-rank p值[11].
1.1.3 SERPINE1在消化系统癌症患者中的免疫分析: 肿瘤免疫估计资源(TIMER, https://cistrome.shinyapps.io/timer/)用于综合分析消化系统癌症患者SERPINE1的免疫浸润相关性[12]. 将SERPINE1基因在网站检索, TIMER计算了Spearman的相关性并显示出统计学意义. 同时评估了SERPINE1不同免疫细胞浸润水平, 涉及肿瘤纯度、B细胞、上皮-间质转化、CD4+T细胞、CD8+T细胞、中性粒细胞、巨噬细胞和树突状细胞等. 为了巩固分析结果, 又进一步使用TIMER平台中的相关模块分析了SERPINE1与免疫细胞标记基因的关联.
使用基因表达谱交互分析(gene expression profile analysis, GEPIA)进行SERPINE1表达分析, 并使用Kaplan-Meier分析分析SERPINE1在临床预后中的潜力.
统计学处理 对以上数据库获取的数据进行统计学分析. 采用单因素方差分析和学生t检验比较SERPINE1表达的平均值. Kaplan-Meier分析和对数秩检验用于消化系统癌症患者的总体生存分析. Spearman相关系数用于评估SERPINE1与标记基因和免疫浸润细胞之间的相关性; P<0.05具有统计学意义.
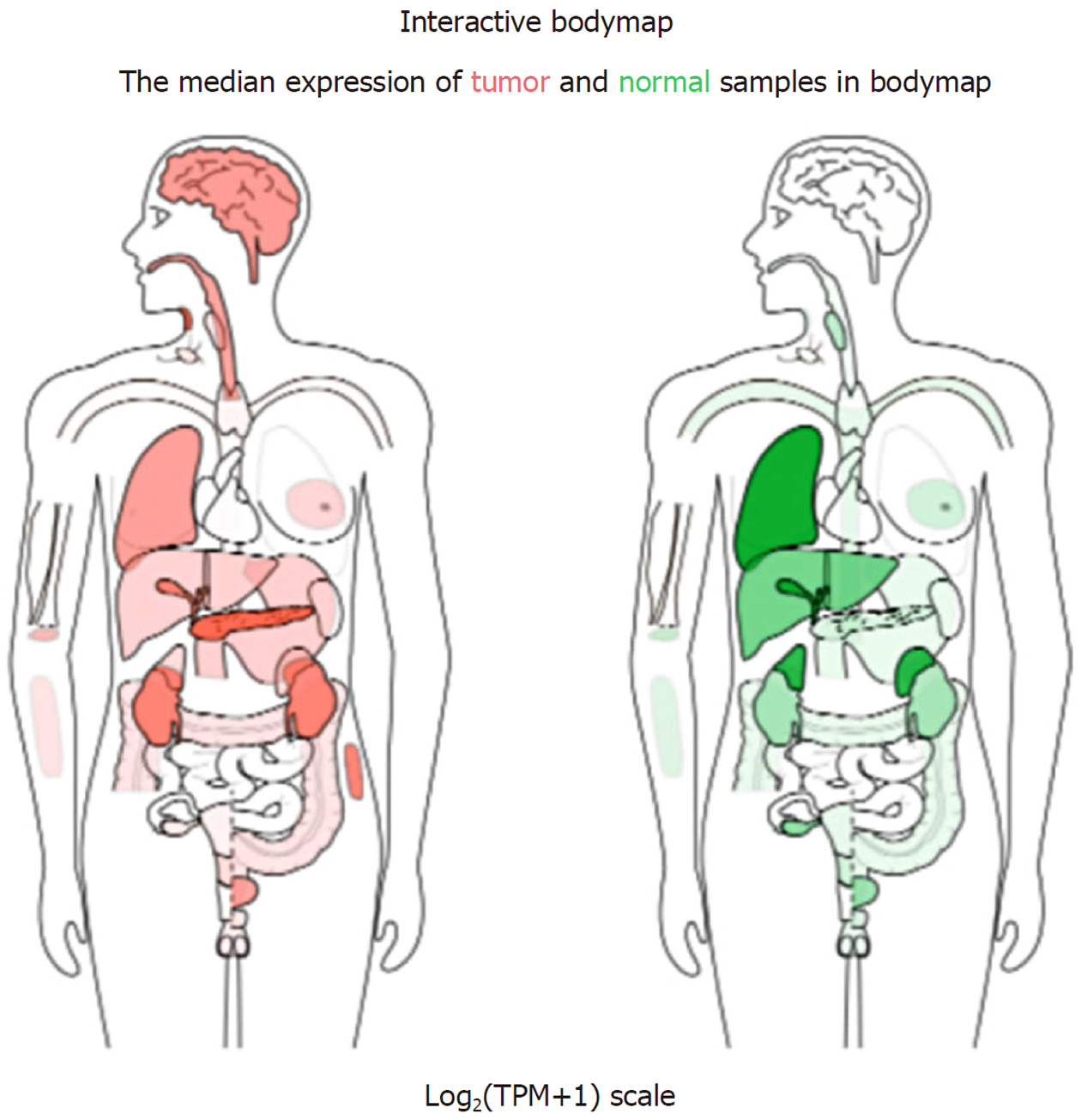
基于GEPIA数据库对SERPINE1进行单基因分析, 如图1所示, 右边的两个示例人左边是tumor, 右边是normal, 颜色深浅分别代表高低表达, 可以看到这个基因在胰腺和大脑肿瘤中的表达较其他组织深.
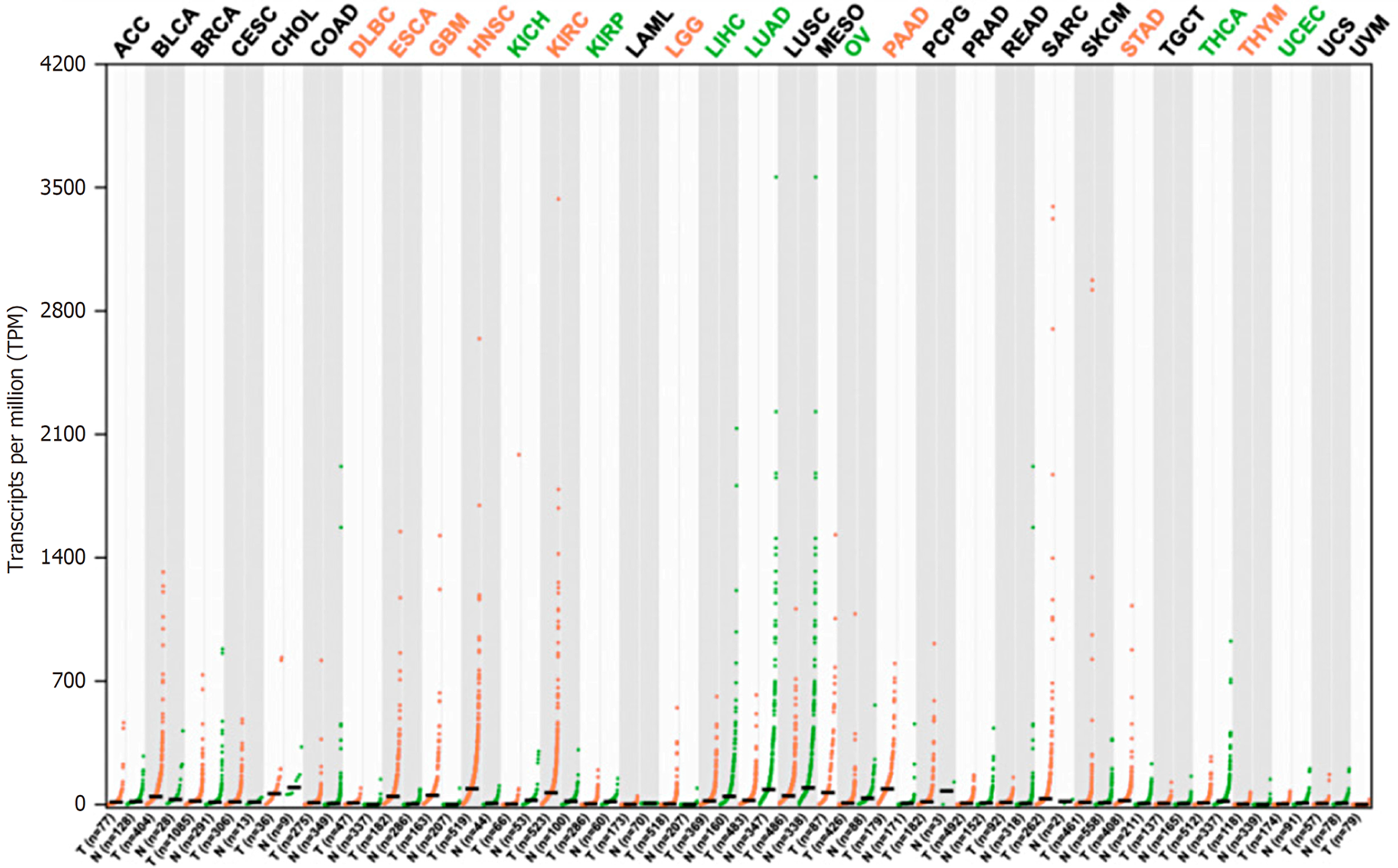
Dot plot图展示, SERPINE1基因在多种癌症中都有差异表达, 高表达会标为红色, 低表达的标为绿色. 可以看出这个基因在PAAD(胰腺癌)和HNSC(头颈鳞状细胞癌)中表达最高; 其次在DLMC(弥漫性大B细胞淋巴瘤)、ESCA(食管癌)、GBM(多形成性胶质细胞瘤)、KIRC(肾透明细胞癌)、LGG(脑低级别胶质瘤)、STAD(胃癌)、THYM(胸腺癌)均有表达, 如图2所示. 显而易见, SERPINE1基因在消化系统癌症中, PAAD、STAD和ESCA表达高于正常人群.
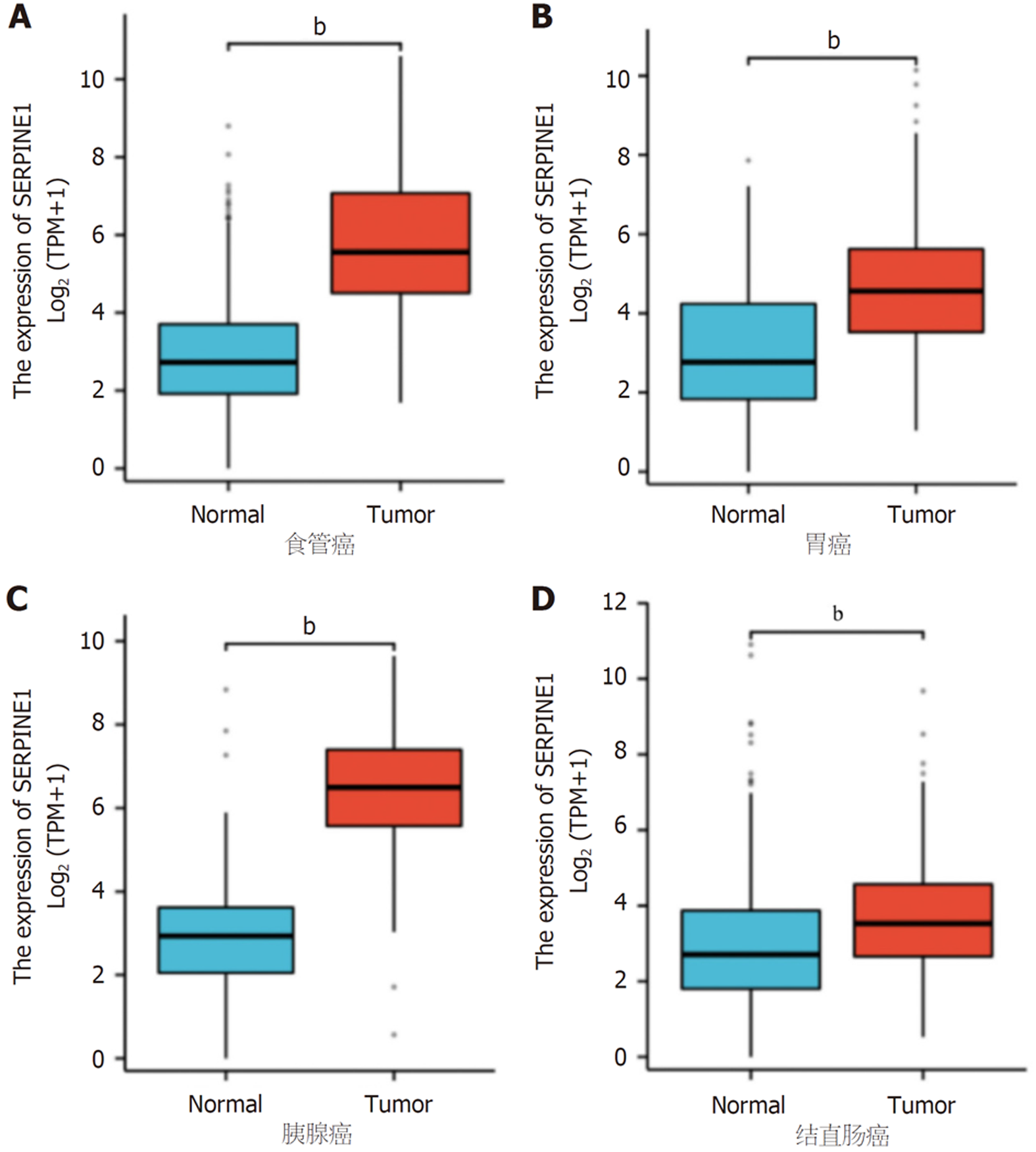
如图3所示, 在食管癌、胃癌、胰腺癌和结直肠癌中, 与正常组织对比表, 均具有统计学意义(P<0.05).
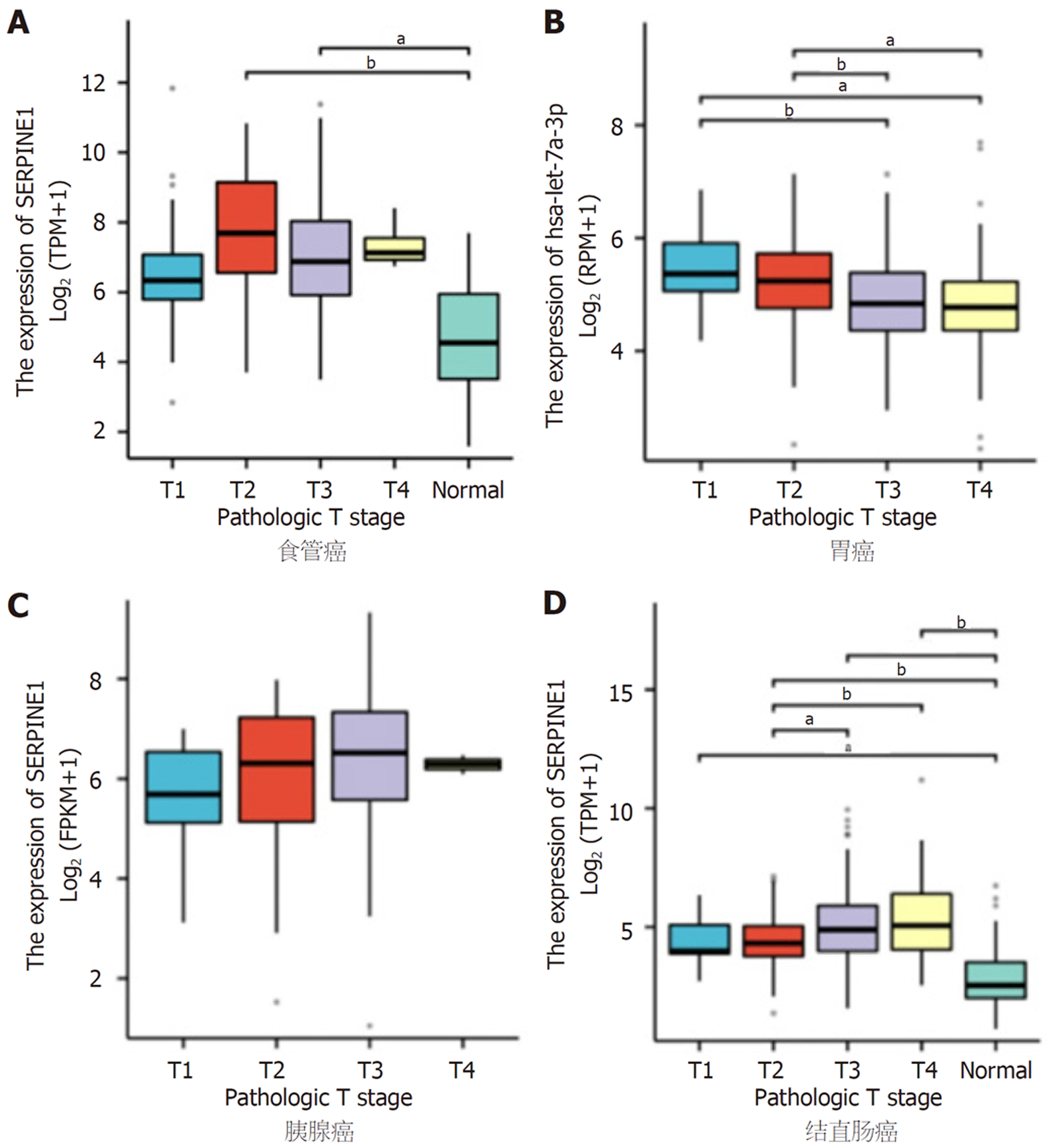
原发肿瘤T1-T4进行评估, 随着原发灶肿瘤大小和对周围组织影响的增加, 分为不同的亚期. 在食管癌中, 与正常组比较, T2和T3均具有统计学意义(P<0.05); T4样本量太少, 在合并T3和T4之后, 亦具有统计学意义(P<0.05). 在胃癌中, 与T1比较, T3和T4均具有统计学意义(P<0.05); T3、T4与T2对比, 亦具有统计学意义(P<0.05). 在胰腺癌中无统计学意义(P>0.05). 在结直肠癌中, 与正常组比较, T1、T2、T3和T4均具有统计学意义(P<0.05); T3、T4与T2亦具有统计学意义(P<0.05); 见图4.
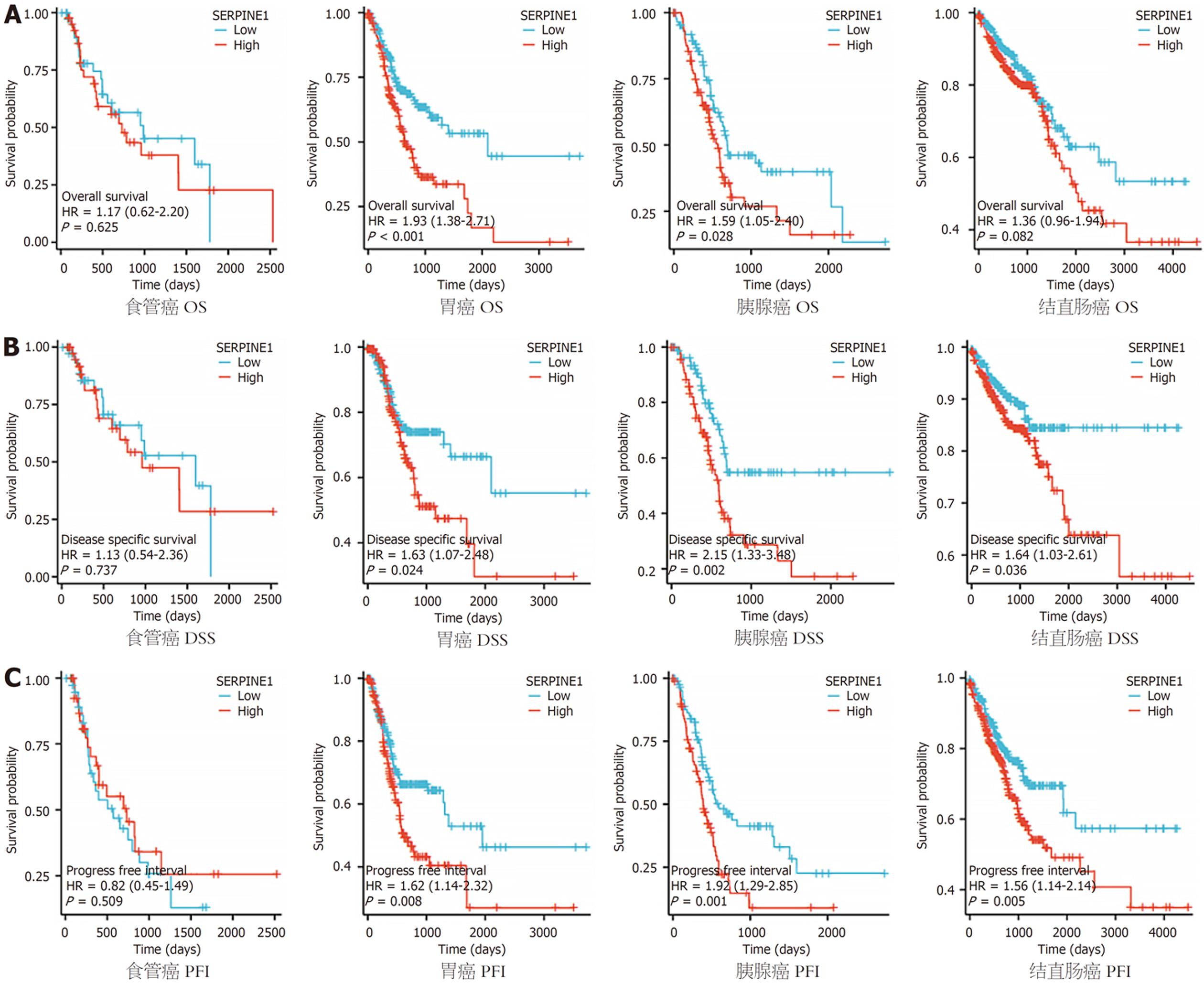
总体生存期(overall survival, OS)、疾病特异生存期(disease-specific survival, DSS)和无进展间隔(progression-free interval, PFI)可以描述各组患者的生存状况的存活情况. 为了确定SERPINE1的预后价值, 使用Kaplan-Meier Plotter工具探索SERPINE1的mRNA水平与消化系统癌症患者生存率之间的相关性. 对数秩检验分析显示, SERPINE1 mRNA高表达胃癌和胰腺癌患者的生存时间显著短于低表达的患者(P<0.05); 而食管癌中SERPINE1 mRNA水平高表达与OS、DSS和PFI无明显相关性(P>0.05); 在结直肠癌中SERPINE1 mRNA水平高表达与OS无明显相关性(P>0.05); 与DSS和PFI显著相关(P<0.05); 见图5.
食管癌与B cell、monocyte、TAM、M2和GATA3相关, 具有统计学意义(P<0.05); 其中与CD86和CD163成正比, 最为相关, 与CCL20负相关. 胃癌与T Cell、monocyte、M2和GATA3相关, 具有统计学意义(P<0.05); 其中与CD14和CD163成正比, 最为相关. 胰腺癌与B cell、T Cell、monocyte、M2和GATA3相关, 具有统计学意义(P<0.05); 其中与CD163成正比, 最为相关. 结直肠癌与B cell、T Cell、monocyte、TAM、M2和GATA3相关, 具有统计学意义(P<0.05); 其中与CD86和CD163成正比, 最为相关, 与CCL20负相关. 如表1所示.
| 指标描述 | 基因标记 | 食管癌 | 胃癌 | 胰腺癌 | 结直肠癌 | ||||
| 斯皮尔曼的相关性 | P值 | 斯皮尔曼的相关性 | P值 | 斯皮尔曼的相关性 | P值 | 斯皮尔曼的相关性 | P值 | ||
| B cell | CD19 | 0.139 | 0.0005 | 0.034 | 0.510 | 0.034 | 0.000 | 0.135 | 0.000 |
| T Cell | CD3E | 0.088 | 0.265 | 0.144 | 0.005 | 0.384 | 0.000 | 0.294 | 0.000 |
| CD3D | 0.019 | 0.811 | 0.132 | 0.010 | 0.359 | 0.000 | 0.214 | 0.000 | |
| CD3G | 0.066 | 0.404 | 0.141 | 0.006 | 0.413 | 0.000 | 0.276 | 0.000 | |
| 单核细胞 | CD86 | 0.566 | 0.000 | 0.376 | 0.000 | 0.411 | 0.000 | 0.560 | 0.000 |
| CD14 | 0.409 | 0.000 | 0.409 | 0.000 | 0.408 | 0.000 | 0.487 | 0.000 | |
| TAM | CCL5 | 0.246 | 0.002 | 0.184 | 0.000 | 0.355 | 0.000 | 0.319 | 0.000 |
| CCL20 | -0.134 | 0.089 | -0.011 | 0.839 | 0.086 | 0.252 | -0.122 | 0.002 | |
| CD47 | 0.259 | 0.0009 | 0.119 | 0.022 | 0.418 | 0.000 | 0.119 | 0.003 | |
| CD68 | 0.247 | 0.001 | 0.103 | 0.046 | 0.138 | 0.065 | 0.084 | 0.032 | |
| M2 | CD163 | 0.439 | 0.000 | 0.432 | 0.000 | 0.598 | 0.000 | 0.567 | 0.000 |
| GATA3 | GATA3 | 0.169 | 0.031 | 0.211 | 0.000 | 0.340 | 0.000 | 0.322 | 0.000 |
消化系统对人体健康极为重要, 人体通过消化系统获取能量, 维持人本身的活动. 近年来, 随着饮食结构的改变以及饮食规律的紊乱, 消化系统疾病已经成为人类的负担之一, 严重的影响患者的生存质量以及家庭经济. 2020年, 全球男性胃癌发病率为15.8/10万, 女性发病率为7.0/10万[13]; 2021年, 中国食管癌发病人数、死亡人数和伤残调整生命年分别为32.08万、29.64万和689.87万, 较1990年分别增加了54.61%、40.61%和17.88%[14]. 2022年全球胰腺癌总发病人数为51.10万, 全球胰腺癌总死亡人数为46.74万; 中国胰腺癌总发病人数为11.87万, 中国胰腺癌总死亡人数为10.63万[15]. 结直肠癌是全球发病第3位癌症, 死亡第2位癌症, 2022年全球新增192.6万结直肠癌病例, 90.4万死亡病例[16]. 目前消化系统癌症疾病以手术为主要治疗手段, 但术后生存期较短, 同时由于术后残留问题, 复发率极高, 给患者和医院带来率巨大的负担. 随着科技进步, 近年来, 从分子水平进行高通量多基因检测, 通过生物信息学分析有助于发现消化系统癌症中新的靶基因, 有助于更深入地理解消化系统癌症的发病机制为疾病诊疗提供参考[13].
SERPINE1在正常生理状态下, SER-PINE1能够平衡纤维蛋白激活及溶解系统, 有利于伤口愈合; 病理状态下, 血浆中SERPINE1的异常升高导致过度的纤维蛋白激活, 形成疤痕[17]. 最近研究逐渐指向SERPINE1参与消化系统癌症细胞的增殖、迁移与侵袭, 抑制其凋亡[18-20].
本研究表明, SERPINE1在ESCA, STAD, PAAD和COADREAD等消化系统癌症中表达高于正常人群. Tumor指肿瘤原发病灶的情况, T越大, 肿瘤的"地盘"越大; 本研究显示, SERPINE1除了在胰腺癌中无统计学意义之外, 在食管癌、胃癌和结直肠癌中, T3、T4与T1、T2比较都具有统计学意义, 这就说明SERPINE1的表达量与肿瘤体积的大小和肿瘤邻近组织受累范围情况, 孙锴等[21]研究表明, SERPINE1表达水平随着胃癌肿瘤TNM分期的进展而升高; 陈德合等[18]在结直肠癌中的研究结果亦一致. KM曲线研究结果显示, SERPINE1 mRNA高表达胃癌和胰腺癌患者的生存时间显著短于低表达的患者(P<0.05); 在结直肠癌中SERPINE1 mRNA水平高表达与OS无明显相关性(P>0.05); 与DSS和PFI显著相关(P<0.05). 而食管癌中SERPINE1 mRNA水平高表达与OS、DSS和PFI无明显相关性(P>0.05); 但常晨等人研究表明, SERPINE1 mRNA的表达水平与食管鳞癌患者预后的关系Kaplan-Meier生存曲线显示, SERPINE1 mRNA高表达患者的生存时间(21.25 mo)显著短于低表达(44.4 mo)的患者(P = 0.017)[22].
SERPINE1表达与免疫标记基因的相关性结果显示, 食管癌与B cell、monocyte、TAM、M2和GATA3相关, 具有统计学意义(P<0.05); 其中与CD86和CD163成正比, 最为相关, 与CCL20负相关. CD86是参与初次B细胞应答的主要刺激分子, 还具有信号传导功能, CD86只有在细胞膜上表达, 才能与T细胞上的CD28分子结合, 激活T淋巴细胞从而发挥免疫效应[23]. CD163是M2型巨噬细胞的标志物, 巨噬细胞是主要浸润炎性细胞, 肿瘤相关巨噬细胞的浸润被认为与抗肿瘤免疫反应有关[24], 胃癌与T Cell、monocyte、M2和GATA3相关, 具有统计学意义(P<0.05); 其中与CD14和CD163成正比, 最为相关. CD14是一种糖磷脂酰肌醇锚定的质膜蛋白, 在细胞内脂多糖介导的toll样受体4(toll-like receptor 4, TLR4)激活中具有长期确定的作用, CD14通过在细胞内递送细胞内脂多糖在体内caspase-11激活中发挥重要的TLR4非依赖性作用. 因此, CD14是体内非经典炎性体的一个组成部分[25]. CD14+胃癌细胞亚群具有一定的肿瘤干细胞特性, 并有较强的体外增殖和侵袭能力, 其机制可能与上调TLR4蛋白表达水平相关[26], TLR4通过识别其配体脂多糖, 招募适配体蛋白至细胞膜, 进而启动下游信号传导, 触发炎症反应[27], 作为炎症反应的一部分, 巨噬细胞被招募到损伤部位, 巨噬细胞受到生长因子影响, 进而获得肌成纤维细胞的特性[28]. 胰腺癌与B cell、T Cell、monocyte、M2和GATA3相关, 具有统计学意义(P<0.05); 其中与CD163成正比, 最为相关. 结直肠癌与B cell、T Cell、monocyte、TAM、M2和GATA3相关, 具有统计学意义(P<0.05); 其中与CD86和CD163成正比, 最为相关, 与CCL20负相关. 趋化因子配体20(chemokine ligand 20, CCL20)与3型免疫反应最直接相关, 其由活化的上皮细胞表达, 以募集表达其唯一受体CCR6的各种3型免疫细胞[29]. 研究显示[30], 组织蛋白酶D的缺失通过下调CCL20抑制肿瘤相关巨噬细胞向M2型极化, 控制CCL20的活性和表达可以被认为是治疗癌症转移和免疫逃逸的一种潜在的联合疗法.
综上所述, SERPINE1表达与CD14、CD163以及CCL20相关, SERPINE1高表达可能通过促进巨噬细胞介导炎症, 从而参与消化系统癌症的发生和发展.
消化系统癌症是全球范围内主要的公共卫生问题之一, 其发病率和死亡率近年来呈现显著上升趋势, 随着生活方式的改变、环境因素的影响以及吸烟、饮酒等不良习惯的增加, 消化系统疾病负担不断加重, 癌变风险显著提高. 丝氨酸蛋白酶抑制剂家族E成员1(serine protease inhibitor family E member 1, SERPINE1)作为调控血凝块降解、细胞粘附与迁移的关键分子, 近年来被发现与多种癌症的发生发展密切相关. 然而, SERPINE1在消化系统癌症中的表达模式及其在肿瘤免疫微环境中的作用机制尚未被充分研究. 本研究利用生物信息学技术, 系统分析SERPINE1在消化系统癌症中的表达特征及其潜在作用, 为揭示其在癌症发生、发展及免疫调控中的作用提供了重要背景依据.
本研究聚焦于SERPINE1在消化系统癌症中的表达及其在肿瘤免疫细胞浸润中的作用机制, 旨在解决以下关键问题: SERPINE1在不同消化系统癌症(食管癌、胃癌、胰腺癌和结直肠癌)中的表达差异及其与临床预后的关联; SERPINE1如何通过调控免疫微环境影响肿瘤的发生与发展. 这些问题的解决对深入理解消化系统癌症的分子机制具有重要意义, 可为开发新的诊断标志物和治疗靶点提供理论依据.
本研究的主要目标是通过生物信息学分析, 全面探讨SERPINE1在消化系统癌症中的表达特征、预后价值及其与肿瘤免疫细胞浸润的相关性. 具体目标包括: 确定SERPINE1在食管癌、胃癌、胰腺癌和结直肠癌中的表达水平与正常组织的差异; 评估SERPINE1表达水平与患者生存期的关联; 揭示SERPINE1与肿瘤免疫微环境中关键免疫细胞和标记基因的相关性. 这些目标的实现有助于阐明SERPINE1在消化系统癌症中的生物学功能, 为开发针对SERPINE1的靶向治疗策略提供科学依据, 推动消化系统癌症的诊断与治疗研究进一步发展.
为实现研究目标, 本研究采用了多种生物信息学分析方法, 包括基因表达谱交互分析数据库用于比较SERPINE1在肿瘤与正常组织中的表达水平, Pan-Cancer数据库进行泛癌分析, Kaplan-Meier Plotter工具评估SERPINE1表达与患者生存期的关系, 以及肿瘤免疫估计资源(TIMER)平台分析SERPINE1与免疫细胞浸润的相关性. 这些方法的独创性在于综合利用多个公开数据库, 结合单基因分析、生存分析和免疫相关性分析, 系统性地揭示了SERPINE1在消化系统癌症中的多维度作用.
本研究成功达到了预设目标, 系统分析了SERPINE1在消化系统癌症中的表达特征及其与免疫微环境的相关性. 研究发现, SERPINE1在食管癌、胃癌、胰腺癌和结直肠癌中的表达显著高于正常组织, 尤其在胰腺癌和胃癌中高表达与较差的总体生存期、疾病特异生存期和无进展间隔(PFI)显著相关. 此外, SERPINE1表达与多种免疫标记基因(如CD86、CD163、CD14)呈正相关, 与CCL20呈负相关, 提示其可能通过调控巨噬细胞介导的炎症反应参与肿瘤免疫微环境的塑造. 这些结果为SERPINE1作为消化系统癌症的潜在诊断和预后标志物提供了证据, 对推动肿瘤免疫治疗研究具有重要贡献.
本研究发现SERPINE1在消化系统癌症(食管癌、胃癌、胰腺癌和结直肠癌)中高表达, 且与肿瘤分期和患者预后密切相关, 特别是在胃癌和胰腺癌中高表达患者生存时间显著缩短. 研究提出了SERPINE1可能通过调控巨噬细胞介导的炎症反应参与肿瘤发生和发展的假说, 揭示了其与免疫标记基因CD14、CD163和CCL20的相关性, 为肿瘤免疫微环境的调控机制提供了新见解. 本研究通过生物信息学分析验证了SERPINE1在消化系统癌症中的重要作用, 提出了新的分析方法, 为现有知识提供了系统性归纳. 未来, SERPINE1可能成为消化系统癌症免疫治疗的潜在靶点, 对临床实践具有指导意义.
本研究的经验教训包括: 生物信息学分析依赖于数据库的质量和完整性, 需结合实验验证以进一步确认结果; 样本量的不足可能影响部分统计分析的显著性, 如胰腺癌分期分析. 未来研究方向应聚焦于SERPINE1在消化系统癌症中的具体分子机制, 如其如何调控巨噬细胞极化及其在肿瘤微环境中的作用. 此外, 需进一步验证SERPINE1作为治疗靶点的可行性, 探索其在免疫治疗中的应用潜力. 最佳研究方法包括结合体外细胞实验、体内动物模型以及临床样本分析, 采用多组学技术(如转录组学、蛋白质组学)深入解析SERPINE1的功能网络, 为开发针对消化系统癌症的精准治疗策略提供更全面的依据.
| 3. | Tu H, Ye Y, Huang M, Xie K, Chow WH, Zhao H, Wu X. Smoking, smoking cessation, and survival after cancer diagnosis in 128,423 patients across cancer types. Cancer Commun (Lond). 2022;42:1421-1424. [PubMed] [DOI] |
| 4. | Choi E, Lee YY, Suh M, Park B, Jun JK, Kim Y, Choi KS. Associations of perceived risk and cancer worry for colorectal cancer with screening behaviour. J Health Psychol. 2018;23:840-852. [PubMed] [DOI] |
| 5. | Chen X, Wang H, Wu C, Li X, Huang X, Ren Y, Pu Q, Cao Z, Tang X, Ding BS. Endothelial H(2)S-AMPK dysfunction upregulates the angiocrine factor PAI-1 and contributes to lung fibrosis. Redox Biol. 2024;70:103038. [PubMed] [DOI] |
| 7. | 金 丽娟, 范 海涛, 马 晓燕, 陈 淼, 张 爱芸. SERPINE1介导miR-660信号影响肝癌细胞增殖的实验研究. 宁夏医学杂志. 2022;44:481-484+476. [DOI] |
| 10. | 闫 小妮, 田 国祥, 潘 振宇, 杨 津, 柳 青青, 吕 军. 如何挖掘GEPIA数据库中研究数据并生成分析结果表达图. 中国循证心血管医学杂志. 2019;11:521-525. [DOI] |
| 11. | Hou GX, Liu P, Yang J, Wen S. Mining expression and prognosis of topoisomerase isoforms in non-small-cell lung cancer by using Oncomine and Kaplan-Meier plotter. PLoS One. 2017;12:e0174515. [PubMed] [DOI] |
| 12. | Li T, Fu J, Zeng Z, Cohen D, Li J, Chen Q, Li B, Liu XS. TIMER2.0 for analysis of tumor-infiltrating immune cells. Nucleic Acids Res. 2020;48:W509-W514. [PubMed] [DOI] |
| 16. | 曹 梦迪, 陈 万青. GLOBOCAN 2022全球癌症统计数据解读. 中国医学前沿杂志(电子版). 2024;16:1-5. [DOI] |
| 18. | 陈 德合, 李 登玉, 郭 刚, 王 杰, 周 倩, 李 洪涛. SERPINE1对结肠癌细胞增殖、迁移、侵袭及凋亡的影响. 陆军军医大学学报. 2024;46:1751-1762. [DOI] |
| 25. | Ciesielska A, Matyjek M, Kwiatkowska K. TLR4 and CD14 trafficking and its influence on LPS-induced pro-inflammatory signaling. Cell Mol Life Sci. 2021;78:1233-1261. [PubMed] [DOI] |
| 27. | Hering M, Madi A, Sandhoff R, Ma S, Wu J, Mieg A, Richter K, Mohr K, Knabe N, Stichling D, Poschet G, Bestvater F, Frank L, Utikal J, Umansky V, Cui G. Sphinganine recruits TLR4 adaptors in macrophages and promotes inflammation in murine models of sepsis and melanoma. Nat Commun. 2024;15:6067. [PubMed] [DOI] |
| 28. | Abu El-Asrar AM, De Hertogh G, Allegaert E, Nawaz MI, Abouelasrar Salama S, Gikandi PW, Opdenakker G, Struyf S. Macrophage-Myofibroblast Transition Contributes to Myofibroblast Formation in Proliferative Vitreoretinal Disorders. Int J Mol Sci. 2023;24:13510. [PubMed] [DOI] |
| 29. | Mempel TR, Lill JK, Altenburger LM. How chemokines organize the tumour microenvironment. Nat Rev Cancer. 2024;24:28-50. [PubMed] [DOI] |
| 30. | Lee SG, Woo SM, Seo SU, Lee CH, Baek MC, Jang SH, Park ZY, Yook S, Nam JO, Kwon TK. Cathepsin D promotes polarization of tumor-associated macrophages and metastasis through TGFBI-CCL20 signaling. Exp Mol Med. 2024;56:383-394. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): D, D, D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁