修回日期: 2016-04-27
接受日期: 2016-05-03
在线出版日期: 2016-05-28
上皮样炎性肌纤维母细胞肉瘤(epithelioid inflammatory myofibroblastic sarcoma, EIMS)是炎性肌纤维母细胞肿瘤(inflammatory myofibroblastic tumor)的罕见特殊亚型, 其临床病理特征、免疫表型及分子遗传学均有特殊性. 本文报道1例腹腔EIMS, 患者男性, 46岁, 因反复腹痛腹胀10余天入院. 肉眼: 肿物结节状不规则, 大小17 cm×12 cm×8 cm, 切面灰白灰黄色, 实性, 鱼肉样, 质中, 包膜似完整. 镜下: 以中性粒细胞为主的炎症性黏液样背景中圆形至上皮样细胞散在分布, 肿瘤细胞泡状核, 核仁明显, 胞质嗜双色性或嗜酸性. 免疫组织化学: 肿瘤细胞ALK特征性核膜阳性, CD30、Vimentin胞质弥漫强阳性; Fish检测ALK基因信号分离. EIMS生物学行为侵袭性强, 肿瘤易快速复发转移, 预后很差, 临床主要治疗方法为手术切除辅以放、化疗.
核心提示: 上皮样炎性肌纤维母细胞肉瘤(epithelioid inflammatory myofibroblastic sarcoma)是炎性肌纤维母细胞肿瘤的罕见特殊亚型, 其临床病理特征、免疫表型及分子遗传学等均有特殊性, 且生物学行为更具侵袭性, 肿瘤易快速复发、甚至发生转移, 预后很差. 迄今国内外文献报道不足20例, 可能与该病新近报道、对其认识不足有关.
引文著录: 曲利娟, 张惠斌, 高杰, 葛小霞, 王旭洲. 腹腔上皮样炎性肌纤维母细胞肉瘤临床病理特征. 世界华人消化杂志 2016; 24(15): 2438-2444
Revised: April 27, 2016
Accepted: May 3, 2016
Published online: May 28, 2016
Epithelioid inflammatory myofibroblastic sarcoma (EIMS) is a rare subtype of inflammatory myofibroblastic tumor (IMT), and its clinicopathologic characteristics, immune phenotypes and molecular genetics are particular. Here we report a case of intra-abdominal EIMS. A male patient, aged 46 years, was admitted due to recurrent pain and distension in the abdomen for more than 10 days. Grossly, a nodular mass measuring 17 cm × 12 cm × 8 cm was observed, and it was grayish yellow and solid, had a fish-like cut surface, and tended to be well circumscribed with medium consistency. Microscopically, round to epithelioid cells were scattered in a mucinous and neutrophil-predominant inflammatory background, and the tumor cells had vacuolated nuclei, prominent nucleoli, and amphophilic or eosinophilic cytoplasm. Immunohistochemically, the tumor cells showed typical nuclear membrane staining for ALK, diffuse and strong cytoplasmic staining for CD30 and Vimentin. Split signals were detected by FISH using break-apart probes to ALK. The aggressive biological behavior of EIMS increases the risk of recurrence and metastasis, and thus the prognosis is poor. Surgical resection is the main treatment for EIMS, with radiation therapy or chemotherapy as a postoperative adjunct.
- Citation: Qu LJ, Zhang HB, Gao J, Ge XX, Wang XZ. Clinicopathologic characteristics of intra-abdominal epithelioid inflammatory myofibroblastic sarcoma. Shijie Huaren Xiaohua Zazhi 2016; 24(15): 2438-2444
- URL: https://www.wjgnet.com/1009-3079/full/v24/i15/2438.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i15.2438
炎性肌纤维母细胞肿瘤(inflammatory myofibroblastic tumor, IMT)是一种好发于儿童和青年的低度恶性潜能的中间型间叶性肿瘤, 部分病例可局部复发但几乎不发生远处转移, 炎性黏液样变及玻璃样变的间质中梭形肿瘤细胞浸润是经典型IMT的特征性病理学改变[1,2]. 上皮样炎性肌纤维母细胞肉瘤(epithelioid inflammatory myofibroblastic sarcoma, EIMS)是IMT的特殊亚型, 2011年由Mariño-Enríquez等[3]首先报道. 与经典型IMT相比, EIMS的临床病理特征、免疫表型及分子遗传学等均有其特殊性, 且生物学行为更具侵袭性, 肿瘤易快速复发、甚至发生转移, 预后很差. EIMS较罕见, 迄今国内外文献报道不足20例[3-9], 可能与该病新近报道、对其认识不足有关. 本文报道1例腹腔内EIMS, 并结合文献进行复习.
男性患者, 46岁, 因反复腹痛腹胀10余天入院. 无明显诱因出现中上腹闷胀痛, 疼痛呈阵发性, 无放射痛, 无恶心、呕吐、腹泻、发热、黄疸等. 查体: 腹部饱满, 腹肌稍紧, 中上腹部轻度压痛, 无反跳痛, 右侧季肋区可触及一约15 cm×10 cm×10 cm包块, 质稍硬, 界不清, 活动度尚可, 直肠指检无异常. 实验室检查: 癌胚抗原125(cancer antigen 125, CA125): 178.30 U/mL, 血尿粪常规、生化全套正常. 腹部彩超示: 腹盆腔内实性占位, 其周边腹水少量. 腹部计算机断层扫描(computed tomography, CT)及磁共振成像(magnetic resonance imaging, MRI)示: 中下腹占位, 考虑间叶源性恶性肿瘤. 全麻下行"腹腔肿物切除+黏连松解术", 术中探查: 肿物位于大网膜, 大小17 cm×12 cm×10 cm, 实性不规则, 包膜较完整, 与盆壁略有黏连, 未与肠管黏连.
手术标本经40 g/L中性甲醛溶液固定, 常规石蜡包埋, 4 μm厚连续切片, 行常规HE染色及免疫组织化学染色, 光镜观察. 免疫组织化学染色: 采用EliVision两步法, 实验步骤参照试剂盒说明书, DAB显色. 一抗选用ALK、CD30、Vimentin、CKpan、HHF35、SMA、Desmin、CD68、CD34、CD117、Dog-1、HMB45、S-100、calretinin、CD21、CD35、D2-40、CD3、CD20、LCA、Ki-67等, 所用抗体和EliVision试剂盒均购自福州迈新生物技术开发有限公司. 荧光原位杂交检测ALK基因: Fish试剂盒及LSI ALK双色分离探针购自美国雅培公司, 具体实验步骤按照试剂盒说明书进行. 结果判断: 细胞核内红、绿分离信号及单一红色信号均为阳性; 红、绿融合信号和单一绿色信号为阴性.
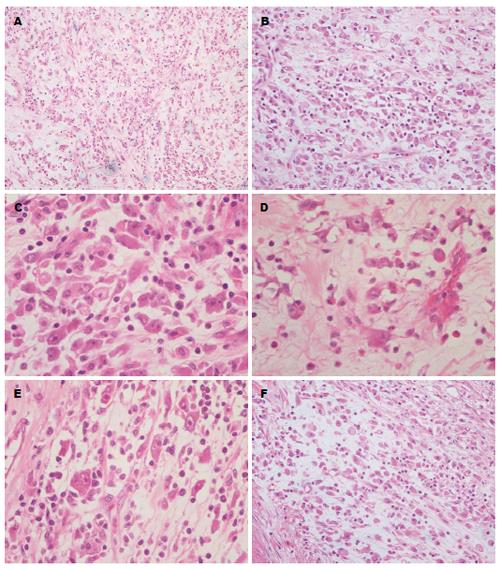
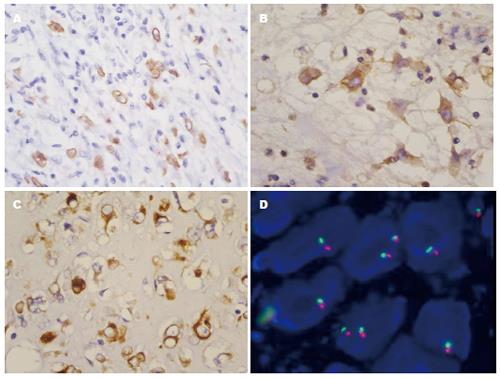
巨检: 送检为大网膜及肿物, 总体积30 cm×22 cm×10 cm, 肿物附于大网膜上, 结节状不规则, 大小17 cm×12 cm×8 cm, 切面灰白灰黄色, 实性, 鱼肉样, 质中, 包膜似完整. 光镜检查: 低倍镜下见炎症细胞背景中瘤细胞松散排列, 细胞密度不高(图1A). 高倍镜见肿瘤细胞形态多样, 主要由上皮样细胞组成, 部分瘤细胞呈圆形、多边形(图1B); 瘤细胞核大、卵圆形或圆形, 泡状核, 核仁明显, 可见核分裂像; 胞质丰富、偏侧, 嗜双色性或嗜酸性(图1C), 部分瘤细胞胞质突起似神经元细胞(图1D). 有的区域瘤细胞排列稍密集, 细胞境界不清, 呈"R-S样"或多核巨细胞(图1E); 仔细寻找局灶总是能看见梭形或短梭形瘤细胞呈束状排列(图1F). 绝大部分肿瘤间质明显水肿及黏液样变性, 少数区域间质玻璃样变; 间质可见大量炎症细胞浸润, 以中性粒细胞为主, 伴有少量淋巴细胞、浆细胞及嗜酸性粒细胞. 免疫组织化学: 肿瘤细胞弥漫表达Vimentin、ALK及CD30, 其中ALK特征性核膜阳性(图2 A), CD30(图2B)及Vimentin胞质弥漫阳性; 肿瘤细胞局灶表达Desmin, 表达部位聚集于核旁胞质(图2C); CD68、HHF35、SMA弱阳性, Ki-67增殖指数30%. 肿瘤细胞不表达CKpan、CD34、CD117、Dog-1、HMB45、S-100、calretinin、D2-40、CD21、CD35、CD3、CD20及LCA等. 荧光原位杂交: Fish检测结果显示, 计数100个细胞, 其中超过40%瘤细胞核内红、绿分离信号(图2D), 表明有ALK基因的重排.
病理诊断: 腹腔上皮样炎性肌纤维母细胞肉瘤. 术后随访6 mo无瘤生存.
IMT是胶原、炎细胞和细胞学常显示肌纤维母细胞分化的温和的混合性梭形细胞肿瘤, 是"炎性假瘤"大类中的一个中间型亚群. 过去认为该病是一种反应性炎性增生性病变, 命名也较混乱, 如炎性假瘤、浆细胞肉芽肿、假肉瘤样肌纤维母细胞增生等, 后经分子遗传学证实IMT系一种真性肿瘤[10-12]. IMT好发于儿童及青少年, 发生部位常见于腹腔内大网膜、肠系膜、腹膜后及肺; 临床生物学行为较为惰性, 预后较好, 偶见复发和转移. 新近报道的发生于腹腔内的EIMS是IMT特殊亚型, 因肿瘤细胞呈上皮样、生物学行为更具侵袭性、预后更差而命名的[3].
EIMS很罕见, 迄今文献报道不足20例, 男性多见, 发病年龄从7 mo-63岁, 中位年龄39岁; 几乎只发生于腹腔内(大网膜、肠系膜、腹膜等)[4-6], 偶见于胸膜腔内[7]. 因肿物较大, 平均直径15 cm, 故临床常表现腹痛、腹胀、肠梗阻, 甚至腹水等.
在大体、组织学、免疫表型上, EIMS有其特征性改变. 大体上: 肿瘤巨大, 呈结节状, 局部质地较韧, 常伴有明显黏液样变区域. 组织学上有以下特点[3-9]: (1)低倍镜下表现肿瘤低细胞密度, 炎症细胞背景中瘤细胞松散排列; (2)高倍镜见肿瘤细胞形态多样, 主要由圆形到上皮样细胞组成, 泡状核, 核仁明显, 胞质嗜双色性, 核分裂象常见; (3)可以见到少量梭形细胞成分; (4)常伴有大量黏液样间质; (5)炎症细胞以中性粒细胞为主, 伴有少量淋巴细胞、浆细胞及嗜酸性粒细胞. 此外, 有时瘤细胞排列密集, 细胞境界不清, 可呈"R-S样"或多核巨细胞; 有时瘤细胞胞质突起似神经元细胞, 有时可见瘤细胞胞质内吞噬的中性粒细胞. 部分病例间质显著黏液样变性, 但仔细寻找总是能找到经典型IMT的梭形细胞束状排列区域. EIMS免疫表型极具特征性: 肿瘤细胞弥漫表达ALK, 绝大多数病例表达模式位于核膜上, 有时核旁胞质阳性[12]; CD30及Vimentin胞质弥漫阳性; Desmin总是核旁胞质强阳性, 尽管只有小部分瘤细胞表达.
研究[11]表明, EIMS具有特征性RANBP2-ALK基因融合. ALK即间变性淋巴瘤激酶是一种跨膜酪氨酸激酶, 最早是在间变性大细胞淋巴瘤(anaplastic large cell lymphoma, ALCL)中发现, 他是一种特征性易位t(2;5)(NPM-ALK)所产生的融合蛋白的一部分[13]. 在正常组织中, ALK表达仅限于中枢神经系统[14]. 在肿瘤组织中ALK表达也并不多见, 除了部分淋巴瘤[15,16], 40%-60%的IMT可出现ALK基因重排[6,8,9,17,18]. 另外, 横纹肌肉瘤、平滑肌肉瘤、脂肪肉瘤、尤文肉瘤、未分化肉瘤等间叶性肿瘤也可表达ALK蛋白[15,16]. ALK可与多种基因融合形成不同的染色体重排, 并且依据融合蛋白部位的不同, 其阳性表达模式亦不相同. RANBP2-ALK基因表达产物是定位于核膜的大分子蛋白, 因此ALK在EIMS中阳性定位于核膜. 在ALCL和经典型IMT中, ALK基因可与TPM3、TPM4、CLTC、NPM、1 RANBP2、CARS和11ATIC12等多种基因融合, 而呈现胞质细颗粒状、胞膜/胞质、胞膜下堆积及胞核和/或胞质等不同的阳性表达模式[18-22].
本例男性患者, 大网膜结节样巨大肿物; 镜下以中性粒细胞为主的炎症性水肿黏液样背景中圆形至上皮样细胞松散分布, 肿瘤细胞泡状核, 核仁明显, 胞质嗜双色性或嗜酸性; 免疫组织化学示ALK核膜、CD30胞质弥漫强阳性, Desmin核旁胞质局灶强阳性; Fish示ALK基因信号分离. 以上临床病理特征与文献报道[11,12]相符, 最后诊断EIMS.
EIMS需要与以下肿瘤进行鉴别[23-25]: (1)ALK阳性ALCL: 特别是肉瘤样型ALCL镜下炎症性黏液样背景中上皮样瘤细胞松散分布, 且免疫组织化学ALK及CD30阳性, 很难与EIMS鉴别. 但后者ALK呈胞核和/或胞质颗粒状、胞膜和胞质等表达模式, 不会出现核膜阳性的表达模式; 而EIMSRANBP2-ALK基因融合及表达Desmin均可以与ALCL相鉴别; (2)黏液炎症性纤维母细胞肉瘤(myxoinflammatory fibroblastic sarcoma, AMIFS): 炎症性黏液样背景中散在大而异型的肌纤维母细胞, 形态学不易与前者鉴别, 虽然AMIFS好发肢端, 但已有腹腔内AMIFS的病例报道, 免疫组织化学不表达ALK及CD30有助于鉴别; (3)滤泡树突细胞肉瘤(follicular dendritic cell sarcoma, FDCS): 少数病例瘤细胞呈上皮样、间质富于黏液样变性、炎症细胞浸润, 但表达CD21、CD23或CD35, 而不表达ALK、CD30及Desmin可以鉴别; (4)炎性上皮样平滑肌肉瘤: 平滑肌肉瘤的一种罕见亚型, 肿瘤细胞有时呈圆形或上皮样, 间质以淋巴细胞为主, 偶尔为中性粒细胞, 可以发生黏液样变, 表达Desmin、SMA等肌源性标志物, 尽管有的病例表达ALK, 但不会出现核膜阳性的表达模式, 且CD30阴性; (5)胃肠道间质瘤(gastrointestinal stromal tumors, GIST): 尽管炎症性黏液样背景的上皮样GIST很罕见, 但腹腔内间叶性肿瘤首先要排除GIST, 免疫组织化学CD117、CD34、Dog-1可以鉴别; (6)横纹肌肉瘤: 尽管也表达ALK及Desmin, 但无EIMS的ALK核膜表达模式, 且其肿瘤细胞形态较为一致, 间质罕见炎症性黏液样背景; (7)黏液样型纤维肉瘤及低级别纤维黏液样肉瘤: 常发生四肢皮下, 低倍镜下呈细胞稀少的黏液样、纤维样区域相互移行过渡的多结节样结构, 但肿瘤细胞形态温和, 通常为梭形或星形, 不表达ALK、Desmin及CD30.
上皮样炎性肌纤维母细胞肉瘤(epithelioid inflammatory myofibroblastic sarcoma, EIMS)是炎性肌纤维母细胞肿瘤的罕见特殊亚型, 迄今国内外文献报道不足20例, 可能与该病新近报道、对其认识不足有关.
耿明, 主任医师, 中国人民解放军济南军区总医院医技楼10楼病理科
与经典型炎性肌纤维母细胞肿瘤相比, EIMS的临床病理特征、免疫表型及分子遗传学等均有其特殊性, 生物学行为更具侵袭性, 肿瘤易快速复发、甚至发生转移, 预后很差.
2011年由Mariño-Enríquez等首先报道, 因肿瘤细胞呈明显的上皮样、细胞异型性显著, 生物学行为更具侵袭性、预后更差而命名. EIMS好发于青年男性, 肿瘤几乎只发生于腹腔内大网膜、肠系膜等, 最近有报道发生于胸膜腔内的EIMS.
本文对1例腹腔内EIMS进行临床病理特征、免疫表型、分子遗传学检测及观察, 并结合文献进行复习. EIMS镜下以中性粒细胞为主的炎症性黏液样背景中圆形至上皮样细胞松散分布, 肿瘤细胞泡状核, 核仁明显, 胞质嗜双色性; 免疫表型ALK特征性核膜阳性, CD30胞质阳性, Desmin核旁胞质局灶强阳性; Fish示ALK基因信号分离.
大部分炎性肌纤维母细胞肿瘤可检测到ALK基因重排, 具有多种不同的融合基因类型, 包括TPM3、TPM4、CLTC、NPM、1 RANBP2、CARS和11ATIC12等. 依据融合部位不同, ALK阳性表达模式亦不相同. EIMS中融合基因为RANBP2-ALK, 其蛋白表达产物是定位于核膜的大分子蛋白, 因此ALK在EIMS中阳性定位于核膜.
ALK: 即间变性淋巴瘤激酶是一种跨膜酪氨酸激酶, 最早是在间变性大细胞淋巴瘤中发现, 他是一种特征性易位t(2;5)(NPM-ALK)所产生的融合蛋白的一部分. 在正常组织中ALK表达仅限于中枢神经系统. 在肿瘤组织中除了部分淋巴瘤、炎性肌纤维母细胞肿瘤外, 一些软组织肿瘤如横纹肌肉瘤、平滑肌肉瘤、脂肪肉瘤、尤文肉瘤、未分化肉瘤等间叶性肿瘤也可表达ALK蛋白.
本文通过对1例腹腔上皮样炎性肌纤维母细胞肉瘤的临床病理学特征、免疫组织化学及分子遗传学特征的分析, 并结合文献, 较系统的对上皮样炎性肌纤维母细胞肉瘤进行介绍和讨论. 设计合理, 思路清晰, 语言流畅.
| 1. | Palaskar S, Koshti S, Maralingannavar M, Bartake A. Inflammatory myofibroblastic tumor. Contemp Clin Dent. 2011;2:274-277. [PubMed] [DOI] |
| 3. | Mariño-Enríquez A, Wang WL, Roy A, Lopez-Terrada D, Lazar AJ, Fletcher CD, Coffin CM, Hornick JL. Epithelioid inflammatory myofibroblastic sarcoma: An aggressive intra-abdominal variant of inflammatory myofibroblastic tumor with nuclear membrane or perinuclear ALK. Am J Surg Pathol. 2011;35:135-144. [PubMed] [DOI] |
| 4. | Sarmiento DE, Clevenger JA, Masters GA, Bauer TL, Nam BT. Epithelioid inflammatory myofibroblastic sarcoma: a case report. J Thorac Dis. 2015;7:E513-E516. [PubMed] [DOI] |
| 5. | Wu H, Meng YH, Lu P, Ning HY, Hong L, Kang XL, Duan MG. Epithelioid inflammatory myofibroblastic sarcoma in abdominal cavity: a case report and review of literature. Int J Clin Exp Pathol. 2015;8:4213-4219. [PubMed] |
| 6. | Liu Q, Kan Y, Zhao Y, He H, Kong L. Epithelioid inflammatory myofibroblastic sarcoma treated with ALK inhibitor: a case report and review of literature. Int J Clin Exp Pathol. 2015;8:15328-15332. [PubMed] |
| 7. | Kozu Y, Isaka M, Ohde Y, Takeuchi K, Nakajima T. Epithelioid inflammatory myofibroblastic sarcoma arising in the pleural cavity. Gen Thorac Cardiovasc Surg. 2014;62:191-194. [PubMed] [DOI] |
| 8. | Kimbara S, Takeda K, Fukushima H, Inoue T, Okada H, Shibata Y, Katsushima U, Tsuya A, Tokunaga S, Daga H. A case report of epithelioid inflammatory myofibroblastic sarcoma with RANBP2-ALK fusion gene treated with the ALK inhibitor, crizotinib. Jpn J Clin Oncol. 2014;44:868-871. [PubMed] [DOI] |
| 9. | Lee JC, Wu JM, Liau JY, Huang HY, Lo CY, Jan IS, Hornick JL, Qian X. Cytopathologic features of epithelioid inflammatory myofibroblastic sarcoma with correlation of histopathology, immunohistochemistry, and molecular cytogenetic analysis. Cancer Cytopathol. 2015;123:495-504. [PubMed] [DOI] |
| 10. | Hirsch MS, Dal Cin P, Fletcher CD. ALK expression in pseudosarcomatous myofibroblastic proliferations of the genitourinary tract. Histopathology. 2006;48:569-578. [PubMed] [DOI] |
| 11. | Tsuzuki T, Magi-Galluzzi C, Epstein JI. ALK-1 expression in inflammatory myofibroblastic tumor of the urinary bladder. Am J Surg Pathol. 2004;28:1609-1614. [PubMed] [DOI] |
| 12. | Freeman A, Geddes N, Munson P, Joseph J, Ramani P, Sandison A, Fisher C, Parkinson MC. Anaplastic lymphoma kinase (ALK 1) staining and molecular analysis in inflammatory myofibroblastic tumours of the bladder: a preliminary clinicopathological study of nine cases and review of the literature. Mod Pathol. 2004;17:765-771. [PubMed] [DOI] |
| 13. | Morris SW, Kirstein MN, Valentine MB, Dittmer K, Shapiro DN, Look AT, Saltman DL. Fusion of a kinase gene, ALK, to a nucleolar protein gene, NPM, in non-Hodgkin's lymphoma. Science. 1995;267:316-317. [PubMed] [DOI] |
| 14. | Pulford K, Lamant L, Espinos E, Jiang Q, Xue L, Turturro F, Delsol G, Morris SW. The emerging normal and disease-related roles of anaplastic lymphoma kinase. Cell Mol Life Sci. 2004;61:2939-2953. [PubMed] [DOI] |
| 15. | Cessna MH, Zhou H, Sanger WG, Perkins SL, Tripp S, Pickering D, Daines C, Coffin CM. Expression of ALK1 and p80 in inflammatory myofibroblastic tumor and its mesenchymal mimics: a study of 135 cases. Mod Pathol. 2002;15:931-938. [PubMed] [DOI] |
| 16. | Li XQ, Hisaoka M, Shi DR, Zhu XZ, Hashimoto H. Expression of anaplastic lymphoma kinase in soft tissue tumors: an immunohistochemical and molecular study of 249 cases. Hum Pathol. 2004;35:711-721. [PubMed] [DOI] |
| 17. | Fujiya M, Kohgo Y. ALK inhibition for the treatment of refractory epithelioid inflammatory myofibroblastic sarcoma. Intern Med. 2014;53:2177-2178. [PubMed] [DOI] |
| 18. | Cook JR, Dehner LP, Collins MH, Ma Z, Morris SW, Coffin CM, Hill DA. Anaplastic lymphoma kinase (ALK) expression in the inflammatory myofibroblastic tumor: a comparative immunohistochemical study. Am J Surg Pathol. 2001;25:1364-1371. [PubMed] [DOI] |
| 19. | Bridge JA, Kanamori M, Ma Z, Pickering D, Hill DA, Lydiatt W, Lui MY, Colleoni GW, Antonescu CR, Ladanyi M. Fusion of the ALK gene to the clathrin heavy chain gene, CLTC, in inflammatory myofibroblastic tumor. Am J Pathol. 2001;159:411-415. [PubMed] [DOI] |
| 20. | Kinoshita Y, Tajiri T, Ieiri S, Nagata K, Taguchi T, Suita S, Yamazaki K, Yoshino I, Maehara Y, Kohashi K. A case of an inflammatory myofibroblastic tumor in the lung which expressed TPM3-ALK gene fusion. Pediatr Surg Int. 2007;23:595-599. [PubMed] [DOI] |
| 21. | 杨 菁, 赵 晓曦, 金 铃, 段 彦龙, 黄 爽, 张 梦, 张 蕊, 周 春菊, 张 永红. 间变性大细胞淋巴瘤患者骨髓及外周血NPM-ALK融合基因表达与预后的关系. 中华血液学杂志. 2013;34:700-703. |
| 22. | Ma Z, Hill DA, Collins MH, Morris SW, Sumegi J, Zhou M, Zuppan C, Bridge JA. Fusion of ALK to the Ran-binding protein 2 (RANBP2) gene in inflammatory myofibroblastic tumor. Genes Chromosomes Cancer. 2003;37:98-105. [PubMed] [DOI] |
| 23. | Minoo P, Wang HY. ALK-immunoreactive neoplasms. Int J Clin Exp Pathol. 2012;5:397-410. [PubMed] |
| 24. | Alaggio R, Coffin CM, Dall'igna P, Bisogno G, Olivotto A, Di Venosa B, Fassina A. Myxoinflammatory fibroblastic sarcoma: report of a case and review of the literature. Pediatr Dev Pathol. 2012;15:254-258. [PubMed] [DOI] |
| 25. | Grogg KL, Macon WR, Kurtin PJ, Nascimento AG. A survey of clusterin and fascin expression in sarcomas and spindle cell neoplasms: strong clusterin immunostaining is highly specific for follicular dendritic cell tumor. Mod Pathol. 2005;18:260-266. [PubMed] [DOI] |
| 26. | Kurihara-Hosokawa K, Kawasaki I, Tamai A, Yoshida Y, Yakushiji Y, Ueno H, Fukumoto M, Fukushima H, Inoue T, Hosoi M. Epithelioid inflammatory myofibroblastic sarcoma responsive to surgery and an ALK inhibitor in a patient with panhypopituitarism. Intern Med. 2014;53:2211-2214. [PubMed] [DOI] |
| 27. | Zhou J, Jiang G, Zhang D, Zhang L, Xu J, Li S, Li W, Ma Y, Zhao A, Zhao Z. Epithelioid inflammatory myofibroblastic sarcoma with recurrence after extensive resection: significant clinicopathologic characteristics of a rare aggressive soft tissue neoplasm. Int J Clin Exp Pathol. 2015;8:5803-5807. [PubMed] |
编辑: 于明茜 电编:都珍珍