修回日期: 2016-04-20
接受日期: 2016-04-25
在线出版日期: 2016-05-28
目的: 探讨人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)表达程度与正电子发射断层扫描(positron emission tomography, PET)-CT标化摄取值(standardized uptake value, SUV)max的关系, 从而定量评价胃癌组织中HER2表达情况, 进而间接评价胃癌的生物学特性.
方法: 回顾性分析57例郑州大学第一附属医院胃腺癌患者的PET-CT扫描资料, 测量最大标准摄取值. 应用免疫组织化学方法检测胃癌中HER2的表达, 用统计学方法分析SUVmax与HER2的相关性.
结果: 所有患者HER2阳性者28例, HER2表达阳性率为49.12%, 按照统计学方法分析得出HER2阳性组SUVmax高于阴性组, 且差异具有统计学意义(8.9357±4.21375 vs 4.6448±3.18597, P = 0.000). SUVmax与HER2呈中度正相关, 相关系数为0.581. 以SUVmax为参考值绘制受试者工作特征曲线, 曲线下面积为0.83, 根据不同SUVmax值所对应特异度、灵敏度及约登指数可得出, 当SUVmax值为5.800时所对应的约登指数越大, 灵敏度为82.1%, 特异度为79.8%.
结论: 胃癌组织中SUVmax与胃癌病灶中的HER2的表达具有一定的相关性, 能较好的评估胃癌的生物学特性.
核心提示: 人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)以及正电子发射断层扫描(positron emission tomography, PET)-CT最大标化摄取值(standardized uptake value, SUV)均可反应肿瘤的血供情况, 本研究中胃癌HER2的表达以及SUVmax值呈中度相关, 术前通过行PET-CT得到SUVmax, 从而定量评价胃癌组织中HER2表达情况, 进而间接评价胃癌的生物学特性.
引文著录: 张健楠, 刘洋, 高剑波, 谢新立, 郭丹丹, 李佳音. PET-CT最大标准摄取值定量评估胃癌组织中HER2的表达情况. 世界华人消化杂志 2016; 24(15): 2312-2318
Revised: April 20, 2016
Accepted: April 25, 2016
Published online: May 28, 2016
AIM: To investigate the relationship between the maximum standardized uptake value (SUVmax) and human epidermal growth factor receptor 2 (HER2) expression in gastric carcinoma.
METHODS: Sixty-one patients who underwent PET-CT at our hospital and had pathologically proven gastric adenocarcinoma were included, and SUVmax was measured. HER2 expression was detected by immunohistochemistry. The correlation between SUVmax and HER2 expression was analyzed statistically.
RESULTS: Of all the patients, 28 were positive for HER2, with a positive rate of 49.12%. The SUVmax for the HER2 positive group was 4.6448 ± 3.18597, which was significantly higher than that for the HER2 negative group (P = 0.000). There was a moderate positive correlation between SUVmax and HER2, and the correlation coefficient was 0.581. According to the ROC analysis, the area under the curve of SUVmax was 0.83. Taking 5.800 as the threshold of SUVmax, the corresponding sensitivity and specificity were 82.1% and 79.8%, respectively.
CONCLUSION: There is a moderate correlation between SUVmax and HER2 in gastric adenocarcinoma, and SUVmax can help assess the biological characteristics of gastric cancer.
- Citation: Zhang JN, Liu Y, Gao JB, Xie XL, Guo DD, Li JY. Correlation between PET-CT maximum standardized uptake value and HER2 expression in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2016; 24(15): 2312-2318
- URL: https://www.wjgnet.com/1009-3079/full/v24/i15/2312.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i15.2312
胃癌是第三大恶性肿瘤, 其死亡率居于世界首位[1]. 有学者认为, 人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)促进了胃癌的发生及发展, 并成为胃癌独立预后的一个指标[2,3]. 正电子发射断层扫描(positron emission tomography, PET)-CT既有PET功能显像的优势, 又有CT解剖学诊断的特点, 一次检查可以获得关于疾病的全身信息, 在胃癌术前诊断和术后随访中起着不可替代的作用[4]. 标化摄取值(standardized uptake value, SUV)是用以肿瘤组织摄取18F-FDG示踪剂定量指标, 临床通常取SUV值的大小来鉴别良性病变与恶性肿瘤, 并可提示肿瘤的恶性程度[5], 可SUVmax在胃癌中的HER2应用报道[6]并不多, 二者之间的相关性尚未十分明确. 本研究将主要探讨HER2表达程度与PET-CT SUVmax的关系, 从而定量评价胃癌组织中HER2表达情况, 进而间接评价胃癌的生物学特性.
回顾性分析2013-05/2015-06于郑州大学第一附属医院行手术治疗且病理结果行HER2免疫组织化学检测的57例胃腺癌患者, 其中男性43例, 女14例, 年龄25-82岁(中位年龄59.95岁). 所有患者均于术前1 wk行PET-CT(德国西门子Biograph 64 Truepoint PET-CT)检查.
1.2.1 检查: 显像仪器为德国西门子公司生产的Biograph 64 Truepoint PET-CT. 显像剂是由日本住友公司生产的18F经北京派特科技有限公司生产的PET-FDG-IT-1自动合成模块合成的18F-FDG, 18F-FDG经高压液相层析测定放射化学纯度达95%以上.
检查前嘱患者空腹6-8 h, 测量末梢血糖于检查前, 控制血糖低于11.00 mmol/L, 若患者血糖高于11.00 mmol/L, 则通过皮下注射适量胰岛素达到降低血糖浓度的目的. 根据患者的身高、体质量, 静脉注射18F-FDG 296-370 MBq(8-10 mCi), 注射剂量0.12 mCi/kg. 注射后嘱患者饮水至少800-1000 mL使胃充盈, 在安静、避光的环境中平卧休息至少1 h, 另检查前需嘱患者排空膀胱.
所有人员均行18F-FDG PET-CT全体部显像. 自患者颅顶到双侧股骨中段, 先行螺旋CT扫描. CT扫描参数: 管电压120 kV, 电流100-250 mA, 球管单圈旋转时间0.8 s. 后以2.5 min/床位进行PET三维扫描.
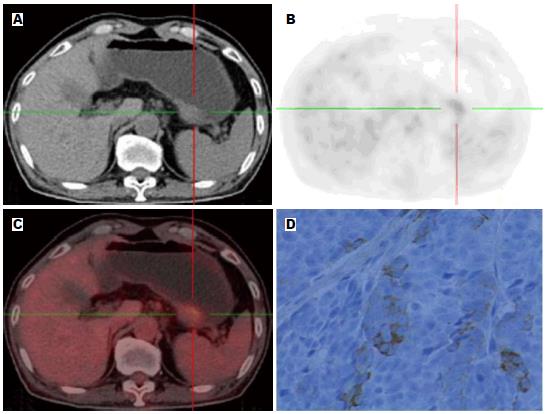
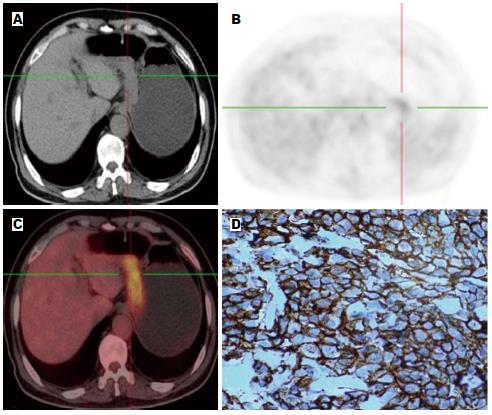
1.2.2 数据采集及分析: 采用CT进行衰减校正, 后行迭代法重建, 重建图像在Syngo工作站上与CT图像进行融合, 分别得到冠状面、矢状面和横断面CT、PET及PET-CT融合图像. 由PET-CT中心具有丰富经验的2位高年资核医学科医师阅片, 对结果进行视觉分析和半定量分析. 视觉分析评分方法[7]: 0 = 正常, 1 = 轻微摄取, 2 = 中等摄取(≥纵隔, <肝), 3 = 高摄取(≥肝), 4 = 强摄取(≥脑皮质), 视觉分析后分别在病灶显像剂浓聚处勾"感兴趣区(region of interest, ROI), ROI尽量将病灶完全覆盖, 经软件自动计算获得SUV, 本研究中采用SUVmax作为分析指标.
1.2.3 病理分析: 选取适当癌组织, 通过免疫组织化学染色的方法检测癌组织中的HER2表达情况. 评分标准: (1)0: 胞膜无染色或者<10%肿瘤细胞膜染色; (2)1+: ≥10%肿瘤细胞微弱或隐约可见膜染色, 仅有部分细胞膜染色; (3)2+: ≥10%肿瘤细胞有弱到中度的基底侧膜、侧膜或完全性膜染色; (4)3+: ≥10%肿瘤细胞基底侧膜、侧膜或完全性膜强染色. 由2位经验丰富的病理科医生检测HER2的表达程度. 既往研究[8]表明0和1+为阴性, 2+与3+为阳性.
统计学处理 应用SPSS21.0软件进行数据分析, 年龄、性别等临床资料利用卡方检验分析; 计量资料采用mean±SD表示, 两组数据符合正态分布及方差齐性采用t检验; 胃癌组织SUVmax与HER2之间采用Spearman非参数相关分析, |r|≥0.8为高度相关, 0.5≤|r|<0.8为中度相关, 0.3≤|r|<0.5为低度相关, |r|<0.3为极弱相关. 检验水准α = 0.05, 以P<0.05为差异有统计学意义. 对有意义的数据进行受试者工作特征曲线(receiver operating characteristic, ROC)的绘制, 记录曲线下面积(area under the curve, AUC)、阈值及对应的敏感度和特异度.
所有患者HER2阴性者29例, 其中男性21例, 女性8例; <50岁者4例, ≥50岁者25例; 中高分化腺癌19例, 低分化腺癌10例HER2阳性者28例, 其中男性22例, 女性6例; <50岁者5例, ≥50岁者23例; 中高分化腺癌16例, 低分化腺癌12例HER2表达阳性率为49.12%. 将此临床资料利用卡方检验分析, 得出P值分别为0.589、0.674、0.516, 均>0.05, 说明胃癌组织中HER2的表达与性别、年龄、分化程度无关(表1).
| 资料 | 阳性 | 阴性 | χ2值 | P值 |
| 性别 | 0.292 | 0.589 | ||
| 男 | 22 | 21 | ||
| 女 | 6 | 8 | ||
| 年龄(岁) | 0.177 | 0.674 | ||
| <50 | 5 | 4 | ||
| ≥50 | 23 | 25 | ||
| 分化程度 | 0.422 | 0.516 | ||
| 中高分化 | 16 | 19 | ||
| 低分化 | 12 | 10 |
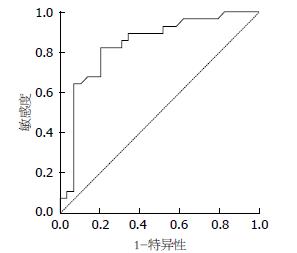
按照统计学方法分析所测得胃癌组织的SUVmax得出: HER2阴性组的SUVmax为4.6448±3.18597, HER2阳性组的SUVmax为8.9357±4.21375, HER2阳性组SUVmax高于阴性组, 且差异具有统计学意义(t = -4.291, P = 0.000). SUVmax与HER2呈中度正相关, 相关系数为0.581(图1, 2). 由HER2阴性阳性所对应的SUV值绘制相应的ROC曲线(图3), 一般认为AUC在0.5-0.7之间诊断准确性较低, 0.7-0.9之间诊断准确性中等, >0.9诊断准确性较高. AUC = 0.83>0.70, 说明SUVmax值对于HER2的表达确定具有一定的诊断价值. SUVmax值不同时所对应的灵敏度及特异度不同(表2), 所确定的诊断阈值为5.800. 即当SUVmax值>5.800时HER2的灵敏度为82.1%, 特异度为79.8%.
| SUVmax | 2.800 | 3.800 | 4.800 | 5.800 | 6.800 | 7.800 |
| 灵敏度 | 96.4 | 89.3 | 85.7 | 82.1 | 64.3 | 50.0 |
| 特异度 | 27.6 | 48.3 | 65.5 | 79.8 | 31.0 | 31.0 |
胃癌是最常见的消化系恶性肿瘤之一, 多数患者在确诊时已处于进展期, 预后较差[9]. 胃癌患者的预后与TNM分期、病理分化程度、肿瘤相关因子的表达及基因等多种因素相关密切相关, 手术治疗和化疗是目前主要的治疗方案, 准确评价其肿瘤的生物学特征为制定联合治疗方案、判断患者预后、预测术后复发等提供重要的信息[10]. HER2是与胃癌预后具有一定相关性的原癌基因, 与胃癌的生物学特性及预后密切相关, 是胃癌肿瘤细胞标志性分子靶点之一[11,12].
HER2在血管生成因子诱导的血管生成中发挥着重要作用, 其通过上调血管内皮生长因子, 促进肿瘤血管的生成[13,14]. 由此可见, 对于胃癌组织的血管生成情况的术前评估无论在治疗方案的确定与预后情况的评估都起着非常重要的作用的. 而研究[15]表明, 对于胃癌HER2过表达者, 曲妥珠单抗能显著延长其生存期限, 目前其检测已经被纳入新的临床治疗指南. 按照HER2改良评分标准进行分组, 2+以上定义为过表达即阳性, HER2的阳性表达率为8.2%-53.4%[16], 本文研究的阳性表达率为49.12%与其相符. HER2的过表达与胃癌的Borrmann分型、Lauren分型、肿瘤的分化程度、淋巴结的状态、静脉的浸润等有关[17]. 本文研究中发现HER2的表达于性别、年龄及分化程度均无关, 与既往研究[18]结果一致.
目前关于HER2对胃癌影像学表现的影响的研究并不多, 主要研究集中在HER2表达与CT表现征像及相关参数的关系, 研究[19,20]发现, HER2过表达的胃癌的CT强化率、标准化碘浓度比越高. 影像学检查在胃癌的诊断和随访中起着不可替代的作用, CT是术前诊断和随访最常用的检查, 在胃癌的T分期、淋巴结转移及化疗疗效评估中的价值得到了肯定[21]. PET-CT可以做到PET与CT的图像进行融合, 可以对病灶进行准确的定性与定位. PET-CT能够从分子水平反映细胞的活性、代谢等[22]. 近年来的研究[23]结果显示, 在临床上恶性肿瘤的分期以及定性方面PET-CT有良好的应用前景. 目前最常用的显像剂是18F-FDG, PET-CT则是测量肿瘤组织对于18F-FDG的SUV来表示肿瘤细胞的代谢, 从而达到诊断肿瘤良恶性的目的. 但是由于胃的解剖和生理结构的特殊性, 使PET-CT在胃癌方面的研究结果差异较大, 目前在寻找原发病灶、区域的淋巴结转移及术后评估方面的应用比较多[24]而关于术前胃癌SUVmax值评估血管生长方式关系的研究较少, 研究[25]发现低分化腺癌的SUVmax值更高.
本文研究主要对胃癌组织中HER2表达以及SUVmax的相关性进行分析, 结果显示: HER2阳性组的SUVmax高于阴性组, SUVmax与HER2表达呈中度相关. 由此可见, 胃癌组织的SUVmax可较好的反映出肿瘤血管的生成状态及情况, 可较好的对其生物学特性进行评估. 主要是由于肿瘤血管的生长速度与肿瘤的良恶性程度相关, 而肿瘤恶性程度越高, 其代谢水平相对增高, 当静脉注射18F-FDG后, 肿瘤对于葡萄糖的需求增高而呈现出高摄取表现, 即SUVmax值增高[26,27]. 且低分化腺癌的肿瘤的血供较中高分化腺癌的更丰富, 18F-FDG的摄取度更高[28], 从而SUVmax值可以定量评价胃癌分化程度, 间接评估了肿瘤的恶性程度, 该研究结果与HER2与SUVmax的相关性研究结果基本一致. 且CT强化率、标准化碘浓度比均可间接反应肿瘤的血供情况, 恶性程度越高的肿瘤强化率、标准化碘浓度比均越高, 与肿瘤PET-CT 18F-FDG的摄取度对良恶性的评估原理一致. 以SUVmax值绘制的ROC曲线, 其AUC即曲线下面积AUC为0.83>0.70, 说明SUVmax值对于HER2的表达的评估具有一定的诊断价值. SUVmax值不同所对应的灵敏度及特异度不同, 但当SUVmax为5.800时, 约登指数最大, 因此所确定的诊断阈值为5.800, 即当SUVmax值>5.800时HER2的灵敏度为0.8, 特异度为0.7. 因此不同的胃腺癌SUVmax值对于HER2的表达的确具有一定的诊断价值. 这与既往研究[29,30]乳腺癌中HER2表达及SUVmax相关性的结果不一致, 但由于胃的生理结构以及解剖位置有一定的特殊性, 与以往研究的可比性不大, 故不做进一步讨论.
目前免疫组织化学染色法成为胃癌组织中检测HER2的的首选方法, 该方法主要通过活检或者术后所采取的标本, 具有一定的创伤性和不可重复性, 同时缺乏在术前对治疗方案和预后情况的预见性. 总之, 术前行PET-CT检查所测得SUVmax值对于评估肿瘤生长方式具有简便, 直观, 创伤小等优势. 但本研究仍存在许多不足之处: 首先, 采用PET-CT扫描的样本量过少, HER2阳性率虽在范围内, 但仍偏高, 需进一步增加病例数, 另外由于本研究为回顾性分析, 所以结果相对缺乏证据性, 需进一步进行前瞻性研究以证实结果的正确性.
人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)与胃癌的生物学特性、治疗方案以及预后密切相关, 可通过正电子发射断层扫描(positron emission tomography, PET)-CT得出标化摄取值(standardized uptake value, SUV)max值从而间接评价肿瘤的生长、转移过程及分化程度.
管樑, 主任医师, 上海交通大学医学院附属瑞金医院核医学科
目前关于HER2的检测局限于免疫组织化学, 具有一定的有创性及不可重复性, 术前通过PET-CT扫描成像技术得到的SUVmax值可以间接的反应HER2的表达情况.
既往研究表明CT强化率、标准化碘浓度比均可间接反映肿瘤的血供情况以及胃癌组织中HER2的相关性, 但常规扫描中, 由于感兴趣区的大小、位置以及肿瘤情况不同, 人为测量且存在的一定误差, 而PET-CT SUV值通过后处理工作站将图像融合, 相对减小了误差存在的可能.
SUV值与肿瘤代谢程度相关, 能够反映肿瘤的血供情况, HER2能够促进肿瘤血管的生成, 因此SUV值能够间接反映HER2的表达情况.
术前将PET-CT所呈图像通过后处理工作站进行图像融合所得SUV值与周围有无淋巴结、肝转移以及胃镜活检结果结合起来, 可以更加准确的评价肿瘤的生物学特征.
SUV: 是用以肿瘤组织摄取18F-FDG示踪剂定量指标, 临床通常取SUV值的大小来鉴别良性病变与恶性肿瘤的病变程度.
本文研究中SUVmax值是PET-CT特有的参数, 有效的反映了肿瘤的代谢情况及血供, 与肿瘤血管生成相关的HER2进行相关性的研究, 具有一定的创新性, 从分子生物学方面解释了肿瘤的影像学表现.
| 1. | Sibertin-Blanc C, Ciccolini J, Norguet E, Lacarelle B, Dahan L, Seitz JF. Monoclonal antibodies for treating gastric cancer: promises and pitfalls. Expert Opin Biol Ther. 2016; Mar 25: 1-11 [Epub ahead of print]. [PubMed] [DOI] |
| 2. | Senoo S, Mannami T, Tamura T, Fujiwara N, Ikeda G, Komoda M, Ohtawa Y, Fujimoto Y, Sato N, Kambara T. [HER2-Positive Advanced Gastric Cancer with Disseminated Intravascular Coagulation and Diffuse Bone Marrow Carcinomatosis Successfully Treated with S-1/Trastuzumab Chemotherapy--A Case Report]. Gan To Kagaku Ryoho. 2015;42:2471-2475. [PubMed] |
| 3. | Oh HS, Eom DW, Kang GH, Ahn YC, Lee SJ, Kim JH, Jang HJ, Kim EJ, Oh KH, Ahn HJ. Prognostic implications of EGFR and HER-2 alteration assessed by immunohistochemistry and silver in situ hybridization in gastric cancer patients following curative resection. Gastric Cancer. 2014;17:402-411. [PubMed] [DOI] |
| 4. | Cui JX, Li T, Xi HQ, Wei B, Chen L. [Evaluation of (18)F-FDG PET/CT in preoperative staging of gastric cancer: a meta-analysis]. Zhonghua Weichang Waike Zazhi. 2013;16:418-424. [PubMed] |
| 5. | Cui J, Zhao P, Ren Z, Liu B. Evaluation of Dual Time Point Imaging 18F-FDG PET/CT in Differentiating Malignancy From Benign Gastric Disease. Medicine (Baltimore). 2015;94:e1356. [PubMed] [DOI] |
| 6. | Chen R, Zhou X, Liu J, Huang G. Relationship between 18F-FDG PET-CT scans and HER2 expression in gastric cancer. J Nucl Med. 2016; Mar 10. [Epub ahead of print]. [PubMed] [DOI] |
| 7. | Cayvarlı H, Bekiş R, Akman T, Altun D. The Role of 18F-FDG PET/CT in the Evaluation of Gastric Cancer Recurrence. Mol Imaging Radionucl Ther. 2014;23:76-83. [PubMed] [DOI] |
| 8. | Bang YJ, Van Cutsem E, Feyereislova A, Chung HC, Shen L, Sawaki A, Lordick F, Ohtsu A, Omuro Y, Satoh T. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010;376:687-697. [PubMed] [DOI] |
| 9. | Shitara K, Yatabe Y, Matsuo K, Sugano M, Kondo C, Takahari D, Ura T, Tajika M, Ito S, Muro K. Prognosis of patients with advanced gastric cancer by HER2 status and trastuzumab treatment. Gastric Cancer. 2013;16:261-267. [PubMed] [DOI] |
| 10. | Sung JK. Diagnosis and management of gastric dysplasia. Korean J Intern Med. 2016;31:201-209. [PubMed] [DOI] |
| 11. | Zhang K, Cui J, Xi H, Bian S, Ma L, Shen W, Li J, Wang N, Wei B, Chen L. Serum HER2 Is a Potential Surrogate for Tissue HER2 Status in Gastric Cancer: A Systematic Review and Meta-Analysis. PLoS One. 2015;10:e0136322. [PubMed] [DOI] |
| 12. | De Carli DM, Rocha MP, Antunes LC, Fagundes RB. Immunohistochemical expression of HER2 in adenocarcinoma of the stomach. Arq Gastroenterol. 2015;52:152-155. [PubMed] [DOI] |
| 13. | Qiu Z, Sun W, Zhou C, Zhang J. HER2 expression variability between primary gastric cancers and corresponding lymph node metastases. Hepatogastroenterology. 2015;62:231-233. [PubMed] |
| 14. | Matsusaka S, Kobunai T, Yamamoto N, Chin K, Ogura M, Tanaka G, Matsuoka K, Ishikawa Y, Mizunuma N, Yamaguchi T. Prognostic impact of KRAS mutant type and MET amplification in metastatic and recurrent gastric cancer patients treated with first-line S-1 plus cisplatin chemotherapy. Genes Cancer. 2016;7:27-35. [PubMed] |
| 15. | Chua TC, Merrett ND. Clinicopathologic factors associated with HER2-positive gastric cancer and its impact on survival outcomes--a systematic review. Int J Cancer. 2012;130:2845-2856. [PubMed] [DOI] |
| 16. | Abrahão-Machado LF, Jácome AA, Wohnrath DR, dos Santos JS, Carneseca EC, Fregnani JH, Scapulatempo-Neto C. HER2 in gastric cancer: comparative analysis of three different antibodies using whole-tissue sections and tissue microarrays. World J Gastroenterol. 2013;19:6438-6446. [PubMed] [DOI] |
| 17. | Liang JW, Zhang JJ, Zhang T, Zheng ZC. Clinicopathological and prognostic significance of HER2 overexpression in gastric cancer: a meta-analysis of the literature. Tumour Biol. 2014;35:4849-4858. [PubMed] [DOI] |
| 19. | 刘 洋, 高 剑波, 岳 松伟, 刘 甲, 高 献争, 郑 琰, 张 燕丽. CT强化率、灌注参数与胃癌病灶中HER2表达的关系. 世界华人消化杂志. 2015;23:426-431. [DOI] |
| 21. | Seevaratnam R, Cardoso R, McGregor C, Lourenco L, Mahar A, Sutradhar R, Law C, Paszat L, Coburn N. How useful is preoperative imaging for tumor, node, metastasis (TNM) staging of gastric cancer? A meta-analysis. Gastric Cancer. 2012;15 Suppl 1:S3-S18. [PubMed] [DOI] |
| 23. | Chen R, Chen Y, Liu L, Zhou X, Liu J, Huang G. The Role of 18F-FDG PET/CT in the Evaluation of Peritoneal Thickening of Undetermined Origin. Medicine (Baltimore). 2016;95:e3023. [PubMed] [DOI] |
| 24. | Yun M. Imaging of Gastric Cancer Metabolism Using 18 F-FDG PET/CT. J Gastric Cancer. 2014;14:1-6. [PubMed] [DOI] |
| 25. | Sollini M, Calabrese L, Zangheri B, Erba PA, Gramaglia A, Gasparini M. (18)F-FDG PET/CT versus bone scintigraphy in the follow-up of gastric cancer. Rev Esp Med Nucl Imagen Mol. 2016;35:121-123. [PubMed] [DOI] |
| 26. | Müller J, Hüllner M, Strobel K, Huber GF, Burger IA, Haerle SK. The value of (18) F-FDG-PET/CT imaging in oral cavity cancer patients following surgical reconstruction. Laryngoscope. 2015;125:1861-1868. [PubMed] [DOI] |
| 27. | Kim J, Lim ST, Na CJ, Han YH, Kim CY, Jeong HJ, Sohn MH. Pretreatment F-18 FDG PET/CT Parameters to Evaluate Progression-Free Survival in Gastric Cancer. Nucl Med Mol Imaging. 2014;48:33-40. [PubMed] [DOI] |
| 28. | Altini C, Niccoli Asabella A, Di Palo A, Fanelli M, Ferrari C, Moschetta M, Rubini G. 18F-FDG PET/CT role in staging of gastric carcinomas: comparison with conventional contrast enhancement computed tomography. Medicine (Baltimore). 2015;94:e864. [PubMed] [DOI] |
| 29. | Kim JY, Lee SH, Kim S, Kang T, Bae YT. Tumour 18 F-FDG Uptake on preoperative PET/CT may predict axillary lymph node metastasis in ER-positive/HER2-negative and HER2-positive breast cancer subtypes. Eur Radiol. 2015;25:1172-1181. [PubMed] [DOI] |
| 30. | Koo HR, Park JS, Kang KW, Cho N, Chang JM, Bae MS, Kim WH, Lee SH, Kim MY, Kim JY. 18F-FDG uptake in breast cancer correlates with immunohistochemically defined subtypes. Eur Radiol. 2014;24:610-618. [PubMed] [DOI] |
编辑: 于明茜 电编:都珍珍