修回日期: 2016-04-13
接受日期: 2016-04-20
在线出版日期: 2016-05-28
目的: 给予大鼠不同剂量、不同时期辣椒素(capsaicin, CAP), 检测胃黏膜屏障、肝肾组织及血常规、血生化, 探讨CAP对胃黏膜屏障的影响及肝肾脏器的安全性.
方法: SD大鼠240只, 随机分实验组与对照组, 实验组分别给予0.1 mg/(kg•d)、1.0 mg/(kg•d)、5.0 mg/(kg•d) CAP饲料, 分别于第1、7、14、28天检测血常规、血生化. 处死大鼠检测胃黏膜屏障及肝肾组织.
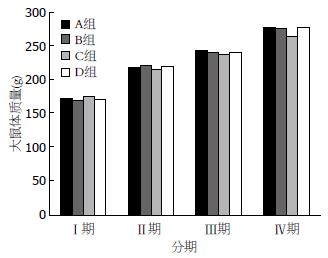
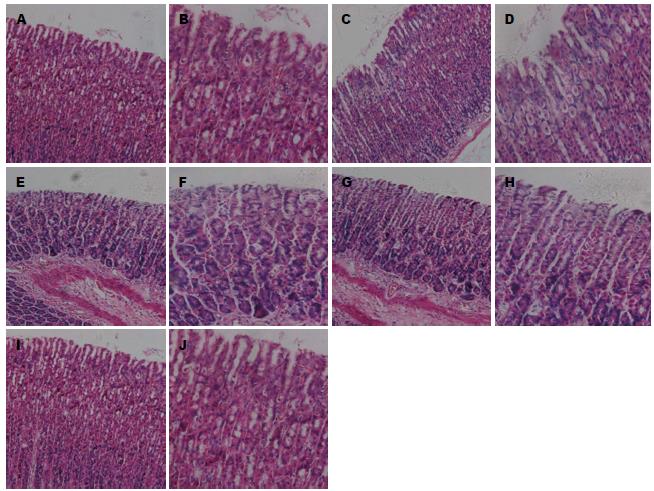
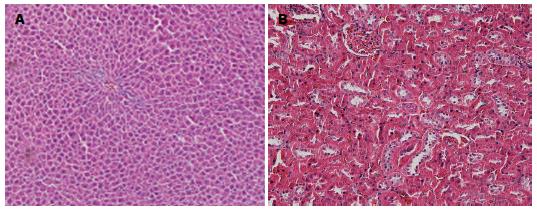
结果: 各组大鼠状态均良好; 大鼠体质量均增加, C组Ⅳ期体质量增加较缓慢, 但与对照组D组相比无统计学意义. 各组大鼠胃黏膜光滑, 未见糜烂出血, Guth评分均为0分. HE染色光镜下观察实验组与对照组大鼠胃黏膜Masude评分无统计学差异(P>0.05). 血常规、血生化的检测: 各实验组与对照组血常规、谷草转氨酶(aspartate transaminase, AST)、谷丙转氨酶(alanine transaminase, ALT)、血肌酐(crea, Cr)检测均无统计学差异. B组、C组血胆固醇(cholesterol, CHOL)及甘油三酯(triglyceride, TG)浓度在Ⅲ、Ⅳ期下降, 与D组相比有统计学意义. 各实验组大鼠肝肾组织HE染色均未见异常.
结论: 大鼠摄入CAP 0.1-5mg/(kg•d)饲料, 1-28 d对胃黏膜屏障、肝肾组织无损伤, 对大鼠血常规、AST、ALT、Cr均无影响. 大鼠摄入CAP 1.0-5.0 mg/(kg•d)饲料14-28 d可以调节血脂代谢, 降低血脂浓度.
核心提示: 本文研究中各组血脂的变化说明辣椒素不仅可以作为新型胃黏膜保护用药, 还可以调节体内代谢紊乱、降低血脂, 作为新一代安全有效减肥药.
引文著录: 徐劲, 彭燕. 小剂量辣椒素对大鼠胃黏膜屏障的影响. 世界华人消化杂志 2016; 24(15): 2304-2311
Revised: April 13, 2016
Accepted: April 20, 2016
Published online: May 28, 2016
AIM: To explore the effect of different doses of capsaicin (CAP) given for different durations on gastric mucosal barrier, liver and kidney histopathology, blood tests, and blood biochemistry in rats.
METHODS: Two hundred and forty SD rats were randomly divided into either an experimental group or a control group (group D). The experimental group was further divided into subgroups, which were given 0.1 mg/(kg•d) (group A), 1.0 mg/(kg•d) (group B), or 5.0 mg/(kg•d) CAP (group C) for 1 d, 7 d, 14 d or 28 d. Blood tests and blood biochemistry were measured. Gastric mucosa barrier and liver and kidney histopathology were assessed.
RESULTS: The status of rats in each group was good. The weight of all rats increased, and the weight of rats in group C increased relatively slowly, although there was no significant difference compared with group D. Rats of all groups had smooth gastric mucosa and had no erosion or bleeding. Guth score was 0 points for all rats. HE staining analysis showed that Masude score had no statistical differences among all groups (P > 0.05). Routine blood tests, AST, ALT and crea showed no statistical difference among each group. Serum CHOL and TG in groups B and C significantly decreased compared with group D. Liver and kidney histopathology was not affected in all groups.
CONCLUSION: Intragastric administration of low dose capsaicin had no significant impact on gastric mucosa barrier, liver and kidney histopathology, routine blood tests, AST, ALT and crea.
- Citation: Xu J, Peng Y. Effect of intragastric administration of capsaicin on gastric mucosal barrier in rats. Shijie Huaren Xiaohua Zazhi 2016; 24(15): 2304-2311
- URL: https://www.wjgnet.com/1009-3079/full/v24/i15/2304.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i15.2304
研究辣椒素(capsaicin, CAP)药理相关的生物活性, 已发现CAP有镇痛、抗癌、抗氧化、降血脂等作用[1-4]. 既往研究主要集中于胃黏膜损伤后, CAP发挥保护、促进胃黏膜屏障修复的作用, 而CAP安全剂量尚无明确限定, 不同剂量CAP本身对胃黏膜屏障、肝肾功能的影响相关研究较少. 本文研究不同剂量、不同时间CAP饲料喂食大鼠, 探讨CAP对大鼠胃黏膜屏障、血常规、血生化及肝肾组织学的影响.
1.1 材料
清洁级SD成年大鼠160只, 雌雄各半(泸州医学院实验动物中心提供), 体质量160-180 g. 用代谢笼饲养, 通风良好, 温度24 ℃±1 ℃, 湿度60%±5%. 大鼠饲养2 wk以适应环境. CAP(99%, Sigma)、血液学分析仪、生化分析仪等. 玉米粉(五谷康, 成都), 香油(购自当地市场).
1.2 方法
1.2.1 CAP饲料配制: 玉米粉0.5 kg+香油0.5 kg+99% CAP 50.0 mg, 即得到浓度为每10 g CAP饲料含有CAP 1.0 mg; 每日根据大鼠体质量计算CAP饲料给予量.
1.2.2 实验分组: 实验组大鼠160只, 根据CAP剂量不同分为A组、B组、C组及对照组D组. 每组实验分4期完成, 分期方法: Ⅰ期为1 d, Ⅱ期为1 wk, Ⅲ期为2 wk, Ⅳ期为4 wk. 每组每期大鼠各10只. 具体如下: A、B、C三组分别摄入CAP饲料0.1 mg/kg、1.0 mg/kg和5.0 mg/kg, 完成后给予普通饲料, 自由进食进水; D组: 摄食普通饲料, 自由进食进水.
1.2.3 检测指标: 实验过程中观察大鼠的精神状态、食欲、大小便等一般情况; 每天测量并记录大鼠体质量1次; 在各组实验完成后, 大鼠空腹12 h, 给予氯胺酮全麻后, 心脏穿刺采血. 用血液分析仪测定各小组白细胞、红细胞、血小板计数. 采用比色法通过生化分析仪测定各小组谷草转氨酶(aspartate transaminase, AST)、谷丙转氨酶(alanine transaminase, ALT)、血肌酐(crea, Cr)、血胆固醇(cholesterol, CHOL)、甘油三酯(triglyceride, TG). 胃黏膜屏障的检测: 戊巴比妥钠处死大鼠, 将胃完整取出, 沿胃大弯剪开, 生理盐水冲洗干净, 肉眼观察黏膜情况, 采用Guth标准改良评分标准[5]评定胃黏膜损伤情况; 取胃底、胃体、胃窦组织各3块, 中性甲醛固定, 石蜡包埋, 行病理组织学检查, 采用Masuda等[6]标准评定胃黏膜损伤情况. 处死大鼠后, 取肝脏、肾脏组织, 中性甲醛固定, 石蜡包埋, 行病理组织学检查.
统计学处理 结果采用SPSS19.0统计软件分析, 计量资料以mean±SD表示, 检验水准α = 0.05, P<0.05认为差异有统计学意义.
各组大鼠精神状态良好, 行动灵活, 食欲佳, 皮毛光滑, 大小便正常, 无死亡. 各组大鼠体质量均呈增加趋势, 各组Ⅰ期与Ⅱ期、Ⅱ期与Ⅲ期、Ⅲ期与Ⅳ期体质量增加量均有显著性差异(P<0.05), 但C组大鼠Ⅳ期较Ⅲ期体质量增加量相对较少. 同期比较: Ⅰ期、Ⅱ期、Ⅲ、Ⅳ期各组之间体质量没有显著性差; 但是C组Ⅳ期大鼠体质量增加较其余各组缓慢(图1).
所有实验组及对照组大鼠胃黏膜光滑, 未见明显出血、糜烂灶. 根据Guth改良评分, 均为0分. HE染色镜下观察: 光学显微镜下观察所有标本黏膜层结构完整, 深层腺体排列整齐, 各组各期均可见浅表上皮细胞脱落、黏膜浅层充血、胃小凹及黏膜固有层炎性细胞浸润的个体标本, 但实验组与对照组大鼠胃黏膜Masude评分差异无统计学意义(P>0.05)(图2).
实验组及对照组各期血液细胞计数及肝肾功比较如表1. D组大鼠在实验各期白细胞计数较稳定, A组大鼠Ⅲ期时白细胞计数小于其余各期, B组、C组大鼠Ⅳ期时白细胞计数小于其余各期. 红细胞计数在整个实验中表现出稳定的增加, 且与剂量有关, 仅D组大鼠Ⅳ期红细胞计数有轻微减小. 血小板计数在A组Ⅲ期、C组Ⅳ期有轻微减少. 但所有实验组与对照组各期血液细胞计数差异均无统计学意义, CAP 0.1-5.0 mg/(kg•d)、1-28 d持续摄入对大鼠血液系统无明显影响.
| 指标 | A组 | B组 | C组 | D组 |
| WBC(×109/L) | ||||
| Ⅰ | 7.45±1.58 | 7.36±2.27 | 7.13±1.25 | 7.17±1.26 |
| Ⅱ | 7.98±1.99 | 7.38±2.12 | 7.27±1.64 | 7.10±1.67 |
| Ⅲ | 7.18±2.03 | 7.53±1.78 | 7.55±1.99 | 7.02±1.32 |
| Ⅳ | 7.55±1.53 | 7.02±3.03 | 7.07±1.33 | 7.90±2.13 |
| RBC(×1012/L) | ||||
| Ⅰ | 7.06±0.53 | 7.12±0.56 | 7.09±0.47 | 7.10±0.59 |
| Ⅱ | 7.37±0.74 | 7.41±0.95 | 7.53±0.76 | 7.84±0.92 |
| Ⅲ | 7.56±0.66 | 7.72±1.42 | 7.96±1.26 | 8.52±2.57 |
| Ⅳ | 8.19±1.53 | 8.22±1.65 | 8.25±2.24 | 7.36±0.39 |
| PLT(×109/L) | ||||
| Ⅰ | 661.53±135.42 | 588.33±95.62 | 611.22±96.13 | 598.93±132.51 |
| Ⅱ | 618.63±210.89 | 623.47±110.13 | 663.15±144.98 | 605.87±166.53 |
| Ⅲ | 521.50±168.32 | 618.53±90.35 | 608.00±86.48 | 589.83±46.31 |
| Ⅳ | 627.20±95.89 | 632.33±113.98 | 503.03±139.82 | 568.00±76.31 |
表2记录的各组各期AST、ALT、Cr血液浓度无统计学差异, 实验组较对照组血脂浓度有所下降. 其中A组各期血胆固醇及甘油三酯浓度在Ⅱ、Ⅲ、Ⅳ期呈缓慢下降的趋势, 与D组相比均无统计学意义. B组Ⅳ期血胆固醇及甘油三酯浓度明显下降: 同组比较, B组Ⅳ期较Ⅰ期血脂浓度明显降低(P<0.05); 同期比较, B组Ⅳ期血脂较A、D组血脂浓度明显降低(P<0.05). C组Ⅳ期血胆固醇及甘油三酯浓度明显下降: 同组比较, C组Ⅳ期较Ⅰ期血脂浓度明显降低(P<0.05); 同期比较, C组Ⅳ期血脂较A、D组血脂浓度明显降低(P<0.05). C组血脂浓度下降较早, 从Ⅱ、Ⅲ期开始, 与对照组D组相比有统计学意义. B组与C组相比, 血脂下降差异无统计学意义(P>0.05).
| 指标 | A组 | B组 | C组 | D组 |
| ALT(U/L) | ||||
| Ⅰ | 45.22±9.98 | 46.11±8.55 | 42.98±3.97 | 49.52±5.64 |
| Ⅱ | 59.50±18.68 | 51.17±13.59 | 48.67±9.79 | 46.33±8.35 |
| Ⅲ | 49.00±8.05 | 49.69±15.21 | 53.58±14.81 | 58.10±16.96 |
| Ⅳ | 53.27±7.64 | 48.18±3.66 | 49.33±9.83 | 50.10±4.16 |
| AST(U/L) | ||||
| Ⅰ | 196.30±64.10 | 166.12±38.90 | 169.56±33.52 | 188.63±33.56 |
| Ⅱ | 177.67±62.28 | 195.37±54.06 | 152.33±41.22 | 197.00±63.11 |
| Ⅲ | 167.63±47.52 | 182.67±49.96 | 149.83±24.10 | 166.50±25.93 |
| Ⅳ | 172.83±57.72 | 179.00±14.89 | 188.67±62.99 | 179.83±27.88 |
| CHOL(mmol/L) | ||||
| Ⅰ | 1.53±0.27 | 1.45±0.21 | 1.47±0.15 | 1.51±0.33 |
| Ⅱ | 1.44±0.35 | 1.32±0.22 | 1.39±0.18 | 1.48±0.13 |
| Ⅲ | 1.41±0.13 | 1.23±0.36 | 1.34±0.11 | 1.46±0.21 |
| Ⅳ | 1.42±0.08 | 1.18±0.19a | 1.27±0.12a | 1.52±0.32 |
| TG(mmol/L) | ||||
| Ⅰ | 0.58±0.16 | 0.54±0.11 | 0.56±0.13 | 0.49±0.27 |
| Ⅱ | 0.54±0.11 | 0.51±0.02 | 0.43±0.09a | 0.53±0.19 |
| Ⅲ | 0.53±0.21 | 0.48±0.18 | 0.45±0.07a | 0.52±0.12 |
| Ⅳ | 0.51±0.08 | 0.46±0.09a | 0.42±0.11a | 0.54±0.08 |
| Cr(μmol/L) | ||||
| Ⅰ | 44.26±11.29 | 37.55±8.15 | 51.38±18.27 | 34.16±2.42 |
| Ⅱ | 40.36±8.34 | 48.89±15.28 | 45.24±8.78 | 43.58±6.61 |
| Ⅲ | 50.21±16.89 | 43.10±9.36 | 43.36±5.47 | 44.88±8.96 |
| Ⅳ | 48.11±9.73 | 47.13±12.49 | 39.25±9.38 | 37.71±6.50 |
辣椒作为香料用于膳食已有7500年历史[7], CAP是辣椒主要成分. 据统计, 欧洲和美国人的CAP平均消耗量是0.77 mg/d[8], 而在墨西哥、泰国等国家的CAP人均消化量是25.0-200.0 mg/d[9]. 中医讲辣椒有"消宿食、解结气、开胃门、辟邪恶、杀腥气诸毒"的功效. 本研究表明CAP 0.1-5.0 mg/(kg•d)剂量范围、1 d-4 wk持续CAP摄入对大鼠胃黏膜屏障、肝肾组织、血液系统及血生化无明显影响.
现有文献关于CAP对胃黏膜屏障的影响, 主要通过观察CAP对胃酸分泌、胃黏膜血流量、胃排空、胃黏膜组织学等的影响. 大量研究显示CAP对胃黏膜屏障有保护作用主要通过抑制胃酸分泌、增加胃黏膜血流量实现. Li等[10]建立乙醇引起急性胃黏膜损伤的动物模型, 发现用CAP 1.0 mg/kg预处理后, 胃溃疡指数、细胞凋亡蛋白3活性、肿瘤坏死因子-α均明显降低, 而CGRP和超氧化物歧化酶均明显增多, CAP表现出明显的胃黏膜保护作用. Kato等[11]研究表明, 小剂量CAP灌注于大鼠胃内产生胃黏膜保护作用, 并在早期加速胃黏膜的修复. Horie等[12]研究发现予大鼠CAP灌胃能以剂量依赖性的方式抑制由0.6 mol/L HCL引起的胃损伤. Okumi等[13]研究发现口服1.0-100.0 mg/kg CAP表现出剂量依赖性的抑制胃酸分泌作用. Mózsik等[14]检测CAP灌胃后大鼠胃液中各种离子浓度的变化, 发现壁细胞来源的氯离子明显减少, 而非壁细胞来源的氯离子增多, 这说明CAP不仅可以抑制胃酸分泌, 还能促进碱性黏液的分泌. Satyanarayana[15]研究表明CAP能减轻吲哚美辛致胃黏膜损害. Mózsik等[7]实验中受试者同时服用200 μg/kg或400 μg/kg CAP及吲哚美辛, 结果显示与对照组相比受试者急性胃微出血量显著降低, 胃酸分泌减少, 且400 μg/kg组较200 μg/kg组出血量及胃酸分泌量减少. Mizuguchi等[16]发现1.6 mmol/L CAP灌胃抑制胃动力作用与保护胃黏膜的完整性相关. 有动物实验研究发现CAP剂量口服超过154.0 mg/kg或者腹腔内注射超过9.5 mg/kg才表现出典型的中毒症状[17]. 当CAP灌胃剂量达50.0-100.0 mg/kg时, 大鼠胃溃疡模型组的损伤程度明显加重[18]. 本实验中大鼠1 d-4 wk持续摄入CAP饲料0.1-5.0 mg/kg, 并未造成胃黏膜的损伤, 提示小剂量CAP对正常大鼠胃黏膜屏障无损伤作用. CAP是否可减轻其他损伤因素对胃黏膜屏障的破坏作用、促进损伤后胃黏膜屏障的修复, 是本实验小组需要继续完善的部分. Mózsik等[7]提对CAP的研究进入了临床研究阶段, 并发现小剂量CAP可以作为保护胃黏膜的新型口服药, 与非甾体抗炎药(nonsteroidal antiinflammatory drugs, NSAIDs)类药物同用, 可以减轻NSAIDs药物对胃黏膜的损伤. 但是文中未提及不同剂量CAP是否都有保护作用, 因此探讨CAP剂量范围也是本实验小组要继续完善的部分.
过去10年全球范围内的肥胖患者数量猛增, 严重威胁公众健康. 摄入CAP后躯体产热、能量消耗增加, 学者们致力于挖掘CAP作为减肥食品的潜能[19-22]. Mun等[19]研究发现CAP灌胃可明显抑制高脂饮食大鼠体质量的增加. Luo等[23]表明CAP抑制低密度脂蛋白的氧化, 降低大鼠血胆固醇及血脂含量. 临床研究[21,24]中发现摄食CAP 10.0 mg增加肾上腺素活性、能量消耗、安静状态下脂质的代谢, 因此认为摄食CAP可以作为除运动及节食外有效的减肥方法. Kang等[25]研究发现食用CAP通过增加脂联素及其受体的表达, 改善糖尿病肥胖小鼠的新陈代谢, 明显降低空腹血糖、增加胰岛素敏感性、降低血脂等. 本实验研究发现C组大鼠持续摄入CAP 5.0 mg/kg达28 d时, 体质量增加明显减缓, 较对照组D组体质量明显减轻. 实验组血脂浓度明显较对照组低, 表明CAP可改善体内血脂代谢. 虽然同期比较下Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期各组之间体质量没有显著性差, 但是C组Ⅳ期大鼠体质量增加比较缓慢. 在高脂饮食的条件下, CAP发挥降脂作用是否更明显, 这是需要深入研究的.
本实验选择CAP的小剂量, 研究不同剂量、不同时间CAP对肝肾组织、血液系统的影响, 评估CAP使用风险. 研究发现大鼠1 d、1 wk、2 wk、4 wk摄入CAP饲料0.1-10.0 mg/kg, 所有组血常规、肝肾功能检测无统计学差异, 各组大鼠肝、肾组织HE染色均未见异常. Golynski等[26]在实验中给予大鼠不同剂量(折算后: 0.2、0.4、0.6 mg/kg CAP)、不同时间(8 d、28 d)CAP灌胃后, 取胃标本做病理学检测, 各组均未发现任何损伤, 与本实验结果一致. 因此认为CAP 0.1-5.0 mg/(kg•d), 1-28 d对大鼠胃黏膜屏障无损伤, 对大鼠血常规、肝肾功及肝肾组织均无影响. 因此, 0.1-5.0 mg/(kg•d) CAP可广泛用于药理作用的研究.
本实验从不同剂量、不同时间比较了CAP对正常大鼠胃黏膜、肝肾组织、血液系统的影响, 评估大鼠1 d、1 wk、2 wk、4 wk 0.1-5.0 mg/kg CAP摄入的安全性, 为在动物及临床实验中开展CAP药理研究奠定了基础. 此外, 实验中各组血脂的变化说明CAP不仅可以作为新型胃黏膜保护用药, 还可以调节体内代谢紊乱、降低血脂, 作为新一代安全有效减肥药.
既往对辣椒素(capsaicin, CAP)研究主要集中于胃黏膜损伤后, CAP发挥保护、促进胃黏膜屏障修复的作用, 而CAP安全剂量尚无明确限定, 不同剂量CAP本身对胃黏膜屏障、肝肾功能的影响相关研究较少.
许翠萍, 主任医师, 山西医科大学第一医院消化内科
本文通过比较在摄入不同剂量辣椒素、不同时期的大鼠胃黏膜组织、肝肾组织及血常规、血生化, 说明辣椒素在一定剂量、一定时期对于胃黏膜、肝肾组织、肝肾功均无影响(具有安全性), 并且可以调节血脂, 为后期辣椒素的药理研发奠定了理论基础, 具有潜在的应用前景.
| 1. | Remadevi R, Szallisi A. Adlea (ALGRX-4975), an injectable capsaicin (TRPV1 receptor agonist) formulation for longlasting pain relief. IDrugs. 2008;11:120-132. [PubMed] |
| 2. | Thoennissen NH, O'Kelly J, Lu D, Iwanski GB, La DT, Abbassi S, Leiter A, Karlan B, Mehta R, Koeffler HP. Capsaicin causes cell-cycle arrest and apoptosis in ER-positive and -negative breast cancer cells by modulating the EGFR/HER-2 pathway. Oncogene. 2010;29:285-296. [PubMed] [DOI] |
| 3. | Joo JI, Kim DH, Choi JW, Yun JW. Proteomic analysis for antiobesity potential of capsaicin on white adipose tissue in rats fed with a high fat diet. J Proteome Res. 2010;9:2977-2987. [PubMed] [DOI] |
| 4. | Peng J, Li YJ. The vanilloid receptor TRPV1: role in cardiovascular and gastrointestinal protection. Eur J Pharmacol. 2010;627:1-7. [PubMed] [DOI] |
| 5. | Guth PH, Paulsen G, Nagata H. Histologic and microcirculatory changes in alcohol-induced gastric lesions in the rat: effect of prostaglandin cytoprotection. Gastroenterology. 1984;87:1083-1090. [PubMed] |
| 6. | Masuda E, Kawano S, Nagano K, Tsuji S, Takei Y, Hayashi N, Tsujii M, Oshita M, Michida T, Kobayashi I. Role of endogenous endothelin in pathogenesis of ethanol-induced gastric mucosal injury in rats. Am J Physiol. 1993;265:G474-G481. [PubMed] |
| 7. | Mózsik G. Capsaicin as new orally applicable gastroprotective and therapeutic drug alone or in combination with nonsteroidal anti-inflammatory drugs in healthy human subjects and in patients. Prog Drug Res. 2014;68:209-258. [PubMed] [DOI] |
| 8. | Merle P. DU, GÉRAUD la collaboration tec D. Estimation des niveaux d'infestation passés de la tordeuse du sapin Choristoneura murinana (Hb.) (Lép, Tortricidae) par analyse rétrospective des pertes de feuillage et de croissance des arbres. Ann.Sci.For. 1988;45:357-381. [DOI] |
| 9. | Datasheet on Capsaicin. Council of Europe. Committee of Experts on Flavouring Substances. 2001;. |
| 10. | Li NS, Luo XJ, Dai Z, Liu B, Zhang YS, Yang ZC, Peng J. Beneficial effects of capsiate on ethanol-induced mucosal injury in rats are related to stimulation of calcitonin gene-related Peptide release. Planta Med. 2012;78:24-30. [PubMed] [DOI] |
| 11. | Kato S, Aihara E, Nakamura A, Xin H, Matsui H, Kohama K, Takeuchi K. Expression of vanilloid receptors in rat gastric epithelial cells: role in cellular protection. Biochem Pharmacol. 2003;66:1115-1121. [PubMed] [DOI] |
| 12. | Horie S, Yamamoto H, Michael GJ, Uchida M, Belai A, Watanabe K, Priestley JV, Murayama T. Protective role of vanilloid receptor type 1 in HCl-induced gastric mucosal lesions in rats. Scand J Gastroenterol. 2004;39:303-312. [PubMed] [DOI] |
| 13. | Okumi H, Tashima K, Matsumoto K, Namiki T, Terasawa K, Horie S. Dietary agonists of TRPV1 inhibit gastric acid secretion in mice. Planta Med. 2012;78:1801-1806. [PubMed] [DOI] |
| 14. | Mózsik G, Szolcsányi J, Rácz I. Gastroprotection induced by capsaicin in healthy human subjects. World J Gastroenterol. 2005;11:5180-5184. [PubMed] |
| 15. | Satyanarayana MN. Capsaicin and gastric ulcers. Crit Rev Food Sci Nutr. 2006;46:275-328. [PubMed] [DOI] |
| 16. | Mizuguchi S, Ohno T, Hattori Y, Kamata K, Arai K, Saeki T, Saigenji K, Hayashi I, Kuribayashi Y, Majima M. Calcitonin gene-related peptide released by capsaicin suppresses myoelectrical activity of gastric smooth muscle. J Gastroenterol Hepatol. 2005;20:611-618. [PubMed] [DOI] |
| 17. | Saito A, Yamamoto M. Acute oral toxicity of capsaicin in mice and rats. J Toxicol Sci. 1996;21:195-200. [PubMed] [DOI] |
| 18. | Mózsik G, Vincze A, Szolcsányi J. Four response stages of capsaicin-sensitive primary afferent neurons to capsaicin and its analog: gastric acid secretion, gastric mucosal damage and protection. J Gastroenterol Hepatol. 2001;16:1093-1097. [PubMed] [DOI] |
| 19. | Mun JM, Ok HM, Kwon O. Corn gluten hydrolysate and capsaicin have complimentary actions on body weight reduction and lipid-related genes in diet-induced obese rats. Nutr Res. 2014;34:458-465. [PubMed] [DOI] |
| 20. | Rohm B, Riedel A, Ley JP, Widder S, Krammer GE, Somoza V. Capsaicin, nonivamide and trans-pellitorine decrease free fatty acid uptake without TRPV1 activation and increase acetyl-coenzyme A synthetase activity in Caco-2 cells. Food Funct. 2015;6:173-185. [PubMed] [DOI] |
| 21. | Josse AR, Sherriffs SS, Holwerda AM, Andrews R, Staples AW, Phillips SM. Effects of capsinoid ingestion on energy expenditure and lipid oxidation at rest and during exercise. Nutr Metab (Lond). 2010;7:65. [PubMed] [DOI] |
| 22. | Saito M, Yoneshiro T, Matsushita M. Food Ingredients as Anti-Obesity Agents. Trends Endocrinol Metab. 2015;26:585-587. [PubMed] [DOI] |
| 23. | Luo XJ, Peng J, Li YJ. Recent advances in the study on capsaicinoids and capsinoids. Eur J Pharmacol. 2011;650:1-7. [PubMed] [DOI] |
| 24. | Reinbach HC, Smeets A, Martinussen T, Møller P, Westerterp-Plantenga MS. Effects of capsaicin, green tea and CH-19 sweet pepper on appetite and energy intake in humans in negative and positive energy balance. Clin Nutr. 2009;28:260-265. [PubMed] [DOI] |
| 25. | Kang JH, Tsuyoshi G, Le Ngoc H, Kim HM, Tu TH, Noh HJ, Kim CS, Choe SY, Kawada T, Yoo H. Dietary capsaicin attenuates metabolic dysregulation in genetically obese diabetic mice. J Med Food. 2011;14:310-315. [PubMed] [DOI] |
| 26. | Golynski M, Balicki I, Lutnicki K, Smiech A, Adamek L, Szczepanik M, Wilkolek P, Brodzki A, Adaszek L. Systemic and local effects of intragastric administration of the habanero fruit (Capsicum chinense Jacquin c.v.) in rats. J Physiol Pharmacol. 2015;66:259-265. [PubMed] |
编辑: 于明茜 电编:都珍珍