修回日期: 2024-11-28
接受日期: 2024-12-17
在线出版日期: 2025-01-28
新辅助治疗后直肠癌的局部再生问题在临床上备受关注. 直肠癌患者接受术前放化疗之后, 局部肿瘤残留或再生成为重要的临床挑战. 针对局部肿瘤残留或再生的发生机制、潜在风险因素以及处理策略的研究逐渐展开. 现有研究表明, 新辅助治疗能降低直肠癌局部再生的发生率, 但局部再生的预防和处理仍然是亟待解决的临床问题. 未来研究需要进一步明确肿瘤微环境在局部再生中的作用, 深入探究直肠癌局部再生的潜在机制, 并制定更加精准和个体化的治疗方案. 此外, 对微小残留病灶研究的深入及影像组学技术的发展等也为"观察等待"策略的管理提供了新的视角与可能性. 本文主要围绕直肠癌患者新辅助治疗后局部再生的研究现状进行总结和未来的研究方向进行展望.
核心提要: 局部再生是选择"观察等待"(watch and wait, W&W)策略的直肠癌患者所面临的困扰. 局部再生后远处转移风险增加, 严重影响预后. 本文旨在探讨局部再生的可能机制, 以期筛选适宜人群并早期发现局部再生, 从而精确管理 W&W策略患者.
引文著录: 袁兴梅, 曹钦兴, 严力, 侯能易, 余松, 陆河江, 张敏, 庞明辉. 直肠癌新辅助治疗后局部再生研究进展. 世界华人消化杂志 2025; 33(1): 37-44
Revised: November 28, 2024
Accepted: December 17, 2024
Published online: January 28, 2025
The issue of local regrowth after neoadjuvant therapy in rectal cancer patients has attracted significant clinical attention. Following preoperative chemoradiotherapy, the persistence or regrowth of local tumors presents a critical clinical challenge. Research into the mechanisms, potential risk factors, and management strategies for local tumor persistence or regrowth is underway. Existing studies suggest that neoadjuvant therapy can reduce the occurrence of local regrowth in rectal cancer, but prevention and management of local regrowth remain urgent clinical issues. Future research needs to further clarify the role of the tumor microenvironment in local regrowth, delve into the potential mechanisms of rectal cancer local regrowth, and develop more precise and personalized treatment strategies. In addition, in-depth research on minimal residual disease and development of imaging genomics technology provide new perspectives and possibilities for the management of "watch and wait" strategies. This article provides a summary of the current research on local regrowth in rectal cancer patients after neoadjuvant therapy and prospects for future research directions.
- Citation: Yuan XM, Cao QX, Yan L, Hou NY, Yu S, Lu HJ, Zhang M, Pang MH. Progress in research of local regrowth after neoadjuvant therapy in rectal cancer. Shijie Huaren Xiaohua Zazhi 2025; 33(1): 37-44
- URL: https://www.wjgnet.com/1009-3079/full/v33/i1/37.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i1.37
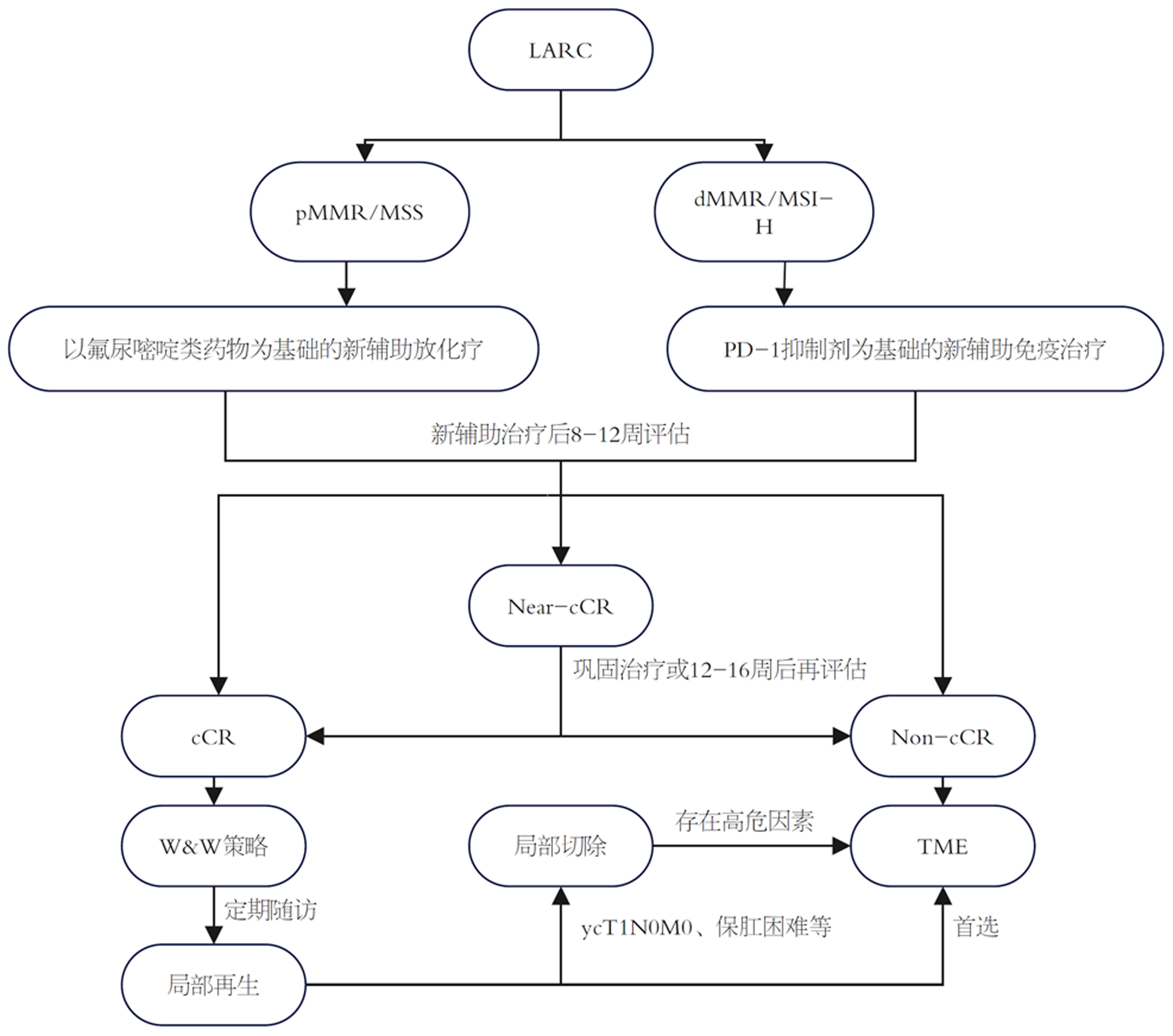
局部进展期直肠癌(locally advanced rectal cancer, LARC)是指经影像学或病理检查发现的原发肿瘤侵出肠壁肌层直至周围有名结构(c/pT3-4b)或系膜内及真骨盆范围内出现淋巴结转移(c/pN1-2)而无远处转移(M0)的距肛门12 cm以内的直肠癌[1]. 新辅助放化疗(neoadjuvant chemoradiotherapy, nCRT)+全直肠系膜切除术(total mesorectal excision, TME)+辅助治疗是LARC的标准治疗策略[2]. 新辅助治疗可以缩小肿瘤、降低肿瘤分期以及提高保肛率, 部分患者在治疗后可达到病理完全缓解(pathological complete response, pCR), 即手术切除的标本中未检测到残余癌细胞. 然而, 手术面临着吻合口瘘、泌尿系及性功能障碍以及永久性结肠造口等并发症, 严重影响患者生存质量. pCR主要反映的是手术后的病理结果, 并不适合作为指导临床决策的初始标准, 为此, Habr-Gama等[3]提出了一个新的评估指标: 临床完全缓解(clinical complete response, cCR), 并进一步形成"观察等待"(watch and wait, W&W)策略. 该策略是指nCRT后达到cCR的患者, 通过定期随访代替手术治疗, 从而达到器官保留的目的, 这对于低位直肠癌尤其是保肛意愿强烈的年轻患者至关重要. LARC患者W&W策略流程如图1所示.
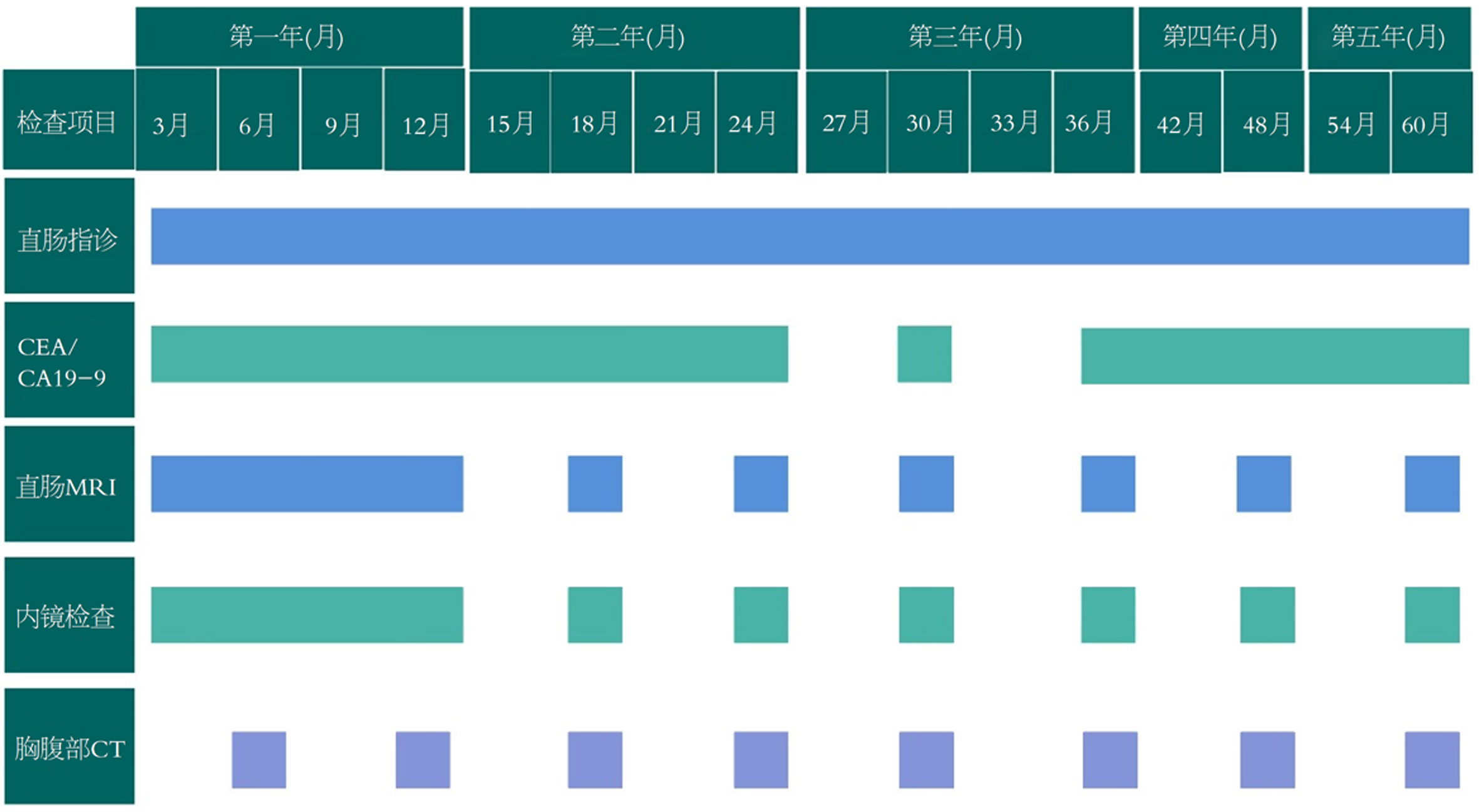
研究显示, 采取W&W策略的患者可产生良好的肿瘤长期预后, 其无病生存期和总生存期与行TME患者之间结果相似, 且能够保证病人的肛门直肠功能和生活质量[4,5]. 然而局部再生是W&W策略被质疑的主要原因. 局部再生在达到cCR后的3年内风险最高(25%-38%)[6], 出现局部再生者远处转移发生率增高(36% vs 1%)[7]. 因此, 实施W&W策略面临的问题是确定适合这一途径的患者, 并且需要考虑随访期间局部再生的可能性、再生后挽救治疗的有效性以及生存预后. 图2展示了W&W患者的随访策略. 对于初始被评估为高危(病理类型差或T分期较晚等)的患者, 可以适当增加随访频率或进行更详细的检查. 随着时间的推移, 特别是随访超过3年后, 局部再生的风险逐渐降低, 可以延长随访间期, 从而降低随访频率.
值得注意的是, 局部再生不同于局部复发, 局部再生是指新辅助治疗后达到cCR患者未行手术, 在观察等待随访期间经直肠指诊、内镜或影像学检查发现在原病灶区域或直肠系膜内肿瘤的重新出现. 而局部复发是指手术后(根治性切除或局部切除)在吻合口、系膜区(局部切除的情况下)或盆腔内(包括侧方淋巴结)出现肿瘤复发. 对于局部复发患者, 约20%-30%的患者可以行手术切除, 且生存率通常较差[8]. 目前的研究指出, 局部再生的出现可能与多种因素有关, 包括肿瘤微环境的改变、微小残留病灶(minimal residual disease, MRD)的存在以及肿瘤浸润深度等.
肿瘤微环境是一个高度结构化的生态系统, 包括多种免疫细胞、肿瘤相关的成纤维细胞(cancer-associated fibroblasts, CAFs)、内皮细胞和细胞外基质等. 其中, CAFs可能与肿瘤进展、转移和耐药性有关[9]. Qin等[10]研究发现在新辅助治疗过程中, CAFs被明显重塑, 分化出了新的细胞亚型, 揭示了CAFs亚群的复杂性以及其对肿瘤促进和免疫激活的双重作用. 一方面, CAFs通过分泌趋化因子CXC配体12等细胞因子对CD8+效应T细胞和树突状细胞进行富集和活化, 进而促进抗肿瘤免疫, 抑制肿瘤进展. 另一方面, 一部分CAF亚群表达大量与血管生成、细胞外基质重塑、上皮-间质转化和肿瘤侵袭等促肿瘤功能相关基因, 这与较差的新辅助化疗疗效相关. Bettoni等[11]基于等位基因突变的肿瘤异质性算法显示, 与遗传不稳定性和耐药性相关的基因突变在新辅助治疗后显著增加. 该研究通过对突变的检测表明新辅助治疗可能作为一种强大的选择压力, 在残余肿瘤中驱动克隆选择, 使残留的肿瘤细胞更容易产生治疗抵抗, 更易修复化疗造成的损伤, 最终导致局部再生.
越来越多的研究指出新辅助治疗疗效不佳与肿瘤微环境密切相关. 肿瘤微环境的抑制使免疫抑制细胞如CAFs亚群激活, T细胞和树突状细胞的效应功能被抑制, 促进残余肿瘤的治疗抵抗, 进而更容易导致局部再生. 另一方面, 肿瘤复杂的免疫微环境又促进了肿瘤细胞基因突变的克隆筛选, 增加局部再生的可能性.
MRD是指癌症治疗后残余的癌细胞(包括对治疗无反应或耐药的癌细胞), 残留的癌细胞数量可能很少, 无法通过传统实验方法(肿瘤标志物)或影像学等手段检查到. 循环肿瘤DNA(circulating tumor DNA, ctDNA)是检测MRD的关键标志物. MRD可作为预测多种肿瘤类型患者的预后和监测治疗反应的指标. Liu等[12]分析了纳入多中心Ⅱ/Ⅲ期随机试验中接受新辅助治疗的60例LARC患者, 发现MRD阳性患者的复发风险是阴性患者的27.38倍(95%CI: 8.61-81.7). 这揭示了MRD在术前预测复发的潜在应用价值, 有助于优化LARC患者的治疗策略. 为了进一步探讨MRD在预测复发中的作用, 一项Meta分析结果显示: 新辅助治疗后ctDNA阳性患者的复发风险是ctDNA阴性患者的11.04倍[13], 这表明ctDNA的存在提示肿瘤负荷的增加. 通过分析并探讨上述结果, 应将局部再生视为对cCR的误诊. 最初表现为明显cCR后出现局部再生的患者很少可能出现第二原发肿瘤, 由于传统检查手段的限制, 对于被判定为cCR的患者实际体内可能残留MRD, 并持续增长及不断扩增最终导致局部再生.
不能忽视的是, MRD仍存在局限性. MRD检测只能提示身体内存在肿瘤, 但不能判断是原发肿瘤还是继发肿瘤. 另外, 由于肿瘤病理部位、组织类型、肿瘤负荷、分期等因素可影响ctDNA的产生, 同时检测敏感度不足影响ctDNA的检出而造成假阴性, 这也限制了MRD检测的敏感度. 总之, 尽管MRD的检测仍面临许多挑战, 但已经展现出了巨大的应用前景, 其具有纵向监测分子突变的优势, 可以作为传统组织病理学检查和影像学的良好补充, 进而对局部再生实现精准的预测.
研究表明, 肿瘤浸润深度可能与局部再生有关. 临床上主要通过cT分期表示肿瘤浸润深度. Chadi等系统分析纳入11个研究的602例患者, 经单变量分析发现, cT分期的增加与局部再生风险的增加相关: cT1期和cT2期的2年累积发生率为18%, cT3为29%, cT4为31%. 这可能是随着肿瘤浸润深度的增加, 肿瘤细胞残留和再生的可能性也相应增大[14]. 然而, 另一项研究指出, 一旦患者cCR达2年或更长时间, 局部再生的风险便与cT分期即肿瘤浸润深度无关[15]. 这表明尽管基线cT较晚的患者在初始cCR后似乎有更高的局部再生风险, 但患者持续2年维持cCR状态, 这些差异可能会消失. 这些研究提示局部再生的潜在驱动因素可能是对治疗的初始反应, 即真正达到并持续维持cCR的状态, 而不是与基线特征相关的风险因素. 因此, 肿瘤浸润深度与局部再生的关系需通过进一步研究与随访证实. 未来有必要基于磁共振成像(magnetic resonance imaging, MRI)的标准化预处理分期方案来验证肿瘤浸润深度和局部再生之间的关系.
由于肿瘤微环境的改变、MRD的存在以及肿瘤浸润深度等因素引起肿瘤生物学行为的改变, 可能导致局部再生的发生. 因此, 在LARC患者的治疗和随访过程中, 需要更加深入理解这些因素的作用机制, 以更准确地评估患者治疗反应, 并制定个性化的治疗方案和随访策略.
目前, 尽管根治性切除术是改善患者生存期最有效的治疗方法. 但是手术的并发症及远期排便功能损害对于患者的生活质量将产生巨大的影响. 因此W&W策略日益受到关注. 多项研究显示, W&W策略人群5年总生存率不逊于根治性手术患者, 然而患者中有近30%通常会在从最初决定到W&W的3年内出现局部再生风险[16-18]. 因此选择W&W策略的患者应接受密切随访以尽早发现局部再生. 目前主要的监测手段包括直肠指诊、肠镜、MRI及肿瘤标志物等. 现有研究指出, 局部再生主要发生在肠壁内, 因此易于通过直肠指诊及内镜检查发现, 且活检可以明确病理性质. 有研究者通过结合直肠指诊、内镜检查、直肠MRI及胸腹部CT等多种检查手段综合评估患者全程新辅助治疗后的反应应答, 结果显示多模态评估可有效检测完全应答者, 降低局部再生率(10.8%)[19]. 然而其他研究表明新辅助治疗后肿瘤的退缩模式并非整体缩小, 而是呈现碎片化、分散退缩的方式[20], 且部分肿瘤仅残存在肌层, 因此易导致活检假阴性[21]. 深部组织穿刺可以弥补这一不足. 它通过结合超声技术和细针穿刺技术获取深部病变组织. 对于新辅助治疗后<1 cm的病灶, 该方法较内镜、MRI等更具优势, 能够通过超声定位, 进而穿刺判断有无肿瘤细胞残存, 更准确地评估新辅助治疗后的肿瘤缓解情况[22]. 但该方法为有创检查, 操作难度大, 且存在一定风险, 如肠穿孔、出血、感染等.
W&W策略的成功取决于准确的再分期和cCR的识别, MRI是直肠癌患者治疗后反应评估、监测和检测局部再生情况的首选影像学检查方法. MERCURY研究表明, 在nCRT后基于MRI的肿瘤退缩等级和环切缘评估能够提供有关无病生存期、总生存率以及局部复发风险的信息[23]. 然而放化疗后肿瘤组织会发生不同程度的纤维化、炎症和水肿, 这些改变与肿瘤残留在MRI上的表现相似, 影响新辅助治疗后MRI重新分期的能力[24]. 肖毅等研究发现, 直肠MRI检查nCRT后CR的灵敏度仅为15.9%, 而特异度为94.0%[25]. Van den Broek等[26]也发现MRI重新分期的准确度较低, 且一致性差异大. 因此目前在如何准确的再分期和cCR的识别上的研究具有重要的临床应用前景和意义.
其他检查如PET-CT, 有国内中心临床经验显示: 与直肠MRI比较, PET-CT预测完全缓解的准确度并不具优势. 其他相关临床研究异质性大, 且价格高昂, 一般不做常规推荐使用. 若怀疑其他影像学检查方法漏诊或存在远处转移者, 可考虑行PET-CT检查[27].
综上, 目前用于早期发现局部再生的检测工具尚存诸多局限, 如特异性差, 存在假阴性和安全风险等. 人工智能(artificial intelligence, AI)的出现为局部再生的预测提供了新思路. AI通过建立智能模型, 可以在患者术前评估、疗效预测及转移复发风险预测等方面提供有效支持. 各监测手段的优点与局限性如表1所示.
| 监测手段 | 优点 | 局限性 |
| 直肠指诊 | 简便、经济、直观 | 主观性强, 无法判断有无肿瘤残存及肿瘤浸润深度 |
| 肿瘤标志物 | 非侵入性, 可辅助诊断、疗效检测及预后评估等 | 特异性较低, 易受其他因素影响 |
| 内镜检查 | 直接观察直肠肠腔, 活检可明确病理性质 | 侵入性检查, 活检存在假阴性可能, 深部组织穿刺存在穿孔、出血等风险 |
| MRI | 软组织分辨率高, 可评估肿瘤退缩情况及环周切缘状态等 | 成本较高, 准确性受到设备性能、操作经验及患者个体差异等因素的影响 |
| AI辅助监测 | 辅助医生决策, 减少误诊和漏诊率; 实时监测, 自动分析, 可提高诊断效率和准确性; 整合多模态数据, 提供个性化治疗方案 | 依靠高质量的数据输入, 技术成熟度和可靠性需进一步验证; 存在数据隐私和安全性问题 |
2018年国际观察等待数据库首次公布了数据库中患者的长期生存数据: 共纳入15个国家、47个中心的880例cCR患者, 中位随访时间3.3年, 2年累计局部再生率25.2%, 其中88%的再生发生在2年以内, 好发部位以肠壁(97%)为主, 远处转移率为8%[7]. 类似地, 国内外研究报道局部再生主要发生在cCR前2年, 80%-88%的患者可行挽救性手术, R0切除率为88%-93%[28,29]. 此外, 局部再生患者的远处转移率更高(36% vs 1%). Julião等研究也支持该结果: 局部再生组21例(26.6%)、根治性手术组10例(13.5%)发生远处转移(P = 0.04)[30]. 一项探讨LARC的器官保留风险的研究, 通过对两个国际癌症登记数据库中的数据进行深入分析显示, 局部再生后的远处转移率明显较高(22.8% vs 10.2%)[31].
上述结果表明大部分观察等待患者可避免行根治性手术, 同时对于局部再生患者挽救性手术率高. 然而基础肛门功能差、肿瘤分期评估较晚或依从性差不能定期随访的患者建议行手术治疗, 对于新辅助治疗之前考虑系膜淋巴结转移的患者也不建议行W&W策略[32]. 与nCRT后直接手术的患者比, 局部再生者行腹会阴切除术的比例增加, 这可能与选择W&W策略患者的肿瘤位置通常相对较低有关. 其次, 局部再生主要发生在cCR前2年, 且多局限在肠腔内. 最后, 将原发肿瘤保持在原位可能会增加远处转移的风险, 最终导致较差的肿瘤预后.
对于局部再生患者, 挽救性根治手术是首选治疗方案. 在国际观察等待数据库中, W&W策略组2年内局部再生的148例患者有115例(78%)行挽救性TME术, 其中101例(88%)的肿瘤切除边缘为肿瘤阴性(R0切除), 即R0切除率达到 88%[7]. 部分患者因拒绝手术、远处转移或基础情况差而未行挽救性手术[33,34]. 局部切除术为备选治疗方案. 治疗后分期为ycT1N0M0、保肛困难或器官保留意愿强烈的患者, 可选择行局部切除术, 局部切除术创伤小, 可保留肛门括约肌功能及避免永久性结肠造口. 对于局部切除后病理提示yc≥T2、脉管癌栓或神经浸润等高危因素的患者建议行挽救性根治手术[6]. 然而新辅助治疗后肿瘤的退缩模式并不清楚, 如何确保局部切除的切缘足够、安全尚需进一步探讨; 同时, 局部切除后存在高危因素的患者会增加后续根治性手术的难度及并发症发生率. 因此, 有保肛可能的患者需充分考虑, 慎重选择局部切除.
近年来, 人工智能为医学数据分析提供了新的方法, AI技术在肿瘤治疗的多个环节中展现了强大的应用潜力. 在结直肠癌的诊治领域, 已有研究者基于MRI影像学、病理学特征、临床数据等资料构建了智能模型, 用于预测疗效、远处转移或淋巴结转移等. Huang等[35]通过收集直肠癌患者新辅助治疗前、后直肠核磁T2WI、DWI的影像学特征, 构建了多期、多参数放射组学模型. 该模型能够准确和稳健地预测局部进展期直肠癌患者对新辅助治疗的反应. Niu等[36]基于临床基线特征-核磁共振影像组学构建的多模态预测模型在预测术前直肠癌淋巴结转移方面表现最佳. 该模型有助于术前评估, 为临床决策提供有力支持. 与临床常规检测相比, AI具有更好的泛化能力, 灵敏度和检测效率, 其与现有传统检测手段的结合更可能早期识别局部再生.
尽管智能预测技术在直肠癌治疗领域已经展现出了巨大潜力和广泛应用前景, 然而目前尚没有针对直肠癌肿瘤局部再生的智能预测模型报道, 但智能预测技术在直肠癌领域的广泛应用为这一方向的研究奠定了重要基础.
ctDNA是评估转移性结直肠癌患者对化疗反应的有效生物标志物[37]. 与传统局部检查方法不同, ctDNA是一种全身性生物标志物, 可以比影像学更早地检测到可能的MRD或微转移. 理论上, ctDNA联合MRI的预测模型性能更佳. Wang等[38]通过建立ctDNA联合MRI肿瘤回归等级(mrTRG)预测模型在术前预测pCR, 其曲线下面积为0.886(95%CI: 0.810-0.962), 优于仅基于ctDNA或mrTRG的预测模型. 这提示ctDNA联合MRI有助于识别MRD患者, 并帮助患者是否选择W&W策略. 既往ctDNA研究集中于术后复发预测, 该研究探讨了ctDNA在术前nCRT中的价值, 发现ctDNA作为一种非侵入性的生物标志物, 存在巨大的临床应用潜力, 可作为常规检查方法的补充手段.
在未来, 随着多模态驱动的人工智能预测模型的发展, ctDNA有望成为预测直肠癌患者接受nCRT后局部再生情况的新工具. 通过定期监测患者ctDNA水平, 并结合临床特征、影像学特征等构建更全面、精确的评估模型, 进而识别受益于W&W策略的患者.
与传统治疗相比, W&W策略具有相似的疾病控制效果, 能够给患者提供更好的生活质量, 因此成为国内外各中心的研究热点. 但实施W&W策略的患者具有较高的2年局部再生率. 局部再生不同于直肠癌复发, 具有独特的生物学行为及肿瘤微环境. 局部再生是否与cT分期及MRD等有关, 尚需进一步研究探讨其发生的机制.
对实际未达cCR而判定cCR的患者, 选择W&W策略会增加局部再生和远处转移的风险, 这是实施W&W策略的最大困难和关键问题. 因此, 需要确定有效的标志物, 以用于监测选择W&W策略的患者在随访期间的疗效与发现局部再生. 人工智能在结直肠领域的应用已经取得了显著的进展, 并且随着技术的不断发展, 其应用范围仍在不断扩大. 基于这样的背景, 人工智能在预测肿瘤局部再生方面具有巨大的潜力和广泛应用前景. MRD作为另一种极具临床应用前景的潜在生物标志物, 日益受到关注, 但仍需更多的大样本前瞻性研究进一步的探索验证其准确性.
综上所述, 选择W&W策略患者会面临局部再生的风险, 早期识别局部再生风险较高的患者有助于进一步制定治疗方案, 避免过度治疗或错失手术机会. 为了使W&W策略尽可能有效并减少局部再生和远处转移, 未来应集中精力提高cCR检测的准确性, 早期发现和挽救局部再生, 并对高风险患者进行强化监测.
| 2. | van Gijn W, Marijnen CA, Nagtegaal ID, Kranenbarg EM, Putter H, Wiggers T, Rutten HJ, Påhlman L, Glimelius B, van de Velde CJ; Dutch Colorectal Cancer Group. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer: 12-year follow-up of the multicentre, randomised controlled TME trial. Lancet Oncol. 2011;12:575-582. [PubMed] [DOI] |
| 3. | Habr-Gama A, Perez RO, Nadalin W, Sabbaga J, Ribeiro U, Silva e Sousa AH, Campos FG, Kiss DR, Gama-Rodrigues J. Operative versus nonoperative treatment for stage 0 distal rectal cancer following chemoradiation therapy: long-term results. Ann Surg. 2004;240:711-7; discussion 717-8. [PubMed] [DOI] |
| 4. | Ferri V, Vicente E, Quijano Y, Duran H, Diaz E, Fabra I, Malave L, Ruiz P, Costantini G, Pizzuti G, Cubillo A, Rubio MC, Cañamaque LG, Alfonsel JN, Caruso R. Light and shadow of watch-and-wait strategy in rectal cancer: oncological result, clinical outcomes, and cost-effectiveness analysis. Int J Colorectal Dis. 2023;38:277. [PubMed] [DOI] |
| 5. | Beard BW, Rettig RL, Ryoo JJ, Parker RA, McLemore EC, Attaluri V. Watch-and-Wait Compared to Operation for Patients with Complete Response to Neoadjuvant Therapy for Rectal Cancer. J Am Coll Surg. 2020;231:681-692. [PubMed] [DOI] |
| 6. | 中国直肠癌新辅助治疗后等待观察数据库研究协作组; 中华医学会外科学分会结直肠外科学组; 中国医师协会结直肠肿瘤医师专业委员会. 直肠癌新辅助治疗后等待观察策略中国专家共识(2024版). 中华胃肠外科杂志. 2024;27:301-315. [DOI] |
| 7. | van der Valk MJM, Hilling DE, Bastiaannet E, Meershoek-Klein Kranenbarg E, Beets GL, Figueiredo NL, Habr-Gama A, Perez RO, Renehan AG, van de Velde CJH; IWWD Consortium. Long-term outcomes of clinical complete responders after neoadjuvant treatment for rectal cancer in the International Watch & Wait Database (IWWD): an international multicentre registry study. Lancet. 2018;391:2537-2545. [PubMed] [DOI] |
| 8. | Dossa F, Chesney TR, Acuna SA, Baxter NN. A watch-and-wait approach for locally advanced rectal cancer after a clinical complete response following neoadjuvant chemoradiation: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol. 2017;2:501-513. [PubMed] [DOI] |
| 9. | Kasashima H, Fukui Y, Kitayama K, Miki Y, Yoshii M, Fukuoka T, Tamura T, Shibutani M, Toyokawa T, Ree S, Tanaka H, Yashiro M, Maeda K. [The Role of Cancer-Associated Fibroblasts in Modulating Tumor Immunity in Colorectal Cancer]. Gan To Kagaku Ryoho. 2023;50:958-959. [PubMed] |
| 10. | Qin P, Chen H, Wang Y, Huang L, Huang K, Xiao G, Han C, Hu J, Lin D, Wan X, Zheng Y, Liu Y, Li G, Yang H, Ye S, Luo M, Fu Y, Xu H, Wen L, Guo Z, Shen X, Li Z, Wang C, Chen X, Wang L, Sun L, Ren D, Wu L, Wang J, Liu S, Lin H. Cancer-associated fibroblasts undergoing neoadjuvant chemotherapy suppress rectal cancer revealed by single-cell and spatial transcriptomics. Cell Rep Med. 2023;4:101231. [PubMed] [DOI] |
| 11. | Bettoni F, Masotti C, Corrêa BR, Donnard E, Dos Santos FF, São Julião GP, Vailati BB, Habr-Gama A, Galante PAF, Perez RO, Camargo AA. The Effects of Neoadjuvant Chemoradiation in Locally Advanced Rectal Cancer-The Impact in Intratumoral Heterogeneity. Front Oncol. 2019;9:974. [PubMed] [DOI] |
| 12. | Liu W, Li Y, Tang Y, Song Q, Wang J, Li N, Chen S, Shi J, Wang S, Li Y, Jiao Y, Zeng Y, Jin J. Response prediction and risk stratification of patients with rectal cancer after neoadjuvant therapy through an analysis of circulating tumour DNA. EBioMedicine. 2022;78:103945. [PubMed] [DOI] |
| 13. | Cao D, Wang F, Zhang RX, Wei B, He MY, Peng JJ, Chen G. [Advances in the application of minimal residual disease in non-metastatic colorectal cancer]. Zhonghua Wei Chang Wai Ke Za Zhi. 2024;27:749-755. [PubMed] [DOI] |
| 14. | Chadi SA, Malcomson L, Ensor J, Riley RD, Vaccaro CA, Rossi GL, Daniels IR, Smart NJ, Osborne ME, Beets GL, Maas M, Bitterman DS, Du K, Gollins S, Sun Myint A, Smith FM, Saunders MP, Scott N, O'Dwyer ST, de Castro Araujo RO, Valadao M, Lopes A, Hsiao CW, Lai CL, Smith RK, Paulson EC, Appelt A, Jakobsen A, Wexner SD, Habr-Gama A, Sao Julião G, Perez R, Renehan AG. Factors affecting local regrowth after watch and wait for patients with a clinical complete response following chemoradiotherapy in rectal cancer (InterCoRe consortium): an individual participant data meta-analysis. Lancet Gastroenterol Hepatol. 2018;3:825-836. [PubMed] [DOI] |
| 15. | São Julião GP, Karagkounis G, Fernandez LM, Habr-Gama A, Vailati BB, Dattani M, Kalady MF, Perez RO. Conditional Survival in Patients With Rectal Cancer and Complete Clinical Response Managed by Watch and Wait After Chemoradiation: Recurrence Risk Over Time. Ann Surg. 2020;272:138-144. [PubMed] [DOI] |
| 16. | Cerdán-Santacruz C, Vailati BB, São Julião GP, Habr-Gama A, Perez RO. Local tumor regrowth after clinical complete response following neoadjuvant therapy for rectal cancer: what happens when organ preservation falls short. Tech Coloproctol. 2023;27:1-9. [PubMed] [DOI] |
| 17. | Verheij FS, Omer DM, Williams H, Lin ST, Qin LX, Buckley JT, Thompson HM, Yuval JB, Kim JK, Dunne RF, Marcet J, Cataldo P, Polite B, Herzig DO, Liska D, Oommen S, Friel CM, Ternent C, Coveler AL, Hunt S, Gregory A, Varma MG, Bello BL, Carmichael JC, Krauss J, Gleisner A, Guillem JG, Temple L, Goodman KA, Segal NH, Cercek A, Yaeger R, Nash GM, Widmar M, Wei IH, Pappou EP, Weiser MR, Paty PB, Smith JJ, Wu AJ, Gollub MJ, Saltz LB, Garcia-Aguilar J. Long-Term Results of Organ Preservation in Patients With Rectal Adenocarcinoma Treated With Total Neoadjuvant Therapy: The Randomized Phase II OPRA Trial. J Clin Oncol. 2024;42:500-506. [PubMed] [DOI] |
| 18. | Smith JJ, Strombom P, Chow OS, Roxburgh CS, Lynn P, Eaton A, Widmar M, Ganesh K, Yaeger R, Cercek A, Weiser MR, Nash GM, Guillem JG, Temple LKF, Chalasani SB, Fuqua JL, Petkovska I, Wu AJ, Reyngold M, Vakiani E, Shia J, Segal NH, Smith JD, Crane C, Gollub MJ, Gonen M, Saltz LB, Garcia-Aguilar J, Paty PB. Assessment of a Watch-and-Wait Strategy for Rectal Cancer in Patients With a Complete Response After Neoadjuvant Therapy. JAMA Oncol. 2019;5:e185896. [PubMed] [DOI] |
| 19. | Özoran E, Özata İH, Uymaz DS, Omarov N, Bozkurt E, Tüfekçi T, Karahan SN, Gürbüz B, Selçukbiricik F, Bölükbaşı Y, Taşkın OÇ, Gürses B, Rencüzoğulları A, Buğra D, Balık E. Multimodal assessment after total neoadjuvant therapy versus standard neoadjuvant chemoradiotherapy in locally advanced rectal cancer accurately predicts complete responders. Int J Colorectal Dis. 2023;38:229. [PubMed] [DOI] |
| 20. | Perez RO, Habr-Gama A, Smith FM, Kosinski L, São Julião GP, Grzona E, Rawet V, Vianna MR, Proscurshim I, Lynn PB, Gama-Rodrigues J. Fragmented pattern of tumor regression and lateral intramural spread may influence margin appropriateness after TEM for rectal cancer following neoadjuvant CRT. J Surg Oncol. 2014;109:853-858. [PubMed] [DOI] |
| 21. | Al-Najami I, Jones HJ, Dickson EA, Muirhead R, Deding U, James DR, Cunningham C. Rectal cancer: Watch-and-wait and continuing the rectal-preserving strategy with local excision for incomplete response or limited regrowth. Surg Oncol. 2021;37:101574. [PubMed] [DOI] |
| 22. | Morken JJ, Baxter NN, Madoff RD, Finne CO. Endorectal ultrasound-directed biopsy: a useful technique to detect local recurrence of rectal cancer. Int J Colorectal Dis. 2006;21:258-264. [PubMed] [DOI] |
| 23. | Patel UB, Blomqvist LK, Taylor F, George C, Guthrie A, Bees N, Brown G. MRI after treatment of locally advanced rectal cancer: how to report tumor response--the MERCURY experience. AJR Am J Roentgenol. 2012;199:W486-W495. [PubMed] [DOI] |
| 24. | Sclafani F, Brown G, Cunningham D, Wotherspoon A, Mendes LST, Balyasnikova S, Evans J, Peckitt C, Begum R, Tait D, Tabernero J, Glimelius B, Roselló S, Thomas J, Oates J, Chau I. Comparison between MRI and pathology in the assessment of tumour regression grade in rectal cancer. Br J Cancer. 2017;117:1478-1485. [PubMed] [DOI] |
| 26. | van den Broek JJ, van der Wolf FS, Lahaye MJ, Heijnen LA, Meischl C, Heitbrink MA, Schreurs WH. Accuracy of MRI in Restaging Locally Advanced Rectal Cancer After Preoperative Chemoradiation. Dis Colon Rectum. 2017;60:274-283. [PubMed] [DOI] |
| 28. | Dattani M, Heald RJ, Goussous G, Broadhurst J, São Julião GP, Habr-Gama A, Perez RO, Moran BJ. Oncological and Survival Outcomes in Watch and Wait Patients With a Clinical Complete Response After Neoadjuvant Chemoradiotherapy for Rectal Cancer: A Systematic Review and Pooled Analysis. Ann Surg. 2018;268:955-967. [PubMed] [DOI] |
| 29. | 王 林, 李 士杰, 张 晓燕, 孙 婷婷, 杜 长征, 陈 楠, 彭 亦凡, 姚 云峰, 詹 天成, 赵 军, 蔡 勇, 李 永恒, 王 惟虎, 李 忠武, 孙 应实, 季 加孚, 武 爱文. 中低位直肠癌新辅助治疗后临床完全缓解或近临床完全缓解的长期预后分析. 中华胃肠外科杂志. 2018;21:1240-1248. [DOI] |
| 30. | São Julião GP, Fernández LM, Vailati BB, Habr-Gama A, Azevedo JM, Santiago IA, Parés O, Parvaiz A, Vendrely V, Rullier A, Rullier E, Denost Q, Perez RO. Local Regrowth and the Risk of Distant Metastases Among Patients Undergoing Watch-and-Wait for Rectal Cancer: What Is the Best Control Group? Multicenter Retrospective Study. Dis Colon Rectum. 2024;67:73-81. [PubMed] [DOI] |
| 31. | Fernandez LM, São Julião GP, Santacruz CC, Renehan AG, Cano-Valderrama O, Beets GL, Azevedo J, Lorente BF, Rancaño RS, Biondo S, Espin-Basany E, Vailati BB, Nilsson PJ, Martling A, Van De Velde CJH, Parvaiz A, Habr-Gama A, Perez RO; International Watch & Wait Database Consortium (IWWD) and the Spanish Rectal Cancer Viking Consortium (VIKINGO); International Watch & Wait Database Consortium (IWWD) & Spanish Rectal Cancer Viking Consortium. Risks of Organ Preservation in Rectal Cancer: Data From Two International Registries on Rectal Cancer. J Clin Oncol. 2024;JCO2400405. [PubMed] [DOI] |
| 32. | Engineer R, Saklani A, D'souza A, Arya S, Kumar S, Ostwal V, Ramaswamy A, Chopra S, Patil P. Watch and Wait Approach After Neoadjuvant Chemoradiotherapy in Rectal Cancer: Initial Experience in the Indian subcontinent. Indian J Surg Oncol. 2021;12:664-670. [PubMed] [DOI] |
| 33. | Cosgrove C, Spence R, Convie L, Beattie D, McCallion K, McAllister I. Watch and wait for Rectal Cancer: A 9 year Experience. Ulster Med J. 2022;91:130-134. [PubMed] |
| 34. | Socha J, Glynne-Jones R, Bujko K. Oncological risks associated with the planned watch-and-wait strategy using total neoadjuvant treatment for rectal cancer: A narrative review. Cancer Treat Rev. 2024;129:102796. [PubMed] [DOI] |
| 35. | Huang H, Han L, Guo J, Zhang Y, Lin S, Chen S, Lin X, Cheng C, Guo Z, Qiu Y. Multiphase and multiparameter MRI-based radiomics for prediction of tumor response to neoadjuvant therapy in locally advanced rectal cancer. Radiat Oncol. 2023;18:179. [PubMed] [DOI] |
| 36. | Niu Y, Yu X, Wen L, Bi F, Jian L, Liu S, Yang Y, Zhang Y, Lu Q. Comparison of preoperative CT- and MRI-based multiparametric radiomics in the prediction of lymph node metastasis in rectal cancer. Front Oncol. 2023;13:1230698. [PubMed] [DOI] |
| 37. | Shitara K, Muro K, Watanabe J, Yamazaki K, Ohori H, Shiozawa M, Takashima A, Yokota M, Makiyama A, Akazawa N, Ojima H, Yuasa Y, Miwa K, Yasui H, Oki E, Sato T, Naitoh T, Komatsu Y, Kato T, Mori I, Yamanaka K, Hihara M, Soeda J, Misumi T, Yamamoto K, Yamashita R, Akagi K, Ochiai A, Uetake H, Tsuchihara K, Yoshino T. Baseline ctDNA gene alterations as a biomarker of survival after panitumumab and chemotherapy in metastatic colorectal cancer. Nat Med. 2024;30:730-739. [PubMed] [DOI] |
| 38. | Wang Y, Yang L, Bao H, Fan X, Xia F, Wan J, Shen L, Guan Y, Bao H, Wu X, Xu Y, Shao Y, Sun Y, Tong T, Li X, Xu Y, Cai S, Zhu J, Zhang Z. Utility of ctDNA in predicting response to neoadjuvant chemoradiotherapy and prognosis assessment in locally advanced rectal cancer: A prospective cohort study. PLoS Med. 2021;18:e1003741. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 四川省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁