修回日期: 2024-11-06
接受日期: 2024-11-21
在线出版日期: 2025-01-28
早期消化道肿瘤起病隐匿, 无特异性表现, 预后较好, 但其诊断却是难点. 随着人工智能技术(artificial intelligence, AI)在医疗领域的快速发展, 其在消化道早癌的诊断和预测预后等临床工作中展示出巨大的潜力. 本文就国内外AI在早期食管癌、早期胃癌、早期结肠癌中的相关研究进行系统性阐述, 并对AI在消化道早癌中的挑战和未来进行讨论.
核心提要: 人工智能技术(artificial intelligence, AI)目前在医疗领域的研究热点, 目前在消化道早癌的诊断和预测预后等临床工作中得到广泛的应用. 本文就AI在消化道早癌的研究进行探讨, 期待对广大医疗工作者产生启发.
引文著录: 殷坤, 梁豪, 郭雯, 陈雅鑫, 崔曼莉, 张明鑫. 人工智能与消化道早癌: 新挑战与新未来. 世界华人消化杂志 2025; 33(1): 1-10
Revised: November 6, 2024
Accepted: November 21, 2024
Published online: January 28, 2025
Early gastrointestinal tumors have a good prognosis, but they have insidious onset and no specific manifestations, making their diagnosis difficult. With the rapid development of artificial intelligence technology in the medical field, it has shown great potential in clinical work such as diagnosis and prognosis prediction of early gastrointestinal cancer. In this paper, we systematically review the relevant studies on AI in early esophageal cancer, early gastric cancer, early colon cancer, and hepatobiliary pancreatic cancer, and discuss the challenges and futures of AI application in early gastrointestinal cancer.
- Citation: Yin K, Liang H, Guo W, Chen YX, Cui ML, Zhang MX. Artificial intelligence and early cancer of the digestive tract: New challenges and new futures. Shijie Huaren Xiaohua Zazhi 2025; 33(1): 1-10
- URL: https://www.wjgnet.com/1009-3079/full/v33/i1/1.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i1.1
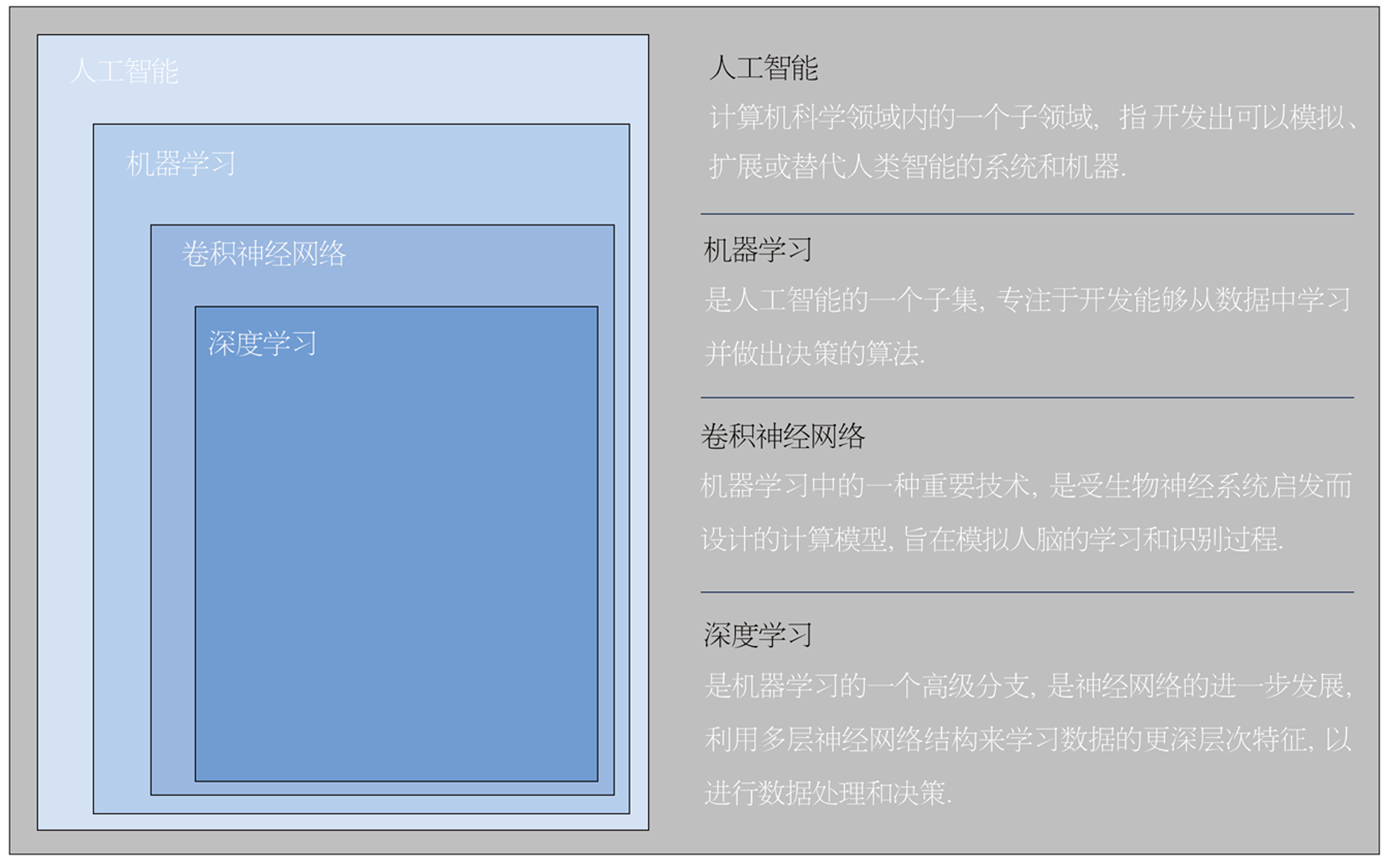
消化道肿瘤在全球的发病率逐年升高, 以食管癌、胃癌、结直肠癌为代表的消化道肿瘤发病率和死亡率占所有肿瘤的一半[1,2]. 消化道肿瘤存在预后与肿瘤诊断分期呈负相关的特点, 因此早发现、早治疗是消化道肿瘤诊疗的关键. 内镜检查作为发现消化道肿瘤的重要手段, 但消化道早癌内镜下表现不典型, 部分早癌范围较小, 在检查过程中较难发现[3]. 因此, 临床内镜检查过程中消化道早癌极易误诊、漏诊. 且消化道早癌的诊断仍高度依赖于内镜医师的经验, 而不同内镜医师的经验和诊断水平存在很大差异. 人工智能(artificial intelligence, AI)以大数据为支撑, 兼具强大计算能力和学习能力的一项计算机技术(图1), 从机器学习(machine learning, ML)到卷积神经网络(convolutional neural network, CNN)再到深度学习(deep learning, DL)等技术的迭代升级推动其在医学领域的应用进入快车道[4,5]. 目前AI运用于消化内镜主要分为两方面(图2), 利用AI进行计算机辅助检测(computeraided detection, CADe)和计算机辅助诊断(computeraided diagnosis, CADx)[6]. CADe主要对内镜图像上有异常表现的可疑区域进行标识, 再由内镜医师做诊断; 而CADx可以对目标区域进行定性, 预测病理诊断和癌症病灶的浸润深度. 将AI与内镜技术相结合, 通过对大量内镜图片学习分析, 建立图像识别及疾病诊断系统, 可以帮助内镜医生快速发现病灶并作出诊断, 提高消化道肿瘤的检出率, 弥补普通医生经验不足的劣势[7]. 目前AI在消化道早癌中的应用包括识别病变以协助快速诊断、提高成像质量及病理分型、肿瘤的分级分期及预后疗效分析等方面[8]. 本文主要讨论AI在消化道早癌领域的挑战和未来.
作为食管癌的高发国家, 我国的多个团队致力于AI系统在早期食管癌诊断中的应用研究. 王娜等[8]选取3家内镜中心的白光图像、碘染图像和完整视频作为数据集, 图中病灶采用矩形和多边形标记, 研发出最佳目标检测模型Yolov 5和病例分割模型Yolact++并构建AI"嵌合体模型", 其诊断早期食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)的敏感性、特异性和准确率分别为95.60%、91.60%和90.70%, 证明AI系统用于诊断ESCC的高准确性. 但随着计算机技术的发展, 单一的早癌诊断系统已不能满足复杂的临床的需求, 因此多功能系统已经开始应用于临床. 其中四川大学华西医院胡兵[9]教授团队开发的一套基于DL模型的多模态判断病变性质、勾画病变边界并评估病变浸润深度的多功能AI实时辅助诊断系统, 通过CNN模型提取图像特征, 该模型诊断ESCC的敏感性为98.04%、特异性为95.03%, 超过了90%的ESCC筛查模型. 并开展一项多中心、串联、双盲、随机对照试验, 在真实临床环境中评估了上述AI系统实时辅助医生行内镜检查时对诊断ESCC的影响. 虽然AI组比常规组的病变漏诊率未超过统计学显著差异界限. 但AI组第一次检查的阳性预测值显著高于常规组(1.8% vs 1.3%, RR = 1.38, P = 0.012)[10]. 以上研究证明AI系统在内镜图像及视频中诊断ESCC具有出色性能, 具有与专家级内镜医生相当的诊断能力, 可以作为内镜医师在日常内镜检查中检测浅表ESCC的辅助方法. 超声内镜(endoscopic ultrasonography, EUS)在ESCC中具有重要价值. Liu等[11]开发了一种用于自动识别食管病变浸润深度和来源的AI系统, 总体准确率为82.49%, 灵敏度为80.23%, 特异度为90.56%. 巴雷特食管(Barrett's Esophagus, BE)是唯一被公认的食管腺癌的癌前病变, 80%的食管腺癌是发生在巴雷特食管的基础上. 在内镜下BE识别方面, Jukema等[12]的一项对比CADx系统辅助不同资质内镜医师的研究, 结果证明CADx辅助显著提高了新手内镜医师对BE的表征识别能力, 使其达到专家内镜医师的水平. 因此AI系统也可用于食管癌前病变的监测[13,14]. AI在食管癌内镜图像的应用主要在内镜下早期诊断和预测浸润深度方面, 部分内镜AI系统已经通过了国家药品监督管理局创新医疗器械审批, 开始产业化道路, 有望实现早期食管癌的同质化诊断[15-17].
AI辅助不仅在内镜下协助诊断食管早癌, 还可对术前临床、影像及病理特征进行筛选, 预测食管癌淋巴结转移风险和免疫疗法疗效[18,19]. Wang等[18]基于82名ESCC患者, 构建了融合影像组学和临床数据的预测模型, 在训练组和验证组的曲线下面积(area under the curve, AUC)值分别为0.93和0.85, 决策曲线分析和校准曲线检验表明该AI模型具有良好的临床可行性和实用性. 可用于预测ESCC新辅助免疫疗法的疗效. Liu等[19]建立人工神经网络模型来预测Ⅰ-Ⅱ期食管鳞状细胞癌患者的淋巴结浸润情况, 其AUC为0.852. Lu等[20]预测局部晚期食管鳞状细胞癌患者接受新辅助化疗的效果, 其在验证集中的AUC为0.831. AI技术实现多种临床资料的结合, 用于食管癌淋巴结转移、放化疗疗效判断及预后预测, 从而为患者提供个体化的治疗方案.
AI辅助在食管早癌的病理诊断方面也取得了不小的进展. Kouzu等[21]使用31例患者的苏木精-伊红数字化载玻片来训练和开发深度学习分类器. 该AI系统可以客观定量地评估ESCC中的纤维组织增生反应(desmoplastic reaction, DR)进而预测预后, 结果显示该AI系统Dice系数得分为0.81, Dice系数是一种集合相似度度量函数, 通常用来计算两个样本的相似度. 研究结果证明基于DR分类的AI系统比手动DR分类对食管早癌特异性生存有更高的预后意义, 且基于DR分类的AI系统的预后准确性优于基于肿瘤深度和淋巴结转移的预后准确性. 将AI医学图像分析技术应用于辅助病理医师快速诊断食管癌淋巴结转移、预测食管癌预后及药物敏感性, 是未来非常有前景的方向[22]. 由此可见其在早期食管癌的诊疗中扮演越来越重要的角色(见表1). 但目前纳入的研究多来自于单中心数据, 缺乏外部数据集的验证, 这使得AI在不同内镜中心的应用存在差异. 今后需要开展多区域、多中心合作以便AI适应在真实世界中的对早期食管癌的应用.
| 研究 | 国家 | 发布时间 | 样本量 | 目的 | AUC | 灵敏度 | 特异度 |
| 王娜等[8] | 中国 | 2024年 | 6321张图像为训练集, 10408图像测试集 | 识别早期食管鳞状细胞癌 | - | 95.6% | 91.6% |
| Guo等[9] | 中国 | 2020年 | 6473张NBI图像为训练集, 6671张NBI图像为测试集 | 识别早期食管鳞状细胞癌 | 0.989 | 98.04% | 95.03% |
| Liu等[11] | 中国 | 2022年 | 1670张白光图像来训练和验证CNN系统 | EUS下自动识别食管病变浸润深度和来源 | 80.23% | 90.56% | |
| Jukema等[12] | 荷兰 | 2024年 | GastroNet数据库为训练集, 3596张NBI图像为测试集 | CADx辅助显着提高了普通内镜医生对BE的表征性能的识别, 达到了专业内镜医生的水平 | - | - | - |
| Liu等[19] | 中国 | 2020年 | 350例食管切除术和重建术的ESCC患者为训练集, 173例食管切除术和重建术的ESCC患者为测试集 | 预测ESCC患者是否存在病理性淋巴结转移 | 0.852 | - | - |
| Kouzu等[21] | 日本 | 2022年 | 156例ESCC患者苏木精-伊红数字化载玻片为训练集, 66例ESCC患者苏木精-伊红数字化载玻片为测试集 | 定量地评估ESCC中的DR进而预测预后 | - | - | - |
胃癌患者的预后与肿瘤分期密切相关, 进展期癌患者预后较差, 5年生存率<20%, 若能及时发现早期胃癌(early gastric cancer, EGC)并治疗, 5年生存率>90%[23]. 因此早诊断对于改善胃癌患者预后有重要作用, 但是由于胃部炎症病变较多, EGC常在胃黏膜炎症背景下出现, 且病变范围较小, 与周围黏膜差异不明显, 使得其很难被识别, 极易漏诊. AI在早期胃癌的内镜下协助诊断方面, Horiuchi等[24]基于CNN使用窄带成像联合放大内镜来区分EGC和胃炎, 其总体准确率、灵敏度和特异度分别为85.3%、95.4%、75.0%, 总测试速度为51.83张图像/秒(0.02秒/图像), 可在短时间内以高灵敏度区分EGC和胃炎. EUS是诊断胃肠道间质瘤重要手段, Yang等[25]研发可以诊断胃肠道间质瘤和胃肠道平滑肌瘤的AI系统, 其使内镜医师诊断黏膜下肿瘤的准确率从73.8%提高到88.8%, 总诊断准确率显著提高. 武汉大学人民医院于红刚教授团队结合DL和ML, 研发了一款基于特征提取的逻辑拟人化诊断系统(ENDOANGEL-LA)用于发现放大图像增强内镜下的EGC[26]. 并在图像和视频中测试了ENDOANGEL-LA诊断EGC的表现, 还将ENDOANGEL-LA与由不同训练集构建的DL模型和不同水平的内镜医生进行了比较. 结果显示, ENDOANGEL-LA在图像上的准确率显著高于单DL模型(88.76% vs 82.77%, P = 0.034)和新手模型(88.76% vs 71.63%, P<0.001), 与专家模型(88.95%)相当. ENDOANGEL-LA在视频中的准确率显著高于单DL模型(87.00% vs 68.00%, P<0.001), 与内镜医生(89.00%)相当. 在ENDOANGEL-LA的辅助下, 新手医师对于EGC的准确率(87.45%, P<0.001)明显提高. 因此ENDOANGEL-LA的表现优于其他DL模型, 且ENDOANGEL-LA辅助下的新手内镜医师的EGC检出率提高且与专家医生相当, 并且提高了内镜医师对AI的信任度和接受度, 目前该AI在国内正逐步推广. 但由于胃内复杂的环境, 为避免漏诊, AI的应用过程中一般会设定高灵敏度, 会造成检查过程中假阳性率较高, 仍需进一步训练其区别炎症、溃疡、萎缩等病变的能力.
随着内镜诊疗技术的发展, 内镜下微创治疗是浸润深度在胃黏膜层或胃黏膜下浅层病变的首选治疗方式. 因此, 内镜下识别病变并对浸润深度的预测是选择治疗方式的前提. Tang等[27]构建了基于DL的模型, 在窄带成像内镜下诊断EGC, 其在验证集中的AUC为0.888-0.951, 并诊断出所有视频数据集中的EGC. Goto等[28]研究证明AI辅助下的内镜医师对黏膜内癌诊断的准确率、灵敏度和特异性分别为78%、76%、80%, 进而减少了不必要的胃切除术. Bang等[29]基于ML根据病灶的生态学和形态学特征, 预测内镜黏膜下剥离术在未分化的ECG的根治性切除率, 其外部验证的准确率为89.8%. Uema[30]等研发一种在超声内镜下用于诊断EGC的浸润深度的AI模型, 该模型在外部验证数据集中的AUC为0.815.
AI在EGC预后方面的应用包括生存时间预测、复发风险预测和转移预测等[31-33]. Fan等[34]结合增强计算机断层扫描(computed tomography, CT)和正电子发射断层显像(positron emission tomography, PET-CT)影像学特征和临床资料使用自适应提升、线性判别分析和逻辑回归3种不同的ML分离器开发的预测模型, 用于术前预测胃癌的淋巴血管浸润状态. 3种预测模型的AUC分别为0.944、0.929和0.921. 证明基于ML的AI模型融合了PET/CT和增强的CT影像组学特征和临床资料, 对胃癌患者淋巴血管浸润状态具有良好的判别能力, 可作为一种无创术前预测工具, 辅助手术治疗决策. 测序分析技术作为挖掘肿瘤潜在生物学靶标的重要方法, 目前AI主要与鉴定药物靶点、构建预后标志物等方面相结合成为研究热点. Chen等[35]通过对胃癌患者代谢组学的分析, 构建可以进行早期诊断的10PM模型和预后预测的28PM模型, 其在外部测试集中AUC为0.967和0.832. 因此, 证明AI技术应用于胃癌基因信息分析, 可更好地量化解析复杂的分子生物通路网络, 有助于胃癌的精准诊疗. 见表2.
| 研究 | 国家 | 发布时间 | 样本量 | 目的 | AUC | 灵敏度 | 特异度 |
| Horiuchi等[24] | 日本 | 2020年 | 1492张EGC和1078张胃炎图像为训练集, 151张EGC和107张胃炎图像为测试集 | 使用NBI联合放大内镜来区分EGC和胃炎 | - | 95.4% | 75.0% |
| Yang等[25] | 中国 | 2022年 | 10439张EUS图像研发 | EUS下诊断胃肠道间质瘤和胃肠道平滑肌瘤 | - | - | - |
| Tang等[27] | 中国 | 2022年 | 13151张图像为训练集, 7057张图像为内部验证集, 1577张图像为外部验证集, 20个视频为视频验证集 | 在NBI内镜下诊断EGC | 0.888-0.951 | ||
| Goto等[28] | 日本 | 2023年 | 500张黏膜内膜和黏膜下癌为训练集, 200张黏膜内膜和黏膜下癌为测试集 | AI辅助下内镜医师之对EGC浸润深度的诊断 | 76% | 80% | |
| Bang等[29] | 韩国 | 2021年 | 2703例未分化型早期胃癌为训练集和内部验证集, 按9:1随机分配. 来自两家独立数据集的402例未分化型早期胃癌为测试集 | 预测内镜黏膜下剥离术在未分化的ECG的根治性切除率 | |||
| Fan等[34] | 中国 | 2022年 | 76例胃癌患者的增强CT和PET-CT影像学特征和临床资料为训练集, 25例胃癌患者的增强CT和PET-CT影像学特征和临床资料为测试集 | 预测胃癌患者淋巴血管浸润状态 | 自适应提升AI模型0.944 | ||
| 线性判别分析AI模型0.929 | |||||||
| 逻辑回归AI模型0.921 | |||||||
| Chen等[35] | 中国 | 2024年 | 426例胃癌患者血清学标本为数据集寻找差异代谢物, 95例胃癌患者为早期诊断的验证集, 181例胃癌患者为预测预后的验证集 | 10PM模型 | |||
| 0.967 | 0.854 | 0.926 | |||||
| 28PM模型 | |||||||
| 0.832 | 0.900 | 0.700 | |||||
结直肠癌(colorectal cancer, CRC)占我国所有肿瘤发病人数的第2位, 60%-70%的结直肠癌起源于腺瘤, 经历"正常黏膜-腺瘤性息肉-息肉癌变-浸润转移"等多个环节, 经历长达十数年的癌变过程[1,36]. 因此在CRC疾病初期尽早发现和预防来改善患者生存结局是内镜医师追求的目标, 通过早期筛查可以降低CRC发生率[37]. 腺瘤性息肉被认为是CRC的癌前病变, 腺瘤性息肉检出率是我国结直肠镜检的重要质量标准[38]. 已有研究证实, 腺瘤检出率提高1%, CRC的发病率降低3%, 死亡率则降低5%[39]. 故提高腺瘤检出率对降低CRC的发病率和死亡率具有重要意义. 目前已有国内外专家共识提出AI在肠镜中的应用[40-42]. 有研究报道, 在结肠镜检查过程中腺瘤性息肉漏诊率高达26%[43]. Glissen Brown等[44]一项前瞻性、多中心、单盲随机串联结肠镜检查研究, 以评估基于DL的CADe辅助结直肠镜检查期间遗漏息肉的情况, 发现使用CADe系统可降低腺瘤性息肉漏诊率和无蒂锯齿状病变的漏检率, 并增加首次腺瘤性息肉检出率. Bang等[45]研究证明CADe系统辅助结直肠镜检查增加小型结直肠息肉(<5 mm)的检出率, 其筛查小型结直肠息肉的灵敏度为93%、特异度为87%. 一项纳入全球21组随机研究的Meta分析结果显示, CADe辅助组的腺瘤检出率高于标准结直肠镜检查组, 与标准组相比, CADe辅助组切除更多非肿瘤性息肉, 因此在结直肠镜检查时使用CADe辅助可增加腺瘤性息肉的检出率[46]. Yao等[47]研究AI辅助新手医师进行内镜检查的有效性和安全性评价, 其表现出不逊于专家水平, 证明AI可以用于训练新手医师的操作. Wittbrodt等[48]通过AI辅助来自动评估结肠镜技术和相关指标的质量, AI对于盲肠插管识别正确率88%, 正确识别95.2%的直肠反折, 且AI具有更高的息肉检出率, 研究结果证明, AI可用于自动评估结肠镜检查的质量和培训内镜医师[49]. 尽管AI可以用来培训内镜医师, 但在临床工作中, 应避免过度依赖AI, 更多的临床训练是进步的必经之路, 要使AI更好的服务于临床工作.
随着各种内镜技术的发展, Kudo等[50]基于AI开发出EndoBRAIN系统, 其在染色内镜和窄带成像内镜下区分肿瘤病变的准确度为98%和96%. T1期CRC准确的光学诊断和黏膜下浸润程度判断有助于选择最佳治疗方案, 而是否行内镜下治疗取决于有无淋巴结转移. Ichimasa等[51]研究使用CAD预测T1期CRC患者有无淋巴结转移风险, 其灵敏度和特异度分别为69%、66%, 参考日本临床实践指南可降低21%的不必要外科手术. Yao等[52]开发了一种基于DL的以结直肠坐标驱动的AI模型用于增强CT图像中的结直肠和结直肠癌分割, 研究结果证明对 CRC 的分割精度为0.669, 结直肠的分割精度为0.892. 广泛用于图像识别的AI能够预测内镜下切片标本的的浸润深度, 可为临床提供客观可靠的诊疗意见, Wang等[53]通过CNN的方法分析核磁共振检查图像判断直肠癌环周切缘的情况, 其确定的环周切除缘状态的准确度、灵敏度和特异性分别为0.932、0.838和0.956. 综上, AI辅助结肠镜检查可以提高腺瘤检出率、评估结肠镜检查的质量和内镜医师的培训, 还可用于预测肿瘤有无淋巴结转移避免过度治疗及直肠癌环周切缘的情况等方面. 见表3.
| 研究 | 国家 | 发布时间 | 样本量 | 目的 | AUC | 灵敏度 | 特异度 |
| Glissen Brown等[44] | 美国 | 2022年 | 一项前瞻性、多中心、单盲、随机串联结肠镜检查研究, 232名患者随机分配进入CADe组和HDWL组 | 使用CADe系统可降低腺瘤性息肉漏诊率和无蒂锯齿状病变的漏检率, 并增加首次腺瘤性息肉检出率 | - | - | - |
| Bang等[45] | 韩国 | 2021年 | 纳入13项临床研究的Meta分析 | CADe模型利用内镜图像预测小型结直肠息肉组织学的准确性 | 0.96 | 0.93 | 0.87 |
| Hasson[46] | 意大利 | 2023年 | 纳入21项临床研究的Meta分析, 纳入18232名受试者 | CADe辅助结直肠镜检查可增加腺瘤性息肉的检出率 | - | - | - |
| Wittbrodt等[48] | 美国 | 2024年 | 使用两家医院的结肠镜资料开发AI模型及外部验证 | AI对于盲肠插管识别正确率88%, 且AI具有更高的息肉检出率 | - | - | - |
| Kudo等[50] | 日本 | 2020年 | 69142张为训练集 | 在染色内镜和NBI内镜下区分肿瘤病变 | - | 染色内镜下 | |
| 96.9% | 100% | ||||||
| 窄带成像内镜下 | |||||||
| 96.9% | 94.3% | ||||||
| Ichimasa等[51] | 日本 | 2018年 | 590例患者的数据为训练集, 100例患者的数据为验证集 | 预测T1期CRC患者有无淋巴结转移风险 | - | 69% | 66% |
| Yao等[52] | 中国 | 2024年 | 227例患者的CT图像及对应的结直肠和结直肠癌像素级标注作为训练集, 585患者的CT图像作为验证集 | 用于增强CT图像中的结直肠和结直肠癌分割 | - | - | - |
| Wang等[53] | 中国 | 2020年 | 192例CRC患者MRI为训练集, 48例CRC患者MRI为验证集 | 预测直肠癌患者环周切缘是否浸润 | 0.953 | 0.838 | 0.956 |
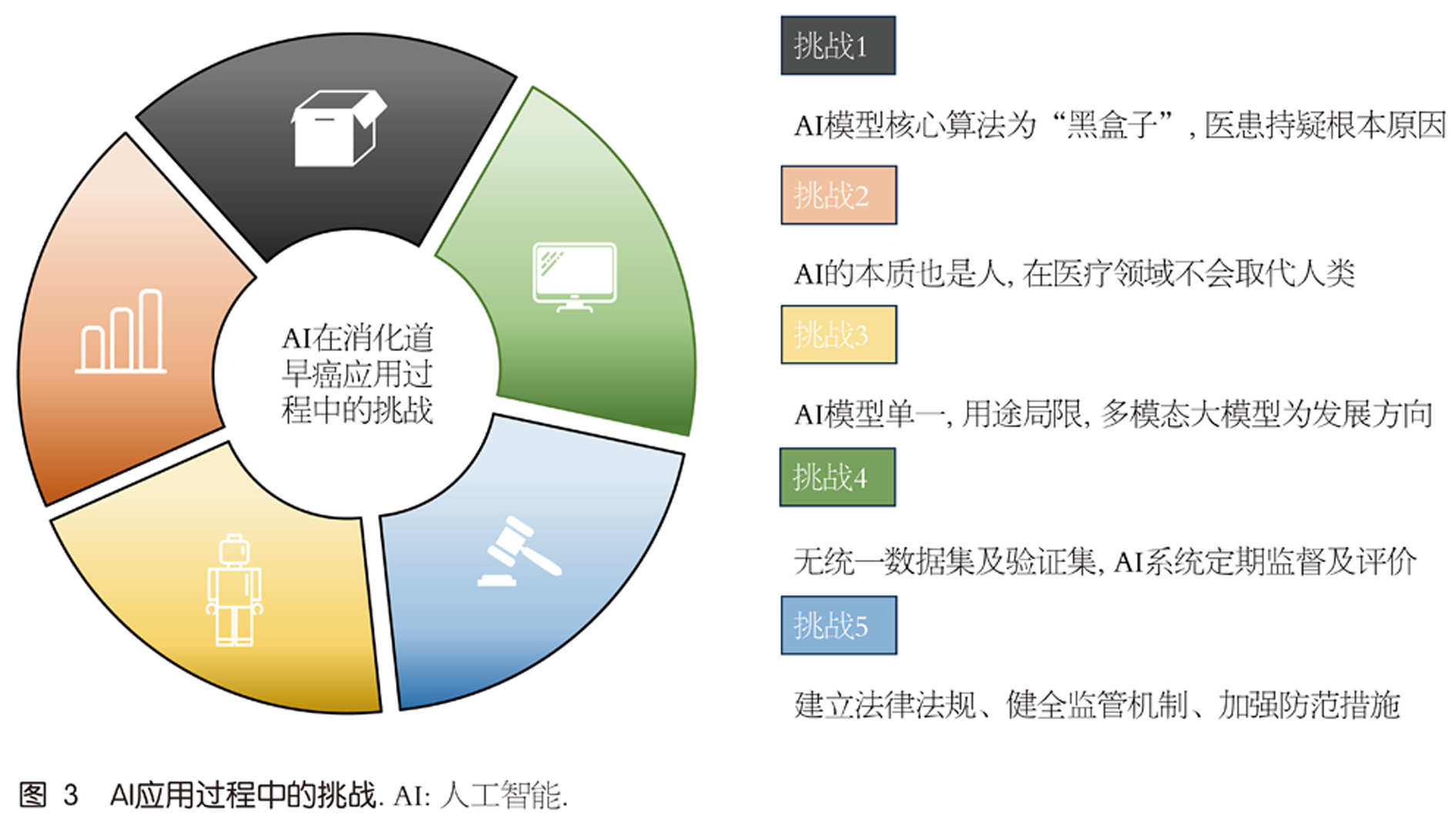
AI对消化道早癌的诊断治疗带来了诸多助力, 比如内镜方面辅助诊断、识别病变深度病理分型、基因分析、基于临床资料的肿瘤的分级分期及预后疗效分析等[54,55]. 但其在走向临床应用的过程中, 仍有许多问题亟待解决. 目前, AI技术应用于消化道早癌仍处于发展阶段, 其在应用过程中怎样发挥作用?在未来医疗工作中是否会取代人类?及其进入临床的道路上在法律监管、伦理学、互联网安全等诸多问题需要一一作答?基于以上数据及实践, 首先AI的核心算法仍为一个"黑匣子", 在临床应用过程中具体怎样发挥作用缺乏可解释性, 这也是医患对于AI进入医疗工作中持疑的根本原因[56]. 未来关于解释AI决策过程, 量化其可靠性, 将诊断决策背后的依据逻辑展示给医患是非常有必要的. AI在算法层面作为一种黑盒算法, 在临床应用中具有不确定性, 在进入临床工作时, 未来需要研发出更高级的监察AI对医疗AI全方位全流程的监督. 当算法出现问题导致医疗不良事件发生时, 责任的划定也是一个重要矛盾点, 是否将全部责任的划定归咎于人工智能, 亦或者医生又需承担相应的责任, 对于此种情况下责任的划分还不明确, 相关法律法规还不完善, 未来只有通过健全AI相关医疗事故法律问责机制、加强医疗监督治理的路径. AI的本质也是人, 在模型研发和训练中数据集需要人工进行特征标记及注释, 其次医疗不仅是治愈疾病, 更多是心理上的照顾, 正如特鲁多医师所说"有事去治愈, 常常去帮助, 总是去安慰", AI无法代替医患之间的情感交流, 医生对于患者的关怀、尊重、同理心和道德责任感是任何AI都无法代替的. 因此目前AI在医疗领域不会取代人类, 更多的是辅助决策作用[57]. 而AI研发过程中无统一训练集和验证集, 各训练集和验证集的质量和专业性无法得到保证, 因此目前的AI模型稳定性差, 其精准性仍有待提高. 未来需要计算机专业、临床医师、生物信息等多学科密切开展合作加深研究, 提高大数据挖掘处理和疾病预测模型的能力, 并定期对AI系统准确性进行有效监督及评价. 癌症的发生是多病因导致的, 目前大多数AI应用于消化道早癌的病灶识别和诊断, 而对于疾病预测和为高危人群识别的AI模型研究少之又少, 具有处理和理解多种类型数据的多模态大模型使得多功能诊治一体化的AI出现成为可能[58]. AI在后期还应建立法律法规、健全监管机制、加强技术研发和防范措施, 才可使AI在医疗领域的应用更广泛、更落地[59-61], 图3.
| 1. | Zheng RS, Chen R, Han BF, Wang SM, Li L, Sun KX, Zeng HM, Wei WW, He J. [Cancer incidence and mortality in China, 2022]. Zhonghua Zhong Liu Za Zhi. 2024;46:221-231. [PubMed] [DOI] |
| 2. | Han B, Zheng R, Zeng H, Wang S, Sun K, Chen R, Li L, Wei W, He J. Cancer incidence and mortality in China, 2022. J Natl Cancer Cent. 2024;4:47-53. [PubMed] [DOI] |
| 3. | Brenner H, Heisser T, Cardoso R, Hoffmeister M. Reduction in colorectal cancer incidence by screening endoscopy. Nat Rev Gastroenterol Hepatol. 2024;21:125-133. [PubMed] [DOI] |
| 4. | Johnson R, Li MM, Noori A, Queen O, Zitnik M. Graph Artificial Intelligence in Medicine. Annu Rev Biomed Data Sci. 2024;7:345-368. [PubMed] [DOI] |
| 5. | Haug CJ, Drazen JM. Artificial Intelligence and Machine Learning in Clinical Medicine, 2023. N Engl J Med. 2023;388:1201-1208. [PubMed] [DOI] |
| 6. | Lu YB, Lu SC, Li FD, Le PH, Zhang KH, Sun ZZ, Huang YN, Weng YC, Chen WT, Fu YW, Qian JB, Hu B, Xu H, Chiu CT, Xu QW, Gong W. Artificial intelligence-aided diagnostic imaging: A state-of-the-art technique in precancerous screening. J Gastroenterol Hepatol. 2024;39:544-551. [PubMed] [DOI] |
| 7. | Bhinder B, Gilvary C, Madhukar NS, Elemento O. Artificial Intelligence in Cancer Research and Precision Medicine. Cancer Discov. 2021;11:900-915. [PubMed] [DOI] |
| 8. | 王 娜, 温 静, 冯 佳, 卢 娜利, 刘 翠华, 智 佳, 王 子阳, 黄 锦. 基于人工智能深度学习算法辅助诊断早期ESCC的研究. 胃肠病学和肝病学杂志. 2024;33:156-161. [DOI] |
| 9. | Guo L, Xiao X, Wu C, Zeng X, Zhang Y, Du J, Bai S, Xie J, Zhang Z, Li Y, Wang X, Cheung O, Sharma M, Liu J, Hu B. Real-time automated diagnosis of precancerous lesions and early esophageal squamous cell carcinoma using a deep learning model (with videos). Gastrointest Endosc. 2020;91:41-51. [PubMed] [DOI] |
| 10. | Yuan XL, Liu W, Lin YX, Deng QY, Gao YP, Wan L, Zhang B, Zhang T, Zhang WH, Bi XG, Yang GD, Zhu BH, Zhang F, Qin XB, Pan F, Zeng XH, Chaudhry H, Pang MY, Yang J, Zhang JY, Hu B. Effect of an artificial intelligence-assisted system on endoscopic diagnosis of superficial oesophageal squamous cell carcinoma and precancerous lesions: a multicentre, tandem, double-blind, randomised controlled trial. Lancet Gastroenterol Hepatol. 2024;9:34-44. [PubMed] [DOI] |
| 11. | Liu GS, Huang PY, Wen ML, Zhuang SS, Hua J, He XP. Application of endoscopic ultrasonography for detecting esophageal lesions based on convolutional neural network. World J Gastroenterol. 2022;28:2457-2467. [PubMed] [DOI] |
| 12. | Jukema JB, Kusters CHJ, Jong MR, Fockens KN, Boers T, van der Putten JA, Pouw RE, Duits LC, Weusten BLAM, Herrero LA, Houben MHMG, Nagengast WB, Westerhof J, Alkhalaf A, Mallant-Hent R, Scholten P, Ragunath K, Seewald S, Elbe P, Silva FB, Barret M, Ortiz Fernández-Sordo J, Moral Villarejo G, Pech O, Beyna T, Montazeri NSM, der Sommen FV, de With PH, de Groof AJ, Bergman JJ; BONS-AI consortium. Computer-aided diagnosis improves characterization of Barrett's neoplasia by general endoscopists (with video). Gastrointest Endosc. 2024;100:616-625.e8. [PubMed] [DOI] |
| 13. | Yao B, Feng Y, Zhao K, Liang Y, Huang P, Zang J, Song J, Li M, Wang X, Shu H, Shi R. Artificial intelligence assisted cytological detection for early esophageal squamous epithelial lesions by using low-grade squamous intraepithelial lesion as diagnostic threshold. Cancer Med. 2023;12:1228-1236. [PubMed] [DOI] |
| 14. | Jong MR, de Groof AJ. Advancement of artificial intelligence systems for surveillance endoscopy of Barrett's esophagus. Dig Liver Dis. 2024;56:1126-1130. [PubMed] [DOI] |
| 16. | Visaggi P, Barberio B, Ghisa M, Ribolsi M, Savarino V, Fassan M, Valmasoni M, Marchi S, de Bortoli N, Savarino E. Modern Diagnosis of Early Esophageal Cancer: From Blood Biomarkers to Advanced Endoscopy and Artificial Intelligence. Cancers (Basel). 2021;13. [PubMed] [DOI] |
| 17. | Pan Y, He L, Chen W, Yang Y. The current state of artificial intelligence in endoscopic diagnosis of early esophageal squamous cell carcinoma. Front Oncol. 2023;13:1198941. [PubMed] [DOI] |
| 18. | Wang JL, Tang LS, Zhong X, Wang Y, Feng YJ, Zhang Y, Liu JY. A machine learning radiomics based on enhanced computed tomography to predict neoadjuvant immunotherapy for resectable esophageal squamous cell carcinoma. Front Immunol. 2024;15:1405146. [PubMed] [DOI] |
| 19. | Liu XL, Shao CY, Sun L, Liu YY, Hu LW, Cong ZZ, Xu Y, Wang RC, Yi J, Wang W. An artificial neural network model predicting pathologic nodal metastases in clinical stage I-II esophageal squamous cell carcinoma patients. J Thorac Dis. 2020;12:5580-5592. [PubMed] [DOI] |
| 20. | Lu S, Wang C, Liu Y, Chu F, Jia Z, Zhang H, Wang Z, Lu Y, Wang S, Yang G, Qu J. The MRI radiomics signature can predict the pathologic response to neoadjuvant chemotherapy in locally advanced esophageal squamous cell carcinoma. Eur Radiol. 2024;34:485-494. [PubMed] [DOI] |
| 21. | Kouzu K, Nearchou IP, Kajiwara Y, Tsujimoto H, Lillard K, Kishi Y, Ueno H. Deep-learning-based classification of desmoplastic reaction on H&E predicts poor prognosis in oesophageal squamous cell carcinoma. Histopathology. 2022;81:255-263. [PubMed] [DOI] |
| 22. | Xie Y, Liu Q, Ji C, Sun Y, Zhang S, Hua M, Liu X, Pan S, Hu W, Ma Y, Wang Y, Zhang X. An artificial neural network-based radiomics model for predicting the radiotherapy response of advanced esophageal squamous cell carcinoma patients: a multicenter study. Sci Rep. 2023;13:8673. [PubMed] [DOI] |
| 23. | Smyth EC, Nilsson M, Grabsch HI, van Grieken NC, Lordick F. Gastric cancer. Lancet. 2020;396:635-648. [PubMed] [DOI] |
| 24. | Horiuchi Y, Aoyama K, Tokai Y, Hirasawa T, Yoshimizu S, Ishiyama A, Yoshio T, Tsuchida T, Fujisaki J, Tada T. Convolutional Neural Network for Differentiating Gastric Cancer from Gastritis Using Magnified Endoscopy with Narrow Band Imaging. Dig Dis Sci. 2020;65:1355-1363. [PubMed] [DOI] |
| 25. | Yang X, Wang H, Dong Q, Xu Y, Liu H, Ma X, Yan J, Li Q, Yang C, Li X. An artificial intelligence system for distinguishing between gastrointestinal stromal tumors and leiomyomas using endoscopic ultrasonography. Endoscopy. 2022;54:251-261. [PubMed] [DOI] |
| 26. | Li J, Zhu Y, Dong Z, He X, Xu M, Liu J, Zhang M, Tao X, Du H, Chen D, Huang L, Shang R, Zhang L, Luo R, Zhou W, Deng Y, Huang X, Li Y, Chen B, Gong R, Zhang C, Li X, Wu L, Yu H. Development and validation of a feature extraction-based logical anthropomorphic diagnostic system for early gastric cancer: A case-control study. EClinicalMedicine. 2022;46:101366. [PubMed] [DOI] |
| 27. | Tang D, Ni M, Zheng C, Ding X, Zhang N, Yang T, Zhan Q, Fu Y, Liu W, Zhuang D, Lv Y, Xu G, Wang L, Zou X. A deep learning-based model improves diagnosis of early gastric cancer under narrow band imaging endoscopy. Surg Endosc. 2022;36:7800-7810. [PubMed] [DOI] |
| 28. | Goto A, Kubota N, Nishikawa J, Ogawa R, Hamabe K, Hashimoto S, Ogihara H, Hamamoto Y, Yanai H, Miura O, Takami T. Cooperation between artificial intelligence and endoscopists for diagnosing invasion depth of early gastric cancer. Gastric Cancer. 2023;26:116-122. [PubMed] [DOI] |
| 29. | Bang CS, Ahn JY, Kim JH, Kim YI, Choi IJ, Shin WG. Establishing Machine Learning Models to Predict Curative Resection in Early Gastric Cancer with Undifferentiated Histology: Development and Usability Study. J Med Internet Res. 2021;23:e25053. [PubMed] [DOI] |
| 30. | Uema R, Hayashi Y, Kizu T, Igura T, Ogiyama H, Yamada T, Takeda R, Nagai K, Inoue T, Yamamoto M, Yamaguchi S, Kanesaka T, Yoshihara T, Kato M, Yoshii S, Tsujii Y, Shinzaki S, Takehara T. A novel artificial intelligence-based endoscopic ultrasonography diagnostic system for diagnosing the invasion depth of early gastric cancer. J Gastroenterol. 2024;59:543-555. [PubMed] [DOI] |
| 31. | Molinari C, Solaini L, Rebuzzi F, Tedaldi G, Angeli D, Petracci E, Prascevic D, Ewald J, Rahm E, Canale M, Giovanni M, Tomezzoli A, Bencivenga M, Ambrosio MR, Marrelli D, Morgagni P, Ercolani G, Ulivi P, Saragoni L. Genomic events stratifying prognosis of early gastric cancer. Gastric Cancer. 2024;27:1189-1200. [PubMed] [DOI] |
| 32. | Chen TH, Kuo CF, Lee C, Yeh TS, Lan J, Huang SC. Artificial Intelligence Model for a Distinction between Early-Stage Gastric Cancer Invasive Depth T1a and T1b. J Cancer. 2024;15:3085-3094. [PubMed] [DOI] |
| 33. | Hayashi T, Takasawa K, Yoshikawa T, Hashimoto T, Sekine S, Wada T, Yamagata Y, Suzuki H, Abe S, Yoshinaga S, Saito Y, Kouno N, Hamamoto R. A discrimination model by machine learning to avoid gastrectomy for early gastric cancer. Ann Gastroenterol Surg. 2023;7:913-921. [PubMed] [DOI] |
| 34. | Fan L, Li J, Zhang H, Yin H, Zhang R, Zhang J, Chen X. Machine learning analysis for the noninvasive prediction of lymphovascular invasion in gastric cancer using PET/CT and enhanced CT-based radiomics and clinical variables. Abdom Radiol (NY). 2022;47:1209-1222. [PubMed] [DOI] |
| 35. | Chen Y, Wang B, Zhao Y, Shao X, Wang M, Ma F, Yang L, Nie M, Jin P, Yao K, Song H, Lou S, Wang H, Yang T, Tian Y, Han P, Hu Z. Metabolomic machine learning predictor for diagnosis and prognosis of gastric cancer. Nat Commun. 2024;15:1657. [PubMed] [DOI] |
| 36. | Dekker E, Tanis PJ, Vleugels JLA, Kasi PM, Wallace MB. Colorectal cancer. Lancet. 2019;394:1467-1480. [PubMed] [DOI] |
| 37. | 中国疾病预防控制中心慢性非传染性疾病预防控制中心肿瘤防控专家组; 吴静, 王宝华, 陈波, 厚磊, 姬一兵, 王宁, 冯雪菲, 周金意, 郭晓雷, 冯石献, 王华东, 周信. 中国社区居民结直肠癌筛查专家共识. 环境卫生学杂志. 2024;14:273-285. [DOI] |
| 39. | Dawwas MF. Adenoma detection rate and risk of colorectal cancer and death. N Engl J Med. 2014;370:2539-2540. [PubMed] [DOI] |
| 41. | Parasa S, Repici A, Berzin T, Leggett C, Gross SA, Sharma P. Framework and metrics for the clinical use and implementation of artificial intelligence algorithms into endoscopy practice: recommendations from the American Society for Gastrointestinal Endoscopy Artificial Intelligence Task Force. Gastrointest Endosc. 2023;97:815-824.e1. [PubMed] [DOI] |
| 42. | Wang J, Long Q, Liang Y, Song J, Feng Y, Li P, Sun W, Zhao L. AI-assisted identification of intrapapillary capillary loops in magnification endoscopy for diagnosing early-stage esophageal squamous cell carcinoma: a preliminary study. Med Biol Eng Comput. 2023;61:1631-1648. [PubMed] [DOI] |
| 43. | Zhao S, Wang S, Pan P, Xia T, Chang X, Yang X, Guo L, Meng Q, Yang F, Qian W, Xu Z, Wang Y, Wang Z, Gu L, Wang R, Jia F, Yao J, Li Z, Bai Y. Magnitude, Risk Factors, and Factors Associated With Adenoma Miss Rate of Tandem Colonoscopy: A Systematic Review and Meta-analysis. Gastroenterology. 2019;156:1661-1674.e11. [PubMed] [DOI] |
| 44. | Glissen Brown JR, Mansour NM, Wang P, Chuchuca MA, Minchenberg SB, Chandnani M, Liu L, Gross SA, Sengupta N, Berzin TM. Deep Learning Computer-aided Polyp Detection Reduces Adenoma Miss Rate: A United States Multi-center Randomized Tandem Colonoscopy Study (CADeT-CS Trial). Clin Gastroenterol Hepatol. 2022;20:1499-1507.e4. [PubMed] [DOI] |
| 45. | Bang CS, Lee JJ, Baik GH. Computer-Aided Diagnosis of Diminutive Colorectal Polyps in Endoscopic Images: Systematic Review and Meta-analysis of Diagnostic Test Accuracy. J Med Internet Res. 2021;23:e29682. [PubMed] [DOI] |
| 46. | Hassan C, Spadaccini M, Mori Y, Foroutan F, Facciorusso A, Gkolfakis P, Tziatzios G, Triantafyllou K, Antonelli G, Khalaf K, Rizkala T, Vandvik PO, Fugazza A, Rondonotti E, Glissen-Brown JR, Kamba S, Maida M, Correale L, Bhandari P, Jover R, Sharma P, Rex DK, Repici A. Real-Time Computer-Aided Detection of Colorectal Neoplasia During Colonoscopy : A Systematic Review and Meta-analysis. Ann Intern Med. 2023;176:1209-1220. [PubMed] [DOI] |
| 47. | Yao L, Li X, Wu Z, Wang J, Luo C, Chen B, Luo R, Zhang L, Zhang C, Tan X, Lu Z, Zhu C, Huang Y, Tan T, Liu Z, Li Y, Li S, Yu H. Effect of artificial intelligence on novice-performed colonoscopy: a multicenter randomized controlled tandem study. Gastrointest Endosc. 2024;99:91-99.e9. [PubMed] [DOI] |
| 48. | Wittbrodt M, Klug M, Etemadi M, Yang A, Pandolfino JE, Keswani RN. Assessment of colonoscopy skill using machine learning to measure quality: Proof-of-concept and initial validation. Endosc Int Open. 2024;12:E849-E853. [PubMed] [DOI] |
| 49. | Hookey L. "AI for the new GI": What role does artificial intelligence have in early colonoscopy training? Gastrointest Endosc. 2024;99:100-101. [PubMed] [DOI] |
| 50. | Kudo SE, Misawa M, Mori Y, Hotta K, Ohtsuka K, Ikematsu H, Saito Y, Takeda K, Nakamura H, Ichimasa K, Ishigaki T, Toyoshima N, Kudo T, Hayashi T, Wakamura K, Baba T, Ishida F, Inoue H, Itoh H, Oda M, Mori K. Artificial Intelligence-assisted System Improves Endoscopic Identification of Colorectal Neoplasms. Clin Gastroenterol Hepatol. 2020;18:1874-1881.e2. [PubMed] [DOI] |
| 51. | Ichimasa K, Kudo SE, Mori Y, Misawa M, Matsudaira S, Kouyama Y, Baba T, Hidaka E, Wakamura K, Hayashi T, Kudo T, Ishigaki T, Yagawa Y, Nakamura H, Takeda K, Haji A, Hamatani S, Mori K, Ishida F, Miyachi H. Artificial intelligence may help in predicting the need for additional surgery after endoscopic resection of T1 colorectal cancer. Endoscopy. 2018;50:230-240. [PubMed] [DOI] |
| 52. | Yao L, Xia Y, Chen Z, Li S, Yao J, Jin D, Liang Y, Lin J, Zhao B, Han C, Lu L, Zhang L, Liu Z, Chen X. A Colorectal Coordinate-Driven Method for Colorectum and Colorectal Cancer Segmentation in Conventional CT Scans. IEEE Trans Neural Netw Learn Syst. 2024;PP. [PubMed] [DOI] |
| 53. | Wang D, Xu J, Zhang Z, Li S, Zhang X, Zhou Y, Zhang X, Lu Y. Evaluation of Rectal Cancer Circumferential Resection Margin Using Faster Region-Based Convolutional Neural Network in High-Resolution Magnetic Resonance Images. Dis Colon Rectum. 2020;63:143-151. [PubMed] [DOI] |
| 54. | Guidozzi N, Menon N, Chidambaram S, Markar SR. The role of artificial intelligence in the endoscopic diagnosis of esophageal cancer: a systematic review and meta-analysis. Dis Esophagus. 2023;36:doad048. [PubMed] [DOI] |
| 55. | Dong Z, Tao X, Du H, Wang J, Huang L, He C, Zhao Z, Mao X, Ai Y, Zhang B, Liu M, Xu H, Jiang Z, Sun Y, Li X, Liu Z, Chen J, Song Y, Liu G, Luo C, Li Y, Zeng X, Liu J, Zhu Y, Wu L, Yu H. Exploring the challenge of early gastric cancer diagnostic AI system face in multiple centers and its potential solutions. J Gastroenterol. 2023;58:978-989. [PubMed] [DOI] |
| 59. | 石 佳友, 徐 靖仪. 医疗人工智能应用的法律挑战及其治理. 西北大学学报(哲学社会科学版). 2024;54:91-103. [DOI] |
| 60. | 钟 晓雯, 高 洁. "人工智能+医疗"的风险研判及治理路径. 广西师范大学学报(哲学社会科学版). 2024;60:29-41. [DOI] |
| 62. | 张 春娟, 马 小董, 周 昔程. 人工智能对基层医院医疗发展的制约因素分析. 中国农村卫生事业管理. 2024;44:522-526. [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 陕西省
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁