修回日期: 2024-09-27
接受日期: 2024-11-21
在线出版日期: 2024-12-28
腹主动脉瘤(abdominal aortic aneurysm, AAA)是一种潜在、致命的血管疾病, 缺乏有效的非手术干预措施. 肠道菌群失调在许多心血管疾病中起着关键作用, 如动脉粥样硬化和高血压, 但其与AAA的关系尚未完全阐明. 本文阐述了肠道菌群与AAA之间的关系, 分析了肠道菌群失调在AAA形成和发展中的潜在作用机制, 并为AAA预防提供了建议.
核心提要: 本文讨论了肠道菌群在腹主动脉瘤(abdominal aortic aneurysm, AAA)形成中的潜在作用机制. 肠道菌群失调可能通过诱发炎症反应、影响代谢通路和导致免疫系统失调, 从而促进AAA的发生和进展. 此外, 肠道菌群调节作为AAA治疗策略的潜力值得进一步评估.
引文著录: 王潇, 于嘉瑞, 田萃红, 陶凉. 肠道菌群失调在腹主动脉瘤形成中的作用. 世界华人消化杂志 2024; 32(12): 859-864
Revised: September 27, 2024
Accepted: November 21, 2024
Published online: December 28, 2024
Abdominal aortic aneurysm (AAA) is a potentially fatal vascular disease that lacks effective non-surgical interventions. Gut flora dysfunction plays a crucial role in various cardiovascular diseases, such as atherosclerosis and hypertension, but its relationship with AAA has not been fully elucidated. This article elaborates the relationship between gut flora and AAA, analyzes the potential mechanisms of gut flora dysfunction in the formation and development of AAA, and provides suggestions for AAA prevention.
- Citation: Wang X, Yu JR, Tian CH, Tao L. Role of intestinal flora imbalance in formation of abdominal aortic aneurysms. Shijie Huaren Xiaohua Zazhi 2024; 32(12): 859-864
- URL: https://www.wjgnet.com/1009-3079/full/v32/i12/859.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i12.859
腹主动脉瘤(abdominal aortic aneurysm, AAA)是一种常见且具有高致残率和致死率的心血管疾病, 其特点是腹主动脉局部病变导致的永久性扩张[1]. AAA的发病率随年龄增长显著增加, 特别是在65岁以上的男性人群中更为常见(1.3%)[2]. 尽管近年来影像学诊断和外科干预措施取得了显著进展, 但AAA的预防和内科治疗手段依然有限[3]. 目前, 动脉瘤破裂仍然是导致患者死亡的主要原因之一, 一旦破裂30天死亡率高达70%[4]. 这突显了探索AAA新的病理机制和治疗靶点的重要性.
AAA的形成和发展是一个多因素共同作用的复杂过程, 涉及血管壁的退行性变化、炎症反应、免疫系统的异常激活以及基因和环境因素的交互作用等[5]. AAA通常伴随着广泛的炎症细胞浸润, 包括中性粒细胞、单核细胞/巨噬细胞和T细胞等. 这些炎症细胞分泌多种炎性介质, 如细胞因子、趋化因子和基质金属蛋白酶(matrix metalloproteinases, MMPs), 导致血管壁细胞外基质降解和血管平滑肌细胞凋亡, 从而促进动脉瘤的进展和破裂[6].
近年来, 肠道菌群作为人体"第二基因组"的概念逐渐被学术界广泛接受[7]. 肠道菌群不仅在消化、代谢和免疫调节中发挥重要作用, 还与多种系统性疾病密切相关, 如代谢性疾病和免疫性疾病[8]. 此外, 肠道菌群失调与动脉粥样硬化和高血压等心血管疾病的发生和发展有关, 而这些疾病也是AAA的重要危险因素[9].
肠道菌群在AAA的形成中至关重要. 首先, 肠道屏障功能的破坏可导致肠道内毒素, 进入血循环, 如脂多糖(lipopolysaccharide, LPS), 激活全身性炎症反应[10]. 其次, 肠道菌群代谢产物, 如短链脂肪酸(short chain fatty acids, SCFAs), 对宿主的免疫调节具有重要作用, 其失衡可导致免疫系统的异常激活. 此外, 一些特定肠道细菌(如Akkermansia muciniphila和Bacteroides spp)的丰度变化可诱发炎症反应和代谢紊乱, 通过调控炎症细胞的募集和激活, 促进AAA的形成和发展[11]. 近年来, 高通量测序技术的迅速发展为研究肠道菌群在疾病中的作用提供了有力支持. 高通量16S rRNA基因测序技术发现, AAA患者存在肠道菌群失调[12], 具体表现为一些具有抗炎作用的益生菌(如Lactobacillus和Bifidobacterium)丰度显著降低, 而一些潜在致病菌(如Enterobacteriaceae)丰度显著增加[13].
本文系统性综述了肠道菌群失调对AAA形成和发展的影响, 深入探讨了其潜在的病理机制, 以期为AAA的预防和治疗提供新的理论依据和实践指导, 并为未来的临床研究奠定基础.
肠道菌群失调又称肠道微生态失衡, 主要是指由于肠道菌群组成改变、细菌活性变化或菌群分布变化而引起的失衡状态[14]. 肠道微生物群的失衡可能通过诱发炎症反应和影响代谢通路促进AAA的形成[15]. 对血管紧张素Ⅱ诱导的载脂蛋白E敲除(apolipoprotein E, ApoE-/-)AAA小鼠模型进行了16S rRNA测序发现, AAA小鼠的肠道微生物群存在显著的失调现象, 具体表现为Akkermansia和Ruminococcus等菌群的相对丰度减少[16]. Akkermansia菌群与肠道黏膜屏障的维护有关, 其丰度的减少可导致肠道通透性增加, 加剧炎症反应; 而Ruminococcus菌群则与膳食纤维的代谢密切相关, 其丰度的减少可影响肠道内的能量平衡和营养吸收[17]. 同时, Helicobacter和Odoribacter等菌群也呈现出显著的丰度减少, 可能通过多种作用参与AAA的形成和进展[18,19].
肠道菌群失调可通过诱发炎症反应导致肠道屏障功能障碍. 当肠道菌群失衡时, 限制在肠道内的毒素如LPS可借机穿透肠道屏障, 进入血液循环系统[20]. Toll样受体和其他模式识别受体立即识别并响应这些毒素的存在, 进而触发一系列信号转导过程, 导致炎性细胞因子的释放, 如肿瘤坏死因子α、白细胞介素6和白细胞介素1β等[21,22]. 这些炎性细胞因子调节炎症反应, 进一步加剧肠道屏障功能障碍, 促进AAA形成[23].
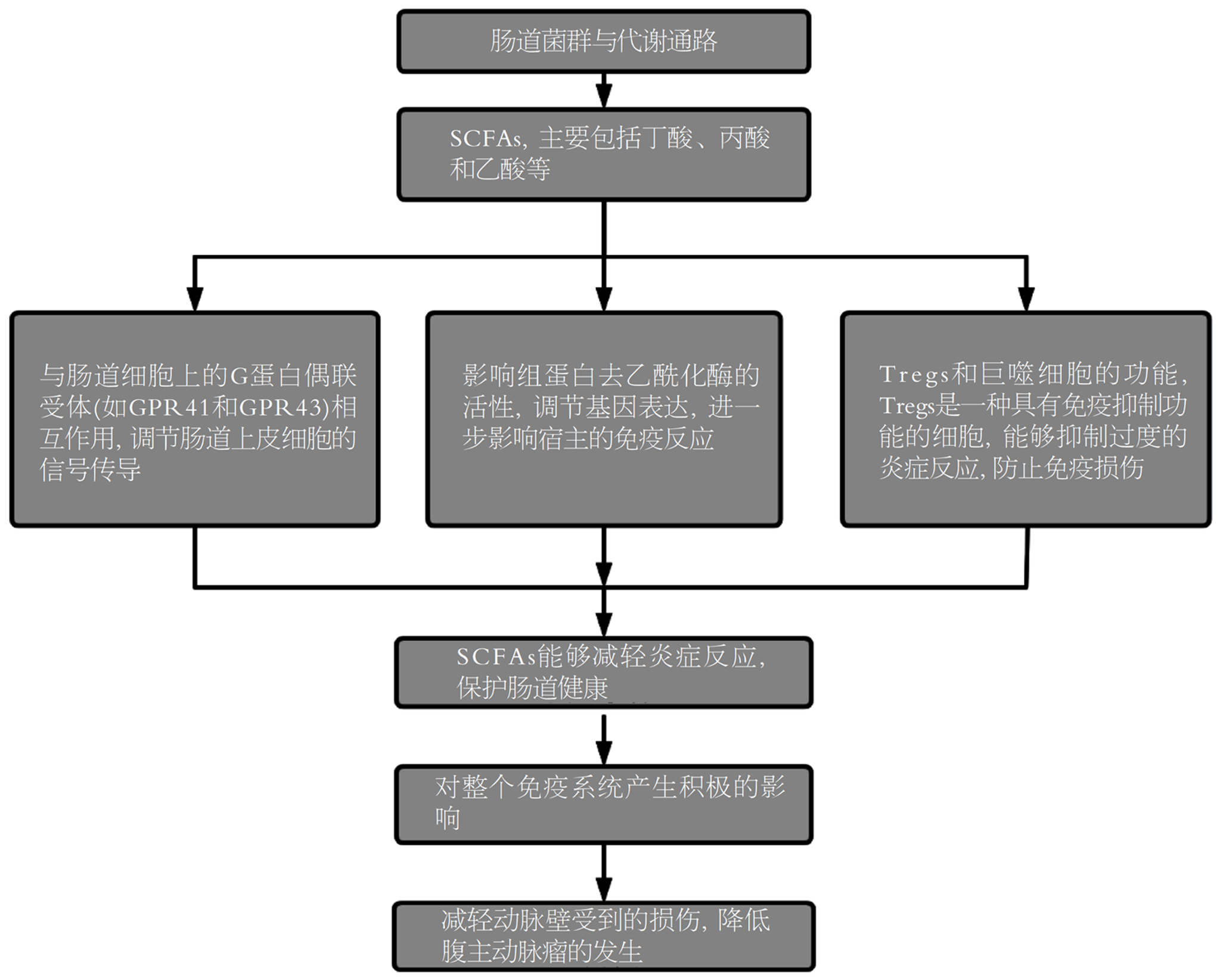
肠道菌群失调可通过影响代谢通路促进AAA的形成和进展. SCFAs和胆碱代谢产物[三甲胺N-氧化物, (trimethylamine N-oxide, TMAO)]是两种具有代表性的代谢产物. SCFAs是一类由肠道菌群发酵膳食纤维而产生的代谢产物, 主要包括丁酸、丙酸和乙酸等[24]. SCFAs能与肠道细胞上的G蛋白偶联受体, 如GPR41和GPR43]相互作用, 调节肠道上皮细胞的信号转导, 从而影响肠道屏障功能[25]. SCFAs还能影响组蛋白去乙酰化酶的活性, 进一步影响宿主的免疫反应[26]. 此外, SCFAs可以通过调节调节性T细胞(regulatory T cells, Tregs)和巨噬细胞的功能, 减轻肠道炎症反应, 维护肠道屏障的稳定[27]. Tregs是一种具有免疫抑制功能的细胞, 能够抑制过度的炎症反应, 防止免疫损伤. Tregs数量的增加有助于维持免疫系统的稳态[28]. 这些机制共同作用下, SCFAs可减轻炎症反应, 保护肠道健康, 维持免疫系统的稳态[29]; 降低胆固醇水平, 减少动脉粥样硬化的发生; 抑制血小板的活化和凝集, 减轻动脉壁损伤(图1)[30]. 然而, 当肠道菌群失调时, SCFAs产量减少, 从而削弱了其抗炎和维护肠道屏障功能稳定的作用.
TMAO是一种由肠道菌群代谢胆碱、肉碱和甜菜碱而产生的代谢产物. 高水平的TMAO与心血管疾病的风险增加密切相关[31]. Shikata等[32]的研究显示, 通过给小鼠补充胆碱或直接提高TMAO含量, 可激活内质网应激相关通路[33], 导致腹主动脉扩张和AAA形成. TMAO能激活内质网应激激酶(protein kinase r-like endoplasmic reticulum kinase, PERK)通路, 促进血管平滑肌细胞凋亡,导致动脉扩张[34]、动脉壁变薄, 增加AAA形成的风险[35]. 此外, TMAO能够激活炎症反应, 加剧动脉壁的损伤, 从而促进AAA的形成[36].
单核/巨噬细胞在AAA形成过程中至关重要. 在AAA形成的过程中, 单核/巨噬细胞可转变为促炎状态, 并聚集在动脉壁[37]. 肠道菌群的失衡会导致周期蛋白依赖激酶抑制因子1A(p21)、细胞周期蛋白依赖性激酶抑制因子2C(p14/p16)和β-半乳糖苷酶表达上调, 造成单核/巨噬细胞在动脉壁内大量积累[38]. 这些细胞可分泌MMPs和其他炎性介质, 降解细胞外基质, 从而促进动脉壁的扩张和动脉瘤的形成[39]. 此外, 中性粒细胞也在动脉瘤的形成过程中发挥着不可忽视的作用. 在AAA形成的早期阶段, 中性粒细胞便开始浸润动脉壁, 激活PERK介导的内质网应激途径和其他炎性介质, 加重动脉壁的损伤, 加速AAA的形成[40].
抗生素的使用可能会对宿主的肠道菌群产生保护作用, 影响宿主的免疫系统和代谢通路, 减少AAA的发生. Swirski等[41]的研究发现, 通过给ApoE-/-小鼠口服抗生素混合物, 可以显著降低AAA的发生率和破裂率. 口服抗生素组AAA发生率为28.6%, 明显低于对照组的58.9%; 口服抗生素组的AAA破裂率为0%, 对照组为11%, 提示抗生素能减少AAA的形成. 这可能是因为抗生素通过作用于单核细胞, 显著减少脾脏中单核细胞的储备量[42], 并对炎症细胞的迁移产生抑制作用. 研究发现经抗生素处理的小鼠腹主动脉壁上巨噬细胞的积累量显著减少[43,44]. 这一发现进一步证实了抗生素通过调节单核巨噬细胞等炎症细胞抑制AAA形成的作用.
虽然抗生素的使用能够减少AAA的发生, 但临床医生在使用抗生素时应合理调整抗生素的用量和使用时间, 防止抗生素滥用对肠道菌群的破坏[45]. 同时, 患者在日常生活中也应注意饮食结构的合理性, 保持肠道微生物群的平衡.
近年来, 随着对肠道微生物的深入研究, 益生菌在调节肠道健康方面的作用逐渐受到重视[46]. 它不仅能促进肠道菌群稳态, 还能有效减轻炎症反应, 可能是一种AAA预防和治疗的新策略. 补充特定的益生菌, 如Akkermansia muciniphila, 可以减少炎症反应, 增强肠道屏障功能, 防止AAA形成[47].
益生菌可通过以下机制发挥保护作用. 首先, 益生菌可增强肠道屏障功能[48], 防止有害物质和毒素穿过肠道进入血液循环, 减轻全身炎症反应. 其次, 益生菌能调节宿主免疫反应[49], 减少炎症细胞在动脉壁的积累, 从而降低AAA的形成风险[50]. 这使益生菌在维护身体健康和预防疾病方面发挥着重要作用[51].
益生元也是预防和治疗AAA的重要策略之一. 益生元是指一类能够选择性刺激肠道内一种或几种有益菌生长繁殖, 从而改善宿主健康的膳食成分[52]. 菊粉和低聚果糖是常见的益生元, 能促进有益菌的生长, 改善肠道菌群组成, 增强肠道屏障功能, 对AAA产生保护作用. 摄入适量的益生元能够显著降低AAA的发生率, 并改善患者的预后[53].
膳食干预同样在AAA的防治中发挥着重要作用. 高纤维饮食是预防AAA的有效手段之一[54]. 膳食纤维能够促进肠道内有益菌的生长, 增加SCFAs的生成, 促进肠道菌群平衡, 减少炎症反应[55]. 此外, 高纤维饮食还能降低血脂、血糖等心血管危险因素, 进一步降低AAA的发生风险[56].
当前, 粪菌移植(fecal microbiota transplantation, FMT)作为重塑肠道菌群的一种有效手段, 展现出治疗多种疾病的潜力. 通过将健康供体的粪便移植到患者体内, 能够有效恢复肠道菌群的多样性, 进而改善宿主的代谢状态和免疫功能. 研究发现, FMT不仅在治疗难治性腹泻、肥胖和糖尿病方面取得显著效果[57], 还可能对腹主动脉瘤的进展产生积极影响.
一方面, FMT能够减少肠道内的炎症反应, 降低宿主对动脉壁的攻击, 进而减缓动脉瘤的形成和发展; 另一方面, 高质量的肠道菌群有助于促进血管保护机制, 增强血管内皮细胞的功能, 提高整体血管健康. 因此, 推动粪菌移植的相关进展将有助于改善患者的预后, 不仅可以为AAA的治疗提供新的思路, 还可能为预防该病的发生提供新的策略. 值得临床界的广泛关注与深入研究.
本文讨论了肠道菌群在AAA形成中的潜在作用机制. 肠道菌群失调可能通过诱发炎症反应、影响代谢通路和导致免疫系统失调, 从而促进AAA的发生和进展. 鉴于肠道菌群对人体健康的广泛影响, 未来研究应深入探讨其在AAA中的具体作用机制. 这将有助于我们更全面地理解AAA的病理过程, 并为开发新的干预措施提供理论支持. 此外, 肠道菌群调节作为AAA治疗策略的潜力值得进一步评估, 以确定其在临床应用中的可行性和安全性.
| 1. | Kent KC. Clinical practice. Abdominal aortic aneurysms. N Engl J Med. 2014;371:2101-2108. [PubMed] [DOI] |
| 2. | Oliver-Williams C, Sweeting MJ, Turton G, Parkin D, Cooper D, Rodd C, Thompson SG, Earnshaw JJ; Gloucestershire and Swindon Abdominal Aortic Aneurysm Screening Programme. Lessons learned about prevalence and growth rates of abdominal aortic aneurysms from a 25-year ultrasound population screening programme. Br J Surg. 2018;105:68-74. [PubMed] [DOI] |
| 3. | Lederle FA, Kyriakides TC, Stroupe KT, Freischlag JA, Padberg FT, Matsumura JS, Huo Z, Johnson GR; OVER Veterans Affairs Cooperative Study Group. Open versus Endovascular Repair of Abdominal Aortic Aneurysm. N Engl J Med. 2019;380:2126-2135. [PubMed] [DOI] |
| 4. | Kuivaniemi H, Ryer EJ, Elmore JR, Tromp G. Understanding the pathogenesis of abdominal aortic aneurysms. Expert Rev Cardiovasc Ther. 2015;13:975-987. [PubMed] [DOI] |
| 5. | Kessler V, Klopf J, Eilenberg W, Neumayer C, Brostjan C. AAA Revisited: A Comprehensive Review of Risk Factors, Management, and Hallmarks of Pathogenesis. Biomedicines. 2022;10. [PubMed] [DOI] |
| 6. | Golledge J. Abdominal aortic aneurysm: update on pathogenesis and medical treatments. Nat Rev Cardiol. 2019;16:225-242. [PubMed] [DOI] |
| 7. | Silvestre-Roig C, Braster Q, Wichapong K, Lee EY, Teulon JM, Berrebeh N, Winter J, Adrover JM, Santos GS, Froese A, Lemnitzer P, Ortega-Gómez A, Chevre R, Marschner J, Schumski A, Winter C, Perez-Olivares L, Pan C, Paulin N, Schoufour T, Hartwig H, González-Ramos S, Kamp F, Megens RTA, Mowen KA, Gunzer M, Maegdefessel L, Hackeng T, Lutgens E, Daemen M, von Blume J, Anders HJ, Nikolaev VO, Pellequer JL, Weber C, Hidalgo A, Nicolaes GAF, Wong GCL, Soehnlein O. Externalized histone H4 orchestrates chronic inflammation by inducing lytic cell death. Nature. 2019;569:236-240. [PubMed] [DOI] |
| 8. | Yan X, Jin J, Su X, Yin X, Gao J, Wang X, Zhang S, Bu P, Wang M, Zhang Y, Wang Z, Zhang Q. Intestinal Flora Modulates Blood Pressure by Regulating the Synthesis of Intestinal-Derived Corticosterone in High Salt-Induced Hypertension. Circ Res. 2020;126:839-853. [PubMed] [DOI] |
| 9. | Truong DT, Franzosa EA, Tickle TL, Scholz M, Weingart G, Pasolli E, Tett A, Huttenhower C, Segata N. MetaPhlAn2 for enhanced metagenomic taxonomic profiling. Nat Methods. 2015;12:902-903. [PubMed] [DOI] |
| 10. | Walter J, Armet AM, Finlay BB, Shanahan F. Establishing or Exaggerating Causality for the Gut Microbiome: Lessons from Human Microbiota-Associated Rodents. Cell. 2020;180:221-232. [PubMed] [DOI] |
| 11. | Montgomery TL, Künstner A, Kennedy JJ, Fang Q, Asarian L, Culp-Hill R, D'Alessandro A, Teuscher C, Busch H, Krementsov DN. Interactions between host genetics and gut microbiota determine susceptibility to CNS autoimmunity. Proc Natl Acad Sci USA. 2020;117:27516-27527. [PubMed] [DOI] |
| 12. | Zhu H, Cao C, Wu Z, Zhang H, Sun Z, Wang M, Xu H, Zhao Z, Wang Y, Pei G, Yang Q, Zhu F, Yang J, Deng X, Hong Y, Li Y, Sun J, Zhu F, Shi M, Qian K, Ye T, Zuo X, Zhao F, Guo J, Xu G, Yao Y, Zeng R. The probiotic L. casei Zhang slows the progression of acute and chronic kidney disease. Cell Metab. 2021;33:1926-1942.e8. [PubMed] [DOI] |
| 13. | Quintana RA, Taylor WR. Cellular Mechanisms of Aortic Aneurysm Formation. Circ Res. 2019;124:607-618. [PubMed] [DOI] |
| 14. | Takagi T, Naito Y, Inoue R, Kashiwagi S, Uchiyama K, Mizushima K, Tsuchiya S, Dohi O, Yoshida N, Kamada K, Ishikawa T, Handa O, Konishi H, Okuda K, Tsujimoto Y, Ohnogi H, Itoh Y. Differences in gut microbiota associated with age, sex, and stool consistency in healthy Japanese subjects. J Gastroenterol. 2019;54:53-63. [PubMed] [DOI] |
| 15. | Zhong L, He X, Si X, Wang H, Li B, Hu Y, Li M, Chen X, Liao W, Liao Y, Bin J. SM22α (Smooth Muscle 22α) Prevents Aortic Aneurysm Formation by Inhibiting Smooth Muscle Cell Phenotypic Switching Through Suppressing Reactive Oxygen Species/NF-κB (Nuclear Factor-κB). Arterioscler Thromb Vasc Biol. 2019;39:e10-e25. [PubMed] [DOI] |
| 16. | He Y, Wu W, Zheng HM, Li P, McDonald D, Sheng HF, Chen MX, Chen ZH, Ji GY, Zheng ZD, Mujagond P, Chen XJ, Rong ZH, Chen P, Lyu LY, Wang X, Wu CB, Yu N, Xu YJ, Yin J, Raes J, Knight R, Ma WJ, Zhou HW. Regional variation limits applications of healthy gut microbiome reference ranges and disease models. Nat Med. 2018;24:1532-1535. [PubMed] [DOI] |
| 17. | Li Z, Wu Z, Yan J, Liu H, Liu Q, Deng Y, Ou C, Chen M. Gut microbe-derived metabolite trimethylamine N-oxide induces cardiac hypertrophy and fibrosis. Lab Invest. 2019;99:346-357. [PubMed] [DOI] |
| 18. | Hu J, Luo H, Wang J, Tang W, Lu J, Wu S, Xiong Z, Yang G, Chen Z, Lan T, Zhou H, Nie J, Jiang Y, Chen P. Enteric dysbiosis-linked gut barrier disruption triggers early renal injury induced by chronic high salt feeding in mice. Exp Mol Med. 2017;49:e370. [PubMed] [DOI] |
| 19. | Jiang X, Chen B, Gu D, Rong Z, Su X, Yue M, Zhou H, Gu W. Gut Microbial Compositions in Four Age Groups of Tibetan Minipigs. Pol J Microbiol. 2018;67:383-388. [PubMed] [DOI] |
| 20. | Liu CS, Liang X, Wei XH, Jin Z, Chen FL, Tang QF, Tan XM. Gegen Qinlian Decoction Treats Diarrhea in Piglets by Modulating Gut Microbiota and Short-Chain Fatty Acids. Front Microbiol. 2019;10:825. [PubMed] [DOI] |
| 21. | Sun Y, Zhong L, He X, Wang S, Lai Y, Wu W, Song H, Chen Y, Yang Y, Liao W, Liao Y, Bin J. LncRNA H19 promotes vascular inflammation and abdominal aortic aneurysm formation by functioning as a competing endogenous RNA. J Mol Cell Cardiol. 2019;131:66-81. [PubMed] [DOI] |
| 22. | Shi J, Guo J, Li Z, Xu B, Miyata M. Importance of NLRP3 Inflammasome in Abdominal Aortic Aneurysms. J Atheroscler Thromb. 2021;28:454-466. [PubMed] [DOI] |
| 23. | Raffort J, Lareyre F, Clément M, Hassen-Khodja R, Chinetti G, Mallat Z. Monocytes and macrophages in abdominal aortic aneurysm. Nat Rev Cardiol. 2017;14:457-471. [PubMed] [DOI] |
| 24. | Cao P, De Rango P, Verzini F, Parlani G, Romano L, Cieri E; CAESAR Trial Group. Comparison of surveillance versus aortic endografting for small aneurysm repair (CAESAR): results from a randomised trial. E. ur J Vasc Endovasc Surg. 2011;41:13-25. [PubMed] [DOI] |
| 25. | Yodoi K, Yamashita T, Sasaki N, Kasahara K, Emoto T, Matsumoto T, Kita T, Sasaki Y, Mizoguchi T, Sparwasser T, Hirata K. Foxp3+ regulatory T cells play a protective role in angiotensin II-induced aortic aneurysm formation in mice. Hypertension. 2015;65:889-895. [PubMed] [DOI] |
| 26. | Stepankova R, Tonar Z, Bartova J, Nedorost L, Rossman P, Poledne R, Schwarzer M, Tlaskalova-Hogenova H. Absence of microbiota (germ-free conditions) accelerates the atherosclerosis in ApoE-deficient mice fed standard low cholesterol diet. J Atheroscler Thromb. 2010;17:796-804. [PubMed] [DOI] |
| 27. | Wang Z, Klipfell E, Bennett BJ, Koeth R, Levison BS, Dugar B, Feldstein AE, Britt EB, Fu X, Chung YM, Wu Y, Schauer P, Smith JD, Allayee H, Tang WH, DiDonato JA, Lusis AJ, Hazen SL. Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease. Nature. 2011;472:57-63. [PubMed] [DOI] |
| 28. | Emoto T, Yamashita T, Kobayashi T, Sasaki N, Hirota Y, Hayashi T, So A, Kasahara K, Yodoi K, Matsumoto T, Mizoguchi T, Ogawa W, Hirata KI. Characterization of gut microbiota profiles in coronary artery disease patients using data mining analysis of terminal restriction fragment length polymorphism: gut microbiota could be a diagnostic marker of coronary artery disease. Heart Vessels. 2017;32:39-46. [PubMed] [DOI] |
| 29. | Yoshida N, Emoto T, Yamashita T, Watanabe H, Hayashi T, Tabata T, Hoshi N, Hatano N, Ozawa G, Sasaki N, Mizoguchi T, Amin HZ, Hirota Y, Ogawa W, Yamada T, Hirata KI. Bacteroides vulgatus and Bacteroides dorei Reduce Gut Microbial Lipopolysaccharide Production and Inhibit Atherosclerosis. Circulation. 2018;138:2486-2498. [PubMed] [DOI] |
| 30. | Tang WH, Wang Z, Levison BS, Koeth RA, Britt EB, Fu X, Wu Y, Hazen SL. Intestinal microbial metabolism of phosphatidylcholine and cardiovascular risk. N Engl J Med. 2013;368:1575-1584. [PubMed] [DOI] |
| 31. | Koeth RA, Wang Z, Levison BS, Buffa JA, Org E, Sheehy BT, Britt EB, Fu X, Wu Y, Li L, Smith JD, DiDonato JA, Chen J, Li H, Wu GD, Lewis JD, Warrier M, Brown JM, Krauss RM, Tang WH, Bushman FD, Lusis AJ, Hazen SL. Intestinal microbiota metabolism of L-carnitine, a nutrient in red meat, promotes atherosclerosis. Nat Med. 2013;19:576-585. [PubMed] [DOI] |
| 32. | Shikata F, Shimada K, Sato H, Ikedo T, Kuwabara A, Furukawa H, Korai M, Kotoda M, Yokosuka K, Makino H, Ziegler EA, Kudo D, Lawton MT, Hashimoto T. Potential Influences of Gut Microbiota on the Formation of Intracranial Aneurysm. Hypertension. 2019;73:491-496. [PubMed] [DOI] |
| 33. | Zhu W, Gregory JC, Org E, Buffa JA, Gupta N, Wang Z, Li L, Fu X, Wu Y, Mehrabian M, Sartor RB, McIntyre TM, Silverstein RL, Tang WHW, DiDonato JA, Brown JM, Lusis AJ, Hazen SL. Gut Microbial Metabolite TMAO Enhances Platelet Hyperreactivity and Thrombosis Risk. Cell. 2016;165:111-124. [PubMed] [DOI] |
| 34. | Ghigliotti G, Barisione C, Garibaldi S, Brunelli C, Palmieri D, Spinella G, Pane B, Spallarossa P, Altieri P, Fabbi P, Sambuceti G, Palombo D. CD16(+) monocyte subsets are increased in large abdominal aortic aneurysms and are differentially related with circulating and cell-associated biochemical and inflammatory biomarkers. Dis Markers. 2013;34:131-142. [PubMed] [DOI] |
| 35. | Daugherty A, Cassis LA. Mouse models of abdominal aortic aneurysms. Arterioscler Thromb Vasc Biol. 2004;24:429-434. [PubMed] [DOI] |
| 36. | Ulndreaj A, Li A, Chen Y, Besla R, Pacheco S, Althagafi MG, Cybulsky MI, Lindsay T, Robbins CS, Byrne JS. Adventitial recruitment of Lyve-1- macrophages drives aortic aneurysm in an angiotensin-2-based murine model. Clin Sci (Lond). 2021;135:1295-1309. [PubMed] [DOI] |
| 37. | Rowe VL, Stevens SL, Reddick TT, Freeman MB, Donnell R, Carroll RC, Goldman MH. Vascular smooth muscle cell apoptosis in aneurysmal, occlusive, and normal human aortas. J Vasc Surg. 2000;31:567-576. [PubMed] |
| 38. | Zeng Q, Rong Y, Li D, Wu Z, He Y, Zhang H, Huang L. Identification of Serum Biomarker in Acute Aortic Dissection by Global and Targeted Metabolomics. Ann Vasc Surg. 2020;68:497-504. [PubMed] [DOI] |
| 39. | Schugar RC, Shih DM, Warrier M, Helsley RN, Burrows A, Ferguson D, Brown AL, Gromovsky AD, Heine M, Chatterjee A, Li L, Li XS, Wang Z, Willard B, Meng Y, Kim H, Che N, Pan C, Lee RG, Crooke RM, Graham MJ, Morton RE, Langefeld CD, Das SK, Rudel LL, Zein N, McCullough AJ, Dasarathy S, Tang WHW, Erokwu BO, Flask CA, Laakso M, Civelek M, Naga Prasad SV, Heeren J, Lusis AJ, Hazen SL, Brown JM. The TMAO-Producing Enzyme Flavin-Containing Monooxygenase 3 Regulates Obesity and the Beiging of White Adipose Tissue. Cell Rep. 2017;19:2451-2461. [PubMed] [DOI] |
| 40. | Romano KA, Vivas EI, Amador-Noguez D, Rey FE. Intestinal microbiota composition modulates choline bioavailability from diet and accumulation of the proatherogenic metabolite trimethylamine-N-oxide. mBio. 2015;6:e02481. [PubMed] [DOI] |
| 41. | Swirski FK, Nahrendorf M, Etzrodt M, Wildgruber M, Cortez-Retamozo V, Panizzi P, Figueiredo JL, Kohler RH, Chudnovskiy A, Waterman P, Aikawa E, Mempel TR, Libby P, Weissleder R, Pittet MJ. Identification of splenic reservoir monocytes and their deployment to inflammatory sites. Science. 2009;325:612-616. [PubMed] [DOI] |
| 42. | Kolypetri P, Liu S, Cox LM, Fujiwara M, Raheja R, Ghitza D, Song A, Daatselaar D, Willocq V, Weiner HL. Regulation of splenic monocyte homeostasis and function by gut microbial products. iScience. 2021;24:102356. [PubMed] [DOI] |
| 43. | Weaver LK, Minichino D, Biswas C, Chu N, Lee JJ, Bittinger K, Albeituni S, Nichols KE, Behrens EM. Microbiota-dependent signals are required to sustain TLR-mediated immune responses. JCI Insight. 2019;4. [PubMed] [DOI] |
| 44. | Rubio-Navarro A, Amaro Villalobos JM, Lindholt JS, Buendía I, Egido J, Blanco-Colio LM, Samaniego R, Meilhac O, Michel JB, Martín-Ventura JL, Moreno JA. Hemoglobin induces monocyte recruitment and CD163-macrophage polarization in abdominal aortic aneurysm. Int J Cardiol. 2015;201:66-78. [PubMed] [DOI] |
| 45. | Sundermann AC, Saum K, Conrad KA, Russell HM, Edwards TL, Mani K, Björck M, Wanhainen A, Owens AP. Prognostic value of D-dimer and markers of coagulation for stratification of abdominal aortic aneurysm growth. Blood Adv. 2018;2:3088-3096. [PubMed] [DOI] |
| 46. | Liu Z, Liu HY, Zhou H, Zhan Q, Lai W, Zeng Q, Ren H, Xu D. Moderate-Intensity Exercise Affects Gut Microbiome Composition and Influences Cardiac Function in Myocardial Infarction Mice. Front Microbiol. 2017;8:1687. [PubMed] [DOI] |
| 47. | Ezeji JC, Sarikonda DK, Hopperton A, Erkkila HL, Cohen DE, Martinez SP, Cominelli F, Kuwahara T, Dichosa AEK, Good CE, Jacobs MR, Khoretonenko M, Veloo A, Rodriguez-Palacios A. Parabacteroides distasonis: intriguing aerotolerant gut anaerobe with emerging antimicrobial resistance and pathogenic and probiotic roles in human health. Gut Microbes. 2021;13:1922241. [PubMed] [DOI] |
| 48. | Li Y, Lu G, Sun D, Zuo H, Wang DW, Yan J. Inhibition of endoplasmic reticulum stress signaling pathway: A new mechanism of statins to suppress the development of abdominal aortic aneurysm. PLoS One. 2017;12:e0174821. [PubMed] [DOI] |
| 49. | Gan XT, Ettinger G, Huang CX, Burton JP, Haist JV, Rajapurohitam V, Sidaway JE, Martin G, Gloor GB, Swann JR, Reid G, Karmazyn M. Probiotic administration attenuates myocardial hypertrophy and heart failure after myocardial infarction in the rat. Circ Heart Fail. 2014;7:491-499. [PubMed] [DOI] |
| 50. | Raffetto JD, Leverkus M, Park HY, Menzoian JO. Synopsis on cellular senescence and apoptosis. J Vasc Surg. 2001;34:173-177. [PubMed] [DOI] |
| 51. | Wanhainen A, Mani K, Vorkapic E, De Basso R, Björck M, Länne T, Wågsäter D. Screening of circulating microRNA biomarkers for prevalence of abdominal aortic aneurysm and aneurysm growth. Atherosclerosis. 2017;256:82-88. [PubMed] [DOI] |
| 52. | Caporaso JG, Kuczynski J, Stombaugh J, Bittinger K, Bushman FD, Costello EK, Fierer N, Peña AG, Goodrich JK, Gordon JI, Huttley GA, Kelley ST, Knights D, Koenig JE, Ley RE, Lozupone CA, McDonald D, Muegge BD, Pirrung M, Reeder J, Sevinsky JR, Turnbaugh PJ, Walters WA, Widmann J, Yatsunenko T, Zaneveld J, Knight R. QIIME allows analysis of high-throughput community sequencing data. Nat Methods. 2010;7:335-336. [PubMed] [DOI] |
| 53. | Callahan BJ, McMurdie PJ, Rosen MJ, Han AW, Johnson AJ, Holmes SP. DADA2: High-resolution sample inference from Illumina amplicon data. Nat Methods. 2016;13:581-583. [PubMed] [DOI] |
| 54. | Gupta N, Buffa JA, Roberts AB, Sangwan N, Skye SM, Li L, Ho KJ, Varga J, DiDonato JA, Tang WHW, Hazen SL. Targeted Inhibition of Gut Microbial Trimethylamine N-Oxide Production Reduces Renal Tubulointerstitial Fibrosis and Functional Impairment in a Murine Model of Chronic Kidney Disease. Arterioscler Thromb Vasc Biol. 2020;40:1239-1255. [PubMed] [DOI] |
| 55. | Baxter BT, Matsumura J, Curci JA, McBride R, Larson L, Blackwelder W, Lam D, Wijesinha M, Terrin M; N-TA3CT Investigators. Effect of Doxycycline on Aneurysm Growth Among Patients With Small Infrarenal Abdominal Aortic Aneurysms: A Randomized Clinical Trial. JAMA. 2020;323:2029-2038. [PubMed] [DOI] |
| 56. | McMurdie PJ, Holmes S. Waste not, want not: why rarefying microbiome data is inadmissible. PLoS Comput Biol. 2014;10:e1003531. [PubMed] [DOI] |
| 57. | Porcari S, Benech N, Valles-Colomer M, Segata N, Gasbarrini A, Cammarota G, Sokol H, Ianiro G. Key determinants of success in fecal microbiota transplantation: From microbiome to clinic. Cell Host Microbe. 2023;31:712-733. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 广东省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁