修回日期: 2023-03-31
接受日期: 2023-04-24
在线出版日期: 2023-05-08
便秘是常见的胃肠道疾病, 也是结直肠癌的危险因素. 益生菌是临床使用最广泛的用于治疗便秘的微生态制剂, 常见肠道微生态药品有贝飞达、益君康、思连康、金双岐等, 它们的菌株组成成分不同, 对便秘的治疗效果可能也不同.
探究并比较这4种微生态制剂对便秘模型大鼠的作用, 并评估这些益生菌对便秘相关指标的影响.
将大鼠随机分为对照组(Control)、模型组(Model)、贝飞达组(Bifido)、益君康组(Yijunkang)、思连康组(Siliankang)和金双歧(Golden bifid)组, 每组10只. 测定各组大鼠的体重、粪便数量、形态、含水率及肠道推进率; HE染色观察各组大鼠肠道的病理学改变; 阿尔新蓝染色分析肠道粘蛋白的表达水平.
各组大鼠的体重及粪便含水率没有显著变化; 相对于模型组, 贝飞达组的粪便数量(P<0.01)、肠道推进率(P<0.05)、肠粘膜厚度(P<0.01)、粘蛋白表达水平(P<0.01)显著增加; 益君康组肠道推进率(P<0.05)和粘蛋白表达(P<0.001)显著增加; 思连康组的肠道推进率及粘蛋白水平增加(P<0.05); 金双歧组观察粘蛋白表达增加(P<0.01).
这4种微生态制剂均被发现可以在不同程度上改善便秘, 其中贝飞达的改善效果最佳. 本研究结果表明, 贝飞达可以显著增加便秘大鼠的粪便数量及肠道转运率, 增加粘蛋白的表达水平, 促进肠道粘液分泌, 改善大鼠胃肠蠕动, 缓解便秘相关症状.
核心提要: 贝飞达、益君康、思连康和金双歧能改善洛哌丁胺诱导便秘模型大鼠的粪便数量及肠道推进率, 且此作用与这些益生菌制剂增加粘蛋白表达有关.
引文著录: 余婧婷, 程小英, 詹扬, 李颖萌, 刘文君. 贝飞达、益君康、思连康及金双歧对洛哌丁胺导致便秘的影响. 世界华人消化杂志 2023; 31(9): 361-368
Revised: March 31, 2023
Accepted: April 24, 2023
Published online: May 8, 2023
Constipation is a common gastrointestinal disorder and a risk factor for colorectal cancer. Probiotics are the most widely used microecological agents for the treatment of constipation in clinical practice. Common intestinal microecological drugs include Bifido, Yijunkang, Siliankang, Golden Bifid, etc. They have different composition and may have different therapeutic effects on constipation.
To compare the effects of the four microecological agents in a rat model of constipation and to assess the effects of these probiotics on constipation-related indicators.
Rats were randomly divided into six groups: Control group, model group, Bifido group, Yijunkang group, Siliankang group, and Golden Bifid group, with 10 rats in each group. The body weight, fecal quantity, shape, and water content, and intestinal transit rate of rats in each group were measured. Hematoxylin-eosin staining was performed to observe the pathological changes in the intestine of rats in each group. The expression level of intestinal mucin was analyzed by Alcian blue staining.
There were no significant changes in body weight and fecal water content of rats in each group. Compared to the model group, the quantity of feces (P < 0.01), intestinal transit rate (P < 0.05), intestinal mucosal thickness (P < 0.01), and mucin expression level (P < 0.01) were significantly increased in the Bifido group. Intestinal transit rate (P < 0.05) and mucin expression (P < 0.001) were significantly increased in the Yijunkang group. Increased intestinal transit rate and mucin level were observed in the Siliankang group (P < 0.05), and increased mucin expression was observed in the Golden Bifid group (P < 0.01).
The four microecological preparations improve constipation to varying degrees, of which Bifido has the best effect. Bifido can significantly increase the quantity of feces and intestinal transit rate of constipation rats, increase the expression level of mucin, promote the secretion of intestinal mucus, improve gastrointestinal peristalsis, and relieve constipation related symptoms.
- Citation: Yu JT, Cheng XY, Zhan Y, Li YM, Liu WJ. Effects of Bifido, Yijunkang, Siliankang, and Golden Bifid on loperamide induced constipation. Shijie Huaren Xiaohua Zazhi 2023; 31(9): 361-368
- URL: https://www.wjgnet.com/1009-3079/full/v31/i9/361.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i9.361
便秘是世界范围内最常见的胃肠道疾病之一, 据报道患病率为2%至30%, 尤其是在老年人当中[1,2]. 便秘也是结直肠癌、肠易激综合征和其他胃肠道疾病的危险因素[3]. 结肠是培养肠道菌群的重要容器, 众多研究已经揭示了这些肠道微生物群在人类健康中的重要作用. 早在1998年, 就有研究确定了便秘患者与健康人群的肠道微生物群存在显著差异[4]. 这些差异表明, 便秘相关症状可能通过引入肠道菌群或修复肠道微环境的益生菌而得到缓解.
益生菌被定义为活的微生物, 适当的补充益生菌可以改善宿主的健康. 益生菌主要通过产生抗菌肽、同化膳食纤维、调节脂肪储存、调节黏膜免疫或调节肠道菌群发挥有益功能[5]. 人们越来越关注益生菌作为恢复或改善胃肠道转运的潜在药物. 研究表明[6,7], 益生菌可以通过增加肠道蠕动和软化粪便稠度来减少全肠道转运时间并增加排便频率, 从而改善便秘.
益生菌的效果因菌株而异[8,9], 由于便秘的多样性和复杂性, 使用混合菌株可能比使用单一菌株更有效. 贝飞达是长型双歧杆菌、嗜酸乳杆菌、粪肠球菌经适当配合而成的活菌制剂; 益君康是由中国株嗜酸乳杆菌、日本株嗜酸乳杆菌、粪链球菌及枯草杆菌等四种菌粉组成的复方制剂; 思连康是由婴儿双歧杆菌、嗜酸乳杆菌、粪肠球菌、蜡样芽孢杆菌组成的复方制剂; 金双歧是由长型双歧杆菌、保加利亚乳杆菌和嗜热链球菌组成. 这些益生菌制剂的各组分组成了一个在不同条件下都能生长、作用快而持久的联合菌群, 服用后可以在肠道黏膜表面形成生物屏障, 维持人体肠道正常的生理功能.
选择出在改善便秘方面表现优异的益生菌制剂, 将为便秘患者提供便利. 在本研究中, 我们选择了市场上常见的几种益生菌制剂, 包括贝飞达、益君康、思连康和金双歧, 通过建立洛哌丁胺诱导的大鼠便秘模型, 并检测粪便参数、胃肠道转运率、肠粘膜厚度及结肠粘蛋白的表达, 来探究各益生菌制剂改善便秘的作用.
贝飞达购自晋城海斯制药有限公司; 益君康购自通化金马药业集团股份有限公司; 思连康购自杭州远大生物制药有限公司; 金双歧购自内蒙古双奇药业股份有限公司; 伊文思蓝染色液(浓度1%)购自上海源叶生物科技有限公司. 盐酸洛哌丁胺(纯度≥98%)和羧甲基纤维素购自上海阿拉丁生化科技股份有限公司; HE染色试剂盒和阿尔新蓝染液购自武汉赛维尔生物科技有限公司.
1.2.1 便秘模型的建立及实验方案: 雄性SD大鼠, 体重(200-220) g, (6-8)周龄, 由浙江维通利华实验动物技术有限公司提供, 许可证号为SCXK(浙)2019-0001. 大鼠饲养在江中药业动物实验中心, 许可证号为SYXK(赣)2020-004, 于清洁级环境中饲养. 实验室温度(24±2) ℃; 相对湿度(45-65)%; 光照周期: 12 h(日)/12 h(夜). 所有动物实验均严格按照江中药业实验动物管理和伦理委员会的规定进行.
将60只(200-220) g雄性SD大鼠分为六组, 分别为对照组、模型组、贝飞达组、益君康组、思连康组和金双歧组, 每组10只. 采用10 mg/kg的洛哌丁胺造模, 每只大鼠以250 g为例按照2.5 mL灌胃, 连续造模17 d, 实验流程如图1所示. 于造模后的第4天模型组给予蒸馏水, 各给药干预组分别按照说明书中的人用最大剂量换算成大鼠的给药剂量, 即贝飞达为0.22 g/kg、益君康为0.31 g/kg、思连康为0.47 g/kg和金双歧为0.62 g/kg, 连续给药至第17天, 即给药天数为14 d.
1.2.2 统计粪便数量: 在洛哌丁胺干预及给药期间每2 d收集一次粪便, 收集相同时间内各组大鼠的粪便, 计数.
1.2.3 测量粪便含水率: 收集各组大鼠一定时间内的应激粪便, 称湿重; 60 ℃恒温24 h烘干, 称干重. 按照公式计算: 粪便含水率 = (粪便湿重-粪便干重)/粪便湿重×100%.
1.2.4 伊文思蓝糊剂的配制: 8 g淀粉、16 g奶粉、8 g糖、5 g羧甲基纤维素和7 mL 1%伊文思蓝溶液溶于约250 mL蒸馏水中, 混匀后定容至300 mL的蓝色半固体糊状物.
1.2.5 测量肠道推进率: 实验终点大鼠禁食 12 h, 每只大鼠给予2 mL伊文思蓝糊剂灌胃, 20 min后处死解剖剥离大鼠的整个肠段, 放在玻璃平板上, 测定幽门至回盲部全长及幽门到伊文思蓝前沿的距离, 用公式计算推进百分率: 肠道推进率% = 蓝色前端与幽门的距离/小肠全长×100%.
1.2.6 组织病理学分析: 大鼠结肠组织用生理盐水清洗, 放入4%组织固定液中固定、脱水、透明、浸蜡、包埋, 制成蜡块和石蜡切片. 这些石蜡切片用苏木精和伊红(Servicebio, China)染色. 在光学显微镜(Leica Microsystems, Switzerland)下观察这些切片的形态特征. 对于粘蛋白的定位, 采用阿尔新蓝(Servicebio, China)染色, 在光学显微镜下观察阿尔新蓝的隐窝形态特征. 使用Image Pro软件对每个样本至少5个视野进行分析.
统计学处理 数据用平均值±标准误(mean±SE)表示, 采用单因素方差(One-way ANOVA)分析, 然后以Dunnet法作组间两两比较. 分析结果以P<0.05 认为差异具有统计学意义, P<0.001认为具有极显著性差异. 所有数据均采用GraphPad Prism 8.0统计软件包进行分析.
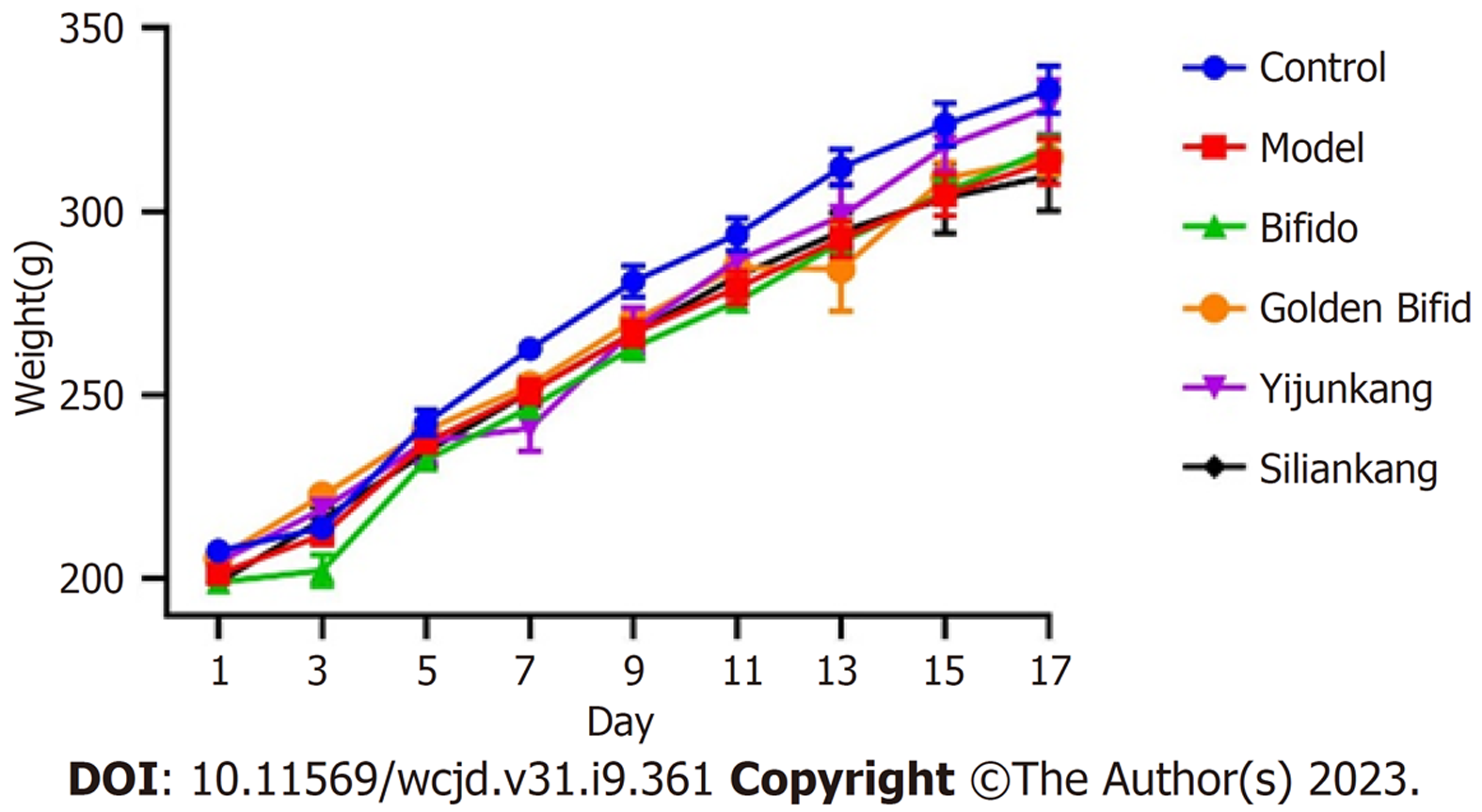
在整个实验过程中, 每隔一天进行大鼠称重, 将体重数据绘制成折线图. 如图2所示, 正常组大鼠体重上升最快, 各给药组和模型组大鼠的体重上升速度较慢, 但与正常组相比差别不大, 各组没有统计学差异.
粪便颗粒数被用作评价便秘缓解常见指标, 图3A显示, 洛哌丁胺致便秘后的模型组与对照组相比, 粪便颗粒数减少, 有显著差异. 相比于模型组, 贝飞达和益君康的摄入可以增加粪便排泄数量, 并具有显著性差异. 至于思连康和金双歧组, 粪便数量虽然比模型组多, 但无统计学意义.
图3B是分别是正常组、模型组、贝飞达组、益君康组、思连康组以及金双歧组大鼠在10 min内排出粪便的代表性图片. 正常组大鼠的粪便形状多呈长条形, 颗粒较大; 而模型组大鼠的粪便小而短, 符合便秘的特征. 而分别给予贝飞达、益君康、思连康和金双歧之后, 短小的粪便状态均得以一定的改善, 其中以贝飞达组改善效果最佳.
不同组大鼠的粪便样品的粪便含水率如图3C, 模型组的粪便含水率(57.0%)低于正常组(65.8%), 二者没有显著差异, 思连康(63.2%)和金双歧(60.7%)的粪便含水率高于模型组, 均无统计学意义.
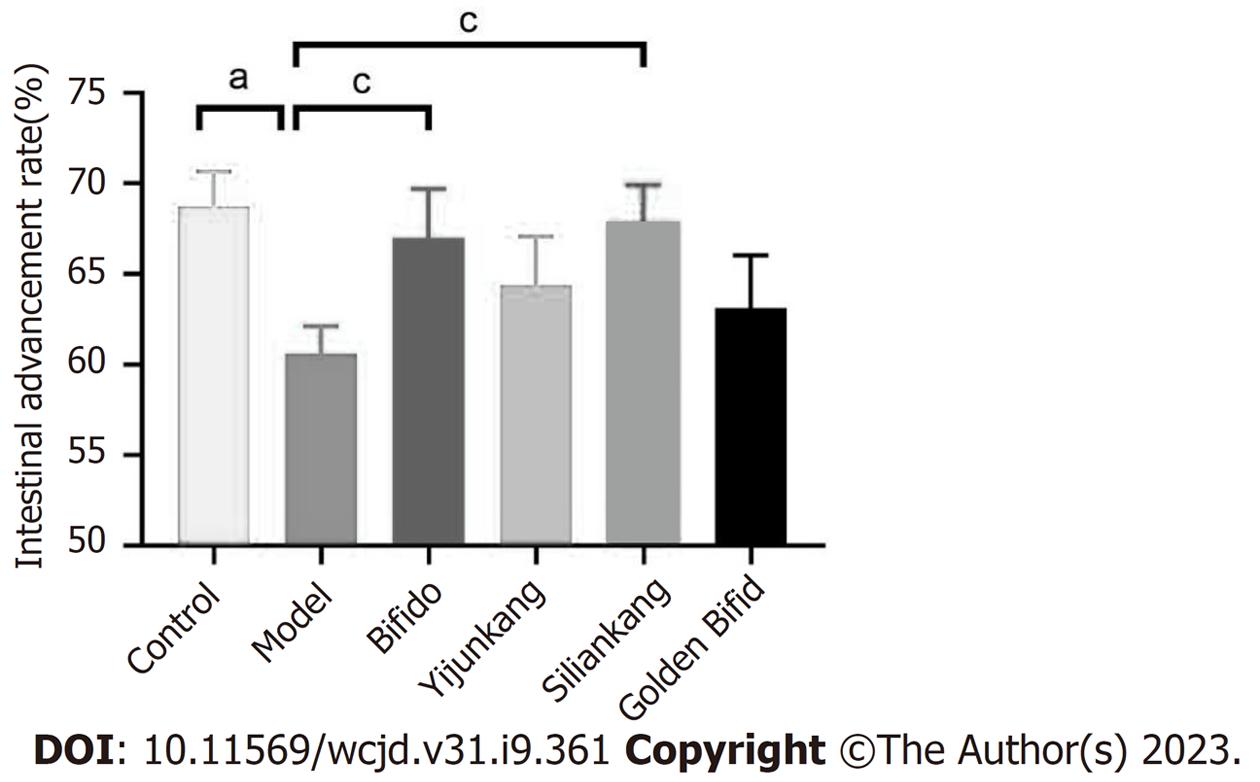
图4显示的是各组大鼠的肠道推进率, 从图中可以看到, 模型组大鼠(60.6%)的肠道推进率显著低于正常组(68.8%), 表明洛哌丁胺可减慢肠道蠕动. 与模型组相比, 贝飞达干预组(67.0%)和思连康干预组(67.8%)的肠道推进率增加, 具有显著性差异, 表明贝飞达和思连康可以促进肠道蠕动. 另外, 虽然金双歧(63.1%)和益君康(64.4%)干预组的大鼠肠道推进率均高于模型组, 但没有统计学意义.
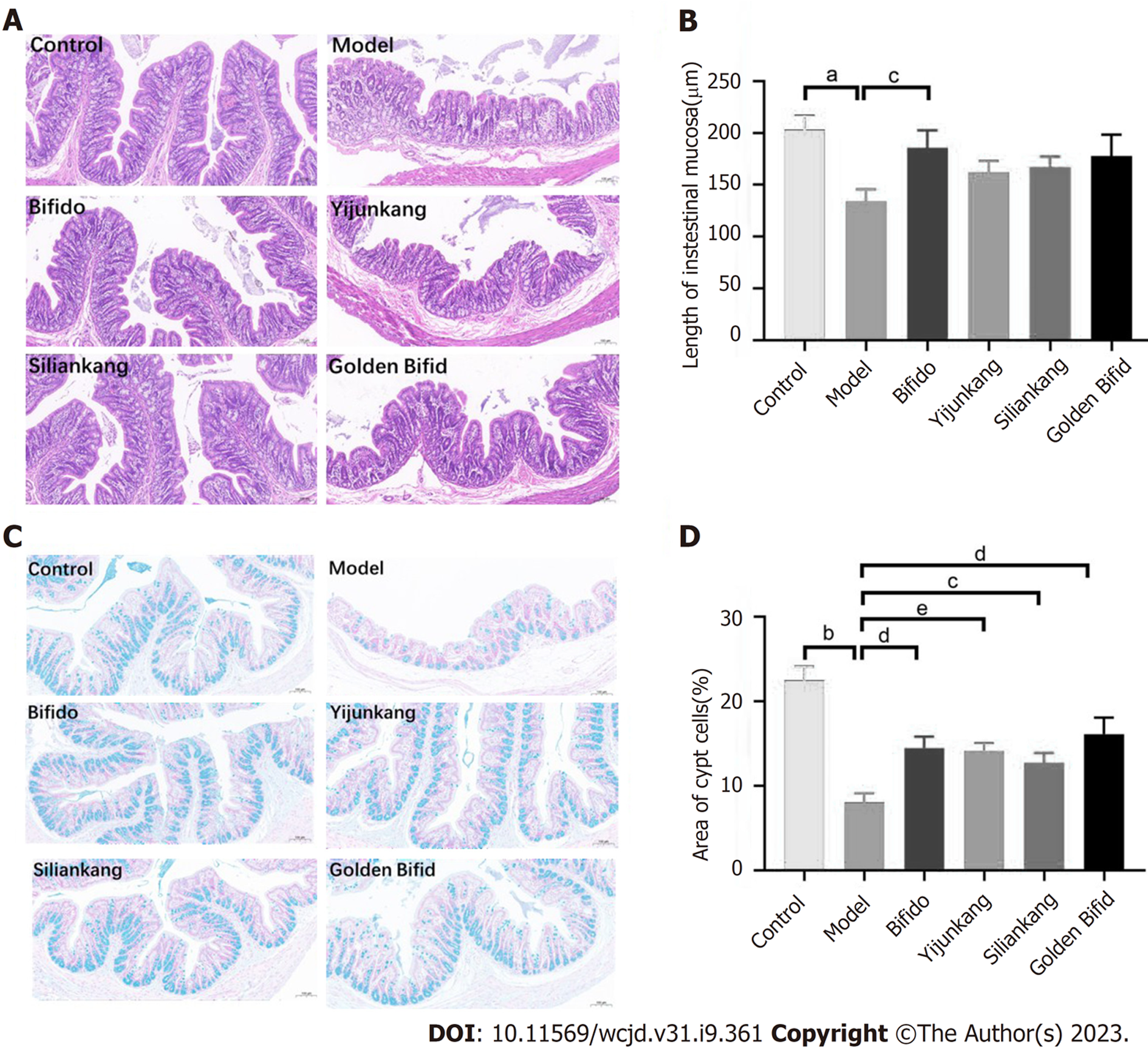
基于上述初步结果, 为了进一步观察益生菌制剂对肠粘膜的影响, 采用苏木精和伊红染色观察肠道形态特征(图5A), 相比于正常组, 模型组大鼠结肠上皮细胞排列紊乱, 杯状细胞大量破裂, 粘膜层褶皱减少, 肠道损伤严重. 经不同益生菌干预后, 贝飞达组和思连康组较模型组肠黏膜形态部分恢复. 对结肠粘膜厚度进行统计(图5B), 模型组的肠道粘膜厚度显著低于正常组(P<0.01); 诱导便秘后, 仅贝飞达组(186 μm)的肠道粘膜厚度明显高于模型组(P<0.05), 而益君康(162 μm)、思连康(167 μm)以及金双歧(178 μm)组与模型组相比虽有增加, 但无统计学差异.
为了观察排便刺激作用是否伴随着隐窝的变化, 使用光学显微镜观察阿尔新蓝染色后的分泌粘液的细胞, 即隐窝细胞(图5C), 并对蓝色区域的面积进行统计(图5D). 观察到正常组隐窝杯状细胞中的粘蛋白染色规律地集中在结肠中, 而模型组中由于杯状细胞的缺失, 蓝色面积减少, 隐窝细胞面积明显小于正常组(P<0.001). 相反, 与模型组相比, 贝飞达(P<0.01)、益君康(P<0.001)、思连康(P<0.05)及金双歧(P<0.01)组均观察隐窝细胞面积的增加.
便秘是一种非常普遍的胃肠道疾病, 在世界范围内常有发生, 严重损害患者生活质量. 同时便秘可导致病菌在结肠积聚, 增加胃肠道疾病风险, 如肠易激综合征[10]和结直肠癌[11]. 肠道菌群与人类健康息息相关, 参与人体的吸收、代谢及免疫功能[12], 便秘患者体内的肠道菌群往往发生了重大改变. 因此, 补充益生菌制剂对于改善便秘是必要的. 有文献报道, 腹部按摩联合贝飞达可以有效预防化疗后的便秘症状[13]. 益君康多用于治疗腹泻[14]、消化不良等症状[15], 未见有便秘相关报道. 思连康则多见于与其他药物联用来改善便秘[16-18]. 金双歧可见便秘[19]及腹泻型肠易激相关报道[20], 此外, 金双歧还可以减轻大肠杆菌K1诱导的粘蛋白缺失[21], 从而保护肠粘膜屏障. 以上可知, 除益君康未见便秘相关报道, 虽然贝飞达、思连康和金双歧均有与便秘相关报道, 但这些制剂对于改善便秘的效果没有直观的比较. 本研究通过建立洛哌丁胺诱导的大鼠便秘模型, 评价这四种益生菌制剂对便秘的改善作用.
在本研究中, 通过检测大鼠的体重变化、粪便参数、肠道推进率及结肠的病理结构和粘蛋白表达, 来评价各益生菌制剂对便秘的效果. 结果显示各组大鼠在造模和益生菌干预期间体重没有明显变化, 但在某种程度上说明了洛哌丁胺诱导便秘的大鼠对这些益生菌制剂有较好的耐受能力. 关于粪便参数, 粪便数量、粪便含水率及粪便颗粒状态均能够反应便秘的严重程度, 本研究证明, 贝飞达和益君康能够显著增加大鼠的排便数量, 此外, 贝飞达还能较好地改善粪便状态. 以上结果说明, 贝飞达和益君康在改善粪便数量和质量方面优于思连康和金双歧.
关于粪便含水率, 很多研究采用的是收集大鼠在一段时间内的粪便, 笔者认为在实际操作过程中, 便秘的大鼠较难在短时间内排出足够数量的粪便用于统计, 暴露在空气中的粪便, 其含水率会随着时间的延长而降低, 并且这种变化受到实验环境及粪便大小等多种因素影响, 为非线性变化. 在长时间等待大鼠排便过程中, 实际测得粪便含水率会受到影响. 本研究中, 笔者首次采用大鼠应激粪便粪便用于检测粪便含水率, 即通过按摩、刺激大鼠肛门附近位置, 使大鼠能够在短时间内排出足够数量的粪便用于统计. 与他人研究结果不同的是, 本研究显示这四种益生菌制剂对应激粪便含水率无影响; 此外, 早期研究表明[22]洛哌丁胺在基础条件下不影响水的吸收, 我们猜测洛哌丁胺造成的便秘不改变粪便的含水率.
良好的肠道运动可以促进排便, 而肠道运动能力可以通过肠道推进率来确认. 本研究发现贝飞达和思连康具有显著促进肠道推进率的作用, 说明贝飞达和思连康可以通过增加胃肠蠕动改善便秘. 组织学分析被广泛用于证明便秘动物肠道的显著变化. 本研究表明贝飞达可以显著改善洛哌丁胺造成的肠粘膜受损, 虽然益君康、思连康和金双歧也可以在一定程度上改善肠道损伤, 但没有观察到显著差异. 阿尔新蓝用于染色隐窝细胞, 这些细胞参与粘蛋白的产生, 粘蛋白是管腔粘液的主要成分, 可保护结肠粘膜免受机械和化学损伤[23]. 洛哌丁胺能减少隐窝细胞中粘蛋白的合成和储存[24]. 本研究发现, 这四种益生菌制剂均能够可以改善粘蛋白的产生, 减少结肠粘膜暴露于潜在的风险因素, 降低粘膜损伤.
如表1所示, 在四种益生菌制剂中, 发现贝飞达、益君康、思连康均能改善一些便秘指标, 其中贝飞达具有最优的改善效果. 结果显示, 贝飞达和益君康可以改善一些粪便参数; 贝飞达和思连康可提高推进率, 改善排泄功能; 初步探究机制发现, 这些益生菌制剂均可以保护杯状细胞、改善结肠粘蛋白的表达.
便秘是一种常见的胃肠功能紊乱的疾病, 长期便秘影响人们的生活质量. 研究表明益生菌可以良好地改善缓解便秘的症状, 但目前市场上益生菌制剂众多, 且疗效不一.
从市场中常见的几种益生菌制剂中筛选出具有较好改善便秘症状的潜在益生菌制剂.
探究贝飞达、益君康、思连康、金双歧在洛哌丁胺诱导的大鼠便秘模型中的作用及潜在的机制.
建立洛哌丁胺诱导的大鼠便秘模型, 并给予贝飞达、益君康、思连康、金双歧治疗, 收集大鼠的粪便和结肠组织, 通过大鼠体重、粪便数量、粪便含水率、肠道推进率、H&E染色及阿尔新蓝染色评估这些益生菌制剂在便秘大鼠中能否发挥有益作用.
贝飞达可以增加便秘大鼠的粪便数量和肠道推进率, 并且增加了粘膜厚度及隐窝面积. 益君康可以增加便秘大鼠的粪便数量以及肠隐窝面积. 思连康可以增加大鼠的肠道推进率及肠隐窝面积. 金双歧可以增加肠隐窝面积.
贝飞达、益君康、思连康、金双歧均能改善便秘大鼠的一些指标, 其中以贝飞达改善效果最佳.
本研究可以为便秘患者挑选择益生菌制剂提供了一定的参考.
| 1. | Dimidi E, Christodoulides S, Fragkos KC, Scott SM, Whelan K. The effect of probiotics on functional constipation in adults: a systematic review and meta-analysis of randomized controlled trials. Am J Clin Nutr. 2014;100:1075-1084. [PubMed] [DOI] |
| 2. | Koebnick C, Wagner I, Leitzmann P, Stern U, Zunft HJ. Probiotic beverage containing Lactobacillus casei Shirota improves gastrointestinal symptoms in patients with chronic constipation. Can J Gastroenterol. 2003;17:655-659. [PubMed] [DOI] |
| 3. | Shimotoyodome A, Meguro S, Hase T, Tokimitsu I, Sakata T. Decreased colonic mucus in rats with loperamide-induced constipation. Comp Biochem Physiol A Mol Integr Physiol. 2000;126:203-212. [PubMed] [DOI] |
| 4. | Zoppi G, Cinquetti M, Luciano A, Benini A, Muner A, Bertazzoni Minelli E. The intestinal ecosystem in chronic functional constipation. Acta Paediatr. 1998;87:836-841. [PubMed] [DOI] |
| 5. | Ku S, Park MS, Ji GE, You HJ. Review on Bifidobacterium bifidum BGN4: Functionality and Nutraceutical Applications as a Probiotic Microorganism. Int J Mol Sci. 2016;17. [PubMed] [DOI] |
| 6. | Eskesen D, Jespersen L, Michelsen B, Whorwell PJ, Müller-Lissner S, Morberg CM. Effect of the probiotic strain bifidobacterium animalis subsp. Lactis, bb-12, on defecation frequency in healthy subjects with low defecation frequency and abdominal discomfort: A randomised, double-blind, placebo-controlled, parallel-group trial. Br J Nutr. 2015;114:1638-1646. [PubMed] [DOI] |
| 7. | Wojtyniak K, Szajewska H. Systematic review: probiotics for functional constipation in children. Eur J Pediatr. 2017;176:1155-1162. [PubMed] [DOI] |
| 8. | Presti I, D'Orazio G, Labra M, La Ferla B, Mezzasalma V, Bizzaro G, Giardina S, Michelotti A, Tursi F, Vassallo M, Di Gennaro P. Evaluation of the probiotic properties of new Lactobacillus and Bifidobacterium strains and their in vitro effect. Appl Microbiol Biotechnol. 2015;99:5613-5626. [PubMed] [DOI] |
| 9. | Aloisio I, Santini C, Biavati B, Dinelli G, Cencič A, Chingwaru W, Mogna L, Di Gioia D. Characterization of Bifidobacterium spp. strains for the treatment of enteric disorders in newborns. Appl Microbiol Biotechnol. 2012;96:1561-1576. [PubMed] [DOI] |
| 10. | Heidelbaugh JJ, Stelwagon M, Miller SA, Shea EP, Chey WD. The spectrum of constipation-predominant irritable bowel syndrome and chronic idiopathic constipation: US survey assessing symptoms, care seeking, and disease burden. Am J Gastroenterol. 2015;110:580-587. [PubMed] [DOI] |
| 11. | Guérin A, Mody R, Fok B, Lasch KL, Zhou Z, Wu EQ, Zhou W, Talley NJ. Risk of developing colorectal cancer and benign colorectal neoplasm in patients with chronic constipation. Aliment Pharmacol Ther. 2014;40:83-92. [PubMed] [DOI] |
| 12. | Marchesi JR, Adams DH, Fava F, Hermes GD, Hirschfield GM, Hold G, Quraishi MN, Kinross J, Smidt H, Tuohy KM, Thomas LV, Zoetendal EG, Hart A. The gut microbiota and host health: a new clinical frontier. Gut. 2016;65:330-339. [PubMed] [DOI] |
| 20. | 周 素芳, 徐 思娅, 杨 景林, 吴 文尧, 王 敏. 参苓固肠颗粒联合金双歧治疗腹泻型肠易激综合征脾胃虚弱的临床疗效观察. 中国微生态学杂志. 2016;28:795-798. [DOI] |
| 21. | Zeng Q, He X, Puthiyakunnon S, Xiao H, Gong Z, Boddu S, Chen L, Tian H, Huang SH, Cao H. Probiotic Mixture Golden Bifido Prevents Neonatal Escherichia coli K1 Translocation via Enhancing Intestinal Defense. Front Microbiol. 2017;8:1798. [PubMed] [DOI] |
| 22. | Hughes S, Higgs NB, Turnberg LA. Loperamide has antisecretory activity in the human jejunum in vivo. Gut. 1984;25:931-935. [PubMed] [DOI] |
| 23. | Faderl M, Noti M, Corazza N, Mueller C. Keeping bugs in check: The mucus layer as a critical component in maintaining intestinal homeostasis. IUBMB Life. 2015;67:275-285. [PubMed] [DOI] |
| 24. | Shimotoyodome A, Meguro S, Hase T, Tokimitsu I, Sakata T. Sulfated polysaccharides, but not cellulose, increase colonic mucus in rats with loperamide-induced constipation. Dig Dis Sci. 2001;46:1482-1489. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 江西省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D
E级 (差): E
科学编辑: 张砚梁 制作编辑:张砚梁