修回日期: 2020-11-06
接受日期: 2020-11-17
在线出版日期: 2020-12-08
代谢性疾病是指葡萄糖、蛋白质及脂质在体内代谢异常引起的一类疾病. 越来越多的证据支持肠道菌群失调与代谢性疾病具有重要的相关性. 具体而言, 肠道菌群失调可能破坏肠道屏障功能, 诱发内毒素血症、胆汁酸代谢紊乱和全身慢性低度炎症, 促进代谢性疾病进展及并发症发生. 随着代谢性疾病病情进展, 肠道内环境改变以及药物、饮食等影响又反过来加重肠道菌群失调, 最终引起预后不良. 这凸显了通过调节肠道菌群结构来开发防治代谢性疾病治疗策略的可能性. 益生菌、益生元和合生元疗法、粪菌移植、中医药等可通过维持肠道菌群平衡、对抗有害菌群产物, 从而治疗代谢性疾病. 本文从代谢性疾病肠道菌群变化、肠道菌群影响代谢性疾病的可能机制、肠道菌群在代谢性疾病治疗中的应用等方面进行综述, 以期为以肠道菌群为靶点的代谢性疾病的诊断防治研究提供借鉴.
核心提要: 肠道疾病主要通过内毒素机制、短链脂肪酸机制、胆汁酸机制影响代谢性疾病的发生发展. 因此, 调节肠道菌群未来可能成为防治代谢性疾病的潜在新靶点.
引文著录: 李玉丽, 肖嫩群, 谭周进. 代谢性疾病的肠道菌群相关研究进展. 世界华人消化杂志 2020; 28(23): 1192-1199
Revised: November 6, 2020
Accepted: November 17, 2020
Published online: December 8, 2020
Metabolic diseases are a class of diseases caused by abnormal metabolism of glucose, protein, and lipids in the body. Accumulating evidence supports the important relevance of intestinal dysbacteriosis to metabolic diseases. Specifically, intestinal dysbacteriosis may disrupt intestinal barrier function, thereby inducing endotoxemia, bile acid metabolism disorders, and systemic chronic low-grade inflammation, which promote metabolic disease progression and complications. With the progression of the disease, the change in intestinal environment and the influence of drugs and diet in turn aggravate the imbalance of intestinal flora, which eventually leads to poor prognosis. This highlights the potential for developing therapies to prevent and treat metabolic diseases by changing the intestinal bacterial structure. Probiotics, prebiotics, synbiotic therapy, fecal bacteria transplantation, and traditional Chinese medicine can be used to treat metabolic diseases by maintaining the balance of intestinal bacteria and counteracting harmful bacterial products. This article reviews the changes of intestinal bacteria in metabolic diseases, the possible mechanism of intestinal bacteria affecting metabolic diseases, and the application of intestinal bacteria in the treatment of metabolic diseases, with an aim to provide a reference for the diagnosis and prevention of metabolic diseases by targeting intestinal flora.
- Citation: Li YL, Xiao NQ, Tan ZJ. Intestinal microflora in metabolic diseases. Shijie Huaren Xiaohua Zazhi 2020; 28(23): 1192-1199
- URL: https://www.wjgnet.com/1009-3079/full/v28/i23/1192.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i23.1192
随着现代社会经济的繁荣发展, 人们的饮食习惯已发生了巨大变化, 长期的"三高"(高盐、高糖、高脂)饮食导致肥胖、糖尿病等代谢性疾病的发病率呈现井喷式发展. 研究表明, 代谢性疾病病因杂糅了先天遗传和后天环境因素, 其中肠道微生态是重要的环境因素之一[1], 人体肠道内存在处于动态的复杂微生物群体, 各种微生物相互作用和影响, 共同参与肠道消化吸收、免疫过程的调节[2]. 现代研究表明肥胖[3]、糖尿病[4]、非酒精性脂肪肝[5]等典型代谢性疾病与肠道微生态的动态变化具有关联性. 肠道菌群在代谢性疾病发生、发展中扮演着重要角色. 本文就肠道菌群与代谢性疾病的相关研究作一综述, 为代谢性疾病的临床诊断和防治提供借鉴与参考.
肠道微生物群是以细菌为主的生态系统, 主要由拟杆菌门、厚壁菌门、放线菌门及少部分变形杆菌门组成, 其可分泌影响宿主代谢和能量贮存的分子, 与肥胖、糖尿病、非酒精性脂肪肝等典型代谢性疾病紧密相关. 常见代谢性疾病特征肠道菌群见表1.
| 病名 | 肠道菌群变化 | Ref. |
| 糖尿病 | 拟杆菌门/厚壁菌门、β变形菌纲、拟杆菌属-普雷沃菌属/C.coccoides-E.rectale、粘蛋白降解菌、硫酸盐还原菌、机会致病菌(如Hathewayi梭菌、粪拟杆菌、大肠埃希菌) ↑ 疣状菌纲、产丁酸盐细菌(如直肠真杆菌、普拉梭菌、罗斯拜瑞氏菌)、粪杆菌属、普拉梭菌↓ | [4,11,12] |
| 肥胖 | 厚壁菌门、古细菌、普雷沃菌属、肠杆菌属、巨单胞菌属↑ 拟杆菌门、拟杆菌属/普雷沃菌属、大肠埃希菌、普拉梭菌、颤螺旋菌科、多形拟杆菌↓ | [3,7-9] |
| NAFLD | 变形菌门、梭杆菌门、放线菌门↑ 普雷沃菌属、拟杆菌门↓ | [13,14] |
肥胖是一种由多因素引起的慢性能量代谢异常疾病. 研究者已指出肠道菌群是调节脂肪能量储存的环境因素[6]. 2005年, Ley等[3]首次运用DNA测序方法分析发现, 与消瘦型小鼠相比, 遗传性肥胖小鼠拟杆菌门丰度降低了50%, 而厚壁菌门丰度则成比例增加. 其后Turnbaugh等[7]使用高通量基因测序方法再次验证了肥胖小鼠体内厚壁菌门与拟杆菌门的比例相对于消瘦型小鼠而言有所增加, 同时还发现肥胖小鼠肠道古细菌比例高于消瘦型小鼠. 人类肥胖者的肠道菌群结构也存在差异. Furet等[8]研究观察到肥胖者的拟杆菌属(Bacteroides)/普雷沃菌属(Prevotella)比值低于非肥胖者, 而经过胃旁路减重手术后肠道菌群结构会相应地发现变化, 如拟杆菌属/普雷沃菌属比值、大肠埃希菌(Escherichia coli)数量上升, 乳酸菌(lactic acid bacteria)和双歧杆菌属(Bifidobacterium)则相对减少. 这些肠道微生物种属的差异与不同代谢层面相关, 拟杆菌属/普雷沃菌属比值高度依赖于热量摄入, 大肠埃希菌与脂肪量及瘦素水平成反比. 且糖尿病患者肠道普拉梭菌(Faecalibacterium prausnitzii)水平与炎症标记物呈负相关. Mayalucas等[9]发现肥胖儿童的肠道菌群聚集成了三种不同肠型(Enterotype), 正常体重儿童肠道菌群群落以胃瘤球菌属(Ruminococcus)为主, 即为肠型3; 而在肥胖儿童肠道中普雷沃菌属占主导, 此为肠型2. 且肥胖患儿的高丰度巨单胞菌属(Megamonas)和低丰度颤螺旋菌科(Oscillospiraceae)与血清胆固醇水平呈负相关. 因此, 肥胖影响肠道菌群结构和代谢能力, 肠道菌群分布差异可能是肥胖发生的重要机制之一, 调节肠道菌群结构有助于改善肥胖个体的能量代谢平衡.
Ⅱ型糖尿病是一类与肥胖密切相关的糖脂代谢异常疾病. Zhang等[10]基于16S rDNA高通量测序技术探讨了中国汉族人群肠道菌群与不同糖耐量状态之间的关系, 发现肠道菌群比例和多样性在糖尿病前期就已发生了变化, 其中疣状菌纲(Verrucomicrobiae)可能是Ⅱ型糖尿病的潜在标志物, 因为其在糖尿病前期组和Ⅱ型糖尿病组中的丰度都显著降低. Larsen等[4]发现Ⅱ型糖尿病患者血糖浓度与粪便中的拟杆菌门/厚壁菌门、拟杆菌属-普雷沃菌属/C. coccoides-E. rectale (Bacteroides-Prevotella/C. coccoides-E. rectale)、β变形菌纲(Betaproteobacteria)呈正相关, 提示糖尿病与不同肠道微生物群有关. Qin等[11]观察到中国Ⅱ型糖尿病患者肠道中的产丁酸盐细菌(如直肠真杆菌、普拉梭菌、罗斯拜瑞氏菌)丰度降低, 但是机会致病菌(Hathewayi梭菌、粪拟杆菌、大肠埃希菌)数量却增多, 此外, 其他微生物功能也有强化, 如粘蛋白降解菌(Akkermansia muciniphila)和硫酸盐还原菌(Desulfovibrio), 会引起胰岛素抵抗和血糖升高. Ⅰ型糖尿病是因胰岛β细胞破坏或功能衰竭导致胰岛素分泌不足的自身免疫疾病. Huang等[12]发现肠道粪杆菌属(Faecalibacterium)丰度与Ⅰ型糖尿病患者糖化血红蛋白量呈负相关, 拟杆菌属丰度则与抗胰岛素自身抗体量呈正相关. 人体肠道菌群受种族、地域、生活习惯等多方面因素的影响, 不同研究得出的菌种有一定的区别, 但总体表现为有益菌减少, 而各种病原菌定植增加.
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)是一种与胰岛素抵抗和遗传易感密切相关的代谢应激性肝脏损伤, 由于肠道菌群对宿主能量代谢有重要影响, 因此肠道菌群改变在NAFLD发病过程中发挥了重要作用. Le Roy等[5]将高脂饮食诱导的NAFLD小鼠肠道菌群移植入无菌小鼠体内, 发现无菌小鼠同样发生了NAFLD, 同时伴随着高血糖症、血浆中促炎细胞因子浓度升高. 此外, 部分临床试验也在积极探索NAFLD与肠道菌群失调的因果关系, 如有研究[13,14]发现与健康人相比, NAFLD患者的变形菌门(Proteobacteria)、梭杆菌门(Fusobacteria)、放线菌门(Actinobacteria)丰度升高, 然而普雷沃菌属(Prevotella)、拟杆菌门(Bacteroidetes)丰度却较低.
肥胖、糖尿病等还是许多疾病的危险因素. 一项大规模流行病学调查研究发现腹型肥胖是早期和晚期老年性黄斑变性(age-related macular degeneration, AMD)的独立危险因素[15]. 脉络膜新生血管(choroidal neovascularization, CNV)形成是引起AMD患者视力丧失的主要原因. Zinkernagel等[16]研究表明CNV形成阶段的AMD患者厌氧棍状菌属(Anaerotruncus)、颤杆菌(Oscillibacter)、扭链瘤胃球菌(Ruminococcus torques)及凸腹真杆菌(Eubacterium ventriosum)等菌属相对丰度高于对照组, 而埃氏拟杆菌(Bacteroides eggerthii)则为对照组的优势菌. 其中厌氧棍状菌属(Anaerotruncus)丰度与炎症及促炎趋化因子升高有关, 凸腹真杆菌(Eubacterium ventriosum)则与IL-6和IL-8细胞因子水平升高有关, 颤杆菌(Oscillibacter)则会导致肠道通透性增加. 因此, 组间微生物种属的差异直接产生功能基因和代谢层面的不同, AMD组肠道微生物群富含L-丙氨酸发酵、谷氨酸降解和精氨酸生物合成途径的基因, 而脂肪酸延长代谢途径的基因减少. 这些代谢层面的不同是微生物种属差异发挥作用的重要机制. 糖尿病进展会引起眼组织、神经及血管微循环改变, 造成眼的营养和视功能的损坏, 并发糖尿病视网膜病变(diabetic retinopathy, DR). 如Beli等[17]设想间歇禁食引起的肠道微生物变化会产生有益代谢物以阻止DR进展, 其通过实验验证了这个设想, 发现间歇禁食的糖尿病小鼠中增加的厚壁菌门会将更多的初级胆汁酸代谢成次级胆汁酸牛磺熊去氧胆酸(tauroursodeoxycholic acid, TUDCA), TUDCA可与G蛋白偶联受体结合以阻止视网膜神经病变和炎症. 因此, 肠道菌群为AMD、DR的诊断和治疗开辟了新方向.
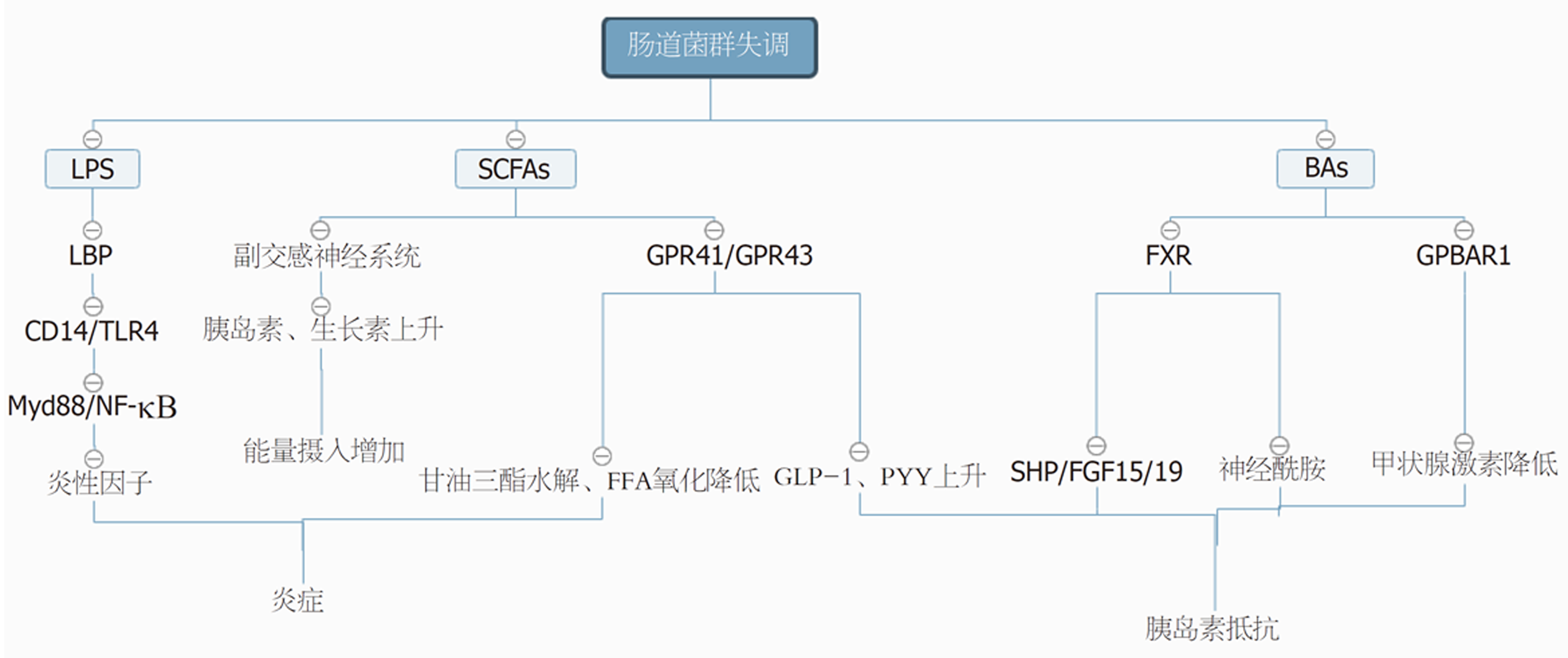
脂多糖(lipopolysaccharide, LPS)又称内毒素, 是肠道革兰阴性细菌细胞壁的成分之一. 肠道菌群失调时, 宿主肠道上皮细胞之间的紧密连接蛋白和闭合蛋白表达下降, 导致肠黏膜通透性增加, 菌群代谢性内毒素进入血液与脂多糖结合蛋白(lipopolysaccharide binding protein, LBP)结合, 激活免疫细胞表面的受体CD14, CD14协助LPS识别并激活CD14/Toll样受体4(toll-like receptor 4, TLR4),然后进一步激活Myd88/NF-κB信号通路,促进炎性反应因子(如IL-1、IL-6、TNF-α等)的释放, 引起体内炎症级联反应, 使得机体进入低度炎症状态, 从而产生代谢异常[18,19]. Fei等[20]发现从肥胖患者中分离出的产LPS病原菌肠杆菌属(Enterobacter)会诱导无菌小鼠肥胖和胰岛素抵抗的发生. Balakumar等[21]通过临床研究证明了益生菌疗法可明显降低糖尿病患者血清LPS水平, 抑制炎症因子, 显著改善胰岛素抵抗而延缓疾病进展. 因此, LPS水平升高会引起肠道病原菌大量生长繁殖, 益生菌活性被抑制. 这些研究结果说明有效降低LPS水平对于防治代谢性疾病至关重要.
短链脂肪酸(short chain fatty acids, SCFAs)是由盲肠和远端结肠中的菌群发酵未消化食物而生成的代谢终产物, 主要包括乙酸、丙酸和正丁酸等. 有研究[22]观察到SCFAs与身体的脂肪分布和新生脂肪生成有关, 肥胖患者有更强的发酵碳水化合物的能力. Turnbaugh等[23]研究发现SCFAs被吸收进入血液循环后, 通过乙酰辅酶A进入Kreb's循环, 增加了机体的能量摄入, 诱导肥胖症发生. Perry等[24]研究表明, 高脂饮食导致的啮齿类动物肠道菌群改变会使乙酸产生增加, 其机制涉及激活副交感神经系统, 促进葡萄糖刺激的胰岛素分泌增多, 生长素分泌增加, 摄食过度, 从而产生肥胖和相关后遗症. 然而又有研究[25]发现, 乙酸、丙酸、丁酸或其混合物的膳食补充剂却可以显著抑制高脂饮食引起的体质量增加, 因为SCFAs补充剂能增加G蛋白耦联受体43(G-protein coupled receptor 43, GPR43)和G蛋白耦联受体41(G-protein coupled receptor 41, GPR41)在脂肪组织中的表达, 增加脂肪组织中甘油三酯的水解和游离脂肪酸(free fatty acid, FFA)的氧化, 促进米色脂肪细胞和线粒体的生物合成, 抑制慢性炎症反应, 从而进一步减轻体重. SCFAs还可通过与GPCR41或GPCR43结合促进胰高血糖素样肽1(glucagon-like peptide 1,GLP-1)、酪酪肽(peptide YY, PYY)、瘦素等的分泌, 进一步抑制胃液分泌和胃肠蠕动, 延缓胃内容物排空, 同时作用于下丘脑等中枢神经系统, 使人体产生饱胀感和食欲下降来改善肥胖. 同时还可改善胰岛素抵抗[26].
胆汁酸(bile acids ,BAs)是胆固醇在肝脏分解代谢的一组产物, 分为初级胆汁酸和次级胆汁酸. 肝细胞将胆固醇转变为初级胆汁酸, 储存在胆囊, 经释放进入小肠, 肠道菌群再将初级胆汁酸转化次级胆汁酸. 当肠道微生物结构改变时, 会阻碍这种转化, 导致次级胆汁酸水平降低, 影响肠道、肝脏、胰腺等组织中法尼醇X受体(farnesoid X receptor, FXR)和G蛋白偶联胆汁酸受体1(G-protein coupled bile acid receptor 1, GPBAR1)的表达. 胆汁酸代谢产物与GPBAR1结合后会促进Ⅱ型脱碘酶释放, 增加体内甲状腺激素水平, 提升脂肪代谢和能量消耗, 改善并预防肥胖及胰岛素抵抗等疾病发生. 研究[27]发现高脂饮食喂养的肠道FXR敲除的小鼠表现出较低的饮食诱导肥胖, 且通过肠肝循环到达肝脏的小异二聚体伴侣(small heterodimeric protein, SHP)和成纤维细胞生长因子15(fibroblast growth factor 15, FGF15)减少, 胆固醇7-羟化酶(cholesterol 7-alpha hydroxy-lase, CYP7A1)表达增加. 同时小鼠血浆神经酰胺水平降低, 可抵抗高脂饮食诱导的代谢性疾[28]. 综上, 胆汁酸作为信号分子介导的调控机制在代谢性疾病中扮演着十分重要的角色. 肠道菌群与代谢性疾病的作用机制如图1.
2018年Koh等[29]介绍了肠道菌群影响糖代谢的新机制-丙酸咪唑影响(mammalian target of rapamycin, mTORC1)信号通路, 减少胰岛受体底物(islet receptor substrate, IRS)的产生, 阻断胰岛素信号, 从而加速着糖尿病的发生发展. 这就为肠道菌群与代谢性疾病关系的研究提供了新的思路.
代谢性疾病患者肠道菌群结构及代谢产物的紊乱, 损坏肠道屏障功能, 诱发系统慢性低度炎症及生理功能紊乱. 肠道产生SCFA、BAs的有益菌丰度降低, 减弱了肠道菌群对机体的有益作用, 促进了胰岛素抵抗和糖尿病发生的进程, 有针对性地恢复有益菌的丰度和多样性, 降低产LPS的菌群丰度可能为防治代谢性疾病提供一种新的生态学方法.
研究发现肠道菌群基因丰度低的人群较丰度高的人群更易发生全身性肥胖、脂质代谢紊乱、胰岛素抵抗等代谢异常. Le Chatelier等[30]报告了123名非肥胖和169名肥胖丹麦个体的人群肠道微生物组成, 发现两组个体的肠道微生物基因数量不同, 即基因丰度不同. 与高细菌基因丰度的个体相比, 低细菌基因丰度的个体表现更为显著的总体肥胖、胰岛素抵抗和血脂异常, 且炎症表型也更明显, 这些个体可能有更高的发展为肥胖症及相关并发症的风险.
除了肠道细菌基因丰度, 不同代谢性疾病的基因种类也存在差异, 比如肠道菌群可以调节宿主脂肪存储基因的表达活性, 促进宿主脂肪的积累. 禁食诱导脂肪细胞因子(fasting-induced adipocyte factor, Fiaf)基因主要负责编码脂蛋白脂肪酶(lipoprotein lipase, LPL)抑制因子, 其通过抑制LPL而抑制甘油三酯循环. 李冰[31]进行了NAFLD患者肠道菌群变化与Fiaf、胰岛素抵抗的相关性研究, 发现变形杆菌数量与Fiaf的表达水平呈显著性负相关, 与胰岛素抵抗指数(homeostasis model assessment of insulin resistance, HOMA-IR)呈正相关. Jacouton等[32]研究了几种乳酸杆菌菌株对人肠上皮Fiaf基因表达的影响, 发现鼠李糖乳杆菌(Lactobacillus rhamnosus) CNCMI-4317能够诱导人肠上皮Fiaf的表达.
益生菌是指能通过改善宿主微生态平衡有效促进人体健康的特定菌株. 复合益生菌可明显增加Ⅱ型糖尿病大鼠血清和结肠中GLP-1的水平而降低空腹血糖水平, 其机制与激活GPR43、GPR41相关[33]. 益生菌大肠埃希菌Nissle 1917可通过增加紧密连接蛋白的表达以及重建紧密连接复合体, 阻止致病菌对黏膜屏障的破坏, 恢复封闭带紧密连接蛋白的定位[34]. 益生菌VSL#3可引起小鼠肠道内的菌群改变而引起SCFAs水平增加, 促进GLP-1释放, 从而减少食物摄入量, 改善葡萄糖耐量, 防止肥胖、糖尿病和肝脂肪变性[35]. 益生元是宿主摄入的非消化性物质, 主要是食物的膳食成分(主要为非淀粉多糖和低聚糖). 低聚果糖可使高脂饮食诱导的肥胖组和非肥胖组小鼠体重降低35%, 提高GLP-1和PYY水平, 增加肠道中乳酸菌和产丁酸菌的数量[36], 降低肠道炎症水平[37]. 合生元为益生菌和益生元的混合物. Ahn等[38]发现合生菌可使肥胖患者的体重指数和内脏脂肪面积明显减少, 甘油三酯水平、肝内脂肪含量降低. 但是有研究显示, 短期(≤12 wk)补充益生菌可降低体质指数, 但效果欠佳. 益生菌对抗生素所致肠道菌群失调的恢复可能无效, 甚至延迟菌群稳态的恢复. 系统回顾研究也未发现益生菌在肠道持续定植的证据[39]. 因此, 益生菌、益生元和合生元对代谢性疾病的作用有待进一步探究.
粪菌移植(fecal microbiota transplantation, FMT)是指将粪便中的微生物从健康人移植到患者体内, 重建正常肠道菌群, 其可以看作是一种特殊的"益生菌". 目前上市的益生菌制剂种类繁多, 但每种制剂所含菌群种类比较局限, 而FMT几乎能包含受体全部的肠道菌群, 能够快速恢复正常肠道菌群结构, 从而达到治疗疾病的目的. 李月芹等[40]观察发现FMT可显著改善NAFLD大鼠肝脏脂肪变性程度, 降低肠道通透性, 改善肠黏膜屏障功能. 同时FMT可降低肥胖大鼠的血内毒素和TNF-α水平. 因此FMT能够纠正肠道微生态失衡, 增强肠道屏障功能, 降低血内毒素及炎症因子水平. Vrieze等[41]对18例接受瘦者FMT肥胖者的研究发现, FMT肥胖者肝脏和外周组织胰岛素敏感性和产丁酸盐菌的丰度均明显增加, 丁酸盐被证明可促进肠道屏障功能修复及抑制炎症因子[42]. 目前以FMT治疗代谢性疾病的研究较少, 且FMT本身也存在着一些安全隐患, 未来需要开展多中心大规模的临床验证, 对粪便移植后供受体菌群间交流机制进行深入研究.
中药成分能被肠道菌群分解成多酚类物质、生物碱、皂苷和多糖等可发挥药理作用的生物活性成分改善疾病症状. Etxeberria等[43]研究发现同时服用反式白藜芦醇和槲皮素两种多酚可以防止高脂高糖饮食大鼠体重增加和降低血清胰岛素水平. 此外, 单独补充反式白藜芦醇和槲皮素也能有效降低血清胰岛素水平和胰岛素抵抗. 其中添加槲皮素降低了厚壁菌门/拟杆菌门的比例, 并抑制了与饮食诱导肥胖相关的细菌的生长. 单独补充反式白藜芦醇或与槲皮素联合使用会在肠道水平起作用, 改变了紧密连接蛋白和炎症相关基因的mRNA表达. 从中药黄连中提取的单体成分小檗碱可升高Ⅱ型糖尿病患者双歧杆菌、乳酸杆菌数而进一步促进肠道β半乳糖苷酶、葡萄糖苷水解酶活性升高, 以及外周组织对糖类物质有效吸收和利用, 而减少了可以加剧糖脂代谢紊乱程度的拟杆菌、肠杆菌、肠球菌数量[44]. 张磊艺等[45]研究表明, 银杏叶提取物可能通过升高糖尿病大鼠肠道内肠球菌、双歧杆菌、乳杆菌等, 从而发挥调节脂质代谢的作用. 体现中医辨证论治应用特色的方剂同样对肠道菌群失调起着明显的改善作用. Wei等[46]研究发现泻心汤(由大黄、黄连、黄芩组成)通过影响一些与SCFAs产生和抗炎相关的菌群而有效改善糖尿病大鼠的高血糖、胰岛素抵抗、炎症和脂质代谢紊乱等情况. Hussain等[47]研究团队发现大柴胡汤可显著增加益生菌如双歧杆菌、乳酸杆菌等的数量, 降低高脂饮食诱导的肥胖小鼠的血糖、甘油三酯和胆固醇水平, 升高高密度脂蛋白, 以及脂肪组织中脂联素基因和瘦素的表达, 调节糖脂代谢, 减少肝脏脂肪沉积, 发挥抗糖尿病作用. 吴帆等[48]研究发现乌梅丸可降低大鼠肠道内革兰氏阴性菌数量, 减少LPS释放入血, 调控TLR-4/NF-κB信号通路, 促进抗炎因子生成, 减轻炎症状态, 从而改善胰岛功能, 下调血糖水平.
中医特色疗法针灸通过刺激人体穴位改善肠道菌群种类, 提高菌群丰度, 如针刺特定穴位可提高肥胖女性的血浆胃饥饿素和胆囊收缩素水平, 降低胰岛素和瘦素水平, 从而使体重指数下降[49]. 温和灸关元穴能够使双歧杆菌、乳酸杆菌数量显著增加; 温和灸天枢穴则能使肠杆菌、肠球菌数量显著增加, 表明温和灸不同募穴能够选择性调节肠道益生菌群[50]. 综上可知, 肠道菌群是中医药治疗代谢性疾病的桥梁, 这可能也是中医药治疗代谢性疾病的机制之一. 总体而言, 中医药疗法可通过增加肠道有益菌群, 降低致病菌的数量, 恢复肠道屏障功能, 改善机体炎症和胰岛素抵抗等以治疗代谢性疾病.
肠道菌群通过影响葡萄糖、蛋白质及脂质等代谢, 产生SCFAs、LPS等多种代谢产物, 或在代谢过程中影响宿主正常物质的代谢, 从而在代谢性疾病的发生与发展中发挥重要作用. 因此, 肠道菌群可能是代谢性疾病防治中有研究前景的新靶点. 益生菌、益生元和合生元、FMT及中医药等通过调节肠道菌群失调结构, 改善全身微炎症和胰岛素抵抗等来延缓代谢性疾病进展, 改善疾病预后. 尽管目前开展了不少肠道菌群与代谢性疾病的相关研究, 但大部分研究具有一定局限性, 如缺乏可重复性、未能阐明肠道菌群失调影响代谢性疾病的机制以及二者间的因果关系等, 未来尚需进一步的深入研究. 大部分报道是基于动物水平的研究, 其结论需要临床实验进一步验证. 此外, 多数研究的微生物组是从粪便中取样, 但粪便的细菌组成与肠道菌群并不完全相同. 未来深入揭示肠道微生物群如何影响机体代谢表型, 解决研究工具上的根本问题, 有利于开发基于肠道菌群的代谢性疾病诊断、防治和预后判断的生物标志物, 实现基础研究与临床应用的转化.
| 1. | Karlsson FH, Tremaroli V, Nookaew I, Bergström G, Behre CJ, Fagerberg B, Nielsen J, Bäckhed F. Gut metagenome in European women with normal, impaired and diabetic glucose control. Nature. 2013;498:99-103. [PubMed] [DOI] |
| 2. | Zhang M, Sun K, Wu Y, Yang Y, Tso P, Wu Z. Interactions between Intestinal Microbiota and Host Immune Response in Inflammatory Bowel Disease. Front Immunol. 2017;8:942. [PubMed] [DOI] |
| 3. | Ley RE, Bäckhed F, Turnbaugh P, Lozupone CA, Knight RD, Gordon JI. Obesity alters gut microbial ecology. Proc Natl Acad Sci USA. 2005;102:11070-11075. [PubMed] [DOI] |
| 4. | Larsen N, Vogensen FK, van den Berg FW, Nielsen DS, Andreasen AS, Pedersen BK, Al-Soud WA, Sørensen SJ, Hansen LH, Jakobsen M. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults. PLoS One. 2010;5:e9085. [PubMed] [DOI] |
| 5. | Le Roy T, Llopis M, Lepage P, Bruneau A, Rabot S, Bevilacqua C, Martin P, Philippe C, Walker F, Bado A, Perlemuter G, Cassard-Doulcier AM, Gérard P. Intestinal microbiota determines development of non-alcoholic fatty liver disease in mice. Gut. 2013;62:1787-1794. [PubMed] [DOI] |
| 6. | Bäckhed F, Ding H, Wang T, Hooper LV, Koh GY, Nagy A, Semenkovich CF, Gordon JI. The gut microbiota as an environmental factor that regulates fat storage. Proc Natl Acad Sci USA. 2004;101:15718-15723. [PubMed] [DOI] |
| 7. | Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature. 2006;444:1027-1031. [PubMed] [DOI] |
| 8. | Furet JP, Kong LC, Tap J, Poitou C, Basdevant A, Bouillot JL, Mariat D, Corthier G, Doré J, Henegar C, Rizkalla S, Clément K. Differential adaptation of human gut microbiota to bariatric surgery-induced weight loss: links with metabolic and low-grade inflammation markers. Diabetes. 2010;59:3049-3057. [PubMed] [DOI] |
| 9. | Maya-Lucas O, Murugesan S, Nirmalkar K, Alcaraz LD, Hoyo-Vadillo C, Pizano-Zárate ML, García-Mena J. The gut microbiome of Mexican children affected by obesity. Anaerobe. 2019;55:11-23. [PubMed] [DOI] |
| 10. | Zhang X, Shen D, Fang Z, Jie Z, Qiu X, Zhang C, Chen Y, Ji L. Human gut microbiota changes reveal the progression of glucose intolerance. PLoS One. 2013;8:e71108. [PubMed] [DOI] |
| 11. | Qin J, Li Y, Cai Z, Li S, Zhu J, Zhang F, Liang S, Zhang W, Guan Y, Shen D, Peng Y, Zhang D, Jie Z, Wu W, Qin Y, Xue W, Li J, Han L, Lu D, Wu P, Dai Y, Sun X, Li Z, Tang A, Zhong S, Li X, Chen W, Xu R, Wang M, Feng Q, Gong M, Yu J, Zhang Y, Zhang M, Hansen T, Sanchez G, Raes J, Falony G, Okuda S, Almeida M, LeChatelier E, Renault P, Pons N, Batto JM, Zhang Z, Chen H, Yang R, Zheng W, Li S, Yang H, Wang J, Ehrlich SD, Nielsen R, Pedersen O, Kristiansen K, Wang J. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature. 2012;490:55-60. [PubMed] [DOI] |
| 12. | Huang Y, Li SC, Hu J, Ruan HB, Guo HM, Zhang HH, Wang X, Pei YF, Pan Y, Fang C. Gut microbiota profiling in Han Chinese with type 1 diabetes. Diabetes Res Clin Pract. 2018;141:256-263. [PubMed] [DOI] |
| 13. | Shen F, Zheng RD, Sun XQ, Ding WJ, Wang XY, Fan JG. Gut microbiota dysbiosis in patients with non-alcoholic fatty liver disease. Hepatobiliary Pancreat Dis Int. 2017;16:375-381. [PubMed] [DOI] |
| 14. | Del Chierico F, Nobili V, Vernocchi P, Russo A, De Stefanis C, Gnani D, Furlanello C, Zandonà A, Paci P, Capuani G, Dallapiccola B, Miccheli A, Alisi A, Putignani L. Gut microbiota profiling of pediatric nonalcoholic fatty liver disease and obese patients unveiled by an integrated meta-omics-based approach. Hepatology. 2017;65:451-464. [PubMed] [DOI] |
| 15. | Adams MK, Simpson JA, Aung KZ, Makeyeva GA, Giles GG, English DR, Hopper J, Guymer RH, Baird PN, Robman LD. Abdominal obesity and age-related macular degeneration. Am J Epidemiol. 2011;173:1246-1255. [PubMed] [DOI] |
| 16. | Zinkernagel MS, Zysset-Burri DC, Keller I, Berger LE, Leichtle AB, Largiadèr CR, Fiedler GM, Wolf S. Association of the Intestinal Microbiome with the Development of Neovascular Age-Related Macular Degeneration. Sci Rep. 2017;7:40826. [PubMed] [DOI] |
| 17. | Beli E, Yan Y, Moldovan L, Vieira CP, Gao R, Duan Y, Prasad R, Bhatwadekar A, White FA, Townsend SD, Chan L, Ryan CN, Morton D, Moldovan EG, Chu FI, Oudit GY, Derendorf H, Adorini L, Wang XX, Evans-Molina C, Mirmira RG, Boulton ME, Yoder MC, Li Q, Levi M, Busik JV, Grant MB. Restructuring of the Gut Microbiome by Intermittent Fasting Prevents Retinopathy and Prolongs Survival in db/db Mice. Diabetes. 2018;67:1867-1879. [PubMed] [DOI] |
| 19. | Ryu JK, Kim SJ, Rah SH, Kang JI, Jung HE, Lee D, Lee HK, Lee JO, Park BS, Yoon TY, Kim HM. Reconstruction of LPS Transfer Cascade Reveals Structural Determinants within LBP, CD14, and TLR4-MD2 for Efficient LPS Recognition and Transfer. Immunity. 2017;46:38-50. [PubMed] [DOI] |
| 20. | Fei N, Zhao L. An opportunistic pathogen isolated from the gut of an obese human causes obesity in germfree mice. ISME J. 2013;7:880-884. [PubMed] [DOI] |
| 21. | Balakumar M, Prabhu D, Sathishkumar C, Prabu P, Rokana N, Kumar R, Raghavan S, Soundarajan A, Grover S, Batish VK, Mohan V, Balasubramanyam M. Improvement in glucose tolerance and insulin sensitivity by probiotic strains of Indian gut origin in high-fat diet-fed C57BL/6J mice. Eur J Nutr. 2018;57:279-295. [PubMed] [DOI] |
| 22. | Goffredo M, Mass K, Parks EJ, Wagner DA, McClure EA, Graf J, Savoye M, Pierpont B, Cline G, Santoro N. Role of Gut Microbiota and Short Chain Fatty Acids in Modulating Energy Harvest and Fat Partitioning in Youth. J Clin Endocrinol Metab. 2016;101:4367-4376. [PubMed] [DOI] |
| 23. | Turnbaugh PJ, Hamady M, Yatsunenko T, Cantarel BL, Duncan A, Ley RE, Sogin ML, Jones WJ, Roe BA, Affourtit JP, Egholm M, Henrissat B, Heath AC, Knight R, Gordon JI. A core gut microbiome in obese and lean twins. Nature. 2009;457:480-484. [PubMed] [DOI] |
| 24. | Perry RJ, Peng L, Barry NA, Cline GW, Zhang D, Cardone RL, Petersen KF, Kibbey RG, Goodman AL, Shulman GI. Acetate mediates a microbiome-brain-β-cell axis to promote metabolic syndrome. Nature. 2016;534:213-217. [PubMed] [DOI] |
| 25. | Lu Y, Fan C, Li P, Lu Y, Chang X, Qi K. Short Chain Fatty Acids Prevent High-fat-diet-induced Obesity in Mice by Regulating G Protein-coupled Receptors and Gut Microbiota. Sci Rep. 2016;6:37589. [PubMed] [DOI] |
| 26. | Müller TD, Finan B, Bloom SR, D'Alessio D, Drucker DJ, Flatt PR, Fritsche A, Gribble F, Grill HJ, Habener JF, Holst JJ, Langhans W, Meier JJ, Nauck MA, Perez-Tilve D, Pocai A, Reimann F, Sandoval DA, Schwartz TW, Seeley RJ, Stemmer K, Tang-Christensen M, Woods SC, DiMarchi RD, Tschöp MH. Glucagon-like peptide 1 (GLP-1). Mol Metab. 2019;30:72-130. [PubMed] [DOI] |
| 27. | Li F, Jiang C, Krausz KW, Li Y, Albert I, Hao H, Fabre KM, Mitchell JB, Patterson AD, Gonzalez FJ. Microbiome remodelling leads to inhibition of intestinal farnesoid X receptor signalling and decreased obesity. Nat Commun. 2013;4:2384. [PubMed] [DOI] |
| 28. | Gonzalez FJ, Jiang C, Patterson AD. An Intestinal Microbiota-Farnesoid X Receptor Axis Modulates Metabolic Disease. Gastroenterology. 2016;151:845-859. [PubMed] [DOI] |
| 29. | Koh A, Molinaro A, Ståhlman M, Khan MT, Schmidt C, Mannerås-Holm L, Wu H, Carreras A, Jeong H, Olofsson LE, Bergh PO, Gerdes V, Hartstra A, de Brauw M, Perkins R, Nieuwdorp M, Bergström G, Bäckhed F. Microbially Produced Imidazole Propionate Impairs Insulin Signaling through mTORC1. Cell. 2018;175:947-961.e17. [PubMed] [DOI] |
| 30. | Le Chatelier E, Nielsen T, Qin J, Prifti E, Hildebrand F, Falony G, Almeida M, Arumugam M, Batto JM, Kennedy S, Leonard P, Li J, Burgdorf K, Grarup N, Jørgensen T, Brandslund I, Nielsen HB, Juncker AS, Bertalan M, Levenez F, Pons N, Rasmussen S, Sunagawa S, Tap J, Tims S, Zoetendal EG, Brunak S, Clément K, Doré J, Kleerebezem M, Kristiansen K, Renault P, Sicheritz-Ponten T, de Vos WM, Zucker JD, Raes J, Hansen T; MetaHIT consortium, Bork P, Wang J, Ehrlich SD, Pedersen O. Richness of human gut microbiome correlates with metabolic markers. Nature. 2013;500:541-546. [PubMed] [DOI] |
| 31. | 李 冰. 非酒精性脂肪性肝病患者肠道菌群变化及其与禁食诱导脂肪因子、胰岛素抵抗的相关性研究. 河北省: 河北医科大学, 2014. |
| 32. | Jacouton E, Mach N, Cadiou J, Lapaque N, Clément K, Doré J, van Hylckama Vlieg JE, Smokvina T, Blottière HM. Lactobacillus rhamnosus CNCMI-4317 Modulates Fiaf/Angptl4 in Intestinal Epithelial Cells and Circulating Level in Mice. PLoS One. 2015;10:e0138880. [PubMed] [DOI] |
| 33. | 孙 昕, 加勒哈斯别克·塞力克, 王艳明, 吴禹澈, 新华·那比. 乳源性复合益生菌对2型糖尿病大鼠GLP-1的影响及调控机制. 中国微生态学杂志. 2020;32:384-391. [DOI] |
| 34. | Zyrek AA, Cichon C, Helms S, Enders C, Sonnenborn U, Schmidt MA. Molecular mechanisms underlying the probiotic effects of Escherichia coli Nissle 1917 involve ZO-2 and PKCzeta redistribution resulting in tight junction and epithelial barrier repair. Cell Microbiol. 2007;9:804-816. [PubMed] [DOI] |
| 35. | Yadav H, Lee JH, Lloyd J, Walter P, Rane SG. Beneficial metabolic effects of a probiotic via butyrate-induced GLP-1 hormone secretion. J Biol Chem. 2013;288:25088-25097. [PubMed] [DOI] |
| 36. | Armani RG, Ramezani A, Yasir A, Sharama S, Canziani MEF, Raj DS. Gut Microbiome in Chronic Kidney Disease. Curr Hypertens Rep. 2017;19:29. [PubMed] [DOI] |
| 37. | Tsai YL, Lin TL, Chang CJ, Wu TR, Lai WF, Lu CC, Lai HC. Probiotics, prebiotics and amelioration of diseases. J Biomed Sci. 2019;26:3. [PubMed] [DOI] |
| 38. | Ahn SB, Jun DW, Kang BK, Lim JH, Lim S, Chung MJ. Randomized, Double-blind, Placebo-controlled Study of a Multispecies Probiotic Mixture in Nonalcoholic Fatty Liver Disease. Sci Rep. 2019;9:5688. [PubMed] [DOI] |
| 39. | Suez J, Zmora N, Zilberman-Schapira G, Mor U, Dori-Bachash M, Bashiardes S, Zur M, Regev-Lehavi D, Ben-Zeev Brik R, Federici S, Horn M, Cohen Y, Moor AE, Zeevi D, Korem T, Kotler E, Harmelin A, Itzkovitz S, Maharshak N, Shibolet O, Pevsner-Fischer M, Shapiro H, Sharon I, Halpern Z, Segal E, Elinav E. Post-Antibiotic Gut Mucosal Microbiome Reconstitution Is Impaired by Probiotics and Improved by Autologous FMT. Cell. 2018;174:1406-1423.e16. [PubMed] [DOI] |
| 41. | Vrieze A, Van Nood E, Holleman F, Salojärvi J, Kootte RS, Bartelsman JF, Dallinga-Thie GM, Ackermans MT, Serlie MJ, Oozeer R, Derrien M, Druesne A, Van Hylckama Vlieg JE, Bloks VW, Groen AK, Heilig HG, Zoetendal EG, Stroes ES, de Vos WM, Hoekstra JB, Nieuwdorp M. Transfer of intestinal microbiota from lean donors increases insulin sensitivity in individuals with metabolic syndrome. Gastroenterology. 2012;143:913-6.e7. [PubMed] [DOI] |
| 42. | Doumatey AP, Adeyemo A, Zhou J, Lei L, Adebamowo SN, Adebamowo C, Rotimi CN. Gut Microbiome Profiles Are Associated With Type 2 Diabetes in Urban Africans. Front Cell Infect Microbiol. 2020;10:63. [PubMed] [DOI] |
| 43. | Etxeberria U, Arias N, Boqué N, Macarulla MT, Portillo MP, Martínez JA, Milagro FI. Reshaping faecal gut microbiota composition by the intake of trans-resveratrol and quercetin in high-fat sucrose diet-fed rats. J Nutr Biochem. 2015;26:651-660. [PubMed] [DOI] |
| 44. | 朱 英倩, 江 华, 沙 雯君, 雷 涛. 盐酸小檗碱对初发2型糖尿病患者降糖疗效及肠道菌群的影响. 同济大学学报(医学版). 2020;41:467-472. [DOI] |
| 46. | Wei X, Tao J, Xiao S, Jiang S, Shang E, Zhu Z, Qian D, Duan J. Xiexin Tang improves the symptom of type 2 diabetic rats by modulation of the gut microbiota. Sci Rep. 2018;8:3685. [PubMed] [DOI] |
| 47. | Hussain A, Yadav MK, Bose S, Wang JH, Lim D, Song YK, Ko SG, Kim H. Daesiho-Tang Is an Effective Herbal Formulation in Attenuation of Obesity in Mice through Alteration of Gene Expression and Modulation of Intestinal Microbiota. PLoS One. 2016;11:e0165483. [PubMed] [DOI] |
| 48. | 吴 帆. 乌梅丸调节肠道菌群对2型糖尿病的干预作用及机制研究. 江西省: 江西中医药大学, 2019. |
| 49. | Güçel F, Bahar B, Demirtas C, Mit S, Cevik C. Influence of acupuncture on leptin, ghrelin, insulin and cholecystokinin in obese women: a randomised, sham-controlled preliminary trial. Acupunct Med. 2012;30:203-207. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 湖南省
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): B, B
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁