修回日期: 2019-01-08
接受日期: 2019-01-29
在线出版日期: 2019-02-28
瑞芬太尼为临床上常用的麻醉药, 近几年其新功效不断被发现, 尤其是抗癌功能. 但瑞芬太尼在胃癌(gastric cancer, GC)中的作用及机制尚未清楚.
探讨瑞芬太尼对AGS、MKN-45人GC细胞中miR-206、GOLPH3表达及细胞增殖、凋亡的影响.
以40 nmol/L瑞芬太尼干预AGS、MKN-45细胞, qRT-PCR、Western blot、MTT和流式细胞仪分别检测细胞中miR-206和GOLPH3表达及细胞活力、凋亡. 在AGS、MKN-45细胞中过表达miR-206或敲减GOLPH3, MTT和流式细胞仪检测细胞活力和凋亡. Targetscan在线预测、双荧光素酶报告基因实验和Western blot实验验证miR-206和GOLPH3的靶向关系. 将miR-206 inhibitors或pcDNA-GOLPH3转染至AGS、MKN-45细胞并以40 nmol/L瑞芬太尼进行处理, 检测细胞活力和凋亡.
瑞芬太尼干预的AGS、MKN-45细胞中miR-206高表达而GOLPH3低表达, 细胞活力降低而凋亡率升高. 过表达miR-206或敲减GOLPH3, 细胞活力下降、凋亡率升高. Targetscan在线预测、双荧光素酶报告基因实验和Western blot实验结果表明, miR-206可靶向调控GOLPH3蛋白表达. 下调miR-206或过表达GOLPH3能够逆转瑞芬太尼对AGS、MKN-45细胞增殖的抑制和凋亡的促进作用.
瑞芬太尼能够通过调节miR-206和GOLPH3表达抑制AGS、MKN-45细胞增殖并诱导凋亡.
核心提要: 瑞芬太尼能够通过调节miR-206和GOLPH3表达抑制AGS细胞增殖并诱导凋亡.
引文著录: 陈晓军, 沈鑫宁, 陈亮. 瑞芬太尼通过miR-206/GOLPH3调控胃癌细胞增殖和凋亡的实验研究. 世界华人消化杂志 2019; 27(4): 228-237
Revised: January 8, 2019
Accepted: January 29, 2019
Published online: February 28, 2019
Remifentanil is a commonly used anesthetic in clinical practice. In recent years, its new efficacy has been continuously discovered, especially its anti-cancer function. However, the role and mechanism of remifentanil in gastric cancer (GC) are still not clear.
To investigate the effect of remifentanil on the expression of miR-206, GOLPH3, cell proliferation, and apoptosis in human GC cell lines AGS and MKN-45.
The expression of miR-206 and GOLPH3 and the viability and apoptosis of AGS and MKN-45 cells after treatment with 40 nmol/L remifentanil were detected by qRT-PCR, Western blot, MTT assay, and flow cytometry, respectively. Cell viability and apoptosis of AGS and MKN-45 cells with overexpression of miR-206 or knockdown of GOLPH3 were detected by MTT assay and flow cytometry, respectively. The targeting relationship between miR-206 and GOLPH3 was verified by Targetscan online prediction, dual-luciferase assay, and Western blot. After transfection with miR-206 inhibitor or pcDNA-GOLPH3, AGS and MKN-45 cells were treated with 40 nmol/L remifentanil and then detected for cell viability and apoptosis.
After treatment with remifentanil, the expression of miR-206 and apoptosis rate were increased while the expression of GOLPH3 and cell viability were decreased in AGS and MKN-45 cells. Cell viability was decreased and apoptotic rate was increased in AGS and MKN-45 cells after overexpression of miR-206 or knockdown of GOLPH3. The results of Targetscan online prediction, dual-luciferase assay, and Western blot indicted that miR-206 could regulate the expression of GOLPH3 protein. Down-regulation of miR-206 or overexpression of GOLPH3 could reverse the inhibition of proliferation and apoptosis of AGS and MKN-45 cells by remifentanil.
Remifentanil could inhibit the proliferation and induce apoptosis of AGS and MKN-45 cells by regulating the expression of miR-206 and GOLPH3.
- Citation: Chen XJ, Shen XN, Chen L. Remifentanil regulates proliferation and apoptosis of gastric cancer cells by regulating miR-206/GOLPH3. Shijie Huaren Xiaohua Zazhi 2019; 27(4): 228-237
- URL: https://www.wjgnet.com/1009-3079/full/v27/i4/228.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i4.228
胃癌(gastric cancer, GC)是世界常见的消化道恶性肿瘤, 据统计[1], 2015年全球GC新发病例约130万, 死亡82万例; 其中, 仅我国GC新发病例就高达67万, 死亡50万例, 已成为继肺癌之后的第二大常见恶性肿瘤[2]. 采用手术除术、放化疗等综合治疗方式治疗早期GC患者效果显著, 5年生存率达90%[3-5]; 但因GC早期缺乏明显症状, 多数患者就诊时已处于进展期, 大大增加了治疗难度, 导致患者预后较差, 仅有10-12 mo的中位生存期, 总体5年生存率约10%[6]. 针对晚期GC治疗的瓶颈是易产生耐药性. 因此, 新药的研发对晚期GC治疗具有重要意义. 瑞芬太尼(Remifentanil)是一种μ型受体激动剂, 具镇痛作用, 能够通过组织和血液中的非特异性酯酶进行代谢, 为临床上常用的麻醉剂[7]. 多项研究[8,9]表明, 瑞芬太尼能够有效体外抑制结肠癌、乳腺癌等肿瘤细胞增殖, 同时促进细胞凋亡. 本研究通过使用40 nmol/L瑞芬太尼处理AGS、MKN-45人GC细胞检测细胞活力和凋亡, 以探讨瑞芬太尼对AGS、MKN-45细胞增殖、凋亡的影响及其作用靶点.
AGS、MKN-45人GC细胞购自ATCC; 胎牛血清、RPMI1640培养液、胰蛋白酶购自美国Gibco-BRL公司; MTT购自美国Sigma公司; 二甲基亚砜(DMSO)、ECL发光液、RIPA裂解液、PVDF膜购自北京Solarbio公司; Lipofectamine TM 2000转染试剂购自美国Invitrogen公司; GOLPH3 siRNA、control siRNA由山东维真生物科技有限公司公司设计合成; pcDNA-GOLPH3过表达载体由金瑞斯生物科技公司构建; miR-206 mimics、control mimics、miR-206 inhibitors、control inhibitors由上海吉玛基因公司设计合成; 兔抗GOLPH3、GAPDH多克隆抗体、辣根过氧化物酶(HRP)标记的山羊抗兔IgG购自美国Abcam公司; Annexin V-FITC/PI细胞凋亡检测试剂盒购自上海前尘生物科技有限公司; 双荧光素酶报告基因检测系统购自美国Promega公司; Trizol试剂购自北京天根生化科技有限公司; TaKaRa反转录试剂盒、TaKaRa实时荧光定量试剂盒购自宝生物工程(大连)有限公司; NanoDrop微量核酸测定仪购自美国赛默飞世尔科技公司; ELx808吸收光酶标仪购自赛默飞世尔科技有限公司; Forma TM Steri-cycle TM i160 CO2细胞培养箱购自美国Thermo公司; CFX96 Touch TM荧光定量PCR检测系统、ChemiDoc TM MP凝胶成像系统购自美国Bio-Rad公司.
1.2.1 细胞培养与分组: 将AGS、MKN-45细胞放入37 ℃ 恒温水浴锅中以融化细胞, 800 g离心收集. 使用含10% 胎牛血清的RPMI 1640培养液于37 ℃、5% CO2饱和湿度条件下培养, 取对数生长期的细胞, 胰酶消化后重悬, 调整细胞悬液浓度为1×105个/mL并接种于24孔板. 待细胞生长至汇合度约45%, 按照Lipofectamine 2000转染试剂说明书分别将miR-206 mimics、control mimics、miR-206 inhibitors、control inhibitors、GOLPH3 siRNA、control siRNA、pcDNA、pcDNA-GOLPH3转染至AGS、MKN-45细胞, 并依次标记为miR-206组、miR-NC组、anti-miR-206组、anti-miR-NC组、si-GOLPH3组、si-NC组.
将AGS、MKN-45细胞分为Re组、Con组、Re+anti-miR-206组、Re+anti-miR-NC组、Re+pcDNA-GOLPH3组、Re+pcDNA组. 处理方法: 使用0.9%氯化钠完全溶解瑞芬太尼并使用无菌过滤器过滤. Re组: 细胞培养液中加入瑞芬太尼溶液并调整终浓度为40 nmol/L[9]; Con组: 细胞培养液中加入等量0.9%氯化钠; Re+anti-miR-206组: 转染miR-206 inhibitors的细胞使用含终浓度为40 nmol/L瑞芬太尼的培养液培养; Re+anti-miR-NC组: 转染control inhibitors的细胞使用含终浓度为40 nmol/L瑞芬太尼的培养液培养; Re+pcDNA-GOLPH3组: 转染pcDNA-GOLPH3的细胞使用含终浓度为40 nmol/L瑞芬太尼的培养液培养; Re+pcDNA组: 转染pcDNA的细胞使用含终浓度为40 nmol/L瑞芬太尼的培养液培养. 每组6个复孔, 实验重复3次.
1.2.2 qRT-PCR: 收集各组对数生长期的细胞, 充分研磨后加入Trizol试剂提取总RNA, 微量核酸测定仪检测其纯度和浓度. 使用TaKaRa反转录试剂盒将RNA反转录成cDNA, 按照TaKaRa 荧光定量试剂盒使用说明配制反应体系, 以GAPDH为内参置于实时荧光定量PCR仪上进行扩增, 每个样品重复3次, 实验结果分析采用F = 2-△△Ct法. GAPDH引物: 正向: 5'-CACCATTGGCAATGAGCGGTTC-3', 反向: 5'-AGGTCTTTGCGGATGTCCACGT-3'; miR-206引物: 正向: 5'-AGTTCACCTTGATGCCGTTCT-3', 反向: 5'-CAGTGCTTCAGCC GCTACCC-3'; GOLPH3引物: 正向: 5'-AAGCCGTTCTTGACAAATGG-3', 反向: 5'- AGGGGCCATCCACAGTCCTTC-3'.
1.2.3 MTT法检测细胞活力: 分别在各组细胞培养24 h、48 h、72 h时加入20 μL浓度为5 mg/mL的MTT, 继续孵育4 h; 去除多余培养液后加入150 μL DMSO振荡反应10 min, 酶标仪检测490 nm处吸光度(OD)值. 细胞活力 = (对照组OD值-实验组OD值)/实验组OD值×100%.
1.2.4 细胞凋亡检测: 取生长状态良好的各组细胞, 0.25%胰蛋白酶消化后4 ℃、300 g离心10 min, 弃上清收集细胞. 使用Annexin V-FITC/PI细胞凋亡检测试剂盒加入5 μL Annexin V-FITC和10 μL PI, 轻轻混匀后室温避光孵育15 min, 流式细胞仪检测细胞凋亡.
1.2.5 Western blot: 收集各组细胞, 加入RIPA裂解液置于冰上裂解, 4 ℃, 12000 g离心10 min, 取上清液. 将蛋白样品进行SDS-PAGE电泳后转至PVDF膜上, 5%脱脂奶粉封闭液室温封闭1 h. 分别加入兔抗GOLPH3(1:1000)和GAPDH(1:1000)多克隆抗体4 ℃孵育过夜, TBST洗膜3次, 每次10 min; 加入HRP标记的山羊抗兔IgG(1:5000)室温孵育2 h, TBST洗涤; ECL发光显影, 每个蛋白样品重复3次.
1.2.6 双荧光素酶报告基因实验: Targetscan在线预测发现GOLPH3 3'UTR上存在miR-149的结合位点, 为进一步验证GOLPH3是否是miR-206的靶基因, 按照Lipofectamine 2000使用说明书, 将构建好的野生型GOLPH3 3'UTR-WT(含GOLPH3 3'UTR片段)和突变型GOLPH3 3'UTR-MUT(GOLPH3 3'UTR片段突变体)载体分别与miR-206 mimics、control mimics共转染至AGS细胞, 培养24 h后检测荧光素酶活性, 相对荧光强度 = 萤火虫荧光强度/海肾荧光强度.
统计学处理 使用GraphPad Prism 7和SPSS 22.0进行数据分析, 实验数据以mean±SD表示, 两组间数据比较采用LSD-t检验, 多组间数据比较采用单因素方差分析, P<0.05具有统计学意义.
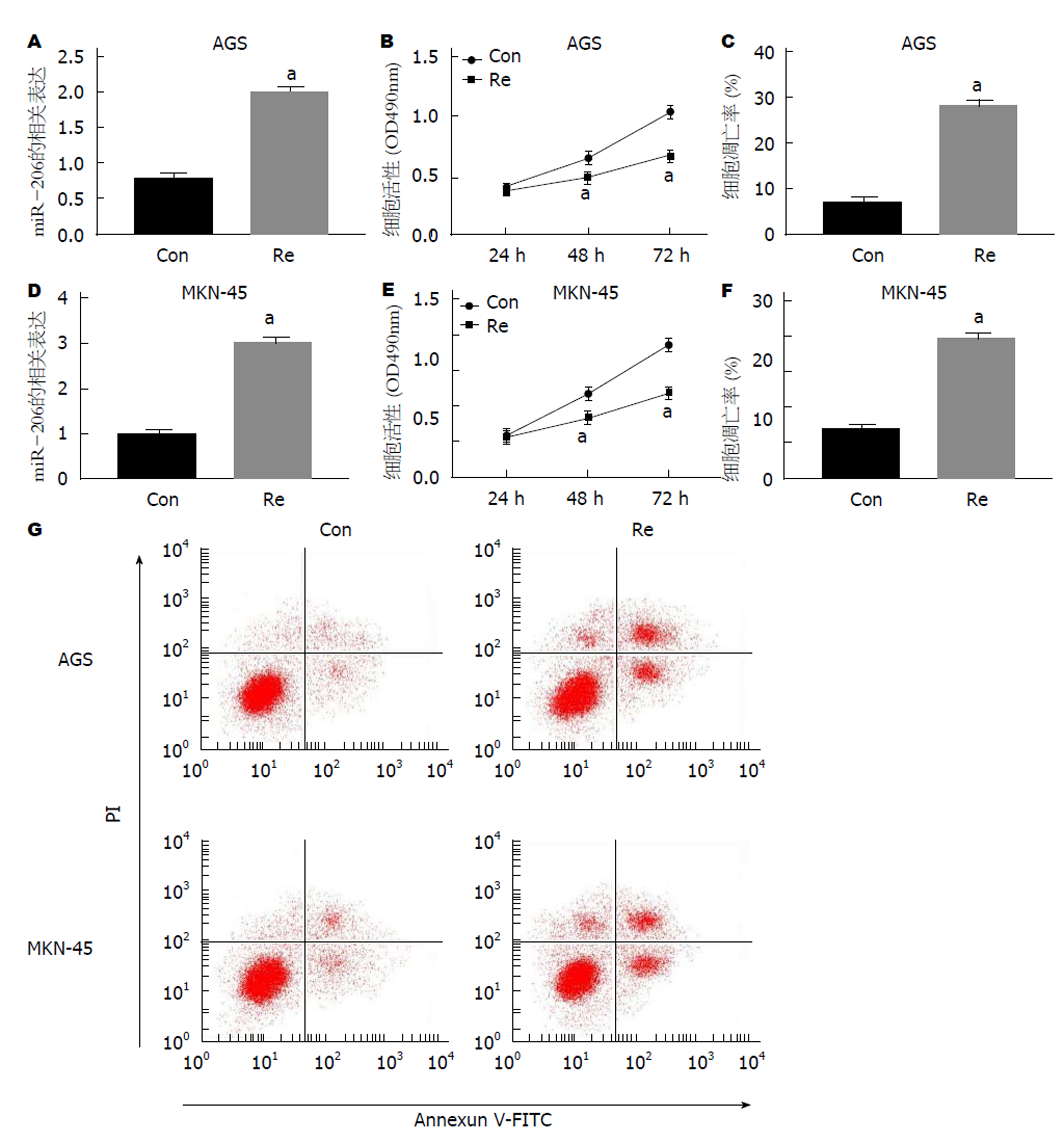
以40 nmol/L瑞芬太尼处理AGS和MKN-45细胞, 细胞中miR-206表达均上调(P<0.05), 对比Con组, Re组细胞活力均显著降低(P<0.05), 凋亡率均显著升高(P<0.05)(图1).
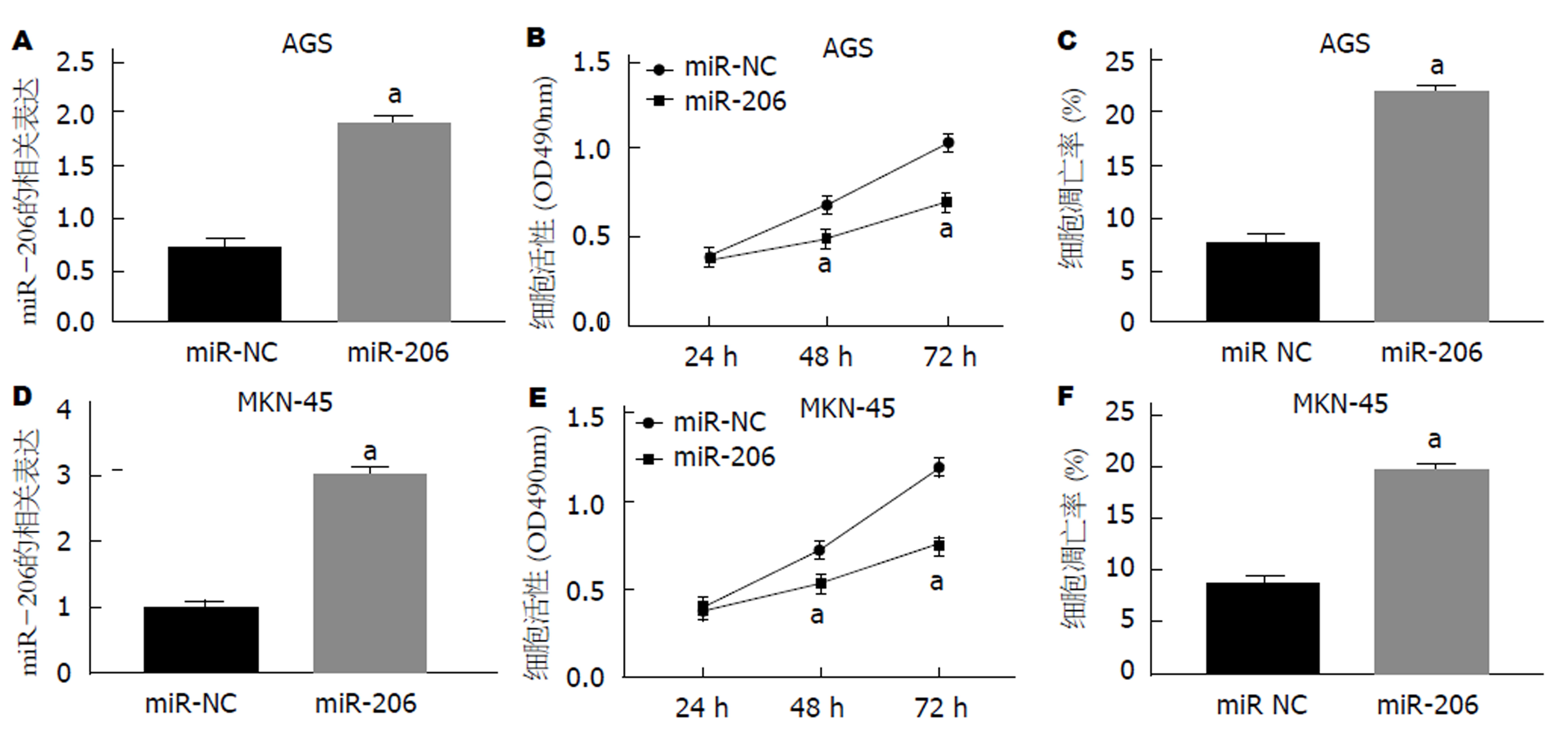
将miR-206 mimics转染至AGS和MKN-45细胞后, 细胞中miR-206表达水平均升高(P<0.05), 细胞活力均显著降低(P<0.05), 同时细胞凋亡率均显著上升(P<0.05)(图2).
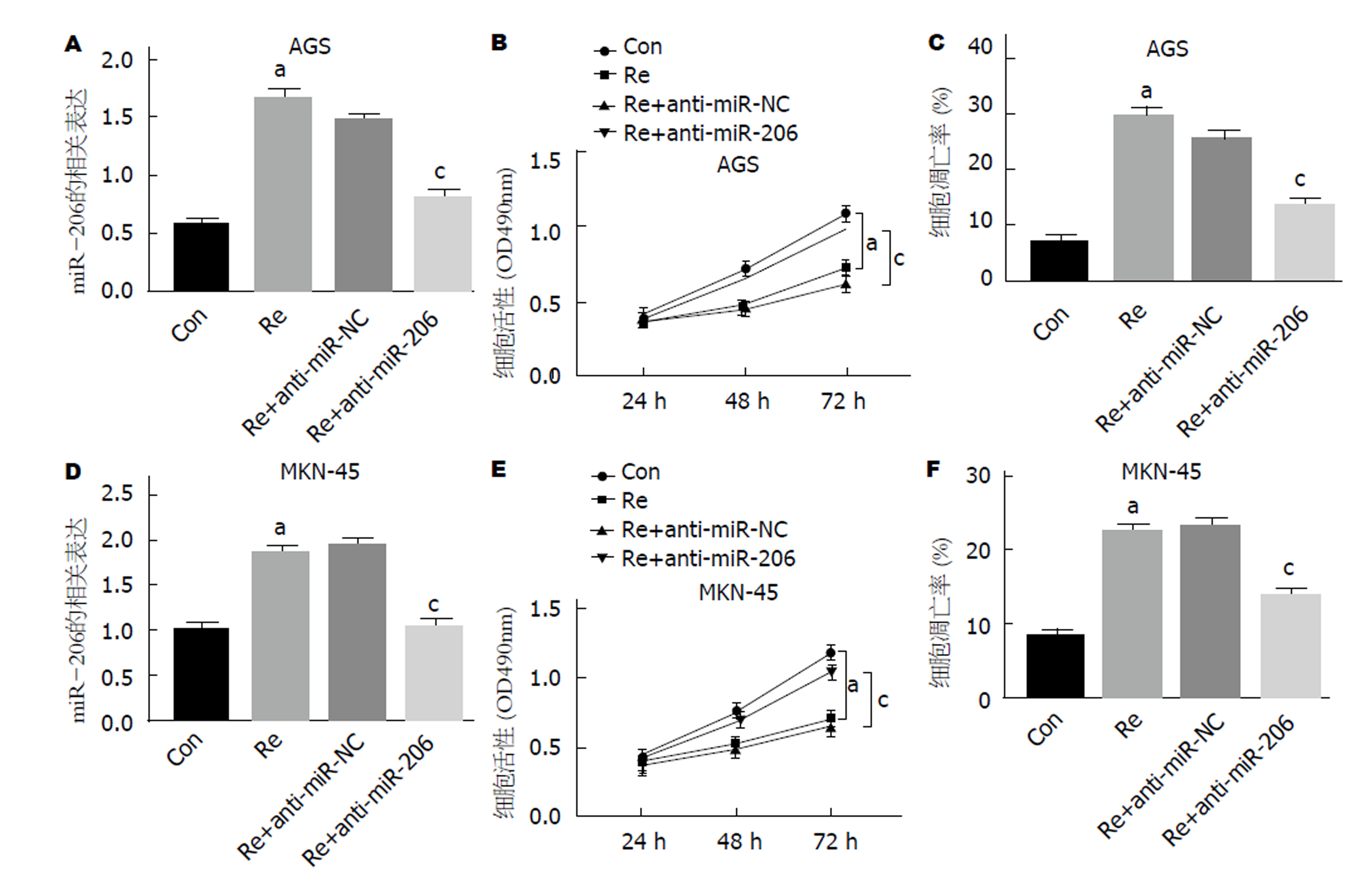
由图3可知, 40 nmol/L瑞芬太尼能够有效促进AGS和MKN-45细胞中miR-206表达(P<0.05), 抑制细胞活力(P<0.05)并诱导细胞凋亡(P<0.05), 而将miR-206 inhibitors转染至AGS和MKN-45细胞后, 细胞中miR-206表达水平、细胞活力和凋亡率均有所恢复(P<0.05).
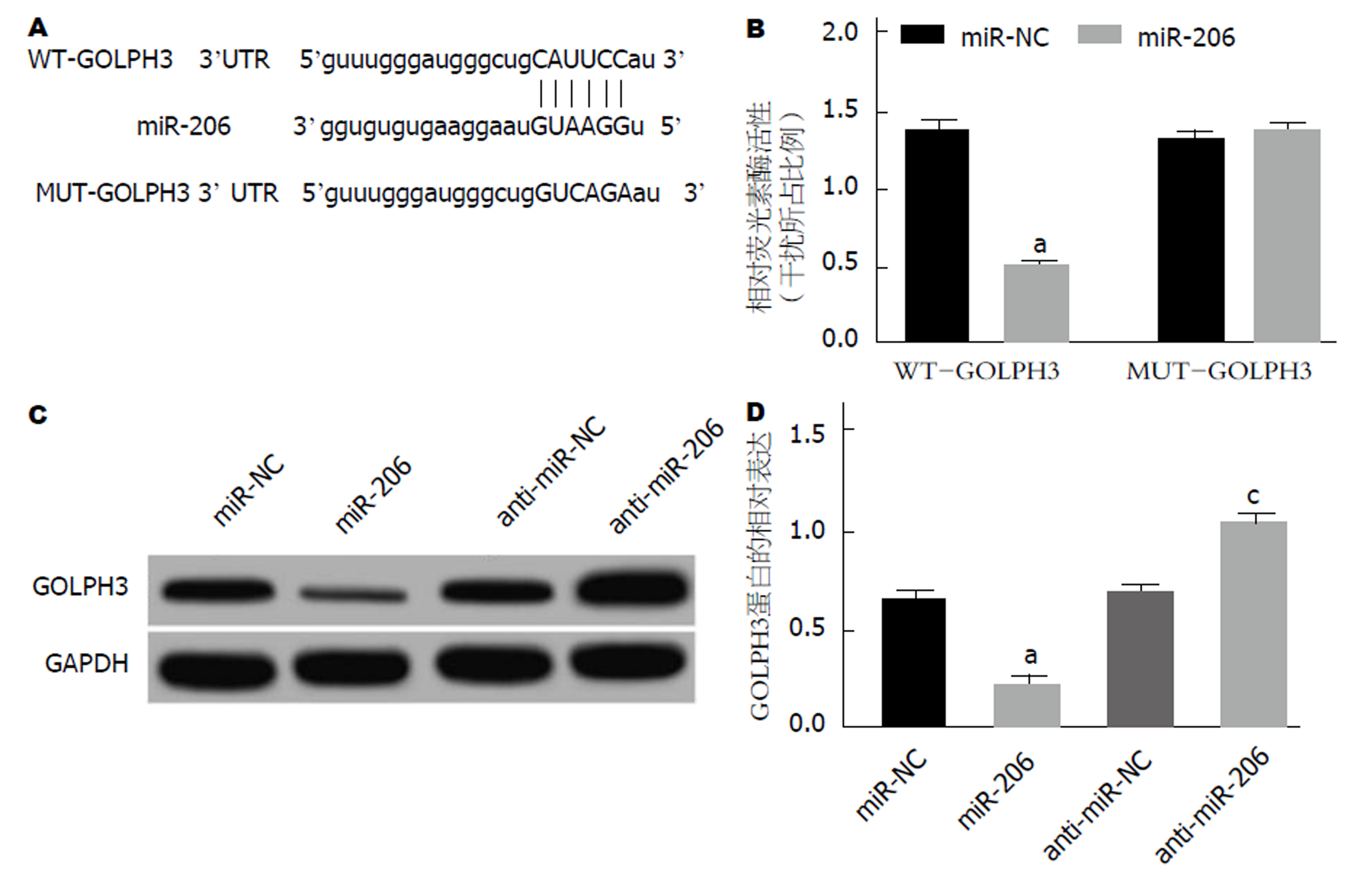
通过Target scan预测发现, GOLPH3 3'UTR上存在miR-206的结合位点, 同时, miR-206 mimics与GOLPH3 3'UTR野生型质粒共转染, 荧光素酶活性降低(P<0.05), 而与GOLPH3 3'UTR突变型质粒共转染, 荧光素酶活性无明显变化; 并且miR-206可把调控GOLPH3蛋白表达(P<0.05)(图4).
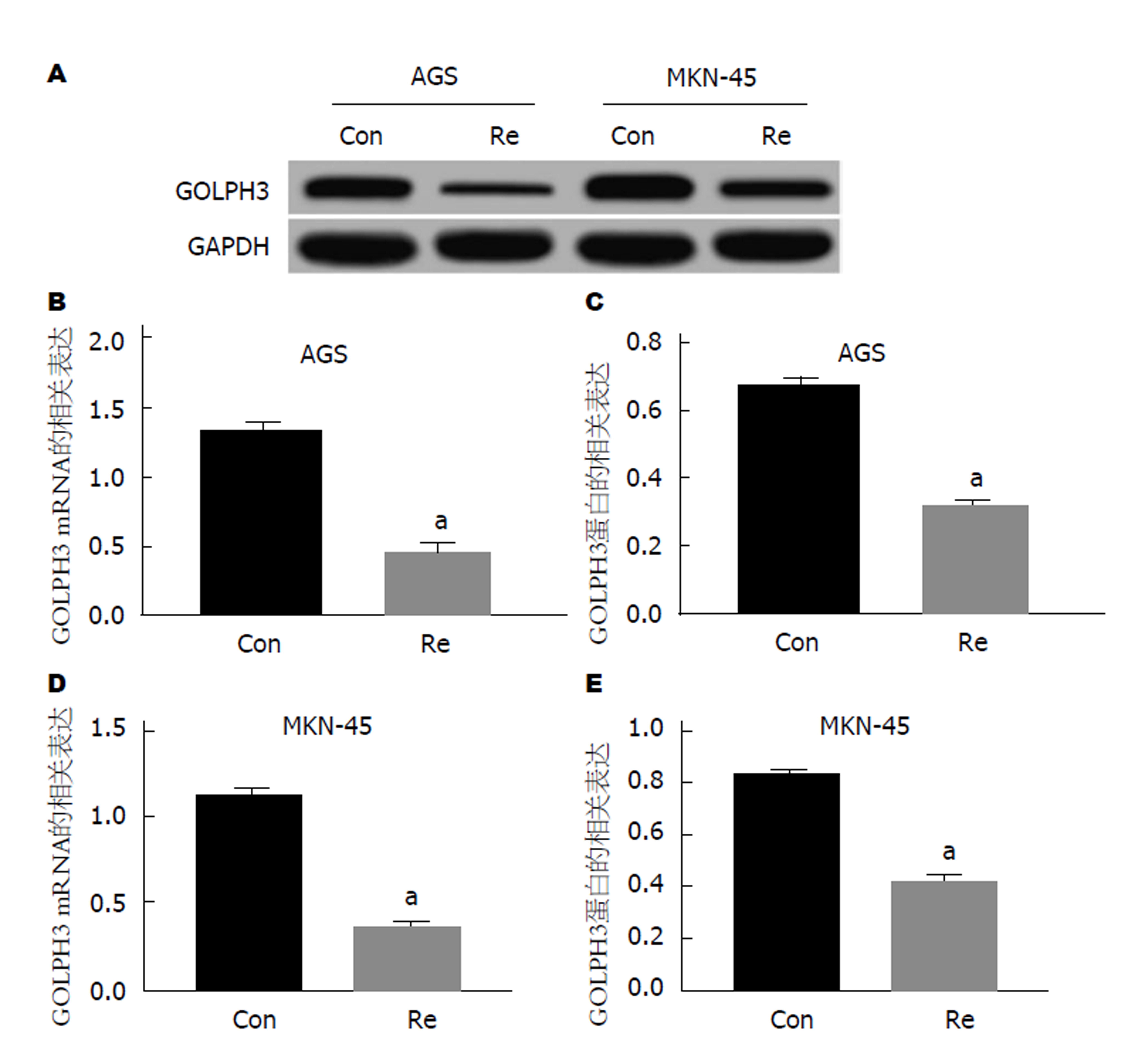
以40 nmol/L瑞芬太尼处理AGS和MKN-45细胞, 细胞中GOLPH3在mRNA和蛋白水平的表达较Con组均显著下调(P<0.05)(图5).
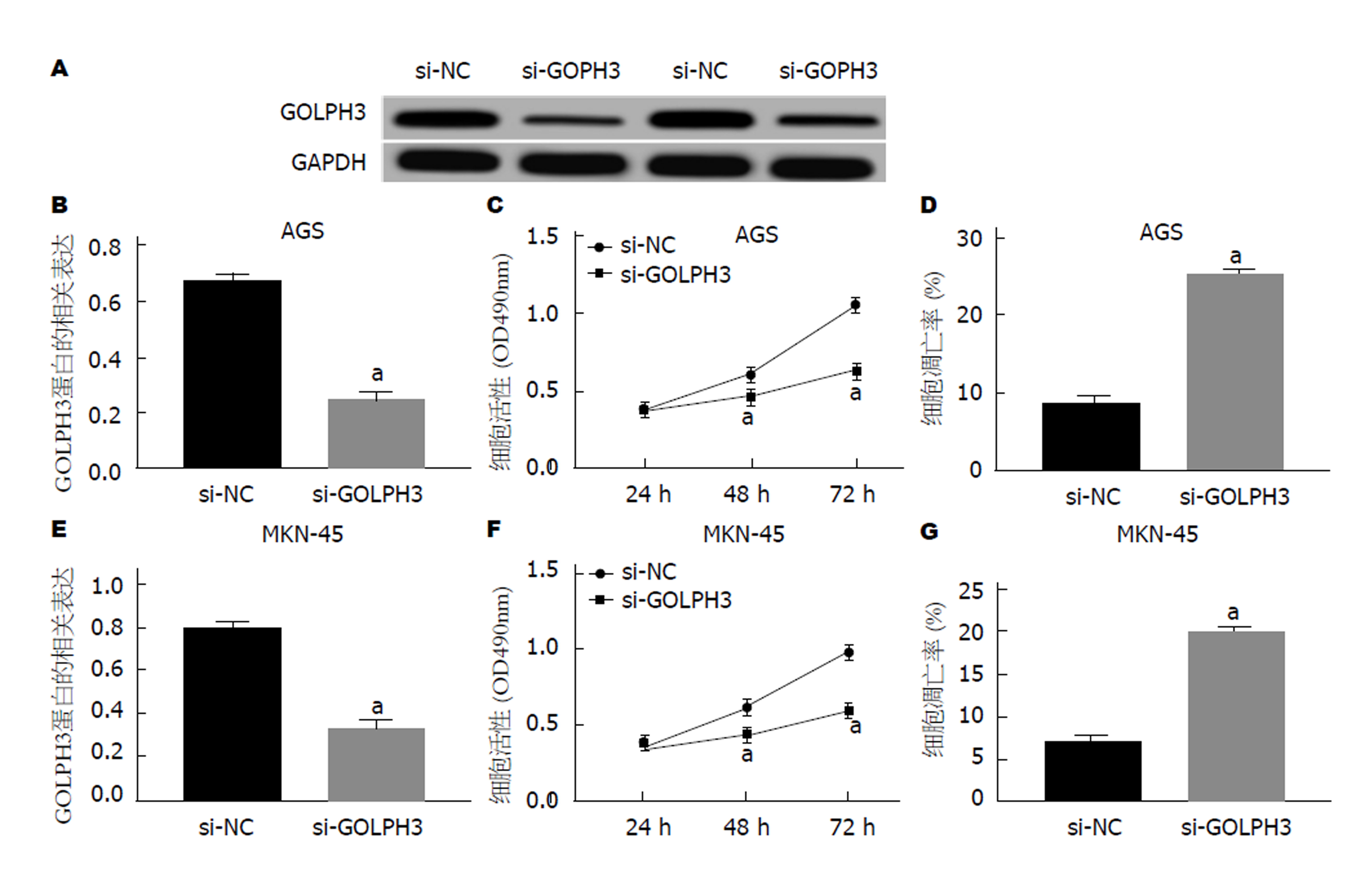
将GOLPH3 siRNA转染至AGS和MKN-45细胞后, 细胞中GOLPH3蛋白表达均下调(P<0.05), 对比si-NC组, si-GOLPH3组细胞活力均显著降低(P<0.05)而凋亡率均显著升高(P<0.05)(图6).
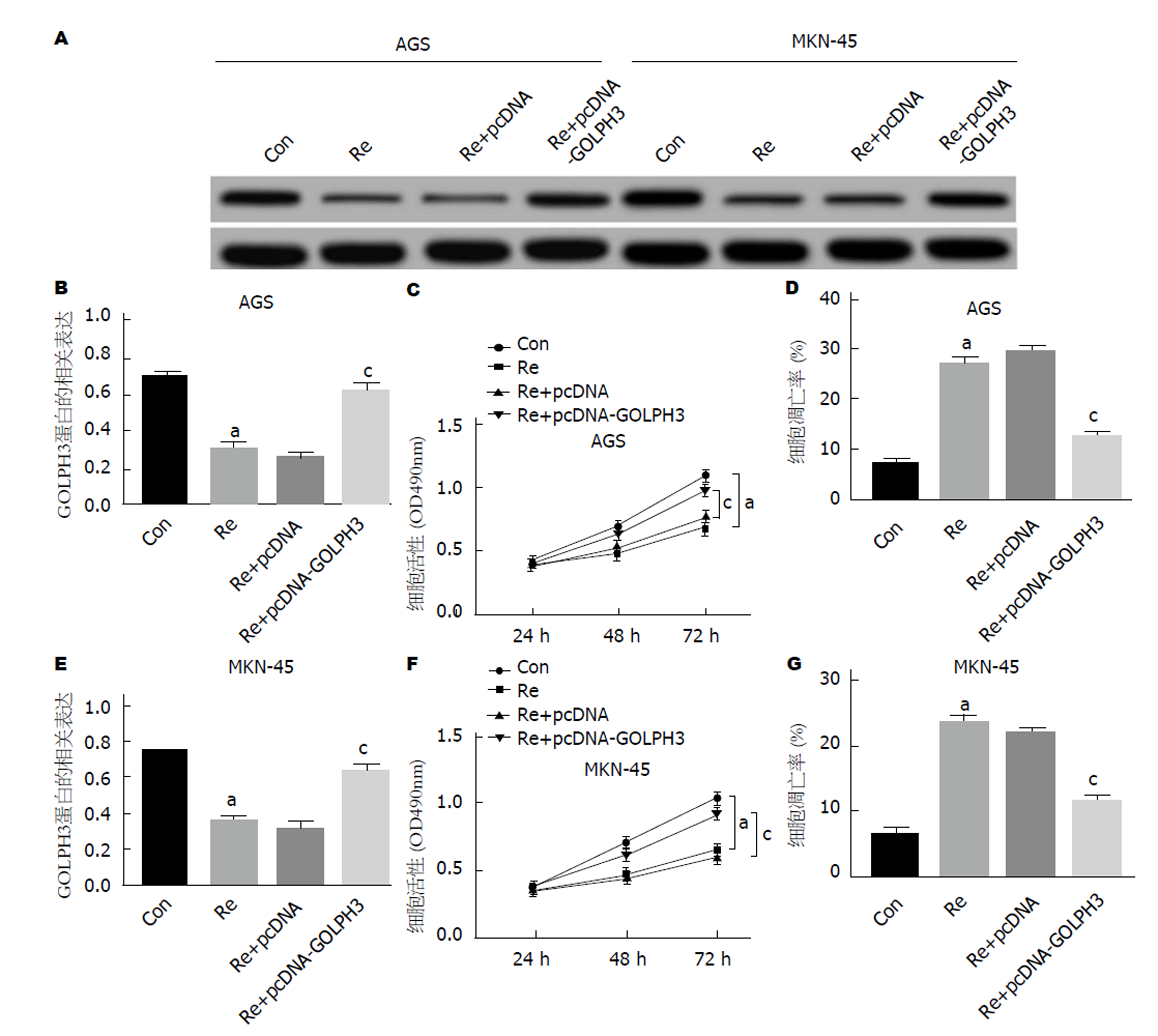
由图7可知, 40 nmol/L瑞芬太尼能够有效抑制AGS和MKN-45细胞中GOLPH3表达和细胞活力(P<0.05)、促进细胞凋亡(P<0.05); 而将pcDNA-GOLPH3转染至AGS和MKN-45细胞进行预处理后, 细胞中GOLPH3蛋白表达水平、细胞活力和凋亡率均基本恢复至正常水平(P<0.05).
阿片类镇痛药在癌症患者手术治疗中具有广泛的应用, 其除镇痛外, 还具调节癌细胞增殖的作用[10,11]. 有研究报道, 吗啡具有促进癌细胞凋亡的作用, 瑞芬太尼可抑制肺癌细胞生长[12]. 本研究运用qRT-PCR、Western blot检测了瑞芬太尼处理的GC细胞AGS、MKN-45中miR-206、GOLPH3的表达发现, 瑞芬太尼可上调miR-206的表达, 下调GOLPH3的表达.
微小RNA(microRNA, miRNA)是一类长度约18~22nt的内源性非编码RNA分子, 能够通过与靶mRNA 3'UTR区互补配对使其降解或抑制其·译过程, 从而调控多种基因表达, 参与细胞生长、分化、胚胎发育、炎症反应、免疫应答等生理过程, 与人类肿瘤的发生发展密切相关[13]. 已有证据[14,15]显示, miR-519d、miR-138和miR-204等多种RNA分子在GC组织中异常表达, 其表达水平与肿瘤临床分期、淋巴结转移有关, 能够通过调节细胞周期、基质金属蛋白酶表达抑制细胞增殖和转移, 从而发挥抑癌作用. 而miR-206由于首次在骨骼肌中被发现, 被认为与骨骼肌的生理病理过程有关, 其在骨骼肌发育及相关疾病中的研究较多[16]. 但近年来发现, miR-206在肺脏、肝脏等组织器官中也有表达, 并且在非小细胞肺癌、肺腺癌、肝癌、鼻咽癌等肿瘤组织或细胞中低表达, 上调miR-206表达可通过阻滞细胞周期、促进细胞凋亡、抑制细胞转移和血管生成发挥抑癌作用[17-19]. 此外, Wang等[20]研究发现, miR-206能够通过靶向调节三磷酸腺苷结合盒转运子B亚家族成员1(ABCB1)表达降低乳腺癌细胞对紫杉醇的耐药性. 而在GC中, 已有研究[21]表明, miR-206在GC组织中低表达, 过表达miR-206能够抑制肿瘤起始细胞的形成, 并增强5-氟尿嘧啶的抗肿瘤作用.
本文检测发现, 过表达miR-206同样能够抑制细胞活力并诱导凋亡; 而下调miR-206表达则逆转瑞芬太尼对AGS、MKN-45细胞活力的抑制和凋亡的促进作用. 提示, 瑞芬太尼对AGS、MKN-45细胞增殖和凋亡的抑制或促进作用可能是通过调节miR-206表达来完成. 进一步预测miR-206的靶基因发现, miR-206能够与GOLPH3 3'UTR区的部分序列互补配对; 同时, 双荧光素酶报告基因实验和Western blot结果显示, miR-206能够靶向调控GOLPH3蛋白表达. 提示, GOLPH3可能在瑞芬太尼调节miR-206表达抑制AGS、MKN-45细胞增殖并诱导凋亡的过程中发挥重要作用.
GOLPH3是一种新型癌基因, 定位于人染色体5p13.3, 主要存在于高尔基体囊泡反面的膜外围、小管、质膜等部位, 参与蛋白糖基化修饰、促进蛋白从高尔基体到细胞膜的囊泡运输、维持高尔基体结构并影响高尔基体分泌功能[22]. 多项研究[23,24]表明: GOLPH3在结肠癌、上皮性卵巢癌等多种实体瘤组织中高表达, 其表达水平与肿瘤生长、患者预后有关. GOLPH3能够通过磷酸化哺乳动物雷帕霉素靶蛋白(mTOR)复合体的特定底物激活mTOR信号传导, 而mTOR信号通路与细胞生长、增殖、能量代谢等有关; 并激活Wnt信号通路, 促进癌细胞增殖, 减少细胞凋亡; 对食管鳞状细胞癌、肝癌等消化道肿瘤发挥促进作用[25,26]. 已有证据[27]表明, miR-134能靶向抑制GOLPH3表达从而抑制GC细胞增殖, 过表达GOLPH3则逆转miR-134对细胞增殖的抑制作用. 本文中, 沉默GOLPH3表达可有效抑制细胞活力并促进细胞凋亡; 过表达GOLPH3则逆转瑞芬太尼对细胞活力的抑制和凋亡的促进作用.
总之, 瑞芬太尼可能是通过miR-206靶向调控GOLPH3表达、同时下调GOLPH3表达, 从而抑制AGS、MKN-45细胞活力、诱导细胞凋亡; 单独过表达miR-206或敲减GOLPH3, 同样能够抑制细胞活力并诱导凋亡. 这一研究结果有望为瑞芬太尼用于GC的治疗及miR-206和GOLPH3作为GC治疗的新靶点提供实验基础.
近些年, 瑞芬太尼在癌症治疗中的新功能得到不断开发, 但其对胃癌(gastric cancer, GC)细胞的作用机制国内外尚未有人研究.
本研究旨在研究瑞芬太尼对GC细胞增殖、凋亡的影响, 并探讨其分子作用机制, 以期望为解决GC治疗过程中的耐药问题提供线索.
探讨瑞芬太尼抑制为癌细胞增殖, 促进凋亡的作用及其机制, 以期为GC的治疗提供新药.
将用40 nmol/L的瑞芬太尼处理的AGS和MKN-45细胞, 分别随机分成miR-206组、miR-NC组、anti-miR-206组、anti-miR-NC组、GOLPH3组、si-NC组、pcDNA-GOLPH3组、pcDNA组、Re组、Con组、Re+anti-miR-206组、Re+anti-miR-NC组、Re+pcDNA-GOLPH3组、Re+pcDNA组, 用MTT法、流式细胞术分析GC细胞的增殖、凋亡, Western blot检测GC细胞中GOLPH3的蛋白表达, 双荧光素酶报告基因检测实验验证miR-206与GOLPH3的靶向关系.
本研究建立瑞芬太尼治疗的GC细胞发现, 瑞芬太尼通过上调miR-206, 下调GOLPH3, 发挥抑制GC细胞增殖, 诱导其凋亡的治疗作用. 上调GOLPH3或下调miR-206均能逆转瑞芬太尼对GC的治疗功效.
瑞芬太尼可抑制GC细胞的增殖, 诱导为癌细胞的凋亡, 其可能与调控miR-206/GOLPH3通路有关, 提示瑞芬太尼具有治疗GC的潜力.
本研究仅在体外研究瑞芬太尼对GC细胞增殖、凋亡的影响, 后期还需增加瑞芬太尼对GC细胞的增殖、凋亡的裸鼠体内对比实验, 以更清晰的展示瑞芬太尼对GC细胞的治疗价值, 也为瑞芬太尼治疗GC提供更充分的理论依据.
| 1. | Fitzmaurice C, Allen C, Barber RM, Barregard L, Bhutta ZA, Brenner H, Dicker DJ, Dandona R, Dandona L, Fleming T, Forouzanfar MH, Hancock J, Hay RJ, Huynh C, Hosgood HD, Johnson CO, Jonas JB, Khubchandani J, Kumar GA, Kutz M, Lan Q, Larson HJ, Liang X, Lim SS, Lopez AD, MacIntyre MF, Marczak L, Marquez N, Mokdad AH, Pinho C, Pourmalek F, Salomon JA, Sanabria JR, Sandar L, Sartorius B, Schwartz SM, Shackelford KA, Shibuya K, Stanaway J, Steiner C, Sun J, Takahashi K, Vollset SE, Vos T, Wagner JA, Wang H, Westerman R, Zeeb H, Zoeckler L, Ahmed MB, Alabed S, Alam NK, Aldhahri SF, Alem G, Alemayohu MA, Ali R, Amare A, Amoako Y, Artaman A, Asayesh H, Atnafu N, Awasthi A, Saleem HB, Barac A, Bedi N, Bensenor I, Berhane A, Betsu B, Binagwaho A, Boneya D, Campos-Nonato I, Chiang P, Chibueze C, Chitheer A, Choi JY, Cowie B, Damtew S, das Neves J, Dey S, Dharmaratne S, Dhillon P, Ding E, Driscoll T, Ekwueme D, Endries AY, Farvid M, Farzadfar F, Fernandes J, Fischer F, Gebru A, Gopalani S, Hailu A, Horino M, Horita N, Husseini A, Huybrechts I, Inoue M, Islami F, Jakovljevic M, James S, Javanbakht M, Jee SH, Kasaeian A, Kedir MS, Khader YS, Khang YH, Kim D, Leigh J, Linn S, Lunevicius R, El Razek HMA, Malekzadeh R, Malta DC, Marcenes W, Markos D, Melaku YA, Meles KG, Mendoza W, Mengiste DT, Meretoja TJ, Miller TR, Mohammad KA, Mohammadi A, Mohammed S, Nagel G, Nand D, Nolte S, Ogbo FA, Oladimeji KE, Oren E, Pa M, Park EK, Pereira DM, Plass D, Qorbani M, Radfar A, Rafay A, Rahman M, Rana SM, Søreide K, Satpathy M, Sawhney M, Sepanlou SG, Shaikh MA, She J, Shiue I, Shore HR, Shrime MG, So S, Soneji S, Stathopoulou V, Stroumpoulis K, Sufiyan MB, Sykes BL, Tadese F, Tedla BA, Tessema GA, Thakur JS, Tran BX, Ukwaja KN, Vlassov VV, Weiderpass E, Yebyo HG, Yimam HH, Yonemoto N, Younis MZ, Yu C, Zaidi Z, Zenebe ZM, Naghavi M, Hunter-Merrill R, Chimed-Orchir O, Abd-Allah M, Naghavi F, Al-Raddadi R, Castañeda-Orjuela C, Catalá-López F, G/Hiwot TT, Uzochukwu BSC, Wubshet Terefe M, Tabarés-Seisdedos R, Zaki MES, Murray CJL, Le Nguyen Q, Bernabé E, Moradi-Lakeh M; Global Burden of Disease Cancer Collaboration. Global, Regional, and National Cancer Incidence, Mortality, Years of Life Lost, Years Lived With Disability, and Disability-Adjusted Life-years for 32 Cancer Groups, 1990 to 2015: A Systematic Analysis for the Global Burden of Disease Study. JAMA Oncol. 2017;3:524-548. [PubMed] [DOI] |
| 2. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 3. | Quan Y, Huang A, Ye M, Xu M, Zhuang B, Zhang P, Yu B, Min Z. Comparison of laparoscopic versus open gastrectomy for advanced gastric cancer: an updated meta-analysis. Gastric Cancer. 2016;19:939-950. [PubMed] [DOI] |
| 4. | Yuan DD, Zhu ZX, Zhang X, Liu J. Targeted therapy for gastric cancer: Current status and future directions (Review). Oncol Rep. 2016;35:1245-1254. [PubMed] [DOI] |
| 5. | Izuishi K, Mori H. Recent Strategies for Treating Stage IV Gastric Cancer: Roles of Palliative Gastrectomy, Chemotherapy, and Radiotherapy. J Gastrointestin Liver Dis. 2016;25:87-94. [PubMed] [DOI] |
| 6. | Digklia A, Wagner AD. Advanced gastric cancer: Current treatment landscape and future perspectives. World J Gastroenterol. 2016;22:2403-2414. [PubMed] [DOI] |
| 7. | Glass PS, Gan TJ, Howell S. A review of the pharmacokinetics and pharmacodynamics of remifentanil. Anesth Analg. 1999;89:S7-14. [PubMed] |
| 9. | 赵 莉, 王 志红, 李 学斌, 徐 桂萍. 瑞芬太尼对人结肠癌COL0205细胞增殖及凋亡的影响. 国际麻醉学与复苏杂志. 2017;38:401-403. [DOI] |
| 11. | 周 成茂, 阮 林. 阿片类受体在蛋白激酶B通路相关肿瘤复发中的作用. 国际麻醉学与复苏杂志. 2015;36:479-480. [DOI] |
| 13. | Rupaimoole R, Slack FJ. MicroRNA therapeutics: towards a new era for the management of cancer and other diseases. Nat Rev Drug Discov. 2017;16:203-222. [PubMed] [DOI] |
| 14. | Li YY, Shao JP, Zhang SP, Xing GQ, Liu HJ. miR-519d-3p Inhibits Cell Proliferation and Invasion of Gastric Cancer by Downregulating B-Cell Lymphoma 6. Cytogenet Genome Res. 2018;154:12-19. [PubMed] [DOI] |
| 15. | Wang Y, Zhang H, Ge S, Fan Q, Zhou L, Li H, Bai M, Ning T, Liu R, Wang X, Deng T, Zhang L, Ying G, Ba Y. Effects of miR1385p and miR2045p on the migration and proliferation of gastric cancer cells by targeting EGFR. Oncol Rep. 2018;39:2624-2634. [PubMed] [DOI] |
| 17. | Pan JY, Sun CC, Bi ZY, Chen ZL, Li SJ, Li QQ, Wang YX, Bi YY, Li DJ. miR-206/133b Cluster: A Weapon against Lung Cancer? Mol Ther Nucleic Acids. 2017;8:442-449. [PubMed] [DOI] |
| 18. | Pang C, Huang G, Luo K, Dong Y, He F, Du G, Xiao M, Cai W. miR-206 inhibits the growth of hepatocellular carcinoma cells via targeting CDK9. Cancer Med. 2017;6:2398-2409. [PubMed] [DOI] |
| 19. | Wang T, Dong XM, Zhang FL, Zhang JR. miR-206 enhances nasopharyngeal carcinoma radiosensitivity by targeting IGF1. Kaohsiung J Med Sci. 2017;33:427-432. [PubMed] [DOI] |
| 20. | Wang R, Zhang T, Yang Z, Jiang C, Seng J. Long non-coding RNA FTH1P3 activates paclitaxel resistance in breast cancer through miR-206/ABCB1. J Cell Mol Med. 2018;22:4068-4075. [PubMed] [DOI] |
| 21. | Gong YC, Ren GL, Liu B, Li F, Zhao HP, Chen JB, Li YP, Yu HH. miR206 inhibits cancer initiating cells by targeting EHF in gastric cancer. Oncol Rep. 2017;38:1688-1694. [PubMed] [DOI] |
| 22. | Rizzo R, Parashuraman S, D'Angelo G, Luini A. GOLPH3 and oncogenesis: What is the molecular link? Tissue Cell. 2017;49:170-174. [PubMed] [DOI] |
| 23. | Zhou B, Wang G, Gao S, Chen Y, Jin C, Wang Z, Yang Y, Ma Z, Zhang W, Feng X. Expression of GOLPH3 protein in colon cancer tissues and its association with the prognosis of patients. Oncol Lett. 2016;12:3936-3940. [PubMed] [DOI] |
| 24. | Sun J, Yang X, Zhang R, Liu S, Gan X, Xi X, Zhang Z, Feng Y, Sun Y. GOLPH3 induces epithelial-mesenchymal transition via Wnt/β-catenin signaling pathway in epithelial ovarian cancer. Cancer Med. 2017;6:834-844. [PubMed] [DOI] |
| 25. | Wang JH, Yuan LJ, Liang RX, Liu ZG, Li BH, Wen ZS, Huang ST, Zheng M. GOLPH3 promotes cell proliferation and tumorigenicity in esophageal squamous cell carcinoma via mTOR and Wnt/βcatenin signal activation. Mol Med Rep. 2017;16:7138-7144. [PubMed] [DOI] |
| 26. | Liu H, Wang X, Feng B, Tang L, Li W, Zheng X, Liu Y, Peng Y, Zheng G, He Q. Golgi phosphoprotein 3 (GOLPH3) promotes hepatocellular carcinoma progression by activating mTOR signaling pathway. BMC Cancer. 2018;18:661. [PubMed] [DOI] |
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:张砚梁