修回日期: 2017-03-15
接受日期: 2017-03-20
在线出版日期: 2017-04-28
随着计算机技术的发展, 机器学习被深入研究并应用到各个领域, 机器学习在医学中的应用将转换现在的医学模式, 利用机器学习处理医学中庞大数据可提高医生诊断准确率, 指导治疗, 评估预后. 机器学习中的深度学习已广泛应用在病理智能图像诊断方面, 目前在有丝分裂检测, 细胞核的分割和检测, 组织分类中已取得较好成效. 在病理组织学上, 胃高分化腺癌因其组织结构和细胞形态异型性小, 取材标本表浅等原因容易漏诊. 现有的早期胃癌的病理智能图像诊断系统中没有关于腺腔圆度的研究, 圆度测量可以将腺腔结构的不规则, 腺腔扩张等特征转换为具体数值的定量指标, 通过数值大小来进行诊断分析, 为病理诊断提供参考价值.
核心提要: 在病理组织学中主要依据组织结构和细胞形态异型性做诊断, 而胃高分化腺癌因两者异型性较小, 不易诊断; 图像分析可将组织结构和细胞形态异型性等主观指标转换成客观数据.
引文著录: 夏靖媛, 纪小龙. 计算机深度学习与智能图像诊断对胃高分化腺癌病理诊断的价值. 世界华人消化杂志 2017; 25(12): 1043-1049
Revised: March 15, 2017
Accepted: March 20, 2017
Published online: April 28, 2017
With the development of computer technology, machine learning has been applied in various fields. The application of machine learning in medicine will transform the current medical model, and using machine learning to solve the large data in medicine can improve diagnostic accuracy, guide treatment and assess prognosis. Computer-based deep learning has been widely used in intelligent pathological image diagnosis, and it has achieved good results in mitosis detection, nucleus segmentation and detection, and tissue classification. Histopathologically, well-differentiated gastric adenocarcinoma has a high misdiagnosis rate due to a relatively low degree of abnormality in tissue structure and cell morphology as well as superficial sampling. There is no research on the roundness of glandular cavity in the pathological diagnosis of early gastric cancer. Roundness measurement can be used to convert the characteristics of irregular glandular cavity and glandular cavity expansion into a specific quantitative index, which is helpful for the pathological diagnosis.
- Citation: Xia JY, Ji XL. Computer-based deep learning and intelligent image diagnosis for pathological diagnosis of well-differentiated gastric adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2017; 25(12): 1043-1049
- URL: https://www.wjgnet.com/1009-3079/full/v25/i12/1043.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i12.1043
在过去十多年中, 医疗诊断的性质由于患者可用性数据的急剧增多而迅速改变, 尤其是精准医疗计划的提出后, 使用大数据对疾病进行精确诊断与分类从而达到个性化精准治疗得到越来越多人的关注[1,2]. 因此机器学习出现在医学的各个领域, 以辅助诊断, 指导治疗, 评估预后[3-5]. 机器学习在图像诊断, 尤其是病理图像诊断方面的应用而随着数字病理的出现而飞速发展. 病理智能图像诊断可得到客观定量资料, 结果具有可重复性, 能够提高诊断准确率, 减少工作量, 是病理未来的发展方向. 我国是胃癌高发国, 在组织学上胃的高分化腺癌的组织结构和细胞形态异型性较小, 不易做出诊断, 本文关于智能图像诊断对胃高分化腺癌病理诊断相关研究作一述评.
大数据将会转变医学模式已不是新消息, 随着精准医疗计划的提出, 对大数据科学的关注也日益增多[6]. 当然, 数据本身没有任何意义, 他必须通过某种算法来分析以应用, 因此我们要将注意力转移到机器学习这一领域. 机器学习是用数据或以往的经验, 以此优化计算机程序的性能标准[7]. 医学中基于计算机的算法相当于专家系统, 可以根据相关知识规则给出相应结论. 机器学习被广泛应用并在许多学科中是解决复杂问题不可或缺的工具; 在生物医学中, 机器学习可以从基因序列中预测蛋白质结构和功能, 同时根据患者的临床和微生物组谱中选择出最佳饮食. 同样机器学习将给医学带来无限可能.
在临床医学上, 医生需要处理庞大的数据, 从宏观方面的生理学, 行为表现到实验室检查, 影像结果到微观方面的组织细胞以及基因蛋白, 各部分的复杂性将医学细分为多方面, 机器学习将成为医生更加了解患者必不可少的工具[8,9]. 以肿瘤为例, 定量图像特征分析可以呈现肿瘤的部位、形态、大小、表型及微环境, 这些信息与临床数据结合, 将所有信息整合建立大数据库, 使用机器学习发现各个指标间的相关性, 提高诊断正确率, 同时预测个人疾病发生概率, 指导治疗.
机器学习可帮助临床医生准确评估预后, 目前的预后模式中参数只局限于少数变量, 而机器学习可以直接从电子病历和移动医疗设备中提取数据, 通过上千种变量预测结果. 准确的评估可以及时更改患者的治疗方案.
同时机器学习将取代放射科医生和病理医生的大部分工作. 这些医生根据影像图像或病理组织学图像做出相应诊断. 如今将数字医学图像转换为数据, 使用高通量计算, 可以快速从计算机断层扫描(computed tomography, CT)、核磁共振(nuclear magnetic resonance, NMR), 正电子发射断层扫描(positron emission computed tomography, PET)图像及数字病理图像中提取大量定量特征, 根据预先设定的算法进行定量图像分析得出诊断结果[10].
在病理方面, Beck和他同事介绍的C-Path, 一种计算机辅助医学诊断系统, 将会转变医学和病理对计算机的使用[11]. C-Path通过对癌组织及周围间质中提取的6642种特征进行分析计算, 可得出乳腺癌的分级及预后. 在此基础上研发的病理智能诊断系统Watson, 在生物医学成像的国际研讨会上同病理医生的比赛中, 打败人工诊断而胜出, 这套技术与病理学家的分析结合在一起时诊断准确率可以高达99.5%[12].
同时伴随计算机技术的发展, 近年来数字病理在世界各地快速普及[13], 也为了对应人口增加伴随而来的医疗及相关基础建设需求, 我国数字病理学网路的建构也如火如荼地展开. 目前已开展使用的远程病理诊断系统取得较好效果, 县级或地级市医院对不能明确诊断的案例通过向上级医院申请会诊, 可以快速得到正确诊断结果, 有效弥补地方医院病理医生资源不足现状[14].
在过去十年中, 医学图像分析飞速发展, 同时伴有图像模式识别工具和数据大小的增加. 这些进步促进了定量特征处理的发展, 这些定量特征可将图像转换为可采集数据并对这些数据进行分析来辅助诊断. 但在图像分析诊断方面存在任务方案研发周期长, 一组操作参数只适用于一组数据集等不足之处, 而深度学习可以较好地解决以上问题[15]. 深度学习是机器学习研究中的一个新的领域, 其通过建立、模拟人脑进行分析学习的神经网络, 模仿人脑的机制来解释数据, 例如图像、声音和文本, 是非常适用于数字病理中图像分析诊断的一种学习方法[16].
数字病理中智能图像诊断主要包括检测和计数, 分割, 组织学分类[17,18]. 深度学习算法在数字病理中有丝分裂检测[19], 组织分类[20]和免疫组织化学染色计数[21]已取得较好成效, 目前深度学习在数字病理中较好的应用包括检测浸润性导管癌[10], 有丝分裂计数[22], 神经元分割[23], 结肠腺体的检测[24], 细胞核的分割[25-27]和检测[28], 脑膜瘤的分类[29], 上皮肿瘤胞核的识别[30], 上皮分割[31]和胶质瘤的分级[32].
智能图像诊断中细胞的计数可以极大降低病理医生繁杂费时的计算工作[33]; 同时因为大部分病理组织标本是良性, 智能图像诊断中的组织学分类可以区分良性组织辅助医生诊断, 病理医生可用更多时间诊断恶性肿瘤或疑难疾病. 如早期胃癌, 误诊率较高, 图像分析可得出定量数据辅助诊断, 减少不同病理医生之间的差异.
我国胃癌死亡率居恶性肿瘤的第3位, 每年新增胃癌患者约40万, 死亡人数约30万, 占全球胃癌死亡人数的1/4[34,35]. 有效降低胃癌死亡率是亟待解决的重大公共卫生问题. 胃癌的预后和分期密切相关, 早期胃癌的5年存活率为90%, 而进展期胃癌的存活率只有10%[36], 因此对于早期胃癌做到早发现早治疗能极大提高生存率. 早期胃癌是指癌组织仅局限于胃黏膜层或黏膜下层, 不论有无淋巴结转移. 在日本和韩国, 因开展的无症状人群的大规模筛查活动, 早期胃癌的检出率占全部胃癌的比例分别为70%和50%, 而中国早期胃癌的检出率只有不到10%[37].
胃癌在人群中发病率较低[38], 目前尚无进行全体人群普查的简单有效的诊断方法, 因此只能对胃癌高危人群进行筛查. 在胃癌的众多检查方法中内镜下活检后做病理组织学检查是目前胃癌的诊断的金标准.
根据病理组织学(WHO分型)可以将胃癌分为以下常见类型: 乳头状腺癌、管状腺癌、黏液腺癌、印戒细胞癌、腺鳞癌、鳞状细胞癌、小细胞癌、未分化癌[39]. 其中管状腺癌约占80%, 管状腺癌根据分化程度可以分为高分化、中分化、低分化腺癌[40], 早期胃癌中高分化腺癌占70%[41]. 高分化腺癌的组织结构和细胞形态的异型性较小, 易与胃黏膜高级别上皮内瘤变混淆, 同时胃镜活检的组织标本较小, 取材深度不够, 病理医生对胃高分化腺癌认识不足, 往往不易做出诊断[42,43].
病理数字切片的广泛应用使许多计算机辅助诊断系统被研发, 计算机图像分析可以得到定量指标, 有效提高病理诊断正确率. 计算机图像诊断在胃肠道方面也有较多研究.
胡亚斌[44]根据胃腺癌细胞特征的知识库, 通过分割、检测组织细胞的细胞核的周长和面积、胞核的圆度、核浆比例、核分裂像等图像形态学特征, 对胃腺癌进行辅助诊断. Ficsor等[45]对正常胃黏膜、胃炎和胃腺癌的腺腔、表面上皮细胞、间质细胞占总体细胞的比率进行分析结果显示三者腺腔形态系数值差异具有统计学意义. 江朝娜[46]通过对细胞和腺腔面积及周长的测量对胃腺癌、胃腺瘤及正常胃黏膜的判别准确率分别为97.1%、87.5%、100%; 胃高分化、中分化、低分化腺癌的判别准确度分别为46.7%、75%、95%. Ficsor等[47]使用自动图像分析系统对正常结肠黏膜、溃疡性结肠炎和非特异性的结肠炎的细胞的周长、长短径、数量以及腺腔的形态和腺体中细胞数量进行分析, 得出三者之间腺腔形态和腺腔细胞数量差异有统计学意义.
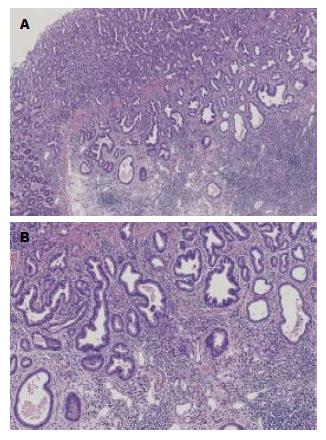
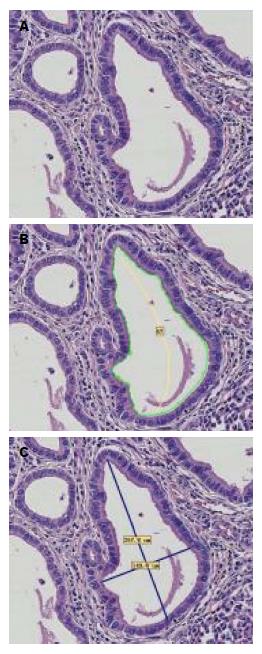
以上是国内外学者对胃癌的智能图像诊断系统的部分研究, 目前还没有关于腺腔圆度的研究, 圆度测量可以将腺腔的结构不规则, 腺腔扩张等特征转换为具体数值的定量指标, 通过数值大小来进行诊断分析, 为病理诊断提供参考价值. 我们的研究发现胃黏膜正常腺腔圆度值>增生腺腔圆度值>高分化腺癌腺腔圆度值, 3组圆度值的比较差异具有统计学意义(P<0.01). 图1为胃高分化腺癌的病理图片, 图2为高分化腺癌的圆度测量图. 因此可用腺腔圆度值大小辅助诊断胃高分化腺癌, 尤其是对于组织和细胞结构异型性较小的组织早期胃癌, 肉眼难以对此做出鉴别. 如分化极好的胃腺癌[48,49], 是指显微镜下呈良性表现但有侵袭行为的肿瘤. 因他细胞异型性小, 腺体形态与正常胃黏膜相似, 容易误诊, 尤其是胃镜活检标本. Ushiku等[50]分析21例术后病理诊断为伴有肠化生的分化极好的胃腺癌的形态特征, 在这21例中有18例的胃镜未被诊断为癌. 对此腺腔圆度值大小是鉴别诊断的有效指标.
精准医学计划提出后, 人们希望精准医学可以引领一个医学新时代. 精准医疗是以个体化医疗为基础、随着基因组测序技术快速进步以及生物信息与大数据科学的交叉应用而发展起来的新型医学概念与医疗模式. 而计算机的深度学习能有效提高大数据处理的效率, 分析各种数据的相关性, 监测病情发展, 从而达到精确诊断和治疗.
在过去的十多年中, 随着数字切片扫描仪的广泛应用, 数字病理开始普遍. 数字切片的出现为图像分析诊断带来了更大的发展空间, 目前已有多种病理智能诊断系统被研发出, 病理智能诊断系统Watson的出现使病理医生重新认识了人工智能. 智能图像诊断系统与病理医生结合可以提高病理医生诊断准确率, 减少工作量. 随着对深度学习和图像诊断深入研究, 计算机深度学习将为医学带来无限可能.
人们对健康的关注的提高就要求医学诊断、治疗、预测疾病发展的水平提高, 这就需要临床医生能够处理各组数据之间的关系, 计算机深度学习是处理庞大医学数据的可靠方法. 智能图像诊断系统能够在减轻病理医生工作量的同时帮助提高诊断正确率, 是未来病理发展的方向.
我国是胃癌大国, 其死亡率占恶性肿瘤前3位, 而我国早期胃癌的诊断率仅有10%, 如何能做到早发现早治疗成为关注热点. 近年来随着计算机图像处理的发展, 医学图像处理与识别可为医学诊断提供更加丰富与准确的信息.
如何提高早期胃癌的诊断率, 尤其是对于资历较浅的年轻病理医生, 提高其对于胃高分化腺癌的认识与诊断是该领域亟待解决的问题.
在医学图像处理领域, 借助计算机进行图像处理与分析诊断是该领域的前沿研究.
智能图像诊断可以极大降低病理医生繁杂费时的计算工作, 提供客观数据, 供病理医生参考.
董稚明, 教授, 主任医师, 河北医科大学第四医院肿瘤研究所, 河北省肿瘤研究所病理研究室; 马大烈, 教授, 主任医师, 长海医院病理科
随着人工智能技术的不断进步, 计算机辅助病理诊断必将有所突破. 目前计算机辅助诊断已经应用于细胞病理诊断, 但是由于肿瘤组织结构的复杂性, 其在常规病理诊断中的应用尚处于探索阶段, 本文能对此项工作的深入起到推进作用.
| 1. | Collins FS, Varmus H. A new initiative on precision medicine. N Engl J Med. 2015;372:793-795. [PubMed] [DOI] |
| 2. | Mirnezami R, Nicholson J, Darzi A. Preparing for precision medicine. N Engl J Med. 2012;366:489-491. [PubMed] [DOI] |
| 3. | Deo RC. Machine Learning in Medicine. Circulation. 2015;132:1920-1930. [PubMed] [DOI] |
| 4. | Cleophas TJ, Zwinderman AH. Machine Learning in Medicine-a Complete Overview. 1st ed. Berlin: Springer International Publishing 2015; 516. |
| 5. | Caixinha M, Nunes S. Machine Learning Techniques in Clinical Vision Sciences. Curr Eye Res. 2017;42:1-15. [PubMed] [DOI] |
| 6. | Obermeyer Z, Emanuel EJ. Predicting the Future - Big Data, Machine Learning, and Clinical Medicine. N Engl J Med. 2016;375:1216-1219. [PubMed] [DOI] |
| 7. | Alpaydin E. Introduction to Machine Learning (Adaptive Computation and Machine Learning). Cambridge: MIT Press 2004; . |
| 8. | Vallmuur K, Marucci-Wellman HR, Taylor JA, Lehto M, Corns HL, Smith GS. Harnessing information from injury narratives in the 'big data' era: understanding and applying machine learning for injury surveillance. Inj Prev. 2016;22 Suppl 1:i34-i42. [PubMed] [DOI] |
| 9. | Taylor RA, Pare JR, Venkatesh AK, Mowafi H, Melnick ER, Fleischman W, Hall MK. Prediction of In-hospital Mortality in Emergency Department Patients With Sepsis: A Local Big Data-Driven, Machine Learning Approach. Acad Emerg Med. 2016;23:269-278. [PubMed] [DOI] |
| 10. | Gillies RJ, Kinahan PE, Hricak H. Radiomics: Images Are More than Pictures, They Are Data. Radiology. 2016;278:563-577. [PubMed] [DOI] |
| 11. | Beck AH, Sangoi AR, Leung S, Marinelli RJ, Nielsen TO, van de Vijver MJ, West RB, van de Rijn M, Koller D. Systematic analysis of breast cancer morphology uncovers stromal features associated with survival. Sci Transl Med. 2011;3:108ra113. [PubMed] [DOI] |
| 12. | Rimm DL. C-path: a Watson-like visit to the pathology lab. Sci Transl Med. 2011;3:108fs8. [PubMed] [DOI] |
| 13. | Gurcan MN, Boucheron LE, Can A, Madabhushi A, Rajpoot NM, Yener B. Histopathological image analysis: a review. IEEE Rev Biomed Eng. 2009;2:147-171. [PubMed] [DOI] |
| 15. | Park SW, Park J, Bong K, Shin D, Lee J, Choi S, Yoo HJ. An Energy-Efficient and Scalable Deep Learning/Inference Processor With Tetra-Parallel MIMD Architecture for Big Data Applications. IEEE Trans Biomed Circuits Syst. 2015;9:838-848. [PubMed] [DOI] |
| 16. | Janowczyk A, Madabhushi A. Deep learning for digital pathology image analysis: A comprehensive tutorial with selected use cases. J Pathol Inform. 2016;7:29. [PubMed] [DOI] |
| 17. | Bhargava R, Madabhushi A. Emerging Themes in Image Informatics and Molecular Analysis for Digital Pathology. Annu Rev Biomed Eng. 2016;18:387-412. [PubMed] [DOI] |
| 18. | Veta M, Pluim JP, van Diest PJ, Viergever MA. Breast cancer histopathology image analysis: a review. IEEE Trans Biomed Eng. 2014;61:1400-1411. [PubMed] [DOI] |
| 19. | Veta M, van Diest PJ, Willems SM, Wang H, Madabhushi A, Cruz-Roa A, Gonzalez F, Larsen AB, Vestergaard JS, Dahl AB. Assessment of algorithms for mitosis detection in breast cancer histopathology images. Med Image Anal. 2015;20:237-248. [PubMed] [DOI] |
| 20. | Cruz-Roa A, Gilmore H, Feldman M, Tomaszewski J, Madabhushi A. Automatic detection of invasive ductal carcinoma in whole slide images with convolutional neural networks. San Diego: Proceedings of the SPIE Medical Imaging 2014; 139-144. [DOI] |
| 21. | Chen T, Chefd'Hotel C. Deep Learning Based Automatic Immune Cell Detection for Immunohistochemistry Images. Boston: Springer International Publishing 2014; . |
| 22. | Xu J, Xiang L, Liu Q, Gilmore H, Wu J, Tang J, Madabhushi A. Stacked Sparse Autoencoder (SSAE) for Nuclei Detection on Breast Cancer Histopathology Images. IEEE Trans Med Imaging. 2016;35:119-130. [PubMed] [DOI] |
| 23. | Dan CC, Giusti A, Gambardella L M, Schmidhuber J. Deep Neural Networks Segment Neuronal Membranes in Electron Microscopy Images. Advances in Neural Information Processing Systems. 2012;2852-2860. |
| 24. | Kainz P, Pfeiffer M, Urschler M. Semantic Segmentation of Colon Glands with Deep Convolutional Neural Networks and Total Variation Segmentation. Computer Science. 2015;. |
| 25. | Maqlin P, Thamburaj R, Mammen J J, Manipadam M T. Automated nuclear pleomorphism scoring in breast cancer histopathology images using deep neural networks. International Conference on Mining Intelligence and Knowledge Exploration. 2015;269-276. |
| 26. | Sirinukunwattana K, Raza S, Tsang YW, Snead D, Cree I, Rajpoot N. Locality Sensitive Deep Learning for Detection and Classification of Nuclei in Routine Colon Cancer Histology Images. IEEE Trans Med Imaging. 2016; Feb 4. [Epub ahead of print]. [PubMed] [DOI] |
| 27. | Zhou Y, Chang H, Barner KE, Parvin B. Nuclei segmentation via sparsity constrained convolutional regression. Proc IEEE Int Symp Biomed Imaging. 2015;2015:1284-1287. [PubMed] [DOI] |
| 28. | Irshad H, Veillard A, Roux L, Racoceanu D. Methods for nuclei detection, segmentation, and classification in digital histopathology: a review-current status and future potential. IEEE Rev Biomed Eng. 2014;7:97-114. [PubMed] [DOI] |
| 29. | Xu Y, Jia Z, Ai Y, Zhang F. Deep convolutional activation features for large scale brain tumor histopathology image classification and segmentation. Acoustics, Speech and Signal Processing (ICASSP). 2015 IEEE International Conference on IEEE. 2015;947-951. |
| 30. | Sirinukunwattana K, Raza SEA, Tsang YW, Snead D, Cree I, Rajpoot N. A spatially constrained deep learning framework for detection of epithelial tumor nuclei in cancer histology images. International Workshop on Patch-based Techniques in Medical Imaging. 2015;154-162. [DOI] |
| 31. | Xu J, Luo X, Wang G, Gilmore H, Madabhushi A. A Deep Convolutional Neural Network for segmenting and classifying epithelial and stromal regions in histopathological images. Neurocomputing. 2016;191:214-223. [PubMed] [DOI] |
| 32. | Ertosun MG, Rubin DL. Automated Grading of Gliomas using Deep Learning in Digital Pathology Images: A modular approach with ensemble of convolutional neural networks. AMIA Annu Symp Proc. 2015;2015:1899-1908. [PubMed] |
| 33. | Hamilton PW, Wang Y, Boyd C, James JA, Loughrey MB, Hougton JP, Boyle DP, Kelly P, Maxwell P, McCleary D. Automated tumor analysis for molecular profiling in lung cancer. Oncotarget. 2015;6:27938-27952. [PubMed] [DOI] |
| 35. | Nagy P, Johansson S, Molloy-Bland M. Systematic review of time trends in the prevalence of Helicobacter pylori infection in China and the USA. Gut Pathog. 2016;8:8. [PubMed] [DOI] |
| 45. | Ficsor L, Varga V, Berczi L, Miheller P, Tagscherer A, Wu ML, Tulassay Z, Molnar B. Automated virtual microscopy of gastric biopsies. Cytometry B Clin Cytom. 2006;70:423-431. [PubMed] [DOI] |
| 47. | Ficsor L, Varga VS, Tagscherer A, Tulassay Z, Molnar B. Automated classification of inflammation in colon histological sections based on digital microscopy and advanced image analysis. Cytometry A. 2008;73:230-237. [PubMed] [DOI] |
| 48. | Kotani S, Miyaoka Y, Fujiwara A, Tsukano K, Ogawa S, Yamanouchi S, Kusunoki R, Fujishiro H, Kohge N, Ohnuma H. Intestinal-type gastric adenocarcinoma without Helicobacter pylori infection successfully treated with endoscopic submucosal dissection. Clin J Gastroenterol. 2016;9:228-232. [PubMed] [DOI] |
| 49. | Yao T, Utsunomiya T, Oya M, Nishiyama K, Tsuneyoshi M. Extremely well-differentiated adenocarcinoma of the stomach: clinicopathological and immunohistochemical features. World J Gastroenterol. 2006;12:2510-2516. [PubMed] |
| 50. | Ushiku T, Arnason T, Ban S, Hishima T, Shimizu M, Fukayama M, Lauwers GY. Very well-differentiated gastric carcinoma of intestinal type: analysis of diagnostic criteria. Mod Pathol. 2013;26:1620-1631. [PubMed] [DOI] |
手稿来源: 邀请约稿
学科分类: 胃肠病学和肝病学
手稿来源地: 北京市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳