修回日期: 2016-07-12
接受日期: 2016-07-19
在线出版日期: 2016-08-18
目的: 研究自身免疫性肝炎(autoimmune hepatitis, AIH)模型小鼠的腹腔巨噬细胞吞噬及溶酶体功能及其与AIH发病的关系.
方法: 80只C57BL/6小鼠平均分为AIH模型组及对照组, 应用腹腔注射小鼠肝特异性抗原S-100与氟式佐剂乳化物建立AIH小鼠模型, 提取AIH模型组和对照组小鼠腹腔巨噬细胞, 应用荧光显微镜和流式细胞仪检测巨噬细胞对荧光标记大肠杆菌的吞噬率和吞噬指数, 比较各组细胞Lysotracker荧光强度分析溶酶体含量.
结果: AIH模型组小鼠腹腔巨噬细胞吞噬率(24.07%±10.21% vs 47.27%±15.57%, t = -7.899, P<0.05)及吞噬指数(0.36±0.19 vs 0.89±0.34, t = -6.793, P<0.05)较对照组明显下降. AIH模型组巨噬细胞的溶酶体含量低于对照组(5.85±0.35 vs 15.39±0.72, t = -5.296, P<0.05); FITC-E. coli被细胞吞噬后, 绝大部分进入溶酶体并刺激巨噬细胞中的溶酶体增多, 刺激后AIH模型小鼠巨噬细胞的溶酶体含量仍显著低于对照组(9.45±0.84 vs 30.00±1.36, t = -7.889, P<0.05).
结论: AIH模型组小鼠腹腔巨噬细胞吞噬及溶酶体功能较对照组明显下降, 这可能是AIH发病机制中的重要一环.
核心提示: 自身免疫性肝炎(autoimmune hepatitis, AIH)是自身免疫反应介导的慢性进行性肝脏炎症性疾病, 病因至今未明. 有研究显示AIH的发病机制与单核-巨噬细胞系统功能异常有关. 本文旨在研究AIH模型小鼠的腹腔巨噬细胞吞噬及溶酶体功能及其与AIH发病的关系.
引文著录: 许瑞蕊, 伍银银, 周璐, 王邦茂, 郑荣秀. 自身免疫性肝炎小鼠腹腔巨噬细胞的吞噬及溶酶体功能异常. 世界华人消化杂志 2016; 24(23): 3488-3494
Revised: July 12, 2016
Accepted: July 19, 2016
Published online: August 18, 2016
AIM: To evaluate the phagocytic function and lysosome activities of intraperitoneal macrophages in autoimmune hepatitis (AIH) mice.
METHODS: Eighty C57BL/680 mice were divided into an AIH group and a control group. AIH was induced by intraperitoneal injection of liver-specific antigen S-100 and Freund's complete adjuvant. Intraperitoneal macrophages were obtained through peritoneal washing. Macrophages were co-cultured with fluorescein isothiocyanate (FITC) labeled Escherichia coli (E. coli) and lysotracker red. The phagocytic rate/index and lysotracker fluorescence intensities were analyzed by fluorescence microscopy or flow cytometry.
RESULTS: Both the phagocytic rate (24.07% ± 10.21% vs 47.27% ± 15.57%, t = -7.899, P < 0.05) and index (0.36 ± 0.19 vs 0.89 ± 0.34, t = -6.793, P < 0.05) of macrophages from AIH mice were lower than those from control mice. Most of FITC-labeled E. coli bacteria were transported into lysosomes after phagocytosis, which enhanced the activities of lysosomes. No matter before or after co-culture with FITC-labeled E. coli, the activities of lysosome in the AIH group were less than those of control mice (before co-culture: 5.85 ± 0.35 vs 15.39 ± 0.72, t = -5.296, P < 0.05; after co-culture: 9.45 ± 0.84 vs 30.00 ± 1.36, t = -7.889, P < 0.05).
CONCLUSION: The phagocytic and lysosome functions of macrophages in AIH mice are reduced, which may be pathogenic factors in AIH.
- Citation: Xu RR, Wu YY, Zhou L, Wang BM, Zheng RX. Dysfunction of phagocytosis and lysosome activities of intraperitoneal macrophages in autoimmune hepatitis mice. Shijie Huaren Xiaohua Zazhi 2016; 24(23): 3488-3494
- URL: https://www.wjgnet.com/1009-3079/full/v24/i23/3488.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i23.3488
自身免疫性肝炎(autoimmune hepatitis, AIH)是自身免疫反应介导的慢性进行性肝脏炎症性疾病, 临床特征为不同程度的血清转氨酶升高、高γ-球蛋白血症、自身抗体阳性, 组织学特征为以淋巴细胞、浆细胞浸润为主的界面性肝炎[1-4], 该病病因至今未明[5-7]. 近年来随着我国AIH发病率逐年升高, 对于其发病机制的研究已经成为医学界探索的热点问题[8,9]. 有研究[10-13]显示AIH的发病机制主要表现为肝脏免疫功能及免疫耐受的破坏, 其中固有免疫系统功能的紊乱, 尤单核-巨噬细胞系统功能异常可造成持续性肝细胞损伤, 在AIH发病过程中发挥重要作用. 由此, 研究AIH模型小鼠腹腔巨噬细胞功能, 探索单核-巨噬细胞在AIH发病中的作用和机制, 将为AIH的治疗开辟一条新道路.
由天津医科大学实验动物中心购进并饲养♂C57BL/6小鼠80只, 4-6周龄, 体质量17-20 g之间, 清洁级, 正常饮食水. 氟式佐剂(CFA, 购自美国Sigma公司), RPMI 1640培养基(购自北京中杉金桥试剂公司), 小牛血清(购自美国Gibco公司), Lysotracker Red DND-99(购自美国Abcam公司), DAPI试剂(购自北京中杉金桥试剂公司), FITC粉剂(购自美国Sigma公司), LB培养基(购自北京中杉金桥试剂公司).
1.2.1 动物模型的建立: 80只C57BL/6小鼠按体质量配对平均分为两组, 提取同种系小鼠肝脏匀浆即S-100[14,15], 两组小鼠分别腹腔注射试剂1(S-100抗原+CFA)或试剂2(生理盐水+CFA)l mL/只, 注射试剂1组称为AIH模型组, 注射试剂2组称为对照组. 第一次免疫后第7天给予同等剂量注射, 4 wk后开始试验. 随机抽取每组各10只小鼠, 统计分析两组小鼠的血清谷丙转氨酶(alanine aminotransferase, ALT)和谷草转氨酶(aspartate aminotransferase, AST)水平以及肝脏病结果, 验证模型的建立成功与否.
1.2.2 AIH小鼠腹腔巨噬胞吞噬及溶酶体功能研究: 取出剩余的每组各30只小鼠, 脱颈处死, 提取腹腔冲洗液的巨噬细胞[16,17], 培养备用. 随机抽取每组各10份标本放入经FITC标记的大肠杆菌(Escherichia coli, E. coli), 胞菌比为1:5, 避光共培养1 h, 加入新鲜制备的含Lysotracker的培养液, 继续温箱培育1 h, 冲洗固定后, 用DAPI(蓝色荧光细胞核染色)荧光染色并制成细胞涂片, 于荧光显微镜下观察, S形计数每个不重复视野中的细胞数(DAPI细胞核染色确定细胞总数)、吞噬E. coli的巨噬细胞数(FITC阳性细胞)和吞噬大肠杆菌总数(细胞内FITC-E. coli总数), 共计数100个巨噬细胞, 计算其吞噬率(phagocytic rate)及吞噬指数(phagocytic index)[18,19], 并利用IPP6.0软件分析FITC-E. coli与溶酶体的共定位度. 另取每组各10份标本, 使用上述方法予溶酶体标记及FITC-E. coli共孵育处理, 剩余每组各10份标本只标记溶酶体而不经过与大肠杆菌孵育过程, 冲洗后放入无菌放免管中, 经流式细胞仪检测验证吞噬功能结果并分析其Lysotracker荧光强度. 相应公式为: 吞噬率 = 巨噬细胞中吞噬大肠杆菌的细胞数/巨噬细胞总数×100%; 吞噬指数 = 巨噬细胞吞噬的大肠杆菌总数/巨噬细胞总数(个).
统计学处理 采用SPSS19.0统计学软件, 计量资料以mean±SD表示, 各组数据分布特征为正态分布, 采用单样本t检验、配对t检验进行比较, P<0.05为差异具有统计学意义.
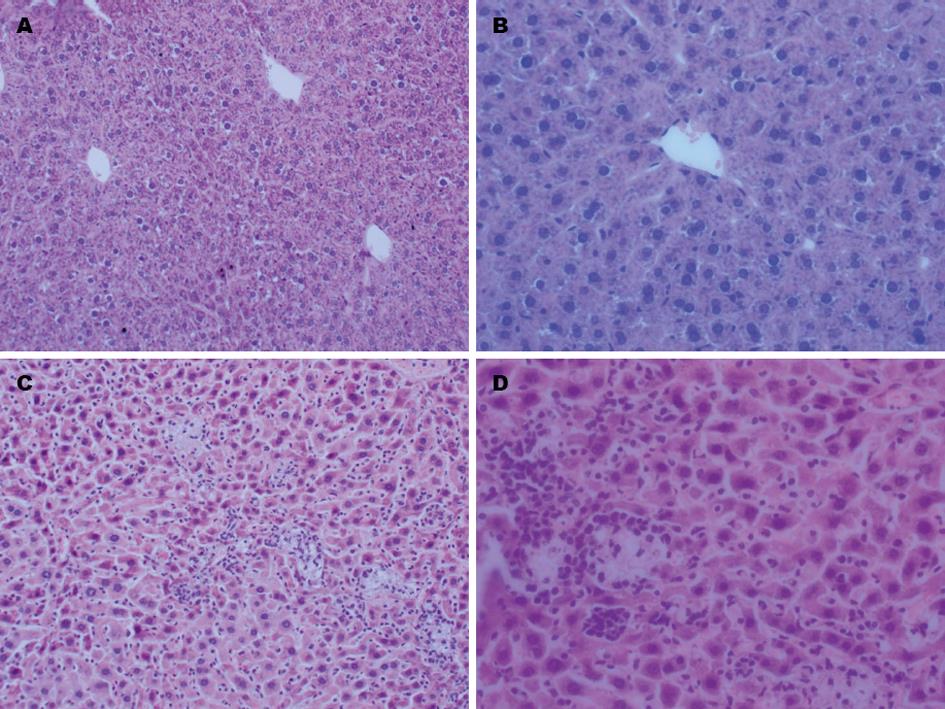
和对照小鼠相比, AIH模型组小鼠皮毛晦暗, 精神状态不佳. 肝酶血清生化检测示: AIH模型组小鼠ALT、AST水平分别较对照组升高(156.80 U/L±52.86 U/L vs 29.90 U/L±8.43 U/L, t = 7.039, P<0.05; 317.80 U/L±125.80U/L vs 146.40 U/L±30.61 U/L, t = 3.820, P<0.05); 肝病理分析结果示: AIH模型组小鼠肝脏中重度损害, 细胞形态结构紊乱, 局灶性肝细胞坏死伴肝小叶内大量炎细胞浸润; 而对照组小鼠肝脏细胞形态正常, 肝小叶结构规则, 呈正常肝组织形态(图1).
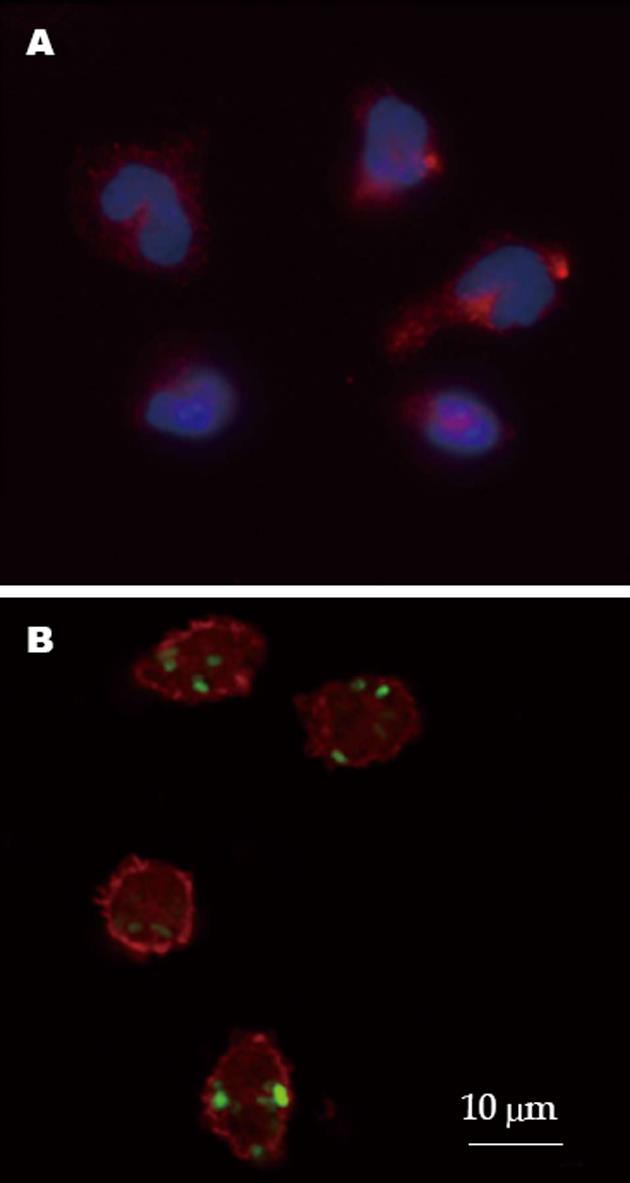
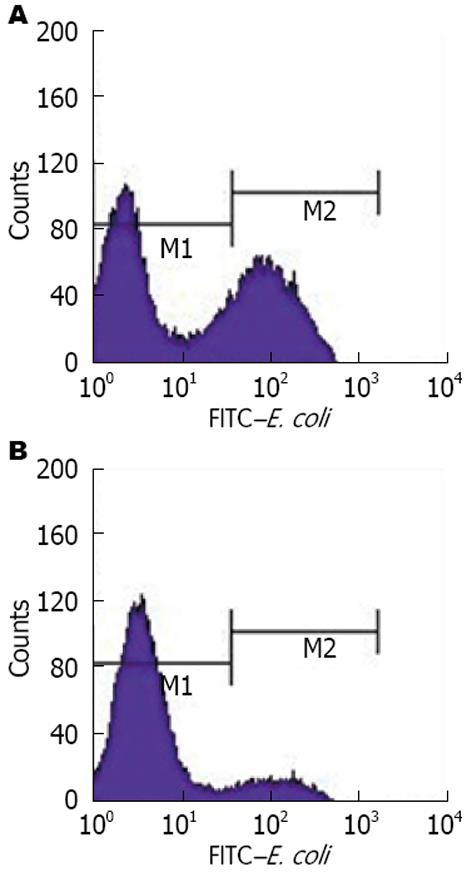
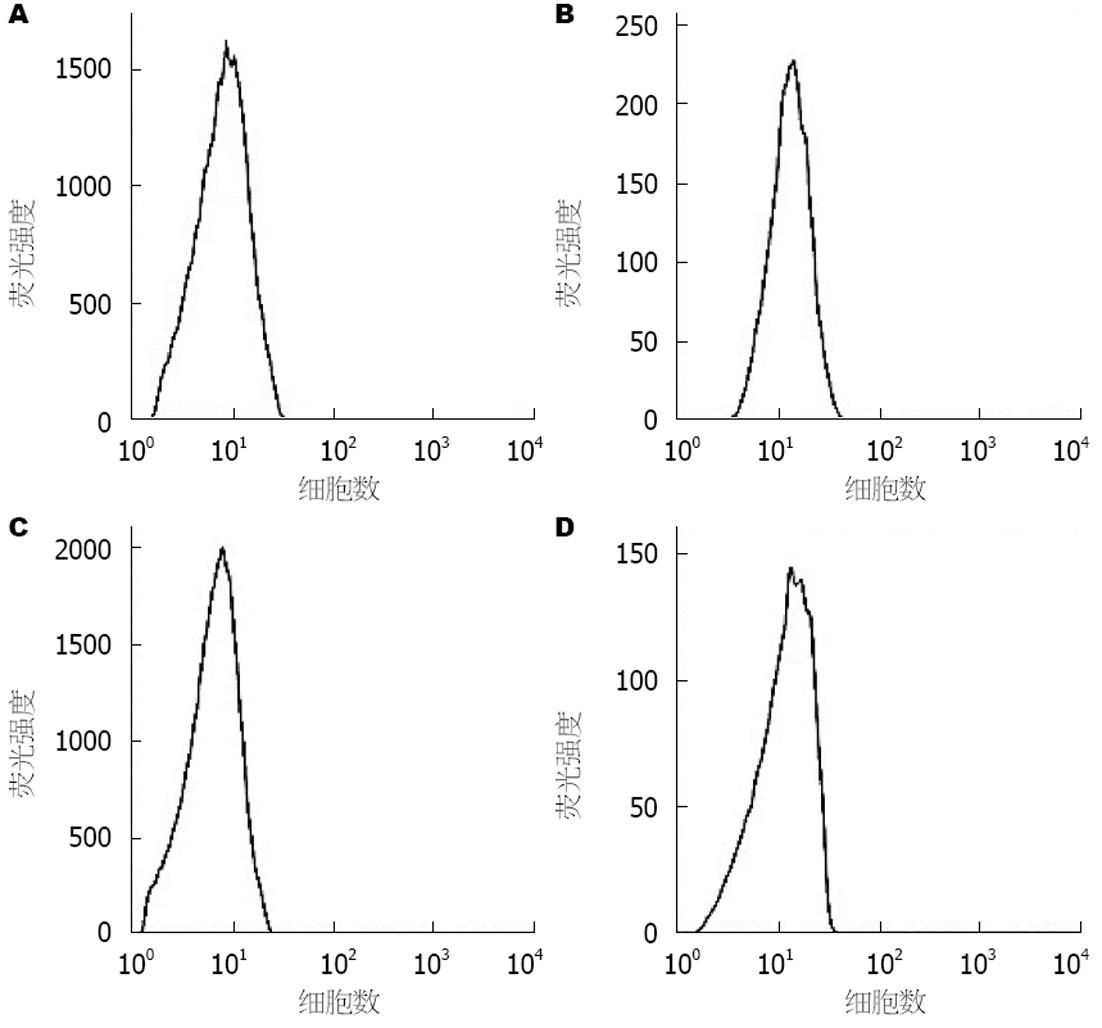
AIH模型组小鼠腹腔巨噬细胞吞噬率较对照组明显下降(24.07%±10.21% vs 47.27%±15.57%, t = -7.899, P<0.05); 相对应的, AIH模型组吞噬指数也显著低于对照组(0.36个± 0.19个 vs 0.89个±0.34个, t = -6.793, P<0.05), 说明AIH模型小鼠的腹腔巨噬细胞吞噬功能有显著下降. 流式细胞仪验证结果也提示AIH模型组小鼠腹腔巨噬细胞吞噬率较对照组明显下降(13.69%±3.62% vs 35.72%±7.93%, t = -5.947, P<0.05)(图2, 3).
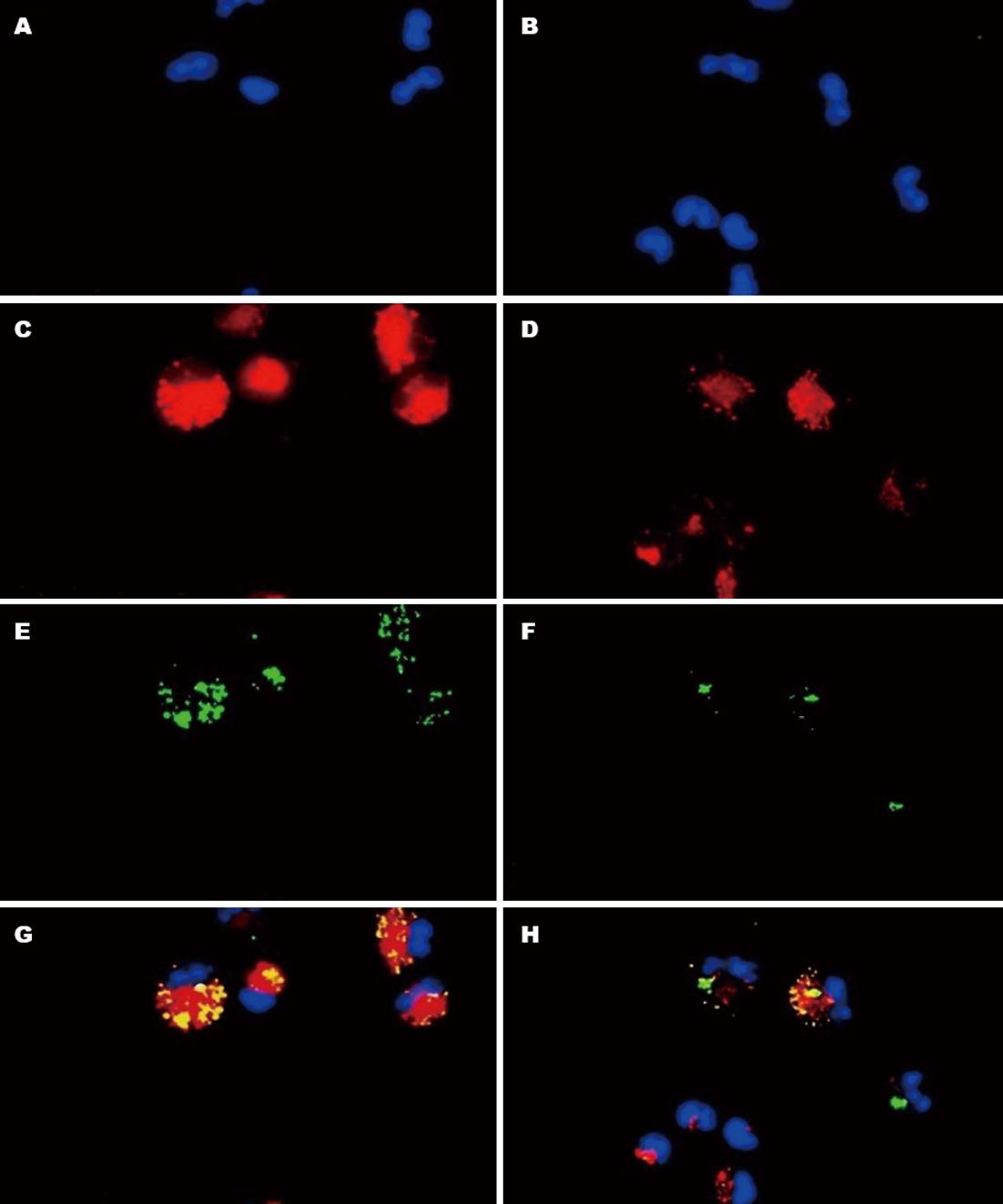
荧光显微镜下观察可见: 溶酶体分布于胞浆中, FITC-E. coli被细胞吞噬后, 绝大部分进入溶酶体. 利用IPP 6.0软件分析溶酶体(红色荧光)与E. coli(绿色荧光)重叠的程度(图4), 即为FITC-E. coli与溶酶体的共定位度, 结果显示两组比较无统计学差异(96.92%±3.19% vs 97.28%±1.77%, t = -0.252, P>0.05).
Lysotracker的平均荧光强度代表细胞内溶酶体的活性, 结果显示AIH模型组巨噬细胞的溶酶体活性低于对照组(5.85±0.35 vs 15.39±0.72, t = -5.296, P<0.05); FITC-E. coli被细胞吞噬后, 绝大部分进入溶酶体并刺激巨噬细胞中的溶酶体增多, 刺激后AIH模型小鼠巨噬细胞的溶酶体活性仍显著低于对照组(9.45±0.84 vs 30.00±1.36, t = -7.889, P<0.05)(表1, 图5).
AIH是一种慢性肝脏疾病, 其多基因遗传特征决定了单项免疫调节基因缺失的动物模型无法模拟其复杂的遗传背景, 而多数报道的肝炎模型仅仅是短暂性或急性的免疫性肝损伤, 如刀豆蛋白(CoA)模型[20], 因此目前还没有一种动物模型可完全体现人类AIH由于自身免疫所造成的肝细胞损伤的所有特性, 迄今尚无标准的AIH动物模型[21-23]. 本文采用的AIH模型是以同种系小鼠的肝组织提供的半抗原与氟式佐剂联合形成的自身抗原, 通过两次腹腔注射建立的. 我们观察到造模后小鼠肝脏组织中可见大量炎症细胞特别是淋巴细胞的浸润, 其分布主要以汇管区为主, 肝细胞出现明显肿胀、坏死,伴有血清转氨酶升高, 造模周期为4周, 自身免疫性炎症的发展呈慢性过程, 与人类AIH的发病过程相似, 是在AIH研究中应用较多的模型之一.
本研究提取小鼠腹腔巨噬细胞, 与FITC荧光标记的大肠杆菌共孵育后, 计算吞噬率及吞噬指数, 并分析细胞的溶酶体活性. 结果显示AIH模型组小鼠的腹腔巨噬细胞吞噬率及吞噬指数均显著低于对照组(P<0.05), 证明AIH组巨噬细胞吞噬功能有明显的下降, 同时AIH模型组小鼠腹腔巨噬细胞的溶酶体活性较对照组减低. 单核-巨噬细胞的吞噬清除作用是机体固有免疫的第一道防线[24,25]. 细菌和病毒被吞噬后, 在溶酶体消化降解[13,26]. 在肝脏, Kupffer细胞(肝脏的巨噬细胞)持续接受来富含肠道细菌抗原的刺激, 通过吞噬、清除和抗原递呈功能维持肝脏的免疫耐受耐受[27,28]. 近期有文献报道[13]在CoA急性免疫性肝损伤小鼠模型中, 小鼠外周单核细胞吞噬功能下降, 凋亡细胞清除障碍, 加重了肝脏的炎症反应. 本研究进一步提示, 在AIH起病过程中, 可能存在巨噬细胞吞噬功能下降及溶酶体减少, 从而导致应清除的细菌、非致病性外来抗原以及自身凋亡小体等内源性抗原堆积, 打破了免疫耐受与应答之间的平衡状态, 启动了自身免疫反应, 从而造成肝脏损害, 这可能是导致AIH发病的因素之一.
总之, 巨噬-溶酶体途径可能在AIH发病中发挥着重要作用, 基于肝Kupffer细胞的后续研究对阐释AIH发病机制和探索新的治疗手段将有重要意义.
自身免疫性肝炎(autoimmune hepatitis, AIH)是自身免疫反应介导的慢性进行性肝脏炎症性疾病, 临床特征为不同程度的血清转氨酶升高、高γ-球蛋白血症、自身抗体阳性, 组织学特征为以淋巴细胞、浆细胞浸润为主的界面性肝炎. 近年来随着我国AIH发病率逐年升高, 对于其发病机制的研究已经成为医学界探索的热点问题.
姚定康, 教授, 中国人民解放军第二军医大学附属长征医院内科
有研究显示AIH的发病机制主要表现为肝脏免疫功能及免疫耐受的破坏, 其中固有免疫系统功能的紊乱, 尤单核-巨噬细胞系统功能异常可造成持续性肝细胞损伤, 在AIH发病过程中发挥重要作用. 由此, 研究AIH模型小鼠腹腔巨噬细胞功能, 探索单核-巨噬细胞在AIH发病中的作用和机制, 将为AIH的治疗开辟一条新道路.
近期有文献报道在CoA急性免疫性肝损伤小鼠模型中, 小鼠外周单核细胞吞噬功能下降, 凋亡细胞清除障碍, 加重了肝脏的炎症反应.
本研究提示, 在AIH起病过程中, 可能存在巨噬细胞吞噬功能下降及溶酶体减少, 从而导致应清除的细菌、非致病性外来抗原以及自身凋亡小体等内源性抗原堆积, 打破了免疫耐受与应答之间的平衡状态, 启动了自身免疫反应, 从而造成肝脏损害, 这可能是导致AIH发病的因素之一.
巨噬-溶酶体途径可能在AIH发病中发挥着重要作用, 基于肝Kupffer细胞的后续研究对阐释AIH发病机制和探索新的治疗手段将有重要意义.
本文通过动物模型研究验证了巨噬细胞吞噬及溶酶体在自身免疫性肝炎发病中可能的机制, 提出自身免疫性肝炎巨噬细胞吞噬及溶酶体功能下降, 导致清除细菌、外来抗原及自身凋亡小体能力下降, 诱发免疫反应, 观点新颖, 实验设计科学, 结果可靠, 证据可信, 统计合理, 结论分析科学, 具有较高学术价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 郭鹏 电编:闫晋利
| 2. | Gleeson D, Heneghan MA. British Society of Gastroenterology (BSG) guidelines for management of autoimmune hepatitis. Gut. 2011;60:1611-1629. [PubMed] [DOI] |
| 3. | 赵 景民, 王 松山, 孙 艳玲, 周 光德, 刘 平, 孟 二红, 辛 绍杰, 张 泰和, 王 福生, 毛 远丽. 自身免疫性肝炎临床病理特征及发病机理的研究. 中华实验和临床病毒学杂志. 2002;16:27-30. |
| 4. | Ishibashi H, Komori A, Shimoda S, Gershwin ME. Guidelines for therapy of autoimmune liver disease. Semin Liver Dis. 2007;27:214-226. [PubMed] [DOI] |
| 5. | Béland K, Lapierre P, Alvarez F. Influence of genes, sex, age and environment on the onset of autoimmune hepatitis. World J Gastroenterol. 2009;15:1025-1034. [PubMed] [DOI] |
| 6. | Liberal R, Mieli-Vergani G, Vergani D. Autoimmune hepatitis: From mechanisms to therapy. Rev Clin Esp. 2016; May 6. [Epub ahead of print]. [PubMed] [DOI] |
| 7. | Longhi MS, Ma Y, Mieli-Vergani G, Vergani D. Aetiopathogenesis of autoimmune hepatitis. J Autoimmun. 2010;34:7-14. [PubMed] [DOI] |
| 10. | Longhi MS, Ma Y, Mieli-Vergani G, Vergani D. Adaptive immunity in autoimmune hepatitis. Dig Dis. 2010;28:63-69. [PubMed] [DOI] |
| 11. | Seki E, Schnabl B. Role of innate immunity and the microbiota in liver fibrosis: crosstalk between the liver and gut. J Physiol. 2012;590:447-458. [PubMed] [DOI] |
| 12. | Lleo A, Bowlus CL, Yang GX, Invernizzi P, Podda M, Van de Water J, Ansari AA, Coppel RL, Worman HJ, Gores GJ. Biliary apotopes and anti-mitochondrial antibodies activate innate immune responses in primary biliary cirrhosis. Hepatology. 2010;52:987-998. [PubMed] [DOI] |
| 13. | Martynova TV, Aleksieieva IM. [Functional activity of peritonal macrophages in liver immune damage of cellular and antibody genesis in mice]. Fiziol Zh. 2009;55:36-42. [PubMed] |
| 15. | Peters MG. Animal models of autoimmune liver disease. Immunol Cell Biol. 2002;80:113-116. [PubMed] [DOI] |
| 19. | Zhou L, Braat H, Faber KN, Dijkstra G, Peppelenbosch MP. Monocytes and their pathophysiological role in Crohn's disease. Cell Mol Life Sci. 2009;66:192-202. [PubMed] [DOI] |
| 24. | Gordon S, Taylor PR. Monocyte and macrophage heterogeneity. Nat Rev Immunol. 2005;5:953-964. [PubMed] [DOI] |
| 25. | 张 帆, 张 金彦, 彭 志海. 补体系统与肝脏疾病的研究进展. 胃肠病学和肝病学杂志. 2014;23:357-360. |
| 26. | Gotthardt D, Warnatz HJ, Henschel O, Brückert F, Schleicher M, Soldati T. High-resolution dissection of phagosome maturation reveals distinct membrane trafficking phases. Mol Biol Cell. 2002;13:3508-3520. [PubMed] [DOI] |