修回日期: 2016-03-17
接受日期: 2016-03-22
在线出版日期: 2016-05-28
目前, 非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)已经成为全球性的慢性肝脏疾病, 其较高的发病率与肥胖症、糖尿病及代谢紊乱等密切相关. 伴随促炎症反应和肝纤维化而发生的胰岛素耐受、脂质代谢紊乱是NAFLD进一步恶化的标志. 核受体法尼酯衍生物X受体(farnesoid X receptor, FXR)对脂类的代谢和体内平衡过程具有重要的调节作用, 对其功能特性的深入研究, 可为非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)的病理生理学特征提供更深的认识, 并阐明NAFLD/NASH潜在药物治疗靶点的机制. FXR的激活可以抑制肝脏脂肪的从头合成, 增加胰岛素的敏感性以及避免胆汁酸诱导的细胞毒性. 结合临床研究提示, FXR的激动剂或调节剂有望用来治疗NAFLD和NASH类肝脏疾病. 本文着重对FXR在NASH中的重要调节作用作一综述.
核心提示: 本文着重介绍了法尼酯衍生物X受体(farnesoid X receptor)在治疗非酒精性脂肪性肝炎中的靶点作用, 包括调节胆汁酸的代谢、改善肝脏的脂肪变性、抑制肝纤维化的作用, 并阐述了其潜在的临床治疗前景.
引文著录: 段兴平, 孟强, 刘克辛. 非酒精性脂肪性肝炎治疗的潜在新靶点: 核受体FXR. 世界华人消化杂志 2016; 24(15): 2289-2297
Revised: March 17, 2016
Accepted: March 22, 2016
Published online: May 28, 2016
Non-alcoholic fatty liver disease (NAFLD) has become a very common chronic liver disease all over the world. The high incidence of NAFLD is closely related to obesity, diabetes and metabolic disorders. Insulin resistance and dyslipidemia following the hepatic proinflammatory response and fibrosis are the primary features of NAFLD deterioration. Nuclear receptor farnesoid X receptor (FXR) regulates lipid metabolism and homeostasis. Clarification of FXR function and features can provide a better understanding of the pathophysiological characteristics of non-alcoholic steatohepatitis (NASH) and illuminate the mechanism of NAFLD/NASH potential therapeutic targets. FXR activation can inhibit the de novo hepatic lipogenesis, improve insulin sensitivity and protect against bile acid-induced cytotoxicity. Clinical studies indicated that FXR agonists or modulators are very promising for the clinical treatment of NAFLD and NASH. This review focuses on the important regulatory role of FXR in NASH.
- Citation: Duan XP, Meng Q, Liu KX. Nuclear receptor FXR: A potential therapeutic target for non-alcoholic steatohepatitis. Shijie Huaren Xiaohua Zazhi 2016; 24(15): 2289-2297
- URL: https://www.wjgnet.com/1009-3079/full/v24/i15/2289.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i15.2289
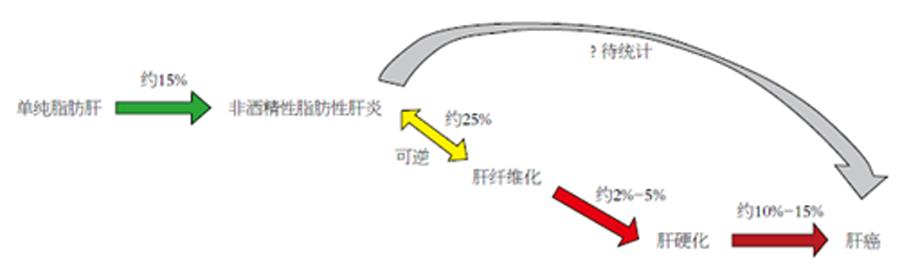
目前, 非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)已经成为全球关乎公众健康问题的慢性肝脏疾病, 世界范围内NAFLD的发病率约在9%-37%, 近年来我国的NAFLD的发病率也明显上升, 且呈低龄化和逐年上升的趋势[1]. NAFLD是一种广谱的以原发性肝细胞脂肪变性为主要特征的肝脏类疾病, 包括单纯的脂肪变性和非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH), NASH进一步发展可形成肝纤维化、肝硬化、肝衰竭甚至是肝癌(hepatocellular carcinoma, HCC)[2](图1). 目前, 针对NASH患者并没有确切有效的药物治疗, 对一般晚期患者采用的有效治疗方案是肝脏移植[3]. 按目前的发展趋势, 在未来几十年, NASH将很可能会成为肝脏移植的首要原因[4]; 随着我国的经济发展, 民众生活水平的提高, 糖尿病和肥胖的患病率也明显增加, NAFLD/NASH也日渐成为影响人们健康的突出问题. NAFLD/NASH在普通人群中发病率约为20%, 在患有Ⅱ型糖尿病、肥胖症以及代谢综合征的患者中发病率会明显升高[5], 尤其是高脂血症患者的发病率高达90%[6]. 与同时期的患病总人数相比, NAFLD和NASH患者的总体存活率都在逐年下降[7]. 研究[8]发现, 糖类和脂质的代谢紊乱是NAFLD进一步发展恶化的主要影响因素. 法尼酯衍生物X受体(farnesoid X receptor, FXR/NR1H4)属于核受体超家族的一员, 主要在肝脏、小肠、肾脏、肾上腺表达, 脂肪组织中也有少量表达. 最初的命名源于法尼醇较弱的激活作用[9], 在人染色体上的基因位点是12q23.1[10], 有4种亚型FXRa1、FXRa2、FXRa3、FXRa4[11]. 在1999年就有研究[12]证明FXR与胆汁酸的结合可以激活FXR核受体. 目前已经人工合成出多种FXR的激动剂, 其中非甾体的GW4064已广泛地用于啮齿类动物的体内及体外研究[13]; 奥贝胆酸(obeticholic acid, OCA)也在Ⅱ型糖尿病和NAFLD患者身上进行Ⅱ期临床研究[7]. 由于FXR激活后能够调节多种控制胆汁酸代谢的基因, 因此FXR也被称为"控制细胞内胆汁酸的感受器". 临床研究[14]发现: NASH患者的血浆和肝脏中的胆汁酸水平均高于正常范围, 暗示该疾病的发展与胆汁酸引起的细胞毒性很可能存在联系[15]. 敲除FXR基因的小鼠, 在9-12 mo的时候出现明显的肝脏炎症和肝损伤症状, 并可自发地形成HCC, 这与NASH患者的晚期症状相一致[16]. 近年的研究也表明FXR的激动剂能够改善胆汁淤积导致的慢性肝损伤和纤维化[17], 通过抑制肝星型细胞(hepatic stellate cell, HSC)的增殖和激活而改善肝纤维化[18]. 本综述主要阐明FXR在肝脏的脂肪变性和纤维化中的重要调控作用以及在NASH中通过对FXR的药理学调节所产生的潜在治疗意义, 进而为其治疗药物的开发提供重要依据.
胆汁酸是胆汁的主要成分, 在肝脏中形成后储存在胆囊, 经释放进入小肠而发挥作用. 对胆汁酸药理学活性的调节可以为肝脏和代谢类疾病提供潜在的治疗策略[19]. FXR的激活不仅可以调节多种参与胆汁酸转运的蛋白表达, 而且可以调节在体内维持胆汁酸和脂质平衡方面一些合成酶的表达. 胆汁酸的肝肠循环对肝脏内胆汁的形成、小肠内脂类和脂溶性维生素的吸收都具有非常重要的生理学意义[20]. 在回肠末端, 参与肝肠循环的胆汁酸约有95%会被重吸收经门静脉转运回肝脏, 进而形成"胆汁酸池"[21]. 肝脏内胆汁的过度蓄积与肝纤维化过程密切相关[22], 高浓度的胆汁酸会产生细胞毒性, 例如在胆汁淤积的情况下, 因细胞内的胆汁酸浓度升高而在激活保护机制的同时, 也会对肝细胞和胆管细胞造成严重的损伤. FXR主要是通过调节胆汁酸的合成、分泌、结合、转运、重吸收以及解毒作用而调节胆汁酸的体内平衡过程[7].
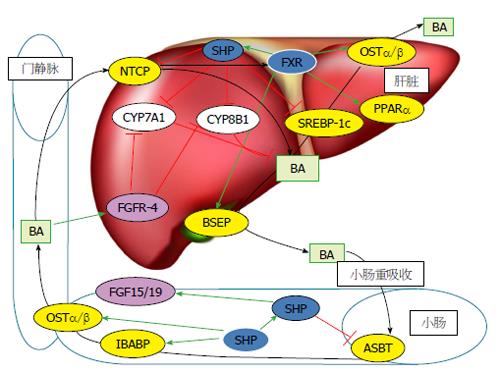
图2为FXR在肝肠循环中的调控作用示意图. 激活FXR后诱导肝脏中的小分子异源二聚体(small heterodimer partner, SHP)的表达进而抑制CYP7A1和CYP8B1的表达, 促进胆汁酸盐外排泵(bile salt export pump, BSEP)的表达, 抑制钠离子-牛磺胆酸共转运蛋白(sodium taurocholate cotransporting polypeptide, NTCP)的表达[23]. 敲除SHP基因的小鼠, 给予FXR的激动剂后并未抑制CYP7A1的表达[24], 这说明FXR对CYP7A1的抑制作用是经SHP来实现的. 在小肠上皮细胞, FXR激活后可抑制钠依赖性胆汁酸转运体(apical sodium dependent bile acid transporter, ASBT)的表达, 诱导回肠胆汁酸结合蛋白(ileal bile acid binding protein, IBABP)和有机可溶性类固醇转运体α/β(organic solute and steroid transporters α/β, OSTα/β)的表达[25]. 小肠内的胆汁酸激活FXR后诱导纤维母细胞生长因子15/19(fibroblast growth factor 15/19, FGF15/19)的表达, FGF15/19分泌后进入肝脏, 与肝细胞表面受体-4(fibroblast growth factor receptor-4, FGFR-4)相结合, 进而下调CYP7A1和CYP8B1的表达[26].
在病态肥胖的NASH患者中的研究[27]发现, 由于NTCP和BSEP的表达下调使其体内胆汁酸的转运和代谢过程均发生明显改变, 这也间接说明FXR在NASH的形成过程中的重要作用. FXR的激活可阻止胆汁酸浓度过高而对肝细胞造成损伤, 值得提及的是, 小肠内FXR的选择性再激活不仅可以修复胆汁酸的肝肠循环, 而且可以抑制敲除FXR基因的小鼠自发地形成HCC[28]. 总之, FXR作为"控制胆汁酸的感受器", 不仅抑制胆汁酸的从头合成和重吸收过程, 而且调节胆管内与胆汁酸的结合、解毒、外排有关的酶的表达, 如葡萄糖醛酸转移酶、硫酸基转移酶以及谷胱甘肽-S-转移酶[29,30].
FXR激活后, 主要通过调节肝脏内胰岛素的敏感性和脂肪的代谢过程, 从而对肝脏脂肪变性过程中一些重要的病理生理学过程产生明显的影响.
在代谢综合征、肥胖症、糖尿病患者中经常出现胰岛素耐受现象, 这些均被认为是发展成NASH的关键因素[31]. FXR的基因缺陷可导致葡萄糖耐量受损和胰岛素抵抗. 在糖尿病动物模型中, 肝脏中FXR的表达降低, 给予胰岛素后其表达增加[19]. Cariou等[32]在胰岛素的敏感性研究中发现敲除FXR基因的小鼠会发生外周胰岛素耐受现象, 主要表现在外周葡萄糖代谢减少, 低浓度的胰岛素对肝糖原分解的抑制作用减弱[33]. FXR的基因缺陷与正常肝脏的胰岛素敏感性有关[32], 有研究[34]报道GW4064可以明显改善db/db和ob/ob的糖尿病模型小鼠中的胰岛素敏感性, 这表明FXR的激动剂很可能是胰岛素的敏化剂, 可增强胰岛素的敏感性.
目前, FXR增强胰岛素敏感性的分子机制依然知之甚少. 在外周胰岛素敏感的脂肪组织中, FXR的基因缺陷促进胰岛素靶组织内的异位脂质蓄积, 加之胰岛素的信号转导被削弱, 进而就产生"脂毒性"[35]. 敲除FXR基因后的小鼠, 游离脂肪酸的循环水平明显升高, 肝脏内的甘油三酯的含量也升高[33]. 过多的游离脂肪酸经肝肠循环进入肝脏, 将使甘油三酯的合成和消除过程失衡导致过量的甘油三酯以脂滴形式在肝脏内蓄积[36].
FXR能够增强胰岛素的敏感性主要鉴于其在脂肪组织中作用. 在离体小鼠胚胎成纤维细胞(3T3-L1)和胚胎纤维母细胞(mouse embryonic fibroblasts, MEFs)的分化过程中, FXR的表达是逐渐增加的. 在MEFs的模型中, FXR的基因缺陷抑制脂肪的形成和甘油三酯的蓄积[32]; 在3T3-L1分化的脂肪细胞中, GW4064明显改善胰岛素信号传递过程以及胰岛素诱导的葡萄糖摄取过程[37]. 小鼠的FXR基因敲除后, 因脂肪细胞的胰岛素敏感性降低而导致出现了温和的脂肪萎缩. 胰岛素调节葡萄糖的摄取主要是通过葡萄糖转运体GLUT4从细胞内转位到质膜上来实现的, 研究[38]表明FXR的激活可直接刺激葡萄糖转运体GLUT4的表达, 改善胰岛素耐受现象. 上述结果表明, FXR的激活可以增强胰岛素的敏感性, 进而改善甘油三酯在肝脏内的蓄积.
在NAFLD发病机制中脂质代谢紊乱扮演重要的角色[39]. 通过抑制固醇调节元件结合蛋白1c(sterol regulatory element binding protein-1c, SREBP-1c)的转录过程, FXR抑制脂肪的生成和甘油三酯的合成[40]. 在小鼠的肝脏及原代肝细胞中, FXR激活后抑制SREBP-1c以及脂肪形成的靶基因脂肪酸合成酶(fatty acid synthetase, FASN)表达, 该过程与SHP的表达成依赖性关系[41]. 甘油三酯是脂肪从头合成后经载脂蛋白B转运以及极低密度脂蛋白(very low density lipoprotein, VLDL)的组装加工后的产物[42]. FXR的激动剂诱导脂肪酸氧化酶的表达, 如过氧化物酶体增殖激活受体α(peroxisome proliferation activated receptor-α, PPARα)以及其靶基因丙酮酸脱氢酶[43]. PPARα是促进脂肪酸β氧化、摄取和清除的酶, 敲除PPARα基因的小鼠会出现高脂血症的症状[44]. 在高脂饮食诱导的NAFLD或蛋氨酸胆碱缺乏饲料诱导的NASH动物模型中, 给予PPARα的激动剂(Wy 14643)后肝脏的脂肪变性和炎症症状均得到明显的改善[45]. 与调节肝脏内甘油三酯的结论一致, FXR与NAFLD的进一步发展有关, 并且激活FXR后可以抑制大鼠和小鼠发生脂肪变性[46]. 肝脏内脂质的蓄积所导致的脂肪变性是NASH形成的第一次打击.
在高脂血症小鼠模型的研究中发现, 敲除低密度脂蛋白受体(low density lipoprotein receptor, LDLR)的小鼠, FXR的基因缺陷可诱导产生NASH. FXR的基因缺陷与大泡性脂肪变性, 尤其与发生炎症细胞因子浸润密切相关[47]. 在啮齿类动物的研究中, 发现FXR激活后会改善肝脏中的脂肪变性. 在KK-A(y)模型小鼠中, 给予胆汁酸后可降低肝脏中甘油三酯的蓄积和VLDL的分泌, 但却升高血清中甘油三酯的浓度; 在db/db模型小鼠中, 给予FXR激动剂GW4064后肝脏中的中性脂质的蓄积明显减少[34].
上述的结果提示: FXR激活后主要通过减少肝脏内脂肪的从头合成, 促进脂肪酸的氧化而减少甘油三酯在肝脏内的蓄积. 该过程在治疗NAFLD/NASH中具有积极的作用[48].
肝纤维化是NASH患者的主要组织病理学特征, 也是肝损伤恶化的表现, HSC的激活对肝纤维化的发生具有决定性作用[49]. FXR的激活能够调节肝脏炎症和纤维化过程[50]. 促炎症反应和氧化应激是NASH形成的第二次打击, 进一步发展可导致肝炎以及肝纤维化、肝硬化甚至是HCC. "二次打击学说"是目前被广泛接受的NASH发生的经典机制. 在啮齿类动物的急性期反应过程中, 肝脏中FXR的表达下调[51], 从侧面说明FXR参与调节炎症反应的基因表达. 当给予胆汁酸后, 诱导小鼠的细胞间黏附分子-1(intercellular cell adhesion molecule 1, ICAM-1)、血管细胞黏附分子-1(vascular cell adhesion molecule 1, VCAM-1)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)以及血清淀粉样蛋白A2的表达; 人肝细胞的体外实验也证明FXR增强ICAM-1启动子的转录活性[52]. 上述结果表明: 肝脏中FXR的激活与有害的促炎症发生的细胞因子有关.
最近研究[53]表明: 在体外的HCC细胞和原代肝细胞实验中, FXR的激活抑制核因子-κB(nuclear factor kappa B, NF-κB)的转录活性, 进而抑制下游的促炎症基因如干扰素γ, TNF-α和白介素-6(interleukin-6, IL-6)的表达. 在均给予脂多糖的情况下, 敲除FXR基因的小鼠比野生型小鼠更易于形成坏死以及较严重的炎症[54]. 虽然FXR在大鼠和人的HSC中只有少量表达, 但是其作用却非常重大[55]. 在研究纤维化的过程发现, HSC的激活是细胞外基质沉淀和蓄积的主要原因. 在慢性肝病中, HSC从静息储存脂肪的表型向类似于成肌纤维母细胞的表型进行分化, 该过程与纤维化的关键基因即α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)的表达增加有关. 敲除FXR基因的小鼠给予高脂饮食后更容易出现高脂血症、肝脏脂肪变性与坏死性炎症、肝纤维化, 提示FXR与肝脏生理病理之间存在紧密关系. FXR的激动剂6-乙基鹅去氧胆酸(6E-CDCA)抑制HSC的分化, 从而抑制已发生肝损伤的啮齿类动物进一步发生肝纤维化[56]; 在硫代乙酰胺诱导的大鼠肝纤维化模型中, 6E-CDCA抑制并逆转肝纤维化和肝硬化症状、明显降低门静脉压[53]. 上述结果表明, FXR的激活主要通过抑制炎症相关因子和肝星型细胞的激活抑制肝脏炎症和肝纤维化的发生.
将近有25%的NASH患者会发展成肝硬化, 而其中将近10%-15%的肝硬化又会进一步发展成HCC[57]. 在NASH患者中, 肝硬化是导致其病情进一步恶化形成HCC的关键影响因素. FXR基因的缺失对高血脂、脂肪性肝炎、肝细胞的恶性转化具有促进作用. 在肥胖型HCC的小鼠模型中, 去氧胆酸(deoxycholic acid, DCA)的浓度与HSC的衰老密切相关, 而HSC的衰老又与促进HCC的形成有关, HSC被激活后就会促进HCC细胞的增殖[58]. HCC是NAFLD患者的脂肪性肝硬化的严重后果, 有研究[59]表明有4%-27%的NASH进展的肝硬化病例会发展为恶性的肝细胞癌. 在慢性肝炎中, 肝细胞的坏死和再生之间的反复循环将可能导致不受控制的肝再生, 这也是肝脏癌变的重要因素之一. 在敲除FXR基因的大龄小鼠(12-15 mo)中HCC的发病率明显升高, 表明FXR在肝脏功能调节中的重要性[60]; 在小鼠模型中, 小肠内FXR基因的选择性再激活也可以避免HCC的发生[28]. 目前为止, 虽然已确定FXR与肝硬化和HCC之间存在必然的联系, 但仍需要进一步大量的临床前和临床研究才可以具体阐明.
到目前为止, 还没有确定FXR的基因突变与人类疾病之间的必然联系. 但是定量的特征轨迹分析研究[61]表明, FXR的基因多态性很可能是胆结石易感性的主要遗传因素. 对健康志愿者、肥胖症患者和Ⅱ型糖尿病患者的研究发现, 血浆中的胆汁酸浓度与胰岛素敏感性成负相关[62]. 很明显胆汁酸代谢与胰岛素的敏感性之间具有关联性, 但胆汁酸在肝肠循环中水平的提高是否是胰岛素耐受形成的一部分或是其标志仍然有待进一步研究. 在人体内的研究中给予胆汁酸的螯合剂后胆汁酸的肝肠循环遭到破坏[63]; 在降脂实验中, 胆汁酸的螯合剂降低血糖和糖化血红蛋白的浓度[64]. 在Ⅱ期临床研究阶段, 患有Ⅱ型糖尿病的NAFLD患者体内, OCA使血清中FGF19的水平提高, 表明FXR的激活能够改善胰岛素的敏感性[65]. 其他的FXR激动剂的进一步相关的临床试验, 需要确定其在治疗肥胖、Ⅱ型糖尿病和NAFLD时的功能相关性. OCA作为FXR的激动剂, 美国食品和药物管理局(Food and Drug Administration, FDA)已经授予其突破性疗法认定, 并在美国国家糖尿病、消化和肾脏疾病研究所进行为期72 wk的临床研究, 用以评估对NASH的改善及治疗效果; 非甾体激动剂Px 104在NAFLD患者身上进行Ⅱ期临床试验以评估其治疗效果[7]. 上述结果表明, 目前的临床研究支持FXR的激动剂类药物对治疗NASH具有潜在的可行性.
FXR核受体属于多功能的核受体, 参与调控胆汁酸、脂质、糖类等物质的体内代谢与平衡. FXR作为NASH潜在的治疗靶点主要表现在: (1)FXR激活后调节胆汁酸的体内平衡过程进而间接调节脂质和胆固醇代谢; (2)FXR激活后改善胰岛素的敏感性、抑制甘油三酯的蓄积、促进脂肪酸的氧化进而改善肝脏的脂肪变性和脂质蓄积; (3)FXR激活后抑制相关炎症因子的表达和肝星型细胞的激活从而抑制肝脏炎症和肝纤维化; (4)对FXR的功能调节可预防因肝损伤而导致的肝硬化和HCC的发生.
FXR作为NASH潜在的治疗靶点, 激活后可降低肝脏脂肪的生成、改善脂肪变性和胰岛素的敏感性、抑制可导致肝硬化或HCC的炎症和纤维化的发生以及发挥肝保护作用等, 有望成为临床上治疗NAFLD和NASH的新靶点.
非酒精性脂肪肝炎(non-alcoholic steatohepatitis, NASH)可进一步发展导致肝纤维化、肝硬化、肝衰竭甚至是肝癌. 目前, 针对NASH的患者并没有确切有效的药物治疗, 所以针对NASH的特异性治疗药物的研究非常有必要. 核受体法尼酯衍生物X受体(farnesoid X receptor, FXR)除维持胆汁酸和胆固醇的体内平衡外, 还具有调节脂质代谢、葡萄糖的体内平衡、改善肝脏炎症、抑制肝纤维化等功能. 近来的研究发现, FXR可能是治疗NASH的潜在新靶点.
邢卉春, 教授, 主任医师, 首都医科大学附属北京地坛医院肝病三科; 刘长征, 副教授, 中国医学科学院基础医学研究所; 展玉涛, 主任医师, 首都医科大学附属北京同仁医院消化科
FXR作为治疗NASH的潜在作用靶点, 其激动剂治疗NASH是目前肝脏研究的热点. 进一步深入的研究FXR作为NASH的潜在治疗靶点, 通过激活FXR受体, 究竟会产生怎样的临床治疗效果是目前肝脏研究中的新方向.
Watanabe等研究发现, FXR激活后通过抑制固醇调节元件结合蛋白-1c(SREBP-1c)的表达抑制甘油三酯的合成; 促进过氧化物酶体增殖激活受体α(PPARα)的表达增加脂肪酸的氧化, 最终都可以抑制甘油三酯在肝脏内的过量蓄积.
本文简要概述了FXR在胆汁酸代谢中的调节作用, 以及FXR激活后对脂肪变性、肝纤维化、肝再生和肝癌变的调节作用, 并在此基础上阐述了FXR作为治疗NASH的潜在靶点的临床研究价值, 对研发治疗NASH的药物有重要的指导意义.
核受体FXR作为治疗NASH的潜在新靶点, 通过药物激活FXR后可以改善NASH患者的胰岛素耐受、肝脏脂肪变性以及肝纤维化, 有望为临床上治疗NASH提供新的思路.
本文作为综述性文章, 层次、逻辑、整体把握较好, 并且为NASH的治疗提供新的思路, 具有较好的应用价值.
编辑: 于明茜 电编:都珍珍
| 1. | Younossi ZM, Stepanova M, Afendy M, Fang Y, Younossi Y, Mir H, Srishord M. Changes in the prevalence of the most common causes of chronic liver diseases in the United States from 1988 to 2008. Clin Gastroenterol Hepatol. 2011;9:524-530.e1; quiz e60. [PubMed] [DOI] |
| 2. | Aguilar-Olivos NE, Carrillo-Córdova D, Oria-Hernández J, Sánchez-Valle V, Ponciano-Rodríguez G, Ramírez-Jaramillo M, Chablé-Montero F, Chávez-Tapia NC, Uribe M, Méndez-Sánchez N. The nuclear receptor FXR, but not LXR, up-regulates bile acid transporter expression in non-alcoholic fatty liver disease. Ann Hepatol. 2015;14:487-493. [PubMed] |
| 3. | Wong RJ, Aguilar M, Cheung R, Perumpail RB, Harrison SA, Younossi ZM, Ahmed A. Nonalcoholic steatohepatitis is the second leading etiology of liver disease among adults awaiting liver transplantation in the United States. Gastroenterology. 2015;148:547-555. [PubMed] [DOI] |
| 4. | Charlton MR, Burns JM, Pedersen RA, Watt KD, Heimbach JK, Dierkhising RA. Frequency and outcomes of liver transplantation for nonalcoholic steatohepatitis in the United States. Gastroenterology. 2011;141:1249-1253. [PubMed] [DOI] |
| 5. | Leite NC, Villela-Nogueira CA, Cardoso CR, Salles GF. Non-alcoholic fatty liver disease and diabetes: from physiopathological interplay to diagnosis and treatment. World J Gastroenterol. 2014;20:8377-8392. [PubMed] [DOI] |
| 6. | Gaggini M, Morelli M, Buzzigoli E, DeFronzo RA, Bugianesi E, Gastaldelli A. Non-alcoholic fatty liver disease (NAFLD) and its connection with insulin resistance, dyslipidemia, atherosclerosis and coronary heart disease. Nutrients. 2013;5:1544-1560. [PubMed] [DOI] |
| 7. | Ali AH, Carey EJ, Lindor KD. Recent advances in the development of farnesoid X receptor agonists. Ann Transl Med. 2015;3:5. [PubMed] |
| 8. | Méndez-Sánchez N, Arrese M, Zamora-Valdés D, Uribe M. Current concepts in the pathogenesis of nonalcoholic fatty liver disease. Liver Int. 2007;27:423-433. [PubMed] [DOI] |
| 9. | Forman BM, Goode E, Chen J, Oro AE, Bradley DJ, Perlmann T, Noonan DJ, Burka LT, McMorris T, Lamph WW. Identification of a nuclear receptor that is activated by farnesol metabolites. Cell. 1995;81:687-693. [PubMed] [DOI] |
| 10. | Cariou B, Staels B. FXR: a promising target for the metabolic syndrome? Trends Pharmacol Sci. 2007;28:236-243. [PubMed] [DOI] |
| 11. | Zhang Y, Kast-Woelbern HR, Edwards PA. Natural structural variants of the nuclear receptor farnesoid X receptor affect transcriptional activation. J Biol Chem. 2003;278:104-110. [PubMed] [DOI] |
| 12. | Makishima M, Okamoto AY, Repa JJ, Tu H, Learned RM, Luk A, Hull MV, Lustig KD, Mangelsdorf DJ, Shan B. Identification of a nuclear receptor for bile acids. Science. 1999;284:1362-1365. [PubMed] [DOI] |
| 13. | Maloney PR, Parks DJ, Haffner CD, Fivush AM, Chandra G, Plunket KD, Creech KL, Moore LB, Wilson JG, Lewis MC. Identification of a chemical tool for the orphan nuclear receptor FXR. J Med Chem. 2000;43:2971-2974. [PubMed] [DOI] |
| 14. | Dasarathy S, Yang Y, McCullough AJ, Marczewski S, Bennett C, Kalhan SC. Elevated hepatic fatty acid oxidation, high plasma fibroblast growth factor 21, and fasting bile acids in nonalcoholic steatohepatitis. Eur J Gastroenterol Hepatol. 2011;23:382-388. [PubMed] [DOI] |
| 15. | Aranha MM, Cortez-Pinto H, Costa A, da Silva IB, Camilo ME, de Moura MC, Rodrigues CM. Bile acid levels are increased in the liver of patients with steatohepatitis. Eur J Gastroenterol Hepatol. 2008;20:519-525. [PubMed] [DOI] |
| 16. | Yang F, Huang X, Yi T, Yen Y, Moore DD, Huang W. Spontaneous development of liver tumors in the absence of the bile acid receptor farnesoid X receptor. Cancer Res. 2007;67:863-867. [PubMed] [DOI] |
| 17. | Liu Y, Binz J, Numerick MJ, Dennis S, Luo G, Desai B, MacKenzie KI, Mansfield TA, Kliewer SA, Goodwin B. Hepatoprotection by the farnesoid X receptor agonist GW4064 in rat models of intra- and extrahepatic cholestasis. J Clin Invest. 2003;112:1678-1687. [PubMed] [DOI] |
| 18. | Fiorucci S, Rizzo G, Antonelli E, Renga B, Mencarelli A, Riccardi L, Orlandi S, Pruzanski M, Morelli A, Pellicciari R. A farnesoid x receptor-small heterodimer partner regulatory cascade modulates tissue metalloproteinase inhibitor-1 and matrix metalloprotease expression in hepatic stellate cells and promotes resolution of liver fibrosis. J Pharmacol Exp Ther. 2005;314:584-595. [PubMed] [DOI] |
| 19. | Mazuy C, Helleboid A, Staels B, Lefebvre P. Nuclear bile acid signaling through the farnesoid X receptor. Cell Mol Life Sci. 2015;72:1631-1650. [PubMed] [DOI] |
| 20. | Fan M, Wang X, Xu G, Yan Q, Huang W. Bile acid signaling and liver regeneration. Biochim Biophys Acta. 2015;1849:196-200. [PubMed] [DOI] |
| 21. | Li G, L Guo G. Farnesoid X receptor, the bile acid sensing nuclear receptor, in liver regeneration. Acta Pharm Sin B. 2015;5:93-98. [PubMed] [DOI] |
| 22. | Hayashi H, Sakai T. Animal models for the study of liver fibrosis: new insights from knockout mouse models. Am J Physiol Gastrointest Liver Physiol. 2011;300:G729-G738. [PubMed] [DOI] |
| 24. | Yuan L, Bambha K. Bile acid receptors and nonalcoholic fatty liver disease. World J Hepatol. 2015;7:2811-2818. [PubMed] [DOI] |
| 25. | Boyer JL, Trauner M, Mennone A, Soroka CJ, Cai SY, Moustafa T, Zollner G, Lee JY, Ballatori N. Upregulation of a basolateral FXR-dependent bile acid efflux transporter OSTalpha-OSTbeta in cholestasis in humans and rodents. Am J Physiol Gastrointest Liver Physiol. 2006;290:G1124-G1130. [PubMed] [DOI] |
| 26. | Uriarte I, Fernandez-Barrena MG, Monte MJ, Latasa MU, Chang HC, Carotti S, Vespasiani-Gentilucci U, Morini S, Vicente E, Concepcion AR. Identification of fibroblast growth factor 15 as a novel mediator of liver regeneration and its application in the prevention of post-resection liver failure in mice. Gut. 2013;62:899-910. [PubMed] [DOI] |
| 27. | Bechmann LP, Kocabayoglu P, Sowa JP, Sydor S, Best J, Schlattjan M, Beilfuss A, Schmitt J, Hannivoort RA, Kilicarslan A. Free fatty acids repress small heterodimer partner (SHP) activation and adiponectin counteracts bile acid-induced liver injury in superobese patients with nonalcoholic steatohepatitis. Hepatology. 2013;57:1394-1406. [PubMed] [DOI] |
| 28. | Degirolamo C, Modica S, Vacca M, Di Tullio G, Morgano A, D'Orazio A, Kannisto K, Parini P, Moschetta A. Prevention of spontaneous hepatocarcinogenesis in farnesoid X receptor-null mice by intestinal-specific farnesoid X receptor reactivation. Hepatology. 2015;61:161-170. [PubMed] [DOI] |
| 29. | Lee FY, de Aguiar Vallim TQ, Chong HK, Zhang Y, Liu Y, Jones SA, Osborne TF, Edwards PA. Activation of the farnesoid X receptor provides protection against acetaminophen-induced hepatic toxicity. Mol Endocrinol. 2010;24:1626-1636. [PubMed] [DOI] |
| 30. | Lee FY, Lee H, Hubbert ML, Edwards PA, Zhang Y. FXR, a multipurpose nuclear receptor. Trends Biochem Sci. 2006;31:572-580. [PubMed] [DOI] |
| 31. | Hassan K, Bhalla V, El Regal ME, A-Kader HH. Nonalcoholic fatty liver disease: a comprehensive review of a growing epidemic. World J Gastroenterol. 2014;20:12082-12101. [PubMed] [DOI] |
| 32. | Cariou B, van Harmelen K, Duran-Sandoval D, van Dijk TH, Grefhorst A, Abdelkarim M, Caron S, Torpier G, Fruchart JC, Gonzalez FJ. The farnesoid X receptor modulates adiposity and peripheral insulin sensitivity in mice. J Biol Chem. 2006;281:11039-11049. [PubMed] [DOI] |
| 33. | Ma K, Saha PK, Chan L, Moore DD. Farnesoid X receptor is essential for normal glucose homeostasis. J Clin Invest. 2006;116:1102-1109. [PubMed] [DOI] |
| 34. | Zhang Y, Lee FY, Barrera G, Lee H, Vales C, Gonzalez FJ, Willson TM, Edwards PA. Activation of the nuclear receptor FXR improves hyperglycemia and hyperlipidemia in diabetic mice. Proc Natl Acad Sci U S A. 2006;103:1006-1011. [PubMed] [DOI] |
| 35. | Unger RH, Orci L. Lipoapoptosis: its mechanism and its diseases. Biochim Biophys Acta. 2002;1585:202-212. [PubMed] [DOI] |
| 36. | Pacana T, Sanyal AJ. Recent advances in understanding/management of non-alcoholic steatohepatitis. F1000Prime Rep. 2015;7:28. [PubMed] [DOI] |
| 37. | Rizzo G, Disante M, Mencarelli A, Renga B, Gioiello A, Pellicciari R, Fiorucci S. The farnesoid X receptor promotes adipocyte differentiation and regulates adipose cell function in vivo. Mol Pharmacol. 2006;70:1164-1173. [PubMed] [DOI] |
| 38. | Shen H, Zhang Y, Ding H, Wang X, Chen L, Jiang H, Shen X. Farnesoid X receptor induces GLUT4 expression through FXR response element in the GLUT4 promoter. Cell Physiol Biochem. 2008;22:1-14. [PubMed] [DOI] |
| 39. | Musso G, Gambino R, Cassader M. Cholesterol metabolism and the pathogenesis of non-alcoholic steatohepatitis. Prog Lipid Res. 2013;52:175-191. [PubMed] [DOI] |
| 41. | Watanabe M, Houten SM, Wang L, Moschetta A, Mangelsdorf DJ, Heyman RA, Moore DD, Auwerx J. Bile acids lower triglyceride levels via a pathway involving FXR, SHP, and SREBP-1c. J Clin Invest. 2004;113:1408-1418. [PubMed] [DOI] |
| 42. | Gibbons GF. Assembly and secretion of hepatic very-low-density lipoprotein. Biochem J. 1990;268:1-13. [PubMed] |
| 43. | Savkur RS, Bramlett KS, Michael LF, Burris TP. Regulation of pyruvate dehydrogenase kinase expression by the farnesoid X receptor. Biochem Biophys Res Commun. 2005;329:391-396. [PubMed] [DOI] |
| 44. | Rogue A, Renaud MP, Claude N, Guillouzo A, Spire C. Comparative gene expression profiles induced by PPARγ and PPARα/γ agonists in rat hepatocytes. Toxicol Appl Pharmacol. 2011;254:18-31. [PubMed] [DOI] |
| 45. | Larter CZ, Yeh MM, Van Rooyen DM, Brooling J, Ghatora K, Farrell GC. Peroxisome proliferator-activated receptor-α agonist, Wy 14,643, improves metabolic indices, steatosis and ballooning in diabetic mice with non-alcoholic steatohepatitis. J Gastroenterol Hepatol. 2012;27:341-350. [PubMed] [DOI] |
| 46. | Schmitt J, Kong B, Stieger B, Tschopp O, Schultze SM, Rau M, Weber A, Müllhaupt B, Guo GL, Geier A. Protective effects of farnesoid X receptor (FXR) on hepatic lipid accumulation are mediated by hepatic FXR and independent of intestinal FGF15 signal. Liver Int. 2015;35:1133-1144. [PubMed] [DOI] |
| 47. | Day CP, James OF. Steatohepatitis: a tale of two "hits"? Gastroenterology. 1998;114:842-845. [PubMed] |
| 49. | Zhang S, Wang J, Liu Q, Harnish DC. Farnesoid X receptor agonist WAY-362450 attenuates liver inflammation and fibrosis in murine model of non-alcoholic steatohepatitis. J Hepatol. 2009;51:380-388. [PubMed] [DOI] |
| 50. | Schreuder TC, Marsman HA, Lenicek M, van Werven JR, Nederveen AJ, Jansen PL, Schaap FG. The hepatic response to FGF19 is impaired in patients with nonalcoholic fatty liver disease and insulin resistance. Am J Physiol Gastrointest Liver Physiol. 2010;298:G440-G445. [PubMed] [DOI] |
| 51. | Fang C, Yoon S, Tindberg N, Järveläinen HA, Lindros KO, Ingelman-Sundberg M. Hepatic expression of multiple acute phase proteins and down-regulation of nuclear receptors after acute endotoxin exposure. Biochem Pharmacol. 2004;67:1389-1397. [PubMed] [DOI] |
| 52. | Qin P, Borges-Marcucci LA, Evans MJ, Harnish DC. Bile acid signaling through FXR induces intracellular adhesion molecule-1 expression in mouse liver and human hepatocytes. Am J Physiol Gastrointest Liver Physiol. 2005;289:G267-G273. [PubMed] [DOI] |
| 53. | Adorini L, Pruzanski M, Shapiro D. Farnesoid X receptor targeting to treat nonalcoholic steatohepatitis. Drug Discov Today. 2012;17:988-997. [PubMed] [DOI] |
| 54. | Wang YD, Chen WD, Wang M, Yu D, Forman BM, Huang W. Farnesoid X receptor antagonizes nuclear factor kappaB in hepatic inflammatory response. Hepatology. 2008;48:1632-1643. [PubMed] [DOI] |
| 55. | Fickert P, Fuchsbichler A, Moustafa T, Wagner M, Zollner G, Halilbasic E, Stöger U, Arrese M, Pizarro M, Solís N. Farnesoid X receptor critically determines the fibrotic response in mice but is expressed to a low extent in human hepatic stellate cells and periductal myofibroblasts. Am J Pathol. 2009;175:2392-2405. [PubMed] [DOI] |
| 56. | Fiorucci S, Antonelli E, Rizzo G, Renga B, Mencarelli A, Riccardi L, Orlandi S, Pellicciari R, Morelli A. The nuclear receptor SHP mediates inhibition of hepatic stellate cells by FXR and protects against liver fibrosis. Gastroenterology. 2004;127:1497-1512. [PubMed] |
| 57. | Vernon G, Baranova A, Younossi ZM. Systematic review: the epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults. Aliment Pharmacol Ther. 2011;34:274-285. [PubMed] [DOI] |
| 58. | Shetty K, Chen J, Shin JH, Jogunoori W, Mishra L. Pathogenesis of hepatocellular carcinoma development in non alcoholic fatty liver disease. Curr Hepatol Rep. 2015;14:119-127. [PubMed] [DOI] |
| 59. | Lindor KD, Kowdley KV, Heathcote EJ, Harrison ME, Jorgensen R, Angulo P, Lymp JF, Burgart L, Colin P. Ursodeoxycholic acid for treatment of nonalcoholic steatohepatitis: results of a randomized trial. Hepatology. 2004;39:770-778. [PubMed] [DOI] |
| 60. | Kim I, Morimura K, Shah Y, Yang Q, Ward JM, Gonzalez FJ. Spontaneous hepatocarcinogenesis in farnesoid X receptor-null mice. Carcinogenesis. 2007;28:940-946. [PubMed] [DOI] |
| 61. | Wittenburg H, Lyons MA, Li R, Churchill GA, Carey MC, Paigen B. FXR and ABCG5/ABCG8 as determinants of cholesterol gallstone formation from quantitative trait locus mapping in mice. Gastroenterology. 2003;125:868-881. [PubMed] |
| 62. | Cariou B, Chetiveaux M, Zaïr Y, Pouteau E, Disse E, Guyomarc'h-Delasalle B, Laville M, Krempf M. Fasting plasma chenodeoxycholic acid and cholic acid concentrations are inversely correlated with insulin sensitivity in adults. Nutr Metab (Lond). 2011;8:48. [PubMed] [DOI] |
| 63. | Staels B, Kuipers F. Bile acid sequestrants and the treatment of type 2 diabetes mellitus. Drugs. 2007;67:1383-1392. [PubMed] |
| 64. | Zieve FJ, Kalin MF, Schwartz SL, Jones MR, Bailey WL. Results of the glucose-lowering effect of WelChol study (GLOWS): a randomized, double-blind, placebo-controlled pilot study evaluating the effect of colesevelam hydrochloride on glycemic control in subjects with type 2 diabetes. Clin Ther. 2007;29:74-83. [PubMed] [DOI] |
| 65. | Puri P, Wiest MM, Cheung O, Mirshahi F, Sargeant C, Min HK, Contos MJ, Sterling RK, Fuchs M, Zhou H. The plasma lipidomic signature of nonalcoholic steatohepatitis. Hepatology. 2009;50:1827-1838. [PubMed] [DOI] |