修回日期: 2014-11-12
接受日期: 2014-11-25
在线出版日期: 2015-01-18
目的: 探讨自噬相关蛋白Beclin1、LC3和P62在进展期胰腺癌组织中的表达及临床意义.
方法: 应用免疫组织化学法检测64例胰腺癌组织及相应癌旁正常组织中自噬相关蛋白Beclin1、LC3和P62的表达情况; 分析自噬蛋白表达水平与胰腺癌临床病理特征的关系.
结果: 免疫组织化学法检测提示Beclin1蛋白在胰腺癌组织及癌旁正常组织中阳性表达率分别为28.1%(18/64)、90.6%(58/64), LC3蛋白阳性表达率分别为34.4%(22/64)、75%(48/64), P62蛋白表达阳性率分别为75%(48/64)、46.9%(30/64), 均P<0.05; 胰腺癌组织中Beclin1与LC3的表达水平呈正相关(r = 0.572, P<0.05), Beclin1、LC3的表达与肿瘤分化、TNM分期相关(P<0.05), Beclin1、LC3和P62的表达均与性别、年龄、有无门脉浸润、淋巴结转移无明显相关(P>0.05).
结论: 自噬相关蛋白Beclin1、LC3和P62在胰腺癌组织中的异常表达及Beclin 1与LC3两者表达呈正相关提示自噬活动下降可能参与了进展期胰腺癌的发展.
核心提示: 自噬相关蛋白在胰腺癌组织中表达失调, 且与胰腺癌的分化程度及TNM分期相关, 提示自噬活动降低在胰腺癌的发病过程中、尤其是进展期胰腺癌的发展中起着重要作用.
引文著录: 张创杰, 张连峰, 周琳. 自噬相关蛋白Beclin1、LC3和P62在进展期胰腺癌中的表达及临床意义. 世界华人消化杂志 2015; 23(2): 318-323
Revised: November 12, 2014
Accepted: November 25, 2014
Published online: January 18, 2015
AIM: To investigate the expression of Beclin1, LC3 and P62 in advanced pancreatic cancer and to analyze their correlation with clinical and pathological parameters of pancreatic cancer.
METHODS: Immunohistochemistry was used to detect the expression of Beclin1, LC3 and P62 in 64 pancreatic cancer specimens and matched tumor-adjacent noncancerous tissues.
RESULTS: The positive rates of Beclin 1 [28.1% (18/64) vs 90.6% (58/64), P < 0.05] and LC3 [34.4% (22/64) vs 75% (48/64), P < 0.05] expression were significantly lower, and that of P62 expression [75% (48/64) vs 46.9% (30/64) P < 0.05] was significantly higher in pancreatic cancer than in matched tumor-adjacent noncancerous tissues. There was a significant correlation between Beclin1 and LC3 expression in pancreatic cancer (r = 0.572, P < 0.05). The expression of Beclin1 in pancreatic cancer was associated with tumor differentiation and stage (P < 0.05), while Beclin1, LC3 and P62 expression in pancreatic cancer had no significant correlation with gender, depth of tumor invasion, or lymph node metastasis (P > 0.05).
CONCLUSION: The abnormal expression of Beclin1, LC3 and P62 may be related to the carcinogenesis of pancreatic cancer.
- Citation: Zhang CJ, Zhang LF, Zhou L. Clinical significance of expression of autophagy-related proteins Beclin1, LC3 and P62 in advanced pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(2): 318-323
- URL: https://www.wjgnet.com/1009-3079/full/v23/i2/318.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i2.318
胰腺癌是一种具有高度侵袭性的恶性肿瘤, 发病隐匿, 大部分患者确诊时已属中晚期, 5年生存率仅有1%-4%, 预后极差[1,2]. 深入研究胰腺癌的发病机制对提高胰腺癌的早期诊断及改善预后非常重要. 自噬是真核细胞的非细胞凋亡性程序性死亡, 又称为Ⅱ型程序性细胞死亡. 近年来大量研究表明[3-5], 自噬参与了多种肿瘤的发生、发展, 并且在肿瘤发展的不同阶段扮演不同角色. 本研究通过免疫组织化学法研究自噬相关蛋白Beclin1、LC3和P62在进展期胰腺癌组织中的表达水平变化及其与胰腺癌临床病理特征的关系, 旨在探讨自噬在胰腺癌发病过程中的作用.
收集郑州大学第一附属医院2011-06/2013-06经外科手术切除的胰腺癌组织标本64例, 并搜集对应癌旁正常组织标本64例作为对照, 所有标本经两位病理医师证实, 均为胰腺导管腺癌. 患者术前均未接受放、化疗及免疫治疗. 64例胰腺癌中, 男47例, 女17例; 年龄36-81岁, 中位年龄61.0岁; 胰头癌41例, 胰体癌21例, 胰尾癌2例. 根据国际抗癌联合会(Union for International Cancer Control, UICC)的肿瘤分类法, 分为Ⅰ期5例、Ⅱ期22例、Ⅲ期37例. 高分化癌4例、中分化癌44例、低分化癌16例. 标本均经40 g/L甲醛固定, 常规石蜡包埋, 4 μm厚连续切片, 所有标本的临床和病理资料均完整. 试剂采用兔抗人Beclinl、LC3、P62多克隆抗体, 购自美国ABGENT公司; DAB显色试剂盒、SP免疫组织化学试剂盒(PV-9000), 购自北京中杉金桥生物技术有限公司.
采用免疫组织化学超敏两步法(SP法)染色, 一抗均采用工作液(其中Beclin1和P62以1:100稀释, LC3以1:50稀释), 用PBS代替一抗作对照, 在同一条件下进行S-P染色. 将所有标本进行脱蜡水化, 操作步骤按照说明书进行, 经SP染色, DAB显色, 苏木素复染, 脱水、透明、封片后显微镜下观察. 结果判断参照李良庆等[6]与王丽华等[7]的判断方法, 每个视野计数100个细胞, 根据其中阳性细胞的比率和染色深度分别进行评估, 最后综合评定. (1)阳性细胞的比率评分: 0分为阳性细胞数占总细胞数<10%, 1分为阳性细胞数占总细胞数10%-25%, 2分为阳性细胞数占总细胞数26%-50%, 3分为阳性细胞数占总细胞数>50%; (2)染色深度评分: 0分为无染色, 1分为淡黄色, 3分为黄色至棕黄色, 2分为染色强度介于1-3分之间; (3)总积分 = 阳性细胞比率评分×染色强度评分, ≤ 3分为阴性,>3分为阳性.
统计学处理 采用SPSS17.0进行统计分析. 不同病理特征间蛋白阳性率的比较采用χ2检验, 不同蛋白水平的相关性采用Spearman相关分析, 检验水准α = 0.05, P<0.05为差异具有统计学意义.
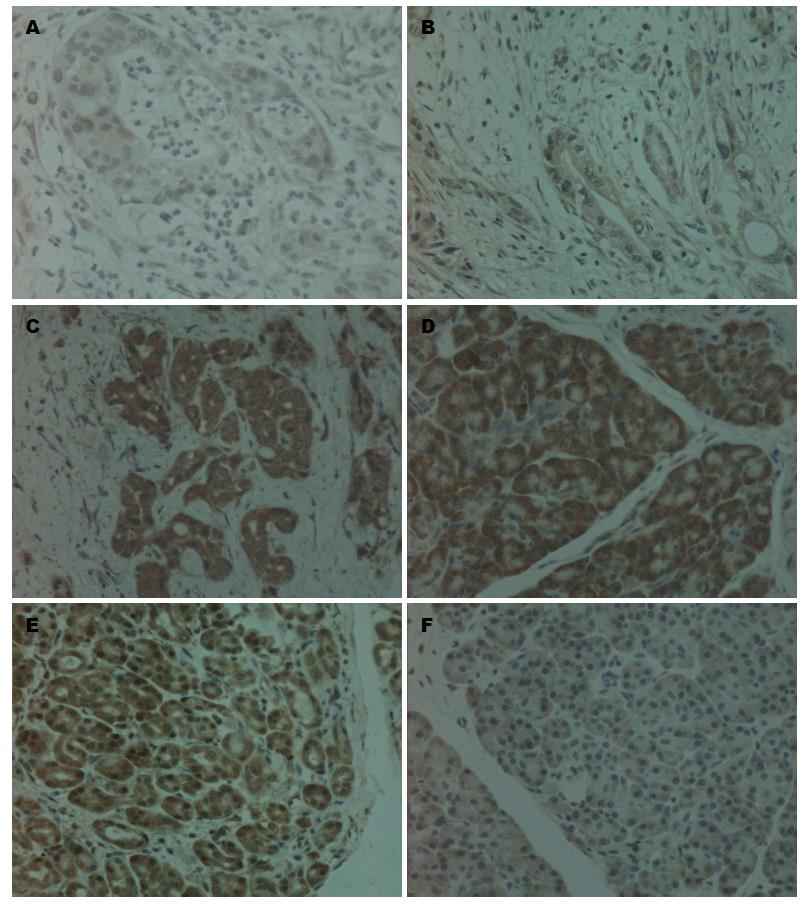
免疫组织化学法显示, Beclin1、LC3和P62阳性染色呈棕褐色颗粒, Beclin1阳性定位于细胞膜及细胞浆, LC3定位于细胞浆及部分胞核, P62阳性定位于细胞浆(图1). Beclin1在胰腺癌组织和癌旁正常组织中阳性表达率分别为28.1%(18/64)、90.6%(58/64); LC3在胰腺癌组织和癌旁正常组织中阳性表达率分别为34.4%(22/64)、75%(48/64); P62在胰腺癌组织和癌旁正常组织中阳性表达率分别为75%(48/64)、46.9%(30/64). 三种蛋白各自在癌组织及癌旁正常组织中的表达水平差异均具有统计学意义(均P<0.05)(表1).
| 组织类型 | Beclin1 | χ2值 | P值 | LC3 | χ2值 | P值 | P62 | χ2值 | P值 | |||
| + | - | + | - | + | - | |||||||
| 胰腺癌组织 | 18 | 46 | 22 | 42 | 48 | 16 | ||||||
| 癌旁正常组织 | 58 | 6 | 51.882 | 0.000 | 48 | 16 | 21.312 | 0.000 | 30 | 34 | 10.634 | 0.001 |
Beclin1在高、中、低分化腺癌中的阳性率为75%(3/4)、31.8%(14/44)、6.3%(1/16), LC3在高、中、低分化腺癌中的阳性率为75%(3/4)、38.6%(17/44)、12.5%(2/16), 各自差异均具有统计学意义(均P<0.05). Beclin1在TNMⅠ-Ⅱ期表达阳性率为44.4%(12/27)、Ⅲ-Ⅳ期表达阳性率为16.2%(6/37), LC3在TNMⅠ-Ⅱ期表达阳性率为48.1%(13/27), Ⅲ-Ⅳ期表达阳性率为24.3%(9/37), 差异均具有统计学意义(均P<0.05)(表2).
| 因素 | n | Beclin1 | χ2值 | P值 | LC3 | χ2值 | P值 | P62 | χ2值 | P值 | |||
| - | + | - | + | - | + | ||||||||
| 性别 | 0.589 | 0.443 | 1.651 | 0.199 | 2.1291 | 0.145 | |||||||
| 男 | 47 | 35 | 12 | 33 | 14 | 14 | 33 | ||||||
| 女 | 17 | 11 | 6 | 9 | 8 | 2 | 15 | ||||||
| 年龄(岁) | 0.914 | 0.339 | 1.523 | 0.217 | 1.022 | 0.312 | |||||||
| ≤ 60 | 31 | 24 | 7 | 18 | 13 | 6 | 25 | ||||||
| > 60 | 33 | 22 | 11 | 24 | 9 | 10 | 23 | ||||||
| 肿瘤直径(cm) | 0.059 | 0.087 | 3.782 | 0.052 | 0.084 | 0.772 | |||||||
| < 3 | 30 | 22 | 8 | 16 | 14 | 8 | 22 | ||||||
| ≥ 3 | 34 | 24 | 10 | 26 | 8 | 8 | 26 | ||||||
| 分化程度 | 8.4321 | 0.0151 | 6.6751 | 0.0361 | 1.4551 | 0.4831 | |||||||
| 高 | 4 | 1 | 3 | 1 | 3 | 2 | 2 | ||||||
| 中 | 44 | 30 | 14 | 27 | 17 | 10 | 34 | ||||||
| 低 | 16 | 15 | 1 | 14 | 2 | 4 | 12 | ||||||
| 肿瘤部位 | 1.0381 | 0.5951 | 1.3601 | 0.5071 | 0.8181 | 0.6641 | |||||||
| 胰头 | 41 | 31 | 10 | 29 | 12 | 10 | 31 | ||||||
| 胰体 | 21 | 14 | 7 | 12 | 9 | 6 | 15 | ||||||
| 胰尾 | 2 | 1 | 1 | 1 | 1 | 0 | 2 | ||||||
| TNM分期 | 6.153 | 0.013 | 3.927 | 0.048 | 0.192 | 0.661 | |||||||
| Ⅰ-Ⅱ期 | 27 | 15 | 12 | 14 | 13 | 6 | 21 | ||||||
| Ⅲ-Ⅳ期 | 37 | 31 | 6 | 28 | 9 | 10 | 27 | ||||||
| 门静脉或腹腔神经侵犯 | 0.4871 | 0.1151 | 1.0001 | ||||||||||
| 无 | 62 | 45 | 17 | 42 | 20 | 16 | 46 | ||||||
| 有 | 2 | 1 | 1 | 0 | 2 | 0 | 2 | ||||||
| 淋巴结转移 | 0.928 | 0.336 | 0.3521 | 0.7401 | |||||||||
| 无 | 48 | 36 | 12 | 30 | 18 | 13 | 35 | ||||||
| 有 | 16 | 10 | 6 | 12 | 4 | 3 | 13 | ||||||
Spearman相关分析显示, Beclin1与LC3在胰腺癌组织中的表达水平呈正相关(r = 0.572, P<0.05). P62蛋白的表达与Beclin1、LC3蛋白的表达均无明显相关(r值分别为0.04、0.11, P>0.05).
自噬是真核细胞不依赖于半胱氨酰天冬氨酸特异性蛋白酶(Caspase)的程序性细胞死亡, 是体内多余的蛋白质和亚细胞成分在溶酶体内降解的复杂的催化过程, 又被称为Ⅱ程序性细胞死亡[8]. 近年来大量研究发现, 自噬通过多种途径抑制肿瘤的发生, 如清除受损细胞器以避免有害自由基及突变的发生、限制DNA损伤、维持基因组完整性、抑制细胞生长、诱发程序性细胞死亡等[9,10]. 体外研究发现, 饥饿、缺氧、生长因子缺乏等生理、病理状态均可诱发自噬. 胰腺癌是高度乏氧、乏血供的实体肿瘤, 我们由此推断自噬可能在胰腺癌的发生、发展中扮演一定角色. 本研究通过检测自噬相关蛋白Beclin1、LC3和P62在胰腺癌组织中表达水平的变化, 以探讨自噬活动在胰腺癌发病中的作用.
Beclin1是哺乳动物中首个被发现的具有调节细胞自吞噬作用的抑癌基因, 定位于人染色体17q21, 大约有150 kb[11]. Beclin1是自噬起始的重要调节因子, 通过与磷脂酰肌醇3激酶(PIK3或Vps34)结合形成Atg1/ULK1复合物. 该复合物受到雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)调节. 哺乳动物体内能量充足时, mTORC1被激活, 雷帕霉素靶蛋白结合自噬复合体, 通过抑制Beclin1的活性抑制自噬发生; mTORC1在细胞能量缺乏时与复合体解离, 释放出Beclin1以诱导自噬]. 大量研究[13,14]发现, 在多种肿瘤中, 癌组织自噬水平都低于相应正常组织, 提示自噬活性降低可能是肿瘤发病过程中的原因之一. 本研究发现, 胰腺癌组织中Beclin1蛋白的阳性表达率明显低于癌旁正常组织, 且与肿瘤分化及TNM分期密切相关. 肿瘤分化程度越低、TNM分期越高, Beclin1表达水平越低, 提示在胰腺癌发病过程中, Beclin1活性下降或功能缺失抑制了自噬启动, 进而促进了胰腺癌的进展.
LC3是哺乳动物细胞中酵母自噬相关基因8(autophagy-related gene, ATG8)基因的同源物, 靶向定位于自噬体膜, 参与自噬的形成, 分为Ⅰ型和Ⅱ型. 当自噬发生时, Ⅰ型经泛素样加工修饰与自噬膜表面的磷脂酰乙醇胺结合, 形成Ⅱ型LC3, LC3-Ⅱ蛋白结合并始终位于胞内自噬体膜上, 其含量与自噬泡数量成正比[15], 被认为是自噬体的标志分子, 研究中所测LC3水平均为LC3-Ⅱ. 本研究结果显示, 胰腺癌组织中LC3-Ⅱ表达水平与癌旁正常组织相比发生了明显下调, 相比中-高分化腺癌, 低分化胰腺癌中自噬水平进一步下降, 且TNMⅢ期癌组织中LC3-Ⅱ水平也显著低于TNMⅠ-Ⅱ期, 提示自噬体数量减少与胰腺癌的恶性程度及疾病进展密切相关, 进而影响患者的预后.
P62是由原癌基因c-myc编码, 定位于细胞核, 在细胞质中合成. 自噬发生时, 细胞质中的P62先与泛素化的蛋白质结合, 再与定位于自噬小体内膜上的LC3-Ⅱ蛋白结合形成复合物, 并在自噬溶酶体中降解. 自噬发生时, P62水平下降; 而自噬活动受到抑制时, P62蛋白则不断累积[16]. 本研究中发现, P62的表达与Beclin1、LC3表达水平呈负相关; 在胰腺癌组织中, P62表达水平明显高于癌旁正常组织, 且表达水平与胰腺癌的TNM分期呈正向变化. 上述结果进一步证实了进展期胰腺癌中自噬活动受到了抑制.
细胞自噬对肿瘤的作用非常复杂, 可能因肿瘤类型, 或者肿瘤发展的不同阶段而不同. 在大鼠胰腺肿瘤的研究中发现, 癌前病变或良性肿瘤期, 自噬活性增强; 而在腺瘤向腺癌转化的过程中, 自噬活性则明显降低[17,18]. 本研究发现在自噬诱导、起始过程起着重要作用的Beclin1、LC3蛋白在低分化、中晚期胰腺癌中显著下调. 这些结果均提示自噬活性降低促进了胰腺癌的发生发展. 可能的机制是因细胞自噬减少增加了肿瘤的易感性, 自噬缺失的细胞不能及时清除受损的线粒体及过氧化物酶体, 这些受损的细胞器是活性氧的潜在来源, 而活性氧易导致DNA损伤和染色体不稳定, 从而诱发或促进肿瘤的发生. 由于胰腺癌的早期诊断率极低, 我们尚缺乏大量的样本以研究自噬在早期胰腺癌及胰腺癌前病变如慢性胰腺炎、IPMN中的水平变化. 因此, 进一步扩大样本量、选择合适的动物模型是非常有必要的.
总之, 本研究发现自噬相关蛋白Beclin1、LC3和P62在胰腺癌组织中表达失调, 并与肿瘤的分化程度及TNM分期相关, 提示自噬活动降低在胰腺癌的发病过程中、尤其是进展期胰腺癌的发展中起着重要作用. 进一步深入探讨自噬在胰腺癌发病中的作用机制对开辟新的治疗途径、提高患者预后有着重要意义.
胰腺癌是恶性程度最高的消化系肿瘤之一, 发病率与病死率相当, 相关基础研究一直是学术界关注的热点. 自噬现象贯穿于肿瘤细胞发生、发展的整个过程, 在肿瘤进展的不同阶段及细胞周围环境发生不同的变化时, 可对细胞产生不同的影响.
谭晓冬, 教授, 中国医科大学附属盛京医院
大量的研究显示自噬与包括胰腺癌在内的恶性肿瘤存在着一定的联系, 自噬在肿瘤发生、发展、治疗和预后等阶段都起重要作用, 自噬与肿瘤是何种关系? 不同药物调节自噬的能力是否相同? 在肿瘤发展转移哪一阶段、干扰自噬哪一通路对肿瘤治疗效果最好? 目前均缺乏大量的基础和临床依据, 均有待学者们更深层次的探索.
目前已经有研究证实自噬同膀胱癌、前列腺癌、结肠癌等密切相关, 而对于其在胰腺癌中的研究尚少.
本文通过免疫组织化学方法检测胰腺癌组织、癌旁正常组织中Beclin1、LC3和P62的表达, 探讨胰腺癌(pancreatic cancer)的发病机制, 为胰腺癌的诊断和治疗提供新的方向.
通过检测自噬相关蛋白在胰腺癌中的表达并比较与胰腺癌临床病理资料的关系,探讨自噬在胰腺癌发生发展中的作用, 为胰腺癌的诊断和治疗提供新思路、新方法, 有望开辟新的治疗途径、并提高患者预后.
细胞自噬: 指细胞利用溶酶体降解自身成分的过程, 被降解的成分包括细胞质及细胞器. 细胞自噬的表现形式有多种, 其共性是通过溶酶体降解细胞内的成分.
本文具有一定的科学性和创新性, 行文严谨, 为胰腺癌的诊断和治疗提供新的方向.
| 1. | Li D, Xie K, Wolff R, Abbruzzese JL. Pancreatic cancer. Lancet. 2004;363:1049-1057. [PubMed] [DOI] |
| 2. | Jemal A, Siegel R, Xu J, Ward E. Cancer statistics, 2010. CA Cancer J Clin. 2010;60:277-300. [PubMed] [DOI] |
| 5. | Yu M, Gou WF, Zhao S, Xiao LJ, Mao XY, Xing YN, Takahashi H, Takano Y, Zheng HC. Beclin 1 expression is an independent prognostic factor for gastric carcinomas. Tumour Biol. 2013;34:1071-1083. [PubMed] |
| 8. | Klionsky DJ. Autophagy revisited: a conversation with Christian de Duve. Autophagy. 2008;4:740-743. [PubMed] [DOI] |
| 9. | Wu WK, Coffelt SB, Cho CH, Wang XJ, Lee CW, Chan FK, Yu J, Sung JJ. The autophagic paradox in cancer therapy. Oncogene. 2012;31:939-953. [PubMed] [DOI] |
| 11. | Aita VM, Liang XH, Murty VV, Pincus DL, Yu W, Cayanis E, Kalachikov S, Gilliam TC, Levine B. Cloning and genomic organization of beclin 1, a candidate tumor suppressor gene on chromosome 17q21. Genomics. 1999;59:59-65. [PubMed] [DOI] |
| 12. | Jung CH, Ro SH, Cao J, Otto NM, Kim DH. mTOR regulation of autophagy. FEBS Lett. 2010;584:1287-1295. [PubMed] [DOI] |
| 14. | Kapoor V, Paliwal D, Baskar Singh S, Mohanti BK, Das SN. Deregulation of Beclin 1 in patients with tobacco-related oral squamous cell carcinoma. Biochem Biophys Res Commun. 2012;422:764-769. [PubMed] [DOI] |
| 15. | Gozuacik D, Kimchi A. Autophagy as a cell death and tumor suppressor mechanism. Oncogene. 2004;23:2891-2906. [PubMed] [DOI] |
| 16. | Mathew R, Karp CM, Beaudoin B, Vuong N, Chen G, Chen HY, Bray K, Reddy A, Bhanot G, Gelinas C. Autophagy suppresses tumorigenesis through elimination of p62. Cell. 2009;137:1062-1075. [PubMed] [DOI] |
| 17. | Köchl R, Hu XW, Chan EY, Tooze SA. Microtubules facilitate autophagosome formation and fusion of autophagosomes with endosomes. Traffic. 2006;7:129-145. [PubMed] [DOI] |
| 18. | Tóth S, Nagy K, Pálfia Z, Réz G. Cellular autophagic capacity changes during azaserine-induced tumour progression in the rat pancreas. Up-regulation in all premalignant stages and down-regulation with loss of cycloheximide sensitivity of segregation along with malignant transformation. Cell Tissue Res. 2002;309:409-416. [PubMed] [DOI] |
编辑: 郭鹏 电编:闫晋利