修回日期: 2014-01-19
接受日期: 2014-02-18
在线出版日期: 2014-04-08
目的: 探讨computed tomography (CT)引导下125I粒子植入联合吉西他滨及顺铂(gemcitabine and cisplatin, GP)方案化疗治疗局部进展期胰腺癌的疗效.
方法: 88例不能手术切除局部进展期胰腺癌(locally advanced pancreatic carcinoma, LAPC)患者随机分为2组: A组(粒子植入+化疗组)45例, 在局麻下行CT引导125I粒子植入术, 术后10-14 d内依据患者体质情况开始行GP方案化疗, 具体方案同化疗组; B组(化疗组)43例, 应用"GP方案"全身化疗, 具体: 吉西他滨1000 mg/m2 (d1, 8)+顺铂75 mg/m2分割呈1-4 d应用, 21 d为1疗程. 2组患者均按期完成4个周期化疗后进行疗效评价. 患者治疗后l、2、3 mo行增强CT扫描及CA199复查, 以后为每3 mo 1次, 共随访30 mo.
结果: A组临床受益率与B组临床受益率比较P<0.05, 有统计学意义; A组平均生存时间与B组平均生存时间比较P<0.05, 有统计学意义. 2组88例患者中均按计划顺利完成, 无1例术后及化疗后出现胰漏、出血、脏器穿孔及Ⅳ度骨髓抑制等严重不良反应.
结论: CT引导下125I粒子植入联合GP方案综合治疗局部进展期胰腺癌是一种安全、有效的治疗手段.
核心提示: 本研究样本量较大, CT引导下125I植入技术成熟, 与肿瘤科密切配合, 严格细化执行GP化疗方案, 临床效果较好, 具有一定应用价值.
引文著录: 杨文魁, 陈勇, 王磊, 吴晓东. CT引导下125I粒子植入联合GP方案治疗局部进展期胰腺癌. 世界华人消化杂志 2014; 22(10): 1455-1459
Revised: January 19, 2014
Accepted: February 18, 2014
Published online: April 8, 2014
AIM: To explore the clinical efficacy of computed tomography (CT)-guided 125I seed interstitial implantation combined with the gemcitabine and cisplatin (GP) chemotherapy regimen for the treatment of locally advanced pancreatic carcinoma.
METHODS: Eighty-eight patients with unresectable locally advanced pancreatic carcinoma (LAPC) were randomly divided into two groups: A (n = 54; 125I seed implantation + chemotherapy) and B (chemotherapy alone). CT-guided 125I seed interstitial implantation was performed under local anaesthesia. Chemotherapy was given 10-14 d after surgery. The chemotherapy protocol was gemcitabine 1000 mg/m2, d1, 8, + cisplatin 75 mg/m2 d1-4 every 21 d. After four cycles of chemotherapy, the curative effect was assessed. Contrast-enhanced CT scanning and CA199 test were performed 1, 2, and 3 mo after treatment, and thereafter every 3 mo during a follow-up period of 30 mo.
RESULTS: The rate of clinical benefit and mean survival time were significantly higher in group A than in group B (P < 0.05 for both). No serious complications such as pancreatic leakage, bleeding, visceral perforation and grade Ⅳ bone marrow suppression were observed in either group.
CONCLUSION: CT-guided 125I seed interstitial implantation combined with GP chemotherapy is safe and effective in the treatment of locally advanced pancreatic cancinoma.
- Citation: Yang WK, Chen Y, Wang L, Wu XD. CT-guided 125I seed interstitial implantation combined with gemcitabine/cisplatin chemotherapy for treatment of locally advanced pancreatic carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(10): 1455-1459
- URL: https://www.wjgnet.com/1009-3079/full/v22/i10/1455.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i10.1455
胰腺癌是常见消化系恶性肿瘤之一. 但由于其早期诊断困难及侵袭性生物学特性, 就诊时仅有10%-20%患者可行根治性手术切除, 总体5年生存率仅1%-9%. 而胰腺癌中约40%为局部晚期胰腺癌[1], 其治疗方法较多, 但效果不尽人意[2,3]. 125I粒子组织间植入已成为局部晚期胰腺癌的重要治疗手段, 目前国内外已有小样本报道并取得不错的疗效[4-6]. 但与化疗联合的报道较少. 为进一步评价125I粒子植入联合化疗在局部晚期胰腺癌方面的疗效. 我院放射科联合放疗科2006-09/2013-09采用125I粒子植入联合吉西他滨及顺铂(gemcitabine and cisplatin, GP)方案化疗治疗患者, 取得了较好的疗效. 现汇报如下.
搜集2006-09/2010-09我院放疗科收治的局部进展期胰腺癌患者共88例, 其中56例经计算机断层扫描(computed tomography, CT)引导下穿刺活检确诊, 其余32例患者均经增强CT或磁共振成像(magnetic resonance imaging, MRI)结合CA199临床确诊. 其中男53例, 女35例. 年龄平均为50岁, 既往未曾行局部放疗及全身化疗, Karnofsky评分87±2.4. 随机分为2组, 病例之间无统计学差异. 使用西门子公司生产的16排螺旋CT扫描仪, 放射性粒子植入治疗计划系统(treatment planning system, TPS)和粒子植入器由珠海和佳医疗股份有限公司生产, 使用日产粒子植入针, 125I粒子由北京市401研究所提供. 封闭性放射性粒子源125I粒子的直径为0.8 mm, 长4.5 mm, 外壳由钛合金制造. 放射活性范围1.52×107 Bq-3.03×107 Bq(0.41-0.82 mCi), 半衰期59.46 d.
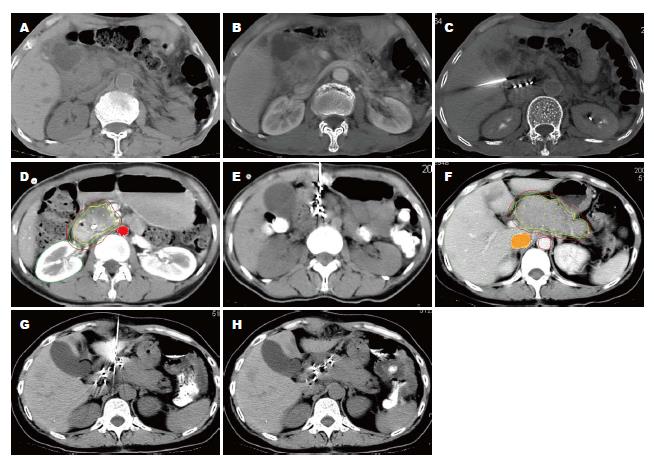
1.2.1 治疗前准备: 治疗前根据患者CT或彩超等影像学资料(图1A, B), 经肝胆胰外科、放疗科、放射科和放疗物理师联合会诊, 经郑州人民医院伦理委员会批准, 若黄疸较重, 先至外科行姑息性手术(胆管空肠吻合和/或胃空肠吻合术)以解除黄疸及胆道梗阻后再行粒子植入治疗(内镜下胆道支架植入时需切开十二指肠奥迪氏括约肌, 损伤了重要解剖结构, 术后容易导致出血和胆汁反流). 粒子植入先通过扫描仪将胰腺肿瘤层面的CT图像传入TPS内, 勾勒出肿块的轮廓, 确定进针的路径, 计算所需粒子的数目(图1D, F). 主要根据肿瘤大小确定植入粒子数, 使用每个粒子的活度为1.1×107 Bq-1.8×107 Bq, 植入粒子具体数目估算公式为: 粒子植入总数 = [(肿瘤长+宽+高)/3×5]/每个粒子的活度.
1.2.2 治疗: 粒子植入在CT引导下, 用施源器将125I放射粒子精确植入, 避免胰管以及大血管损伤. 穿刺点间距1.5-2.0 cm, 每一穿刺点植入125I放射粒子5-8枚(图1C, E, G). 平均植入125I粒子22粒(11-60粒), 植入粒子源强平均2.44×107 Bq/粒(0.41-0.82 mCi), 植入前每枚粒子性活度测定、与术前要求不符者予以更换. 在粒子植入后10-14 d内依据患者体质恢复情况行GP方案化疗. 具体方案如下: 吉西他滨注射液1000 mg/m2 (d1, 8)+顺铂注射液75 mg/m2分4 d使用, 每21 d为1周期. 依据患者的毒性反应相应减少剂量.
1.2.3 疗效评价: (1)临床疗效标准: 按世界卫生组织(World Health Organization, WHO)疗效评价标准, 将患者治疗疗效评价为: 所有已知病灶消失并保持最少4 wk为完全缓解(complete remission, CR), 肿瘤双径乘积之和减少50%以上维持4 wk为部分缓解(partial remission, PR)(图1H), 缩小不足50%为无变化(no change, NC)或稳定(steady, SD), 肿瘤体积增大>25%或有新病灶出现为进展(progress, PD). (2)临床受益反应(the clinical benefit response, CBR): 依据1997年Burris等制定的CBR标准对患者的疼痛强度评分(pain intensity scores, PIS)、镇痛药物消耗量、KPS评分和体质量变化综合评估. 凡符合下列一项指标(持续4 wk以上), 并无任何一项恶化者, 定义为临床受益:疼痛强度减轻≥50%; 镇痛药物用量减少≥50%; 体力状况按卡氏评分标准改善≥2分; 如疼痛程度及体力状况均稳定, 则体质量增加≥7%.
统计学处理 2组间样本客观有效率, 临床受益率以及并发症发生率等采用χ2检验, 采用SPSS17.00软件上进行统计学分析; 对生存率比较采用Log-rank检验法. P<0.05差异有统计学意义.
客观有效率: A组, 15/45 = 33.3%; B组, 10/43 = 23.3%; χ2 = 1.098, P = 0.295, 无统计学差异. 临床受益率: A组, 29/45 = 64.4%; B组, 14/43 = 32.6%; χ2 = 8.974, P = 0.003<0.05, 有统计学差异. 并发症: A组, 2/45 = 4.4%; B组, 1/43 = 2.3%; χ2 = 0.000, P = 1.000, 无统计学差异. 并发症发生主要是发热、腹腔感染, 恶心、呕吐为主(表1).
| 分组 | PR+CR | SD+PD | 客观有效率(%) | 临床受益率n(%) | 并发症n(%) |
| A | 15 | 30 | 33.3 | 29(64.4) | 2(4.4) |
| B | 10 | 33 | 23.3 | 14(32.6) | 1(2.3) |
| 总计 | 25 | 63 | 39.7 | 43(48.9) | 3(3.4) |
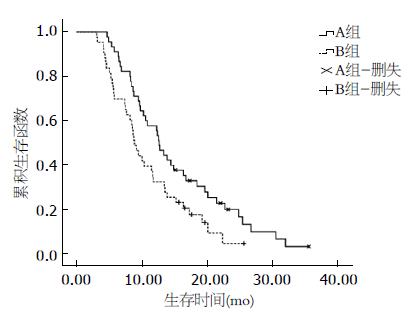
A组中位生存期为12.70 mo, B组中位生存期为8.90 mo, 平均生存时间A组为15.3 mo, B组为11 mo. Log-rank检验发现两组差异有统计学意义(χ2 = 5.024, P = 0.025<0.05)(表2, 图2).
| 分组 | 均值 | 中位数 | ||||||
| 95%置信区间 | 95%置信区间 | |||||||
| 估计 | 标准误 | 下限 | 上限 | 估计 | 标准误 | 下限 | 上限 | |
| A组 | 15.328 | 1.286 | 12.808 | 17.849 | 12.7 | 0.738 | 11.254 | 14.146 |
| B组 | 11.029 | 0.975 | 9.119 | 12.940 | 8.9 | 0.590 | 7.744 | 10.056 |
胰腺癌是一种常见的消化系恶性肿瘤, 其恶性程度高, 发展快, 具有发现晚, 病期短, 预后极差等特点. 根据美国肿瘤学会最新资料显示胰腺癌发病率与死亡率几乎相当, 发病率位居恶性肿瘤第10位, 死亡率在女性为第5位, 男性为第4位, 5年生存率仅为4%[7,8]. 目前, 虽然胰腺癌的治疗存在许多问题, 但多学科、多中心联合治疗胰腺癌的研究广泛开展着, 并在许多方面取得了成就. 胰腺癌位置深, 周围肠道的放射耐受性低, 常规外照射的剂量受到一定限制, 达不到根治放疗目的, 使肿瘤局部控制率低、复发率高. 三维适形或调强放射治疗虽能在一定程度上改善局部控制率, 但仍受到肿瘤周围正常组织耐受剂量限制和腹腔脏器移动的困扰, 难以达到彻底治愈的目的. 如何提高胰腺癌的疗效是目前肿瘤科医师亟待解决难题.
1934年Handley[9]在世界上首先运用镭针插植成功治疗胰腺癌的先例, 自此拉开了肿瘤内植入放射性粒子治疗肿瘤序幕. 粒子植入可应用其低剂量率连续照射特性, 从而增加肿瘤照射剂量、提高肿瘤局控率, 成为肿瘤局部治疗的一种有效手段. 目前常用的核素粒子有125I、103Pd、198AU、169Y. 目前我院常用为125I, 其半衰期为60.1 d, 外壳钛合金管与人体组织相容性好, 保存时间相对较长、便于运输, 有利于临床医师应用. 125I产生的γ射线虽然能量不大, 但他持续照射肿瘤组织内处不同分裂时象的细胞, 使其完全处在辐射中. 而且放射性粒子使肿瘤得到根治剂量的同时, 由于其放射距离短(1.7 cm), 对周围正常组织放射损伤少, 减少了相邻正常组织的不良反应. 最近国内应用125I粒子植入治疗晚期胰腺癌已成为研究热门课题, 但尚缺乏大样本的临床研究案例.
而我院正是基于以上的研究背景, 联合吉西他滨+顺铂化疗对局部晚期胰腺癌患者进行一系列的疗效分析. 吉西他滨对胰腺癌的治疗作用最早在1999年Storniolo等[10]、Yoshitomi等[11]及吴汉清等[12]一项临床试验, 证明了吉西他滨对晚期胰腺癌的治疗价值. 他作为新合成的脱氧胞苷类似物, 具有完全不同的抗肿瘤活性, 美国FDA于1996年批准吉西他滨作为抗胰腺癌的一线用药, 对于局部晚期的胰腺癌患者, 吉西他滨可以获得较高的有效率和更长的生存期. Yoshitomi等[11]报道了胰腺癌术后辅助化疗的Ⅱ期随机临床试验结论是吉西他滨联合顺铂为基础的联合化疗方案对患者是安全有效的.
本研究结果显示对局部晚期胰腺癌患者, 在行全身化疗基础上, 结合125I粒子植入可显著提高患者的客观有效率和临床受益率. 同时结果显示125I粒子植入+化疗组临床受益率明显高于单独化疗组, 说明125I粒子植入可持久的改善患者生活质量, 缓解痛苦, 这可能与125I粒子既可以使肿瘤局部变性坏死, 减轻内部张力, 也可以破坏腹膜后神经丛有关. 在并发症的发生率上, 125I粒子植入+化疗组并发症发生并没有高于单独化疗组, 这说明在粒子植入对于患者是安全的. 在生存时间的比较上, 125I粒子植入+化疗组与单独化疗组有明显的统计学差异, 因此粒子植入能够提高患者的远期生存率, 延长患者生存时间, 这可能与125I粒子的放射性能够杀灭胰腺肿瘤细胞, 抑制肿瘤的生长, 从而提高患者中位生存期[13-15]. 但125I粒子种植治疗也有其不利的因素, 如粒子游走等. 而且由于125I的半衰期特点以及穿透力的局限性, 目前国内许多专家正进行更具优越性的103Pd粒子治疗胰腺癌的探讨, 但确切疗效尚需要大样本资料对照研究来进一步证实.
总之, 125I粒子植入联合全身化疗对局部进展期胰腺癌, 能控制局部肿瘤的生长, 提高患者生存率, 是一种安全有效的治疗晚期胰腺肿瘤良好方案, 值得进一步深入研究.
胰腺癌是消化系统常见的恶性肿瘤, 目前多学科、多中心联合的综合治疗已经在许多方面取得了一定的进展, 如何提高胰腺癌患者生存质量和生存期为当今治疗的难点和重点. 常规放疗技术定位不准确, 对正常组织保护不利, 不良反应大, 疗效差. CT引导下125I粒子植入能够进行精确定位和精确放疗, 联合吉西他滨及顺铂(gemcitabine and cisplatin, GP)方案治疗局部进展期胰腺癌, 评价其效果, 能提高患者的长期生存率, 改善患者的生活质量, 为临床胰腺癌治疗提供依据.
张火俊, 副教授, 副主任医师, 长海医院放射科
不能根治切除的进展期胰腺癌单纯应用化疗药物由于可能产生耐药性从而导致治疗效果不佳. 由于放射性粒子的应用取得了很大的进展, 故联合化疗和放疗将成为不能根治切除的进展期胰腺癌的一个重要的治疗方法.
GP方案是临床研究较早的治疗进展期胰腺癌的2药方案, 研究者认为, 一般状况较好者能从GP方案治疗中获益. 有研究认为125I植入具有很多优势, 对无法手术的胰腺癌患者具有重要意义.
本研究采用CT引导下125I植入联合GP方案治疗进展期胰腺癌, 充分发挥化疗及靶向放疗的优势, 提高患者的长期生存率, 改善患者的生活质量.
该研究在临床方面有一定创新, 具有一定临床应用价值.
| 2. | Cooperman AM, Kini S, Snady H, Bruckner H, Chamberlain RS. Current surgical therapy for carcinoma of the pancreas. J Clin Gastroenterol. 2000;31:107-113. [PubMed] [DOI] |
| 4. | Peretz T, Nori D, Hilaris B, Manolatos S, Linares L, Harrison L, Anderson LL, Fuks Z, Brennan MF. Treatment of primary unresectable carcinoma of the pancreas with I-125 implantation. Int J Radiat Oncol Biol Phys. 1989;17:931-935. [PubMed] [DOI] |
| 6. | Jemal A, Murray T, Ward E, Samuels A, Tiwari RC, Ghafoor A, Feuer EJ, Thun MJ. Cancer statistics, 2005. CA Cancer J Clin. 2005;55:10-30. [PubMed] [DOI] |
| 8. | Oya N. Chemoradiotherapy for pancreatic cancer: current status and perspectives. Int J Clin Oncol. 2004;9:451-457. [PubMed] [DOI] |
| 9. | Handley WS. Pancreatic cancer and its treatment by implanted radium. Ann Surg. 1934;100:215-223. [PubMed] [DOI] |
| 10. | Storniolo AM, Enas NH, Brown CA, Voi M, Rothenberg ML, Schilsky R. An investigational new drug treatment program for patients with gemcitabine: results for over 3000 patients with pancreatic carcinoma. Cancer. 1999;85:1261-1268. [PubMed] |
| 11. | Yoshitomi H, Togawa A, Kimura F, Ito H, Shimizu H, Yoshidome H, Otsuka M, Kato A, Nozawa S, Furukawa K. A randomized phase II trial of adjuvant chemotherapy with uracil/tegafur and gemcitabine versus gemcitabine alone in patients with resected pancreatic cancer. Cancer. 2008;113:2448-2456. [PubMed] [DOI] |
| 13. | 王 成锋, 赵 平, 李 晔雄, 单 毅, 赵 东兵, 田 艳涛, 孙 跃民, 白 晓枫, 车 旭, 曲 辉. 125I粒子植如治疗局部进展期胰腺癌. 中华医学杂志. 2010;90:92-96. |
| 15. | Oettle H, Post S, Neuhaus P, Gellert K, Langrehr J, Ridwelski K, Schramm H, Fahlke J, Zuelke C, Burkart C. Adjuvant chemotherapy with gemcitabine vs observation in patients undergoing curative-intent resection of pancreatic cancer: a randomized controlled trial. JAMA. 2007;297:267-277. [PubMed] [DOI] |
编辑 郭鹏 电编 鲁亚静