修回日期: 2013-11-01
接受日期: 2013-11-19
在线出版日期: 2013-12-18
目的: 探讨大黄治疗大鼠重症急性胰腺炎(severe acute pancreatitis, SAP)肠动力衰竭的可能机制.
方法: 将54只♂SD大鼠随机分为假手术组(SO组)、重症急性胰腺炎肠动力衰竭组(SAP组)和大黄治疗组, 每组18只. 经胆胰管内加压注射3.5%牛磺胆酸钠0.1 mL/100 g体质量制备SAP肠动力衰竭模型, 治疗组在造模前给予10%的大黄汤剂(2 mL/100 g体质量)灌胃1次, SAP组和SO组则灌注等量0.9%氯化钠溶液. 每组于造模后3、6、12 h各处死6只大鼠并立即心脏取血, 检测血清淀粉酶、脂肪酶水平, 酶联免疫吸附试验检测血清5-羟色胺(5-hydroxytryptamine, 5-HT)含量. 同时检测6 h时间点各组大鼠距屈氏韧带10 cm空肠、末端回肠及乙状结肠组织中5-HT1R、5-HT2R的表达情况.
结果: 造模后SAP组(淀粉酶分别为9807 U/L±698 U/L、15442 U/L±952 U/L、18231 U/L±869 U/L, 脂肪酶分别为94 U/L±23 U/L、257 U/L±99 U/L、306 U/L±107 U/L, 5-HT分别为1192 ng/mL±142 ng/mL、1437 ng/mL± 114 ng/mL、1646 ng/mL±163 ng/mL)和治疗组(淀粉酶分别为2238 U/L±298 U/L、2313 U/L±302 U/L、2289 U/L±323 U/L, 脂肪酶分别为62 U/L±16 U/L、71 U/L±17 U/L、69 U/L±15 U/L, 5-HT分别为794 ng/mL±86 ng/mL、814 ng/mL±83 ng/mL、798 ng/mL±81 ng/mL)血清淀粉酶、脂肪酶及5-HT水平均明显高于SO组(淀粉酶分别为1853 U/L±272 U/L、1959 U/L±269 U/L、1897 U/L±293 U/L, 脂肪酶分别为46 U/L±9 U/L、54 U/L±11 U/L、52 U/L±14 U/L, 5-HT分别为699 ng/mL±64 ng/mL、721 ng/mL±76 ng/mL、705 ng/mL±72 ng/mL)(P<0.01), 且每个时间点治疗组均较SAP组显著降低(P<0.01). 与SO组相比, SAP组5-HT1、5-HT2R蛋白及阳性细胞面积(SAP组空肠、末端回肠及乙状结肠5-HT1R+细胞面积分别为4.58万μm2±0.56万μm2、4.64万μm2±0.63万μm2、4.79万μm2±0.56万μm2, 5-HT2R+细胞面积分别为4.89万μm2±0.61万μm2、4.76万μm2±0.51万μm2、5.03万μm2±0.73万μm2; SO组空肠、末端回肠及乙状结肠5-HT1R+细胞面积分别为5.63万μm2±0.82万μm2、5.94万μm2±0.91万μm2、6.37万μm2±0.87万μm2, 5-HT2R+细胞面积分别为6.02万μm2±0.78万μm2、5.98万μm2±0.66万μm2、6.49万μm2±0.85 μm2)表达水平在空肠、末端回肠及乙状结肠均明显下降(P<0.05); 与SAP组比较, 治疗组各部位5-HT1R蛋白及阳性细胞面积(空肠、末端回肠及乙状结肠5-HT1R+细胞面积分别为5.57万μm2±0.83万μm2、5.82万μm2±0.74万μm2、6.02万μm2±0.81万μm2)表达均增高(P<0.05), 而5-HT2R蛋白及阳性细胞(5-HT2R+细胞面积分别为4.94万μm2±0.59万μm2、4.81万μm2±0.63万μm2、5.16万μm2±0.79万μm2)表达则未见增加.
结论: 血清5-HT升高及肠组织中受体降低可能是SAP发生肠动力衰竭的原因之一, 而大黄则可能是通过激活肠组织中5-HT1R, 或增加5-HT1R的表达量来促进肠功能恢复.
核心提示:重症急性胰腺炎大鼠肠动力衰竭时血清5-羟色胺(5-hydroxytryptamine, 5-HT)水平明显增加, 但其受体5-HT1、5-HT2的表达明显下降, 从而导致5-HT与其受体亲和力降低, 这可能是SAP发生肠动力衰竭的机制之一, 而大黄可能是通过激活5-HT1R, 或增加5-HT1R的表达量来改善肠动力衰竭.
引文著录: 薛育政, 吴燕敏, 盛颖玥, 陆宇峰, 吴铁龙, 刘宗良, 俞宪民, 李兆申. 大黄治疗重症急性胰腺炎肠动力衰竭的机制. 世界华人消化杂志 2013; 21(35): 3947-3953
Revised: November 1, 2013
Accepted: November 19, 2013
Published online: December 18, 2013
AIM: To investigate the effect of Da-Huang on intestinal motility failure in rats with severe acute pancreatitis (SAP) and the potential mechanism involved.
METHODS: Fifty-four SD rats were randomly divided into s sham operation (SO) group, a SAP group and a Da-Huang treatment group, with 18 rats in each group. Gastrointestinal motility disturbance in rats with SAP was induced by retrograde injection of sodium taurocholate (0.1 mL/100 g) into the bitiopancreatic duct. Before modeling, the rats in the treatment group received 10% Da-Huang solution (2 mL/100 g), and the rats in other two groups received 0.9% NaCl solution. The rats were sacrificed at 3, 6 and 12 h (6 rats at each time), and blood samples were taken for detecting the levels of amylase, lipase and the contents of 5-hydroxytryptamine (5-HT) by enzyme-linked immunosorbent assay. The jejunum, terminal ileum and sigmoid colon tissues 10 cm apart from the trans-ligament were collected at 6 h for examining the expressions of 5-HT1 receptor (5-HT1R) and 5-HT2 receptor (5-HT2R).
RESULTS: The levels of serum amylase, lipase and 5-HT at three time points in the SAP group (amylase: 9807 IU/L ± 698 IU/L, 15442 IU/L ± 952 IU/L, 18231 IU/L ± 869 IU/L; lipase: 94 IU/L ± 23 IU/L, 257 IU/L ± 99 IU/L, 306 IU/L ± 107 IU/L; 5-HT: 1192 ng/mL ± 142 ng/mL, 1437 ng/mL ± 114 ng/mL, 1646 ng/mL ± 163 ng/mL) and treatment group (amylase: 2238 IU/L ± 298 IU/L, 2313 IU/L ± 302 IU/L, 2289 IU/L ± 323 IU/L; lipase: 62 IU/L ± 16 IU/L, 71 IU/L ± 17 IU/L, 69 IU/L ± 15 IU/L; 5-HT: 794 ng/mL ± 86 ng/mL, 814 ng/mL ± 83 ng/mL, 798 ng/mL ± 81 ng/mL) were significantly higher than those in the SO group (amylase: 1853 IU/L ± 272 IU/L, 1959 IU/L ± 269 IU/L, 1897 IU/L ± 293 IU/L; lipase: 46 IU/L ± 9 IU/L, 54 IU/L ± 11, 52 IU/L ± 14 IU/L; 5-HT: 699 ng/mL ± 64 ng/mL, 721 ng/mL ± 76 ng/mL, 705 ng/mL ± 72 ng/mL)(all P < 0.01), but they were lower in the treatment group than in the SAP group at each time point (all P < 0.01). The expression of 5-HT1R and 5-HT2R proteins was significantly decreased in the jejunum, terminal ileum and sigmoid colon in the SAP group compared with the SO group (all P < 0.05). The areas of 5-HT1R and 5-HT2R positive cells in the jejunum, terminal ileum and sigmoid colon in the SAP group (5-HT1R positive cells: 4.58 × 104 μm2 ± 0.56 × 104 μm2、4.64 × 104 μm2 ± 0.63 × 104 μm2、4.79 × 104 μm2 ± 0.56 × 104 μm2, 5-HT2R positive cells: 4.89 × 104 μm2 ± 0.61 × 104 μm2, 4.76 × 104 μm2 ± 0.51 × 104 μm2, 5.03 × 104 μm2 ± 0.73 × 104 μm2) were significantly decreased compared with the SO group (5-HT1R positive cells: 5.63 × 104 μm2 ± 0.82 × 104 μm2, 5.94 × 104 μm2 ± 0.91 × 104 μm2, 6.37 × 104 μm2 ± 0.87 × 104 μm2, 5-HT2R positive cells: 6.02 × 104 μm2 ± 0.78 × 104 μm2, 5.98 × 104 μm2 ± 0.66 ×104 μm2, 6.49× 104 μm2 ± 0.85 × 104 μm2). The expression of 5-HT1R protein and the areas of 5-HT1 positive cells in the jejunum, terminal ileum and sigmoid colon in the treatment group (5.57 × 104 μm2 ± 0.83 × 104 μm2, 5.82 × 104 μm2 ± 0.74 × 104 μm2, 6.02 × 104 μm2 ± 0.81 × 104 μm2), but not the areas of 5-HT2 positive cells (4.94 × 104 μm2 ± 0.59 × 104 μm2, 4.81 × 104 μm2 ± 0.63 × 104 μm2, 5.16 × 104 μm2 ± 0.79 × 104 μm2), were increased in comparison with SAP group (all P < 0.05).
CONCLUSION: The level of 5-HT is significantly increased in SAP, but its receptors (5-HT1R and 5-HT2R) are decreased, which may induce intestinal motility failure. Da-Huang may improve enteric dynamic failure by activating 5-HT1R or increasing the expression of 5-HT1R, and may be a choice for treatment of SAP with intestinal motility failure.
- Citation: Xue YZ, Wu YM, Sheng YY, Lu YF, Wu TL, Liu ZL, Yu XM, Li ZS. Effect of Da-Huang on intestinal motility failure in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2013; 21(35): 3947-3953
- URL: https://www.wjgnet.com/1009-3079/full/v21/i35/3947.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i35.3947
5-羟色胺(5-hydroxytryptamine, 5-HT), 又名血清素(serotonin), 广泛分布于人体中, 约90%存在于胃肠道, 是体内最重要的胃肠动力调节剂之一. 近来研究显示, 人体中存在多种5-HT受体(5-HT1R-5-HT7R), 这些受体又各自可分成若干亚型[1], 而与胃肠道功能密切相关的主要有5-HT1R、5-HT2R、5-HT3R、5-HT4R及5-HT7R[2-9].
重症急性胰腺炎(severe acute pancreatitis, SAP)常见的并发症主要是胃肠动力衰竭, 但目前对5-HT及其受体在SAP胃肠动力衰竭中的变化及作用机制鲜有报道, 本研究采用牛磺胆酸钠制备SAP大鼠肠动力衰竭模型, 观察大黄对SAP大鼠肠动力衰竭模型的血清淀粉酶、脂肪酶及5-HT含量, 并检测相应肠段黏膜中5-HT1R、5-HT2R的表达情况, 以探讨大黄治疗SAP胃肠动力衰竭的可能机制.
SPF级♂SD大鼠54只, 体质量200 g±20 g, 由南通大学医学院实验动物中心提供, 许可证号: SYXK(苏)2002-0022, 实验期间所有动物置于同一室内, 在没有特定病原菌的环境中分笼饲养, 自由饮水, 室温21 ℃±4 ℃, 光照12 h, 黑暗12 h. 随机分为假手术组(SO)、SAP组及大黄治疗组, 每组18只. 实验过程中所有大鼠均没有出现意外死亡.
1.2.1 SAP肠动力衰竭模型的制备: 根据文献[10]的方法制备SAP肠动力衰竭模型: 大鼠术前禁食12 h, 禁水6 h, 10%水合氯醛(300 mg/kg)腹腔注射麻醉, 正中切口入腹, 胆胰管十二指肠开口处用无损伤金属夹夹闭, 注射器针头向十二指肠开口方向插入胆胰管, 以0.1 mL/min速度向胆胰管内注入3.5%牛磺胆酸钠 (0.1 mL/100 g体质量, Sigma公司), 10 min后关腹. SO组大鼠开腹后仅翻动十二指肠并触摸胰腺数次后关腹. 大黄治疗组造模15 min前经胃管一次注入10%的大黄汤剂(2 mL/100 g体质量, 成都大西南制药有限公司), 而SO组和SAP组则给予等量0.9%氯化钠溶液.
1.2.2 生化指标的测定: SO组、SAP组及大黄治疗组分别于3、6、12 h时间点各处死6只大鼠, 立即心脏取血, 置入肝素钠管内, 4000 r/min离心15 min, 取上层血清, -80 ℃保存. 用全自动生化分析仪检测血清淀粉酶、脂肪酶水平, ELISA法测定血清5-HT含量.
1.2.3 小肠推进率的测定: 各组造模2.5 h后(即3 h时间点处死的大鼠)分别给予含有苯酚红2 mg/mL的生理盐水1.0 mL灌胃, 30 min后快速剖腹分别取出小肠. 剪下幽门下端至阑尾上端的肠管, 将其铺在纸上, 不加任何拖曳牵引, 测小肠全长和苯酚红前沿至幽门下端的距离. 苯酚红前沿如果显示不清楚, 可在疑似处剪开小肠, 然后滴加0.1 mol/L的NaOH溶液确认(显示鲜亮的玫红色), 并需在其前和后各1 cm处再次剪断滴加NaOH溶液, 加以验证, 以保证数据的准确性. 小肠推进率的计算公式为苯酚红推进的小肠长度/小肠全长×100%.
1.2.4 免疫印迹法检测肠黏膜中5-HT1R、5-HT2R蛋白表达情况: 分别取3组6 h时间点大鼠距屈氏韧带10 cm的空肠、末端回肠及乙状结肠组织, 量约50 mg, 常规提取总蛋白, BCA法测定样本组织中蛋白浓度, 聚丙烯酰胺凝胶电泳分离蛋白, 湿法转膜, 脱脂奶粉封闭, 分别加入兔抗大鼠5-HT1R、5-HT2R多克隆抗体50 μL(1:400), 4℃过夜, 加入羊抗兔Ig-HRP 50 μL(1:500), 室温反应2 h, ECL显色, 上述实验以b-actin作为内参.
1.2.5 免疫组织化学法检测5-HT1R+、5-HT2R+ 细胞面积: 分别取3组6 h时间点大鼠距屈氏韧带10 cm的空肠、末端回肠及乙状结肠组织, 约5 mm×5 mm, 常规固定、包埋、切片, 脱蜡至水、抗原修复, 分别加5-HT1R、5-HT2R一抗50 μL(1:300), 37℃孵育1 h后4 ℃过夜, 加辣根过氧化物酶标记的二抗50 μL, 室温孵育各20 min, DAB显色, 复染、脱水、封片. 结果判断: 胞浆染色呈棕色者判定为阳性细胞. 每张切片选择5个高倍镜视野(400×), 应用Leica RX250型图像分析系统进行定量灰度扫描, 以及Qwin软件分别进行分析, 并自动计算5-HT1R+、5-HT2R+细胞面积.
1.2.6 胰腺组织病理学诊断: 胰腺组织经HE染色后, 由两位专业的病理医师双盲阅片, 每组随机取3张切片, 每张切片随机选取10个高倍视野, 以水肿、感染、出血和坏死评价胰腺组织损伤的程度.
统计学处理 实验数据录入SPSS18.0统计软件包, 所有数据均以mean±SD表示, 组间以t检验进行统计学处理, P<0.05为差异有统计学意义.
与SO组比较, SAP组和大黄治疗组在造模后各时间点血清淀粉酶明显升高, 其中SAP组与SO组比较差异有统计学意义(P<0.01); 与SAP组比较, 大黄治疗组各时间点血清淀粉酶明显降低, 差异有统计学意义(P<0.01); SAP组血清淀粉酶水平随观察时间的延长呈依赖性增加. 各组大鼠血清脂肪酶变化与淀粉酶变化一致(表1).
与SO组相比, SAP组、治疗组5-HT含量在造模后3、6、12 h明显升高, 其中SAP组与SO组比较差异有统计学意义(P<0.01); 与SAP组比较, 大黄治疗组各时间点血清5-HT明显降低, 差异有统计学意义(P<0.01); 且SAP组血清5-HT含量随观察时间的延长呈依赖性增加(表2).
SAP组小肠推进率在3 h时间点为25.72%±4.52%, 与SO组63.52%±10.5%比较明显降低, 差异有统计学意义(P<0.01); 治疗组小肠推进率在3 h时间点为61.45%±9.11%, 与SAP组比较差异有统计学意义(P<0.01), 而与SO组比较差异无统计学意义(P>0.05).
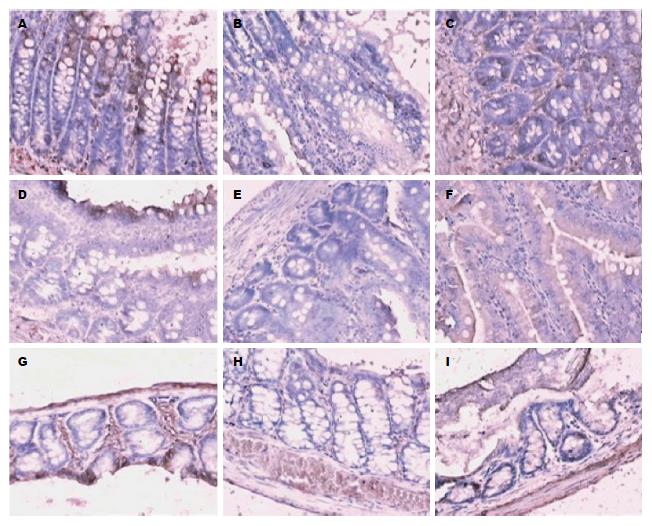
与SO组比较, SAP组于造模后6 h点5-HT1R、5-HT2R蛋白表达水平在空肠、末端回肠及乙状结肠处均明显减少; 与SAP组比较, 大黄治疗组上述部位5-HT1R蛋白表达均增加, 但较SO组表达降低, 而5-HT2R蛋白表达均未见明显增加(图1).
SAP组于造模后6 h点空肠、末端回肠及乙状结肠5-HT1R+细胞面积分别与SO组比较明显减少, 差异有统计学意义(P均<0.05). 治疗组于造模后6 h点空肠、末端回肠及乙状结肠5-HT1R+细胞面积分别与SAP组相同部位比较5-HT1R+细胞面积明显增加, 差异有统计学意义(P均<0.05, 图2, 表3). 与SO组比较, SAP组于造模后6 h点相同部位5-HT2R+细胞面积明显减少, 差异有统计学意义(P均<0.05); 但治疗组上述部位5-HT2R+细胞面积较SAP组比较, 均未见明显增加 (P均>0.05, 表3).
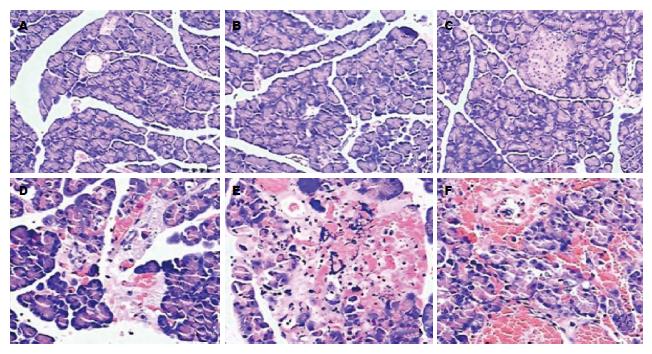
SO组大鼠各时间点胰腺组织病理学改变基本相同, 可见胰腺部分间质水肿, 少量炎性细胞浸润, 偶可见点状出血, 极少量腺泡细胞坏死. SAP组大鼠胰腺组织病理学改变随着造模时间延长, 改变越明显: 造模后3 h可见明显的小叶间水肿, 散在片状出血, 较多炎性细胞浸润, 部分腺泡细胞变性坏死; 造模后6、12 h可见大量炎性细胞浸润, 片状出血显著, 胰腺小叶结构被破坏, 大量腺泡细胞坏死(图3). 结合本实验3 h时间点SAP组小肠推进率与SO组比较明显降低, 提示本研究采用牛磺胆酸钠制备SAP大鼠肠动力衰竭模型成功.
SAP具有病情重、并发症多等特点, 病死率高达30%-50%[11,12]. 近年来, 随着人们生活水平的提高, 生活方式和饮食习惯的改变, SAP的发病率呈逐年增高的趋势[13]. 胃肠动力衰竭是SAP最常见的并发症之一, 其可导致肠黏膜的屏障功能减弱甚至丧失、肠道内菌群及内毒素移位, 进而引起肠源性感染甚至多脏器功能衰竭[14], 最终导致SAP患者死亡率增加. 大量临床研究表明, SAP患者早期恢复胃肠动力, 可显著降低其他并发症的发生率及死亡率, 提高抢救成功率及治愈率.
传统医学认为SAP早期发病机制的中心环节在于气机不畅, 腑气不通, 气机升降失司, 气滞血瘀, 故通里攻下、活血化瘀是中医早期治疗该病的主要方法. 大黄性寒味苦, 具有攻积滞、清湿热、泻火、凉血、祛瘀、解毒等功效, 是通里攻下的代表中药. 有研究表明, 大黄可通过以下两方面治疗急性胰腺炎: 一是大黄对与急性胰腺炎直接有关的几种酶如胰蛋白酶、胰弹性蛋白酶、胰糜蛋白酶、胰激肽释放酶和胰脂肪酶具有明显的抑制作用[15], 本研究结果显示大黄治疗组与SAP组相比, 血清淀粉酶及脂肪酶水平明显下降, 与严鸣等[16]研究结果基本一致; 本研究对血清5-HT含量进行了测定, 结果显示: 与SO组相比, SAP组、大黄治疗组5-HT含量在造模后各时间点均明显升高; 而大黄治疗组各时间点血清5-HT含量较SAP组同时间点均明显降低. 另外, 本研究还检测了各组大鼠距屈氏韧带10 cm的空肠、末端回肠及乙状结肠组织中5-HT1R、5-HT2R蛋白表达水平的变化及肠黏膜中5-HT1R+、5-HT2R+细胞面积的变化, 结果表明, SAP组每个部位各时间点5-HT1R、5-HT2R蛋白、5-HT1R+及5-HT2R+细胞面积较SO组均显著下降, 但血清中5-HT含量明显增加, 由此推测, 5-HT与其受体不能有效地结合可能是导致SAP肠动力衰竭的机制之一[17]. 与SAP组相比, 大黄治疗组每个部位各时间点5-HT1R及5-HT1R+细胞面积显著增加, 血清5-HT相同时间点含量显著下降, 而5-HT2R及5-HT2R+细胞面积未见明显增加, 此结果提示大黄有效恢复SAP大鼠肠动力的机制可能是: 大黄自身作为5-HT1R激动剂或其直接增加5-HT1R的表达, 从而有效恢复5-HT与5-HT1R的亲和力, 消耗血清5-HT, 进而使SAP肠动力得以恢复.
总之, 本研究表明SAP大鼠肠动力衰竭时血清5-HT水平明显增加, 但其受体5-HT1、5-HT2的表达明显下降, 从而导致5-HT与其受体亲和力降低, 这可能是SAP发生肠动力衰竭的机制之一, 而大黄可能是通过激活5-HT1R, 或增加5-HT1R的表达量来改善肠动力衰竭. 中药大黄来源广泛、给药方便、价格便宜, 建议可将其作为SAP肠动力衰竭的有效治疗方法.
重症急性胰腺炎(severe acute pancreatitis, SAP)具有病情重、并发症多、病死率高等特点, 肠动力衰竭是其最常见的并发症之一, 临床研究发现, 有效恢复SAP患者肠动力, 可显著降低并发症的发生率及死亡率, 提高抢救成功率及治愈率.
刘改芳, 主任医师, 河北医科大学第三医院消化内科
5-羟色胺(5-hydroxytryptamine, 5-HT)广泛分布于人体胃肠道, 是体内最重要的胃肠动力调节剂之一, 故5-HT及其受体在SAP肠动力衰竭中的变化值得关注.
Bertoni等对5-HT2A受体进行了研究, 假手术组给予了5-HT2A激活剂发现可引起肠系膜缺血-再灌注损伤, 从而导致了胃肠道传输功能的延迟; 手术组给予了5-HT2A抑制剂, 胃肠道传输功能未见延迟, 保护了胃肠道对肠系膜缺血-再灌注损伤应激效应.
目前国内外对5-羟色胺及其受体在重症急性胰腺炎肠动力衰竭中的变化及作用机制鲜有报道, 本研究采用牛磺胆酸钠制备重症急性胰腺炎大鼠肠动力衰竭模型, 观察大黄对其肠黏膜中5-HT1R、5-HT2R的表达情况, 以探讨大黄治疗重症急性胰腺炎肠动力衰竭的可能机制属国内首创.
中药大黄能有效改善重症急性胰腺炎患者肠动力衰竭, 且来源广泛、给药方便、价格便宜, 建议可将其作为重症急性胰腺炎肠动力衰竭的有效治疗方法.
本文选题新颖、科学, 方法正确, 资料齐全, 研究结果可靠, 值得临床应用.
| 1. | Hannon J, Hoyer D. Molecular biology of 5-HT receptors. Behav Brain Res. 2008;195:198-213. [PubMed] [DOI] |
| 2. | Delesalle C, van Acker N, Claes P, Deprez P, de Smet I, Dewulf J, Lefebvre RA. Contractile effects of 5-hydroxytryptamine (5-HT) in the equine jejunum circular muscle: functional and immunohistochemical identification of a 5-HT1A-like receptor. Equine Vet J. 2008;40:313-320. [PubMed] [DOI] |
| 3. | Moro E, Crema F, De Ponti F, Frigo G. Triptans and gastric accommodation: pharmacological and therapeutic aspects. Dig Liver Dis. 2004;36:85-92. [PubMed] [DOI] |
| 4. | Bertoni S, Ghizzardi P, Cattaruzza F, Ballabeni V, Impicciatore M, Tognolini M, Lagrasta CA, Barocelli E. Evidence for the involvement of 5-HT2A receptors in mild mesenteric ischemia/reperfusion dysfunctions in mice. Pharmacol Res. 2007;56:550-555. [PubMed] [DOI] |
| 5. | Wouters MM, Gibbons SJ, Roeder JL, Distad M, Ou Y, Strege PR, Szurszewski JH, Farrugia G. Exogenous serotonin regulates proliferation of interstitial cells of Cajal in mouse jejunum through 5-HT2B receptors. Gastroenterology. 2007;133:897-906. [PubMed] [DOI] |
| 6. | Chetty N, Irving HR, Coupar IM. Activation of 5-HT3 receptors in the rat and mouse intestinal tract: a comparative study. Br J Pharmacol. 2006;148:1012-1021. [PubMed] [DOI] |
| 7. | 朱 晓蕾, 李 运红, 徐 肇敏, 陈 隆典, 邹 小平, 陈蕾蕾. . 腹泻型肠易激综合征结肠黏膜5-HT3受体的研究. 南京医科大学学报(自然科学版). 2006;26:563-566. |
| 8. | Liu M, Geddis MS, Wen Y, Setlik W, Gershon MD. Expression and function of 5-HT4 receptors in the mouse enteric nervous system. Am J Physiol Gastrointest Liver Physiol. 2005;289:G1148-G1163. [PubMed] [DOI] |
| 9. | Gershon MD, Liu MT. Serotonin and neuroprotection in functional bowel disorders. Neurogastroenterol Motil. 2007;19 Suppl 2:19-24. [PubMed] [DOI] |
| 10. | Lankisch PG, Ihse I. Bile-induced acute experimental pancreatitis. Scand J Gastroenterol. 1987;22:257-260. [PubMed] [DOI] |
| 12. | Cappell MS. Acute pancreatitis: etiology, clinical presentation, diagnosis, and therapy. Med Clin North Am. 2008;92:889-923, ix-x. [PubMed] [DOI] |
编辑: 田滢 电编:鲁亚静