修回日期: 2013-06-11
接受日期: 2013-07-31
在线出版日期: 2013-09-08
目的: 检测DNA甲基转移酶(DNA methyltransferase, DNMT)在距大肠癌病灶不同距离组织中的表达差异, 以探讨其表达在大肠癌癌变早期的意义.
方法: 实验共取25例中分化结肠癌标本, 从距离大肠癌病灶近端10、5、2 cm获取组织样本, 并分别命名为1、2、3号位组织样本, 用免疫组织化学以及Western blot检测3个部位组织中DNMT的表达及分布情况.
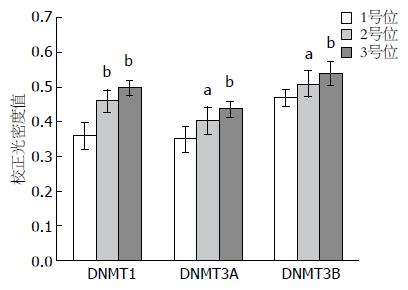
结果: 免疫组织化学实验显示DNMT1在1、2、3号位中的校正吸光度值(corrected absorbance, CA)分别0.359484±0.037511、0.460941±0.032146、0.498767±0.021143, 呈递增趋势(P<0.05). Western blot实验结果也显示DNMT1在1、2、3号位中的表达依次增加, 其在3个部位的相对表达量分别为0.7173、0.7418、0.8296. DNMT3A在2、3号位的表达均高于1号位(P<0.05), 但在2、3号位之间的表达差异无统计学意义(P>0.05). DNMT3B的表达变化与DNMT3A相同.
结论: DNMTs在1、2、3号位表达增加, 说明DNMTs在大肠癌的启动及演进过程中发挥了重要作用
核心提示: DNA甲基化是肿瘤发生的一条重要机制, 组织架构和微环境的变化对肿瘤的形成至关重要, 本文以大肠的组织架构的基本结构单元-隐窝为基本研究单位, 研究DNA甲基化的关键酶DNMT在大肠癌变过程中的表达变化.
引文著录: 吴丽云, 文彬, 胡丰良, 刘金元, 付道时. 人大肠癌癌旁不同部位组织中DNA甲基转移酶的表达差异. 世界华人消化杂志 2013; 21(25): 2515-2521
Revised: June 11, 2013
Accepted: July 31, 2013
Published online: September 8, 2013
AIM: To detect the expression of DNA methyltransferases (DNMTs) in tissues at different distances from colorectal cancer lesions.
METHODS: Immunohistochemistry and Western blot were used to detect the expression of DNMTs in 25 colorectal cancer specimens and matched tumor-adjacent tissues (> 5 cm apart from the tumor and 2 cm apart from the tumor) and normal tissues (> 10 cm apart from the tumor). None of the patients received preoperative treatments such as radiotherapy or chemotherapy.
RESULTS: The corrected absorbance of DNMT1 detected by immunohistochemistry in tissues > 10, > 5 and 2 cm apart from the tumor was 0.359484 ± 0.037511, 0.460941 ± 0.032146 and 0.498767 ± 0.021143, respectively, showing an upward-trend (P < 0.05). The corresponding relative expression levels of DNMT1detected by Western blot were 0.7173, 0.7418 and 0.8296. Expression of DNMT3A in tissues > 5 and > 10 cm apart from the tumor was significantly higher than that in tissues 2 cm apart from the tumor (both P < 0. 05), although expression of DNMT3A showed no significant difference between tissues > 5 and > 10 cm apart from the tumor (P > 0. 05). Expression of DNMT3B in the above tissues was similar to that of DNMT3A.
CONCLUSION: Up-regulation of DNMT1, DNMT3A and DNMT3B may play a significant role in the occurrence of colorectal carcinoma.
- Citation: Wu LY, Wen B, Hu FL, Liu JY, Fu DS. DNMTs are differentially expressed in tissues at different distances from colorectal cancer lesions. Shijie Huaren Xiaohua Zazhi 2013; 21(25): 2515-2521
- URL: https://www.wjgnet.com/1009-3079/full/v21/i25/2515.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i25.2515
对于肿瘤, 人类尚无良方, 目前最为行之有效的方法就是: 早发现、早诊断、早治疗. 研究肿瘤恶变前期和早期生物学特征, 寻找早期病变的分子标志、探求肿瘤的启动分子机制, 一直是肿瘤研究领域的重点. 随着后基因组时代的到来, 越来越多的研究表明, DNA甲基化、组蛋白修饰、染色质异构等表观遗传学转换是细胞增殖分化失衡的早期事件, 早于基因突变和基因组不稳定性的发生[1].
DNA甲基化是表观遗传学的重要内容, 也是肿瘤发生的一条重要机制[2]. 机体内所有的DNA甲基化(去甲基化)过程都在DNA甲基转移酶(DNA methyltransferase, DNMT)催化下完成, DNA异常甲基化的一个潜在机制就是DNMT发生过调节[3,4].
从组织病理学角度, 肠道隐窝是肠道细胞结构的基本单元, 也是承载肠道病变的基本单元. 隐窝底部肠道干细胞的增殖、分化是肠黏膜更新的主要细胞学基础[5]. 肠道干细胞在向上移行的同时不断分化成为成熟的杯状细胞和柱状细胞, 以补充脱落的肠道上皮细胞, 维持肠黏膜细胞的正常更新. 因此本研究通过免疫组织化学和蛋白质印迹法观察不同部位组织中DNA甲基转移酶的表达分布, 进行探讨DNMTs在大肠癌变过程中表达的变化在大肠癌变启动过程中的意义.
标本取自广州中医药大学附属医院及广州军区总医院2012-05/2013-02手术切除的25位中分化结肠癌患者, 其中男性13例, 女性12例, 平均年龄57.8岁±10.9岁. 所有大肠癌患者均为散发性大肠癌, 且术前均未经任何放、化疗, 所有病例均经两位以上病理医师确诊. 标本切取位置如图1所示, 每例依次取距离大肠癌病灶近端10、5、2 cm的组织, 分别标记为1、2和3号位. 结肠癌沿远近两端直接浸润一般不超过2 cm, 但沿结肠旁淋巴结却可向两侧扩展8 cm以上, 1号位距离肿瘤近端10 cm属于手术切除的安全距离, 在本研究中我们视其为正常组织; 3号组织为距离病灶边缘2 cm的癌旁组织样本; 2号位组织为1和3号位之间的组织样本. 兔抗人DNMT1多克隆抗体(批号bs-0678R)、兔抗人DNMT-3A多克隆抗体(批号bs-0497R)、DNMT-3B(批号bs-0301R)均购自北京博奥森生物技术公司. 免疫组织化学检测试剂(SP法)及二氨基联苯胺(3, 3'-diaminobenzidine, DAB)显色试剂盒购自北京中杉金桥生物技术公司. PVDF膜(MILLIPORE), SDS凝胶加样缓冲液, 三去污剂裂解缓冲液, 脱脂奶粉, 0.1%PBST.
1.2.1 免疫组织化学染色及结果判定: 所有标本均经4%多聚甲醛固定, 常规石蜡包埋, 采用4 μm厚连续切片. 常规脱蜡水化, PBS冲洗, 3%过氧化氢灭活内源性过氧化物酶, 微波修复15 min, 加入兔抗人一抗(抗体稀释度为1:300), 4 ℃过夜; PBS冲洗2 min×3次, 滴加相应二抗37 ℃温箱孵育30 min, 具体步骤按试剂盒说明书操作. DAB显色, 苏木精复染, 常规乙醇脱水, 二甲苯透明, 中性树胶封片, 显微镜下观察结果. 每例标本均用PBS代替一抗作阴性对照. 应用IPP6.0病理图象分析软件测定各组免疫阳性产物的光密度(A)值, 每张切片随机测定6个视野, 同时测定同一张切片上组织的A值作为背景, 免疫反应产物的A值减去背景A值得到校正的A值(CA值), 即为各阳性产物的实际吸光度值, 然后求平均值作为该样本的CA值. 用CA值进行分析和比较, 以避免染色过程中的非特异性染色等导致的误差.
1.2.2 用Western blot方法检测DNMT1、DNMT3A及DNMT3B的表达: 每100 mg组织中加入1 mL蛋白裂解液和10 μL 100 mmol/L的PMSF. 研磨后将样品转移到1.5 mL离心管, 冰里放置30 min, 然后4 ℃、12000 r/min高速离心30 min. 取20 μL的上清液即细胞裂解液, 并加5 μL 5×电泳上样缓冲液(预染Marker取5 μL), 沸水浴5 min, 12000 r/min离心3 min, 去除不溶性蛋白, 上样, 电泳约1.5 h, 取分离胶进行转膜, 取出PVDF膜, 去离子水洗涤, 洗液平衡后用5%脱脂奶粉室温封闭90 min, 加已稀释好的兔抗DNMT1(1:500), DNMT3A(1:500), DNMT3B(1:500), 4 ℃过夜. PBS洗膜, 第1次15 min, 后3次每次5 min. 加5 mL 1:5000稀释的羊抗兔二抗, 室温反应1 h, TBST洗膜后, ECL增强发光, X线曝光5 min. 以β-actin蛋白作为内参对照. 采用WO-9413B型凝胶成像系统自带软件Gelpro32来分析胶片中的蛋白条带.
统计学处理 各组实验数据以mean±SD表示, 采用SPSS16.0统计软件, 计量资料进行均数间比较采用t检验或方差分析. 以P<0.05为差异有统计学意义.
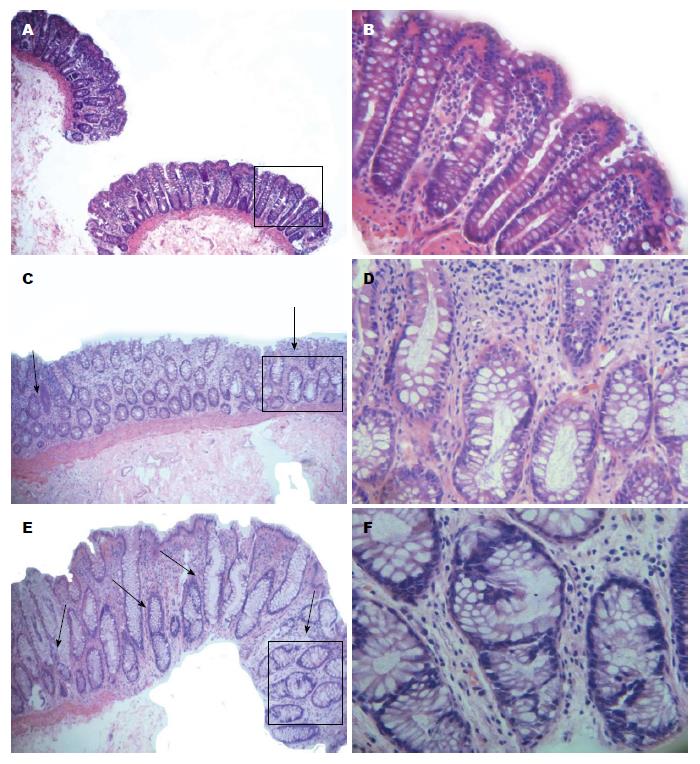
1987年Bird和Good[6]在研究啮齿动物的大肠癌模型中发现了异常隐窝病灶(aberrant crypt foci, ACF). 1991年ACF被确认亦存在于人类结肠中[7,8]. 多数学者认为ACF可能是大肠癌发生的最早期事件, 并把ACF作为大肠癌早期诊断的观察指标之一[9-11]. ACF是由单个或一组异常隐窝构成的病灶, 其形态学特征与正常黏膜相比, 有以下特征: 隐窝增大变厚, 呈锯齿状; 裂隙状管腔, 开口呈椭圆状; 上皮细胞层增生染色加深; 细胞核大有异型性[12,13]. 此后, 许多研究者对ACF发生过程中的遗传和表观遗传变化进行了研究[14-16]. 研究表观遗传与遗传的改变, 对于大肠癌早期诊断、预后及个体化的医疗都具有十分重要的意义. 在本研究中, 我们首先比较了3个不同部位组织中ACF的存在情况及形态特征.
通过HE染色, 我们观察到, 在1号位组织中, 隐窝排列整齐, 腺腔直径正常, 隐窝中的细胞呈单层排列且细胞核大小正常, 上皮层无明显改变(图2A, B). 在最靠近病灶的2、3号部位组织中, 依肿瘤恶性程度不同, 隐窝或完全消失或部分残存, 对于残存的ACF, 越接近病灶的组织, 隐窝形态变化越大, 而且ACF数量越多. 在2号位组织中, 我们观察到有的隐窝较大, 管腔呈锯齿状, 细胞核增大拉长, 表现出拥挤、分层的状态, 均属典型的ACF特征(图2C, D). 3号位组织同2号位组织一样, 也有ACF出现, 其隐窝异型增生明显, 腺管染色加深, 隐窝直径异常增大, 上皮层增厚, 隐窝内细胞的细胞核增大, 细胞排列得拥挤, 还出现分层、极性消失的情况(图2E, F), 且ACF数量较2号位组织多. Shpitz等[17]在对74例散发性大肠癌ACF的分布规律进行研究后也发现大肠癌远端的ACF多于近端部分.
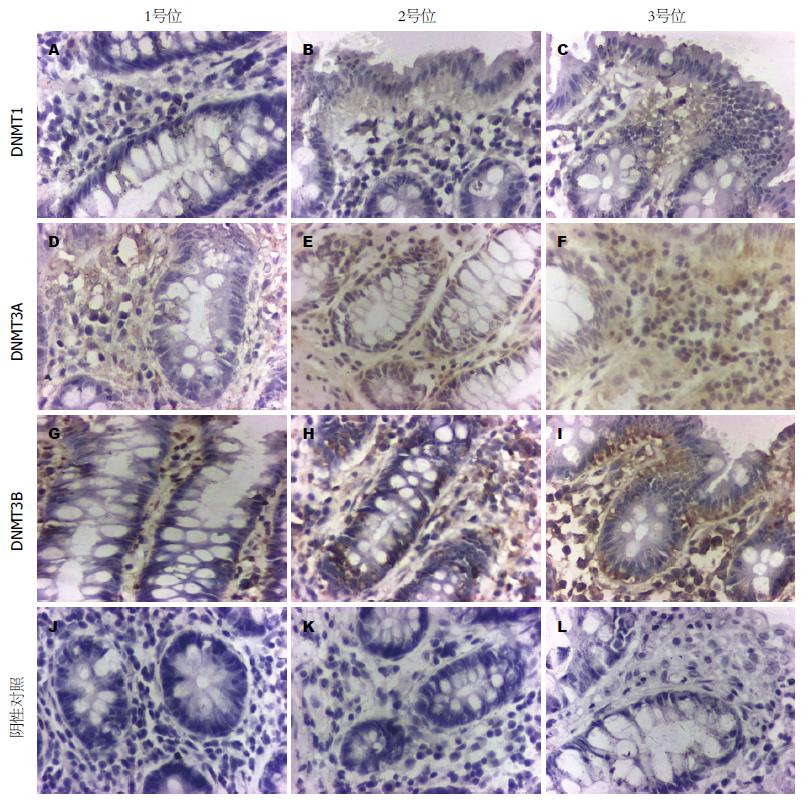
我们用免疫组织化学对3个部位组织中DNA甲基转移酶的表达分布进行分析, 结果显示DNMT1表达可见于1、2和3号位组织中. 其中在距离病灶最远的1号位组织中, 隐窝结构清晰、排列整齐, 隐窝内细胞单层排列, DNMT1表达较少, 且表达主要分布在隐窝之间的间质中表达(图3A), 而在2号位中存在ACF, 隐窝口变大, 隐窝内的细胞出现分层而非单层状态, DNMT1在其中的表达较1号位高, 且在隐窝间间质及隐窝中均有表达(图3B); 3号位中(图3C), ACF数量较2号位多, 如图3C中隐窝内细胞密集呈现拥挤、分极性消失的状态, DNMT1这个部位组织中的表达较1、2号位高. 其在3个部位的校正光密度值(CA)分别为0.359484±0.037511、0.460941±0.032146、0.498767±0.021143, 呈逐渐递增的趋势(P<0.05, 图4).
DNMT3A主要表达于隐窝之间的间质中, 在隐窝内表达较少, 其在1、2和3号位中的表达量分别为0.3512±0.03775、0.404684±0.039239、0.438148±0.020438, 其表达依次增高, 在2和3号位的表达都高于1号位(图3D-F, P<0.05), 但在2和3号位之间的表达差异没有统计学意义(P>0.05, 图4).
DNMT3B在隐窝内及隐窝之间的间质中都有表达, 且其在3个部位组织的表达变化与DNMT3A类似, 在2和3号位的表达都高于1号位(图3G-I, P<0.05), 但在2和3号位之间的表达差异没有统计学意义(P>0.05), 其在3个部位组织表达量分别为0.471217±0.026454、0.510019±0.032516、0.540606±0.036183.
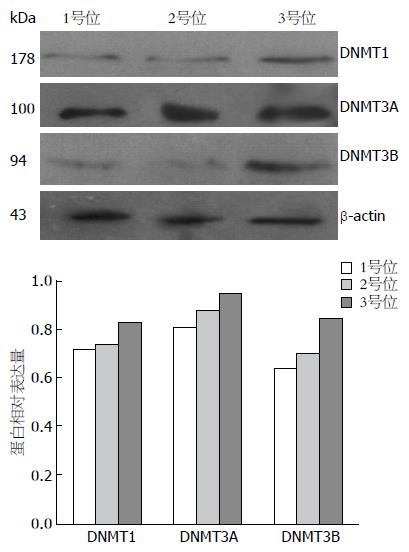
分别取3个部位新鲜组织样本, 用Western blot检测组织中DNMTs相对表达量, 结果表明DNMT1在3个部位的相对表达量分别为0.7173、0.7418、0.8296, DNMT3A和DNMT3B在3个部位的相对表达分别为0.8091、0.8804、0.9051; 0.6405、0.7023、0.8445都呈现依次增加的趋势(图5).
近十几年来, 肿瘤细胞中心观指导下的肿瘤研究模式受到了巨大冲击[18-20]: 首先, 以肿瘤相关机制为基础的肿瘤组织原则的构建, 使人们意识到肿瘤其实就是一个不断发展的紊乱器官; 正常组织可以精确地产生、释放、控制促进生长信号, 以维持正常组织的架构和功能. 组织架构和内稳态的转变是肿瘤启动的早期信号[21-25], 其中的机制可能是组织结构的重塑改变了组织微环境. 其次, 表观遗传调控在肿瘤的发生发展中发挥了关键性的作用, 表观遗传调控决定了组织微环境的重塑, 而微环境的重塑又转变了组织微架构, 反过来, 组织结构的重塑又进一步转变了组织微环境, 这些都决定了肿瘤的形成和生长[26]. 对于大肠, 隐窝是上皮组织的基本结构单元, 也是装载这一过程的基本单元.
Tamura等[27]通过扫描电镜观察不同病变状态下的大肠隐窝, 发现处于不同病变时期的隐窝形态学上有很大差别, 他们的体积、形状、表面光滑程度以及有无分支都与正常隐窝不同. 这些异常的隐窝单独或聚集在一起, 就形成了ACF. Gupta和Schoen[28]对ACF与人类大肠癌的发生相关文献进行了整理, 认为流行病学和分子生物学的研究都支持ACF是结肠腺瘤的前体, 是大肠癌的生物标识.
我们从距离大肠癌病灶近端不同距离取的标本中也发现了这一点, 我们的研究是以隐窝结构为基础, 在正常组织中, 罕见ACF, 隐窝长度、大小及管腔开口均正常, 隐窝内细胞单层排列, 具有极性. 而在2号位及3号位组织中, 都可见ACF, 且3号位组织中的ACF数量较2号位中多, 在这两种组织中, 隐窝可见直径、长度增大, 隐窝开口锯齿状、有分支, 隐窝内细胞排列杂乱拥挤甚至分层而极性消失. 我们以ACF为基本研究单元, 在此基础上研究肿瘤的表观遗传转换对促肿瘤微环境进行再教育, 对靶向治疗肿瘤有重要意义.
表观遗传学是近15年来最令人兴奋, 也是发展最迅速的领域, 许多学者认为表观遗传学可能会从根本上改变我们对肿瘤基础生物学的理解. 目前, 我们尚不能对表观机制是否会实质性改变我们对肿瘤基础生物学的理解下一个定论, 但表观遗传机制却引发了肿瘤病理机制根本性的转变, 至少目前, 表观机制对肿瘤与微环境之间的调控使对肿瘤启动机制前移到更加早期的阶段.
表观遗传的改变使癌前细胞具有了选择生长优势[29,30]. DNA甲基化是表观遗传学修饰的重要内容, 是肿瘤发生的一条重要机制, 也是肿瘤发生的早期分子事件[31-33]. 对癌旁组织的研究发现, 癌基因低甲基化在癌症发生之前就已存在, 几乎每种类型肿瘤的启动子甲基化都有其独特的模式, DNA的甲基化和去甲基化都由DNMT催化完成, DNA甲基化异常的一个潜在机制就是DNMT发生过调节. DNMT表达和活性升高是癌细胞的一个特征性的早期分子改变[34].
哺乳动物中具有甲基化活性的甲基转移酶有DNMT1、DNMT3A、DNMT3B[35]. 传统上认为DNMT1主要负责维持基因甲基化, 而DNMT3A、DNMT3B负责从头甲基化, 但最新研究认为三者同时具有重头甲基化和维持甲基化作用[36].
DNMTs能维持基因组完整性, 基因组的完整性一旦被破坏将会引起染色质不稳定以及肿瘤的发生. 其维持基因组稳定性的作用依赖于其在基因的表达调控中起着重要作. DNMTs的异常表达暗示了基因表达调控的异常. 在癌细胞中, DNMT基因的表达升高往往先于高甲基化变化, 因此可认为DNMT表达量增高是癌细胞的一个特征性的早期分子变化[37].
我们的研究显示在癌变早期肠组织不仅发生了形态学的变化, 出现了隐窝异常病灶, 而且在离肠癌病灶不同距离组织中甲基转移酶的表达有差异, DNMTs在越靠近肠癌病灶的组织中表达越高. 2、3号位组织中可见ACF, 且3号位组织中ACF数量多于2号位组织. DNMTs在这两个部位组织中的表达均高于正常组织(P<0.05), 且在3号位组织中的表达高于2号位组织, 但DNMT3A、DNMT3B在2号位组织和3号位组织中的表达差异无统计学意义(P>0.05). 就表达分布而言, DNMT1、DNMT3A的表达主要分布于隐窝间的间质中, 且在2、3号位组织中隐窝间间质的表达量明显增多. DNMT3B在隐窝中和隐窝间的间质中均有表达, 且在2、3号位组织的隐窝及隐窝间质中表达均增多. 这说明组织结构、微环境的变化即出现ACF与DNMTs的高表达在大肠癌变启动中有重要意义, 可将二者结合作为大肠癌变的早期标志, 运用于大肠癌的筛查、预防、诊断等方面, 但二者之间的相互作用机制仍需探索, 我们将把这作为下一步的方向继续深入研究.
近年来, 对肿瘤启动机制的研究认为, 表观遗传在肿瘤的启动中发挥了关键性的作用. DNA甲基化是表观遗传修饰的重要内容, 也是肿瘤发生的早期分子事件. DNA甲基化、组织微环境、组织架构共同决定了肿瘤的发生和生长楚.
蔡开琳, 副教授, 华中科技大学同济医学院附属协和医院普通外科
研究发现, 肿瘤的发生常伴随着DNA的异常甲基化, 但不同肿瘤中, DNA甲基化的变化却不相同. DNMT作为DNA甲基化的关键酶, 已经被用作大肠癌临床检测指标.
Tamura等研究发现了隐窝异常病灶(aberrant crypt foci, ACF). 许多学者都认为ACF是结肠腺瘤的前体, 是大肠癌的生物标志. 对肿瘤启动的研究发现肿瘤发生的机制之一是DNMT异常表达从而引起的DNA异常甲基化.
近年来对肿瘤中DNMT异常表达的研究大多以癌组织、癌旁组织和正常组织为研究对象, 研究DNMT在3种组织中的表达变化, 而本实验在不同组织的基础上以隐窝为基本研究单位, 结合组织结构、微环境, 研究DNMT在癌变过程中的表达变化.
DNMT结合ACF可作为大肠癌临床检查指标, 比二者单独作为检测指标来检测大肠癌更加准确.
本文发现结直肠癌病例中, 以癌灶为中心, 存在一个梯度下降性的DNMT表达及ACF发生率的差异, 此结果未见报道, 值得深入研究.
编辑: 田滢 电编: 鲁亚静
| 1. | 王 先火, 赵 秀娟, 邱 立华, 王 华庆, 王 玺. 肿瘤发生的表观遗传学: 进展与临床意义. 北京大学学报(医学版). 2012;44:701-707. |
| 3. | Baylin SB, Herman JG, Graff JR, Vertino PM, Issa JP. Alterations in DNA methylation: a fundamental aspect of neoplasia. Adv Cancer Res. 1998;72:141-196. [PubMed] [DOI] |
| 4. | Robertson KD, Uzvolgyi E, Liang G, Talmadge C, Sumegi J, Gonzales FA, Jones PA. The human DNA methyltransferases (DNMTs) 1, 3a and 3b: coordinate mRNA expression in normal tissues and overexpression in tumors. Nucleic Acids Res. 1999;27:2291-2298. [PubMed] [DOI] |
| 6. | Bird RP, Good CK. The significance of aberrant crypt foci in understanding the pathogenesis of colon cancer. Toxicol Lett. 2000;112-113:395-402. [PubMed] [DOI] |
| 7. | Roncucci L, Stamp D, Medline A, Cullen JB, Bruce WR. Identification and quantification of aberrant crypt foci and microadenomas in the human colon. Hum Pathol. 1991;22:287-294. [PubMed] [DOI] |
| 8. | Pretlow TP, Barrow BJ, Ashton WS, O'Riordan MA, Pretlow TG, Jurcisek JA, Stellato TA. Aberrant crypts: putative preneoplastic foci in human colonic mucosa. Cancer Res. 1991;51:1564-1567. [PubMed] |
| 9. | Wargovich MJ, Jimenez A, McKee K, Steele VE, Velasco M, Woods J, Price R, Gray K, Kelloff GJ. Efficacy of potential chemopreventive agents on rat colon aberrant crypt formation and progression. Carcinogenesis. 2000;21:1149-1155. [PubMed] [DOI] |
| 10. | Jen J, Powell SM, Papadopoulos N, Smith KJ, Hamilton SR, Vogelstein B, Kinzler KW. Molecular determinants of dysplasia in colorectal lesions. Cancer Res. 1994;54:5523-5526. [PubMed] |
| 11. | Siu IM, Pretlow TG, Amini SB, Pretlow TP. Identification of dysplasia in human colonic aberrant crypt foci. Am J Pathol. 1997;150:1805-1813. [PubMed] |
| 12. | Pretlow TP, Pretlow TG. Mutant KRAS in aberrant crypt foci (ACF): initiation of colorectal cancer? Biochim Biophys Acta. 2005;1756:83-96. [PubMed] [DOI] |
| 13. | Cheng L, Lai MD. Aberrant crypt foci as microscopic precursors of colorectal cancer. World J Gastroenterol. 2003;9:2642-2649. [PubMed] |
| 14. | Nucci MR, Robinson CR, Longo P, Campbell P, Hamilton SR. Phenotypic and genotypic characteristics of aberrant crypt foci in human colorectal mucosa. Hum Pathol. 1997;28:1396-1407. [PubMed] |
| 15. | Shivapurkar N, Huang L, Ruggeri B, Swalsky PA, Bakker A, Finkelstein S, Frost A, Silverberg S. K-ras and p53 mutations in aberrant crypt foci and colonic tumors from colon cancer patients. Cancer Lett. 1997;115:39-46. [PubMed] [DOI] |
| 16. | Suehiro Y, Hinoda Y. Genetic and epigenetic changes in aberrant crypt foci and serrated polyps. Cancer Sci. 2008;99:1071-1076. [PubMed] [DOI] |
| 17. | Shpitz B, Bomstein Y, Mekori Y, Cohen R, Kaufman Z, Neufeld D, Galkin M, Bernheim J. Aberrant crypt foci in human colons: distribution and histomorphologic characteristics. Hum Pathol. 1998;29:469-475. [PubMed] [DOI] |
| 19. | Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011;144:646-674. [PubMed] [DOI] |
| 20. | Pietras K, Ostman A. Hallmarks of cancer: interactions with the tumor stroma. Exp Cell Res. 2010;316:1324-1331. [PubMed] [DOI] |
| 21. | Polyak K, Haviv I, Campbell IG. Co-evolution of tumor cells and their microenvironment. Trends Genet. 2009;25:30-38. [PubMed] [DOI] |
| 22. | Egeblad M, Nakasone ES, Werb Z. Tumors as organs: complex tissues that interface with the entire organism. Dev Cell. 2010;18:884-901. [PubMed] [DOI] |
| 23. | Moran EM. Epidemiological and clinical aspects of nonsteroidal anti-inflammatory drugs and cancer risks. J Environ Pathol Toxicol Oncol. 2002;21:193-201. [PubMed] [DOI] |
| 24. | Weber CE, Kuo PC. The tumor microenvironment. Surg Oncol. 2012;21:172-177. [PubMed] [DOI] |
| 25. | Dvorak HF. Tumors: wounds that do not heal. Similarities between tumor stroma generation and wound healing. N Engl J Med. 1986;315:1650-1659. [PubMed] [DOI] |
| 26. | Allen M, Louise Jones J. Jekyll and Hyde: the role of the microenvironment on the progression of cancer. J Pathol. 2011;223:162-176. [PubMed] [DOI] |
| 27. | Tamura S, Furuya Y, Tadokoro T, Higashidani Y, Yokoyama Y, Araki K, Onishi S. Pit pattern and three-dimensional configuration of isolated crypts from the patients with colorectal neoplasm. J Gastroenterol. 2002;37:798-806. [PubMed] [DOI] |
| 28. | Gupta AK, Schoen RE. Aberrant crypt foci: are they intermediate endpoints of colon carcinogenesis in humans? Curr Opin Gastroenterol. 2009;25:59-65. [PubMed] [DOI] |
| 29. | Esteller M, Herman JG. Cancer as an epigenetic disease: DNA methylation and chromatin alterations in human tumours. J Pathol. 2002;196:1-7. [PubMed] [DOI] |
| 30. | Jones PA, Baylin SB. The fundamental role of epigenetic events in cancer. Nat Rev Genet. 2002;3:415-428. [PubMed] [DOI] |
| 31. | Esteller M. Relevance of DNA methylation in the management of cancer. Lancet Oncol. 2003;4:351-358. [PubMed] [DOI] |
| 33. | Baylin SB, Herman JG. DNA hypermethylation in tumorigenesis: epigenetics joins genetics. Trends Genet. 2000;16:168-174. [PubMed] [DOI] |
| 34. | Rhee I, Bachman KE, Park BH, Jair KW, Yen RW, Schuebel KE, Cui H, Feinberg AP, Lengauer C, Kinzler KW. DNMT1 and DNMT3b cooperate to silence genes in human cancer cells. Nature. 2002;416:552-556. [PubMed] [DOI] |
| 36. | Fernandez AF, Huidobro C, Fraga MF. De novo DNA methyltransferases: oncogenes, tumor suppressors, or both? Trends Genet. 2012;28:474-479. [PubMed] [DOI] |