修回日期: 2013-03-06
接受日期: 2013-04-07
在线出版日期: 2013-04-28
目的: 研究铁鳌合剂去铁胺(deferoxamine, DFO)对胰腺癌PANC-1细胞增殖率的影响, 为进一步探讨DFO用于治疗胰腺癌提供实验基础.
方法: 体外培养胰腺癌PANC-1细胞, 分别以DFO 200 μmol/L、吉西他滨(gemcitabine, GEM)10 μmol/L、DFO 200 μmol/L+GEM 10 μmol/L作用于PANC-1细胞, 24 h后收获细胞用MTT试剂盒检测PANC-1细胞的增殖率; 以GEM筛选GEM耐药PANC-1细胞, 分别以DFO 100 μmol/L及200 μmol/L处理24 h后收获细胞, 用MTT试剂盒检测GEM耐药PANC-1细胞的增殖率.
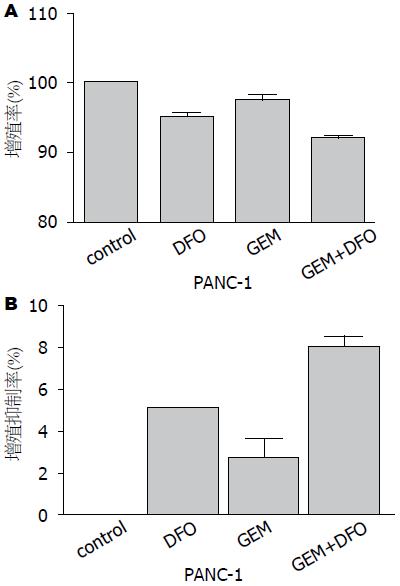
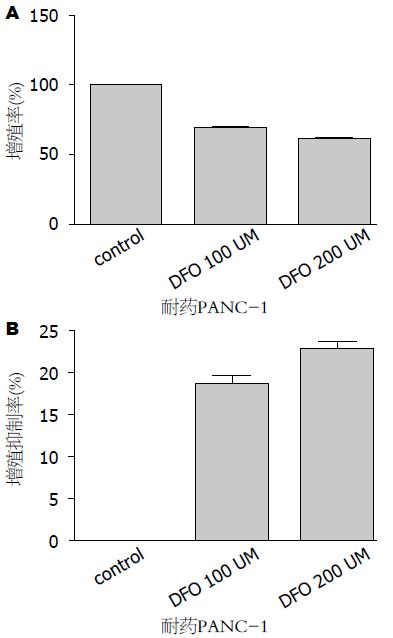
结果: 经DFO 200 μmol/L、GEM 10 μmol/L处理24 h后, PANC-1细胞增殖率分别为94.9%和97.3%, DFO及GEM对细胞增殖的抑制率分别为4.25%和2.28%, 经DFO 200 μmol/L+GEM 10 μmol/L处理24 h后, PANC-1细胞增殖率为91.9%, 其对PANC-1细胞增殖抑制率为6.67%. DFO及GEM对PANC-1细胞增殖均有明显的抑制作用(P<0.05), 二者联用具有协同作用. GEM耐药PANC-1细胞经DFO 100 μmol/L和200 μmol/L处理24 h后其增殖率分别为40.0%和35.8%, DFO 100 μmol/L和200 μmol/L对GEM耐药PANC-1细胞增殖抑制率分别为22.5%和27.7%. DFO可明显抑制GEM耐药PANC-1细胞的增殖.
结论: 铁鳌合剂DFO对胰腺癌PANC-1细胞株的增殖有明显的抑制作用, 与GEM具有协同作用; DFO对GEM耐药PANC-1细胞的增殖亦有明显的抑制作用.
核心提示: 铁鳌合剂去铁胺(deferoxamine, DFO)对胰腺癌PANC-1细胞株的增殖有明显的抑制作用, 与吉西他滨(gemcitabine, GEM)具有协同作用; DFO对GEM耐药PANC-1细胞的增殖亦有明显的抑制作用.
引文著录: 赵慧贞, 庞慧芳, 赵秋, 覃华. 铁鳌合剂DFO对胰腺癌细胞株PANC-1增殖率的影响. 世界华人消化杂志 2013; 21(12): 1109-1113
Revised: March 6, 2013
Accepted: April 7, 2013
Published online: April 28, 2013
AIM: To investigate the effect of treatment with deferoxamine (DFO), an iron chelator, on cell proliferation in pancreatic cancer cell line PANC-1, and to provide an experimental basis for the possible use of DFO for the treatment of pancreatic cancer.
METHODS: Cultured PANC-1 cells were treated with DFO 200 μmol/L, gemcitabine (GEM) 10 μmol/L, or DFO 200 μmol/L + GEM 10 μmol/L for 24 h. The proliferation of PANC-1 cells was determined by MTT Assay. GEM-resistant PANC-1 cells were cultured in vitro and treated with DFO at 100 μmol/L or 200 μmol/L for 24 h. The proliferation of GEM-resistant PANC-1 cells was assessed by MTT assay.
RESULTS: After treatment with DFO (200 μmol/L) and GEM (10 μmol/L) for 24 h, the proliferation rates of PANC-1 cells were 94.9% and 97.3%, respectively, and the reduced rates of cell proliferation were 4.25% and 2.28%. After treatment with DFO (200 μmol/L) + GEM (10 μmol/L) for 24 h, the proliferation rate of PANC-1 cells was 91.9%, and the reduced rate of cell proliferation was 6.67%. DFO and GEM significantly inhibited the proliferation of PANC-1 cells (P < 0.05), and they had a synergistic effect on PANC-1 cell proliferation. After treatment with DFO (100 μmol/L and 200 μmol/L) for 24 h, the proliferation rates of GEM-resistant PANC-1 cells were 40.0% and 35.8%, and reduced rates of cell proliferation were 22.5% and 27.7%, respectively. DFO also significantly inhibited the proliferation of GEM-resistant PANC-1 cells.
CONCLUSION: Treatment with DFO can significantly inhibit the proliferation of PANC-1 cells, and DFO has a synergistic effect with GEM. DFO can also significantly inhibit the proliferation of GEM-resistant PANC-1 cells.
- Citation: Zhao HZ, Pang HF, Zhao Q, Qin H. Treatment with deferoxamine inhibits the proliferation of PANC-1 cells. Shijie Huaren Xiaohua Zazhi 2013; 21(12): 1109-1113
- URL: https://www.wjgnet.com/1009-3079/full/v21/i12/1109.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i12.1109
铁是机体中重要的微量元素之一, 细胞内多种酶均含有铁且其活性与铁含量相关, 机体铁代谢异常可导致多种疾病[1]. 铁参与机体氧气转运、电子传递、DNA合成以及细胞免疫应答等多种生理机能[2,3], 在细胞新陈代谢过程中起着重要的作用. 铁可调节细胞周期蛋白、凋亡相关基因的表达, 在肿瘤细胞生长和分化过程中亦起着重要的作用[4-6]. 国外研究发现铁超载可加快肿瘤细胞的生长速度, 铁鳌合剂剥夺细胞内铁后可抑制肺癌、肝癌细胞的生长[7-9]. 胰腺癌是一种恶性程度高、易早期转移、预后极差的消化系肿瘤, 其早期诊断十分困难, 多数患者在确诊时因已发生肿瘤局部浸润和/或远处转移而失去最佳治疗时机, 且胰腺癌对放疗和化疗并不敏感, 即使采用综合治疗其5年生存率不到5%[10], 预后极差. 因此, 寻求新的治疗药物成为胰腺癌的研究热点, 本研究在细胞水平观察铁鳌合剂去铁胺(deferoxamine, DFO)对人胰腺癌PANC-1细胞增殖的影响, 为进一步探讨DFO用于胰腺癌的临床治疗提供实验基础.
PANC-1细胞由本实验室保存; 胎牛血清购自杭州四季青生物工程材料公司; RMPI培养基购自Gibco公司; DFO购自诺华公司; 盐酸吉吉西他滨(gemcitabine, GEM)购自江苏豪森药业股份有限公司; MTT试剂盒购自碧云天公司.
1.2.1 细胞培养: PANC-1细胞用含10%胎牛血清、青霉素100 U/mL和链霉素100 U/mL的RMPI培养液, 置于37 ℃、5%CO2培养箱中培养, 根据细胞生长状态, 观察培养基颜色更换新鲜培养基. 按Shah等[11]报道的方法筛选、培养GEM耐药PANC-1细胞.
1.2.2 MTT法检测细胞增殖: 分别收集对数期PANC-1细胞及吉西他滨筛选后的耐吉西他滨PANC-1细胞, 收集至10 mL离心管, 1 200 r/min离心5 min去除培养基, 以培养基悬浮细胞后接种于96孔板(4×103细胞/孔), 96孔周边孔添加无菌PBS溶液, 减少细胞培养基挥发, 待细胞贴壁, 细胞密度长至60%-80%后, 吸去培养基, 保留空白孔和对照孔, 实验孔分别加入含DFO、GEM或DFO+GEM的培养基. 本研究中PANC-1细胞分为4组: 对照组、DFO 200 μmol/L组、GEM 10 μmol/L组及DFO 200 μmol/L+GEM 10 μmol/L组; GEM耐药PANC-1细胞分为3组: 对照组、DFO 100 μmol/L及DFO 200 μmol/L组. 每个实验组设定6个复孔, 37 ℃、5%CO2培养24 h. 按照每孔100 μL培养基加入10 μL MTT工作液, 避光微量震荡器上震荡均匀, 后置于37 ℃、5%CO2培养箱, 2 h后于450 nm波长测吸光度.
统计学处理 用SPSS17.0统计软件进行分析, 用Graphpad prism作图. DFO、GEM及DFO+GEM等处理组与对照组之间的差异采用t检验分析, P<0.05表示有显著统计学差异.
胰腺癌PANC-1细胞经DFO 200 μmol/L、GEM 10 μmol/L及DFO 200 μmol/L+GEM 10 μmol/L处理24 h后, 其增殖率分别为94.9%、97.3%和91.9%, 与对照组相比PANC-1细胞增殖率均明显降低(P = 0.0009, 0.0476, <0.0001). GEM 10 μmol/L与DFO 200 μmol/L组无统计学意义(P>0.05), DFO 200 μmol/L+GEM 10 μmol/L与DFO 200 μmol/L、GEM 10 μmol/L相比细胞增殖率明显下降(P = 0.0082, 0.0094). DFO 200 μmol/L、GEM 10 μmol/L及DFO 200 μmol/L+ GEM 10 μmol/L对PANC-1细胞增殖抑制率分别为4.25%、2.28%和6.67%, DFO 200 μmol/L与GEM 10 μmol/L可明显抑制PANC-1细胞的增殖, 且二者具有协同作用(图1).
吉西他滨耐药PANC-1细胞经DFO 100 μmol/L及200 μmol/L处理24 h后, 其增殖率分别为40.0%和35.8%, 与对照组相比PANC-1细胞增殖率均明显降低(P<0.0001, <0.0001); DFO 100 μmol/L与DFO 200 μmol/L相比有统计学意义(P = 0.0017)DFO可明显抑制吉西他滨耐药PANC-1细胞增殖, DFO 100 μmol/L及200 μmol/L对PANC-1细胞增殖抑制率分别为18.5%和22.68%, 其抑制作用强度与DFO剂量相关(图2).
去铁胺被认为是降低机体铁负荷的"金标准", 主要用于治疗血红蛋白病及β-地中海贫血合并铁负荷过重者[9]. DFO与游离或蛋白结合的Fe3+形成稳定、无毒的水溶性铁胺复合物随尿排出体外而降低机体铁负荷. DFO对转铁蛋白中的铁离子清除作用不强, 亦不能清除血红蛋白、肌球蛋白和细胞色素中的铁离子, 因而DFO对血红蛋白、肌红蛋白及细胞色素无不良影响.
本研究中胰腺癌PANC-1细胞经DFO 200 μmol/L处理24 h后, 其增殖率与对照组相比明显降低(P<0.05), 与GEM组相近, 二者联用可进一步抑制PANC-1细胞的增殖, 两者具有协同作用. 因此, 在胰腺癌综合治疗中可以将铁鳌合剂作为新的选择. DFO抑制肿瘤细胞增殖的确切机制尚未明了, 其可能机制包括以下几个方面: (1)肿瘤细胞快速增殖过程中合成DNA时需要大量的铁, DFO可通过螯合作用降低肿瘤细胞内铁水平, 从而影响肿瘤细胞DNA合成[9]; (2)核苷酸还原酶(ribonucleotide reductase, RR)是DNA合成的限速酶, RR在DNA修复中亦起着重要作用, 其活性中心包含一个Fe-O-Fe结构, DFO可降低肿瘤细胞内铁水平进而降低RR活性[12,13]抑制DNA合成; (3)DFO螯合肿瘤细胞内铁后下调细胞周期蛋白Cyclin D1、cdk2的表达致使肿瘤细胞G1/S期停滞, 上调p53及Ndrg1水平导致肿瘤细胞生长周期停滞或诱导细胞凋亡[4,14,15]. 与此同时, 有研究发现DFO可通过上调肿瘤细胞内Ndrg1水平而减弱TGF-β诱导的上皮细胞间质转分化, 降低结肠癌HT29及DM145细胞的迁移和侵袭力[5,16]. 我们同期的研究发现胰腺癌ASPC-1细胞经DFO 50、100、200 μmol/L处理24 h后, 其增殖率分别为95.52%、93.65%、94.29%, 和对照组相比无统计学意义, 组间相比亦无统计学意义, 其原因有待于进一步研究.
胰腺癌为消化系常见肿瘤, 其恶性度高、进展快、预后差, 5年存活率仅为1%-3%. 随着诊疗技术的改进, 胰腺癌诊断率及手术切除率均有所提高, 围手术期死亡率及并发症发生率亦有显著降低, 但其治疗效果仍不理想, 分析其原因主要与胰腺癌细胞多药耐药有关. GEM是治疗胰腺癌的首选化疗药物, 由于胰腺癌细胞获得性或内在的耐药性致使其总体有效率不足20%, 近年来GEM联合非细胞毒性药物以增强其化疗敏感性成为研究的热点, 王若天等[17]研究发现联合应用姜黄素与GEM可显著抑制PANC-1细胞增殖率, 且呈时间依赖性. 曾勇等[18]研究发现大黄素与GEM联用可显著抑制BxPC-3细胞增殖率, 其抑制作用强于任一单用药物. 本研究发现DFO及GEM均可明显抑制PANC-1细胞增殖率, 二者联用可进一步抑制PANC-1细胞的增殖, 两者具有协同作用. 对于GEM耐药PANC-1细胞, 即使将GEM浓度提高至100 μmol/L对其增殖率亦无明显影响, 但DFO可显著抑制其增殖. 因此, 我们认为DFO可作为胰腺癌综合治疗的一种新的选择, 特别是GEM耐药胰腺癌患者.
总之, 本研究结果显示铁鳌合剂DFO对胰腺癌PANC-1细胞株的增殖有明显的抑制作用, 而且与GEM具有协同作用; 对于GEM耐药PANC-1细胞DFO亦可明显抑制其增殖, 虽然其确切机制尚未明了, 铁鳌合剂仍有望作为胰腺癌综合治疗的一种新的选择, 特别是GEM耐药的患者, 为胰腺癌患者带来新的希望.
胰腺癌是一种恶性程度高、易早期转移、预后极差的消化系肿瘤, 其早期诊断十分困难, 多数患者在确诊时因已发生肿瘤局部浸润和/或远处转移而失去最佳治疗时机, 且胰腺癌对传统的放疗和化疗并不敏感, 即使采用综合治疗其5年生存率不到5%.
杜奕奇, 副教授, 中国人民解放军第二军医大学长海医院
铁超载可加快肿瘤细胞的生长速度, 铁鳌合剂铁剥夺后可抑制肺癌、肝癌细胞的生长.
目前铁螯合剂对胰腺癌细胞的增殖作用国内外研究不多, 此研究给胰腺癌患者带来希望.
本研究给胰腺癌患者带来希望, 也为进一步研究胰腺癌的发病机制与铁鳌合剂去铁胺抗肿瘤机制提供实验基础.
本文有一定创新性, 目前未见铁螯合剂对胰腺癌作用方面的研究, 仅在其他肿瘤中有报道, 研究结果数据较为可靠, 讨论分析恰当, 本文的结果对于阐明肿瘤细胞的耗铁机制有一定参考价值.
| 1. | Chua AC, Graham RM, Trinder D, Olynyk JK. The regulation of cellular iron metabolism. Crit Rev Clin Lab Sci. 2007;44:413-459. [PubMed] [DOI] |
| 2. | Zhang AS, Enns CA. Molecular mechanisms of normal iron homeostasis. Hematology Am Soc Hematol Educ Program. 2009;207-214. [PubMed] [DOI] |
| 3. | Muñoz M, Villar I, García-Erce JA. An update on iron physiology. World J Gastroenterol. 2009;15:4617-4626. [PubMed] [DOI] |
| 4. | Le NT, Richardson DR. The role of iron in cell cycle progression and the proliferation of neoplastic cells. Biochim Biophys Acta. 2002;1603:31-46. [PubMed] |
| 5. | Yu Y, Kovacevic Z, Richardson DR. Tuning cell cycle regulation with an iron key. Cell Cycle. 2007;6:1982-1994. [PubMed] |
| 6. | Bohnsack BL, Hirschi KK. Nutrient regulation of cell cycle progression. Annu Rev Nutr. 2004;24:433-453. [PubMed] [DOI] |
| 7. | Huang X. Iron overload and its association with cancer risk in humans: evidence for iron as a carcinogenic metal. Mutat Res. 2003;533:153-171. [PubMed] [DOI] |
| 8. | Toyokuni S. Role of iron in carcinogenesis: cancer as a ferrotoxic disease. Cancer Sci. 2009;100:9-16. [PubMed] [DOI] |
| 9. | Yu Y, Gutierrez E, Kovacevic Z, Saletta F, Obeidy P, Suryo Rahmanto Y, Richardson DR. Iron chelators for the treatment of cancer. Curr Med Chem. 2012;19:2689-2702. [PubMed] [DOI] |
| 10. | Hidalgo M. Pancreatic cancer. N Engl J Med. 2010;362:1605-1617. [PubMed] [DOI] |
| 11. | Shah AN, Summy JM, Zhang J, Park SI, Parikh NU, Gallick GE. Development and characterization of gemcitabine-resistant pancreatic tumor cells. Ann Surg Oncol. 2007;14:3629-3637. [PubMed] [DOI] |
| 12. | Dayani PN, Bishop MC, Black K, Zeltzer PM. Desferoxamine (DFO)--mediated iron chelation: rationale for a novel approach to therapy for brain cancer. J Neurooncol. 2004;67:367-377. [PubMed] [DOI] |
| 13. | Shao J, Zhou B, Chu B, Yen Y. Ribonucleotide reductase inhibitors and future drug design. Curr Cancer Drug Targets. 2006;6:409-431. [PubMed] |
| 14. | Gao J, Richardson DR. The potential of iron chelators of the pyridoxal isonicotinoyl hydrazone class as effective antiproliferative agents, IV: The mechanisms involved in inhibiting cell-cycle progression. Blood. 2001;98:842-850. [PubMed] |
| 16. | Saletta F, Suryo Rahmanto Y, Noulsri E, Richardson DR. Iron chelator-mediated alterations in gene expression: identification of novel iron-regulated molecules that are molecular targets of hypoxia-inducible factor-1 alpha and p53. Mol Pharmacol. 2010;77:443-458. [PubMed] [DOI] |
编辑: 田滢 电编:闫晋利