修回日期: 2012-01-19
接受日期: 2012-02-27
在线出版日期: 2012-03-28
目的: 研究乙型肝炎病毒X(hepatitis B virus X, HBV X)基因在乙型肝炎病毒致肝纤维化中的作用.
方法: 构建HBV X基因真核表达载体pHBV-X-IRES2-EGFP, 将其转染人肝细胞HL-7702后分成2组, 一组经G418筛选出稳定表达HBV X基因的肝细胞株(L02/x), 另一组予瞬时转染48 h(L02/48x). Real-time PCR、Western blot鉴定2组细胞HBV X基因的表达. 与转染空质粒和未转染的肝细胞组对照, 将L02/x和L02/48x细胞分别与肝星状细胞(hepatic stellate cells, HSCs)共培养36 h, 并检测各组HSCs增殖和迁移情况.
结果: Real-time PCR和Western blot实验显示, 转染pHBV-X-IRES2-EGFP载体的L02/x和L02/48x细胞均有HBV X基因的表达. 与转染空质粒和未转染的肝细胞组对照, 与L02/x和L02/48x细胞共培养的HSCs的增殖和迁移均显著增多.
结论: HBV X基因在肝细胞中的表达可以促进HSCs发生增殖和迁移, 从而在乙型肝炎病毒致肝纤维化过程中起重要作用.
引文著录: 陈红英, 王小众, 陈治新. 肝细胞中HBV X基因的表达及其共培养的肝星状细胞的增殖和迁移. 世界华人消化杂志 2012; 20(9): 721-728
Revised: January 19, 2012
Accepted: February 27, 2012
Published online: March 28, 2012
AIM: To determine whether the hepatitis B virus X (HBV X) gene is involved in the pathogenesis of hepatitis B-related cirrhosis.
METHODS: A eukaryotic expression vector containing the HBV X gene (pHBV-X-IRES2-EGFP) was constructed and transfected into HL-7702 cells. The transfected cells were divided into two groups. One group was selected with G418 and named L02/x, which could express the HBV X gene stably, and another group was transfected with pHBV-X-IRES2-EGFP for 48 h and named L02/48x. The expression of HBV X was detected by real-time PCR and Western blot. L02/x and L02/48x cells were then co-cultured with hepatic stellate cells (HSCs) for 36 h, and the proliferation and migration of HSCs were detected.
RESULTS: Real-time PCR and Western blot analyses showed that L02/x and L02/48x cells could express HBV X. Compared to HSCs co-cultured with HL-7702 cells transfected with empty vector and non-transfected cells, the proliferation and migration of HSCs co-cultured with L02/x or L02/48x cells significantly increased.
CONCLUSION: The expression of the HBV X gene in HL-7702 cells could promote the proliferation and migration of HSCs and may play an important role in the pathogenesis of hepatitis B virus-induced liver fibrosis.
- Citation: Chen HY, Wang XZ, Chen ZX. Expression of the hepatitis B virus X gene in liver cells promotes the proliferation and migration of co-cultured hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2012; 20(9): 721-728
- URL: https://www.wjgnet.com/1009-3079/full/v20/i9/721.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i9.721
慢性乙型肝炎病毒(hepatitis B virus, HBV)感染可以导致慢性肝炎、肝纤维化和肝细胞癌的发生, 每年因乙型肝炎死亡者约为75万例. HBV基因组是一个不全双链的环状DNA分子, 其长链含有4个开放读码框架(open reading frame, ORF), 分别为编码前S1蛋白, 前S2蛋白及S蛋白的S基因, 编码前C蛋白与C蛋白的C基因, 编码DNA聚合酶蛋白的P基因, 以及编码X蛋白的X基因. X基因是HBV DNA中最小的一个ORF, 编码区位于1374-1818核苷酸之间, 其编码的HBx蛋白由154个氨基酸组成, 分子量为17 kDa. 已有大量的研究显示, HBx是一个多功能调节因子, 他可以通过调节转录、影响细胞增殖[1,2]与凋亡[3-6]、干扰细胞周期[7-9]及各种信号传导途径[10-15]、影响细胞修复[16-18]等从而在肝细胞癌发生发展中起重要的作用[19-22]. HBV是肝纤维化形成的重要因素之一, Liu等[23]研究发现HBV可以通过调节Ⅰ型胶原纤维增殖和表达而影响肝星状细胞(hepatic stellate cells, HSCs)的增殖. Martín-Vílchez等[24]进一步研究证实HBx能激活HSCs而促进肝纤维化. 为进一步探讨HBV X基因在肝纤维化形成和发展中的作用, 本文通过构建HBV X基因真核表达载体, 使其在HL-7702人肝细胞中表达, 观察与肝细胞共培养的肝星状细胞增殖和迁移的情况, 揭示HBx与肝纤维化的关系.
用于获取目的基因HBV X的质粒pUCmT-x为本研究所保存, 真核荧光表达载体pIRES2-EGFP购自Clontech公司, 两者双酶切后连接构建表达HBV X基因的重组质粒pHBV-X-IRES2-EGFP. HL-7702肝细胞为本研究室保存, 质粒转染试剂盒lipo2000购自Invitrogen公司, 转染后经G418(购自sigma公司)筛选构建稳定表达X基因的肝细胞株. β-actin蛋白抗体(Mouse mAb to Beta-actin)购自abmart公司, HBV X蛋白抗体[Hepatitis B Virus X antigen antibody(X36C)]购自Abcam公司(ab2741), 经Realtime-PCR、Western blot进一步鉴定X基因的表达. 采用购自corning公司的Transwell非接触式共培养小室, 将购自中国科学院上海细胞库HSCs细胞与肝细胞共培养, 采用DMEM+10%FBS+1%P/S+1%Glutamax培养基(培养基成分购自Gibco公司), 50 mL/LCO2、950 mL/L湿润空气、37 ℃培养. 采用碧云天公司的CCK-8检测试剂盒、杰美公司的结晶紫试剂盒、Thermo酶标仪(MuLTiSKAN MK3)检测HSCs的增殖与迁移. 实验过程中所用的各种酶, 包括内切酶、连接酶、逆转录酶等购自上海生物工程有限公司.
1.2.1 构建HBV X基因真核表达载体: 用PCR法从本研究所保存的pUCmT-x质粒[25]中扩增出HBV X基因片段, 在目的基因的5'端添加XhoⅠ酶切位点, 3'端添加EcoRⅠ酶切位点. 引物序列如下: 上游为5'-TAATctcgagATGGCTGCTAGGCTGTGCT-3'和下游5'-GTCAgaattcTTAATGGTG ATGGTGATGATGGGCAGAGGTGAAAAAGTTGC-3'. PCR条件为94 ℃预变性3 min; 94 ℃变性30 s, 57 ℃退火30 s, 68 ℃延伸30 s, 共35个循环. 将目的基因PCR产物和目的载体pIRES2-EGFP用XhoⅠ和EcoRⅠ内切酶分别进行酶切, T4 DNA连接酶连接上述酶切产物, 构建HBV X基因真核表达载体pHBV-X-IRES2-EGFP. 经酶切及直接序列测定以确认重组质粒的成功构建.
1.2.2 HBV X基因转染肝细胞: 将肝细胞株HL-7702培养于含DMEM+10%FBS中. 选择对数生长期的肝细胞HL-7702, 采用脂质体转染的方法(按脂质体转染试剂盒lipo2000的说明书操作), 将质粒pHBV-X-IRES2-EGFP和pIRES2-EGFP分别导入肝细胞HL-7702中(6孔板每孔中加入2 μg DNA). 转染48 h后, 荧光显微镜观察细胞的转染效率. 一部分肝细胞转染48 h后经G418 800 mg/L选择培养2 wk后, 挑取单克隆予进一步扩增以构建稳定表达HBV X基因的肝细胞株并命名为L02/x, 转染空质粒组命名为L02/ctr. 另一部分肝细胞于重组质粒瞬时转染48 h后作为瞬时转染组直接进入共培养实验, 此细胞分别命名为L02/48x, 其相应的转染空质粒对照组命名为L02/48ctr.
1.2.3 Real-time PCR鉴定X基因的表达: (1)抽提5组细胞(L02/x、L02/48x、L02/ctr、L02/48ctr和HL-7702空白细胞)RNA并进行反转录, 检测RNA质量、浓度和纯度; (2)依据目的基因及内参基因ACTB(Beta Actin)设计并合成荧光定量PCR引物, 引物序列见表1. SYBR Green法荧光定量PCR分析各基因的表达, PCR条件为: 95 ℃ 2 min; (95 ℃ 20 s, 57 ℃ 15 s, 72 ℃ 20 s)×40 cycles, qPCR反应体系如下: 2X qPCR buffer mix 10 μL, Primer 1 μL, cDNA 1 μL, ddH2O 8 μL; PCR结束后, 进行熔解曲线实验, 升温温度从60 ℃到95 ℃; (3)用△△Ct法进行各基因表达的相对定量.
| 引物名称 | 引物序列 | 产物(bp) |
| HBV X-F1 | 5'-CCCGTCTGTGCCTTCTCATC-3' | 105 |
| HBV X-R1 | 5'-ATCTCCTCCCCCAACTCCTC-3' | |
| HBV X-F2 | 5'-CTAGGCTGTGCTGCCAACTG-3' | 182 |
| HBV X-R2 | 5'-AGAAGGCACAGACGGGGAGT-3' | |
| hACTB-F | 5'-TCCTTCCTGGGCATGGAGT-3' | 208 |
| hACTB-R | 5'-CAGGAGGAGCAATGATCTTGAT-3' |
1.2.4 Western blot实验鉴定X基因的表达: 取稳定和瞬时转染X基因的肝细胞株L02/x和L02/48x, 其相应的转染空质粒细胞株L02/ctr和L02/48ctr, 以及相应的空白细胞对照组L02/NC和L02/48NC. Loading Buffer裂解此6组细胞并抽提蛋白, BSA法进行蛋白定量后行SDS-PAGE电泳, 恒压80 V, 30 min之后恒压120 V, 75-90 min, 恒压20 V条件下半干电转1 h, 将蛋白转移到PVDF膜上. 用封闭液(含5%脱脂奶粉的PBST溶液)室温封闭膜1 h; 用新配制的封闭液稀释一抗(HBV X蛋白抗体稀释比1:1 000; actin蛋白抗体稀释比1:4 000); 4 ℃, 一抗孵育过夜; 用PBST洗膜30 min后室温下二抗孵育膜1 h, 再次洗膜后ECL显影.
1.2.5 肝细胞与肝星状细胞共培养: 将上述6组肝细胞及HSCs培养于DMEM+10%FBS+1%P/S+1%Glutamax培养液中. 采用Transwell共培养体系, 取HSCs悬液(细胞数约为6×105)接种到PBS浸润的上层小室中; 用镊子将小室仔细放于培养肝细胞的孔板中, 避免底部产生气泡, 放回培养箱中于50 mL/LCO2、950 mL/L湿润空气、37 ℃培养. 共培养36 h后进行下述实验.
1.2.6 CCK-8检测HSCs增殖: 在共培养36 h后, 每孔加入10 μL CCK-8, 混匀后培养箱中孵育3 h, 测定450 nm处的吸光度(A)值. 酶标仪读取待测样品和空白对照在450 nm处的A值, 将各待测样本的A值记为测量值, 空白对照的A值记为空白值, 则终值 = 测量值-空白值.
1.2.7 检测HSCs的迁移: 共培养36 h后取出小室, 去除小室中的培养基, 用湿润的棉签仔细擦掉小室上层的细胞; 在室温下, 用PBS润洗小室上表层, 将小室转移到新的6孔板中, 用4%的多聚甲醛室温固定细胞15 min, 用结晶紫染色试剂盒对细胞进行染色(按试剂盒说明书进行操作), 后用酶标仪检测570 nm处的A值, 然后计算细胞迁移.
统计学处理 重复上述实验3次, 将终值绘制柱状图, 结果用mean±SD表示, 用SPSS17软件进行单因素方差分析, 以P<0.05为有统计学差异.
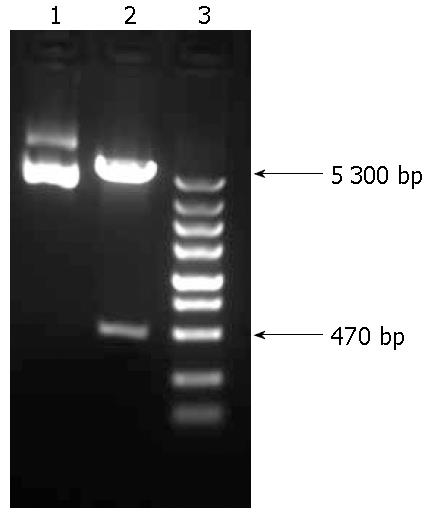
重组克隆的酶切鉴定如图1所示, pHBV-X -IRES2-EGFP重组载体经酶切电泳后可见HBV X基因目的条带(约470 bp). NCBI网上比对测序序列, 显示与HBV X基因99%相似度, 结果证明已成功构建HBV X重组质粒(图2).
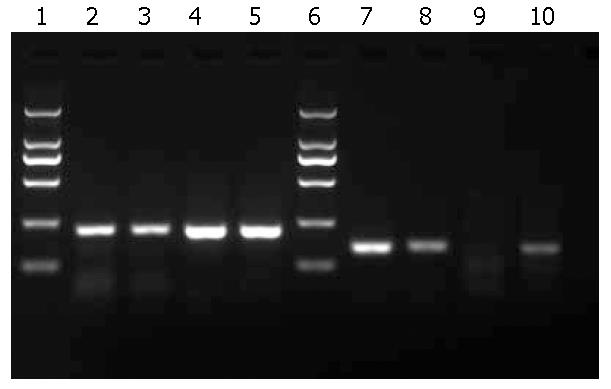
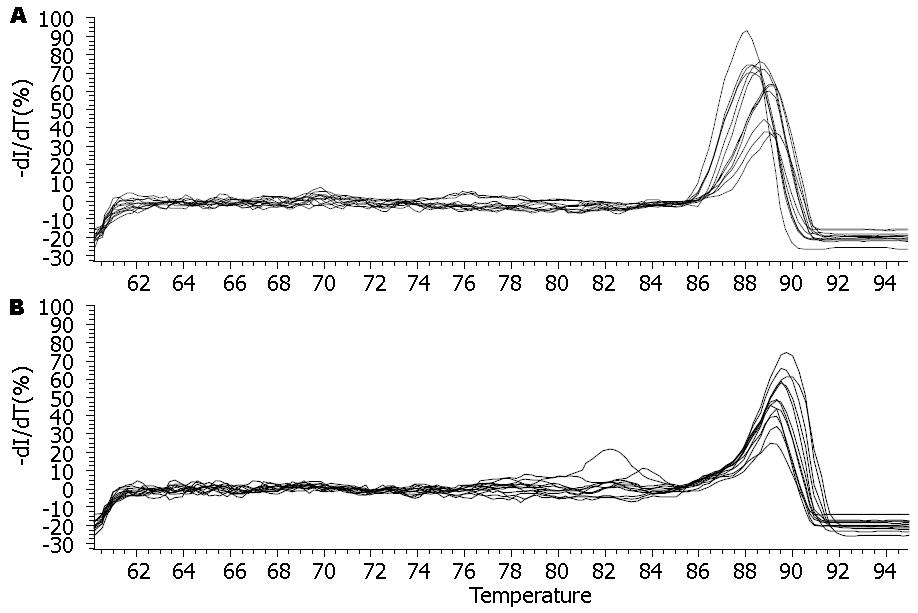
重组质粒、L02/x、L02/48x和空白对照组HL-7702细胞均有内参基因的表达, 前3组亦可见HBV X mRNA表达, 而空白对照组HL-7702细胞则未见目的基因表达, 即稳定和瞬时HBV X基因的肝细胞中有HBV X mRNA表达(图3). △△Ct法对各组目的基因表达相对定量, 结果显示在稳定转染株中, L02/x的HBV X mRNA表达量为对照组L02/ctr的4倍, L02/48x的HBV X mRNA表达量为其对照 L02/48ctr的54 855倍, 进一步证实稳定和瞬时HBV X基因的肝细胞中有HBV X mRNA表达(表2, 图4, 图5).
| 样品 | 基因Actin | 基因HBV X | ΔCt | -ΔΔCt | 2-ΔΔCt | ||||||
| Ct1 | Ct2 | Ct3 | Ct-Ave | Ct1 | Ct2 | Ct3 | Ct-Ave | ||||
| L02/48x | 23.71 | 23.58 | 23.53 | 23.61 | 13.18 | 13.37 | 13.60 | 13.38 | -10.22 | -15.74 | 54854.92 |
| L02/48ctr | 21.79 | 21.81 | 21.73 | 21.78 | 27.02 | 27.62 | 27.25 | 27.30 | 5.52 | 0 | 1 |
| L02/x | 17.04 | 16.80 | 17.15 | 17.00 | 29.05 | 28.89 | 28.54 | 28.80 | 11.83 | -2.01 | 4.03 |
| L02/ctr | 16.97 | 16.74 | 16.70 | 16.80 | 30.86 | 30.51 | 30.43 | 30.60 | 13.84 | 0.00 | 1.00 |
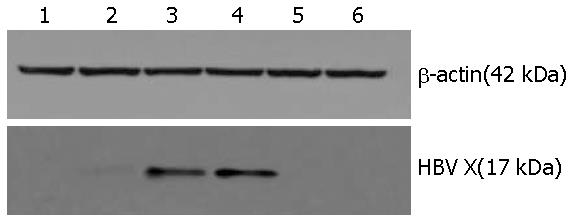
稳定和瞬时转染HBV X基因的肝细胞, 即L02/x和L02/48x, 均可见HBV X蛋白(17 kDa)的表达, 而转染空质粒组L02/ctr和L02/48ctr, 以及相应的空白细胞对照组L02/NC和L02/48NC均未有该蛋白的表达, 即成功构建了稳定表达X基因的肝细胞株, 同时验证了瞬时转染X基因的肝细胞确有目的基因的表达(图6).
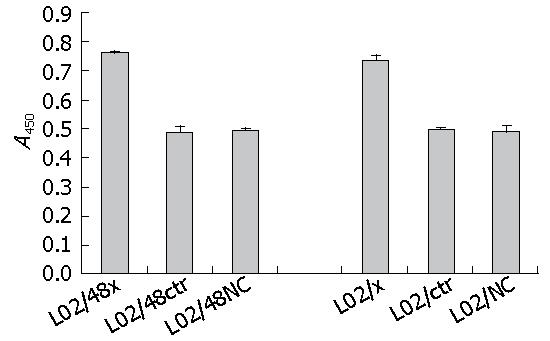
运用SPSS17软件进行统计分析, 结果显示与稳定和瞬时HBV X基因的肝细胞共培养的HSCs增殖数值显著高于相应的转染空质粒组和空白组, 差别有显著意义(表3, 图7, P<0.05).
| 第1次 | 第2次 | 第3次 | mean±SD | |
| L02/48x | 0.763 | 0.758 | 0.764 | 0.7617±0.0032 |
| L02/48ctr | 0.487 | 0.470 | 0.508 | 0.4883±0.0190 |
| L02/48NC | 0.497 | 0.503 | 0.492 | 0.4973±0.0055 |
| L02/x | 0.753 | 0.735 | 0.725 | 0.7377±0.0142 |
| L02/ctr | 0.496 | 0.506 | 0.489 | 0.4970±0.0085 |
| L02/NC | 0.486 | 0.512 | 0.476 | 0.4913±0.0186 |
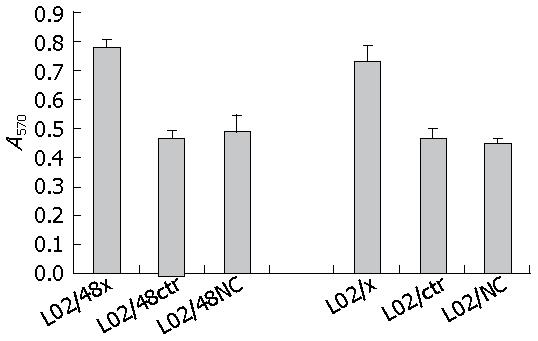
结晶紫染色后, 运用SPSS17软件进行统计分析, 结果显示与稳定和瞬时HBV X基因的肝细胞共培养的HSCs迁移数值显著高于相应的转染空质粒组和空白组, 差别有显著意义(表4, 图8, P<0.05).
| 第1次 | 第2次 | 第3次 | mean±SD | |
| L02/48x | 0.424 | 0.427 | 0.448 | 0.4330±0.0131 |
| L02/48ctr | 0.244 | 0.259 | 0.272 | 0.2583±0.0140 |
| L02/48NC | 0.279 | 0.235 | 0.297 | 0.2703±0.0319 |
| L02/x | 0.439 | 0.389 | 0.395 | 0.4077±0.0273 |
| L02/ctr | 0.256 | 0.247 | 0.278 | 0.2603±0.0159 |
| L02/NC | 0.246 | 0.247 | 0.257 | 0.2500±0.0061 |
我国属于HBV感染的高发病区, 每年有11-13万人死于HBV感染所致的肝硬化和肝细胞癌. 1989年Shirakata等[26]将HBV X基因转染小鼠成纤维细胞, 并将其移植裸鼠发现该基因可诱发肿瘤形成, 从而揭示了HBV X基因的致癌作用. 近30年来, 大量的分子生物学及动物实验已证实HBx蛋白可以通过影响PI-3激酶、p38和JNK等信号通路[5,27]、干扰细胞修复[17,18]等机制使细胞的增殖和凋亡失衡而致肝细胞癌的发生. 然而HBV X基因与肝纤维化的相关研究却少有报道, 二者关系未完全明确.
目前认为HSCs活化是肝纤维化发生、发展的关键环节, 各种致纤维化因子激活HSCs[28], 使其活化、增殖, 转化为肌成纤维细胞样细胞, 合成多种细胞因子、大量合成细胞外基质, 尤其是Ⅰ、Ⅲ型胶原等, 并获得细胞运动和收缩功能, 向损伤部位迁移聚集, 直接参与损伤修复, 加速胶原沉积, 促进纤维化进程[29]. 近年来仅有少数研究报道HBx有可能通过各种细胞因子旁分泌激活HSCs并促进其增殖, 从而参与肝纤维化进程[30]. 为进一步明确HBV X基因与肝纤维化的关系, 本实验通过构建X基因真核表达载体, 以此为平台构建稳定和瞬时转染该基因的HL-7702肝细胞, 检测与其共培养的HSCs的增殖与迁移情况, 最后统计学分析HBV X基因对HSCs增殖和迁移的影响, 从而确立HBV X基因在肝纤维化中的作用.
在实验中, 我们首先构建了HBV X基因的荧光真核表达载体pHBV-X-IRES2-EGFP, 经酶切及直接测序证实重组载体的成功构建. 其次是肝细胞的选择, 目前国内外大多数肝细胞研究选用HepG2为实验细胞, 但是此细胞具有部分肝癌细胞的特性, 不宜用于HBV致肝纤维化的研究. 为了更好模拟体内环境, 本实验选用具有正常肝细胞特性的HL-7702肝细胞, 通过脂质体转染技术, 获得稳定和瞬时转染HBV X基因的肝细胞, PCR和蛋白印迹实验均证实两组细胞中X基因的mRNA和蛋白的表达. 最后是肝细胞与HSCs的共培养实验. 既往研究已发现瞬时转染X基因24 h即有表达, 并逐渐上升, 于72 h达到最高峰, 之后回落[9]. 以此为依据, 本实验选取瞬时转染48 h和稳定转染的肝细胞与HSCs于Transwell非接触培养体系中共培养36 h, 之后检测HSCs的增殖与迁移情况, 结果显示, 与转染空质粒和未转染肝细胞共培养的HSCs做对照, 与转染X基因组共培养的HSCs的增殖和迁移数值显著升高(P<0.05).
实验结果说明HBV X基因在肝细胞中的表达可促进与其共培养的HSCs发生增殖与迁移. 如上所述, HSCs的活化与增殖是肝纤维化进程的一重要环节, HBx对HSCs的这一作用揭示了其在肝纤维化发生与发展中的作用, 即HBV X基因的表达能促使HSCs增殖和迁移, 从而促进肝纤维化进程.
感谢唐南洪、李秀金及王晓茜同志在本试验中给予的大力帮助.
慢性乙型肝炎病毒(hepatitis B virus, HBV)感染可以导致慢性肝炎、肝纤维化和肝细胞癌的发生, 每年因乙型肝炎死亡者约为75万例.
杨江华, 副教授, 皖南医学院弋矶山医院感染科
目前认为HSCs活化是肝纤维化发生、发展的关键环节, 各种致纤维化因子激活HSCs, 使其活化、增殖, 转化为肌成纤维细胞样细胞, 合成多种细胞因子、大量合成细胞外基质, 直接参与损伤修复, 加速胶原沉积, 促进纤维化进程.
研究显示, HBx是一个多功能调节因子, 他可以通过调节转录影响细胞增殖与凋亡, 干扰细胞周期及各种信号传导途径, 影响细胞修复等, 从而在肝细胞癌发生发展中起重要的作用.
本文有一定的科学性、创新性和可读性, 为HBV X基因与肝纤维化的临床研究提供了较为可靠的参考依据.
| 1. | Gearhart TL, Bouchard MJ. The hepatitis B virus X protein modulates hepatocyte proliferation pathways to stimulate viral replication. J Virol. 2010;84:2675-2686. [PubMed] [DOI] |
| 2. | Mao Y, Da L, Tang H, Yang J, Lei Y, Tiollais P, Li T, Zhao M. Hepatitis B virus X protein reduces starvation-induced cell death through activation of autophagy and inhibition of mitochondrial apoptotic pathway. Biochem Biophys Res Commun. 2011;415:68-74. [PubMed] [DOI] |
| 3. | Clippinger AJ, Gearhart TL, Bouchard MJ. Hepatitis B virus X protein modulates apoptosis in primary rat hepatocytes by regulating both NF-kappaB and the mitochondrial permeability transition pore. J Virol. 2009;83:4718-4731. [PubMed] [DOI] |
| 4. | Kuo TC, Chao CC. Hepatitis B virus X protein prevents apoptosis of hepatocellular carcinoma cells by upregulating SATB1 and HURP expression. Biochem Pharmacol. 2010;80:1093-1102. [PubMed] [DOI] |
| 5. | Liu Q, Chen J, Liu L, Zhang J, Wang D, Ma L, He Y, Liu Y, Liu Z, Wu J. The X protein of hepatitis B virus inhibits apoptosis in hepatoma cells through enhancing the methionine adenosyltransferase 2A gene expression and reducing S-adenosylmethionine production. J Biol Chem. 2011;286:17168-17180. [PubMed] [DOI] |
| 6. | Knoll S, Fürst K, Thomas S, Villanueva Baselga S, Stoll A, Schaefer S, Pützer BM. Dissection of cell context-dependent interactions between HBx and p53 family members in regulation of apoptosis: a role for HBV-induced HCC. Cell Cycle. 2011;10:3554-3565. [PubMed] [DOI] |
| 7. | Gearhart TL, Bouchard MJ. The hepatitis B virus HBx protein modulates cell cycle regulatory proteins in cultured primary human hepatocytes. Virus Res. 2011;155:363-367. [PubMed] [DOI] |
| 8. | Martin-Lluesma S, Schaeffer C, Robert EI, van Breugel PC, Leupin O, Hantz O, Strubin M. Hepatitis B virus X protein affects S phase progression leading to chromosome segregation defects by binding to damaged DNA binding protein 1. Hepatology. 2008;48:1467-1476. [PubMed] [DOI] |
| 9. | Chen HY, Tang NH, Li XJ, Zhang SJ, Chen ZX, Wang XZ. Transfection and expression of hepatitis B virus x gene and its effect on apoptosis in HL-7702 cells. World J Gastroenterol. 2004;10:959-964. [PubMed] |
| 10. | Yang WJ, Chang CJ, Yeh SH, Lin WH, Wang SH, Tsai TF, Chen DS, Chen PJ. Hepatitis B virus X protein enhances the transcriptional activity of the androgen receptor through c-Src and glycogen synthase kinase-3beta kinase pathways. Hepatology. 2009;49:1515-1524. [PubMed] [DOI] |
| 11. | Kim K, Kim KH, Cheong J. Hepatitis B virus X protein impairs hepatic insulin signaling through degradation of IRS1 and induction of SOCS3. PLoS One. 2010;5:e8649. [PubMed] [DOI] |
| 12. | Wei C, Ni C, Song T, Liu Y, Yang X, Zheng Z, Jia Y, Yuan Y, Guan K, Xu Y. The hepatitis B virus X protein disrupts innate immunity by downregulating mitochondrial antiviral signaling protein. J Immunol. 2010;185:1158-1168. [PubMed] [DOI] |
| 13. | Hsieh A, Kim HS, Lim SO, Yu DY, Jung G. Hepatitis B viral X protein interacts with tumor suppressor adenomatous polyposis coli to activate Wnt/β-catenin signaling. Cancer Lett. 2011;300:162-172. [PubMed] [DOI] |
| 14. | Chen L, Hu L, Li L, Liu Y, Tu QQ, Chang YX, Yan HX, Wu MC, Wang HY. Dysregulation of β-catenin by hepatitis B virus X protein in HBV-infected human hepatocellular carcinomas. Front Med China. 2010;4:399-411. [PubMed] [DOI] |
| 15. | Ha HL, Yu DY. HBx-induced reactive oxygen species activates hepatocellular carcinogenesis via dysregulation of PTEN/Akt pathway. World J Gastroenterol. 2010;16:4932-4937. [PubMed] [DOI] |
| 16. | Matsuda Y, Ichida T. Impact of hepatitis B virus X protein on the DNA damage response during hepatocarcinogenesis. Med Mol Morphol. 2009;42:138-142. [PubMed] [DOI] |
| 17. | Qadri I, Fatima K, AbdeL-Hafiz H. Hepatitis B virus X protein impedes the DNA repair via its association with transcription factor, TFIIH. BMC Microbiol. 2011;11:48. [PubMed] [DOI] |
| 18. | Chen HY, Tang NH, Lin N, Chen ZX, Wang XZ. Hepatitis B virus X protein induces apoptosis and cell cycle deregulation through interfering with DNA repair and checkpoint responses. Hepatol Res. 2008;38:174-182. [PubMed] |
| 19. | Koike K. Hepatitis B virus X gene is implicated in liver carcinogenesis. Cancer Lett. 2009;286:60-68. [PubMed] [DOI] |
| 20. | Xiang WQ, Liu W. [Role of HBx in hepatocellular carcinoma development]. Zhejiang Daxue Xuebao Yixueban. 2010;39:333-338. [PubMed] |
| 21. | Pár A. [Hepatitis B virus (HBV) infection and hepatocarcinogenesis]. Orv Hetil. 2010;151:1045-1053. [PubMed] [DOI] |
| 22. | Kew MC. Hepatitis B virus x protein in the pathogenesis of hepatitis B virus-induced hepatocellular carcinoma. J Gastroenterol Hepatol. 2011;26 Suppl 1:144-152. [PubMed] [DOI] |
| 23. | Liu X, Zhu ST, You H, Cong M, Liu TH, Wang BE, Jia JD. Hepatitis B virus infects hepatic stellate cells and affects their proliferation and expression of collagen type I. Chin Med J (Engl). 2009;122:1455-1461. [PubMed] |
| 24. | Martín-Vílchez S, Sanz-Cameno P, Rodríguez-Muñoz Y, Majano PL, Molina-Jiménez F, López-Cabrera M, Moreno-Otero R, Lara-Pezzi E. The hepatitis B virus X protein induces paracrine activation of human hepatic stellate cells. Hepatology. 2008;47:1872-1883. [PubMed] [DOI] |
| 26. | Shirakata Y, Kawada M, Fujiki Y, Sano H, Oda M, Yaginuma K, Kobayashi M, Koike K. The X gene of hepatitis B virus induced growth stimulation and tumorigenic transformation of mouse NIH3T3 cells. Jpn J Cancer Res. 1989;80:617-621. [PubMed] [DOI] |
| 27. | Shukla R, Yue J, Siouda M, Gheit T, Hantz O, Merle P, Zoulim F, Krutovskikh V, Tommasino M, Sylla BS. Proinflammatory cytokine TNF-α increases the stability of hepatitis B virus X protein through NF-κB signaling. Carcinogenesis. 2011;32:978-985. [PubMed] [DOI] |
| 28. | Shimada H, Staten NR, Rajagopalan LE. TGF-β1 mediated activation of Rho kinase induces TGF-β2 and endothelin-1 expression in human hepatic stellate cells. J Hepatol. 2011;54:521-528. [PubMed] [DOI] |
| 29. | Wirkowska A, Paczek L. [Liver fibrosis and cirrhosis--causes. Part I]. Przegl Lek. 2011;68:222-227. [PubMed] |
| 30. | Guo GH, Tan DM, Zhu PA, Liu F. Hepatitis B virus X protein promotes proliferation and upregulates TGF-beta1 and CTGF in human hepatic stellate cell line, LX-2. Hepatobiliary Pancreat Dis Int. 2009;8:59-64. [PubMed] |
编辑: 张珊珊 电编: 闫晋利