修回日期: 2012-09-05
接受日期: 2012-09-26
在线出版日期: 2012-10-18
目的: 研究siRNA沉默糖体蛋白L31(ribosomal protein L31, RPL31)对人胰腺癌BxPC-3细胞裸鼠皮下移植瘤的抑制作用, 探讨RPL31基因在胰腺癌中可能的作用机制.
方法: 设计合成靶向人RPL31基因的siRNA及阴性对照siRNA; 建立人胰腺癌BxPC-3细胞的Balb/c裸鼠皮下移植瘤模型, 按照移植瘤体积随机化分为3组: 溶剂对照组、阴性对照组及RPL31-siRNA干预组; 使用RNAi-Mate转染试剂将RPL31-siRNA进行移植瘤瘤内注射, 观察各组裸鼠体内瘤体生长速度, 绘制肿瘤生长曲线; 采用实时定量PCR及Western blot的方法检测移植瘤组织RPL31基因的表达; 免疫组织化学法(immunohistochemistry, IHC)检测裸鼠皮下移植瘤Ki-67及CD31的表达; 原位末端标记技术(TUNEL)检测移植瘤组织的细胞凋亡.
结果: 与溶剂对照组和阴性对照组相比, RPL31-siRNA注射组裸鼠皮下移植瘤生长缓慢, 移植瘤体积明显缩小, 差异具有统计学意义(P<0.05); 移植瘤组织中RPL31基因的mRNA水平和蛋白水平表达下调; 另外, RPL31-siRNA注射组裸鼠移植瘤中Ki-67表达下调(55.78%±4.63%、51.37%±5.05% vs 11.08%±1.31%), CD31的表达下调(56.53%±6.03%、44.84%±5.24% vs9.67%±1.39%); RPL31-siRNA注射组裸鼠移植瘤细胞凋亡增加(2.92%±0.54%、3.85%±0.87% vs 39.58%±4.02%).
结论: RPL31-siRNA可以下调胰腺癌BxPC-3细胞裸鼠皮下移植瘤中RPL31基因的表达, 抑制移植瘤的生长, 并且还可以抑制移植瘤中Ki-67及CD31的表达, 诱导移植瘤细胞的凋亡. 以RPL31为靶点的基因治疗有潜在临床应用前景.
引文著录: 李朝东, 刘春亮, 夏玉叶, 戈梅, 陈代杰. RPL31-siRNA对人胰腺癌BxPC-3细胞裸鼠皮下移植瘤生长的抑制作用. 世界华人消化杂志 2012; 20(29): 2782-2788
Revised: September 5, 2012
Accepted: September 26, 2012
Published online: October 18, 2012
AIM: To investigate the effect of siRNA-mediated RPL31 gene silencing on the growth of xenograft tumors derived from human pancreatic cancer cell line BxPC-3 in nude mice, and to explore the potential role of the RPL31 gene in pancreatic cancer.
METHODS: The siRNA sequence targeting to human RPL31 gene was designed. Human pancreatic cancer BxPC-3 cells were subcutaneously inoculated into Balb/c nude mice to develop a transplantation tumor model of human pancreatic cancer. According to the tumor volume, nude mice were randomly divided into three groups: vehicle control group, negative control group and RPL31-siRNA injection group. Mice of the RPL31-siRNA injection group were intratumorally injected with RPL31-siRNA using RNAi-Mate. Tumor volumes were calculated daily. On the 16th day after the first intratumoral injection, all the mice were sacrificed and the tumors were taken out to undergo real-time quantitative PCR (qRT-PCR) and Western blot analyses to detect RPL31 expression. The expression of Ki-67 and CD31 proteins in xenograft tissue was detected by immunohistochemistry. Cell apoptosis in xenograft tumors was detected by TUNEL assay.
RESULTS: Compared with the vehicle control group and negative control group, mice in the RPL31-siRNA injection group exhibited slower tumor growth, significantly smaller tumor volume (P < 0.05), and lower RPL31 expression level (P < 0.05). Immunohistochemistry results showed that the proportions of Ki-67- and CD31-positive cells decreased in xenograft tissue injected with RPL31-siRNA (55.78% ± 4.63%, 51.37% ± 5.05% vs 11.08% ± 1.31%; 56.53% ± 6.03%, 44.84% ± 5.24% vs9.67% ± 1.39%). TUNEL results showed that apoptosis increased in xenograft tissue injected with RPL31-siRNA (2.92% ± 0.54%, 3.85% ± 0.87% vs 39.58% ± 4.02%).
CONCLUSION: Silencing of RPL31 expression could inhibit the growth of subcutaneous xenograft tumors derived from BxPC-3 cell line in nude mice, down-regulate the expression of Ki-67 and CD31, and induce cell apoptosis in the transplantation tumors. The RPL31 gene is a potential target for gene therapy of pancreatic cancer.
- Citation: Li CD, Liu CL, Xia YY, Ge M, Chen DJ. SiRNA-mediated RPL31 gene silencing inhibits the growth of xenograft tumors derived from human pancreatic cancer BxPC-3 cells in nude mice. Shijie Huaren Xiaohua Zazhi 2012; 20(29): 2782-2788
- URL: https://www.wjgnet.com/1009-3079/full/v20/i29/2782.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i29.2782
全球胰腺癌发病率逐年上升, 其恶性程度极高, 临床表现无特异性, 早期诊断及手术治疗困难, 死亡率在所有癌症死亡中排名第4位, 总体5年生存率低于3%[1,2]. 随着对胰腺癌分子生物学特性和病理生理特性的深入研究, 基因治疗逐渐成为继手术、放疗和化疗等传统疗法之后的胰腺癌治疗新模式[3,4]. RNA干扰(RNA interference, RNAi)可以快速、高效、特异性的抑制靶基因的表达, 这种特点使其在包括胰腺癌在内的多种疾病中应用前景广阔[5-8]. 核糖体蛋白L31(ribosomal protein L31,RPL31)基因属于核糖体蛋白L31E家族, 其编码的蛋白质是构成核糖体60S亚基成员之一. RPL31在结直肠癌中是过表达的, 而在转移性的结直肠癌内, RPL31的表达下调[9]. RPL31在结直肠癌的发生、发展中具有促增殖及致癌性的作用[10,11]. 我们前期的体外研究发现, 利用siRNA沉默RPL31基因表达可以抑制胰腺癌细胞的生长, 为了进一步明确RPL31基因在胰腺癌中的作用, 本文进一步在体内探讨RPL31-siRNA对胰腺癌BxPC-3细胞裸鼠皮下移植瘤的生长的影响, 为RPL31基因应用于胰腺癌治疗提供理论依据.
人胰腺癌细胞株BxPC-3(中国科学院典型培养物保藏委员会细胞库), DMEM培养基(美国Gibco), 胎牛血清(HyClone), RNAi-Mate(上海吉玛制药有限公司), TRIzolTM (TIANGEN), cDNA反转录试剂盒、SYBR Green qPCR Master Mix(Fermentas), RPL31兔抗人单克隆一抗(Abgent), β-Actin兔抗人单克隆一抗(Cell Signaling), HRP标记的山羊抗兔二抗(北京中杉金桥), ECL发光试剂盒(Thermo Scientific), BCA蛋白浓度检测试剂盒、RIPA裂解液(碧云天), 各种规格培养皿(corning costar), Ki-67兔抗人一抗、CD31兔抗人一抗、原位细胞凋亡检测(TUNEL)试剂盒及SP免疫组织化学检测试剂盒(上海蓝基生物科技有限公司).
1.2.1 siRNA的设计及合成: 通过Ambion网站[12], 根据人RPL31基因(Genbank NM_000993.4)的编码序列设计siRNA, RPL31-siRNA: 5'-AUUCGGUAUGGCACAUUCCTT-3', 5'-GGAAUGUGCCAUACCGAAUTT-3'. 同时设计阴性对照siRNA: 5'-UUCUCCGAACGUGUCACGUTT-3', 5'-ACGUGACACGUUCGGAGAATT-3'. 所有siRNA均进行末端2'Ome修饰以提高其在体内的半衰期, 并由上海吉玛制药有限公司合成提供.
1.2.2 细胞培养及动物模型建立: 4周龄Balb/c裸鼠, 体质量16-18 g, 共18只(SCXK2007-0005), 雌雄各半, 均购自上海斯莱克实验动有限公司, 在SPF级动物饲养室喂养. 复苏BxPC-3胰腺癌细胞, 待细胞传代3次后, 生长至对数生长期时, 收集细胞, 计数, 调整细胞浓度至5×107个/mL, 将细胞悬液按照每只0.1 mL的接种量接种至小鼠腋窝处皮下, 每日观察裸鼠生存状况和肿瘤大小情况.
1.2.3 实验动物分组、给药及瘤体积测量: BxPC-3接种后10 d, 瘤子体积生长至约50 mm3时, 基于肿瘤体积随机化分为3组: 溶剂对照组、阴性对照组、干预组. 每组6只, 雌雄各半. 以转染试剂混合液溶解各个siRNA粉末, 转染试剂混合液由RNAi-Mate转染试剂+DEPC水+OPTI-MEM培养基组成, 添加比例为1∶1.25∶1.5. 分组当日记为d0. 分组次日采用瘤内注射的方式开始注射小分子RNA: 干预组注射RPL31-siRNA, 阴性对照组注射相同量的阴性对照siRNA, 溶剂对照组注射相同体积的转染试剂混合液. 每3日1次, 每只裸鼠每次注射10 μg siRNA, 连续5次. 每3日测量瘤块长径(a)和短径(b), 计算瘤体积, 计算公式为: V(mm3) = 1/2×a×b2, 绘制裸鼠的移植瘤生长曲线. 开始给药后16 d采用颈椎脱位法处死所有裸鼠, 取瘤组织待测.
1.2.4 实时定量PCR及Western blot检测瘤组织RPL31表达: 取新鲜的肿瘤组织按照操作说明提取细胞总RNA, 紫外分光光度计检测样品纯度和浓度, 逆转录合成cDNA. 实时定量PCR检测引物序列如下: RPL31-F: 5'-CGACCCGGAAGTTGTACTTG-3'; RPL31-R: 5'-TCTCGCCACCCTTCTTTG-3'; GAPDH-F: 5'-GCACCGTCAAGGCTGAGAAC-3'; GAPDH-R: 5'GCCTTCTCCATGGTGGTGAA-3'. 反应程序为: (1)94 ℃ 10 min; (2)94 ℃ 30 s; (3)60 ℃ 30 s; (4)72 ℃ 30 s; (2)-(4)40个循环. 用2-∆∆Ct分析法进行数值分析[13]. 同样取新鲜的肿瘤组织按照RIPA裂解液说明提取总蛋白, 取上清进行BCA法蛋白定量[14], 取30 μg蛋白进行SDS-PAGE电泳, 转膜, 封闭, 4 ℃孵育RPL31抗体及β-actin抗体过夜, 二抗室温震荡孵育1 h, TBST洗膜后用ECL试剂盒暗室显影.
1.2.5 免疫组织化学法检测移植瘤组织中Ki-67及CD31的表达: 取新鲜瘤块PBS(0.01 mol/L, pH 7.4)清洗, 40 g/L甲醛固定后石蜡包埋, 切片后按照SP试剂盒说明书进行免疫组织化学染色: 二甲苯脱蜡、抗原修复、内源性过氧化物酶封闭及非特异性抗原封闭, Ki-67及CD31(1∶100)一抗4 ℃孵育过夜, 二抗37 ℃孵育20 min, DAB显色, 苏木素复染细胞核1 min, 氨水反蓝, 脱水, 二甲苯透明, 中性树胶封片后于显微镜下观察并拍照. 采用阳性细胞百分比的计算方法分析Ki-67及CD31的表达: 400倍显微镜下随机选择10个视野进行计数, 计算阳性细胞占总细胞数的百分比[15].
1.2.6 原位末端标记技术检测肿瘤组织原位细胞凋亡: 取新鲜移植瘤组织, 严格根据TUNEL试剂盒说明进行操作, 以阳性细胞百分比为凋亡指数分析各个处理组细胞的凋亡情况[15].
统计学处理 用SPSS12.0软件进行数据统计分析, 数据以mean±SD表示. 两组数据之间进行t检验, 多组均数间的显著性检验用方差分析, P<0.05代表差异具有显著性.
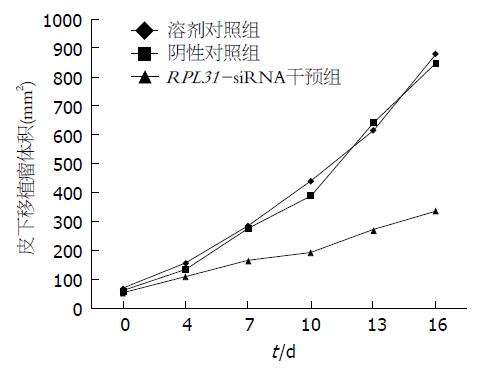
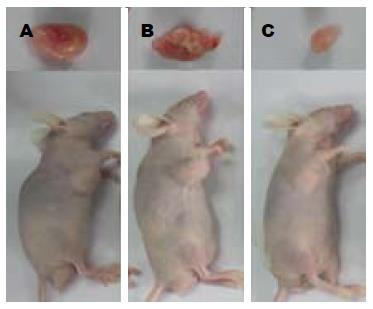
本实验中, 注射siRNA后荷瘤裸鼠生命活动正常, 无一死亡. 3组移植瘤生长曲线显示: 从注射siRNA第1天开始, RPL31-siRNA干预组皮下移植瘤生长较缓慢, 肿瘤体积相对较小; 溶剂对照组及阴性对照组皮下移植瘤生长较迅速, 肿瘤体积较大, RPL31-siRNA干预组皮下移植瘤体积的增长明显滞后于溶剂对照组及阴性对照组, 差异有统计学意义(P<0.05). 测量给药结束后解剖的肿瘤终体积, RPL31-siRNA干预组(336.54 mm3±175.03 mm3)显著小于溶剂对照组(881 mm3±372.83 mm3)和阴性对照组(846.44 mm3±263.96 mm3, 图1, 2).
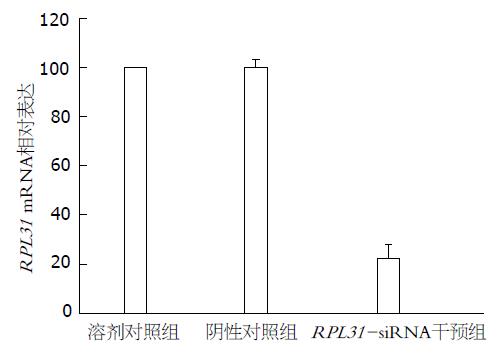
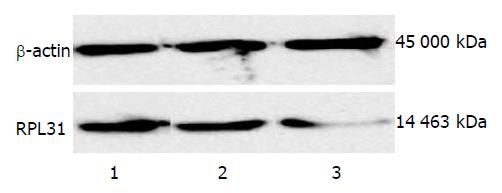
与溶剂对照组和阴性对照组相比, 注射RPL31-siRNA的移植瘤组织中的RPL31基因mRNA及蛋白水平表达明显下降. 实时定量PCR结果显示, 与溶剂对照组相比, RPL31-siRNA干预组移植瘤组织的mRNA下降了77.31%±5.28%(P<0.05, 图3), 而溶剂对照组与阴性对照组相比差异无统计学意义. Western blot实验分析得出, RPL31-siRNA干预组皮下移植瘤组织中RPL31蛋白表达水平明显低于溶剂对照组和阴性对照组, 而溶剂对照组与阴性对照组相比差异不大(图4).
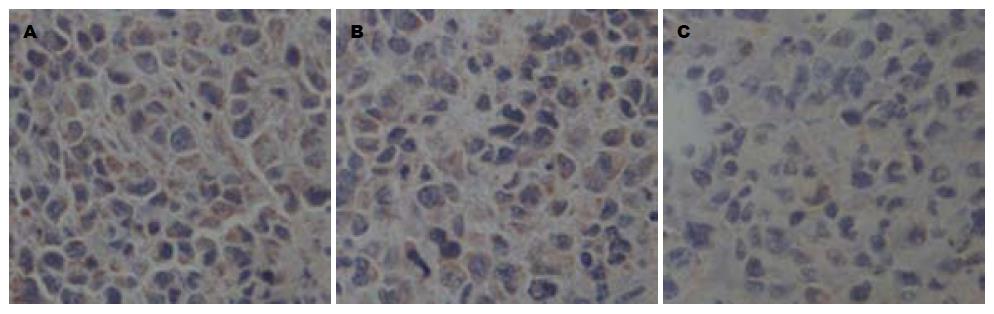
Ki-67阳性染色定位于胞细胞核, 溶剂对照组和阴性对照组阳性细胞染色较深, 分布较广, 而RPL31-siRNA干预组阳性细胞染色较淡, 分布较散(图5). 对图像进行分析, 统计各处理组移植瘤中Ki-67阳性细胞的百分比, 溶剂对照组为55.78%±4.63%, 阴性对照组为51.37%±5.05%, 而RPL31-siRNA干预组为11.08%±1.31%(P<0.05, 表1). 因此, 裸鼠移植瘤组织中注射RPL31-siRNA关闭RPL31的表达后Ki-67的表达明显降低.
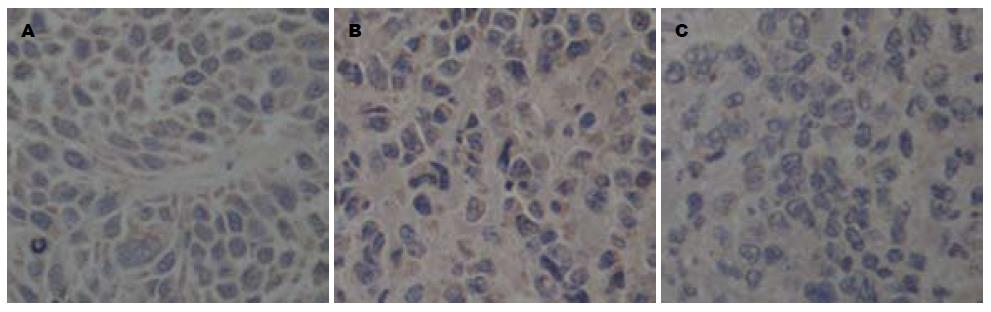
CD31蛋白可用于评价新生血管的能力. 免疫组织化学结果显示, 溶剂对照组及阴性对照组CD31阳性细胞较多, 染色较深, 而RPL31-siRNA干预组CD31阳性细胞较少, 染色较浅(图6). 对图像进行分析, 统计各个处理组移植瘤中CD31阳性细胞的百分比, 溶剂对照组为56.53%±6.03%, 阴性对照组为44.84%±5.24%, 而RPL31-siRNA干预组为9.67%±1.39%(P<0.05, 表1). 因此, 裸鼠移植瘤组织中注射RPL31-siRNA关闭RPL31的表达后CD31的表达明显降低.
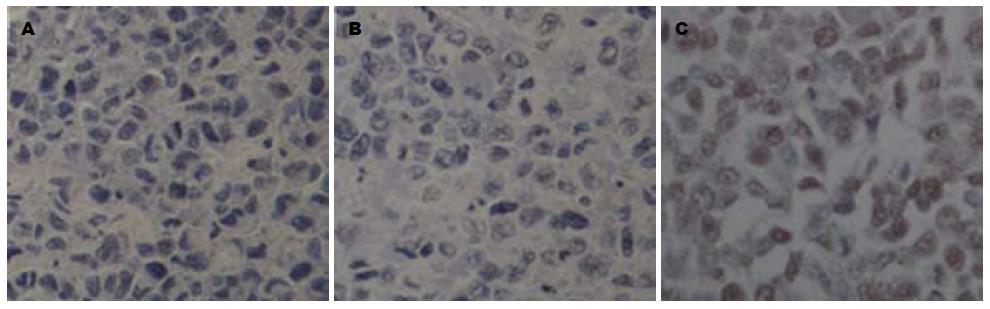
TUNEL反应后显微镜下观察, 阳性细胞(凋亡)细胞核呈黄褐色, 核质浓缩, 细胞形态不规则, 阴性(非凋亡细胞)则无细胞形态学变化, 不着色或轻微染色(图7). 对图像进行分析, 统计各个处理组移植瘤组织中的凋亡指数, 溶剂对照组为2.92%±0.54%, 阴性对照组为3.85%±0.87%, 而RPL31-siRNA干预组为39.58%±4.02%(P<0.05, 表1). 这些结果表明, 注射RPL31-siRNA关闭RPL31的表达后可以诱导移植瘤组织的细胞发生凋亡.
胰腺癌是常见的消化系恶性肿瘤, 约占人类全部恶性肿瘤的2%. 其早期缺乏特异症状诊断困难, 死亡率极高[16]. 胰腺癌的最初发生一般需要多个基因突变连续性积累, 在这个过程中, 控制细胞分化、增殖和凋亡的多个基因出现了异常改变[17,18]. 基因治疗是当前公认的新的治疗方向, 相对于传统的手术及放疗化疗, 基因治疗具有靶向性强、细胞毒性小、不良反应小、对正常组织损伤较小、耐受性好等优点[19]. 然而, 在胰腺癌中针对目前公认的癌症治疗靶点进行的基因治疗效果都不理想, 这就需要寻找更加有效的治疗靶点[20,21].
核糖体蛋白(ribosomal protein, RP)是组成核糖体(ribosome)的主要成分, 他们在细胞内蛋白质合成过程中发挥重要的作用[22]. 越来越多的研究表明, 许多核糖体蛋白还有独立于蛋白质生物合成之外的其他功能, 比如核糖体蛋白可能在肿瘤的发生、发展、转移和肿瘤抑制中发挥重要的作用. 许多核糖体蛋白的表达量在肿瘤中发生改变[23-25]. 此外, 有的肿瘤中存在多种核糖体蛋白的突变[26]. RPL31基因属于核糖体蛋白L31E家族, 其编码的蛋白质是构成核糖体60S亚基的成员之一. RPL31研究较多的主要是探讨其与结直肠癌(colorectal carcinomas, CRC)的关系. RPL31与胰腺癌的关系目前未见国内外报道. 我们的前期体外研究表明, 在胰腺癌PANC-1细胞中利用siRNA关闭RPL31的表达, PANC-1细胞的增殖受到抑制, 细胞周期阻遏于G0/G1期, 细胞迁移能力降低, VEGF表达降低, 说明了RPL31基因在维持胰腺癌PANC-1细胞生物学特性方面的重要性. 为了深入研究RPL31与胰腺癌的关系, 我们首先以人胰腺癌BxPC-3细胞构建了胰腺癌裸鼠移植瘤模型, 以探讨RPL31-siRNA对胰腺癌裸鼠移植瘤的抑制作用. 结果表明, RPL31-siRNA在降低胰腺癌移植瘤RPL31表达的同时可以显著抑制移植瘤的生长. 进一步对移植瘤组织进行IHC和TUNEL分析发现: RPL31下调后, 移植瘤组织中的Ki-67表达下降, CD31表达下降, 凋亡增加.
增殖细胞核抗原(Ki-67)是一种核增殖标志物, 开始表达于细胞周期的G1期, 在S期及G2期表达增加, 细胞有丝分裂后迅速减少[27]. Ki-67在多数肿瘤中过表达. 他的表达水平可以反应肿瘤细胞的增殖状态及肿瘤的生物学行为, 与肿瘤的发展、转移和预后高度相关[28,29]. 因此我们推测RPL31基因可能通过下调Ki-67的表达来抑制胰腺癌细胞的增殖. CD31是一种分子量为130 kDa的跨膜糖蛋白, 在非成熟及成熟的肿瘤血管中均有表达[30]. CD31的特异性和敏感性较高, 可以作为微血管密度(microvessel density, MVD)的定量指标, 用于评价肿瘤的血管生成[31]. CD31的表达降低表明关闭RPL31基因的表达可以降低胰腺癌细胞的血管生成能力. 除此之外, TUNEL实验表明关闭RPL31基因的表达可以诱导胰腺癌移植瘤组织细胞发生凋亡. 这些研究结果充分说明了RPL31基因在胰腺癌发生发展中的重要作用. 但是, RPL31基因在胰腺癌中具体作用的分子生物学机制及信号传导途径尚需深入研究. 总之, 本研究通过荷瘤裸鼠体内实验探讨了沉默RPL31基因的表达对人胰腺癌裸鼠移植瘤的抑制作用, 为以RPL31为靶基因的胰腺癌基因治疗奠定了良好的理论基础.
感谢毛文伟、殷瑜及杨天同志在本实验中给予的大力帮助.
全球胰腺癌发病率逐年上升, 其恶性程度高、预后差, RNA干扰可以快速、高效、特异性的抑制靶基因的表达, 以RNA干扰技术为基础的基因治疗逐渐成为继手术、放疗和化疗等传统疗法之后的胰腺癌治疗新模式.
刘炳亚, 研究员, 上海交通大学医学院附属瑞金医院上海消化外科研究所
近年来发现许多核糖体蛋白具有独立于蛋白质生物合成之外的生物学效应, 例如核糖体蛋白可能在肿瘤的发生、发展、转移和肿瘤抑制中发挥重要的作用. 探讨某些核糖体蛋白与肿瘤的关系成为研究肿瘤发病机制及治疗的新热点.
糖体蛋白L31(RPL31)基因属于核糖体蛋白L31E家族, 他在结直肠癌的发生、发展中具有促增殖及致癌性的作用, 我们前期的体外研究表明, RPL31基因在维持胰腺癌PANC-1细胞生物学特性方面的发挥了重要的作用.
国内外关于RPL31基因与胰腺癌的关系的研究报道较少, 本实验以人胰腺癌BxPC-3细胞构建了胰腺癌裸鼠移植瘤模型, 采用瘤内注射siRNA的方式探讨了在裸鼠移植瘤内关闭RPL31基因的表达对胰腺癌裸鼠移植瘤的抑制作用.
使用siRNA关闭RPL31表达可以显著抑制裸鼠移植瘤的生长. 进一步研究显示, RPL31下调后, 移植瘤组织中的Ki-67表达下降, CD31表达下降, 凋亡增加. 以RPL31为靶基因的胰腺癌基因治疗具有良好的应用前景.
本文选用靶向RPL31基因的siRNA进行荷瘤鼠体内实验, 探索了siRNA应用于胰腺癌基因治疗的新途径, 具有一定的学术价值.
| 1. | Szabolcs A, Reiter RJ, Letoha T, Hegyi P, Papai G, Varga I, Jarmay K, Kaszaki J, Sari R, Rakonczay Z. Effect of melatonin on the severity of L-arginine-induced experimental acute pancreatitis in rats. World J Gastroenterol. 2006;12:251-258. [PubMed] |
| 2. | Siegel R, Ward E, Brawley O, Jemal A. Cancer statistics, 2011: the impact of eliminating socioeconomic and racial disparities on premature cancer deaths. CA Cancer J Clin. 2011;61:212-236. [PubMed] [DOI] |
| 3. | Egami T, Ohuchida K, Miyoshi K, Mizumoto K, Onimaru M, Toma H, Sato N, Matsumoto K, Tanaka M. Chemotherapeutic agents potentiate adenoviral gene therapy for pancreatic cancer. Cancer Sci. 2009;100:722-729. [PubMed] [DOI] |
| 4. | Matthaios D, Zarogoulidis P, Balgouranidou I, Chatzaki E, Kakolyris S. Molecular pathogenesis of pancreatic cancer and clinical perspectives. Oncology. 2011;81:259-272. [PubMed] [DOI] |
| 5. | Zhong YQ, Xia ZS, Fu YR, Zhu ZH. Knockdown of hTERT by SiRNA suppresses growth of Capan-2 human pancreatic cancer cell via the inhibition of expressions of Bcl-2 and COX-2. J Dig Dis. 2010;11:176-184. [PubMed] [DOI] |
| 6. | Shi XH, Liang ZY, Ren XY, Liu TH. Combined silencing of K-ras and Akt2 oncogenes achieves synergistic effects in inhibiting pancreatic cancer cell growth in vitro and in vivo. Cancer Gene Ther. 2009;16:227-236. [PubMed] |
| 7. | Nishikura K. A short primer on RNAi: RNA-directed RNA polymerase acts as a key catalyst. Cell. 2001;107:415-418. [PubMed] [DOI] |
| 8. | Elbashir SM, Harborth J, Lendeckel W, Yalcin A, Weber K, Tuschl T. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature. 2001;411:494-498. [PubMed] [DOI] |
| 9. | Bertucci F, Salas S, Eysteries S, Nasser V, Finetti P, Ginestier C, Charafe-Jauffret E, Loriod B, Bachelart L, Montfort J. Gene expression profiling of colon cancer by DNA microarrays and correlation with histoclinical parameters. Oncogene. 2004;23:1377-1391. [PubMed] [DOI] |
| 10. | Lai MD, Xu J. Ribosomal proteins and colorectal cancer. Curr Genomics. 2007;8:43-49. [PubMed] [DOI] |
| 11. | Chester KA, Robson L, Begent RH, Talbot IC, Pringle JH, Primrose L, Macpherson AJ, Boxer G, Southall P, Malcolm AD. Identification of a human ribosomal protein mRNA with increased expression in colorectal tumours. Biochim Biophys Acta. 1989;1009:297-300. [PubMed] [DOI] |
| 12. | Schotte R, Nagasawa M, Weijer K, Spits H, Blom B. The ETS transcription factor Spi-B is required for human plasmacytoid dendritic cell development. J Exp Med. 2004;200:1503-1509. [PubMed] [DOI] |
| 13. | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 2001;25:402-408. [PubMed] [DOI] |
| 14. | Liu MJ, Wang Z, Li HX, Wu RC, Liu YZ, Wu QY. Mitochondrial dysfunction as an early event in the process of apoptosis induced by woodfordin I in human leukemia K562 cells. Toxicol Appl Pharmacol. 2004;194:141-155. [PubMed] [DOI] |
| 15. | Kong R, Sun B, Jiang H, Pan S, Chen H, Wang S, Krissansen GW, Sun X. Downregulation of nuclear factor-kappaB p65 subunit by small interfering RNA synergizes with gemcitabine to inhibit the growth of pancreatic cancer. Cancer Lett. 2010;291:90-98. [PubMed] [DOI] |
| 16. | Gudjonsson B. Pancreatic cancer: survival, errors and evidence. Eur J Gastroenterol Hepatol. 2009;21:1379-1382. [PubMed] [DOI] |
| 17. | Sakorafas GH, Smyrniotis V. Molecular biology of pancreatic cancer: how useful is it in clinical practice? JOP. 2012;13:332-337. [PubMed] |
| 18. | Wong HH, Lemoine NR. Pancreatic cancer: molecular pathogenesis and new therapeutic targets. Nat Rev Gastroenterol Hepatol. 2009;6:412-422. [PubMed] [DOI] |
| 19. | El-Aneed A. An overview of current delivery systems in cancer gene therapy. J Control Release. 2004;94:1-14. [PubMed] [DOI] |
| 20. | Mendelsohn J. The epidermal growth factor receptor as a target for cancer therapy. Endocr Relat Cancer. 2001;8:3-9. [PubMed] [DOI] |
| 21. | Feldmann G, Dhara S, Fendrich V, Bedja D, Beaty R, Mullendore M, Karikari C, Alvarez H, Iacobuzio-Donahue C, Jimeno A. Blockade of hedgehog signaling inhibits pancreatic cancer invasion and metastases: a new paradigm for combination therapy in solid cancers. Cancer Res. 2007;67:2187-2196. [PubMed] [DOI] |
| 22. | Ramakrishnan V. Ribosome structure and the mechanism of translation. Cell. 2002;108:557-572. [PubMed] [DOI] |
| 23. | Wang Y, Cheong D, Chan S, Hooi SC. Ribosomal protein L7a gene is up-regulated but not fused to the tyrosine kinase receptor as chimeric trk oncogene in human colorectal carcinoma. Int J Oncol. 2000;16:757-762. [PubMed] [DOI] |
| 24. | Sahin F, Qiu W, Wilentz RE, Iacobuzio-Donahue CA, Grosmark A, Su GH. RPL38, FOSL1, and UPP1 are predominantly expressed in the pancreatic ductal epithelium. Pancreas. 2005;30:158-167. [PubMed] [DOI] |
| 25. | Kasai H, Nadano D, Hidaka E, Higuchi K, Kawakubo M, Sato TA, Nakayama J. Differential expression of ribosomal proteins in human normal and neoplastic colorectum. J Histochem Cytochem. 2003;51:567-574. [PubMed] [DOI] |
| 26. | Amsterdam A, Sadler KC, Lai K, Farrington S, Bronson RT, Lees JA, Hopkins N. Many ribosomal protein genes are cancer genes in zebrafish. PLoS Biol. 2004;2:E139. [PubMed] [DOI] |
| 27. | Scholzen T, Gerdes J. The Ki-67 protein: from the known and the unknown. J Cell Physiol. 2000;182:311-322. [PubMed] [DOI] |
| 28. | Urruticoechea A, Smith IE, Dowsett M. Proliferation marker Ki-67 in early breast cancer. J Clin Oncol. 2005;23:7212-7220. [PubMed] [DOI] |
| 29. | Allegra CJ, Paik S, Colangelo LH, Parr AL, Kirsch I, Kim G, Klein P, Johnston PG, Wolmark N, Wieand HS. Prognostic value of thymidylate synthase, Ki-67, and p53 in patients with Dukes' B and C colon cancer: a National Cancer Institute-National Surgical Adjuvant Breast and Bowel Project collaborative study. J Clin Oncol. 2003;21:241-250. [PubMed] [DOI] |
| 30. | Miettinen M, Lindenmayer AE, Chaubal A. Endothelial cell markers CD31, CD34, and BNH9 antibody to H- and Y-antigens--evaluation of their specificity and sensitivity in the diagnosis of vascular tumors and comparison with von Willebrand factor. Mod Pathol. 1994;7:82-90. [PubMed] |
| 31. | de la Taille A, Katz AE, Bagiella E, Buttyan R, Sharir S, Olsson CA, Burchardt T, Ennis RD, Rubin MA. Microvessel density as a predictor of PSA recurrence after radical prostatectomy. A comparison of CD34 and CD31. Am J Clin Pathol. 2000;113:555-562. [PubMed] [DOI] |
编辑: 田滢 电编:鲁亚静