修回日期: 2010-12-19
接受日期: 2010-12-29
在线出版日期: 2011-02-18
目的: 探讨内镜超声(EUS)及其引导下的细针穿刺活检(EUS-FNA)在胰腺疾病诊断中的价值.
方法: 回顾性分析2008-03/2010-03经EUS检查的62例胰腺疾病, 其中有32例行细针穿刺活检.
结果: (1)62例胰腺疾病中胰腺癌26例、慢性胰腺炎20例、胰腺囊肿10例、胰岛细胞瘤2例; (2)B超、CT、EUS/EUS-FNA对胰腺癌的确诊率分别为: 46.2%、69.2%、88.5%; 对慢性胰腺炎的确诊率为: 50%、66.7%、100%; 对胰腺囊肿的确诊率分别为: 50%、83.3%、100%; (3)EUS-FNA可以明确胰腺疾病的性质, 2例胰岛细胞瘤通过EUS-FNA而得以确诊.
结论: EUS对胰腺疾病的诊断正确率较常规的B超、CT高, 联合EUS-FNA更能提高其诊断的准确性.
引文著录: 毛靖伟, 徐鸰鸽, 唐海英, 王英德. 内镜超声及其引导下的细针穿刺活检在胰腺疾病中的诊断价值. 世界华人消化杂志 2011; 19(5): 533-537
Revised: December 19, 2010
Accepted: December 29, 2010
Published online: February 18, 2011
AIM: To investigate the diagnostic value of endoscopic ultrasound (EUS) and EUS-guided fine needle aspiration (EUS-FNA) biopsy in pancreatic diseases.
METHODS: The clinical data for 62 patients with pancreatic diseases who underwent EUS (including 32 undergoing EUS-FNA) were retrospective analyzed.
RESULTS: Of 62 patients, 26 had pancreatic cancer, 20 had chronic pancreatitis, 10 had pancreatic cyst, and 2 had islet cell adenoma. The rates of achieving final diagnosis by B ultrasound, CT scan, and EUS/EUS-FNA were 46.2%, 69.2%, and 88.5% in patients with pancreatic cancer, 50%, 66.7%, and 100% in patients with chronic pancreatitis, 50%, 83.3%, and 100% in patients with pancreatic cyst. Pancreatic occupying lesions can be confirmed by EUS-FNA, through which we found 2 cases of islet cell adenoma.
CONCLUSION: EUS is more accurate than B ultrasound and CT scan in the diagnosis of pancreatic diseases. EUS in combination with EUS-FNA can further enhance the diagnostic accuracy of pancreatic diseases.
- Citation: Mao JW, Xu LG, Tang HY, Wang YD. Diagnostic value of endoscopic ultrasound and endoscopic ultrasound-guided fine needle aspiration biopsy in pancreatic diseases. Shijie Huaren Xiaohua Zazhi 2011; 19(5): 533-537
- URL: https://www.wjgnet.com/1009-3079/full/v19/i5/533.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i5.533
内镜超声(endoscopic ultrasound, EUS)是将微型高频超声探头安置在内镜顶端, 通过内镜进入腔内, 观察腔内形态, 获取管壁层次的组织学声像特征及周围邻近脏器的超声图像, 并且可以通过超声内镜引导下细针穿刺(EUS guided-fine needle aspiration, EUS-FNA)活检而获得病理组织学的诊断. EUS具有内镜和超声的双重功能, 他的临床应用提高了消化病的诊治水平. 由于EUS对胰腺实质和胰管的良好显示, 已经成为诊断胰腺疾病的重要手段. 我们通过对62例经EUS检查的胰腺疾病进行回顾性分析, 进一步探讨胰腺疾病的EUS声像图特征及其在胰腺疾病诊断中的价值.
2008-03/2010-03我们共完成62例胰腺疾病的EUS检查, 其中32例行EUS-FNA. 其中男43例, 女19例, 平均年龄57.9岁. 所有病例均经B超或CT的常规检查发现有或可疑胰腺病变. EUS为日本PENTAX公司生产的EG-3630UR和EG-3830UT(穿刺时使用), 主机为EPM3500型, 超声诊断仪为日本HITACHI 公司的EUB-5500, 探头频率5-10 MHz. 穿刺针为GIP Hancke-Vilmann 19G内镜超声穿刺针. 除EUS-FNA证实为胰腺癌及部分行手术治疗有病理明确诊断外, 其余患者均随访3-12 mo.
按常规胃镜检查前准备, 行EUS-FNA的患者均除外凝血机能障碍性疾病, 术前2 wk禁用非甾体抗炎药物及其他抗凝血药物. 检查时采用水囊法及水充盈法. 在超声影像提示下选择合适位置行细针穿刺. 将抽取物推于玻片, 成条的组织置于甲醛中固定, 每处病变重复抽吸2-3次. 对切片和涂片进行病理学检查. 采用回顾分析的方法进行研究.
62例中32例行EUS-FNA, 共发现胰腺癌、慢性胰腺炎、胰腺囊肿以及胰岛细胞瘤4种病变. 30例仅行EUS检查的病例中有7例EUS表现为胰腺囊肿(其中有3例术后病理证实为胰腺囊肿); 11例EUS提示为炎症, 但是其中的3例进一步手术证实为胰腺癌; 4例B超示胰腺病变, EUS未见胰腺有病变; 8例CT及MRI示胰头癌、壶腹周围癌, EUS也表现为癌, 术后病理证实. 32例行EUS-FNA的病例中: 胰腺癌15例; 胰腺囊肿3例; 慢性炎症12例; 胰岛细胞瘤2例. 62例中最终有病理证实的胰腺癌、胰腺炎、胰腺囊肿、胰岛细胞瘤分别为26例、12例、6例、2例.
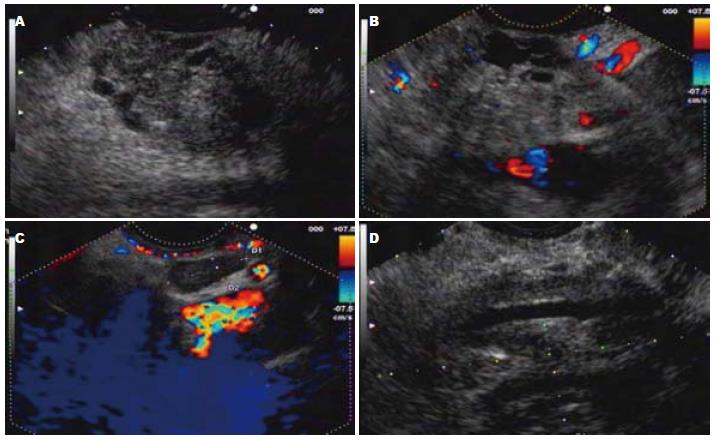
2.2.1 胰腺癌: 表现为边界不清晰, 可有周围血管受侵犯、胆总管和胰管受压扩张的低回声. 呈低回声或中等回声(图1).
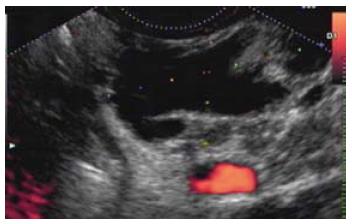
2.2.2 慢性胰腺炎: 胰腺实质腹背分界不清、背侧腺体回声不均、实质高回声点或高回声线聚集、主胰管>2 mm, 胰管管壁回声增强, 胰腺边缘细波纹状或模糊, 实质内见异常回声块(图2).
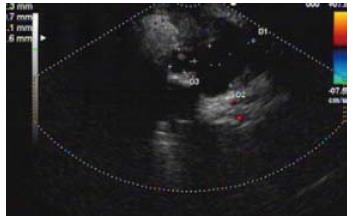
2.2.3 胰腺囊肿: 胰腺内或胰腺周围的圆形或不规则形无回声病变, 后方伴有增强效应, 壁薄光滑, 透生良好, 部分可见絮状回声或组织碎屑样沉积. 大部分假性囊肿伴有慢性胰腺炎改变(图2, 3).
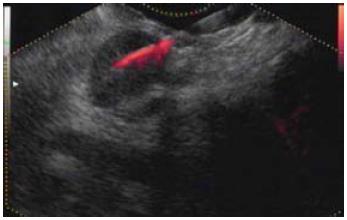
2.2.4 胰岛细胞瘤: 主要表现为胰腺内有低回声, 病变边界清楚, 回声均匀, 与周围正常胰腺组织区别明显(图4).
| 检查类型 | 胰腺癌 | 慢性胰腺炎 | 胰腺囊肿 | 胰岛细胞瘤 |
| B超 | 46.2(12/26) | 50.0(6/12) | 50.0(3/6) | 0.0(0/2) |
| CT | 69.2(18/26) | 66.7(8/12) | 83.3(5/6) | 0.0(0/2) |
| EUS/EUS-FNA | 88.5(23/26) | 100.0(12/12) | 100.0(6/6) | 100.0(2/2) |
2.3.1 胰腺癌: 确诊为胰腺癌的26例中, 经B超发现的有12例、CT诊断的有18例, EUS/EUS-FNA确诊的有23例, 他们的确诊率分别为46.2%、69.2%、88.5%.
2.3.2 慢性胰腺炎: 12例慢性胰腺炎中, 经B超、CT、EUS/EUS-FNA确诊的分别为6例、8例、12例, 他们的确诊率分别为50%、66.7%、100%.
2.3.3 胰腺囊肿: 确诊的6例胰腺囊肿中, 经B超、CT、EUS/EUS-FNA确诊的分别为3例、5例、6例, 他们的确诊率分别为50%、83.3%、100%.
2.3.4 胰岛细胞瘤: 2例胰岛细胞瘤病例B超及CT未发现明确的胰腺病变, 均因临床具有Whipple三联征, 故而行EUS-FNA, 取得病例证实.
EUS的高分辨率使得其对胰腺实质和胰腺导管均能清晰显示, 而且对于胰腺的扫描几乎没有盲区, 因而其在胰腺疾病的诊断中具有越来越重要的地位. 在EUS基础上发展的EUS-FNA技术, 使得胰腺疾病的诊断准确率得到了显著的提高.
胰腺疾病中的胰腺癌早期诊断较为困难, B超、CT检查往往不能最终确诊, 胰腺癌早期容易漏诊和误诊. EUS明显弥补了常规检查的不足, 可以发现早期胰腺癌, 同时可以判断分期, 针对不同分期指导其手术及其他的治疗方案[1]. EUS对于胰腺癌的诊断具有较高的敏感性, 特别是<2 cm的病灶. 有学者认为EUS对胰腺癌的诊断敏感性甚至优于PET-CT[2]. Ngamruengphong等[3]的研究发现行EUS的胰腺癌患者的中位生存期显著高于未行EUS的病例, 其可能的原因在于EUS可以发现早期的胰腺癌, 同时也可以准确地判断胰腺癌不同的分期, 而后可以针对不同的分期进行治疗. 我们的研究表明, B超、CT、EUS/EUS-FNA对于胰腺癌的确诊率分别为46.2%、69.2%、88.5%. EUS较B超及CT对于胰腺癌的诊断敏感性高. Artifon的研究发现, 对与胰腺癌发病类似的壶腹癌的肿瘤分期, EUS较CT更具有特异性和敏感性; EUS联合CT检查并不能提高诊断的准确性, CT不能提高EUS的诊断正确率[4]. EUS也是依赖于超声图像的声像学特征对疾病进行判断, 故而单纯的EUS并不能完全达到100%的诊断率. 本研究中即有3例最终确诊为胰腺癌, 而EUS却考虑为胰腺炎症. 对于病灶性质不明确的病例, 可以通过FNA而获得病理学诊断. 15例行FNA的胰腺癌病例中, 术后切除的病理与FNA完全吻合. EUS-FNA路径短, 分辨率高, 能准确穿刺直径<1.0 cm的微小病灶, 所以联合FNA可以大大提高胰腺癌的诊断准确率. 对于CT或MRI发现的可疑胰腺癌的胰腺局灶性病变, EUS-FNA具有较高的诊断准确率, 对于这些患者, EUS-FNA可成为确诊的手段[5]. 重要的是, EUS有较高的TNM分期诊断准确率[6,7]. EUS能显示胰腺癌的大小、肿瘤是否侵犯周围血管、胆总管、十二指肠、肝脏、肾脏和肾上腺的情况以及有无淋巴结转移, 能较清楚地显示门静脉和脾静脉. 预测胰腺肿瘤可切除性的敏感性达90%. 虽然EUS-FNA诊断肿瘤的特异性几乎可以达到100%, 但是其敏感性却有较大差异, 主要与操作者的技术水平、穿刺的次数、穿刺针等多种因素有关. 除了对胰腺癌的诊断外, 还可以通过EUS对于胰腺癌进行治疗, 主要包括: 胰腺癌的腹腔神经节的阻断、肿瘤的射频消融、光动力疗法、近距离的放射治疗, 甚至可以局部注射抗肿瘤因子等[8].
慢性胰腺炎的诊断, 尤其是早期诊断, 一直是临床面临的一个难题. 现有的B超、CT检查对于慢性胰腺炎诊断的敏感性和特异性均较低. 本研究中, B超、CT对于慢性胰腺炎确诊率分别为50%、66.7%. 由于EUS具有发现细微的和严重的胰管和胰腺实质的能力, 并且与ERCP相比更具有安全性, 所以目前对于慢性胰腺的诊断已经是被广泛接受[9]. 由于EUS不仅可以观察胰腺实质, 而且可以扫描到胰管以及与胰腺相比邻的器官, 故而能对慢性胰腺炎做出更为准确的判断. 慢性胰腺炎的EUS声像特征为: 胰腺实质腹背分界不清、背侧腺体回声不均、实质高回声点或高回声线聚集、主胰管>2 mm, 胰管管壁回声增强, 胰腺边缘细波纹状或模糊, 实质内见异常回声块. 胰腺实质钙化、胰管侧支增多及管壁回声增强是早期慢性胰腺炎的EUS特征. 本研究中, EUS/EUS-FNA对于慢性胰腺炎的确诊率达到了100%, 说明EUS/EUS-FNA在慢性胰腺炎诊断中具有很高的敏感性及特异性. 然而, 对于慢性胰腺炎以及其来源的假性囊肿和胰腺癌等占位性病变, 仅仅通过EUS, 在某些情况下难以确诊, 但是联合EUS-FNA则可以显著提高诊断的准确率[10]. 同时, 有国外学者发现EUS对于早期轻度慢性胰腺炎的确诊率不到20%, 对于中度以上的胰腺炎可达到90%以上[11]. 出现我们的结果这种情况的原因可能与以下因素有关: (1)我们的病例选择上都是经过常规检查发现异常而后行EUS, 说明病变程度较重; (2)样本量较少; (3)有一部分行了FNA.
胰腺囊性病变约90%为胰腺假性囊肿, 常为急性胰腺炎的并发症. 胰腺囊肿EUS典型的声像图表现为胰腺内或胰腺周围的圆形或不规则形无回声病变, 后方伴有增强效应, 壁薄光滑, 透生良好, 部分可见絮状回声或组织碎屑样沉积. 大部分假性囊肿伴有慢性胰腺炎改变. EUS可以清晰显示囊肿的大小、形态、部位, 以及与胰腺的关系, 并且可以行EUS下的FNA, 所以对胰腺的囊性病变诊断具有重要意义. 我们的研究亦表明, EUS在对胰腺囊肿的诊断方面较B超及CT具有更高的敏感性. 更为重要的是, 近年来发展起来的EUS引导下胰腺假性囊肿穿刺术是目前比较重要的非手术治疗方法. 在EUS引导下选择胃内最佳的穿刺造瘘位置, 放置内引流支架, 将胰液和炎性液体引出, 使得囊肿在短时间内消退, 而达到治疗的目的. 在某些情况下, 可以替代外科手术治疗, 而且并发症少[12]. EUS下的胰腺假性囊肿的穿刺引流是有希望的治疗手段, 但是对于那些壁厚、囊肿液黏稠的囊肿以及继发感染的囊肿, 仅仅穿刺引流往往难以奏效, 还需要进一步的后续治疗[13].
胰岛细胞瘤是常见的胰腺内分泌肿瘤, 临床上有Whipple三联征, 但是胰岛细胞瘤的病灶一般较少, 常规检查很难发现, 对于病变的定位更加困难. 由于EUS的高分辨率及对胰腺的扫描几乎没有盲区, 所以其能发现常规无阳性发现的胰腺的微小病灶[14]. 正是因为EUS可以发现胰腺的微小病灶, 并且通过FNA可以明确微小病灶的性质, 故近年来胰岛细胞瘤的确诊率得到了明显的提高[15]. 我们发现的2例胰岛细胞瘤, 常规的B超及CT检查均未发现胰腺有明确的病灶, 因为有临床表现而高度怀疑胰岛细胞瘤, 进而行EUS-FNA, 从而确诊. 胰岛细胞瘤的EUS图像特征主要表现为胰腺内有低回声, 病变边界清楚, 回声均匀, 与周围正常胰腺组织区别明显.
我们的研究表明, 超声内镜对胰腺疾病的诊断正确率较常规的B超、CT高, 联合内镜引导下的细针穿刺活检可以明确病变的性质, 更能提高其诊断的准确性.
EUS通过内镜进入腔内, 获取管壁层次的组织学声像特征及周围邻近脏器的超声图像, 并且可以通过EUS引导细针穿刺活检获得病理. EUS对胰腺实质和胰管显示良好, 已成为诊断胰腺疾病的重要手段.
郝建宇, 教授, 首都医科大学附属北京朝阳医院消化内科
EUS对胰腺实质和导管均能清晰显示, 对胰腺的扫描几乎无盲区, 故其在胰腺疾病诊断中的地位越来越重要. 对于某些病灶, 联合EUS-FNA可以明确病变的性质. EUS在胰腺疾病诊断中的价值及EUS引导下的胰腺囊肿穿刺术已成为当下研究的热点和重点.
Galasso等学者的研究表明, EUS能明显弥补常规检查的不足, 可以发现早期胰腺癌, 同时可以判断分期, 针对不同分期指导其手术及其他的治疗方案.
本文通过分析B超、CT、EUS/EUS-FNA在胰腺癌、慢性胰腺炎、胰腺囊肿以及胰岛细胞瘤4种胰腺疾病中的确诊率, 发现EUS/EUS-FNA在胰腺疾病的诊断正确率较B超、CT高. 更为重要的是对于常规检查很难发现的微小病灶如岛细胞瘤, EUS-FNA具有无可比拟的优势.
本文选题较好, 对胰腺疾病的诊断具有重要的参考价值.
| 1. | Galasso D, Carnuccio A, Larghi A. Pancreatic cancer: diagnosis and endoscopic staging. Eur Rev Med Pharmacol Sci. 2010;14:375-385. [PubMed] |
| 2. | Mertz HR, Sechopoulos P, Delbeke D, Leach SD. EUS, PET, and CT scanning for evaluation of pancreatic adenocarcinoma. Gastrointest Endosc. 2000;52:367-371. [PubMed] [DOI] |
| 3. | Ngamruengphong S, Li F, Zhou Y, Chak A, Cooper GS, Das A. EUS and survival in patients with pancreatic cancer: a population-based study. Gastrointest Endosc. 2010;72:78-83, 83.e1-e2. [PubMed] |
| 4. | Artifon EL, Couto D Jr, Sakai P, da Silveira EB. Prospective evaluation of EUS versus CT scan for staging of ampullary cancer. Gastrointest Endosc. 2009;70:290-296. [PubMed] [DOI] |
| 5. | Krishna NB, LaBundy JL, Saripalli S, Safdar R, Agarwal B. Diagnostic value of EUS-FNA in patients suspected of having pancreatic cancer with a focal lesion on CT scan/MRI but without obstructive jaundice. Pancreas. 2009;38:625-630. [PubMed] [DOI] |
| 6. | Yamao K, Okubo K, Sawaka A, Hara K, Nakamura T, Suzuki T, Shimizu Y, Ozden I. Endolumenal ultrasonography in the diagnosis of pancreatic diseases. Abdom Imaging. 2003;28:545-555. [PubMed] [DOI] |
| 7. | DeWitt J, Devereaux B, Chriswell M, McGreevy K, Howard T, Imperiale TF, Ciaccia D, Lane KA, Maglinte D, Kopecky K. Comparison of endoscopic ultrasonography and multidetector computed tomography for detecting and staging pancreatic cancer. Ann Intern Med. 2004;141:753-763. [PubMed] |
| 8. | Ashida R, Chang KJ. Interventional EUS for the treatment of pancreatic cancer. J Hepatobiliary Pancreat Surg. 2009;16:592-597. [PubMed] [DOI] |
| 9. | Stevens T, Parsi MA. Endoscopic ultrasound for the diagnosis of chronic pancreatitis. World J Gastroenterol. 2010;16:2841-2850. [PubMed] [DOI] |
| 10. | Ardengh JC, Lopes CV, Campos AD, Pereira de Lima LF, Venco F, Módena JL. Endoscopic ultrasound and fine needle aspiration in chronic pancreatitis: differential diagnosis between pseudotumoral masses and pancreatic cancer. JOP. 2007;8:413-421. [PubMed] |
| 11. | Catalano MF, Lahoti S, Geenen JE, Hogan WJ. Prospective evaluation of endoscopic ultrasonography, endoscopic retrograde pancreatography, and secretin test in the diagnosis of chronic pancreatitis. Gastrointest Endosc. 1998;48:11-17. [PubMed] [DOI] |
| 12. | Grzebieniak Z, Woytoń M, Kielan W. Surgical and endoscopic treatment of pancreatic pseudocysts. Przegl Lek. 2000;57 Suppl 5:50-52. [PubMed] |
| 13. | Yasuda I, Iwata K, Mukai T, Iwashita T, Moriwaki H. EUS-guided pancreatic pseudocyst drainage. Dig Endosc. 2009;21 Suppl 1:S82-S86. [PubMed] [DOI] |
| 14. | Nesje LB, Varhaug JE, Husebye ES, Odegaard S. Endoscopic ultrasonography for preoperative diagnosis and localization of insulinomas. Scand J Gastroenterol. 2002;37:732-737. [PubMed] [DOI] |
| 15. | Caudill JL, Humphrey SK, Salomão DR. Islet cell tumor of the pancreas: increasing diagnosis after instituting ultrasonography-guided fine needle aspiration. Acta Cytol. 2008;52:45-51. [PubMed] [DOI] |
编辑: 李薇 电编:何基才