修回日期: 2010-11-12
接受日期: 2010-11-23
在线出版日期: 2010-12-28
目的: 探讨人肝癌细胞株Huh7、PLC/REF/5中以侧群(SP)细胞为标志的肿瘤干细胞抵抗NOD/SCID小鼠来源的NK细胞杀伤的作用.
方法: 分选所得NK细胞制成细胞悬液接种于培养皿中, 经小鼠重组IL2和IL15活化后, 同肝癌细胞株Huh7、PLC/REF/5经FACS Aria分选后所得主群(MP)、SP细胞共培养, 使NK细胞:肿瘤靶细胞为6:1. 经Annexin V和7AAD染色后, 流式细胞仪检测.
结果: 单独培养Huh7或PLC/PRF/5细胞中MP与SP细胞比较, 其细胞活力(A值)及细胞凋亡比例无明显差别(P>0.05); 而与NK共培养的MP细胞中AnnexinV+7AAD+细胞较单独培养的MP和与NK共培养的SP细胞明显升高(Huh7: 8.43±1.56 vs 4.33±1.36, 4.41±0.70; PLC/PRF/5: 7.89±1.53 vs 5.47±1.04, 4.94±0.95, P<0.05).
结论: 通过细胞凋亡检测发现, Huh7和PLC/REF/5中SP能明显抵抗NK细胞诱导的杀伤作用, 提示肝癌细胞株Huh7、PLC/REF/5中SP细胞在体外具有主动的免疫逃逸能力.
引文著录: 邱爽, 张会英. 侧群细胞对NOD/SCID小鼠NK细胞杀伤的抵抗作用. 世界华人消化杂志 2010; 18(36): 3905-3909
Revised: November 12, 2010
Accepted: November 23, 2010
Published online: December 28, 2010
AIM: To examine whether side population (SP) cells isolated from hepatic carcinoma cell lines can escape being killed by NK cells from NOD/SCID mice.
METHODS: Sorted natural killer (NK) cells from NOD/SCID mice were seeded in dishes and cultured for three days in the presence of 25 ng/mL IL-2 and IL-15 to activate cells. SP cells and main population (MP) cells were sorted with the FACSAria from Huh7 and PLC/REF/5 cell lines and co-cultured with activated NK cells for 12 hours. Cell apoptosis was evaluated by annexin V/7-AAD staining and flow cytometry.
RESULTS: There are no significant differences in cell viability and apoptosis between MP cells and SP cells from Huh7 and PLC/REF/5 cell lines (all P > 0.05). However, the proportions of annexin V+/7-AAD+ cells in MP cells co-cultured with NK cells were significantly higher than those in MP cells cultured alone and SP cells co-cultured with NK cells (Huh7: 8.43 ± 1.56 vs4.33 ± 1.36, 4.41 ± 0.70; PLC/PRF/5: 7.89 ± 1.53 vs 5.47 ± 1.04, 4.94 ± 0.95, all P < 0.05).
CONCLUSION: SP cells isolated from Huh7 and PLC/REF/5 cells could probably escape being killed by activated NK cells from NOD/SCID mice.
- Citation: Qiu S, Zhang HY. Side population cells isolated from hepatic carcinoma cell lines escape being killed by NK cells from NOD/SCID mice. Shijie Huaren Xiaohua Zazhi 2010; 18(36): 3905-3909
- URL: https://www.wjgnet.com/1009-3079/full/v18/i36/3905.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i36.3905
肿瘤中存在极少量能驱动肿瘤生长的干细胞样癌细胞亚群, 称为肿瘤干细胞(cancer stem cells, CSCs). 少量人CSCs反复接种在免疫缺陷小鼠体内, 均能形成肿瘤移植物, 目前这也是人肿瘤中CSCs存在的唯一鉴定方法[1-3]. 大量研究表明某些肿瘤细胞经Hoechst33342染色后, 形成的侧群(side population, SP)细胞, 能够相对富集肿瘤干细胞, 因而认为SP细胞可能也是一种CSCs. 目前也有研究认为CSCs和SP细胞所使用免疫缺陷小鼠(NOD/SCID、SCID、Rag-/-)等, 只是缺失了T、B淋巴细胞的获得性免疫能力, 但仍然存在部分自然杀伤(natural killer, NK)细胞和全部髓系免疫细胞组成的天然免疫能力, 仍然有一定的抗肿瘤的免疫能力[4-6]. 因而提示少量CSCs或SP细胞在免疫缺陷小鼠体内驱动肿瘤形成的现象, 可能是由其特殊的逃逸免疫监视的能力所致. 有研究表明在肝脏肿瘤中也存在CSCs[7], 实验中我们观察了肝癌细胞株Huh7、PLC/REF/5中的SP细胞[8], 对非肥胖糖尿病/重症联合免疫缺陷(non-obese diabetic/severe combined immunodeficiency)NOD/SCID小鼠NK细胞杀伤的抵抗作用.
人肝癌细胞株Huh7、PLC/REF/5由天津医科大学肿瘤医院提供, 细胞于含100 mL/L FBS、1%青链霉素的DMEM培养基中, 37 ℃、50 mL/L CO2常规培养. NOD/SCID小鼠, ♂, 周龄10 wk, 由中国医学科学院实验动物研究所提供. Hoechst33342、烟曲霉素C(fumitremorgin C, FTC)、MTT由Sigma公司提供, 小鼠重组细胞因子IL2、IL15购自PeproTech, 抗小鼠CD49b(DX5)MicroBeads NK细胞分选磁珠试剂盒购自Miltenyibiotec, AlexaFluor@647标记抗小鼠NK1.1流式抗体为BioLegend产品, FITC标记AnnexinV凋亡检测试剂盒为eBioscience产品. SP细胞分选使用BD FACS Aria流式细胞仪.
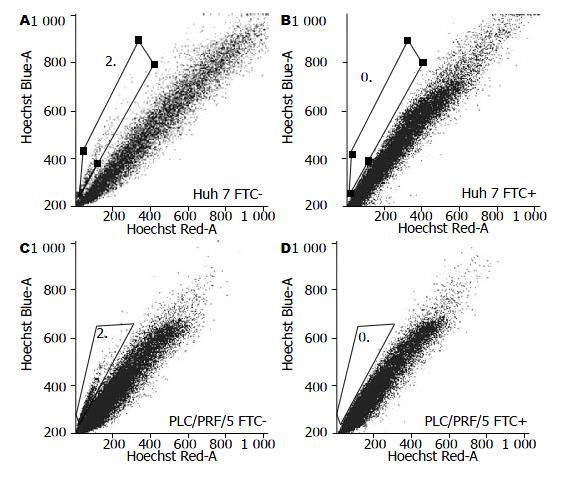
1.2.1 Hoechst33342标记肝癌细胞: 处于对数生长期的Huh7、PLC/REF/5[9]细胞经胰酶-EDTA消化, 用含50 mL/L FBS的PBS制备成106细胞/mL的细胞悬液, Hoechst33342以10 mg/L的终浓度加入细胞悬液中; 对照细胞中先加入ABCG2抑制剂FTC, 终浓度2 µmol/L, 37 ℃孵育15 min, 再加入10 mg/L Hoechst33342, 37 ℃孵育90 min. 孵育完成后, 上述细胞中立即加入10倍体积冷PBS(含50 mL/L FBS), 4 ℃离心洗细胞2次, 细胞在上流式细胞仪检测分选之前保持置于冰上[10].
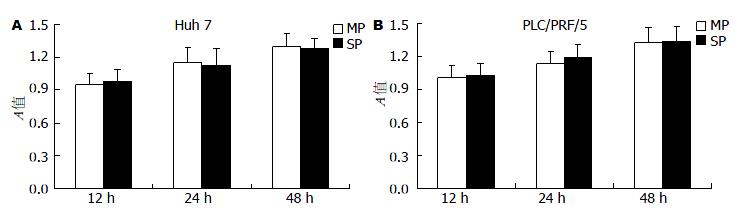
1.2.2 MTT检测主群细胞、SP细胞活力: Huh7、PLC/REF/5细胞经分选所得主群(main population, MP)、SP细胞分别接种于96孔板中, 5×104/孔, 分别培养12、24、48 h. 然后弃去培养上清液, 每孔中加入100 µL(0.5 g/L)的MTT(PBS)37 ℃孵育4 h, 弃上清液, 每孔加入100 µL DMSO, 充分混匀溶解, 用酶标仪检测每孔在570 nm处的吸光度值A.
1.2.3 NK细胞分选: NOD/SCID小鼠麻醉后取脾脏, 脾脏分别经50目、300目筛网研磨、过滤, 离心洗两次, 最终制成108细胞/mL, 按细胞体积的10%加入抗小鼠CD49b(DX5)MicroBeads, 4 ℃孵育20 min, 后经分选柱磁性分选, 获得的分选阳性细胞须经纯度检测, 纯度保持在90%以上.
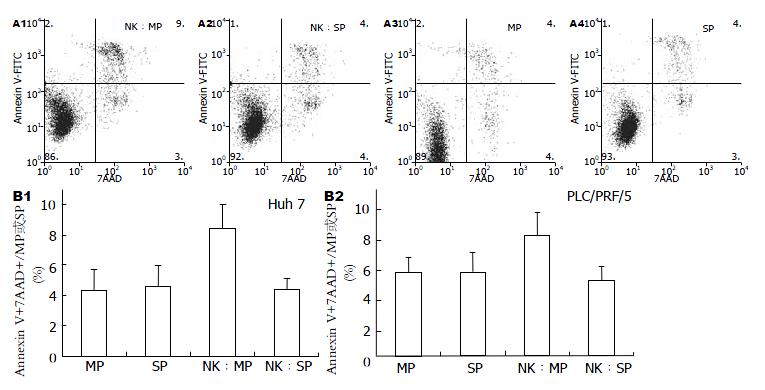
1.2.4 细胞凋亡检测: 用DMEM(100 mL/L FBS)将磁珠分选所得NK细胞制成细胞悬液接种于培养皿中, 并在细胞悬液中加入终浓度为25 µg/L的小鼠重组IL2和IL15, 37 ℃、50 mL/L CO2孵育3 d后细胞接种于96孔板中, 使孔中NK细胞数为3×105/孔. 肝癌细胞株Huh7、PLC/REF/5经FACS Aria分选后所得MP、SP细胞以5×104/孔加入NK细胞中, 使NK细胞:肿瘤靶细胞为6:1, 37 ℃、50 mL/L CO2孵育12 h后经Annexin V和7AAD染色后[11], 经流式细胞仪检测.
3次Hoechest33342标记流式细胞仪检测显示, Huh7和PLC/PRF/5细胞中SP比例分别为: 2.11±0.40和2.33±0.35. FTC能够完全抑制SP细胞的出现(图1).
MTT检测显示, 在12、24、48 h Huh7及PLC/REF/5 MP、SP细胞增殖并没有显著差别(P>0.05, 表1, 图2).
| Huh7 MP | Huh7 SP | PLC/PRF/5 MP | PLC/PRF/5 SP | |
| 12 h | 0.95±0.10 | 0.98±0.11 | 1.01±0.11 | 1.03±0.12 |
| 24 h | 1.15±0.14 | 1.13±0.15 | 1.14±0.10 | 1.19±0.12 |
| 48 h | 1.30±0.12 | 1.28±0.09 | 1.33±0.13 | 1.34±0.14 |
细胞活力检测显示12、24、48 h Huh7及PLC/REF/5的MP、SP细胞之间增殖活力并无显著差别, 为避免MP、SP细胞之间增殖差别影响细胞凋亡检测, 选取12 h作为NK细胞杀伤MP、SP细胞的观察点.
结果显示培养12 h, 肿瘤细胞中主要出现了AnnexinV+7AAD+的凋亡中晚期细胞(图3A); 单独Huh7和PLC/REF/5 MP、SP细胞单独培养12 h AnnexinV+7AAD+细胞比例无显著差别(P>0.05). 同NK细胞共培养的MP细胞的AnnexinV+7AAD+细胞比例显著高于共培养的SP细胞及单独培养的MP细胞(P<0.05); 共培养的SP细胞表现出明显的抵抗NK细胞杀伤的能力, 其AnnexinV+7AAD+细胞比例和单独培养的SP细胞相比, 无显著差异(P>0.05, 表2, 图3B).
近年提出的CSCs学说认为: 肿瘤中存在极少量能驱动肿瘤生长的干细胞样癌细胞亚群, 其具有无限增殖的潜能, 在启动肿瘤形成和生长中起着决定性的作用, 而其余的大多数细胞, 经过短暂的分化, 最终死亡. CSCs这种无限增殖的能力被称为自我更新(self renew)[1,12]. 通过反复在免疫缺陷小鼠体内接种少量(最少至100个细胞)人CSCs, 观察肿瘤生长与否能够验证人CSCs的自我更新能力, 目前这也是鉴定人肿瘤中CSCs存在的最可靠的方法. CSCs学说的提出也为肿瘤的研究与治疗提供了新的思路.
目前CSCs的分选标志有多种: 部分白血病细胞CD34+CD38-细胞[1], 乳腺癌中CD44+CD24-/low细胞[13], 胶质瘤、髓母细胞瘤及结肠癌中CD133+细胞[3,14,15]. 多数上述CSCs在进行Hoechst33342染色时都会表现出一定的SP现象, 因而SP也可作为一种通用的CSCs标志.
随着研究深入也有部分学者对SP细胞或CSCs驱动肿瘤生长持有不同观点, 同样在免疫缺陷小鼠体内接种少量小鼠普通肿瘤细胞和与人CSCs类似的小鼠CSCs时, 肿瘤的生长状况却非常相同. 这种观点认为, 在排除免疫缺陷小鼠的免疫监视作用的情况下, 人CSCs能在免疫缺陷小鼠体内生长的原因是, 其更能适应小鼠体内的分子环境, 或其能够自分泌足够维持自身及其后代细胞生长的生长因子[16,17].
在2009年Nature报道了一篇文章[18], 认为以往研究SP细胞或CSCs所使用免疫缺陷小鼠仍然存在部分免疫能力, 研究者使用IL2受体γ(Common γ)敲除的NOD/SCID小鼠作为受体, 任意的单个肿瘤细胞均能生长出肿瘤. 这就为SP细胞和CSCs研究引入了免疫学问题. 目前研究所使用的免疫缺陷小鼠有NOD/SCID、SCID、Rag-/-等[4-6], 这些品系均伴有不同程度的T、B淋巴细胞的缺失, 然而研究表明这些小鼠仍然存在十分健全的髓系免疫系统和功能部分受损的NK细胞. 在Common γ敲除的NOD/SCID小鼠髓系细胞仍然保存, 而NK细胞完全消失, 这是其和其他免疫缺陷小鼠差别所在. 这些提示我们少量人SP细胞或CSCs能在NOD/SCID、SCID、Rag-/-等免疫缺陷小鼠体内生长也可能是因其具有逃避NK细胞免疫监视所致.
本研究中我们分选得到了人肝癌细胞株Huh7、PLC/REF/5中SP细胞和MP细胞[9], 在体外分别单独培养12、24、48 h, 细胞活力检测并无差别; 且反复培养扩增的Huh7、PLC/REF/5细胞时, 其SP、MP细胞的比例并无变化. 这就提示我们SP细胞和MP细胞在NOD/SCID小鼠体内移植时也可能存在相似的无明显差别的生长状态. 那么, 假设NOD/SCID小鼠仅存的免疫系统对人肝癌SP细胞和MP细胞的排斥无差别, 说明这两种细胞的成瘤性应该大致相同. 然而事实是, 大部分学者只观察到了SP细胞发展成的肿瘤, 这就提示我们Huh7、PLC/REF/5中SP细胞可能具有逃避免疫监视的能力.
基于上述考虑, 本研究以人肝癌细胞株Huh7、PLC/REF/5中SP细胞和MP细胞为靶细胞[9], 同NOD/SCID小鼠来源的NK细胞共培养, 发现Huh7和PLC/REF/5细胞株中SP细胞能明显抵抗NK细胞诱导的杀伤作用, 初步提示我们肝癌细胞株Huh7、PLC/REF/5中侧群细胞在体外具有主动的免疫逃逸能力.
人肿瘤SP细胞或CSCs在人体中处于一个同源的免疫环境, 其可能同在NOD/SCID小鼠中所遇到的免疫监视作用相似, 这种免疫监视作用可能都是由天然免疫系统的NK细胞或髓系免疫细胞组成. 那么研究人肿瘤SP细胞或CSCs在NOD/SCID小鼠移植模型中的免疫逃逸作用对于探讨SP细胞或CSCs在人体内驱动肿瘤生长的机制应该具有一定意义.
研究表明结肠癌、乳腺癌、黑色素瘤等恶性肿瘤中存在着具有持续驱动肿瘤生长的肿瘤干细胞, 侧群细胞能够伏击这样的肿瘤干细胞, 侧群细胞也就成为研究肿瘤干细胞时的常用的研究手段. 对肿瘤干细胞、侧群细胞自身生长特性及其与宿主免疫系统的研究, 能够帮助人们更深入地认识肿瘤的发生、发展规律.
肖文华, 主任医师, 中国人民解放军总医院第一附属医院肿瘤科; 朱亮, 副教授, 大连医科大学生理教研室
目前国际上对侧群细胞、肿瘤干细胞的研究主要集中在能够帮助识别这些特殊肿瘤细胞群的表面标志物上, 以及这些细胞的生长特性上. 基于上面的研究基础, 部分学者已将注意力转移至针对侧群细胞、肿瘤干细胞的治疗研究上.
Kelly等认为: 人SP细胞或CSCs能在免疫缺陷小鼠体内生长的原因是其更能适应小鼠体内的分子环境, 或其能够自分泌足够维持自身及其后代细胞生长的生长因子.
本文针对以往CSCs相关研究中, 大家不十分重视的SP细胞或CSCs与宿主免疫系统之间的相互作用设计研究方案. 初步证实了肝癌细胞株Huh7、PLC/REF/5中侧群细胞在体外具有主动的逃逸NK细胞免疫监视的能力.
人肿瘤SP细胞或CSCs在人体中处于同源的免疫环境, 其受到的免疫压力可能同其在免疫缺陷小鼠体内类似. 通过研究人肝癌细胞株Huh7、PLC/REF/5中SP细胞在NOD/SCID小鼠移植模型中的免疫逃逸作用, 对于探讨SP细胞或CSCs在人体内驱动肿瘤生长的机制应该具有一定意义.
1 侧群(SP)细胞: 是利用Hoechst 33342染料和流式细胞术进行造血干/祖细胞分离时发现的一群特殊细胞, 具有
干细胞样自我更新能力, 其广泛分布于多种成体组织、胚胎和某些肿瘤细胞系中.
2 肿瘤干细胞(CSCs): AACRl3 2006年将肿瘤干细胞定义为, 肿瘤中具有自我更新能力并能产生异质性肿瘤细胞的
细胞.
3 自然杀伤(NK)细胞: 为含有穿孔素和颗粒酶素的非特异性细胞毒淋巴细胞, 是固有免疫系统的主要成员, 对
杀伤肿瘤细胞和病毒感染细胞起重要作用.
本文创新性较好, 对理解侧群细胞的生物学特性, 侧群细胞与肿瘤干细胞的关系均有一定的科学意义.
| 1. | Hope KJ, Jin L, Dick JE. Acute myeloid leukemia originates from a hierarchy of leukemic stem cell classes that differ in self-renewal capacity. Nat Immunol. 2004;5:738-743. [PubMed] [DOI] |
| 2. | Jin L, Hope KJ, Zhai Q, Smadja-Joffe F, Dick JE. Targeting of CD44 eradicates human acute myeloid leukemic stem cells. Nat Med. 2006;12:1167-1174. [PubMed] [DOI] |
| 3. | O'Brien CA, Pollett A, Gallinger S, Dick JE. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice. Nature. 2007;445:106-110. [PubMed] [DOI] |
| 4. | Shiokawa M, Takahashi T, Murakami A, Kita S, Ito M, Sugamura K, Ishii N. In vivo assay of human NK-dependent ADCC using NOD/SCID/gammac(null) (NOG) mice. Biochem Biophys Res Commun. 2010;399:733-737. [PubMed] [DOI] |
| 5. | André MC, Erbacher A, Gille C, Schmauke V, Goecke B, Hohberger A, Mang P, Wilhelm A, Mueller I, Herr W. Long-term human CD34+ stem cell-engrafted nonobese diabetic/SCID/IL-2R gamma(null) mice show impaired CD8+ T cell maintenance and a functional arrest of immature NK cells. J Immunol. 2010;185:2710-2720. [PubMed] [DOI] |
| 6. | Davies E, Reid S, Medina MF, Lichty B, Ashkar AA. IL-15 has innate anti-tumor activity independent of NK and CD8 T cells. J Leukoc Biol. 2010;88:529-536. [PubMed] [DOI] |
| 7. | Teufel A, Galle PR. Collecting evidence for a stem cell hypothesis in HCC. Gut. 2010;59:870-871. [PubMed] |
| 8. | Wulf GG, Wang RY, Kuehnle I, Weidner D, Marini F, Brenner MK, Andreeff M, Goodell MA. A leukemic stem cell with intrinsic drug efflux capacity in acute myeloid leukemia. Blood. 2001;98:1166-1173. [PubMed] [DOI] |
| 9. | Chiba T, Kita K, Zheng YW, Yokosuka O, Saisho H, Iwama A, Nakauchi H, Taniguchi H. Side population purified from hepatocellular carcinoma cells harbors cancer stem cell-like properties. Hepatology. 2006;44:240-251. [PubMed] [DOI] |
| 10. | Mathew G, Timm EA Jr, Sotomayor P, Godoy A, Montecinos VP, Smith GJ, Huss WJ. ABCG2-mediated DyeCycle Violet efflux defined side population in benign and malignant prostate. Cell Cycle. 2009;8:1053-1061. [PubMed] |
| 11. | Derby E, Reddy V, Kopp W, Nelson E, Baseler M, Sayers T, Malyguine A. Three-color flow cytometric assay for the study of the mechanisms of cell-mediated cytotoxicity. Immunol Lett. 2001;78:35-39. [PubMed] [DOI] |
| 12. | Weissman IL, Anderson DJ, Gage F. Stem and progenitor cells: origins, phenotypes, lineage commitments, and transdifferentiations. Annu Rev Cell Dev Biol. 2001;17:387-403. [PubMed] [DOI] |
| 13. | Zafarana G, Bristow RG. Tumor senescence and radioresistant tumor-initiating cells (TICs): let sleeping dogs lie! Breast Cancer Res. 2010;12:111. [PubMed] [DOI] |
| 14. | Singh SK, Hawkins C, Clarke ID, Squire JA, Bayani J, Hide T, Henkelman RM, Cusimano MD, Dirks PB. Identification of human brain tumour initiating cells. Nature. 2004;432:396-401. [PubMed] [DOI] |
| 15. | Read TA, Fogarty MP, Markant SL, McLendon RE, Wei Z, Ellison DW, Febbo PG, Wechsler-Reya RJ. Identification of CD15 as a marker for tumor-propagating cells in a mouse model of medulloblastoma. Cancer Cell. 2009;15:135-147. [PubMed] [DOI] |
| 16. | Kennedy JA, Barabé F, Poeppl AG, Wang JC, Dick JE. Comment on "Tumor growth need not be driven by rare cancer stem cells". Science. 2007;318:1722; author reply 1722. [PubMed] |
编辑: 曹丽鸥 电编:李薇